Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
PENENTUAN ORDE REKASI DAN TETAPAN LAJU REAKSI DARI
REAKSI PENYABUNAN ETIL ASETAT (ESTER) DENGAN METODA
TITRASI
I. TUJUAN
Menentukan orde dan laju reaksi penyabunan etil asetat dengan metoda titrasi
II. TINJAUAN PUSTAKA
Reaksi kimia adalah tindakan yang terjadi pada perubahan kimia, yaitu perubahan materi yang menyangkut struktur dalam molekul suatu zat. Dalam reaksi kimia, sifat zat yang bereaksi berubah, demikian pula terjadi perubahan tenaga, misalnya kalor akan diserap atau dilepaskan. Reaksi ini juga merupakan proses yang meliputi perubahan pada suatu atau beberapa bentuk zat menjadi bentuk zat lain yang meliputi pembentukan atau pemutusan ikatan kimia. Ada dua jenis reaksi, yakni
- reaksi kimia yang spontan
kecepatan reaksi tidak dapat ditentukan atau diukur
- reaksi kimia yang lambat
kecepatan reaksi dapat ditentukan (Atkins 2008)
Suatu reaksi dikatakan termasuk reaksi tingkat satu bila kecepatan reaksi sebanding dengan konsentrasi reaktan sisa dari satu jenis zat yang bereaksi, sedangkan bila sebanding dengan dengan hasil kali konsentrasi reaktan sisa dari dua jenis zat yang bereaksi dimasukkan ke dalam reaksi tingkat dua. Kecepatan reaksi merupakan fungsi dari konsentrasi zat yang bereaksi atau produk dari temperatur maupun variabel operatif tertentu. Sedangkan bila mekanisme diketahui, maka kondisi optimum dari produk yang diharapkan dapat ditentukan.
Mekanisme reaksi dapat menentukan atau mempelajari :
- Tahap-tahap reaksi dan keadaan stereokimia dari masing-masing tahap
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
- Bagaimana komposisi kompleks teraktivasi, apakah terdiri dari
beberapa atom atau molekul reaktan, sudut antar atom dan jarak. Pada dasarnya lemak dan minyak dihasilkan oleh alam yang bersumber dari hewan dan tanaman. Sedangkan berdasarkan pada sumbernya, minyak dan lemak dapat diklasifikasikan atas hewan dan tanaman. Perbedaan mendasar daripada lemak hewani dan nabati adalah
- lemak hewani mengandung kolesterol, sedangkan lemak nabati
mengandung fitisterol.
- Kadar lemak jenuh dalam lemak hewani lebih kecil daripada lemak
nabati.
- Lemak hewani mempunyai bilangan Reicher-Meiss lebih besar dan
bilangan polenshe lebih kecil dibandingkan dengan minyak nabati (Ketaren,1986).
Ada beberapa sifat fisik dari minyak dan lemak yang dapat dilihat antara lain : warna, abu amis, odor dan flavor, kelarutan, titik cair dan polymerism, titik didih, splitting point, titik lunak, shot melting point, berat jenis, indeks bias dan kekeruhan.
Adapun sifat kimia dari lemak dan minyak antara lain : hidrolisa, oksidasi, hidrogenasi, esterifikasi, dan pembentukan keton. Hidrolisa minyak atau lemak akan asam-asam lemak bebas dan gliserol. Reaksi hidrolisa yang dapat menyebabkan kerusakan pada minyak atau lemak karena terdapatnya air dalam minyak tersebut. Reaksi ini menyebabkan flavor dan bau tengik pada minyak tersebut.
Bilangan penyabunan adalah jumlah miligram KOH yang diperlukan untuk menyabunkan 1 gram lemak atau minyak. Apabila sejumlah sampel minyak atau lemak disabunkan dengan larutan KOH berlebih dalam alkohol, maka KOH akan bereaksi dengan trigliserida, yaitu 3 molekul KOH bereaksi dengan 1 molekul minyak atau lemak. Larutan alkali yang
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
tertinggal ditentukan dengan titrasi menggunakan HCl sehingga KOH yang bereaksi dapat diketahui. Dalam penetapan bilangan penyabunan, biasanya larutan alkali yang digunakan adalah larutan KOH, yang diukur dengan hati-hati ke dalam tabung dengan menggunakan buret atau pipet.
Sabun termasuk salah satu jenis surfaktan yang terbuat dari minyak atau lemak alami. Setiap lemak mengandung asam-asam lemak yang berbeda-beda. Perbedaan tersebut menyebabkan sabun yang terbentuk mempunyai sifat yang berbeda, minyak dengan kandungan asam lemak rantai pendek dan ikatan tak jenuh akan menghasilkan sabun cair. Sedangkan rantai panjang dan jenuh menghasilkan sabun yang tak larut pada suhu kamar.
Pada percobaan ini reaksi yang terjadi adalah reaksi yang merupakan reaksi orde dua yaitu pada reaksi penyabunan etil asetat oleh ion hidroksida. Reaksi yang terjadi adalah :
CH3COOC2H5 + OH- CH3COO- + C2H5OH
Laju reaksinya yaitu :
-d (ester) = k1 (ester) (OH-)
dt atau
dx = k1 (a – x) (b – x)
dt
dimana : a = konsentrasi awal ester (mol / liter)
b = konsentrasi awal ion hidroksida (mol / liter) x = jumlah mol/liter ester yang bereaksi pada waktu t k1= tetapan laju reaksi
Reaksi diikuti dengan cara penentuan konsentrasi ion hidroksida
(OH-) pada waktu tertentu larutan, kemudian dimasukkan ke dalam larutan
yang mengandung asam berlebih. Penetralan dari basa ke dalam campuran reaksi pada saat reaksi dihentikan (menghentikan reaksi). Jumlah basa
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
yang ada di dalam campuran reaksi pada saat reaksi dihentikan dapat diketahui dengan cara mentitrasi sisa asam oleh larutan standar.
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
III. PROSEDUR PERCOBAAN 3.1Alat dan Bahan
Alat Fungsi
Labu volumetri
Pipet
Labu erlenmeyer bertutup
Buret 25 mL
Botol semprot
Stopwatch
Konduktometer
Sel hantaran
Tempat melarutkan zat dan
pengenceran
Memindahkan larutan
Wadah analit saat titrasi
Wadah titran untuk titrasi
Wadah aquades
Penguku waktu
Pengukur hantaran listrik
Penghantar arus listrik
Bahan Fungsi
Etil asetat, p.a
Larutan NaOH 0,02 M 200 mL
Larutan HCl 0,02 M
Indikator Fenolftalein
Sampel
Sumber OH- untuk penyabunan
Untuk menghentikan reaksi
Indikator asam basa
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
3.2Cara Kerja
3.2.1 Pembuatan Larutan Standar Asam Oksalat
1. Sebanyak 0,126 gr asam oksalat dilarutkan dalam labu ukur 100 mL 2. Aquades ditambahkan sampai volume 100 mL dan didapatkan larutan
standar asam oksalat 0,02 N 3.2.2 Standarisasi Larutan NaOH
1. sebanyak 10 mL larutan asam oksalat 0,02 N diambil dan dimasukkan kedalam erlenmeyer
2. indikator PP ditambahkan sebanyak 2 tetes kemudian larutan asam oksalat dititrasi dengan larutan NaOH
3. Volume NaOH yang terpakai dicatat dan didapatkan konsentrasi NaOH 3.2.3 Reaksi Penyabunan Etil Asetat
1. sejumlah tertentu etil asetat ditimbang dalam botol timbang tertutup dan dilarutkan kedalam air hingga didapatkan larutan sebanyak 250 mL dengan konsentrasi 0,02 M
2. 250 mL larutan NaOH 0,02 M disediakan dan 100 mL larutan HCl 0,02 M. Konsentrasi kedua larutan ini harus diketahui dengan tepat
3. 60 mL larutan NaOH dan 30 mL larutan etil asetat dipipet dengan menggunakan pipet kedalam labu erlenmeyer. Sementara itu kedalam masing-masing 6 buah labu erlenmeyer lainnya dipipet 20 mL larutan HCl 0,02 M
4. Larutan NaOH dan larutan etil asetat dicampur dan dikocok dengan baik. Stopwatch dihidupkan saat kedua larutan tercampur
5. 10 menit setelah reaksi dimulai, 10 mL campuran reaksi dipipet dan dimasukkan kedalam labu yang berisi 20 mL HCl. Diaduk dengan baik dan kelebihan HCl dititrasi dengan larutan standar NaOH
6. Lakukan pengambilan campuran pada menit ke 20, 30, dan 40 setelah reaksi dimulai
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
3.3Skema Kerja
3.3.1 Pembuatan Larutan Standar Asam Oksalat 0,126 gr asam oksalat
Dilarutkan dalam labu ukur 100 mL
Larutan standar asam oksalat 0,02 M 3.3.2 Standarisasi Larutan NaOH
10 mL larutan asam oksalat 0,02 M
Ditambah indikator pp
Dititrasi dengan NaOH
Volume NaOH yang terpakai dicatat
Konsentrasi NaOH
3.3.3 Reaksi Penyabunan Etil Asetat
30 mL etil asetat 0,02 N 60 mL NaOH 0,02 N
Campuran
Dinyalakan stopwatch 10 menit
10 mL campuran 20 mL HCl 0,02 N
Diaduk
Dititrasi dengan NaOH
Hasil
Catatan : dilakukan pengambilan 10 mL campuran etil asetat pada variasi waktu 20, 30, dan 40 menit, kemudian di dilakukan hal yang sama dengan diatas
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
3.4Skema Alat Keterangan gambar : 1. Standard 2. Klem 3. Buret 4. Erlenmeyer
1
2
3
4
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
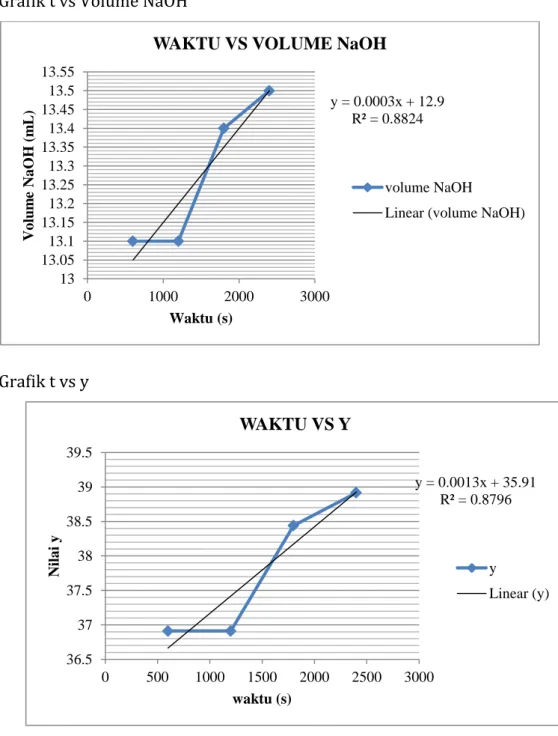
IV. HASIL DAN PEMBAHASAN 4.1. Data Percobaan t (s) V campuran V NaOH 600 30 13.1 1200 30 13.1 1800 30 13.4 2400 30 13.5 t ∞ 30 13.7 4.2Perhitungan A. Pembuatan NaOH 0,02 N g = 0,2 gram
B. Pembuatan asam oksalat 0,02 N
g = 0,126 gram
C. Standarisasi NaOH dengan asam oksalat
VNaOH terpakai = 9.4 mL
Vasam oksalat = 10 mL
(V.N)oksalat = (V.N)NaOH
10 mL . 0,02 N = 9.4 mL . N M = 0,021 N
D. Pembuatan etil asetat 0,02 N
N =
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
N = N = 9,81 N V1 .N1 = V2 . N2 V . 9,8 N = 250 mL . 0,021 N V = 0,535 mL Massa = . = 0,9 g/mL . 0,535 mL = 0,4815 gram E. Pengenceran HCl 4 N menjadi 0,02 N V1 .N1 = V2 . N2 V1 . 4 N = 100 mL . 0,02 N V = 0,5 mL
F. Penentuan Konsentrasi campuran
(V.N)NaOH = (V.N)Campuran a. t = 10 13,1 mL . 0,021 N = 30 mL . N N = 0,00917 N b. t = 20 13,1 mL . 0,021 N = 30 mL . N N = 0,00917 N c. t = 30 13,4 mL . 0,021 N = 30 mL . N N = 0,00938 N d. t = 40 13,5 mL. 0,021 N = 30 mL. N N = 0,00945 N e. t = ∞ 13,7 mL . 0,021 N = 30 mL . N
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
N = 0,00959 N G. Menghitung nilai y x = konsentrasi campuran a = konsentrasi NaOH a. t = 10 b. t = 20 c. t = 30 d. t = 40 e. t = ∞ H. Menentukan nilai k a. t = 10 b. t = 10 c. t = 30 d. t = 40
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
̅
̅ = 0,03535 N-1s-1 I. Persamaan Regresi x = t (s) y = X Y xy x2 600 22147,2 360000 1200 44294,4 1440000 1800 69190.2 3240000 2400 93506,4 5760000 ∑ = 151,224 229138,2 10800000 ̅ ̅ = = 0,0012 ̅ ̅ A = ̅ - ̅ = 37,806– (0,0012 . 1500) = 36,006 Y = 36,006 + 0,0012xPenentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
4.4Grafik
Grafik t vs Volume NaOH
Grafik t vs y y = 0.0003x + 12.9 R² = 0.8824 13 13.05 13.1 13.15 13.2 13.25 13.3 13.35 13.4 13.45 13.5 13.55 0 1000 2000 3000 Vo lum e Na O H ( m L ) Waktu (s)
WAKTU VS VOLUME NaOH
volume NaOH
Linear (volume NaOH)
y = 0.0013x + 35.91 R² = 0.8796 36.5 37 37.5 38 38.5 39 39.5 0 500 1000 1500 2000 2500 3000 Nila i y waktu (s) WAKTU VS Y y Linear (y)
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
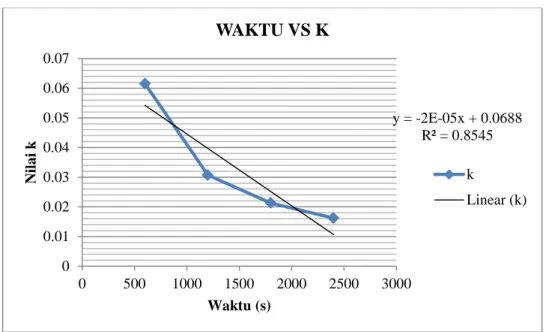
Grafik t vs k y = -2E-05x + 0.0688 R² = 0.8545 0 0.01 0.02 0.03 0.04 0.05 0.06 0.07 0 500 1000 1500 2000 2500 3000 Nila i k Waktu (s) WAKTU VS K k Linear (k)
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
4.4Pembahasan
Telah dilakukan percobaan Penentuan Orde Reaksi dan Teatapan Laju Reaksi dengan menggunakan reaktan etil asetat (ester) dan NaOH pada Metoda Titrasi.
Pada awalnya NaOH harus distandarisasi dulu dengan menggunakan asam oksalat, karena NaOH merupakan larutan standar sekunder yang konsentrasinya tidak bisa diketahui dengan cara penimbaangan langsung. Etil asetat yang digunakan yaitu larutan p.a dimana konsentrasinya dapat diketahui dengan cara penimbangan.
Reaksi penyabunan ini menggunakan reaksi orde dua karena reaksi ini melibatkan dua reaktan atau dua zat yang berbeda dengan konsentrasi yang sama.
Untuk menentukan orde dan konstanta laju reaksi maka digunakan metoda titrasi pada percobaan dimana prinsipnya perubahan warna dari analit dengan bantuan indikator fenolftalein.
Etil asetat dicampurkan dengan NaOH dalam suatu wadah, kemudian dikocok. Hal ini bertujuan untuk mempercepat dan menyempurnakan reaksi, kemudian larutan dituang dalam wadah berisi HCl. Kegunaan HCl pada reaksi ini adalah untuk menetralkan larutan yang bersifat basa sehingga penetralan ini akan dapat menghentikan reaksi yang terjadi antara etil asetat dengan NaOH. Kemudian larutan tersebut dititrasi dengan tujuan mengetahui jumlah basa yang ada dalam campuran reaksi pada saat reaksi dihentikan, dengan cara mentitrasi sisa asam atau kelebihan asam dengan menggunakan larutan standar NaOH.
Dengan memvariasikan waktu terjadinya reaksi antara kedua reaktan antara etil asetat dan NaOH didapatkan jumlah/volume NaOH yang terpakai untuk titrasi secara variasi.
Didapat grafik yang linier menandakan semakin lama waktu maka semakin banyak dibutuhkan NaOH untuk titrasi. Kesalahan dalam penentuan titik akhir titrasi mempengaruhi perhitungan.
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
V. KESIMPULAN DAN SARAN
5.1Kesimpulan
Dari percobaan yang dilakukan dapat diambil beberapa kesimpulan sebagai berikut :
1. Reaksi antara etil asetat dan NaOH merupakan reaksi penyabunan
dan berorde dua, karena reaksi tersebut melibatkan dua reaktan atau dua zat berbeda dengan konsentrasi yang sama.
2. Dari rumus yang diperoleh tetapan laju reaksi k = 0,03535
3. Dari persamaan regresi diperoleh nilai k = 0,0012
4. Persamaan regresi yaitu : y = 36,006 + 0,0012x
5.2Saran
Untuk mendapatkan hasil yang bagus, maka diharapkan praktikan selanjutnya agar :
1. Hati-hati dan teliti dalam menimbang dan menakar zat.
2. Teliti dalam memipet zat.
3. Teliti dalam menentukan titik akhir titrasi.
4. Lakukan titrasi secepat mungkin.
5. Jika etil asetat sudah dicampur dengan NaOH jangan lupa untuk
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
JAWABAN PERTANYAAN
1. Orde reaksi adalah : jumlah indeks / koefisien konsentrasi atau jumlah partikel /molekul pereaksi yang konsentrasinya menentukan laju reaksi atau kinetika reaksi kimia.
2. Perbedaan ore reaksi atau kemolekulan reaksi :
- Orde reaksi merupakan jumlah partikel atau molekul pereaksi yang
konsentrasinya menentukan laju reaksi.
- Kemolekulan reaksi merupakan jumlah dari partikel (molekul, ion,
atom atau radikal bebas) yang terlibat dalam langkah pembentukan suatu reaksi.
3. Kenyataan yang membuktikan bahwa reaksi penyabunan etil asetat
adalah reaksi berorde dua adalah reaksi tersebut melibatkan dua reaktan atau dua zat yang berbeda dengan konsentrasi yang sama.
4. Hantaran jenis : x = L . l A Dimana : L = 1/R = ohm-1 Maka : x = ohm-1 . m m2 = m-1 ohm-1 Hantaran molar = x/C = m-1 ohm-1 mol m-3 = m2 ohm mol
5. Bila titrasi dari HCl tidak dapat segera dilakukan kemungkinan akan
mengakibatkan kelebihan HCl menjadi lebih besar dan jika titrasi dilakukan agak lama, kemungkinan volume NaOH yang terpakai juga akan semakin banyak. Jika titrasi ditunda sampai semua percobaan selesai yang ahrus dilakukan adalah campuran etil asetat dan NaOH jangan
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
dicampurkan dulu dengan HCl, tetapi tunggu sampai campuran tersebut akan dititrasi baru dicampur dengan HCl.
6. Cara menentukan orde reaksi ada dua metoda :
a. Metoda titrasi
Prinsipnya adalah : analisa yang menggunakan indikator yang nantinya dapat mengubah warna dari analit saat tercapainya titik akhir titrasi.
b. Metoda Konduktometer
Prinsipnya adalah : kecepatan ion H+ jauh lebih besar dari kecepatan
ion positif lainnya, dan kecepatan ion dari OH- jauh lebih besar dari
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
LAMPIRAN
LAMPIRAN 1
FOTO Keterangan
Dilarutkan 0,126 gram asam oksalat, lalu diencerkan. Asam oksalat larut dalam akuades. Larutan berwarna bening
Diencerkan 0,4815 gram etil asetat diencerkan dengan akuades dalam labu ukur 250 mL. Larutan berwarna bening
Dicampurkan 10 mL etil asetat dengan 20 mL HCl di dalam Erlenmeyer. Ditutup dengan alumunium karena larutannya menguap
Lalu dititrasi dengan NaOH sampai terbentuk larutan berwarna merah muda yang tidak hilang dengan pengocokan
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
LAMPIRAN 2
No. Nama Bahan Struktur senyawa
1. Etil asetat, p.a
2. Larutan HCl 0,02 M
3. Larutan NaOH 0,02 M
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
LAMPIRAN 3
Simbol-simbol pada perhitungan percobaan a = konsentrasi awal ester (mol / liter)
b = konsentrasi awal ion hidroksida (mol / liter)
x = jumlah mol/liter ester atau massa yang telah bereaksi pada waktu t k1= tetapan laju reaksi
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
LAMPIRAN 4
A. Judul Artikel Ilmiah
“Kinetic Studies on Saponification of Acetate Using an Innovative Conductivity-Monitoring Instrument with a Pulsating Sensor”.
B. Tujuan Penelitian
Mengukur nilai konduktivitas dari reaksi penyabunan etil asetat dengan NaOH menggunakan alat monitoring konduktivitas yang inovatif dengan sensor pulsator
C. Skema Kerja
25 mL air destilasi
- Dimasukkan dalam bejana
- Temperatur dijaga antara 30 – 55oC
Larutan
- Ambil 0,5 mL NaOH 0,1 M
- 0,5 mL etil asetat 0,1 M
- Masukkan kedalam bejana tersebut
Campuran
- Larutan dimonitoring selang waktu 500 – 1000 s
Hasil pengamatan D. Analisis
Pada penelitian yang dilakukan untuk mengukur nilai konduktivitas dari reaksi penyabunan etil asetat dengan NaOH menggunakan alat monitoring konduktivitas yang inovatif dengan sensor pulsator.
Dari pengukuran yang metode konduktometri akan didapatkan daya hantar listrik yang dihasilkan oleh campuran etil asetat dengan NaOH sehingga dapat ditentukan juga laju reaksi penyabunan ester oleh NaOH.
Sensor inovatif dikembangkan pada peralatan inovatif yang telah tersebar dibeberapa laboratorium dan aplikasi dengan jalan terbaru dari peralatan konduktivitas.
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
E. Kelebihan Artikel Ilmiah
penentuan konstanta kecepatan reaksi pada artikel ilmiah ini dikenal baik pada perbedaan suhu dengan tingkat ketelitian yang tinggi dengan cara yang mudah dan cepat. Dengan menggunakan teknik pengukuran konduktometri dapat memudahkan dan mempercepat penentuan ratio konstanta pada variasi temperatur larutan.
Hal ini yang membedakan proses pengamatan pada jurnal ilmiah dengan metoda praktikum yang telah dilakukan. Sebab, pada percobaan yang dilakukan pada penentuan orde reaksi dan tetapan laju reaksi dari reaksi penyabunan etil asetat dengan menggunakan metoda titrasi ialah pengerjaanya tergolong lambat dengan tingkat ketelitian yang rendah.
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
LAMPIRAN 5 ANGGOTA KELOMPOK 7 KELAS C FARADIBAH 1010412043 ARRIJAL MUSTAKIM 1010412015 DEVI ASRIANTI 1110412058 WENNY SEPTIA A. 1110412038 NURUL FADILLAH 1110412049 MIRA WIDIA 1110413029
Penentuan Orde Reaksi dan Tetapan Laju Reaksi dari Reaksi Penyabunan Etil Asetat (Ester) dengan Metoda Titrasi
DAFTAR PUSTAKA
Alif, Admin. Kinetika dan Mekanisme Reaksi. Jurusan Kimia Universitas Andalas.
Penuntun Praktikum Kinetika dan Mekanisme Reaksi. 2008. Jurusan Kimia Universitas Andalas
Mickey, C. D. 1980. CHEMICAL KINETICA REACTION RATES. J chem. educ. Palrucci, Ralph H. 1999. KIMIA DASAR PRINSIP DAN TERAPAN MODERN.