INTISARI
Penelitian ini bertujuan untuk mengetahui pengaruh pemberian jangka panjang fraksi heksan-etanol ekstrak metanol-air daun Macaranga tanarius L. (FHEMM) pada tikus betina galur Wistar yang terinduksi karbon tetraklorida berdasarkan penurunan aktivitas laktat dehidrogenase (LDH) serta untuk mengetahui kekerabatan antar dosis pemberian FHEMM terhadap penurunan aktivitas LDH pada tikus betina galur Wistar yang terinduksi karbon tetraklorida.
Penelitian ini bersifat eksperimental murni dengan rancangan acak lengkap pola searah. Hewan uji yang digunakan adalah tikus putih betina galur Wistar umur 2-3 bulan dengan berat 130-180 gram. Tiga puluh ekor tikus dibagi acak dalam 6 kelompok perlakuan. Kelompok I merupakan kontrol negatif CMC-Na 1% yang diberikan selama 6 hari berturut-turut. Kelompok II merupakan kontrol hepatotoksin karbon tetraklorida 2 ml/kgBB. Kelompok III diberikan FHEMM dosis tertinggi tanpa induksi karbon tetraklorida selama 6 hari berturut-turut. Kelompok IV-VI merupakan perlakuan FHEMM dengan 3 peringkat dosis (34,28; 68,57; dan 137,14 mg/kgBB) yang diberikan selama 6 hari berturutan, pada hari ke-7 diberikan karbon tetraklorida. Pengambilan darah dilakukan pada jam ke-24 untuk pengukuran kadar LDH. Kadar LDH dianalisis dengan metode
Shapiro-Wilk dan diperoleh distribusi data tiap kelompok normal maka dilanjutkan dengan analisis pola searah (One Way Anova) dengan taraf kepercayaan 95%. Uji Scheffe dilakukan untuk melihat perbedaan antar kelompok bermakna (signifikan) (p<0,05) atau tidak bermakna (tidak signifikan) (p>0,05).
Hasil penelitian menunjukkan bahwa FHEMM terbukti berpengaruh dalam menurunkan aktivitas serum LDH tikus betina galur Wistar yang terinduksi karbon tetraklorida 2 ml/kgBB. Tidak terdapat kekerabatan antar dosis FHEMM dengan aktivitas serum LDH yang muncul, yang terlihat dari semakin besar dosis praperlakuan FHEMM, kadar LDH relatif sama.
Abstract
The purposes of this research were to find out the long-term effect of hexane-ethanol fraction, derived from methanol-water extract Macaranga tanarius L. leaves (FHEMM), toward Wistar female rats that were induced by carbon tetrachloride based on the decreased lactate dehydrogenase (LDH) activity; and to perceive the correlation of FHEMM doses toward the decreased in LDH activity on Wistar female rats induced by carbon tetrachloride.
This research was done in a pure experimental method by using completely randomized design in one direction. Animal tested for this research was Wistar female rats at the age of 2 to 3 months and with a weight of 130-180 grams. Thirty rats were divided randomly into 6 groups. The first group was the negative control of 1% CMC-Na which was given for 6 days in a row. The second group was the control of 2 ml/kgBW carbon tetrachloride as a hepatotoxin. The third group was given the highest dose of FHEMM without being induced by carbon tetrachloride for six days in a row. The fourth to sixth group were provided with FHEMM with three rankings of dose (34.28; 68.57; and 137.14 mg/kgBW) for six days in a row, and on the 7th day carbon tetrachloride was granted. The blood sampling was accomplished on the 24th hour to carry out the measurement of LDH level. LDH level was analyzed by refering to Shapiro-Wilk, and since the data distribution of each group was normal, One Way Anova design with 95% confidence interval continued. Scheffe test was performed to witness the difference between significant groups (p<0.05) and insignificant groups (p>0.05)
The result showed that the FHEMM had an effect in lowering the serum LDH activity of Wistar female rats induced by 2 ml/kgBW carbon tetrachloride. There’s no correlation found between FHEMM doses and the emergence of serum LDH activity, which was seen from the more the dose of FHEMM pre-treatment given, the more LDH levels looked relatively the same.
EFEK HEPATOPROTEKTIF JANGKA PANJANG FRAKSI HEKSAN-ETANOL EKSTRAK MHEKSAN-ETANOL-AIR DAUN Macaranga tanarius L. TERHADAP AKTIVITAS LAKTAT DEHIDROGENASE PADA TIKUS BETINA GALUR WISTAR TERINDUKSI KARBON TETRAKLORIDA
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
oleh :
Penina Kurnia Uly
NIM : 128114142
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
EFEK HEPATOPROTEKTIF JANGKA PANJANG FRAKSI HEKSAN-ETANOL EKSTRAK MHEKSAN-ETANOL-AIR DAUN Macaranga tanarius L. TERHADAP AKTIVITAS LAKTAT DEHIDROGENASE PADA TIKUS BETINA GALUR WISTAR TERINDUKSI KARBON TETRAKLORIDA
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
oleh :
Penina Kurnia Uly
NIM : 128114142
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
PERSEMBAHAN
orang yang berhenti belajar akan menjadi pemilik masa lalu.
Orang-orang yang masih terus belajar, akan menjadi pemilik masa depan
(Mario Teguh)
I never dreamed about success. I worked for it
(Estee Lauder)
Bukan kemampuan yang memutuskan kesuksesan hidup orang. Namun
kesungguhan dan tekad berusaha
(Mario Teguh)
Kupersembahkan skripsi untuk……… Tuhan Yesus Kristus, sumber segala pengharapan, kekuatan, berkat, dan jalan keluar dari setiap persoalan,
Papa, Mama, Kakak Ariata dan Beatrix Sahabat-sahabat dan teman-temanku tersayang,
vii
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas
berkat dan rahmat-Nya, sehingga penulis dapat menyelesaikan skripsi yang berjudul “Efek Hepatoprotektif Jangka Panjang Fraksi Heksan-Etanol Ekstrak Metanol-Air Daun Macaranga tanarius L. Terhadap Aktivitas Laktat Dehidrogenase Pada Tikus Betina Galur Wistar Terinduksi Karbon Tetraklorida”
ini dengan baik. Skripsi ini disusun untuk memenuhi salah satu syarat
memperoleh gelar Sarjana Farmasi Fakultas Farmasi Universitas Sanata Dharma
Yogyakarta.
Penulis menyadari bahwa dalam penyelesaian skripsi tentunya tidak lepas
dari bantuan dan campur tangan dari berbagai pihak, baik secara langsung
maupun tidak langsung. Oleh karena itu, penulis hendak mengucapkan
terimakasih kepada :
1. Ibu Aris Widayati, M.Si., Ph.D., Apt. selaku Dekan Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta.
2. Ibu Phebe Hendra, M.Si., Ph.D., Apt. selaku Dosen Pembimbing dan
Dosen Penguji pada skripsi ini atas segala kesabaran, masukan, bantuan,
bimbingan, dan motivasi kepada penulis selama pengerjaan skripsi ini.
3. Ibu Dr. Erna Tri Wulandari, Apt. selaku Dosen Penguji skripsi yang telah
memberi banyak perhatian, masukan, dan saran kepada penulis.
4. Ibu Dita Maria Virginia, S. Farm., M.Sc., Apt. selaku Dosen Penguji
skripsi yang telah memberi banyak perhatian, masukan, dan saran kepada
penulis.
5. Ibu Agustina Setiawati, M.Sc., Apt. selaku Kepala Penanggungjawab
Laboratorium Fakultas Farmasi yang telah memberikan ijin dalam
penggunaan semua fasilitas laboratorium untuk kepentingan penelitian
viii
6. Pak Heru, Pak Parjiman, Pak Kayat, Pak Wagiran, dan Pak Agung selaku
laboran laboratorium Fakultas Farmasi, atas segala bantuan dan kerja sama
selama di laboratorium.
7. Rekan-rekan tim skripsi Macaranga 2015, Novita, Cyndi Yulanda P.,
Cinthya Anggarini, Oktariani Aurelia J., Dian Ayu M., Maria Angelika S.,
Rahayu Triwanti, dan Sona Karisnata I., atas segala kerja sama, bantuan
dan dukungan dalam pengerjaan skripsi.
8. Seluruh dosen dan teman-teman FSM D 012, FKK B 012 serta seluruh
angkatan 2012 Fakultas Farmasi Universitas Sanata Dharma.
9. Orang tua penulis yang selalu memotivasi dan mendanai sebagian besar
penelitian ini.
10. Kedua kakak penulis yang selalu setia membantu dan mendukung
pengerjaan skripsi.
11. Pihak-pihak lain yang ikut membantu selama penyusunan skripsi yang
tidak dapat disebutkan satu-persatu
Penulis menyadari bahwa setiap manusia tidak ada yang sempurna. Oleh
karena itu, penulis mengharapkan adanya kritik, saran dan masukan yang berguna
bagi kemajuan di masa yang akan datang. Semoga tulisan ini dapat memiliki
manfaat sekecil apapun bagi perkembangan ilmu pengetahuan khususnya di
bidang kefarmasian, serta semua pihak, baik mahasiswa, lingkungan akademis,
maupun masyarakat.
Yogyakarta, 5 November 2015
ix
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
PERNYATAAN PERSETUJUAN PUBLIKASI ... vi
PRAKATA ... vii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvii
INTISARI ... xviii
ABSTRACT ... xix
BAB I. PENGANTAR ... 1
A. Latar Belakang ... 1
1. Perumusan masalah ... 4
2. Keaslian penelitian ... 5
3. Manfaat penelitian ... 6
a. Manfaat teoritis ... 6
b. Manfaat praktis ... 6
x
1. Tujuan umum ... 6
2. Tujuan khusus ... 7
BAB II. PENELAAHAN PUSTAKA ... 8
A. Hepar ... 8
1. Anatomi dan Fisiologi hepar ... 8
2. Kerusakan hepar ... 11
B. Laktat Dehidrogenase ... 19
C. Hepatotoksin ... 23
D. Karbon tetraklorida ... 24
E. Macaranga tanarius L. ... 27
1. Sinonim ... 27
2. Nama lain ... 28
3. Taksonomi ... 28
4. Morfologi ... 28
5. Kandungan ……... 29
6. Khasiat dan kegunaan ... 31
F. Ekstraksi ... 32
G. Fraksinasi ... 34
H. Landasan teori ... 35
I. Hipotesis ... 37
BAB III. METODE PENELITIAN ... 38
xi
B. Variabel Penelitian dan Definisi Operasional ... 38
1. Variabel utama... 38
2. Variabel pengacau ... 39
3. Definisi operasional ... 39
C. Bahan Penelitian ... 41
1. Bahan utama ... 41
2. Bahan kimia ... 41
D. Alat Penelitian ... 42
1. Alat pembuatan serbuk kering daun M. tanarius …………. 42
2. Alat pembuatan fraksi daun M. tanarius ……….. 42
3. Alat uji hepatoprotektif ………. 43
E. Tata Cara Penelitian ... 43
1. Determinasi daun M. tanarius ... 43
2. Pengumpulan bahan uji ... 43
3. Pembuatan serbuk daun M. tanarius ... 44
4. Penetapan kadar air serbuk daun M. tanarius ... 44
5. Pembuatan ekstrak metanol-air daun M. tanarius ... 44
6. Pembuatan fraksi daun M. tanarius ... 45
7. Pembuatan larutan CMC-Na 1% ... 46
8. Pembuatan suspensi FHEMM ………... 46
9. Pembuatan larutan karbon tetraklorida ………. 46
xii
11.Pengelompokkan dan perlakuan hewan uji ... 47
12.Pengukuran aktivitas LDH ... 48
F. Tata Cara Analisis Hasil ... 49
G. Ruang Lingkup Penelitian ………. 50
BAB IV. HASIL DAN PEMBAHASAN ... 51
A. Penyiapan Bahan ... 51
1. Hasil determinasi tanaman ... 51
2. Pembuatan serbuk daun M. tanarius ... 52
3. Penetapan kadar air serbuk daun M. tanarius ... 52
B. Hasil Penimbangan Bobot Pengeringan tetap dan rendemen FHEMM ... 53
C. Uji Pendahuluan ... 56
1. Penetapan dosis FHEMM ... 56
2. Penetapan dosis hepatotoksin CCl4………... 56
3. Penetapan waktu pencuplikan darah ………. 57
4. Penetapan lama pemejanan FHEMM... 64
D. Hasil Uji Efek Hepatoprotektif FHEMM Jangka Panjang Terhadap Tikus Betina Galur Wistar Terinduksi CCl4 berdasarkan Aktivitas Serum LDH ... 64
1. Kontrol Negatif ………... 67
2. Kontrol Hepatotoksin ... 67
xiii
4. Kelompok perlakuan FHEMM dosis I (34,28 mg/kgBB),
dosis II (68,57 mg/kgBB) dan dosis III (137,14 mg/kgBB)
pada tikus betina galur Wistar yang terinduksi CCl4 dengan
dosis 2 mL/kgBB………... 71
E. Rangkuman Pembahasan ... 75
BAB V. KESIMPULAN DAN SARAN ... 77
A. Kesimpulan ... 77
B. Saran ... 77
DAFTAR PUSTAKA ... 78
LAMPIRAN ... 86
xiv
DAFTAR TABEL
Tabel I. Nilai purata ± SE aktivitas serum ALT darah tikus setelah pemberian CCl4 dengan dosis 2
mL/kgBB pada selang waktu 0, 24 dan 48 jam
………... 59
Tabel II. Perbedaan kenaikan aktivitas serum ALT setelah pemberian 2 mL/kgBB CCl4 pada
waktu pencuplikan darah jam ke-0, 24 dan 48
……… 61
Tabel III. Nilai purata ± SE aktivitas serum AST darah tikus setelah pemberian CCl4 dengan dosis 2
mL/kgBB pada selang waktu 0, 24 dan 48 jam
………... 61
Tabel IV. Perbedaan kenaikan aktivitas serum AST setelah pemberian 2 mL/kgBB CCl4 pada
waktu pencuplikan darah jam ke-0, 24 dan 48
……… 63
Tabel V. Efek hepatoprotektif FHEMM jangka panjang pada dosis 34,28; 68,57; 137,14 mg/kgBB
terhadap aktivitas serum LDH darah tikus
terinduksi CCl4 ……….. 65
Tabel VI. Hasil statistik dengan uji Scheffe nilai aktivitas serum LDH tikus setelah pemberian FHEMM
jangka panjang dan induksi CCl4 dengan dosis
xv
DAFTAR GAMBAR
Gambar 1. Anatomi Hepar ... 8
Gambar 2. Lobulus Hepar ... 10
Gambar 3. Mekanisme kerusakan sel hepar karena obat ... 14
Gambar 4. Patogenesis perlemakan hepar ... 16
Gambar 5. Isoenzim LDH ... 20
Gambar 6. Mekanisme produksi dan eliminasi laktat ………... 22
Gambar 7. Struktur Karbon Tetraklorida ………. 24
Gambar 8. Mekanisme CCl4 merusak hepar ………. 25
Gambar 9. Mekanisme CCl4 terhadap akumulasi lemak di hepar …. 27 Gambar 10. Kandungan senyawa ekstrak metanol M. tanarius……. 29
Gambar 11. Kandungan senyawa ekstrak etanol M. tanarius…... 30
Gambar 12. Tiga senyawa baru dari M. tanarius: tanarifuranolol (1) tanariflavanone C (2) tanariflavanone D (3) …... 30
Gambar 13. Kandungan senyawa ekstrak etil asetat M. tanarius: mallotinic acid (1), corilagin (2), macatannin A (3), chebulagic acid (4) dan macatannin B (5) …... 31
Gambar 14. Flowchart ruang lingkup penelitian ... 50
xvi
Gambar 16. Diagram batang rata-rata aktivitas serum AST tikus setelah pemberian 2 ml/kgBB CCl4 pada waktu
pencuplikan 0, 24, dan 48 jam ………... 62
Gambar 17. Diagram batang purata aktivitas serum LDH setelah praperlakuan pemberian FHEMM selama 6 hari dan
xvii
DAFTAR LAMPIRAN
Lampiran 1. Foto daun M. tanarius L. ... 87
Lampiran 2. Foto ekstrak daun M. tanarius L. ... 87
Lampiran 3. Foto fraksi daun M. Tanarius ... 88
Lampiran 4. Surat determinasi tanaman M. tanarius ... 89
Lampiran 5. Surat Ethical Clearance ... 90
Lampiran 6. Hasil analisis statistik data ALT dan AST pada uji pendahuluan waktu pencuplikan darah hewan uji setelah induksi CCl4 2 ml/kgBB ……… 91
Lampiran 7. Hasil analisis statistik data kontrol CMC-Na 1%, kontrol CCl4, kontrol dosis tertinggi, dan perlakuan pemberian FHEMM dosis 34,28; 68,57; 137,14 mg/kgBB ………. 100
Lampiran 8. Perhitungan penetapan peringkat dosis fraksi daun M. tanarius pada kelompok perlakuan ……… 106
Lampiran 9. Perhitungan konversi dosis untuk manusia ……….. 107
Lampiran 10. Penetepan kadar air serbuk daun M. tanarius ... 108
xviii
INTISARI
Penelitian ini bertujuan untuk mengetahui pengaruh pemberian jangka panjang fraksi heksan-etanol ekstrak metanol-air daun Macaranga tanarius L. (FHEMM) pada tikus betina galur Wistar yang terinduksi karbon tetraklorida berdasarkan penurunan aktivitas laktat dehidrogenase (LDH) serta untuk mengetahui kekerabatan antar dosis pemberian FHEMM terhadap penurunan aktivitas LDH pada tikus betina galur Wistar yang terinduksi karbon tetraklorida.
Penelitian ini bersifat eksperimental murni dengan rancangan acak lengkap pola searah. Hewan uji yang digunakan adalah tikus putih betina galur Wistar umur 2-3 bulan dengan berat 130-180 gram. Tiga puluh ekor tikus dibagi acak dalam 6 kelompok perlakuan. Kelompok I merupakan kontrol negatif CMC-Na 1% yang diberikan selama 6 hari berturut-turut. Kelompok II merupakan kontrol hepatotoksin karbon tetraklorida 2 ml/kgBB. Kelompok III diberikan FHEMM dosis tertinggi tanpa induksi karbon tetraklorida selama 6 hari berturut-turut. Kelompok IV-VI merupakan perlakuan FHEMM dengan 3 peringkat dosis (34,28; 68,57; dan 137,14 mg/kgBB) yang diberikan selama 6 hari berturutan, pada hari ke-7 diberikan karbon tetraklorida. Pengambilan darah dilakukan pada jam ke-24 untuk pengukuran kadar LDH. Kadar LDH dianalisis dengan metode
Shapiro-Wilk dan diperoleh distribusi data tiap kelompok normal maka dilanjutkan dengan analisis pola searah (One Way Anova) dengan taraf kepercayaan 95%. Uji Scheffe dilakukan untuk melihat perbedaan antar kelompok bermakna (signifikan) (p<0,05) atau tidak bermakna (tidak signifikan) (p>0,05).
Hasil penelitian menunjukkan bahwa FHEMM terbukti berpengaruh dalam menurunkan aktivitas serum LDH tikus betina galur Wistar yang terinduksi karbon tetraklorida 2 ml/kgBB. Tidak terdapat kekerabatan antar dosis FHEMM dengan aktivitas serum LDH yang muncul, yang terlihat dari semakin besar dosis praperlakuan FHEMM, kadar LDH relatif sama.
xix
Abstract
The purposes of this research were to find out the long-term effect of hexane-ethanol fraction, derived from methanol-water extract Macaranga tanarius L. leaves (FHEMM), toward Wistar female rats that were induced by carbon tetrachloride based on the decreased lactate dehydrogenase (LDH) activity; and to perceive the correlation of FHEMM doses toward the decreased in LDH activity on Wistar female rats induced by carbon tetrachloride.
This research was done in a pure experimental method by using completely randomized design in one direction. Animal tested for this research was Wistar female rats at the age of 2 to 3 months and with a weight of 130-180 grams. Thirty rats were divided randomly into 6 groups. The first group was the negative control of 1% CMC-Na which was given for 6 days in a row. The second group was the control of 2 ml/kgBW carbon tetrachloride as a hepatotoxin. The third group was given the highest dose of FHEMM without being induced by carbon tetrachloride for six days in a row. The fourth to sixth group were provided with FHEMM with three rankings of dose (34.28; 68.57; and 137.14 mg/kgBW) for six days in a row, and on the 7th day carbon tetrachloride was granted. The blood sampling was accomplished on the 24th hour to carry out the measurement of LDH level. LDH level was analyzed by refering to Shapiro-Wilk, and since the data distribution of each group was normal, One Way Anova design with 95% confidence interval continued. Scheffe test was performed to witness the difference between significant groups (p<0.05) and insignificant groups (p>0.05)
The result showed that the FHEMM had an effect in lowering the serum LDH activity of Wistar female rats induced by 2 ml/kgBW carbon tetrachloride. There’s no correlation found between FHEMM doses and the emergence of serum LDH activity, which was seen from the more the dose of FHEMM pre-treatment given, the more LDH levels looked relatively the same.
1
BAB I PENGANTAR A. Latar Belakang
Hepar merupakan organ terbesar dalam tubuh manusia. Pada hepar
terjadi proses-proses penting bagi kehidupan seperti metabolisme karbohidrat,
lemak, protein, dan detoksifikasi racun atau obat yang masuk ke dalam tubuh
(Price and Wilson, 2005). Hepar merupakan organ yang paling sering rusak (Lu,
1995). Beberapa penyebab kerusakan hepar yaitu infeksi virus, imunologi, dan
obat-obat yang dapat merusak hepar (Williamson, David, and Fred, 1996).
Karbon tetraklorida (CCl4) adalah salah satu dari bahan-bahan kimia
beracun yang menyebabkan model kerusakan hepar atau bersifat hepatotoksik.
Pada penelitian ini, CCl4 digunakan sebagai induktor kerusakan hepar.
Hepatotoksik yang ditimbulkan oleh CCl4 disebabkan oleh senyawa hasil
metabolisme yang bersifat radikal bebas. Senyawa radikal bebas tersebut adalah
triklorometil yang dapat bereaksi dengan oksigen membentuk
triklorometilperoksida (Weber, Boll, and Stampfl, 2003). Triklorometil dengan
bantuan katalis enzim sitokrom P-450 dapat menimbulkan peroksidasi lipid. Hasil
ini dapat menyebabkan kerusakan sel berupa perlemakan hepar (steatosis)
2
Pada tahun 2001, angka kejadian perlemakan hepar 30,6% dari 1000
orang dengan usia 25 tahun ke atas di kota Depok. Pasien perlemakan hepar
umumnya berusia 40-50 tahun. Perlemakan hepar dapat menyebabkan sirosis,
tetapi potensinya lebih kecil dibandingkan akibat virus. Dari 100 orang penderita
perlemakan hepar, 10-15 orang dapat mengalami sirosis (Sey, 2003). Prevalensi
kejadian steatosis dan steatohepatitis pada obesitas tipe 1 (BMI 30-39,9 kg/m2)
adalah 65% dan 20%, sedangkan pada obesitas tipe 2 (BMI ≥ 40 kg/m2) adalah
85% dan 40% (Petersen, Dufour, Feng, Befroy, Dziura, and Dalla Man, 2006).
Sel-sel hepar yang mengalami kerusakan akan mengakibatkan
enzim-enzim yang terdapat di dalam hepatosit tersebut terlepas ke dalam sirkulasi
sistemik sehingga kadar enzim-enzim tersebut akan meningkat dalam darah.
Enzim-enzim tersebut antara lain alkaline phosphatase (ALP), laktat dehidrogenase (LDH), aspartat aminotransferase (AST), alanin aminotransferase
(ALT), dan gamma glutamil transferase (GGT) (Weber, Boll, and Stampfl, 2003).
Pada penelitian ini digunakan enzim LDH sebagai parameter kerusakan hepar.
Laktat dehidrogenase (LDH) merupakan enzim intraseluler yang terdapat
pada hampir semua sel yang bermetabolisme. LDH memfasilitasi proses glukosa
menjadi energi di dalam sel. LDH terdapat pada banyak organ dan jaringan di
dalam tubuh seperti hepar, jantung, pankreas, ginjal, otot rangka, otak, dan sel
darah. Aktivitas LDH total dalam serum dapat meningkat pada hampir semua
keadaan kerusakan organ atau jaringan atau bila terjadi destruksi sel. Ada 5 tipe
3, LDH 4, dan LDH 5. Isoenzim LDH-5 mempunyai konsentrasi yang tertinggi
pada organ hepar (Vincent and Muhopadhyay, 2008).
Radikal bebas dari CCl4 dapat diredam oleh suatu antioksidan. Dalam
kondisi normal radikal bebas jumlahnya seimbang dengan antioksidan sebagai
suatu mekanisme pertahanan. Hepar berfungsi sebagai sistem pertahanan tubuh
tentunya juga memiliki sistem antioksidan yang cukup baik. Tetapi bila hepar
telah rusak karena bahan toksik, maka perlu diberi tambahan antioksidan dari luar
(Zimmerman, 1999). Salah satu tanaman yang mempunyai aktivitas antioksidan
yaitu Macaranga tanarius L. Macaranga tanarius L. (M. tanarius, Euphorbiaceae) merupakan tanaman tropis yang tersebar secara merata di Asia
Selatan dan biasanya disebut sebagai tanaman bersemut (Kumazawa, Murase,
Momose, and Fukumoto, 2013). Akan tetapi, M. tanarius juga dapat ditemukan di Indonesia dan merupakan tanaman asli Indonesia (World Agroforestry Centre,
2002). Pada penelitian Kumazawa et al. (2013) melaporkan bahwa ekstrak etanol
M. tanarius mempunyai aktivitas antioksidan dan antimikroba. Phommart, Sutthivaiyakit, Chimnoi, Ruchirawat, and Sutthivaiyakit (2005) melaporkan
bahwa M. tanarius mempunyai aktivitas antiinflamasi. Pada penelitian Matsunami, Otsuka, Kondo, Shinzato, Kawahata, Yamaguchi, and Takeda (2009)
melaporkan bahwa ekstrak metanol M. tanarius mempunyai aktivitas antioksidan karena mempunyai macarangiosida A-C dan malofenol B yang dapat menangkap
radikal terhadap DPPH. Berdasarkan penelitian Adrianto (2010) melaporkan
efek hepatoprotektif. Fraksi heksan-diklorometan ekstrak metanol daun
Macaranga denticulate dan Macaranga pruinosa memiliki kandungan aktivitas antioksidan tertinggi dibandingkan fraksi pelarut lainnya (Mazlan, Mediani, Abas,
Ahmad, Shaari, Khamis, dan Lajis, 2013). Belum ada penelitian mengenai fraksi
heksan-etanol ekstrak metanol-air M. tanarius (FHEMM). Oleh karena itu, dilakukan penelitian mengenai efek hepatoprotektif pemberian jangka panjang
FHEMM terhadap aktivitas LDH pada tikus yang terinduksi CCl4. Selain itu,
pemilihan pelarut fraksi heksan dan etanol didasarkan pada kepolaran senyawa M. tanarius. Kepolaran heksan dan etanol diketahui dengan menggunakan aplikasi
Marvin sketch yaitu sebesar 2,97 yang memiliki kepolaran yang hampir sama dengan senyawa ellagitannin pada M. tanarius yang berhasil diteliti oleh Puteri dan Kawabata (2010) yaitu Chebulagic acid (2,64), Macatanin A (2,76) dan
Macatanin B (2,94) sehingga diharapkan ketiga senyawa tanin tersebut dapat diisolasi dengan pelarut heksan dan etanol karena adanya persamaan kepolaran.
Fraksi ekstrak metanol-air M. tanarius dipilih karena pada bentuk ekstrak dan infusa sudah dapat menghasilkan efek hepatoprotektif, sehingga diharapkan pada
bentuk fraksi juga dapat menghasilkan efek hepatoprotektif dengan kandungan
senyawa yang lebih spesifik yaitu ellagitannin.
1. Perumusan Masalah
Permasalahan yang diajukan dalam penelitian ini berdasarkan uraian latar
a. Apakah pemberian jangka panjang FHEMM pada tikus betina
galur Wistar yang terinduksi CCl4 mempunyai efek hepatoprotektif
berdasarkan aktivitas LDH ?
b. Apakah terdapat kekerabatan antara dosis FHEMM jangka panjang
terhadap penurunan kadar serum LDH pada tikus betina galur
Wistar yang terinduksi CCl4 ?
2. Keaslian Penelitian
Sebelumnya pernah dilakukan penelitian yang berhubungan dengan
daun M. tanarius. Berdasarkan penelitian Phommart et al. (2005) melaporkan bahwa flavonoid dari ekstrak n-heksan dan kloroform daun M. tanarius mempunyai aktivitas antioksidan terhadap 1,1-diphenyl-2-pycrylhydrazyl (DPPH). Macarangioside A, macarangioside B, macarangioside C, dan malofenol B yang diisolasi dari ekstrak metanol daun M. tanarius menunjukkan aktivitas yang poten terhadap DPPH (Matsunami et al., 2009). Pada penelitian invivo menunjukkan bahwa ekstrak metanol-air M. tanarius mempunyai efek analgesik pada mencit betina (Andini, 2010). Windrawati (2013) melaporkan bahwa dosis
sebesar 3840 mg/kgBB merupakan dosis efektif untuk memberikan efek
hepatoprotektif jangka panjang ekstrak metanol-air daun M. tanarius. Berdasarkan penelitian Tiala (2013) telah dilakukan penelitian efek
hepatoprotektif dengan pemberian ekstrak metanol-air daun M. tanarius. Nurcahyanti (2013) melaporkan bahwa infusa air daun M. tanarius
metanol daun Macaranga denticulate dan Macaranga pruinosa memiliki kandungan aktivitas antioksidan tertinggi (Mazlan dkk., 2013). Sejauh
penelurusan pustaka yang dilakukan, penelitian mengenai efek
hepatoprotektif jangka panjang FHEMM pada tikus betina galur Wistar
yang terinduksi CCl4 berdasarkan aktivitas LDH belum pernah dilakukan.
3. Manfaat Penelitian
a. Manfaat Teoritis
Hasil penelitian dapat memberikan informasi dalam
bidang kefarmasian yang berhubungan dengan efek hepatoprotektif
jangka panjang FHEMM
b. Manfaat Praktis
Hasil penelitian dapat memberikan informasi kepada
masyarakat mengenai manfaat penggunaan jangka panjang daun M. tanarius dalam menurunkan kadar LDH.
B. Tujuan Penelitian
a. Tujuan Umum
Untuk mengetahui FHEMM terhadap penurunan aktivitas LDH
b. Tujuan Khusus
- Untuk mengetahui pengaruh pemberian jangka panjang FHEMM pada
tikus betina galur Wistar yang terinduksi CCl4 berdasarkan aktivitas
LDH.
- Untuk mengetahui kekerabatan antar dosis pemberian FHEMM
terhadap penurunan kadar serum LDH pada tikus betina galur Wistar
8
BAB II
PENELAAHAN PUSTAKA A. Hepar
1. Anatomi dan Fisiologi Hepar
Hepar merupakan organ terbesar dalam tubuh manusia dengan berat
kurang lebih 1,5 kg, 2,5% dari berat tubuh orang dewasa normal (Jungueira and
Carneiro, 2002).Pada kondisi hidup, hepar berwarna merah tua karena kaya akan
persediaan darah (Sloane, 2004). Permukaan atas hepar terletak bersentuhan
dibawah diafragma, permukaan bawah terletak bersentuhan diatas organ-organ
abdomen. Batas atas hepar sejajar dengan ruang interkosta V kanan dan batas
bawah menyerong ke atas dari iga IX kanan ke iga VIII kiri. Permukaan posterior
hepar berbentuk cekung dan terdapat celah transversal sepanjang 5 cm dari sistem
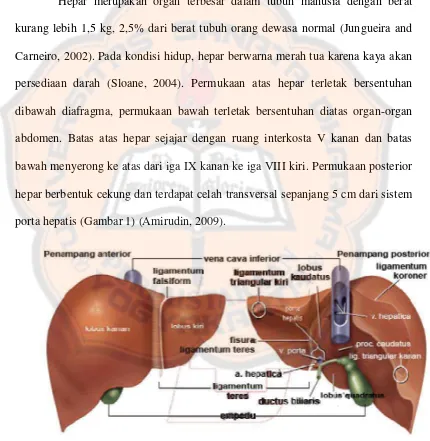
[image:30.595.98.528.230.671.2]porta hepatis (Gambar 1) (Amirudin, 2009).
Gambar 1: Anatomi Hepar (Toole and Susan, 1999)
Secara anatomis hepar terdiri dari lobus kanan yang besar dan lobus kiri
falsiforme dan postero-inferior oleh fisura untuk ligamentum venosum dan
ligamentum teres. Pada klasifikasi anatomis, lobus kanan terdiri dari lobus
kaudatus dan kuadratus. Akan tetapi, secara fungsional lobus kaudatus dan
sebagian besar lobus kuadratus merupakan bagian dari lobus kiri karena mendapat
darah dari arteri hepatika sinistra dan aliran empedunya menuju duktus hepatika
sinistra. Oleh karenanya, klasifikasi fungsional hepar menyatakan bahwa batas
antara lobus kanan dan kiri terletak pada bidang vertikal yang berjalan ke
posterior dari kandung empedu menuju vena kava inferior (Faiz and Moffat,
2003).
Bila permukaan postero-inferior (viseral) hepar dilihat dari belakang
terlihat bentuk huruf H yang terdiri dari sulkus dan fosa. Batas-batas huruf H ini
adalah :
a. Kaki anterior kanan-fosa kandung empedu.
b. Kaki posterior kanan-sulkus untuk vena kava inferior.
c. Kaki anterior kiri-fisura yang berisi ligamentum teres (sisa vena umbilikalis
sinistra fetus yang mengalirkan kembali darah yang mengandung oksigen
dari plasenta ke fetus).
d. Kaki posterior kiri-fisura untuk ligamentum venosum (struktur ini
merupakan sisa ductus venosus fetus; pada fetus duktus venosus berfungsi
sebagai jalan pintas yang mempersingkat aliran darah dari vena umbilikalis
sinistra langsung ke vena kava inferior tanpa melalui hepar).
e. Kaki horizontal-porta hepatis. Lobus kaudatus dan kuadratus hepar adalah
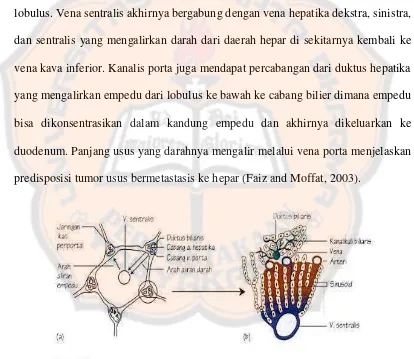
Hepar terdiri dari banyak unit fungsional (Gambar 2). Hepar disuplai
oleh dua pembuluh darah yaitu vena porta hepatika yang berasal dari lambung dan
usus yang kaya akan nutrien seperti asam amino, monosakarida, vitamin yang
larut dalam air dan mineral; dan arteri hepatika, cabang dari arteri koliaka yang
kaya akan oksigen. Cabang-cabang vena porta dan arteri hepatika mentranspor
darah melalui kanalis porta menuju vena sentralis melalui sinusoid yang melintasi
lobulus. Vena sentralis akhirnya bergabung dengan vena hepatika dekstra, sinistra,
dan sentralis yang mengalirkan darah dari daerah hepar di sekitarnya kembali ke
vena kava inferior. Kanalis porta juga mendapat percabangan dari duktus hepatika
yang mengalirkan empedu dari lobulus ke bawah ke cabang bilier dimana empedu
bisa dikonsentrasikan dalam kandung empedu dan akhirnya dikeluarkan ke
duodenum. Panjang usus yang darahnya mengalir melalui vena porta menjelaskan
[image:32.595.99.513.273.632.2]predisposisi tumor usus bermetastasis ke hepar (Faiz and Moffat, 2003).
Gambar 2: Lobulus Hepar (Faiz and Moffat, 2003).
Hepar adalah organ metabolik terbesar dan terpenting di tubuh. Organ ini
penting bagi sistem pencernaan untuk sekresi empedu. Hepar menghasilkan
empedu sekitar satu liter per hari, yang diekskresi melalui duktus hepatikus kanan
sekresi empedu, hepar juga melakukan berbagai fungsi lain, mencakup hal-hal
berikut:
1. Pengolahan metabolik kategori nutrien utama (karbohidrat, lemak, protein).
2. Detoksifikasi atau degradasi zat-zat sisa dan hormon serta obat dan senyawa
asing lainnya.
3. Sintesis berbagai protein plasma, mencakup protein-protein yang penting
untuk pembekuan darah serta untuk mengangkut hormon tiroid, steroid dan
kolesterol dalam darah.
4. Penyimpanan glikogen, lemak, besi, tembaga dan banyak vitamin.
5. Pengaktifan vitamin D yang dilakukan oleh hepar bersama dengan ginjal.
6. Pengeluaran bakteri dan sel darah merah yang sudah tua atau rusak.
7. Ekskresi kolesterol dan bilirubin yang merupakan produk penguraian yang
berasal dari pemecahan sel darah merah yang sudah tua atau rusak
(Sherwood, 2001).
2. Kerusakan Hepar
Kondisi toksisitas hepar dipersulit oleh berbagai kerusakan hepar dan
mekanisme yang menyebabkan kerusakan tersebut. Hepar sering menjadi organ
sasaran zat toksikan karena sebagian besar toksikan memasuki tubuh melalui
sistem gastrointestinal dan setelah toksikan diserap lalu dibawa oleh vena porta ke
Kerusakan hepar karena zat toksik dipengaruhi oleh beberapa faktor,
seperti jenis zat kimia, dosis yang diberikan, dan lamanya paparan zat tersebut
seperti akut, subkronik atau kronik. Semakin tinggi konsentrasi suatu senyawa
yang diberikan maka respon toksik yang ditimbulkan semakin besar. Kerusakan
hepar dapat terjadi segera atau setelah beberapa minggu sampai beberapa bulan.
Kerusakan dapat berbentuk nekrosis hepatosit, kolestasis, atau timbulnya
disfungsi hepar secara perlahan-lahan (Amalina, 2009).
Hepatotoksisitas akibat senyawa kimia merupakan komplikasi potensial
yang hampir selalu ada pada setiap senyawa kimia yang diberikan karena hepar
merupakan pusat disposisi metabolik dari semua obat dan bahan asing yang
masuk. Sebagaimana yang dinyatakan Robins and Kumar (1992) bahwa
kerusakan sel hepar jarang disebabkan oleh suatu substansi secara langsung,
melainkan seringkali oleh metabolit toksik dari substansi yang bersangkutan.
Hepar merupakan organ paling sering rusak (Lu, 1995). Karena
metabolisme obat/ berbagai senyawa terutama terjadi dalam hepar, sehingga
kemungkinan terjadinya kerusakan organ ini menjadi sangat besar (Powell and
Piper, 1989). Apabila proses metabolisme tidak berjalan dengan normal, maka
akan menimbulkan berbagai penyakit, salah satunya adalah penyakit yang terjadi
di hepar. Sel-sel yang terdapat di hepar akan terdeposit sehingga akan mengalami
perubahan (Sherwood, 2001). Selain itu, hepar juga mempunyai kemampuan
untuk mengeluarkan toksikan dengan kapasitasnya yang lebih tinggi dalam proses
biotransformasi toksikan. Akan tetapi paparan oleh berbagai bahan toksik secara
Kerusakan hepar dapat dibedakan menjadi 2 yaitu kerusakan hepar akut
dan kerusakan hepar kronis. Kerusakan hepar akut disebabkan karena virus,
obat-obatan, alkohol dan keadaan iskemik. Kerusakan hepar akut ditandai dengan
adanya penyakit kuning, hipoglikemia, gangguan elektrolit dan asam-basa,
ensefalopati hepar, dan kenaikan serum enzim yang berhubungan dengan kasus
nekrosis hepar. Kerusakan hepar akut memiliki angka kematian yang tinggi.
Sedangkan kerusakan hepar kronis yaitu hepatitis kronis, sirosis hepar dan
hepatoma (Chandrasoma and Taylor, 1995). Mekanisme kerusakan sel hepar
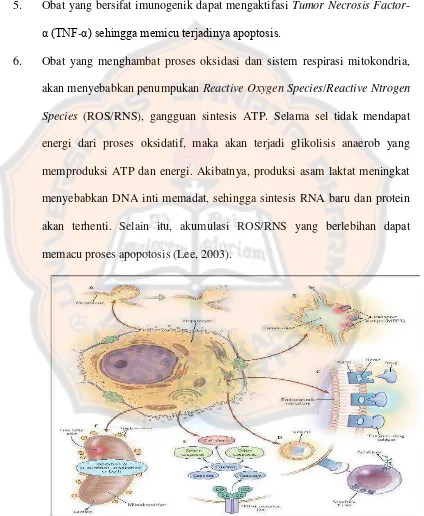
karena obat (Gambar 3) :
1. Apabila reaksi energi tinggi melibatkan enzim sitokrom p-450
menyebabkan ikatan kovalen obat dengan protein intrasel, maka akan terjadi
disfungsi intraseluler berupa hilangnya gradien ion, penurunan kadar ATP,
dan disrupsi aktin pada permukaan hepatosit yang menyebabkan
pembengkakan sel.
2. Disrupsi aktin pada membran kanalikuli dapat menghalangi aliran bilier
menyebabkan kolestasis. Kolestasis bersama dengan proses kerusakan
intrasel akan menyebabkan akumulasi asam empedu sehingga menyebabkan
kerusakan hepatosit lebih lanjut.
3. Reaksi hepatoseluler yang melibatkan senyawa besi heme akan
menyebabkan timbulnya ikatan kovalen antara enzim dengan obat sehingga
reaksi enzimatik tidak bekerja.
4. Obat dengan molekul kecil berfungsi sebagai hapten membentuk kompleks
menginduksi sel T untuk membentuk antibodi atau menginduksi respon
sitotoksik sel T dan sitokin.
5. Obat yang bersifat imunogenik dapat mengaktifasi Tumor Necrosis Factor -α (TNF-α) sehingga memicu terjadinya apoptosis.
6. Obat yang menghambat proses oksidasi dan sistem respirasi mitokondria,
akan menyebabkan penumpukan Reactive Oxygen Species/Reactive Ntrogen Species (ROS/RNS), gangguan sintesis ATP. Selama sel tidak mendapat energi dari proses oksidatif, maka akan terjadi glikolisis anaerob yang
memproduksi ATP dan energi. Akibatnya, produksi asam laktat meningkat
menyebabkan DNA inti memadat, sehingga sintesis RNA baru dan protein
akan terhenti. Selain itu, akumulasi ROS/RNS yang berlebihan dapat
[image:36.595.100.524.170.686.2]memacu proses apopotosis (Lee, 2003).
Jenis-jenis kerusakan hepar yang dapat timbul dari berbagai jenis
senyawa toksik :
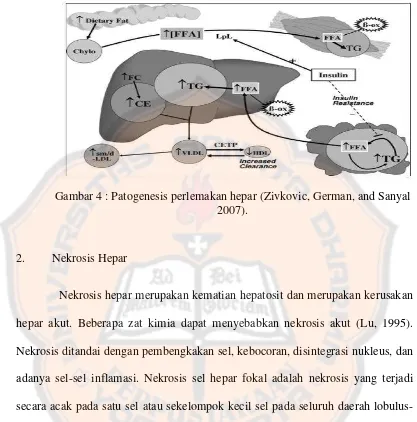
1. Steatosis (Perlemakan hepar)
Perlemakan hepar adalah keadaan dimana lemak yang terdapat di hepar
melebihi 5% dari berat hepar normal (Soemarto, 1996). Secara teoritis lemak
dapat mengalami akumulasi di hepar melalui beberapa mekanisme (Gambar 4)
yaitu,
a. Peningkatan transfer lemak atau asam lemak dari usus ke hepar. Makanan
berlemak dikirim melalui sirkulasi terutama dalam bentuk kilomikron.
Lipolisis pada jaringan adiposa melepaskan asam lemak kemudian
bergabung dengan trigliserida di dalam adiposit, tetapi beberapa asam lemak
dilepaskan ke dalam sirkulasi dan diambil oleh hepar, sisa kilomikron juga
dikirim ke hepar.
b. Peningkatan sintesis asam lemak atau pengurangan oksidasi di mitokondria,
keduanya akan meningkatkan sintesis trigliserida melalui proses esterifikasi.
c. Gangguan pengeluaran trigliserida keluar dari sel hepar. Pengeluaran
trigliserida dari sel hepar tergantung ikatannya dengan apoprotein, fosfolipid
dan kolesterol untuk membentuk very low density lipoprotein (VLDL). d. Kelebihan karbohidrat yang dikirim ke hepar dapat dirubah menjadi asam
Gambar 4 : Patogenesis perlemakan hepar (Zivkovic, German, and Sanyal 2007).
2. Nekrosis Hepar
Nekrosis hepar merupakan kematian hepatosit dan merupakan kerusakan
hepar akut. Beberapa zat kimia dapat menyebabkan nekrosis akut (Lu, 1995).
Nekrosis ditandai dengan pembengkakan sel, kebocoran, disintegrasi nukleus, dan
adanya sel-sel inflamasi. Nekrosis sel hepar fokal adalah nekrosis yang terjadi
secara acak pada satu sel atau sekelompok kecil sel pada seluruh daerah
lobulus-lobulus hepar. Nekrosis ini dikenali pada biopsi melalui badan asidofilik
(councilman) yang merupakan sel hepar nekrotik dengan inti piknotik atau lisis dan sitoplasma terkoagulasi berwarna merah muda. Selain itu dapat dikenali juga
pada daerah lisis sel hepar yang dikelilingi oleh kumpulan sel kupffer dan sel radang. Nekrosis zona sel hepar adalah nekrosis sel hepar yang terjadi pada
regio-regio yang identik disemua lobulus hepar, sedangkan nekrosis submasif
merupakan nekrosis sel hepar yang meluas melewati batas lobulus, sering
(Chandrasoma and Taylor, 2005). Nekrosis dapat dideteksi dengan pengujian
biokimia plasma (atau serum) untuk enzim yang dihasilkan di sitosol, aktivitas
enzim alanin aminotransferase (ALT) yang mendominasi enzim di hepatosit dan
aktivitas enzim LDH yang terdapat di berbagai jaringan (Gregus and Klaaseen,
2001).
3. Kolestasis
Kegagalan produksi atau pengeluaran empedu merupakan definisi dari
kolestasis. Kolestasis dapat menyebabkan gagalnya penyerapan lemak, vitamin
dan juga terjadi penumpukan asam empedu, bilirubin, dan kolesterol di hepar
(Depkes RI, 2007).
4. Sirosis Hepar
Sirosis hepar adalah penyakit hepar menahun yang ditandai dengan
adanya pembentukan jaringan ikat disertai nodul. Biasanya dimulai dengan
adanya proses peradangan nekrosis sel hepar yang luas, pembentukan jaringan
ikat dan usaha regenerasi nodul. Distorsi arsitektur hepar akan menimbulkan
perubahan sirkulasi mikro dan makro menjadi tidak teratur akibat penambahan
jaringan ikat dan nodul tersebut. Telah diketahui bahwa penyakit ini merupakan
stadium terakhir dari penyakit hepar kronis dan terjadinya pengerasan dari hepar
yang akan menyebabkan penurunan fungsi hepar dan bentuk hepar yang normal
akan berubah disertai terjadinya penekanan pada pembuluh darah dan
portal. Pada sirosis dini biasanya hepar membesar, kenyal, tepi tumpul, dan terasa
nyeri bila ditekan.
Secara fungsional sirosis hepar dibagi menjadi:
a. Sirosis hepar kompensata atau sirosis hepar laten, yang berarti belum
adanya gejala klinis yang spesifik. Skrining adalah cara untuk mengetahui
penyakit ini.
b. Sirosis hepar dekompensata atau Active Liver Cirrhosis, dimana terdapat gejala dan tanda klinis yang jelas. Sirosis hepar kompensata merupakan
kelanjutan dari proses hepatitis kronik dan pada satu tingkat tidak terlihat
perbedaanya secara klinis, hanya dapat dibedakan melalui biopsi hepar
(Nurdjanah, 2007).
Secara morfologi sirosis hepar bedasarkan besar kecilnya nodul, yaitu:
a. Makronodular
Sirosis makronodular ditandai dengan terbentuknya septa tebal, besarnya
bervariasi dan terdapat nodul besar di dalamnya sehingga terjadi regenerasi
parenkim (Lawrence, 2005).
b. Mikronodular
Sirosis mikronodular ditandai dengan terbentuk septa tebal teratur yang
terdapat dalam parenkim hepar, mengandung nodul halus dan kecil tersebar
diseluruh lobul
(Lawrence, 2005).
c. Kombinasi antara bentuk makronodular dan mikronodular
Menurut Gall seorang ahli penyakit hepar, membagi penyakit sirosis
hepar atas:
a. Sirosis Postnekrotik, atau sesuai dengan bentuk sirosis makronodular atau
subacute yellow, atrophy cirrhosis yang terbentuk karena banyak terjadi jaringan nekrosis.
b. Nutritional cirrhosis , atau sesuai dengan bentuk sirosis mikronodular, sirosis alkoholik, Laennec´s cirrhosis atau fatty cirrhosis. Sirosis terjadi sebagai akibat kekurangan gizi, terutama faktor lipotropik.
c. Sirosis Post hepatic, sirosis yang terbentuk sebagai akibat setelah menderita hepatitis (Nurdjanah, 2007).
5. Kanker Hepar
Kanker pada hepar yang banyak terjadi yaitu Hepatocellular carcinoma
(HCC) yang merupakan komplikasi dari hepatis kronis yang serius terutama
karena virus hepatitis B, C dan hemochromatosis (Lu, 1995).
B. Laktat Dehidrogenase
LDH adalah enzim intraseluler yang terdapat pada hampir semua sel
yang bermetabolisme dan jika sel rusak maka ditemukan peningkatan kadar LDH
dalam serum. LDH serum total tidak spesifik terhadap suatu jaringan tertentu,
melainkan isoenzimnya yang dikenal sebagai LDH 1 hingga LDH 5 yang spesifik
terhadap jaringan tertentu(Gavaghan, 1999).
Ada 5 tipe LDH atau isoenzim dengan konsentrasi yang berbeda pada
darah merah, LDH 2 terdapat pada sel darah putih, LDH 3 terdapat pada
paru-paru, LDH 4 terdapat pada ginjal, plasenta, dan pankreas, LDH 5 terdapat pada
[image:42.595.98.512.193.558.2]hepar dan otot rangka (Rahaju, 2003) (Gambar 5).
Gambar 5: Isoenzim LDH (Berg, Tymoczko and Stryer, 2002)
Nilai normal LDH berdasarkan umur yaitu umur 1-3 hari sebesar
135-750 U/L; 31 hari- 11 bulan sebesar 180-435 U/L; 1-3 tahun sebesar 160-370 U/L;
4-6 tahun sebesar 145-345 U/L; 7-9 tahun sebesar 143-290 U/L; 10-12 tahun
sebesar 120-293 U/L; 13-15 tahun sebesar 110-283 U/L; 16-17 tahun sebesar
105-233 U/L; lebih besar sama dengan 18 tahun sebesar 122-222 (Burtis and
Ashwood, 2006).
Pengukuran isoenzim dilakukan apabila terjadi peningkatan LDH.
Presentasi kadar normal isoenzim pada dewasa yaitu, LDH 1 sebesar 17-27%;
LDH 2 sebesar 27-37%; LDH 3 sebesar 18-25%; LDH 4 sebesar 3-8%; LDH 5
sebesar 0-5%. Peningkatan LDH 5 menandakan bahwa terjadi kerusakan pada
hepar atau penyakit hepar (Marianne, 2015).
Laktat dehidrogenase mengkatalisis proses reduksi piruvat menjadi laktat
menghasilkan NADH. Reaksi ini berlangsung di sitosol. Asam laktat atau laktat
laktat diproduksi setiap hari. Semua jaringan dapat memproduksi laktat dan asam
piruvat dari glukosa (Luft, 2001).
Jalur metabolisme glikolisis merupakan langkah awal metabolisme
glukosa dan terjadi pada sitoplasma sel. Produk akhir dari proses ini adalah
piruvat, yang selanjutnya berdifusi ke dalam mitokondria dan dimetabolisme
menjadi karbon dioksida melalui siklus kreb. Metabolisme glukosa menjadi
piruvat juga terjadi sebagai akibat reduksi dari kofaktor enzim yang
mengoksigenasi bentuk nicotinic acid dehydrogenase (NAD+) menjadi nicotinic acid dehydrogenase (NADH), bentuk tereduksi (Murray, Granner, and Mayes, 1995).
NADH/NAD+ merupakan kofaktor pertukaran atom hidrogen yang
dilepaskan atau yang dipakai. Oleh karena itu, rasio laktat/piruvat selalu
sebanding dengan rasio NADH/NAD+ di sitosol. Konsentrasi laktat yang tinggi
juga disertai dengan konsentrasi yang tinggi dari piruvat atau NADH di sitosol,
atau keduanya. Sintesis laktat meningkat bila pembentukan piruvat di sitosol
melebihi penggunaannya oleh mitokondria. Sintesis laktat juga dapat terjadi bila
metabolisme glukosa melebihi kapasitas oksidatif mitokondria (Luft, 2001).
Laktat berdifusi keluar dari sel dan dikonversi menjadi piruvat dan
selanjutnya dimetabolisme secara aerob menjadi karbondioksida dan ATP.
Jantung, hepar, dan ginjal menggunakan laktat dengan cara ini. Sebagai alternatif,
jaringan hepar dan ginjal dapat menggunakan laktat untuk menghasilkan glukosa
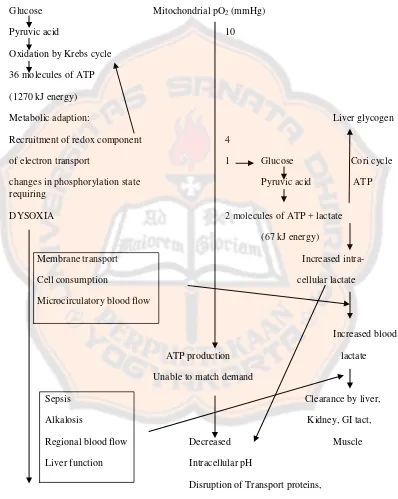
dan eritrosit. Laktat dimetabolisme oleh hepar, ginjal, dan jantung (Gambar 6)
(Duke, 1999).
Glucose Mitochondrial pO2 (mmHg)
Pyruvic acid 10
Oxidation by Krebs cycle
36 molecules of ATP
(1270 kJ energy)
Metabolic adaption: Liver glycogen
Recruitment of redox component 4
of electron transport 1 Glucose Cori cycle
changes in phosphorylation state Pyruvic acid ATP
requiring
DYSOXIA 2 molecules of ATP + lactate
(67 kJ energy)
Membrane transport Increased intra-
Cell consumption cellular lactate
Microcirculatory blood flow
Increased blood
ATP production lactate
Unable to match demand
Sepsis Clearance by liver,
Alkalosis Kidney, GI tact,
Regional blood flow Decreased Muscle
Liver function Intracellular pH
Disruption of Transport proteins,
Cell membrane synthesis and
[image:44.595.104.502.174.673.2]Specialized cell function
C. Hepatotoksin
Hepatotoksin adalah senyawa yang dapat menyebabkan gangguan pada
jaringan hepar (Robbins and Kumar, 1995). Hepatotoksin juga merupakan zat
yang mempunyai efek toksik pada hepar dengan dosis berlebih atau dalam jangka
waktu yang lama (Watt and Zimmerman, 1978). Berdasarkan mekanisme
kerusakan hepar, hepatotoksin dibagi menjadi dua macam :
a. Hepatotoksin intrinsik
Hepatotoksin intrinsik merupakan hepatotoksin yang dapat diprediksi,
tergantung dosis dan melibatkan mayoritas individu yang menggunakan obat
dalam jumlah tertentu. Rentang waktu antara mulainya dan timbulnya kerusakan
hepar sangat bervariasi (dari beberapa jam sampai beberapa minggu). Contoh obat
dari hepatotoksin tipe ini antara lain tetrasiklin, parasetamol, karbon tetraklorida,
dan salisilat (Aslam, Tan dan Prayitno, 2003).
b. Hepatotoksin idiosinkratik
Hepatotoksin idiosinkratik merupakan hepatotoksin yang tidak dapat
diprediksi. Hepatotoksin ini terkait dengan hipersensitivitas atau kelainan
metabolisme. Respon dari hepatotoksin ini tidak dapat diprediksi dan tidak
tergantung pada dosis pemberian. Contoh obat dari hepatotoksin tipe ini antara
D. Karbon Tetraklorida
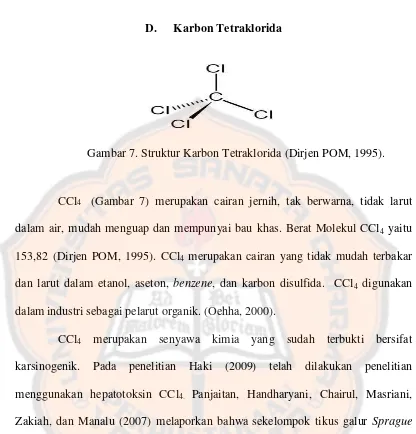
Gambar 7. Struktur Karbon Tetraklorida (Dirjen POM, 1995).
CCl4 (Gambar 7) merupakan cairan jernih, tak berwarna, tidak larut
dalam air, mudah menguap dan mempunyai bau khas. Berat Molekul CCl4 yaitu
153,82 (Dirjen POM, 1995). CCl4 merupakan cairan yang tidak mudah terbakar
dan larut dalam etanol, aseton, benzene, dan karbon disulfida. CCl4 digunakan
dalamindustri sebagai pelarut organik. (Oehha, 2000).
CCl4 merupakan senyawa kimia yang sudah terbukti bersifat
karsinogenik. Pada penelitian Haki (2009) telah dilakukan penelitian
menggunakan hepatotoksin CCl4. Panjaitan, Handharyani, Chairul, Masriani,
Zakiah, dan Manalu (2007) melaporkan bahwa sekelompok tikus galur Sprague Dawley yang diinduksi karbon tetraklorida mengalami steatosis pada sel-sel hepar tikus dan kerusakan yang diakibatkan oleh CCl4 sebanding dengan dosis yang
diinduksikan. Rosnalini (1995) melakukan penelitian mengenai hepatotoksin CCl4
dengan menggunakan senyawa hepatoprotektif kurkuminoid. CCl4 dapat melalui
membran sel dan CCl4 yangtertelan akan didistribusikan ke semua organ, tetapi
Gambar 8: Mekanisme CCl4 merusak hepar (Fausto, 2006)
Hepar menjadi target utama karena senyawa ini bergantung pada
aktivasi metabolisme sitokrom P-450 (CYP2E1). Dosis rendah karbon tetraklorida
dapat menyebabkan perlemakan hepar dan destruksi CYP2E1. Destruksi CYP2E1
terjadi terutama di sentrilobular dan daerah tengah hepar. Senyawa ini selektif
untuk isoenzim tertentu, pada tikus diketahui selektif untuk CYP2E1, sedangkan
pada isoenzim lain seperti CYP1A1 tidak mempengaruhi (Timbrell, 2008).
CCl4 merupakan xenobiotik yang lazim digunakan untuk menginduksi
peroksidasi lipid dan keracunan. Dalam endoplasmik retikulum hepar CCl4
dimetabolisme oleh sitokrom P-450 2E1 (CYP2E1) menjadi radikal bebas
triklorometil (CCl3*) (Jeon, Hwang, Park, Shin, Choi, Park, 2003). Triklorometil
dengan oksigen akan membentuk radikal triklorometilperoksi yang dapat
menyerang lipid membran endoplasmik retikulum dengan kecepatan yang
melebihi radikal bebas triklorometil. Selanjutnya triklorometilperoksi
akhirnya menyebabkan kematian sel (Shanmugasundaram and Venkataraman,
2006).
Penyusun utama membran sel adalah lipid, protein, dan karbohidrat.
Lipid yang menyusun membran adalah fosfolipid. Fosfolipid merupakan molekul
yang bersifat amfipatik, artinya memiliki daerah hidrofilik dan hidrofobik.
Keberadaan dua lapis fosfolipid mengakibatkan membran memiliki permeabilitas
selektif, tetapi protein juga ikut menentukan sebagian besar fungsi spesifik
membran. Membran plasma dan membran organel memiliki ragam protein yang
spesifik. Molekul lipid dan molekul protein pada membran tidak terikat secara
kovalen, melainkan melalui interaksi nonkovalen yang kooperatif (Delgado and
Remers, 1991).
Asam lemak penyusun membran sel khususnya asam lemak rantai
panjang tak jenuh (PUFAs) amat rentan terhadap radikal bebas. Menurut Jeon et al. (2003) jumlah PUFAs dalam fosfolipid membran endoplasmik retikulum akan berkurang sebanding dengan jumlah CCl4 yang diinduksikan. Pemberian CCl4
dalam dosis tinggi dapat merusak endoplasmik retikulum, mengakumulasi lipid,
mengurangi sintesis protein, mengacaukan proses oksidasi, menurunkan bobot
badan, menyebabkan pembengkakan hepar sehingga bobot hepar menjadi
bertambah, dan pemberian jangka panjang dapat menyebabkan nekrosis
Gambar 9: Mekanisme CCl4 terhadap akumulasi lemak di hepar (Fausto, 2006)
E. Macaranga tanarius L.
Hepatoprotektor merupakan senyawa atau zat berkhasiat yang dapat
melindungi sel-sel hepar terhadap pengaruh zat toksik yang dapat merusak sel
hepar. Mekanisme senyawa hepatoprotektif antara lain dengan cara detoksifikasi
senyawa racun baik yang masuk dari luar (eksogen) maupun yang terbentuk
dalam tubuh (endogen) pada proses metabolisme, meningkatkan regenerasi hepar
yang rusak, antiradang, dan sebagai imunostimulator (Dalimarta, 2000). Hepar
berfungsi sebagai pertahanan tubuh tentunya juga memiliki sistem antioksidan
yang cukup baik. Tetapi bila hepar telah rusak karena bahan toksik, maka perlu
diberi tambahan antioksidan dari luar. Pada penelitian ini, M. tanarius dipilih sebagai senyawa yang mempunyai fungsi hepatoprotektif terhadap kerusakan
yang diinduksi oleh CCl4.
1. Sinonim
2. Nama lain
Inggris : hairy mahang
Filipina : binunga, himindan, kuyonon
Indonesia : hanuwa, mapu, mara, tutup ancur
Malaysia : ka-lo, kundoh, mahang puteh, tampu
Thailand : hu chang lek, ka-lo, lo khao, mek, paang
Vietnam : hach dâu-nam
(World Agroforestry Centre, 2002)
3. Taksonomi
Kerajaan : Plantae
Subkerajaan : Tracheobionta
Divisi : Spermatophyta
Subdivisi : Magnoliophyta
Kelas : Magnoliopsida
Subkelas : Rosidae
Ordo : Euphorbiales
Famili : Euphorbiaceae
Genus : Macaranga
Spesies : Macaranga tanarius L. (Mus, 2008).
4. Morfologi
Tinggi pohon tanaman M. tanarius mencapai 20 meter. Daun berwarna hijau, berbentuk jantung dan pangkalnya berbentuk bulat dengan ukuran daun
tebal dan berwarna hijau keabu-abuan. Buah tanaman berbentuk kapsul biccocus
dengan panjang 1 cm, berwarna kekuningan. Biji tanaman berbentuk bulat dengan
ukuran 5 mm (World Agroforestry Centre, 2002).
5. Kandungan
M. tanarius memiliki berbagai macam kandungan kimia. Daun M. tanarius mempunyai kandungan senyawa lauroside E, metil brevifolin karboksilat, isoquercitrin, hiperin, mallophenol B, macarangioside A,
macarangioside B, macarangioside C, macarangioside D yang diisolasi dari ekstrak metanol (Gambar 10) (Matsunami, Ichiko, Takakazu, Mitsunori,
[image:51.595.99.515.238.654.2]Kazunari, Hideaki, et al., 2006).
Gambar 10 : Kandungan senyawa ekstrak metanol M. tanarius(Matsunami et al., 2006)
Kumazawa et al. (2013) menganalisis mengenai kandungan senyawa antioksidan dari ekstrak etanol M. tanarius yaitu nymphaeol A, nymphaeol B,
Gambar 11 : Kandungan senyawa ekstrak etanol M. tanarius (Kumazawa et al., 2013)
Berdasarkan penelitian Phommart et al. (2005) terdapat tiga kandungan senyawa baru ekstrak n-heksan dan kloroform daun M. tanarius yaitu tanarifuranonol, tanariflavanone C, dan tanariflavanone D (Gambar 12) beserta tujuh kandungan yang telah diketahui yaitu nymphaeol A, nymphaeol B,
nymphaeol C, tanariflavanone B, blumenol A (vomifoliol), blumenol B (7,8
dihydrovomifoliol dan annuionone)
Gambar 12 : Tiga senyawa baru dari M. tanarius: tanarifuranonol (1)
tanariflavanone C (2) tanariflavanone D (3) (Phommart et al., 2005)
Puteri dan Kawabata (2010) menganalisis kandungan senyawa
antioksidan dari ekstrak etil asetat daun M. tanarius yaitu mallotinic acid,
Gambar 13: Kandungan senyawa ekstrak etil asetat M. tanarius: mallotinic acid
(1), corilagin (2), macatannin A (3), chebulagic acid (4) dan macatannin B (5) (Puteri dan Kawabata, 2010)
6. Khasiat dan Kegunaan
Daun M. tanarius dapat digunakan sebagai obat diare dan sebagai antiseptik (Lin, Nonaka, and Nishioka, 1990). Akar M. tanarius dapat digunakan sebagai agen emetik dan ekstrak metanol daun M. tanarius mempunyai aktivitas antibakteri (Lim, Lim, and Yule, 2009). Kumazawa et al. (2013) melaporkan bahwa ekstrak etanol M. tanarius mempunyai aktivitas antioksidan dan antimikroba. Ekstrak metanol-air daun M. tanarius memiliki khasiat sebagai hepatoprotektor jangka panjang (Ardianto, 2010). Nugraha (2010) melaporkan
bahwa infusa daun M. tanarius juga memiliki khasiat sebagai efek hepatoprotektif. Ekstrak metanol-air daun M. tanarius memiliki khasiat sebagai antiinflamasi (Kurniawaty, 2007). Menurut penelitian Puteri dan Kawabata
(2010), pada ekstrak etil asetat daun M. tanarius mempunyai aktivitas menghambat α-glukosidase yang berpotensi sebagai antidiabetik. Khasiat lain
dapat digunakan sebagai antidiabetes (Oktavia, 2012). Di Cina, tanaman ini
dijadikan sebagai produk minuman kesehatan (Lim, et al., 2009).
F. Ekstraksi
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat
aktif dari simplisia nabati atau hewan menggunakan pelarut yang sesuai,
kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang
tersisa diperlakukan sedemikian rupa hingga memenuhi baku yang telah
ditetapkan (Dirjen POM, 1995).
Ekstrak dikelompokan atas dasar sifatnya, yaitu :
a. Ekstrak encer adalah sediaan yang memiliki konsistensi semacam madu dan
dapat dituang.
b. Ekstrak kental adalah sediaan yang dilihat dalam keadaan dingin dan tidak
dapat dituang. Kandungan airnya berjumlah sampai 30%. Tingginya
kandungan air menyebabkan ketidakstabilan sediaan obat karena cemaran
bakteri.
c. Ekstrak kering adalah sediaan yang memiliki konsistensi kering dan mudah
dituang, sebaiknya memiliki kandungan lembab tidak lebih dari 5%.
d. Ekstrak cair adalah ekstrak yang dibuat sedemikian sehingga satu bagian
simplisia sesuai dengan dua bagian ekstrak cair (Voight, 1994).
Ekstrak diperoleh dengan cara ekstraksi. Ekstraksi adalah penarikan
konstituen yang diinginkan dari simplisia dengan pelarut tertentu, yang dapat
dibedakan menjadi infudasi, maserasi, perkolasi, dan penyarian
berkesinambungan (Dirjen POM, 1979).
Proses ekstraksi dapat melalui tahap pembuatan serbuk, pembasahan,
penyarian, dan pemekatan. Sistem pelarut yang digunakan dalam ekstraksi harus
dipilih berdasarkan kemampuannya dalam melarutkan jumlah yang maksimum
dari zat aktif dan yang seminimum mungkin bagi unsur yang tidak diinginkan
(Depkes RI, 2000).
Ekstraksi dengan metode maserasi merupakan cara penyarian sederhana
yang dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari
selama beberapa hari pada temperatur kamar dan terlindung dari cahaya sambal
diaduk (Badan Pengawasan Obat dan Makanan Republik Indonesia, 2010) .
Proses maserasi berakhir artinya bahwa keseimbangan antara bahan yang
diekstraksi pada bagian dalam sel dan luar sel telah tercapai maka proses difusi
segera berakhir. Selama maserasi atau proses perendaman dilakukan pengocokan
berulang-ulang. Upaya ini menjamin keseimbangan konsentrasi bahan ekstraksi
yang lebih cepat di dalam cairan. Sedangkan keadaan diam selama maserasi
menyebabkan turunnya perpindahan bahan aktif. Secara teoritis pada suatu
maserasi tidak memungkinkan terjadinya ekstraksi absolut. Semakin besar
perbandingan simplisia terhadap cairan pengekstraksi, akan semakin banyak hasil
yang diperoleh (Voight, 1994).
Kerugian dari ekstraksi dengan metode maserasi yaitu pengerjaannya
lama dan penyarian kurang sempurna. Maserasi kinetik berarti dilakukan
pertama, dan seterusnya. Penyarian diakhiri setelah pelarut tidak berwarna lagi
(Depkes RI, 2000).
G. Fraksinasi
Fraksinasi merupakan proses pemisahan antara zat cair dengan zat cair.
Fraksinasi dilakukan secara bertingkat berdasarkan tingkat kepolarannya yaitu
dari non polar, semi polar, dan polar. Senyawa yang memiliki sifat non polar akan
larut dalam pelarut non polar, yang semi polar akan larut dalam pelarut semi
polar, dan yang bersifat polar akan larut dalam pelarut polar (Harborne, 1987).
Fraksinasi umumnya dilakukan dengan menggunakan metode corong
pisah atau kromatografi kolom. Kromatografi kolom merupakan salah satu
metode pemurnian senyawa dengan menggunakan kolom (Sastrohamidjojo,
1985). Corong pisah merupakan peralatan laboratorium yang digunakan untuk
memisahkan komponen-komponen dalam campuran antara dua fase pelarut yang
memiliki massa jenis berbeda yang tidak tercampur.
Macam-macam proses fraksinasi :
a. Proses fraksinasi kering (Winterization)
Fraksinasi kering adalah suatu proses fraksinasi yang didasarkan pada berat
molekul dan komposisi dari suatu material. Proses ini lebih murah
dibandingkan dengan proses yang lain, namun hasil kemurnian
fraksinasinya rendah.
b. Proses fraksinasi basah (Wet fractionation)
Fraksinasi basah adalah suatu proses fraksinasi dengan menggunakan zat
proses detergen. Hasil fraksi dari proses ini sama dengan proses fraksinasi
kering.
c. Proses fraksinasi dengan menggunakan solvent/pelarut (Solvent fractionation)
Proses fraksinasi ini menggunakan pelarut. Proses fraksinasi ini lebih mahal
dibandingkan dengan proses fraksinasi lainnya karena menggunakan bahan
pelarut.
d. Proses fraksinasi dengan pengembunan (Fractional condentation)
Proses fraksinasi ini didasarkan pada titik didih dari suatu zat/bahan
sehingga dihasilkan suatu produk dengan kemurnian yang tinggi. Fraksinasi
pengembunan ini membutuhkan biaya yang cukup tinggi (Stahl, 1985).
H. Landasan Teori
Hepar adalah organ metabolik terbesar dan terpenting di tubuh. Organ ini
penting untuk sekresi empedu, metabolisme karbohidrat, lemak, dan protein, serta
detoksifikasi atau degradasi zat-zat sisa, hormon, obat dan juga senyawa asing
lainnya (Sherwood, 2001).
Senyawa yang bersifat hepatotoksin dapat menyebabkan kerusakan
hepar. Salah satu model senyawa hepatotoksin yaitu CCl4. CCl4 merupakan
molekul sederhana, yang dapat menyebabkan nekrosis sentrilobular hepatik dan
perlemakan di hepar. Target utama dari ketoksikan CCl4 adalah hepar. Toksisitas
CCl4 bergantung pada metabolisme aktivasi oleh sitokrom P-450 (CYP2E1)
CYP3A untuk membentuk radikal triklorometil (Naik and Panda, 2007). CCl4
akan bereasi dengan oksigen membentuk radikal triklorometil peroksi (Gregus
dan Klaaseen, 2001). Radikal bebas triklorometil dengan katalis enzim sitokrom
P-450 dapat menimbulkan peroksidasi lipid serta dapat berikatan secara kovalen
dengan protein dan lipid sehingga mengakibatkan steatosis dan penimbunan lipid
yang dapat mengganggu integritas membran sel hepar (Timbrell, 2008).
Kadar LDH menjadi tinggi secara abnormal saat serangan jantung dan
penyakit hepar, juga beberapa jenis penyakit lain. LDH memegang peranan
penting dalam produksi energi dalam sel-sel tubuh (Michael and Roizen, 2007).
Daun M. tanarius memiliki aktivitas antioksidan dengan kandungan senyawa laurosida E, metil brevifolin karboksilat, isokuercitin, hiperin,
mallophenol B, macarangioside A, macarangioside B, dan macarangioside C,
macarangioside D yang diisolasi dari ekstrak metanol yang dapat menangkap radikal bebas terhadap DPPH (Matsunami et al., 2009). Kumazawa et al. (2013) menganalisis mengenai kandungan senyawa antioksidan dari M. tanarius yaitu
nymphaeol A, nymphaeol B, nymphaeol C, isonymphaeol B, dan 3’ -geranyl-naringenin. Berdasarkan penelitian Phommart et al. (2005) terdapat tiga kandungan senyawa baru yaitu tanarifuranonol, tanariflavanon C, dan
denticulate dan Macaranga pruinosa memiliki kandungan aktivitas antioksidan tertinggi (Mazlan dkk., 2013).
Kandungan senyawa-senyawa ellagitannin M. tanarius yang terlarut dalam pelarut heksan-etanol diharapkan dapat menghambat perlemakan hepar
sehingga dapat mengurangi ketoksikan yang disebabkan oleh CCl4.
I. Hipotesis
Pemberian jangka panjang FHEMM dapat menurunkan kadar serum
38
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian eksperimental murni untuk
mengetahui hubungan ada tidaknya akibat setelah perlakuan yaitu penurunan
aktivitas serum LDH setelah diberi FHEMM, kemudian terdapat kelompok
kontrol sebagai pembanding dan kelompok perlakuan yang diberi perlakuan yang
sama. Setiap kelompok diambil darahnya sebelum dan sesudah perlakuan untuk
perbandingan. Penelitian ini menggunakan rancangan penelitian acak lengkap
pola searah dimana hewan uji diambil secara ra