*) Peneliti pada Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan, Balitbang KP, KKP; Jl. KS. Tubun Petamburan VI, Slipi, Jakarta Pusat; E-mail: muhammadnursid@gmail.com
**) Jurusan Perikanan Fakultas Pertanian Universitas Gadjah Mada; Jl. Flora Bulaksumur Gedung A-4, Jogyakarta ***) Fakultas Farmasi Universitas Gadjah Mada; Sekip Utara, Jogyakarta
PENAPISAN KAPANG LAUT PENGHASIL SENYAWA SITOTOKSIK
DARI BEBERAPA PERAIRAN DI INDONESIA
Muhammad Nursid*), Ekowati Chasanah*), Murwantoko**), dan Subagus Wahyuono***)
ABSTRAK
Kapang yang berasal dari laut merupak an sumber senyawa sitotok sik yang dapat dikembangkan sebagai bahan obat antikanker. Penelitian ini bertujuan untuk : 1) menapis kapang laut penghasil senyawa sitotoksik dari beberapa wilayah perairan di Indonesia, 2) mengidentifikasi kapang penghasil senyawa sitotoksik paling kuat dan 3) mengetahui nilai inhibition concentration
50 (IC50) dari senyawa sitotoksik yang dihasilkan. Kapang diisolasi dari organisme laut yang
diambil dari Taman Nasional Laut Wakatobi-Sulawesi Tenggara, Pantai Binuangeun-Banten, dan perairan sekitar kota Manado-Sulawesi Utara, dan Taman Nasional Laut Kepulauan Seribu. Kultivasi cair dilakukan pada media Malt Extract Broth (MEB) dan Soluble Starch-Soytone (SW S)
selama 4 minggu pada suhu 27–28oC dalam kondisi statis. Identifikasi kapang secara molekular
dilakukan secara PCR dengan menggunakan primer ITS1 dan ITS4. Aktivitas sitotoksik dari ekstrak yang dihasilkan diuji dengan metode MTT
(3-(4,4-dimethylthiazol-2-yl)-2,5-diphenyl-tetrazolium bromide). Hasil uji MTT terhadap 46 strain kapang menunjukkan bahwa kapang
MFW39 memiliki aktivitas sitotoksik yang paling kuat (35,4%) terhadap sel T47D. Hasil identifikasi secara molekular menunjukkan bahwa kapang tersebut memiliki similaritas sebesar 99% dengan kapang Emericella nidulans. Ekstrak miselium dan broth kapang MFW 39 dapat menghambat
pertumbuhan sel T47D dengan nilai IC50 berturut-turut sebesar 21,9 dan 169,3 µg/mL. Riset
selanjutnya akan difokuskan untuk meneliti kapang laut strain MFW39.
ABSTRACT: Screening of marine fungi producing cytotoxic compound from Indonesian waters. By: Muhammad Nursid, Ekowati Chasanah, Murwantoko and Subagus Wahyuono
Marine-derived fungi have proven to be a rich source of cytotoxic compounds for the development of new anti cancer drugs. The aims of this research were to: 1) screen cytotoxic activity of marine fungi from Indonesian waters, 2) indentify marine fungus that produced that produced the most active cytotoxic compound and 3) investigate inhibition concentration 50 (IC50) value of cytotoxic compound. The fungi were isolated from marine organism collected from Wakatobi Marine National Park-South East Sulawesi, Binuangeun Beach-Banten, Manado waters-North Sulawesi and Kepulauan Seribu Marine National Park-Jakarta. Liquid cultures of the fungi were carried out in Malt Extract Broth and Soluble Starch Soytone medium for 4 weeks at 27–28oC
without shaking. Molecular identification of fungus was conducted through PCR amplificatin using primers of ITS1 and ITS4 primer. Cytotoxic activity of the extract was tested by using MTT (3-(4.4-dimethylthiazol-2-yl)-2.5-diphenyl-tetrazolium bromide) method. The MTT test showed that MFW39 strain exhibited the strongest cytotoxic activity. Molecular identification revealed that MFW39 marine fungus was similar to Emericella nidulans with precent identity of 99%. Mycelium and broth extract of MFW39 fungus inhibited the growth of T47D cell with IC50 values of 21.9 and 169.3 µg/mL, respectively. Further research will be focus on to the strain of MFW39 marine fungi.
KEYWORDS: screening, cytotoxic activity, marine fungi, Emericella nidulans
PENDAHULUAN
Spesies kapang di dunia ini diperkirakan berjumlah sek itar 1,5 juta spesies t etapi yang sudah dideskripsikan baru sekitar 5–10%. Keanekaragaman kapang di daerah tropik diperkirakan lebih tinggi dibandingkan di daerah sub-tropik (Hawksworth, 2001; Hyde, 1998). Indonesia memiliki perairan laut yang sangat luas yaitu sekitar 2/3 dari luas wilayahnya.
Keanekaragaman hayati yang terkandung di dalamnya merupakan salah satu yang tertinggi di dunia termasuk keanekaragaman mikroba khususnya kapang. Menurut G andjar et al. ( 2006), ti nggi nya keanekaragaman kapang di Indonesia karena lingkungannya yang lembab dan suhu di daerah tropis yang mendukung pertumbuhan kapang. Menurut Rifai (1995), sekitar 200.000 spesies kapang diperkirakan terdapat di Indonesia.
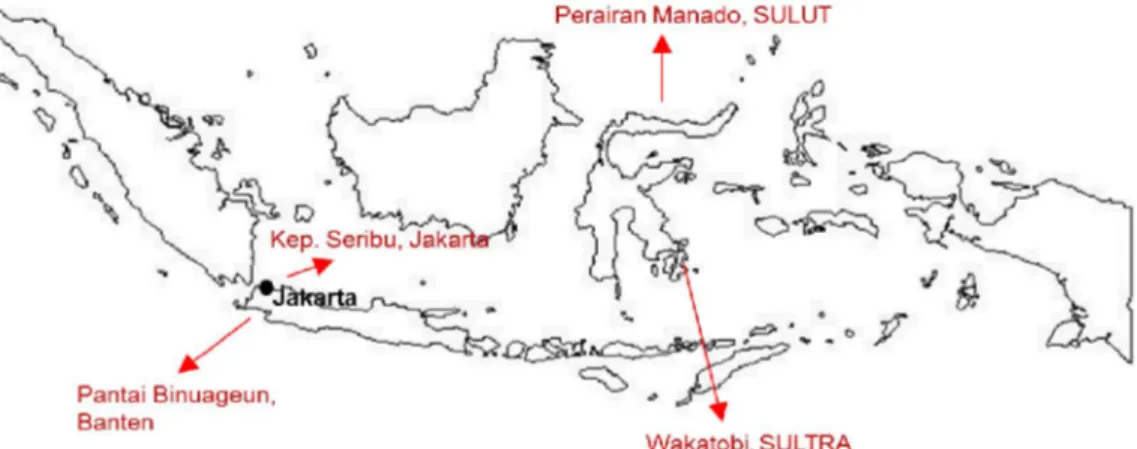
Gambar 1. Lokasi pengambilan sampel.
Figure 1. Sampling location.
Penelitian mengenai bioprospeksi kapang yang diisolasi dari lingkungan laut di Indonesia bisa dikatakan masih terbatas baik biodiversitas maupun kemodiversitasnya. Beberapa penelitian dalam bidang ini misalnya dilakukan oleh Namikoshi et al. (2001); Proksch et al. (2003); Chasanah et al. (2009); dan Pratitis et al. (2009). Dengan mempertimbangkan tingginya biodiversitas kapang yang ada di Indonesia serta potensinya sebagai penghasil senyawa aktif maka penelitian tentang senyawa metabolit sekunder dari kapang yang berasal dari perairan Indonesia penting untuk dilakukan.
Di negara maju yang telah berhasil mengatasi penyakit infeksi, kanker menjadi penyebab kematian kedua setelah penyakit kardiovaskular. Kanker ialah suatu penyakit sel dengan ciri gangguan atau kegagalan mekanisme pengatur multiplikasi dan fungsi homeostasis lainnya pada organisme multiselular (Nafrialdi & Gan, 2007). Salah satu kanker yang banyak menyerang kaum wanita adalah kanker payudara. Kanker payudara merupakan jenis kanker yang memiliki keganasan tertinggi setelah kanker leher rahim. Jenis kanker ini di Indonesia cenderung terus meningkat dari tahun ke tahun (Tjindarbumi & Mangunkusumo, 2002).
Berbagai upaya dilakukan untuk mencari bahan obat antikanker, salah satunya dengan memanfaatkan senyawa bahan alam. Senyawa bahan alam untuk obat anti kanker secara umum ditapis berdasarkan aktivitas sitotoksik atau anti proliperatif yang dimiliki dengan menggunakan sel lestari kanker (cancer cell
lines). Penggunaan sel lestari kanker dalam biodiscovery obat antikanker memiliki beberapa
keuntungan diantaranya mudah cara penanganannya, memiliki kemampuan replikasi yang tidak terbatas, homogen, bersifat repeatable (dapat diulang), serta secara in vitro dapat diketahui mekanisme molekular suatu senyawa antikanker yang sedang dipelajari (Burdal et al., 2003; Felth, 2011). Salah satu sel yang
banyak digunakan dalam penapisan senyawa yang memiliki aktivitas antikanker adalah sel T47D (human
ductal breast epithelial tumor cell line). Sel T47D
pertama kali diisolasi dari jaringan tumor duktal payudara seorang wanita berusia 54 tahun (Abcam, 2007). Berdasarkan uraian di atas, maka penelitian ini bertujuan untuk :
1. Menapis kapang laut penghasil senyawa sitotoksik terhadap sel T47D dari beberapa wilayah perairan di Indonesia.
2. Mengidentifikasi jenis kapang yang memiliki aktivitas sitotoksik paling kuat.
3. Mengetahui nilai inhibition concentration 50 (IC 50) dari senyawa aktif yang dihasilkan.
BAHAN DAN METODE Sampling Hospes
Sampel hospes (host) diambil dari Taman Nasional Laut Wakatobi-Sulawesi Tenggara, perairan Taman Nasional Laut Kepulauan Seribu-Jakarta, perairan sekitar kota Manado-Sulawesi Utara dan pantai Binuangeun-Banten (Gambar 1). Sampel hospes yang diambil berasal dari golongan spons, ascidian, karang lunak, dan rumput laut. Sampel hospes yang diperoleh dibersihkan dengan air laut steril kemudian dimasukkan ke dalam kantong plastik steril, diberi label dan segera dipreservasi pada suhu dingin dengan menggunakan es batu. Setiap spesimen sampel yang diperoleh difoto baik ketika masih berada di dalam air m aupun ketika sudah berada di perm ukaan. Identifikasi dan perkiraan taksonomik setiap hospes dilakukan berdasarkan Colin & Arneson (1995).
Isolasi Kapang
Isolasi kapang dari hospes dilakukan dengan menggunakan Minimum Fungi Medium (terdiri dari
0,02% ekstrak khamir, 0,1% soluble starch, 2% agar),
Malt Extract Agar medium (terdiri dari 0,3% ekstrak
malt, 0,3% ekstrak khamir, 0,5% pepton, 1,5% agar), dan Glucose Peptone Yeast medium (0,1% glukosa, 0,05% pepton soya, 0,01% ekstrak khamir, 1,5% agar). Penggunaan ketiga jenis media tersebut dim aksudkan untuk m em perbesar peluang memperoleh isolat kapang yang berbeda. Ketiga jenis media tersebut dilarutkan dalam ASW (artificial
seawater, NaCl 70 g; KCl 3,0 g; Na2SO4 1,1 g; MgCl2 20,4 g; dan CaCl2 0,6 g, dilarutkan dalam akuades 4 L). Metode isolasi kapang dilakukan menurut Zhang
et al. (2009) dan Kjer et al. (2010) dengan beberapa
modifikasi. Sebelum dipotong, hospes disemprot dengan alkohol 70%, kemudian secara aseptis, sampel hospes dipotong dengan ukuran sekitar 2–4 mm3 dan potongan ditempatkan ke dalam petri yang berisi media. Petri diinkubasi pada suhu ruang (27– 29°C) selama 3–7 hari. Setiap kapang yang tumbuh pada cawan petri kemudian dipindah ke petri yang baru berdasarkan bentuk dan warna hifa. Proses isolasi dilakukan secara berulang hingga diperoleh 1 jenis kapang tunggal (strain murni).
Kultivasi dan Penapisan Kapang
Strain murni hasil isolasi dikultivasi dalam media Malt Extract Broth/MEB (komposisi media MEB sama
dengan MEA namun tanpa menggunakan agar) selama 3 minggu pada suhu 27–29°C dalam kondisi statis. Ekstraksi metabolit yang terdapat dalam kultur dilakukan dengan menggunakan etil asetat. Setiap ekstrak kasar yang diperoleh ditimbang beratnya lalu diuji aktivitas sitotoksiknya terhadap sel T47D pada dosis 30 µg/mL. Strain murni yang memiliki aktivitas sitotoksik paling kuat selanjutnya diidentifikasi nama jenisnya, dikultivasi dalam media cair 1 L, diekstraksi dan diamati profil metabolitnya serta ditentukan nilai IC50-nya terhadap sel T47D.
Kultivasi Strain Aktif
Strain aktif adalah kapang yang memiliki aktivitas
sitotoksik paling baik hasil dari proses penapisan. Kultivasi strain aktif dilakukan di dalam media SWS yang mengandung 1% soluble starch; 0,1% soya pepton dan 1 L ASW. Kultivasi dilakukan selama 5 minggu pada suhu 27–28oC dalam kondisi statis. Ekstrak yang dihasilkan dari kultivasi 1 L tersebut kemudian diuji aktivitas sitotoksiknya terhadap sel T47D dalam berbagai variasi dosis.
Ekstraksi dan Profil Metabolit
Ekstraksi metabolit dari kapang yang terdapat dalam miselium dan broth dilakukan secara terpisah.
Broth adalah bagian cairan yang terdapat dalam
culture cair, berisi campuran media dan hasil metabolit
yang disekresi oleh kapang, sedangkan miselium adalah bagian dari tubuh kapang yang terbentuk dari kumpulan hifa yang bercabang. Metabolit dalam broth diekstraksi dengan etil asetat sedangkan metabolit yang terdapat dalam miselium diekstraksi dengan campuran diklorometan (DCM) : metanol (MeOH) = 1 : 1.
Profil metabolit yang terdapat pada ekstrak miselium dan broth dilihat dengan kromatografi lapis tipis (KLT) dan kromatografi cair kinerja tinggi (KCKT). Analisis KLT dilakukan dengan plat alumunium yang mengandung matriks SiO2. Sistem pengembang yang digunakan adalah campuran DCM : MeOH = 10 : 1. Deteksi dilakukan di bawah UV 254 nm dan disemprot dengan phospomolybdic acid (PMA) kemudian dipanaskan pada suhu 100°C hingga bercak-bercak muncul dengan jelas. Analisis KCKT dilakukan dengan instrumen LCMS (Shimadzu), kolom ODS 2,0 x 150 mm, detektor photo diode array (PDA), sistem elusi H2O 20%–asetonitril 100% (gradien).
Uji Sitotoksik
Uji sitotoksik dilakukan dengan metode MTT
(3-(4,4-dimethylthiazol-2-yl)-2,5-diphenyl-tetrazolium bromide) menggunakan sel lestari T47D. Sel tersebut
dikultur dalam medium Roswell Park Memorial Institut 1640 (RPMI) (Sigma), Fetal Bovine Serum (FBS) 10% (Gibco), fungizone 0,5% (Gibco) dan penisilin-streptomisin 2% (Gibco). Sel dipelihara dalam inkubator dengan aliran CO2 sebesar 5 mL/menit pada suhu 37°C. Jumlah sel yang digunakan dalam uji sebesar 20.000 sel/sumuran. Secara umum uji sitotoksik dilakukan menurut Freshney (2005). Dosis ekstrak yang digunakan untuk penapisan adalah sebesar 30 µg/ml sedangkan dosis untuk mengetahui nilai IC50 ekstrak yang paling aktif adalah 1, 5, 25, 125, dan 625 µg/mL. Dalam uji ini digunakan doxorubicin sebagai kontrol positif. Doxorubicin merupakan salah satu obat kemoterapi yang tersedia secara komersial di pasaran. Persentase kematian sel tumor dihitung berdasarkan rumus [{(A-D) – (B-C)}/(A-D)] x 100% dimana A = absorbansi kontrol sel, B = absorbansi sampel, C = absorbansi kontrol sampel dan D = absorbansi kontrol media. Nilai IC50 ditentukan dengan menggunakan analisis probit dengan bantuan program statistik MINITAB 14.0.
Identifikasi Kapang
Kapang diidentif i kasi secar a m olekuler berdasarkan sekuens gen ITS1-5.8S-ITS2 rDNA. Amplifikasi sekuens gen tersebut dilakukan dengan
polymerase chain r eaction (P CR) dengan
menggunakan primer Internal Transcribed Spacer 1 (ITS1) dan Internal Transcribed Spacer 4 (ITS4)
masing-masing dengan urutan basa 5’- CTT GGT CAT TTA GAG GAA GTAA-3’ dan 5’- TCC TCC GCT TAT TGA TAT GC-3’. Isolasi DNA kapang dilakukan sesuai dengan petunjuk yang ada pada protokol Fermentasi
DNA Extraction Kit. PCR dilakukan dengan volume
akhir sebanyak 25 µL yang terdiri dari campuran 5– 25 ng DNA, 0,4 mM primer, 0,2 mM dNTPs, 1,5 mM MgCl2, 2,0 U Taq polymerase, dan 1,0x buffer. Produk PCR kemudian dianalisis dengan elektroforesis, dipurifikasi dengan menggunakan Fermentas Agarose
Gel DNA Purification Kit kemudian disekuens dengan
ABI PRISMTM 3730XL sequencer. Sekuens gen ITS1 dan ITS 2 yang diperoleh lalu dibandingkan dengan sekuens gen ITS1-5.8S-ITS2 rDNA dari spesies kapang yang sudah diketahui di NCBI GenBank. Pensejajaran sekuens gen dan konstruksi pohon filogenetik dilakukan dengan bantuan perangkat lunak
Molecular Evolutionary Genetics Analysis (MEGA)
versi 5.0. Hasil identifikasi kapang secara molekular selanjutnya diperkuat dengan identifikasi secara morfologi menurut buku Gandjar (1989) dan Pitt & Hocking (2009).
HASIL DAN BAHASAN
Skrining Kapang Penghasil Senyawa Sitotoksik
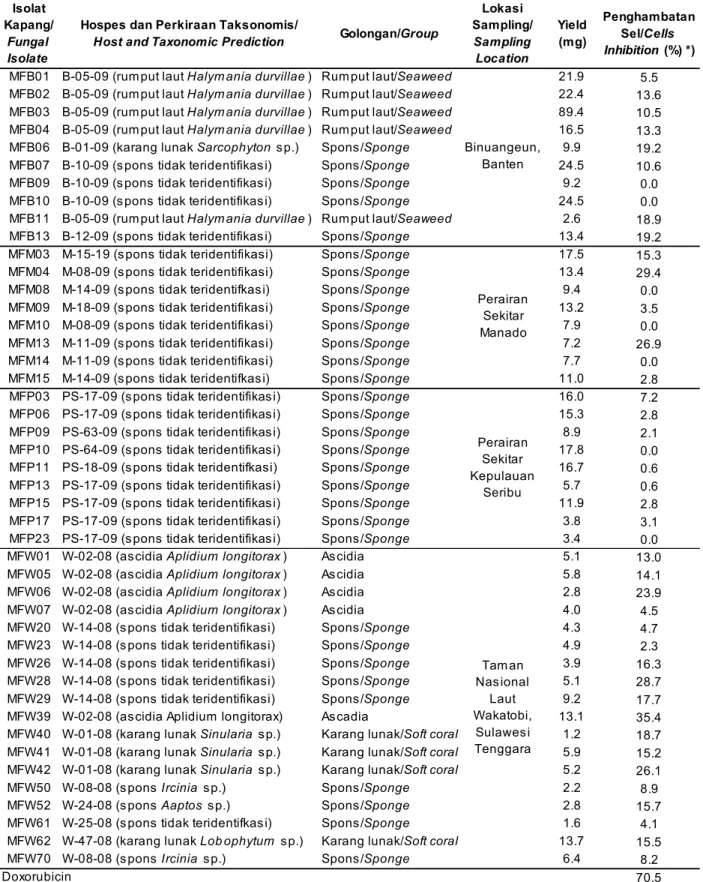
Keseluruhan isolat kapang yang diskrining aktivitas sitotoksiknya berjumlah 46 isolat, dengan rincian 10 isolat berasal dari pantai Binuangeun, Kabupaten Lebak, Banten, 8 isolat berasal dari perairan sekitar Kota Manado, Sulawesi Utara, 9 isolat berasal dari perairan sekitar pulau Pramuka kawasan Taman Nasional Laut Kepulauan Seribu, DKI Jakarta dan 18 isolat berasal dari taman Nasional Laut Wakatobi, Sulawesi Tenggara (Tabel 1). Hospes kapang sebagian besar berasal dari spons (porifera) lalu diikuti karang lunak (coelenterata), ascidia, dan rumput laut merah. Menurut Bugni & Ireland (2004), spons merupakan sumber host atau substrat yang paling banyak dieksplorasi dalam penelitian senyawa bahan alam dari kapang laut. Jumlah senyawa baru dari kapang laut yang berasosiasi dengan spons merupakan yang tertinggi dibandingkan dengan kapang yang berasosiasi dengan host lain misalnya rumput laut, moluska, ekinodermata, dan lain-lain.
Rendemen (yield) ekstrak yang dihasilkan dari strain kapang tersebut berkisar antara 1,2–89,4 mg dengan rata-rata sebesar 11,3 mg per 100 mL volume kultur. Rendemen yang dihasilkan tergantung dari jenis strain kapang yang dikultivasi. Beberapa kapang memiliki biomassa yang tinggi sedangkan yang lainnya rendah. Ekstrak yang dihasilkan masih berupa ekstrak kasar (crude extract) yang terdiri dari banyak
campuran senyawa ditambah dengan pengotor seperti garam-garam dan protein dari media.
Hasil uji sitotoksik memperlihatkan bahwa nilai inhibisi ekstrak terhadap proliferasi sel T47D dengan dosis 30 µg/mL berkisar antara 0–35,5% (rata-rata penghambatan sebesar 10,7%). Ekstrak yang memiliki aktivitas sitotoksik paling kuat terhadap sel T47D adalah ekstrak yang diperoleh dari kapang dengan kode isolat MFW39 (Tabel 1) dengan jumlah ekstrak yang dihasilkan sebesar 13,1 mg.
Kapang MFW39 disolasi dari permukaan ascidia W-02-08 dengan menggunakan media MEA. Ascidia W-02-08 diambil dari perairan sekitar pulau Wangi-Wangi yang termasuk dalam kawasan Taman Nasional Laut Wakatobi, Sulawesi Tenggara. Berdasarkan kenampakan morfologi, ascidia ini diperkirakan termasuk dalam genus Aplidium. Perkiraan ini diperkuat oleh hasil identifikasi yang dilakukan oleh Pusat Penelitian Oseanologi LIPI yang menyatakan bahwa ascidia ini termasuk dalam jenis Aplidium
longithorax. Hasil uji sitotoksik terhadap 46 ekstrak
kapang disajikan dalam Tabel 1, doxorubicin dengan dosis 5 µg/mL digunakan sebagai kontrol positif.
Inhibisi ekstrak MFW39 terhadap peroliferasi sel T47D adalah sebesar 35,4 % sedangkan doxorubicin (sebagai kontrol positif) memiliki nilai inhibisi sebesar 70,5% pada dosis 5 µg/mL (Gambar 2). Nilai hambatan ekstrak MFW39 masih jauh lebih kecil dari doxorubicin kemungkinan besar karena ekstrak yang diujikan masih sangat kasar. Pada saat panen (harvest), metabolit dari miselium dan broth masih bercampur sehingga kemungkinan besar kadar senyawa sitotoksik yang terdapat di dalamnya masih sangat kecil. Pada tahap ini juga belum diketahui pada bagian mana senyawa sitotoksik terdapat pada kapang MFW39, apakah pada ekstrak miselium atau ekstrak broth. Meskipun nilai inhibisi ekstrak MFW39 tidak sebesar nilai inhibisi doxorubicin, tetapi hasil penelitian ini memberi petunjuk bahwa isolat kapang MFW39 mampu menghasilkan senyawa aktif yang mampu menghambat proliferasi sel T47D.
Morfologi sel T47D setelah diberi perlakuan ekstrak MFW39, doxorubicin dan tanpa perlakuan disajikan pada Gambar 2. Hasil pengamatan morfologi memperlihatkan bahwa pemberian ekstrak MFW39 dapat menyebabkan perubahan morfologi pada sel T47D dibandingkan dengan ekstrak yang lain. Berdasarkan pengamatan secara visual terhadap foto sel setelah diberi perlakuan ekstrak MFW39, morfologi sel T47D tampak berubah menjadi bulat sedangkan sel yang tidak diberi perlakuan (kontrol sel), bentuknya tetap pipih-lonjong (seperti bentuk daun) dan melekat kuat di dasar flask kultur. Ekstrak yang tidak aktif (tidak mengandung senyawa sitotoksik) tidak dapat menyebabkan perubahan pada morfologi sel.
Tabel 1. Isolat kapang dan bobot ekstrak kasar yang diperoleh dari 100 mL kultur cair
Table 1. Fungal isolate and weight of crude extract obtained from 100 mL liquid culture
Keterangan/Note :
*) Penghambatan pertumbuhan sel T47D (%) setelah diberi perlakuan ekstrak kapang selama 24 jam (dosis
ekstrak kapang = 30 µg/mL, doxorubicin = 5 µg/mL)/Growth inhibition of T47D cells (%) after being treated with
fungi extract for 24 hours (dose of fungal extract = 30 µg/mL, doxorubicin = 5 µg/mL).
Isolat Kapang/
Fungal Isolate
Hospes dan Perkiraan Taksonomis/
Host and Taxonomic Prediction Golongan/Group
Lokasi Sampling/ Sampling Location Yield (mg) Penghambatan Sel/Cells Inhibition (%) *)
MFB01 B-05-09 (rum put laut Halym ania durvillae ) Rum put laut/Seaweed 21.9 5.5
MFB02 B-05-09 (rum put laut Halym ania durvillae ) Rum put laut/Seaweed 22.4 13.6
MFB03 B-05-09 (rum put laut Halym ania durvillae ) Rum put laut/Seaweed 89.4 10.5
MFB04 B-05-09 (rum put laut Halym ania durvillae ) Rum put laut/Seaweed 16.5 13.3
MFB06 B-01-09 (karang lunak Sarcophyton s p.) Spons /Sponge 9.9 19.2
MFB07 B-10-09 (s pons tidak teridentifikas i) Spons /Sponge 24.5 10.6
MFB09 B-10-09 (s pons tidak teridentifikas i) Spons /Sponge 9.2 0.0
MFB10 B-10-09 (s pons tidak teridentifikas i) Spons /Sponge 24.5 0.0
MFB11 B-05-09 (rum put laut Halym ania durvillae ) Rum put laut/Seaweed 2.6 18.9
MFB13 B-12-09 (s pons tidak teridentifikas i) Spons /Sponge 13.4 19.2
MFM03 M-15-19 (s pons tidak teridentifikasi) Spons /Sponge 17.5 15.3
MFM04 M-08-09 (s pons tidak teridentifikasi) Spons /Sponge 13.4 29.4
MFM08 M-14-09 (s pons tidak teridentifkas i) Spons /Sponge 9.4 0.0
MFM09 M-18-09 (s pons tidak teridentifikasi) Spons /Sponge 13.2 3.5
MFM10 M-08-09 (s pons tidak teridentifikasi) Spons /Sponge 7.9 0.0
MFM13 M-11-09 (s pons tidak teridentifikasi) Spons /Sponge 7.2 26.9
MFM14 M-11-09 (s pons tidak teridentifikasi) Spons /Sponge 7.7 0.0
MFM15 M-14-09 (s pons tidak teridentifkas i) Spons /Sponge 11.0 2.8
MFP03 PS-17-09 (s pons tidak teridentifikas i) Spons /Sponge 16.0 7.2
MFP06 PS-17-09 (s pons tidak teridentifikas i) Spons /Sponge 15.3 2.8
MFP09 PS-63-09 (s pons tidak teridentifikas i) Spons /Sponge 8.9 2.1
MFP10 PS-64-09 (s pons tidak teridentifikas i) Spons /Sponge 17.8 0.0
MFP11 PS-18-09 (s pons tidak teridentifkasi) Spons /Sponge 16.7 0.6
MFP13 PS-17-09 (s pons tidak teridentifikas i) Spons /Sponge 5.7 0.6
MFP15 PS-17-09 (s pons tidak teridentifikas i) Spons /Sponge 11.9 2.8
MFP17 PS-17-09 (s pons tidak teridentifikas i) Spons /Sponge 3.8 3.1
MFP23 PS-17-09 (s pons tidak teridentifikas i) Spons /Sponge 3.4 0.0
MFW01 W-02-08 (as cidia Aplidium longitorax ) As cidia 5.1 13.0
MFW05 W-02-08 (as cidia Aplidium longitorax ) As cidia 5.8 14.1
MFW06 W-02-08 (as cidia Aplidium longitorax ) As cidia 2.8 23.9
MFW07 W-02-08 (as cidia Aplidium longitorax ) As cidia 4.0 4.5
MFW20 W-14-08 (s pons tidak teridentifikasi) Spons /Sponge 4.3 4.7
MFW23 W-14-08 (s pons tidak teridentifikasi) Spons /Sponge 4.9 2.3
MFW26 W-14-08 (s pons tidak teridentifikasi) Spons /Sponge 3.9 16.3
MFW28 W-14-08 (s pons tidak teridentifikasi) Spons /Sponge 5.1 28.7
MFW29 W-14-08 (s pons tidak teridentifikasi) Spons /Sponge 9.2 17.7
MFW39 W-02-08 (as cidia Aplidium longitorax) As cadia 13.1 35.4
MFW40 W-01-08 (karang lunak Sinularia s p.) Karang lunak/Soft coral 1.2 18.7
MFW41 W-01-08 (karang lunak Sinularia s p.) Karang lunak/Soft coral 5.9 15.2
MFW42 W-01-08 (karang lunak Sinularia s p.) Karang lunak/Soft coral 5.2 26.1
MFW50 W-08-08 (s pons Ircinia s p.) Spons /Sponge 2.2 8.9
MFW52 W-24-08 (s pons Aaptos s p.) Spons /Sponge 2.8 15.7
MFW61 W-25-08 (s pons tidak teridentifkas i) Spons /Sponge 1.6 4.1
MFW62 W-47-08 (karang lunak Lob ophytum s p.) Karang lunak/Soft coral 13.7 15.5
MFW70 W-08-08 (s pons Ircinia s p.) Spons /Sponge 6.4 8.2
70.5 Doxorubicin Perairan Sekitar Kepulauan Seribu Tam an Nas ional Laut Wakatobi, Sulawes i Tenggara Binuangeun, Banten Perairan Sekitar Manado
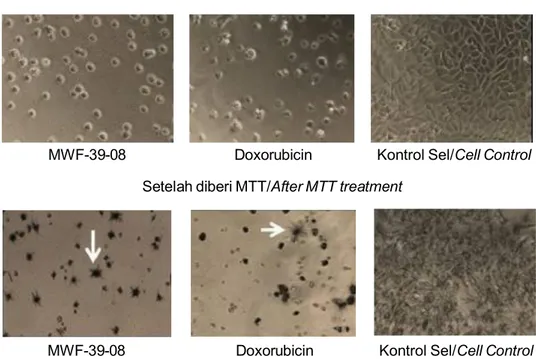
Gambar 2. Morfologi sel T47D setelah diberi perlakuan ekstrak kapang MFW39 dan kristal formazan yang terbentuk (tanda panah) setelah 3 jam pemberian MTT (perbesaran 100 x).
Figure 2. Morphology of T47D cells after being treated with MFW39 fungal extract and formazan crystal formed (arrows) after 3 hours exposing with MTT (100 x magnification).
Sebelum diberi MTT/Before MTT treatment
MWF-39-08 Doxorubicin Kontrol Sel/Cell Control
MWF-39-08 Doxorubicin Kontrol Sel/Cell Control
Setelah diberi MTT/After MTT treatment
Aktivitas sitotoksik yang terdapat pada ekstrak kapang MFW39 juga dapat dideteksi berdasarkan kristal formazan yang terbentuk di dalam mikroplat setelah 3-4 jam pemberian MTT. Kristal formazan yang terbentuk setelah pemberian ekstrak MF-39-08 relatif paling sedikit dibandingkan dengan kristal formazan yang terbentuk akibat perlakuan ekstrak kapang lainnya (Gambar 2). Dalam uji sitotoksik metode MTT, jumlah kristal formazan sebanding dengan jumlah sel yang hidup. Reaksi MTT merupakan reaksi reduksi seluler yang didasarkan pada pemecahan garam tetrazolium MTT yang berwarna kuning menjadi kristal formazan yang berwarna biru keunguan. Enzim suksinat dehidrogenase pada mitokondria sel hidup mampu memecah MTT menjadi kristal formazan (Zachary, 2003). Reaksi tersebut melibatkan piridin nukleotida kofaktor NADH dan NADPH yang hanya dikatalis oleh sel hidup, sehingga jumlah formazan yang terbentuk proporsional dengan jumlah sel yang hidup. Semakin banyak sel yang hidup, semakin banyak kristal formazan yang terbentuk, semakin tinggi nilai absorbansi yang diperoleh dan mengindikasikan mortalitas yang rendah.
Profil Metabolit Kapang MFW39
Rendemen metabolit dari kultivasi kapang MFW39 dalam media cair SWS pada skala 1 L sebesar 360,8 mg untuk ekstrak miselium dan ekstrak broth sebesar
57,4 mg. Ekstraksi metabolit dari miselium kapang dilakukan dengan campuran diklorometan : metanol = 1 : 1. Campuran kedua pelarut ini dipilih karena diklorometan bersifat non polar sedangkan metanol bersif at polar sehingga cam puran keduanya diharapkan dapat menarik atau melarutkan semua metabolit sekunder yang terdapat pada miselium. Proses ekstraksi metabolit dari miselium dilakukan dengan sonikasi selama 2 jam untuk memecah dinding sel dari miselium sehingga proses ekstraksi berjalan dengan lebih sempurna.
Ekstraksi metabolit dari broth dilakukan dengan etil asetat karena pelarut ini bersifat semipolar sehingga diharapkan dapat menarik senyawa metabolit sekunder hasil metabolisme kapang yang terdapat dari broth dalam kisaran polaritas yang lebar mulai yang bersifat non polar sampai polar. Selain itu, etil asetat memisah dengan baik dengan broth ketika didiamkan dalam corong pisah setelah dilakukan pengocokan sehingga mudah memisahkan antar keduanya.
Ekstraksi terhadap miselium dan broth dilakukan secara terpisah karena ada kemungkinan metabolit sekunder yang terdapat pada miselium dan broth memiliki perbedaan. Ada metabolit tertentu yang hanya terdapat dalam miselium dan ada pula metabolit tertentu yang hanya terdapat pada broth. Alasan lainnya adalah jika senyawa sitotoksik yang dihasilkan
oleh kapang hanya terdapat pada miselium atau broth saja, maka untuk penelitian selanjutnya dapat difokuskan pada miselium atau broth saja.
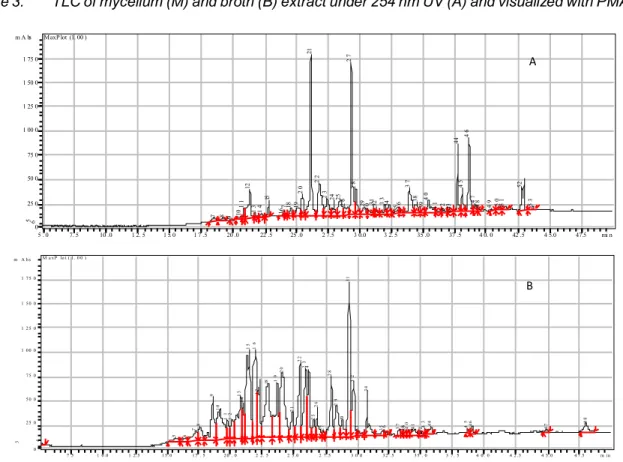
Untuk melihat profil metabolit dari ekstrak miselium dan broth dilakukan dengan KLT dan KCKT. Berdasarkan kromatogram KLT (Gambar 3) terlihat bahwa profil metabolit dari miselium (M) berbeda dengan metabolit yang terdapat dalam broth (B). Miselium terlihat memiliki keragaman metabolit yang lebih kecil dibanding dengan broth terutama pada Rf
Gambar 3. KLT ekstrak miselium (M) dan broth (B) dibawah UV 254 nm (A), dan divisualisasikan dengan PMA (B).
Figure 3. TLC of mycelium (M) and broth (B) extract under 254 nm UV (A) and visualized with PMA (B).
antara 0,1–0,5. Ekstrak miselium maupun broth memiliki serapan yang kuat di bawah UV 254 nm. Hal ini memberi petunjuk bahwa senyawa-senyawa dalam kedua ekstrak tersebut mempunyai ikatan rangkap ataupun merupakan suatu senyawa aromatik (Gritter et al., 1991).
Kromatogram KCKT juga memperlihatkan bahwa
broth memiliki kandungan metabolit yang lebih
beragam (Gambar 4). Ekstrak broth memiliki lebih banyak puncak dengan waktu retensi yang lebih
Gambar 4. Kromatogram KCKT ekstrak miselium (A) dan broth (B).
Figure 4. HPLC chromatogram of mycelium (A) and broth (B) extracts.
5 . 0 7. 5 10 .0 1 2. 5 1 5. 0 1 7 .5 20 .0 22 .5 25 .0 2 7.5 3 0.0 3 2. 5 35 .0 37 .5 4 0. 0 42 .5 4 5.0 47.5 mi n 0 25 0 50 0 75 0 1 00 0 1 25 0 1 50 0 1 75 0 m A bs MaxP lot (1. 00 ) 4 5 6 7 8 9 1 01 1 1 2 1 3 1 4 15 16 17 18 19 2 0 2 1 2 2 2 3 24 25 2 6 2 7 2 8 2 9 3 0 31 32 3334 35 36 3 7 38 39 4 0 4 1 4 2 43 44 4 5 4 6 4 7 4 8 4 9 50 5 1 52 5 3 7 .5 1 0 .0 1 2 .5 1 5 . 0 1 7 . 5 2 0 . 0 2 2 . 5 2 5 .0 2 7 . 5 3 0 .0 3 2 .5 3 5 . 0 3 7 . 5 4 0 . 0 4 2 .5 4 5 .0 4 7 .5 m i n 0 2 5 0 5 0 0 7 5 0 1 0 0 0 1 2 5 0 1 5 0 0 1 7 5 0 m A b s M a x P lo t ( 1 . 0 0 ) 3 4 5 6 7 8 9 1 0 1 1 1 2 1 3 1 4 1 5 1 6 1 7 18 1 9 2 0 2 1 2 2 2 3 2 4 2 5 2 6 2 7 2 8 2 9 30 3 1 3 2 3 3 3 4 3 5 3 6 373839 4 0 4 1 4 2 4 3 44 4 546 4 7 48 A B A B Rf 0,8 M B Rf 0,5 Rf 0,1 Rf 0,8 Rf 0,5 Rf 0,1 A B
Gambar 5. Hasil PCR daerah ITS1-5.8S-ITS2 kapang MFW39.
Figure 5. PCR result of ITS1-5.8S-ITS2 region of MFW39 fungal.
berdekatan dibanding ekstrak miselium. Meskipun demikian, ekstrak miselium dan broth memiliki beberapa persamaan puncak misalnya puncak nomor 27 dari ekstrak miselium kemungkinan besar sama dengan puncak nomor 31 dari ekstrak broth.
Kapang dikenal sebagai mikroba yang mampu menghasilkan berbagai macam senyawa metabolit sekunder dari golongan alkaloid, poliketida, terpen, steroid, dan peptida. Senyawa metabolit sekunder dari kapang memiliki kisaran bioaktivitas yang luas. Menurut Bugni & Ireland (2004), senyawa metabolit sekunder dari kapang kebanyakan diteliti aktivitasnya sebagai antibiotik dan antikanker.
Identifikasi Kapang
Identifikasi jenis kapang secara molekular dilakukan dengan mengisolasi genom DNA kapang MFW39. DNA yang diperoleh selanjutnya di-PCR untuk mengamplifikasi daerah ITS1-5.8S-ITS2 (berukuran sekitar 450-550 pasang basa). Hasil pur if ikasi pr oduk PCR di v isualisasi dengan elektroforesis gel (Gambar 5). Amplifikasi daerah ITS1-5.8S-ITS2 berhasil dilakukan, hal ini terlihat dengan adanya pita DNA di daerah sekitar 500 bp (Gambar 5). Hasil sekuensing produk PCR memperlihatkan bahwa kapang MFW39 memiliki tingkat similaritas sebesar 99% dengan Emericella nidulans. Pohon filogenetik strain MFW39 disajikan pada Gambar 6.
Secara morfologi kapang MFW39 pada media MEA memiliki koloni yang berwarna hijau kekuningan dengan zona pertumbuhan yang berwarna putih. Sebalik koloni berwarna kuning kecoklatan dan sedikit abu-abu. Diameter koloni yang berumur 5 hari mencapai 5–6 cm. Konidiofor tidak bersekat, berdinding halus dan memiliki warna coklat. Vesikula berbentuk lonjong agak bulat. Konidia berbentuk bulat dengan jumlah sangat banyak (dominan) dan memiliki dinding yang agak kasar. Karakteristik morfologi
tersebut m em iliki kesamaan dengan kapang
Emericella nidulans seperti yang dideskripsikan oleh
Gandjar (1989) serta Pitt & Hocking (2009).
Nama umum dari kapang Emericella nidulans adalah Aspergillus nidulans. Nama Emericella
nidulans diperoleh setelah siklus reproduksinya
diketahui secara lengkap. Emericella nidulans m erupakan kapang filamentus yang bersif at kosmopolitan dan secara khusus terdapat di dalam tanah. Kapang ini telah diisolasi dari berbagai substrat yang ada di lingkungan terestrial (Gandjar, 1989; Gandjar et al., 2006). Meskipun spesies ini berasal dari lingkungan terestrial namun Kralj et al. (2006) berhasil mengisolasi kapang ini dari lingkungan laut tepatnya dari permukaan alga hijau. Jenis lain dari genus Emericella yang berhasil diperoleh dari lingkungan laut misalnya Emericella variecolor yang diisolasi dari spons Haliclona valliculata (Bringmann
et al., 2003). Kapang ini berada dalam lingkungan laut
kemungkinan besar terbawa oleh aliran air hujan dari daratan dan masuk ke dalam laut kemudian spora tersebut menempel atau terhisap oleh invertebrata laut yang bersifat filter feeder.
Menurut Hooler et al. (2000), isolasi kapang dari organisme laut tidak menunjukkan bahwa kapang tersebut tumbuh dan berkembang dalam tubuh organisme tersebut. Dalam kasus kapang yang diisolasi dari spons, bisa saja spora kapang tersebut berasal dari spora kapang terestrial karena spons bersifat filter feeder. Menurut Kohlmeyer & Kohlmeyer (1979), banyak peneliti yang belum berhasil menunjukkan bahwa kapang yang diisolasi dari lingkungan laut dapat tumbuh di habitat laut. Kapang tersebut kemungkinan dalam keadaan dorman dalam bentuk spora atau fraksi hifa dimana spora ini akan tumbuh serta bersporulasi apabila lingkungan menguntungkan. Menurut Konig et al. (2006), kapang dari lingkungan terestrial dapat tumbuh dengan baik
Gambar 6. Pohon filogenetik kapang MFW39.
Figure 6. Phylogentic tree of MFW39 fungal.
Pe nic illiu m wa k s m a nii Pe nic illiu m c itr inum Pe nic illiu m v irg at um As pe rg illu s c la va tu s As pe rg illu s fu m iga tu s As pe rg illu s pa ra s it ic us As pe rg illu s us tu s MF W 3 9
Em e ric ella nid ula ns G y m na s c ella da nk a liens is Hy p oc r ea v ir en s F us ar iu m in c a rn at um F us ar iu m o x y s po ru m G ib b er ella m o nilifo rm is Alt er na ria a lt er na ta Ca nd ida t ro pic a lis Ca nd ida alb ic an s
Sa c c ha ro m yc es c er ev is ia e Rh iz o pus s to lon ife r
0 .00 0 .0 5 0 .1 0 0 .1 5 0 .2 0 0 .25 0.3 0
Gambar 7. Koloni dalam media MEA (A) dan gambaran mikroskopis kapang MFW39 (B) (perbesaran 2000x).
Figure 7. Colony of MFW39 fungal on MEA medium (A) and microscopic features of MFW39 fungal (B) (2000x magnification).
A
B
Keterangan/Note: a : konidiofor/conidiophore; b : vesikula/vesicle; c : konidia/conidia
dalam media yang mengandung air laut karena memiliki daya toleransi dan adaptasi yang baik dalam habitat yang berkadar kadar garam tinggi.
Aktivitas Sitotoksik
Hasil uji aktivitas sitotoksik ekstrak miselium dan
broth terhadap sel T47D (sel kanker payudara)
memperlihatkan adanya perubahan yang jelas terhadap morfologi sel setelah diberi perlakuan ekstrak MFW39. Ekstrak miselium terlihat memiliki efek sitotoksik yang lebih kuat dibanding ekstrak broth karena pada dosis 1 µg/mL menyebabkan perubahan morfologi sel sedangkan perubahan morfologi sel akibat pemberian ekstrak broth terjadi pada dosis yang lebih tinggi yaitu 5 µg/mL (Gambar 8). Demikian juga halnya
dengan jumlah kristal formazan yang terbentuk. Kristal formazan yang terbentuk pada sel yang diberi perlakuan ekstrak miselium pada dosis 1 µg/mL sangat sedikit bila dibandingkan dengan kristal formazan yang terbentuk pada sel yang diberi ekstrak
broth pada dosis yang sama (Gambar 8).
Profil penghambatan pertumbuhan sel T47D akibat pemberian ekstrak miselium dan broth disajikan pada
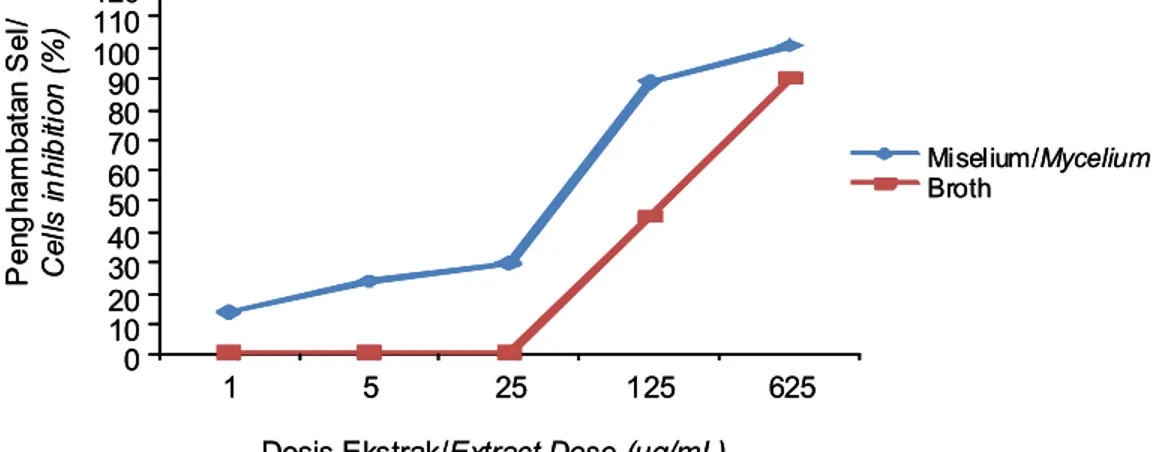
Gambar 9. Ekstrak miselium pada dosis 1 µg/mL mampu m enghambat pertumbuhan sel T47D, sedangkan ekstrak broth tidak m enunjukkan penghambatan terhadap sel T47D pada dosis 1, 5, dan 25 µg/mL (Gambar 9).
Hasil perhitungan nilai IC50 dengan program MINITAB 14.0 memperlihatkan bahwa ekstrak miselium memiliki aktivitas sitotoksik yang lebih kuat
Gambar 9. Penghambatan sel T47D setelah diberi ekstrak miselium dan broth inkubasi 24 jam.
Figure 9. Inhibition of T47D cells treated with mycelium and broth extract of 24 hour incubation. Sebelum perlakuan MTT/Before MTT treatment
1 g/mL 5 g/mL 25 g/mL 125 g/mL 625 g/mL
1 g/mL
Setelah perlakuan MTT/After MTT treatment
5 g/mL 25 g/mL 125 g/mL 625 g/mL
1 g/mL
Sebelum perlakuan MTT/Before MTT treatment
5 g/mL 25 g/mL 125 g/mL 625 g/mL
1 g/mL
Setelah perlakuan MTT/After MTT treatment
5 g/mL 25 g/mL 125 g/mL 625 g/mL
Ekstrak miselium/
Mycelium extract
Ekstrak broth/
Broth extract
Gambar 8. Morfologi sel T47D setelah diberi perlakuan ekstrak miselium dan broth selama 24 jam.
Figure 8. Morphology of T47D cells after being treated with mycelium and broth extract for 24 hours.
0 10 20 30 40 50 60 70 80 90 100 110 120 1 5 25 125 625 P en g h am ba ta n S el / C e lls in hi b iti o n ( % )
Dosis Ekstrak/Extract Dose (µg/mL)
Miselium/Mycelium Broth 0 10 20 30 40 50 60 70 80 90 100 110 120 1 5 25 125 625 P en g h am ba ta n S el / C e lls in hi b iti o n ( % )
Dosis Ekstrak/Extract Dose (µg/mL)
Miselium/Mycelium Broth
(IC50 21,9 µg/mL) dibanding dengan ekstrak broth (IC50 169,3 µg/mL). Ekstrak miselium memiliki aktivitas yang lebih kuat kemungkinan disebabkan oleh senyawa aktif yang terdapat pada kapang MFW39 tidak dilepas keluar dari sel tetapi tetap dipertahankan berada di dalam miselium. Jika senyawa aktif tersebut dilepas dari sel-sel miselium dan masuk ke dalam media kultur (broth) maka ekstrak broth juga memiliki efek sitotoksik yang kuat. Keberadaan senyawa aktif dalam miselium ada hubungannya dengan mekanisme pertahanan diri terutama untuk melindungi struktur reproduksi seperti halnya miselium. Senyawa metabolit sekunder pada kapang pada umumnya berhubungan dengan proses sporulasi dan pigmentasi. Selain itu metabolit toksik yang dihasilkan oleh kapang berfungi untuk melindungi koloni yang sedang tumbuh (Calvo et al., 2002).
KESIMPULAN
Hasil penapisan terhadap 46 strain kapang penghasil senyawa sitotoksik memperlihatkan bahwa strain kapang MFW39 memiliki nilai inhibisi terbaik (35,4%) terhadap pertumbuhan sel T47D pada konsentrasi ekstrak sebesar 30 µg/mL. Berdasarkan hasil identifikasi secara molekular dan morfologi, kapang MFW39 termasuk dalam jenis Emericella
nidulans. Hasil uji sitotoksik terhadap sel T47D
menunjukkan bahwa ekstrak miselium memiliki aktivitas sitotoksik yang lebih kuat (IC50 = 21,9 µg/ mL) dibanding dengan ekstrak broth (IC50 = 169,3 µg/ mL). Penelitian selanjutnya akan difokuskan untuk mengisolasi dan mengidentifikasi senyawa sitotoksik yang terdapat dalam ekstrak miselium kapang MFW39.
UCAPAN TERIMA KASIH
Penulis ucapkan terima kasih kepada Gintung Patantis, S.Kel atas bantuannya dalam identifikasi kapang MFW39 secara molekular dan Asri Pratitis, S.Pi atas bantuannya dalam isolasi kapang laut dari sampel hospes yang berasal dari Taman Nasional Laut Wakatobi.
DAFTAR PUSTAKA
Abcam. 2007. T47D (Human ductal breast epithelial tumor cell line) whole cell lysate (ab14899) datasheet.
htt p:// www.a bc am.c om/ index .html?datas he et= 14899. Diakses pada tanggal 11 Mei 2011.
Bringmann, G., Lang, G., Steffens, S., Gunther, E., and Schaumann. 2003. Evariquinone, isoemericellin and stromemycin from a sponge derived strain of the fungus Emericella variecolor. Phytochemistry. 63: 437–443.
Bugni, T.S. and Ireland, C.M. 2004. Marine-derived fungi: a chemically and biologic ally diverse group of microorganisms. Nat. Prod. Rep. 21: 143–163. Burdall, S.E., Hanby, A.M., Lansdown, M.R.J., and Speirs,
V. 2003. Breast cancer cell lines: friend or foe? Breast
Cancer Res. 5: 89–95.
Calvo, A.M., Wilson, R.A., Bok, J.W., and Keller, N.P. 2002. Relationship between secondary metabolism and fungal development. Microbiology and Molecular
Biology Reviews. p. 447–438.
Colin, P.L. and Arneson, C. 1995. Tropic al Pacific
Invertebrates. A Field guide to the Marine Invertebrates Occuring on Tropical Pacific Coral Reefs, Seagrass Beds and Mangrove. Coral Reef
Press, California. 296 pp.
Chasanah, E., Januar, H.I., Irianto, H.E., Bourne, D., Liptrot, C., and Wright, A. Screening of anticancer activity of fungi derived from Indonesia marine sponges. 2009. Journal of marine and fisheries
postharvest and biotechnology, special edition in conjuction with World Ocean Conference 2009. p. 1–
8.
Felth, J. 2011. Studies of Cytotoxic Compounds of Natural
Origin and Their Mechanism of Action. Dissertations.
University of Uppsala. 58 pp.
Freshney, R.I. 2005. Culture of Animal Cells. A Manual of Basic Technique, Fifth Edition. John Wiley and Son, Inc., Hoboken, New Jersey.
Gandjar, I. 1989. Pengenalan Kapang Umum Tropik. Yayasan Obor Indonesia, Jakarta.
Gandjar, I., Sjamsuridjal, W., dan Oetari, A. 2006. Mikologi
Dasar dan Terapan. Yayasan Obor Indonesia,
Jakarta. 238 pp.
Gritter, R.J., Bobbit, J.M., and Schwarting, A.E. 1991.
Pengantar k romatografi. Diterj emahk an oleh
Padmawinata, K. Penerbit ITB, Bandung. 266 pp. Holler, U., Wrigth, A.T., Matthee, G.F., Konig, G.M., Draeger,
S., Aust, H.J., and Schulz, B. 2000. Fungi from marine sponges : diversity, biological activity and secondary metabolites. Mycol. Res. 104(11): 1354–1365. Hyde, K.D., Gareth, Jones, E.B.G., Leano, E., Pointing,
S.B., Poonyth, A.D., and Vrijmoed, L.P. 1998. Role of fungi in marine ec osystems. Biodiv ers ity and
Conservation. 7: 1147–1161.
Hawksworth, D.L. 2001. The magnitude of fungal diversity : the 1.5 million species estimate revisited.
Mycol. Res. 105(12): 1422–1433.
Konig, G., Kehraus, S., Seibert, S.F., Abdel-Latif, A., and Muller, D. 2006. Natural products from marine organism and their associated microbes. Chem. Bio.
Chem. 7: 229–238.
Kohlmeyer, J. and Kohlmeyer, E. 1979. Marine Mycology:
the Higher Fungi. Academic Press, New York. 690 pp
Kralj, A., Kehraus, S., Krick, A., Eguereva, A., Kelter, G., Maurer, M., Wortmann, A., Fiebig, H.H., and Konig, M. 2006. Arugosin G and H : prenylated polyketodes from marine-derived fungi Emeric ella nidulans var. acristata. J. Nat. Prod. 69: 995–2000.
Kjer, J., Debbab, A., Aly, H., and Proksch, P. 2010. Methods for isolation of marine-derived endophytic fungi and
their bioactive secondary products. Nature Protocols. 5(3): 479–490.
Nafrialdi dan Gan, S. 2007. Antikanker. In. Gunawan, S.G., Setiabudi, R., Nafrialdi, dan Elysabeth (eds.).
Farmak ologi dan Te rapi, Edis i 5. Departemen
Farmakologi dan Terapeutik, FK UI, Jakarta. 926 pp. Namikoshi, M., Akano, K., Kobayashi, H., Koike, Y., Kitazawa, A., Rondonuwu, A.B., and Pratasik, S.B. 2002. Distribution of marine filamentous fungi associated with marine sponges in coral reefs of Palau and Bunaken Island, Indonesia. Journal of
Tokyo University of Fisheries. 88: 15–20.
Pratitis, A., Chasanah, E., and Nursid, M. 2009. Skrining aktivitas sitotoksik dan peredaman radikal bebas DPPH ektrak marine fungi yang diisolasi dari spons asal perairan Wakatobi. Prosiding Seminar Nasional
Pasc apanen dan Biotek nologi Kelautan dan Perikanan, Jakarta.
Pitt, J.I. and Hoc king, A.D. 2009. Fungi and Food
Spoilage. Spinger, New York. 519 pp.
Proksch, P., Ebel, R., Edrada, R.S., Schupp, P., Lin W.H., Sudarsono., Wray, V., and Steube, K. 2003. Detection of pharmacologically active natural products using ecology, selected examples from Indopacific marine invertebrates and sponge-derived fungi. Pure Appl.
Chem. 75: 343–352.
Rifai. M.A. 1995. The Biodiversity of Indonesian Microbial
Diversity. Regional warkshop on culture collection of
microorganism in Southeast Asia. Gadjah Mada University, Yogyakarta.
Tjindarbumi, D. and Mangunkusumo, R. 2002. Cancer in Indonesia, present and future, Jpn. J Clin. Oncol. 32(supplement 1): 17–21.
Zhang, Y., Mu, J., Feng, Y., Kang, Y., Zhang, J., Gu, P.J., W ang, Y., Ma, L.F., and Zhu, Y.H. 2009. Broad-spectrum antimicrobial epiphytic and endophytic fungi from marine organisms: Isolation, bioassay and taxonomy. Marine Drugs. 7: 97–112.
Zachary, I. 2003. Determination of cell number. In Hughes, D. and Mehmet, H. (eds.). Cell Proliferation