Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA Universitas Pendidikan Indonesia | repository.upi.edu| perpustakaan.upi.edu
ANALISIS FILOGENETIKA ISOLAT BAKTERI Aeromonas hydrophila DARI IKAN
SEHAT MENGGUNAKAN GEN 16S rRNA
SKRIPSI
Diajukan untuk Memenuhi Sebagian dari Syarat untuk Memperoleh Gelar Sarjana Sains
Program Studi Biologi
Oleh: Maesaroh
0905752
PROGRAM STUDI BIOLOGI JURUSAN PENDIDIKAN BIOLOGI
FAKULTAS PENDIDIKAN MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS PENDIDIKAN INDONESIA
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA Universitas Pendidikan Indonesia | repository.upi.edu| perpustakaan.upi.edu
ANALISIS FILOGENETIKA ISOLAT BAKTERI
Aeromonas
hydrophila
DARI IKAN SEHAT
MENGGUNAKAN GEN 16S rRNA
Oleh Maesaroh
Sebuah skripsi yang diajukan untuk memenuhi salah satu syarat memperoleh gelar Sarjana pada Fakultas Pendidikan Matematika dan Ilmu Penetahuan Alam
© Maesaroh 2013
Universitas Pendidikan Indonesia Agustus 2013
Hak Cipta dilindungi undang-undang.
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA Universitas Pendidikan Indonesia | repository.upi.edu| perpustakaan.upi.edu
LEMBAR PENGESAHAN
ANALISIS FILOGENETIKA ISOLAT BAKTERI Aeromonas hydrophila DARI IKAN
SEHAT MENGGUNAKAN GEN 16S rRNA
Oleh
Maesaroh 0905752
DISETUJUI DAN DISAHKAN OLEH:
Pembimbing I
Dr. Topik Hidayat, M.Si
NIP. 197004101997021001
Pembimbing II
Diah Kusumawaty, M.Si
NIP.19708112001122001
Mengetahui,
Ketua Jurusan Pendidikan Biologi FPMIPA UPI
Dr. Riandi, M.Si
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA Universitas Pendidikan Indonesia | repository.upi.edu| perpustakaan.upi.edu
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi dengan judul “Analisis Filogenetika Isolat Bakteri Aeromonas hydrophila dari Ikan Sehat Menggunakan Gen 16S rRNA” ini
beserta seluruh isinya adalah benar-benar karya sendiri, dan saya tidak melakukan penjiplakan atau pengutipan dengan cara-cara yang tidak sesuai dengan etika keilmuan yang berlaku dalam masyarakat keilmuan. Atas pernyataan ini, saya siap menanggung sanksi yang dijatuhkan kepada saya apabila kemudian ditemukan adanya pelanggaran terhadap etika keilmuan dalam karya saya ini atau klaim dari pihak lain terhadap keaslian karya saya ini.
Bandung, Agustus 2013 Yang membuat pernyataan
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
Universitas Pendidikan Indonesia | repository.upi.edu| perpustakaan.upi.edu
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
ABSTRAK
Aeromonas hydrophila umum dijumpai pada ekosistem perairan dan mempunyai peranan sebagai microbial flora bagi organisme air pada kondisi lingkungan yang stabil dan dapat menjadi patogen pada ikan saat kondisi kualitas air yang buruk. Aeromonas memiliki taksonomi yang kompleks dengan karakter yang berbeda-beda, bahkan dilevel intraspesies. Tujuan penelitian ini yaitu untuk melihat kekerabatan bakteri A. hydrophila yang diisolasi dari beberapa ikan sehat dan menggambarkan potensi patogen setiap A.hydrophila yang didapat sehingga dapat dijadikan sebagai landasan awal dalam pengontrol perkembangan jangkitan penyakit pada ikan. Pada penelitian ini dilakukan pengujian morfologi dan biokimia untuk menskrining sampel bakteri yang diisolasi dari beberapa intestin ikan sehat (mas, gurame, lele, nila, dan tawes). Selain itu, dilakukan pengujian molekuler yaitu pendeteksian gen lip sebagai gen spesifik A. hydrophila, gen 16S rRNA, dan pendeteksian gen virulen (act, aerA, aopB, alt, ast, aexT, dan ascV) untuk mengetahui keberadaan gen-gen virulen pada setiap strain A. hydrophila. Hasil skrining dengan pengujian morfologi, biokimia, dan molekuler, dari 46 isolat bakteri yang didapat, hanya 8 isolat bakteri yang kemungkinan besar merupakan A. hydrophila. Kedelapan isolat tersebut merupakan bakteri gram negatif dengan bentuk basil, positif terhadap uji oksidase, merupakan bakteri
fakultatif anaerob, bersifat motil dan memiliki kemampuan β hemolisis. Hasil dari
pendeteksian gen lip pada seluruh isolat A. hydrophila, 60% isolat menunjukkan amplikon pada ukuran 760 pb. Sedangkan hasil dari analisis bioinformatika menggunakan sikuen gen 16S rRNA menunjukan kedelapan isolat bakteri tersebut berkerabat dekat satu dengan yang lainnya dan dengan A. hydrophila ATCC 7966. Pendeteksian gen virulen menunjukkan bahwa seluruh isolat dimungkinkan tidak memiliki sifat patogen pada ikan.
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
Universitas Pendidikan Indonesia | repository.upi.edu| perpustakaan.upi.edu
PHYLOGENETIC ANALYSIS OF Aeromonas hydrophila ISOLATED FROM HEALTHY FISH USING 16S rRNA GENE
ABSTRACT
Aeromonas hydrophila is present in aquatic ecosystems and act as microbial flora of aquatic organism in stable environmental conditions and can be act as pathogenic agent in poor water condition. Aeromonas have complex taxonomy because of its different characters, even in intraspesies level. The purpose of this research is to describe phylogenetic relationship of A. hydrophila isolated from some healthy fish and describe its potential pathogen. So, it can be use as basic to control of epidemical disease spreade in fish. In this research morphology and biochemistry were tested for screening bacteria isolated from some healthy fish intestin (goldfish, carp, catfish, tilapia, and tawes). Moreover, molecular identifiation was tested such as gene lip detection as specific gene A. hydrophila, detection 16S rRNA gene, and detection virulence genes (act, aerA, aopB, alt, ast, aexT, and ascV) for knowing of existence virulence genes in every strains A. hydrophila. The screening results showed from 46 isolated of bacteria, only 8 isolates are probably A. hydrophila. All isolates are bacillary Gram-negative bacteria, positive for oxidase testing, facultative anaerob, motile and have β hemolysis ability. The results from detection of lip gene in all of A. hydrophila, 60% isolated showed amplicon at 760 pb. While the results from analysis of bioinformatics using gene sequence 16S rRNA showed all eighth isolates have close relation each other and with A. hydrophila ATCC 7966. Detection of virulence gene showed that all isolates are probably not pathogen in fish.
Key word: Aeromonas hydrophila, 16S rRNA gene, phylogenetic, virulence
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
DAFTAR ISI
KATA PENGANTAR ... i
ABSTRAK ... iii
DAFTAR ISI ... iv
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... ix
BAB I PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Rumusan Masalah ... 4
C. Pertanyaan Penelitian ... 4
D. Tujuan Penelitian ... 4
E. Manfaat Penelitian ... 4
F. Batasan Penelitian ... 5
BAB II KARAKTERISTIK BAKTERI Aeromonas hydrophila DAN STUDI ANALISIS FILOGENETIKA MENGGUNAKAN SIKUEN GEN 16S rRNA ... 6
A. Deskripsi Bakteri A. hydrophila ... 6
B. A. hydrophila dan Ikan Sehat ... 7
C. Karakterisasi Bakteri A. hydrophila ... 7
1. Karakterisasi secara Morfologi dan Biokimia ... 7
2. Karakteristik A. hydrophila secara Molekuler ... 12
3. Filogenetika Molekuler ... 15
BAB III METODE PENELITIAN ... 17
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
B. Populasi dan Sampel ... 17
C. Waktu dan Tempat Penelitian ... 17
D. Alat dan Bahan ... 17
E. Prosedur Penelitian ... 17
1. Persiapan Alat dan Pembuatan Medium ... 17
2. Isolasi Bakteri A. hydrophila dari Intestin Ikan Sehat ... 18
3. Identifikasi A. hydrophila secara Morfologi dan Biokimia ... 19
4. Karakterisasi A. hydrophila secara Molekuler ... 22
5. Cryoreservasi ... 29
6. Sikuensing ... 29
7. Analisis Data Bioinformatika ... 29
F. Alur Penelitian ... 30
BAB IV HASIL PENELITIAN DAN PEMBAHASAN ... 31
A. Karakterisasi Bakteri A. hydrophila secara Morfologi, Biokimia, dan Molekuler ... 32
B. Analisis Sikuen Gen 16S rRNA ... 49
1. Deteksi Gen 16S rRNA ... 49
2. Sikuen Gen 16S rRNA ... 51
3. Analisis Filogenetika Berdasarkan Sikuen Gen 16S rRNA ... 53
C. Deteksi Gen Virulen pada A. hydrophila ... 59
BAB V KESIMPULAN DAN SARAN ... 64
A.Kesimpulan ... 64
B. Saran ... 64
DAFTAR PUSTAKA ... 65
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
DAFTAR TABEL
Tabel Halaman
3.1 Komposisi Reaksi Amplifikasi Gen Lipase pada A. hydrophila... 23
3.2 Komposisi Reaksi Amplifikasi Gen 16S rRNA ... 24
3.3 Primer Gen Virulen yang digunakan dalam Penelitian ... 26
3.4 Komposisi Reaksi Amplifikasi Gen Virulen pada A. hydrophila ... 27
4.1 Nama Isolat Bakteri yang digunakan dalam Penelitian ... 34
4.2 Hasil Uji Morfologi dan Biokimia Isolat Bakteri ... 35
4.3 Hasil Pendeteksian Gen Lipase pada Isolat Aeromonas ... 41
4.4 Morfologi Koloni A. hydrophila diatas medium RS ... 43
4.5 Hasil Pengujian Biokimia Tambahan Isolat A. hydrophila ... 45
4.6 Hasil Spektrofotometer DNA Isolat A. hydrophila ... 50
4.7 Hasil analisis bioinformatika isolat L21 dengan Blast ... 52
4.8 Hasil pengujian biokimia dan molekuler isolat A. hydrophila ... 56
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
DAFTAR GAMBAR
Gambar Halaman
2.1 Bakteri Aeromonas hydrophila ... 6
3.1 Program PCR Gen Lipase ... 23
3.2 Program PCR Gen 16S rRNA ... 25
3.3 Rumus Perhitungan Konsentrasi DNA ... 26
3.4 Program PCR Touchdown Gen Virulen Alt ... 27
3.5 Program PCR Touchdown Gen Virulen Act, AopB, AerA, AscV, AexT, dan Ast ... 28
4.1 Hasil Penanaman Sampel dari Intestin Ikan Lele dan Nila di atas Medium RS ... 31
4.2 Hasil Pewarnaan Gram Isolat Bakteri ... 36
4.3 Indikator Lengket yang ditunjukkan oleh Bakteri Gram negatif dalam KOH String Test ... 37
4.4 Hasil Uji Motilitas dan Produksi H2S Isolat Bakteri ... 38
4.5 Hasil Uji Oksidase Isolat Bakteri ... 39
4.6 Reaksi Positif Isolat Bakteri dari ikan Gurame terhadap Uji O/F ... 40
4.7 Elektrogram Gen Lipase pada Aeromonas ... 42
4.8 Penampakan morfologi A. hydrophila diatas medium RS ... 43
4.9 Hasil Pewarnaan Gram Isolat Bakteri A. hydrophila ... 44
4.10 Kemampuan Hemolisis Isolat Bakteri A. hydrophila ... 46
4.11 Hasil Pengujian V-P Isolat Bakteri A. hydrophila ... 46
4.12 Hasil Pengujian MacConkey Isolat Bakteri A. hydrophila ... 47
4.13 Hasil Pengujian Indol Isolat Bakteri A. hydrophila ... 48
4.14 Hasil Pengujian Sitrat Isolat Bakteri A. hydrophila ... 49
4.15 Hasil Amplifikasi Gen 16S rRNA bakteri A. hydrophila ... 51
4.16 Elektroferogram isolat L21 ... 52
4.17 Pohon Filogenetika A. hydrophila berdasarkan Sikuen Gen 16S rRNA ... 54
4.18 Elektrogram gen Act pada A. hydrophila ... 60
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
DAFTAR LAMPIRAN
Lampiran Halaman
1. Daftar Alat dan Bahan ... 73
2. Protokol Pembuatan Medium ... 77
3. Dokumentasi Penanaman Sampel pada medium RS ... 81
4. Dokumentasi Uji Motilitas Isolat Bakteri A. hydrophila ... 85
5. Dokumentasi Uji O/F Isolat Bakteri A. hydrophila ... 86
6. Dokumentasi elektrogram gen lipase ...87
7. Morfologi Koloni A. hydrophila diatas medium RS ... 88
8. Penampakan Koloni A. hydrophila pada medium RS ... 89
9. Hasil Pewarnaan Gram Isolat Bakteri A. hydrophila ... 90
10. Dokumentasi Hasil Uji Hemolisis Bakteri A. hydrophila. ... 91
11. Dokumentasi Hasil Uji MacConkey Bakteri A. hydrophila... 92
1
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
Universitas Pendidikan Indonesia | repository.upi.edu| perpustakaan.upi.edu BAB I
PENDAHULUAN
A. Latar Belakang Masalah
Aeromonas hydrophila merupakan bakteri gram negatif berbentuk batang yang tersebar luas di lingkungan, terutama di air tawar dan memiliki sifat patogen pada manusia serta dapat menyebabkan penyakit pada hewan (Martin-Carnahan & Joseph, 2005; EPA, 2006). A. hydrophila umum dijumpai pada ekosistem perairan dan mempunyai peranan sebagai microbial flora bagi organisme air pada kondisi lingkungan yang stabil (Mangunwardoyo et al., 2010). Bakteri ini juga secara normal berada pada intestin ikan sebagai microbial flora (Trush et al., 1974; Illanchezian et al., 2010). A. hydrophila dikenal sebagai bakteri yang bersifat oportunis, yaitu jarang menyerang pada ikan yang sehat tetapi dapat menginfeksi pada saat sistem pertahanan tubuh ikan sedang menurun akibat stess. Gejala ikan yang terinfeksi oleh bakteri ini bervariasi, namun umunya ditandai dengan adanya hemoragik pada kulit, insang, rongga mulut, dan borok pada kulit (Gardenia et al., 2010).
2
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
Universitas Pendidikan Indonesia | repository.upi.edu| perpustakaan.upi.edu
secara pasti pada tingkatan spesies diperlukan identifikasi lebih lanjut menggunakan analisis secara molekuler. Teknik identifikasi menggunakan biologi molekuler telah berhasil mengidentifikasi kelompok mikroorganisme dari lingkungan secara spesifik (Gonzales et al., 2001).
Teknik yang saat ini populer untuk mengidentifikasi dan menganalisis suatu bakteri yaitu dengan menggunakan teknologi analisis sikuen suatu gen. Gen yang sering digunakan dalam mengidentifikasi bakteri adalah gen 16S rRNA. Gen ini merupakan gen yang mengkode RNA ribosomal pada sub unit kecil ribosom dan memiliki urutan nukleotida yang khas dan berbeda pada setiap bakteri (Gonzales & Saiz, 2005). Selain itu, 16S rRNA ini lebih stabil dan tepat digunakan sebagai penanda molekuler spesifik untuk identifikasi bakteri (Singh et al., 2012). 16S rRNA juga bersifat ubikuitus (keberadaannya selalu dipertahankan dalam kondisi apapun) dengan fungsi yang identik pada seluruh organisme (Pangastuti, 2006). Oleh sebab itu, pengunaan 16S rRNA sangat tepat dalam mengidentifikasi dan menganalisis suatu spesies dalam taraf molekuler.
3
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
Universitas Pendidikan Indonesia | repository.upi.edu| perpustakaan.upi.edu
isolat bakteri yang diisolasi dari ikan dan air menggunakan gen lip dan hasil amplifikasi yang berukuran 760 pb ditunjukkan oleh empat spesies yang merupakan A. hydrophila. Metode ini dapat dengan cepat dan spesifik dalam mengidentifikasi A. hydrophila yang diisolasi dari lingkungan perairan.
Pendeteksian faktor virulen pada A. hydrophila merupakan komponen penting dalam mendeterminasi potensi patogen karena faktor-faktor ini bertindak secara multifungsi dan multifaktor (Nam & Joh, 2007). Keragaman genotip yang dimiliki A. hydrophila menyebabkan timbulnya potensi patogen yang bervariasi (Carvalho-Castro et al., 2010). Kelompok gen virulen tertentu dengan kehadiran dan ketidakhadiran gen virulen tertentu akan mempengaruhi tingkat virulensi suatu bakteri A. hydrophila (Li et al., 2011). Wulandari (2012) dan Syadza (2012) menyebutkan bahwa isolat A. hydrophila ATCC 7966 memiliki karakter gen virulen aerA+, act+, alt+, ast+, ascV-, aopB-, dan aexT -. Sedangkan isolat A2 yang diisolasi dari ikan Botia sakit memiliki karakteristik genetik aerA+, ascV+, aopB+, dan aexT+ (Syadza, 2012) dan isolat AKS yang diisolasi dari air kolam Sukabumi memiliki karakteristik genetik aerA+, act+, alt+, ast- (Wulandari, 2012). Dari uji patogenitas isolat A2 dan AKS terhadap ikan gurame varietas tutug oncom menunjukkan tingkat patogenitas yang berbeda, tingkat patogenitas isolat A2 dengan nilai LD50 = 106,91 termasuk kedalam kelompok virulen sedang, sedangkan isolat AKS memiliki nilai LD50 > 108 yang termasuk kedalam kelompok avirulen. Melihat dari hasil penelitian Wulandari dan Syadza (2012), maka perlu kiranya dilakukan pendeteksian ketujuh gen virulen tersebut terhadap isolat A. hydrophila yang di dapat dari ikan sehat untuk mengetahui keberadaan gen-gen virulen yang diharapkan dapat menggambarkan potensi patogen dari setiap isolat bakteri yang didapat.
4
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
Universitas Pendidikan Indonesia | repository.upi.edu| perpustakaan.upi.edu
menggambarkan karakteristik dari setiap isolat bakteri A. hydrophila yang terpilih dalam penelitian ini. Selain itu, dibutuhkan pula pendeteksian gen-gen virulen terhadap semua isolat A. hydrophila yang didapat untuk mengetahui keberadaan gen-gen virulen yang diharapkan dapat menggambarkan potensi patogen dari setiap bakteri.
B. Rumusan Masalah
Bagaimanakah hubungan filogenetika bakteri A. hydrophila dari isolat beberapa ikan sehat dengan gen penanda 16S rRNA?
C. Pertanyaan Penelitian
1. Bagaimanakah karakteristik A. hydrophila yang terdapat pada intestin ikan sehat secara biokimia dan morfologi?
2. Bagaimanakah hubungan kekerabatan A. hydrophila yang didapat dari beberapa ikan sehat berdasarkan sikuen gen 16S rRNA?
3. Bagaimanakah keberadaan gen-gen virulen pada setiap A. hydropila yang didapat dari ikan sehat?
D. Tujuan
1. Untuk mengetahui karakteristik A. hydrophila yang hidup di ikan sehat secara biokimia dan morfologi.
2. Untuk mengetahui hubungan kekerabatan A. hydrophila yang didapat dari beberapa ikan sehat berdasarkan sikuen gen 16S rRNA.
3. Untuk mengetahui keberadaan gen-gen virulen dari setiap isolat bakteri A. hydrophila yang didapat dari ikan sehat.
E. Manfaat Penelitian
1. Memberikan informasi mengenai karakteristik bakteri A. hydrophila dari ikan sehat.
5
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
Universitas Pendidikan Indonesia | repository.upi.edu| perpustakaan.upi.edu
3. Dapat menggambarkan potensi patogen dari setiap bakteri A. hydrophila dilihat dari kelimpahan gen-gen virulen yang dimilikinya.
4. Dapat dijadikan sebagai landasan awal dalam pengontrolan perkembangan jangkitan penyakit pada ikan yang disebabkan oleh bakter A. hydrophila.
5. Sebagai tambahan ilmu khususnya bidang mikrobiologi dan biologi molekuler.
F. Batasan Penelitian
1. Ikan sehat yang digunakan merupakan ikan air tawar yaitu ikan tawes, ikan mas, ikan lele, ikan gurame, dan ikan nila.
2. Organ yang digunakan dalam mengisolasi bakteri A. hydrophila yaitu intestin.
3. Primer yang digunakan untuk amplifikasi gen 16S rRNA adalah primer forward 27F dan primer reverse 1492R (Lane, 1991; Hill et al., 2003). 4. Isolat bakteri A. hydrophila yang digunakan merupakan bakteri yang
17
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
BAB III
METODE PENELITIAN
A. Jenis Penelitian
Jenis penelitian yang digunakan yaitu penelitian deskriptif. Penelitian deskriptif dilakukan dengan tujuan utama menggambarkan secara sistematis fakta dan karakteristik objek serta subjek yang diteliti secara tepat. Penelitian ini merupakan penelitian yang diarahkan untuk memberikan gejala-gejala dan fakta-fakta atau kejadian-kejadian secara sistematis dan akurat (Zuriah, 2007).
B. Populasi dan Sampel
Populasi yang digunakan dalam penelitian adalah bakteri A. hydrophila yang diisolasi dari intestin ikan air tawar sehat yaitu ikan mas, ikan lele, ikan gurame, ikan nila dan ikan tawes yang diperoleh di pertambakan dan atau di pasar.
Sampel yang digunakan yaitu DNA bakteri A. hydrophila yang berasal dari intestine ikan mas, lele, gurame, nila dan tawes.
C. Waktu dan Tempat Penelitian
Penelitian ini dimulai pada bulan November 2012 sampai Mei 2013 yang dilaksanakan di Laboratorium Mikrobiologi Jurusan Pendidikan Biologi Fakultas Pendidikan Matematika dan Ilmu Pengetahuan Alam Universitas Pendidikan Indonesia, Jalan Dr. Setiabudhi No. 299 Bandung.
D. Alat dan Bahan
Alat dan bahan yang digunakan dalam penelitian ini terdapat di Laboratorium Mikrobiologi Universitas Pendidikan Indonesia. Daftar alat dan bahan yang digunakan tercantum dalam lampiran 1.
E. Prosedur Penelitian
18
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
Persiapan penelitian dimulai dengan pengecekan alat dan bahan yang akan digunakan dalam penelitian. Alat-alat kaca dan plastik yang akan digunakan dicuci terlebih dahulu dan dikeringkan. Alat kemudian dibungkus dengan kertas pembungkus setelah dimasukan ke dalam plastik untuk dilakukan sterilisasi panas lembab dengan cara dimasukan kedalam autoclave selama 15-20 menit pada suhu 121 °C dan tekanan 1 atm. Selain itu dipersiapkan juga medium TSA (Trypic Soy Agar) sebagai media tumbuh bakteri A. hydrophila dan medium lainnya yang berperan dalam uji biokimia A. hydrophila selama penelitian, seperti medium RS (Rimler Shotts), sitrat agar, SIM agar, agar darah untuk uji hemolisis, medium Voges-Proskauer, MacConkey agar, dan kaldu trytofan dalam tes indol serta reagen-reagennya. Pembuatan medium dan larutan yang digunakan dalam penelitian ini seluruhnya terpapar dalam lampiran 2.
2. Isolasi Bakteri A. hydrophila dari Intestin Ikan Sehat
a. Pengambilan Sampel
Permukaan tubuh ikan dibersihkan dengan kapas yang telah dibasahi alkohol 70%. Kemudian ikan dibedah dengan menggunkaan pisau bedah steril (SNI, 2009), intestine diambil sebagai organ target, karena organ ini merupakan tempat perkembangbiakan A. hydrophila sebagai microbial flora dan mudah dibedakan dari organ pencernaan lainnya.
b. Isolasi A. hydrophila pada medium RS + novobiosin 0,005 gr/10ml
19
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
penampakkan koloni yang berwarna kuning tanpa warna hitam di tengah koloni (SNI, 2009).
c. Pemurnian Koloni
Satu koloni yang tumbuh terpisah di dalam cawan petri yang diduga A. hydrophila ditumbuhkan pada medium TSA miring dan diinkubasi pada suhu 28oC selama ±18 jam. Setelah didapatkan biakan murni, isolat bakteri tersebut diidentifikasi morfologi, biokimia, dan diteruskan dengan pengujian molekuler.
3. Identifikasi A. hydrophila secara Morfologi dan Biokimia
Karakterisasi A.hydrophila secara morfologi dan biokimia ini diawali dengan pengujian-pengujian morfologi dan biokimia sesuai Standar Nasional Indonesia (SNI 7303, 2009) yaitu pewarnaan gram, uji motilitas, uji oksidase, dan uji oksidatif-fermentatif. Sedangkan satu pengujian lainnya yaitu pengujian RS digunakan secara langsung dalam menyeleksi bakteri A. hydrophila dalam intestin ikan sehat. Selain itu dilakukan pula pengujian biokimia tambahan yang terdiri dari uji fermentasi laktosa pada medium MacConkey, deteksi hemolisis pada medium agar darah, uji indol, uji sitrat, dan uji Voges Proskakuer. Uji-uji biokimia tambahan ini dilakukan dengan harapan dalam lebih mengkarakterisasi secara spesifik sifat dari masing-masing isolat yang didapat.
a. Pewarnaan Gram
20
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
sampai merata, selanjutnya didiamkan maksimal 30 detik. Preparat dicuci dengan aquades dan dikeringkan. Kemudian larutan safranin diteteskan pada preparat sampai merata dan didiamkan selama dua menit. Selanjutnya preparat dicuci kembali dengan aquades dan dikeringkan, setelah itu morfologi bakteri diamati menggunakan mikroskop dengan perbesaran 1000x. (SNI, 2009). Hasil pewarnaan Gram ini akan menghasilkan warna ungu pada bakteri Gram positif dan warna merah pada bakteri Gram negatif. Penentuan jenis Gram ini dapat diperkuat dengan dilakukannya KOH sring test, KOH 3% diteteskan pada objek glass kemudian diambil satu ose bakteri dan diinokulasikan pada larutan KOH tersebut. Bakteri Gram negatif akan menunjukkan adanya perubahan suspensi menjadi lengket (Cappucino & Sherman, 2011).
b. Uji Motilitas
Isolat diambil dengan jarum ose lurus, dan diinokulasikan dengan menusukkan pada medium semi solid (SIM Agar) kemudian diinkubasikan pada suhu 25°C-28°C selama 18-24 jam. Reaksi positif ditandai dengan adanya pertumbuhan bakteri yang menyebar dan tidak terlihat bekas tusukan (SNI, 2009).
c. Uji Oksidasi
Kertas saring dibasahi dengan pereaksi oksidasi. Diambil satu loop isolat bakteri, kemudian digoreskan pada kertas saring yang sudah terbasahi reagen oksidasi. Reaksi oksidasi positif ditandai dengan munculnya warna biru keunguan pada goresan (SNI, 2009). Reaksi positif pada uji ini menunjukkan terdapatnya enzim oksidase pada bakteri tersebut yang penting dalam transfer elektron pada sistem aerobik (Cappucino & Sherman, 2011).
d. Uji Oksidatif- Fermentasi (O/F)
21
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
melakukan fermentasi pada kondisi anaerob. Sedangkan tabung lainnya tidak ditambahkan dengan parafin cair, hal ini bertujuan untuk mengetahui kemampuan bakteri dalam mengoksidasi dan bersifat aerobik (Cappucino & Sherman, 2011), kemudian inkubasi pada suhu 280C selama 24 jam. Reaksi positif ditandai dengan perubahan warna media pada kedua tabung dari hijau menjadi kuning (SNI, 2009).
e. Deteksi Hemolisis Aeromonas hydrophila
Sifat hemolisis A. hydrophila dapat dibuktikan dengan menumbuhkan bakteri tersebut pada medium agar darah. Medium agar darah ini menggunakan darah kuda dengan ditambahkan antibiotik ampicilin 0,01 gr/l. Satu koloni bakteri yang telah ditumbuhkan sebelumnya diambil dengan jarum ose steril dan dipurifikasi pada medium agar darah di cawan petri, kemudian inkubasi selama ± 24 jam pada suhu 370C dan diamati zona lisis yang terbentuk (Ruoff, K. L., 1995; Acumedia, 2009).
f. Uji MacConkey
Isolat bakteri diambil 1 ose menggunakan ose steril, kemudian digoreskan diatas medium agar MacConkey dan diinkubasi pada suhu 370C selama 18 jam. isolat yang dapat memfermentasi laktosa ditandai dengan warna koloni "pink rose" sedangkan bakteri yang tidak dapat memfermentasi laktosa memiliki warna koloni yang sama dengan medium (Acumedia, 2011).
g. Uji Indol
22
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
h. Uji Sitrat
Bakteri diinokulasi pada medium sitrat miring dengan jarum inokulasi steril, kemudian inkubasi selama 24-96 jam pada suhu 370C dan hasil positif ditunjukkan dengan adanya perubahan warna medium dari hijau menjadi warna biru dan hasil yang negatif ditunjukkan oleh warna medium yang tetap hijau (ASMMicrobeLibrary, 2013).
i. Uji Voges-Proskauer
Satu ose bakteri dimasukkan kedalam medium Voges Proskakuer (V-P), kemudian inkubasi pada suhu 370C selama 48 jam. Selanjutnya setelah diinkubasi,
ditambahkan Reagen Barritt’s A (alfa-napthol) dan Reagen Barritt B (kalium hidroksida) ke dalam sampel, kemudian tabung digoyang perlahan untuk aerasi, dan didiamkan ±15 menit dan pembentukan warna merah akan menunjukkan reaksi positif. Tidak ada perubahan warna atau warna tembaga menunjukkan hasil negatif (ASMMicrobeLibrary, 2013).
4. Karakterisasi A. hydrophila secara Molekuler
a. Isolasi DNA Bakteri
Isolasi DNA bakteri A. hydrophila dilakukan dengan menggunakan metode boiling. Sebanyak 1 ml PBS (Phospat Buffer Saline) dimasukkan ke tabung 1,5 ml steril kemudian dimasukkan satu ose kultur bakteri dan selanjutnya disentrifugasi pada kecepatan 5.000 rcf selama 3 menit. Supernatan pada tabung 1,5 ml dibuang dan pada pelet yang terbentuk ditambahkan 100µl TE 1X pH 8,0 dan dihomogenkan dengan alat vortex. Setelah homogen kemudian disimpan dalam air mendidih selama 10 menit. Selanjutnya disentrifugasi selama 1 menit pada kecepatan 5.000 rcf dan 100 µl lisat yang diperoleh dipindahkan ke tabung 1,5 ml baru dan ditambahkan TE dingin 1X sebanyak 900µl. Setelah itu disimpan pada suhu -20°C (Yanez et al., 2003).
b. Identifikasi Aeromonas hydrophila dengan Gen Lipase (lip)
23
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
spesifik pada A. hydrophila dan amplifikasi gen ini menunjukkan pita pada ukuran 760 pb (Cascon et al., 1996). Primer yang digunakan yaitu primer forward (5’ -AACCTGGTTCCGCTCAAGCCGTTG-3’) dan primer reverse (5’ -TTGCCTCGCCTCGGCCCAGCAGCT-3’) (Cascon et al., 1996). PCR dilakukan dengan komposisi ½ volume reaksi menurut protocol Master Mix KAPPA 2GTM Fast Ready Mix 2X. Komposisi reaksi PCR tersebut dapat dilihat pada tabel 3.1.
Tabel 3.1 Komposisi reaksi amplifikasi gen lipase pada A. hydrophila
Bahan Konsentrasi awal
Konsentrasi
akhir
Volume 1x
reaksi (µl)
Volume
1/2x reaksi
(µl)
2X Kappa 2G fast ready mix 2x 1x 12,5 6,25
Primer forward lipase 10 µM 0,2 µM 0,5 0,25
Primer reverse lipase 10 µM 0,2 µM 0,5 0,25
Air deion steril 9,5 4,75
DNA templat 2 1
Total volume 25 12,5
Proses amplifikasi gen lip diawali dengan denaturasi awal pada suhu 950C selama 5 menit, kemudian diikuti dengan 28 kali siklus yang tiap siklusnya terdiri dari tahap denaturasi pada suhu 950C selama 15 detik, annealing pada suhu 590C selama 15 detik, elongasi pada suhu 720C selama 30 detik, dan diakhiri dengan
final elongasi pada suhu 720C selama 10 menit. Program PCR dapat dilihat pada
gambar 3.1. Hasil amplifikasi gen lipase ini akan disimpan pada suhu -200C.
24
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
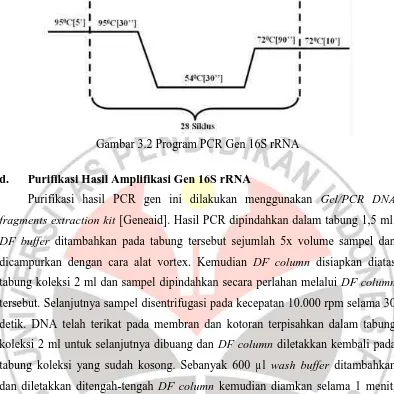
c. Amplifikasi Gen 16S rRNA dengan Metode PCR
Proses amplifikasi gen ini dilakukan dengan metode PCR sesuai dengan yang dilakukan dalam penelitian Sahu et al (2012). Primer yang digunakan yaitu
primer universal forward 27F (5’-AGAGTTTGATCCTGGCTCAG-3’) dan
primer universal reverse 1492R (5’-GGTTACCTTGTTACGACTT-3’) (Lane, 1991; Hill et al., 2003). Hasil amplifikasi dari gen ini memiliki ukuran target pita 1500 pb. Amplifikasi dilakukan dengan komposisi PCR untuk 50 µl volume reaksi menurut protokol Promega, 20 µl dari hasil amplifikasi digunakan sebagai sampel untuk sikuensing. Komponen PCR yang digunakan berbeda dengan komponen PCR yang digunakan dalam mengamplifikasi gen lip, hal ini dikarenakan target dari amplifikasi gen memiliki ukuran lebih dari 1000 pb sehingga komponen PCR yang berasal dari Promega (Go Taq) yang cocok dalam mengamplikasinya. Komposisi reaksi amplifikasi dalam penelitian ini dapat dilihat pada tabel 3.2.
Tabel 3.2 Komposisi reaksi amplifikasi gen 16S rRNA
Bahan Konsentrasi selama 5 menit, kemudian diikuti dengan 28 kali siklus yang berlangsung dengan tahap denaturasi pada suhu 950C selama 30 detik, annealing pada suhu 540C selama 30 detik, elongasi pada suhu 720C selama 90 detik, dan diakhiri dengan
final elongasi pada suhu 720C selama 10 menit. Program PCR dapat dilihat pada
25
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
Gambar 3.2 Program PCR Gen 16S rRNA
d. Purifikasi Hasil Amplifikasi Gen 16S rRNA
26
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
e. Mengukur Kemurnian dan Konsentrasi DNA
Kemurnian dan konsentrasi DNA hasil amplifikasi yang telah dipurifikasi dianalisis dengan menggunakan spektrofotometer UV dengan panjang gelombang 260 nm dan 280 nm. Kemurnian DNA dapat dilihat dari perbandingan absorbansi suspensi DNA pada panjang gelombang 260 nm terhadap 280 nm. Nilai absorbansi pada panjang gelombang 260 nm dapat dikonversikan menjadi konsentrasi dengan rumus:
Gambar 3.3 Rumus Perhitungan Konsentrasi DNA
f. Deteksi Gen Virulen
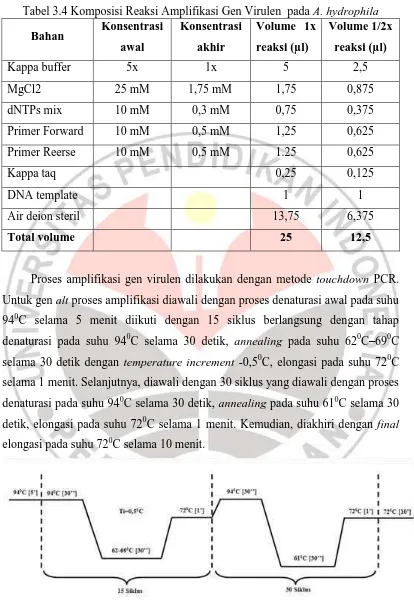
Gen Virulen pada A. hydrophila dapat diamplifikasi dengan metode touchdown yaitu melakukan replikasi dengan suhu annealing yang berbeda-beda pada rentang suhu tertentu (Syadza, 2012). Terdapat tujuh gen virulen yang digunakan dalam penelitian ini, yaitu Act, AopB, AscV, Alt, AerA, Ast, dan AexT. Primer yang digunakan dalam amplifikasi dapat dilihat pada tabel 3.3. Komposisi PCR yang digunakan adalah ½ reaksi menurut protokol Mix KAPPA 2GTM. Komposisi reaksi amplifikasi dalam penelitian ini dapat dilihat pada tabel 3.4.
Tabel 3.3 Primer Gen Virulen yang Digunakan dalam Penelitian
Primer Sikuen (5‘ - 3’) Pustaka
27
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
Tabel 3.4Komposisi Reaksi Amplifikasi Gen Virulen pada A. hydrophila
Bahan Konsentrasi awal
Konsentrasi
akhir
Volume 1x
reaksi (µl)
Volume 1/2x
reaksi (µl)
Kappa buffer 5x 1x 5 2,5
MgCl2 25 mM 1,75 mM 1,75 0,875
dNTPs mix 10 mM 0,3 mM 0,75 0,375
Primer Forward 10 mM 0,5 mM 1,25 0,625
Primer Reerse 10 mM 0,5 mM 1.25 0,625
Kappa taq 0,25 0,125
DNA template 1 1
Air deion steril 13,75 6,375
Total volume 25 12,5
Proses amplifikasi gen virulen dilakukan dengan metode touchdown PCR. Untuk gen alt proses amplifikasi diawali dengan proses denaturasi awal pada suhu 940C selama 5 menit diikuti dengan 15 siklus berlangsung dengan tahap denaturasi pada suhu 940C selama 30 detik, annealing pada suhu 620C–690C selama 30 detik dengan temperature increment -0,50C, elongasi pada suhu 720C selama 1 menit. Selanjutnya, diawali dengan 30 siklus yang diawali dengan proses denaturasi pada suhu 940C selama 30 detik, annealing pada suhu 610C selama 30 detik, elongasi pada suhu 720C selama 1 menit. Kemudian, diakhiri dengan final elongasi pada suhu 720C selama 10 menit.
28
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
Sedangkan untuk keenam gen virulen lainnya, yaitu act, aopB, aerA, ascV,
aexT, dan ast, PCR dilakukan dengan program suhu awal denaturasi 940C selama
5 menit, diikuti dengan 17 siklus yang terdiri dari tahap denaturasi pada suhu 940C selama 30 detik, annealing 540C-620C selama 30 detik dengan temperature
increment -0,50C, elongasi pada suhu 720C selama 1 menit. Selanjutnya, diawali
dengan 28 siklus yang diawali dengan proses denaturasi pada suhu 940C selama 30 detik, annealling pada suhu 530C selama 30 detik, elongasi pada suhu 720C selama 1 menit. Kemudian, diakhiri dengan final elongasi pada suhu 720C selama 10 menit.
Gambar 3.5 Program PCR touchdown gen virulen act, aopB, aerA, ascV, aexT, dan ast (Wulandari, 2012 dan Syadza, 2012).
g. Elektroforesis Hasil PCR Gen Lipase, Gen 16S rRNA, dan Gen Virulen
Gel agarosa 1,5% dalam 0,5x TBE untuk elektroforesis gen lipase dan gen 16S Rrna serta 1,4% dalam 0,5x TBE untuk elektroforesis hasil amplifikasi gen virulen dibuat terlebih dahulu sebelum memulai tahapan elektroforesis. Larutan didihkan hingga agarosa larut sempurna. Baki gel agarosa disiapkan dan sisir elektroforesis dipasang disalah satu ujung baki. Larutan agarosa dihomogenkan, kemudian dituangkan kedalam baki gel agarosa. Larutan dibiarkan hingga
berubah menjadi gel yang padat. Selanjutnya diambil 3 μl DNA, kemudian
campur dengan 1 μl "loading dye" dan dimasukkan ke dalam sumuran gel
29
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
pada tegangan 100 volt dengan buffer 0,5x TBE (0,04 M Tris-asetat dan 0,001 M EDTA) sebagai running buffer, sedangkan untuk gen virulen dielektroforesis selama 20 menit pada tegangan 100 volt.
Hasil elektroforesis diwarnai dengan merendam gel agarosa dalam larutan ethidium bromide selama 3 menit. Kemudian gel dicuci dengan air deion steril selama 5 menit. Selanjutnya hasil elektroforesis yang sudah terwarnai diamati dengan alat UV transluminator dan didokumentasikan menggunakan kamera digital Canon tipe Ixus dengan modus hitam-putih.
5. Cryoreservasi
Bakteri A. hydrophila yang didapat dari intestin ikan nila, mas, tawes, gurame, dan lele dimasukkan ke dalam cryo buffer. Satu loop inokulasi penuh berisi isolat bakteri dimasukkan dalam tabung 1,5 ml yang berisikan 600 µl Cryo
buffer, kemudian disimpan pada suhu -200C.
6. Sikuensing
Proses sikuensing DNA dilakukan dengan menggunakan mesin sikuencer BigDye Applied Biosystem model 3730 yang dilakukan di Macrogen inc., Korea.
7. Analisis Data Bioinformatika
30
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
F. Alur Penelitian
Karakterisasi secara morfologi dan biokimia sesuai SNI dan deteksi hemolisis
Tahap persiapan
Pengumpulan ikan
Isolasi Bakteri A. hydrophila pada medium selektif RS
Analisis data Isolasi DNA
PCR Gen spesifik (gen lipase)
PCR Gen 16S rRNA
Sikuensing
Uji Biokimia tambahan +
+
Deteksi gen virulen
64
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
Universitas Pendidikan Indonesia | repository.upi.edu| perpustakaan.upi.edu BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Dari hasil penelitian yang dilakukan dapat disimpulkan bahwa Aeromonas yang diisolasi dari intestin lima jenis ikan sehat seluruhnya merupakan jenis A.hydrophila dan kedelapan isolat bakteri A. hydrophila yang dijadikan sampel dalam penelitian ini memiliki hubungan kekerabatan yang sangat dekat. Setiap A.hydrophila menunjukkan karakter yang berbeda-beda yang dapat dilihat pada hasil uji biokimia dan deteksi gen lip secara molekuler. Namun secara umum A. hydrophila yang berhasil diisolasi merupakan Gram negatif dengan bentuk basil pendek, positif terhadap uji oksidase, merupakan bakteri fakultatif anaerob, bersifat motil dan memiliki kemampuan β-hemolisis. Sedangkan dari hasil pendeteksian gen virulen, Aeromonas hydrophila yang didapat dimungkinkan seluruhnya tidak patogen terhadap ikan.
B. Saran
65
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
Universitas Pendidikan Indonesia | repository.upi.edu| perpustakaan.upi.edu DAFTAR PUSTAKA
Abbott, S.L., Wendy K. W., Cheung, And Janda, J. M. (2003). The Genus Aeromonas: Biochemical Characteristics, Atypical Reactions, And Phenotypic Identification Schemes. Journal Of Clinical Microbiology. 41: No. 6
Acumedia. (2009). Blood Agar Base, Improved (7268) [Online], Neogen
Corporation PI 7268, Rev 04. Tersedia:
http://www.neogen.com/Acumedia/pdf/ProdInfo/7268_PI.pdf [2 Maret 2013].
Acumedia. (2011). MacConkey agar (7102) [Online] PI7102, Rev 5. Tersedia: http://www.neogen.com/Acumedia/pdf/ProdInfo/7102_PI.pdf [2 Maret 2013].
Arthi, K., Appalaraju, & B. Parvathi, S. (2003). Vancomycin sensitivity and KOH string test as an alternative to gram staining of bacteria [Online]. Indian journal of medical microbiology. 21,(2),121-123. Tersedia: http://www.ijmm.org/text.asp?2003/21/2/121/7989.
ASMMicrobelibrary. 2013. Indol test Protocol [Online]. Tersedia: http://www.microbelibrary.org/component/resource/laboratory-test/3202-indole-test-protocol [5 Maret 2013].
ASMMicrobelibrary. 2013. Citrate test Protocol [Online]. Tersedia: http://www.microbelibrary.org/component/resource/laboratory-test/3202-citrate-test-protocol [5 Maret 2013].
ASMMicrobelibrary. 2013. Methyl Red and Voges-Proskauer Test Protocols [Online]. Tersedia: http://www.microbelibrary.org/component/resource/
laboratory-test/3202 methyl-red-and-voges-proskauer-test-protocol [5 Maret 2013].
Aulia. (2012). Medium Pertumbuhan Bakteri [Online]. Cikarang: Bapelkes. Tersedia: http://bapelkescikarang.or.id/bapelkescikarang/index.php?view=
article&type=ra&catid=39%3Akesehatan&id=595%3Amedium-pertumbuhanbakteri&format=pdf&option=com_content&Itemid=15 [26 Januari 2013].
66
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
Universitas Pendidikan Indonesia | repository.upi.edu| perpustakaan.upi.edu
Awan, M.B., Ahmed, M., Maqbool, Bari, A., Saad, A.M. (2005). Biochemical Characterization Of The Aeromonas Species Isolated From Food And Environment. Pak J Physiol, 1: 1-2.
Bryn, K., Ulatrup, J.C., and Stbrmer, F.C. (1973). Effect of Acetate upon the Formation of Acetoin in Klebsiella and Enterobacter and its Possible Practical Application in a Rapid Voges-Proskauer Test. Applid Microbiology, American Society for Microbiology, 25: 3.
Cappuccino, J. and Sherman, N. (2011). Microbioloy: A Laboratory Manual. California: the benjamin comings publishing company. Inc.
Carnahan, A. M., M. O'Brien, Joseph,S. W., and Colwell, R. R,. (1988). Enzymatic characterization of three aeromonas species using API Peptidase, API "Osidase," and API Esterase test kits. Diagnostic Microbiology & Infectious Disease 10(4):195-203.
Carvalho-Castro, G.A., Lopes, C.O., Leal, C.A.G., Cardoso, P.G., Leite, R.C., & Figueiredo, H.C.P,. (2010). Detection of type III Secretion System Genes in Aeromonas hydrophila their Relationship with Virulence in Nile tilapia.
144. (6),371-376.
Cascon, A., Juan, A., Hernanz, C., Mari´A, S., Ferna, N., and Germa´N, N. (1996). Identification Of Aeromonas hydrophila Hybridization Group 1 By Pcr Assays. Applied And Environmental Microbiology, American Society For Microbiology. 62: 4.
Case, R.J., Boucher, Y., Dahllo, I., Holmstro¨m, C.W., Doolittle, F., and Kjelleberg, S. (2007). Use of 16S rRNA and rpoB Genes as Molecular Markers for Microbial Ecology Studies. Applied And Environmental Microbiology. 73: 1.
Chaco’n, M.R., Soler, L., Groisman, E.A., Guarro, J., & Figueras, M.J,. (2004). Type III Secretion System Genes in Clinical Aeromonas Isolates. Journal of Clinical Microbiology. 42(4)3.1285-1287.
Chen H.Q. and Lu C.P. (1991). Study on pathogen of bacterial hemorrhagic
septicemia of rice eel. Chinese Journal of Zoonoses. 7(4):21–23.
Chopra, A. K., Houston, C. W., Genaux, C. T., Dixon, J. D., and Kurosky, A. (1986). Evidence for production of an enterotoxin and cholera toxin cross-reactive factor by Aeromonas hydrophila. Journal of Clinical Microbiology
24(4):661-664.
67
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
Universitas Pendidikan Indonesia | repository.upi.edu| perpustakaan.upi.edu
Chopra, A. K., Xu, X., Ribardo, D., Gonzalez, M., Kuhl, K., Peterson, J. W., and Houston, C. W. (2000). The cytotoxic enterotoxin of Aeromonas hydrophila induces proinflammatory cytokine production and activates arachidonic acid metabolism in macrophages. Infection & Immunity 68(5):2808-2818. Cipriano, R.C. (2001). Aeromonas Hydrophila And Motile Aeromonad
Septicemias Of Fish. U.S. Geological Survey, Leetown Science Center, National Fish Health Research Laboratory.
Cynthia, S. (2007). Lab Manual untuk Mikrobiologi untuk Ilmu Kesehatan [Online]. Kalamazoo Valley Community College. Tersedia:
http://onbonsai.com/201110/agar-darah-bap-medium-pertumbuhan-bakteri.htm. [2 Agustus 2013].
Daskalov, H. (2005). The importance of Aeromonas hydrophila in food safety. Elsevier. Food Control 17: 474-483.
Dewi, C.L.H. (2012). Analisis Biomolekuler Gen Internal Transcribed Spacer (ITS) dalam Studi Filogenetik Zingiber loerzingii Valeton (Zingiberaceae) [Online]. Skripsi Sarjana pada FMIPA IPB Bogor. Tersedia: http://repository.ipb.ac.id/bitstream/handle/123456789/58614/G12clh.pdf. [15 Agustus 2013].
Elwitigala, J.P., Higgs, D.S., Namnyak, S., White, J.W., Yaneza, A. (2005). Septic arthritis due to Aeromonas hydrophila: case report and review of the literature. Int J Clin Pract;59:121e4.
EPA Office of Water. (2006). Aeromonas: Human Healh Criteria Document. Health and Ecological Criteria Division Office of Science and Technology Office of Water U. S. Environmental Protection Agency Washington.
Erdem, B., Kariptaş, E., Cil, E., Işik, K. (2011). Biochemical Identification And Numerical Taxonomy Of Aeromonas spp. Isolated From Food Samples In Turkey. Turk J Biol 35: 463-472
Gardenia, L., Koesharyani, L., Supriyadi, H., & Mufidah, T.,. (2010). Aplikasi Aeromonas hydrophila Penghasil Aerolisin dengan Menggunakan Polimerase Chain Reaction (PCR). Prosiding forum Inovasi Teknologi Akuakultur. Pusat Riset Perikanan Budidaya.
Gonzalez, C. J., J. A. Santos, M. L. Garcia-Lopez, N. Gonzalez, and A. Otero. (2001). Mesophilic aeromonads in wild and aquacultured freshwater fish. Journal of Food Protection 64(5):687-691.
Gonzalez, J. M. & Saiz-Jimenez, C. (2005). A simple fluorimetric method for the
68
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
Universitas Pendidikan Indonesia | repository.upi.edu| perpustakaan.upi.edu
microorganisms by thermal denaturation temperatures. Extremophiles 9: 75-79.
Guntly, L. (2007). Aeromonas hydrophila [Online]. Tersedia: http://web.mst.edu/~microbio/bio_221/2007/a_hydrophila_2.htm. [20 Maret 2013].
Harikrishnan, R., Nisha, R. M., and Balasundaram, C. (2003). Hematological and biochemical parameters in common carp, Cyprinus carpio, following herbal treatment for Aeromonas hydrophila infection. Aquaculture, 221:41e50. Harikrishnan, R., Balasundaram, C., and Heo, M-S.,. (2011). Impact of plant
products on innate and adaptive immune system of cultured finfish and shellfish. Elsivier, Aquaculture 317: 1-15.
Heuzenroeder, M. W., C. Y. F. Wong, and R. L. P. Flower. (1999). Distribution of two hemolytic toxin genes in clinical and environmental isolates of Mariana. D.,. (2008). Analisis Filogenetika Molekuler Pada Phyllanthus Niruri L. (Euphorbiaceae) Menggunakan Urutan Basa DNA Daerah Internal Transcribed Spacer (ITS). Jurnal Matematika & Sains ITB. 13: 16-21.
Hill, K.E., Davies, C.E., Wilson, M.J., Stephens, P., Harding, K.G., and Thomas, D.W.,. (2003). Molecular analysis of the microflora in chronic venous leg ulceration. Journal of Medical Microbiology, 52: 365-369.
Himedia. (2011). RS medium base. HiMedia Laboratories [Online]. Swastik Disha Business Park, Via Vadhani Ind. Est. Tersedia: https://us.vwr.com/stibo/hi_res/8113202.pdf [18 Desember 2012].
Illanchezian, S., Jayaraman, S.K., Manoharan, M.S., Valsalam, S.,. (2010). Virulence and Cytotoxicity of Seafood Borne Aeromonas hydrophila. Brazilian Journal of Microbiology. 41:978-983
Janda, J. M., and Abbott, S. L. (1998). Evolving concepts regarding the genus Aeromonas: an expanding Panorama of species, disease presentations, and unanswered questions. Clinical Infectious Diseases 27(2):332-344.
69
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
Universitas Pendidikan Indonesia | repository.upi.edu| perpustakaan.upi.edu
Kingombe, C. I., Huys, G., Tonolla, M., Albert, M.J., Swings, J., Peduzzi, R., & Jemmi, T.,. (1999). PCR detection, characterization, and distribution of
virulence genes in Aeromonas spp. Appl. Environ. Microbiol. 65:5293–
5302.
Kingombe, C. l., D’Aoust, J. Y., Huys, G., Hofmann, L., Rao, M., et al. (2010). Multiplex PCR method for detection of three Aeromonas enterotoxin genes. Appl Environ Microbiol 76: 425–433.
Kupfer, M., Kuhnert, P., Korczak, B. M., Peduzzi, R., and Demarta, A.,. (2006). Genetic relationships of Aeromonas strains inferred from 16S rRNA, gyrB
and rpoB gene sequences. Int. J. Syst. Evol. Microbiol. 56:2743–2751.
Lane, D.J. (1991). 16/23S rRNA sequencing: In Stackebrandt, E and Goodfellow, M (eds) Nucelic acid techniques in bacterial systematics. John Wiley and Sons, Chichester, New York, Brisbane, Toronto and Singapore. 115−175.
Lee, S., Kim, S., Oh, J., and Lee, Y.,. (2000). Characterization of Aeromonas hydrophila Isolated from Rainbow Trouts in Korea. The Journal of Microbiology, 38(1): 1-7.
Li, J., Ni, X.D., Liu, Y.J., & Lu, C.P.,. (2011). Detection of three virulence genes alt, ahp and aerA in Aeromonas hydrophila and their relationship with
actual virulence to zebrafish. J. Appl. Microbiol. 110:823–830.
Majeed, K. N., and Mac Rae I. C.,. (1991). Experimental evidence for toxin production by Aeromonas hydrophila and Aeromonas sobria in a meat extract at low temperatures. International Journal of Food Microbiology
12(2-3):181-188.
Mangunwardoyo, W., Ismayasari, R., Riani, E.,. (2010). Uji Patogenisitas dan Virulensi Aeromonas hydrophila Stanier pada Ikan Nila (Oreochromis niloticus Lin.) melalui Postulat Koch. J. Ris. Akuakultur, 5 : 245-255. Martin, J. (2004). Aeromonas hydrophila [Online]. Tersedia:
http://web.mst.edu/~microbio/BIO221_2004/A_hydrophila.htm. [20 Agustus 2013]
Martino, M. E., Fasolato, L., Montemurro, F., Rosteghin, M., Manfrin, A., Patarnello, T., Novelli, E., & Cardazzo, B.,. (2011). Determination of Microbial Diversity of Aeromonas Strains on the Basis of Multilocus Sequence Typing, Phenotype, and Presence of Putative Virulence Genes. American Society for Microbiology. 77: 14.
70
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
Universitas Pendidikan Indonesia | repository.upi.edu| perpustakaan.upi.edu
Martinez-Murcia, A.J., Benlloch, S., and Collins, M.D.,. (1992). Phylogenetic Interrelationships Of Members Of The Genera Aeromonas And Plesiomonas As Determined By 16s Ribosomal Dna Sequencing: Lack Of Congruence With Results Of Dna-Dna Hybridizations. International Journal Of Systematic Bacteriology. 412-421.
Nam, I. Y., and Joh. K.,. (2007). Rapid Detection of Virulence Factors of Aeromonas Isolated from a Trout Farm by Hexaplex PCR. The Journal of Microbiology, The Microbiological Society of Korea, 45: 4.
Nielsen, M. E., Høi1, L., Schmidt, A. S., Qian, D., Shimada, T., Shen, J. Y., Larsen, J. L. (2001). Is Aeromonas hydrophila the dominant motile Aeromonas species that causes disease outbreaks in aquaculture production in the Zhejiang Province of China?. Diseases Of Aquatic Organisms 46: 23–29.
Ottaviani, D., Santarelli, S., Bacchiocchi, S., Masini, L., Ghittino, C., Bacchiocchi, I.,. (2006). Occurrence and characterization of Aeromonas
spp. in mussels from the Adriatic sea. Food Microbiology 23: 418–422.
Ottaviani, D, Parlani C., Cittero B., Massini L, Leoni F., Canonico C., Sabatini L., Bruscolini F., Pianetti A. (2011). Putative virulence properties of Aeromonas strains isolated from food, environmental and clinical sources in Italy: A comparative study. International Journal of Food Microbiology
144 : 538–545.
Pangastuti, A. (2006). Species definition of procaryotes based on 16S rRNA and protein coding genes sequence. Biodiversitas Issn: 1412-033x, Volume 7. Paniagua, C., Rivero, O., Anguita, J., and Naharro, G.,. (1990). Pathogenicity
factors and virulence for rainbow trout (Salmo gairdneri) of motile
Aeromonas spp. isolated from a river. J. Clin. Microbiol. 28:350–355.
Pelczar, M. J., and Chan, E. C. S., (2005). Dasar-dasar mikrobiologi. Jakarta: Penerbit Universitas Indonesia (UI-Press).
Pemberton, J. M., Kidd, S. P., and Schmidt, R.,. (1997). Secreted enzymes of Aeromonas. FEMS Microbiology Letters 152(1):1-10.
71
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
Universitas Pendidikan Indonesia | repository.upi.edu| perpustakaan.upi.edu
Rollof, J., Braconier, H., Soderstrom, C. & Nilsson-ehle, P.,. (1988). Interference of Staphylococcus aureus lipase with human granulocyte function. Eur J Clin Microbiof Infect Dis 7: 505-510.
Sahu, I. B.K., Das, N.P., Marhual, J., Pradhan, D.R., Sahoo, B., and Mishra, K.,. (2012). Phenotypic and Genotypic Methods for Identifications of Aeromonas hydrophila Strains from Carp Labeo rohita and their Virulence Study. International Journal of Fisheries and Aquaculture Sciences. ISSN 2248-9975, 2:2. International Research Publication House
Scabra, A.R. (2010). Perbedaan Ikan Sehat dan Ikan Sakit secara Internal dan
Eksternal [Online]. Tersedia: http://andrescabra.student.umm.ac.id/
download-aspdf/umm_blog_ article_ 29.pdf. [3 September 2013].
Seshadri, R., Joseph, S. W., Chopra, A. K., Sha, J., Shaw, J., Graf, J., Haft, D., Wu, M., Ren, Q. & other authors. (2006). Sequence of Aeromonas
hydrophila ATCC 7966T: jack of all trades. Bacteriol 188: 8272–8282.
Sha, J., Kozlova, E. V., and Chopra A. K.,. (2002). Role of various enterotoxins in Aeromonas hydrophila induced gastroenteritis: generation of enterotoxin gene-deficient mutants and evaluation of their enterotoxic activity. Infection & Immunity 70(4):1924-1935.
Sha, J., Pillai, Lakshmi, F., Amin, A., Galindo, C. L., Erova, T. E., and Chopra, A. K.,. (2005). The Type III Secretion System and Cytotoxic Enterotoxin Alter the Virulence of Aeromonas hydrophila. The University of Texas Medical Branch, Galveston, American Society for Microbiology. 73: No. 10.
Singh, V., Chaudhary, D.K., Mani, I.,. (2012). Molecular characterization and modeling of secondary structure of 16S rRNA from Aeromonas veronii. International journal of applied biology and pharmaeutical technology, 3, ISSN 0976-4550.
SNI. (2009). Metode identifikasi Aeromonas hydrophila Secara Biokimia. BSNI.
Stackebrandt, E. and Goebel, B.M.,. (1995). A place for DNA-DNA reassociation and 16S rRNA sequence analysis in the present species definition in bacteriology. International Jurnal of Systematic Bacteriology 44: 846-849. Swaminathan, T. J., Rathore, G., Abidi, R., and Kapoor, D.,. (2004). Detection of
Aeromonas hydrophila by polymerase chain reaction. Indian J. Fish., 51(2) : 251-254.
72
Maesaroh, 2013
Analisis Filogenetika Isolat Bakteri Aeromonas Hydrophila Dari Ikan Sehat Menggunakan Gen 16s rRNA
Universitas Pendidikan Indonesia | repository.upi.edu| perpustakaan.upi.edu
Taylor, W. I., and Harris, B.,. (1965). Isolation of shigellae.II. Comparison of plating media and enrichment broths. Amer. J. Clin. Pathol. 44:476-479. Trower, C. J., Abo, S., Majeed, K. N., and von Itzstein, M.,. (2000). Production of
an enterotoxin by a gastro-enteritis-associated Aeromonas strain. Journal of Medical Microbiology 49(2):121-126.
Vilches, S., Jimenez, N., Tomas, J. M., & Merino, S.,. (2009). Aeromonas hydrophila AH-3 Type 3 Secretion System Expression and Reulatory Network. 75.(11). 6382-6392.
Ward, D. M. (1998). A natural species concepts for procaryotes. Current Opinion in Microbiology 1: 271-277.
Weisburg, W.G., Barns, S.M., Pelletier, D.A., Lane, D.J., (1991). 16S ribosomal
DNA amplification for phylogenetic study. J. Bacteriol. 173: 697–703.
Wulandari, R. (2012). Deteksi Gen Virulen Dan Uji Patogenisitas Bakteri Aeromonas Hydrophila Isolat Air Kolam Sukabumi Pada Ikan Gurami (Osphronemus Gouramy). Skrisi Sarjana pada FPMIPA UPI Bandung: tidak diterbitkan.
Xu, X.J., Ferguson, M. R., Popov, V. L., Houston, C. W., Peterson, J. W., and Chopra, A. K.,. (1998). Role of a cytotoxic enterotoxin in Aeromonas-mediated infections: Development of transposon and isogenic mutants. Infect. Immun. 66(8):3501-3509.
Yanez, M. A., Catalan, V., Apraiz, D., Figueras, M.J., and Martinnez-Murcia, A.J.,. (2003). Philogenetic analysis of member of the genus Aeromonas based on gyrB gene sequences. International Journal of Systematic and Evolutionary Microbiology, 53:875-883.
Yuwono, T. (2005). Biologi Molekuler. Erlangga: Jakarta.