PERBANDINGAN AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL BUAH JAMBU BIJI, JAMBU BIJI MERAH, DAN
JAMBU BIJI KRISTAL
SKRIPSI
OLEH :
DITHA AZLINA SEMBIRING NIM 151501189
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PERBANDINGAN AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL BUAH JAMBU BIJI, JAMBU BIJI MERAH, DAN
JAMBU BIJI KRISTAL
SKRIPSI
OLEH :
DITHA AZLINA SEMBIRING NIM 151501189
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2019
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara
KATA PENGANTAR
Puji dan syukur atas kehadirat Allah yang Maha Kuasa yang telah melimpahkan rahmat karunia dan ridhoNya, sehingga penulis dapat menyelesaikan skripsi yang berjudul “Perbandingan Aktivitas Antioksidan Ekstrak Etanol Buah Jambu Biji, Jambu Biji Merah dan Jambu Biji Kristal”.
Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Penulis menyampaikan terima kasih kepada Dekan Fakultas Farmasi Universitas Sumatera Utara, Prof. Dr. Masfria, M.S., Apt., yang telah memberikan bantuan dan fasilitas selama masa pendidikan. Ibu Dra. Tuty Roida Pardede, M.Si., Apt, yang telah membimbing dengan penuh kesabaran, tulus dan ikhlas selama penelitian dan penulisan skripsi ini berlangsung. Bapak Prof. Dr. Jansen Silalahi, M.App.Sc., Apt., dan Ibu Marianne, S.Si, M.Si., Apt., selaku dosen penguji yang telah memberikan kritik, saran dan arahan kepada penulis dalam menyelesaikan skripsi ini. Bapak dan Ibu staf pengajar Fakultas Farmasi Universitas Sumatera Utara yang telah mendidik selama perkuliahan dan Bapak Alm. Dr. Kasmirul Ramlam Sinaga, M.S., Apt dan Ibu Lia Laila S. Farm, M.Sc., Apt selaku penasehat akademik yang selalu memberi bimbingan, perhatian dan motivasi kepada penulis selama masa perkuliahan.
Penulis juga mengucapkan terima kasih dan penghargaan yang tulus kepada kedua orangtua, Ayahanda M. Irwansyah Sembiring dan Ibunda Sabarina Tarigan, serta adik Alya Dwi Irawan Sembiring dan Fachry Ahmad Fairuz Sembiring yang telah memberikan cinta dan kasih sayang, do’a, semangat, dorongan dan pengorbanan baik moril maupun materil kepada penulis selama ini.
Penulis juga mengucapkan terima kasih kepada Pemerintahan Mahasiswa Universitas Sumatera Utara, Pemerintahan Mahasiswa Fakultas Farmasi, Incomphasco, yang banyak mengajarkan manajemen waktu dan percaya diri kepada penulis. Terima kasih juga penulis ucapkan kepada sahabat Benzena;
Karin, Anggie, Cindi, Wilda dan Afrah yang telah banyak memberikan motivasi, saran dan dukungan baik dalam perkuliahan maupun selama penulisan skripsi, sahabat Tengkong; Lulu, Oka, Kartika, Risky, Aldoni, Anggia dan Hanafi yang selalu memberikan dukungan kepada penulis, sahabat elutuli07 yang selalu memberikan keceriaan dan Asisten Laboratorium Statistika serta sahabat-sahabat terbaik stambuk 2015 Fakultas Farmasi USU atas kebersamaan, perhatian, do’a, dorongan, semangat serta cinta yang diberikan kepada penulis selama ini, hingga akhirnya penulis dapat menyelesaikan skripsi ini. Penulis juga banyak dibantu oleh orang-orang yang sabar dan ikhlas yang tidak dapat disebutkan satu persatu sehingga skripsi ini dapat selesai dengan baik.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini masih jauh dari kesempurnaan, oleh karena itu dengan segala kerendahan hati, penulis menerima kritik dan saran demi kesempurnaan skripsi ini. Akhirnya, penulis berharap semoga skripsi ini dapat memberi manfaat bagi kita semua.
SURAT PERNYATAAN ORISINALITAS
Saya yang bertanda tangan di bawah ini:
Nama : Ditha Azlina Sembiring
Nomor Induk Mahasiswa : 151501189
Program Studi : Sarjana Farmasi
Judul Skripsi : Perbandingan Aktivitas Antioksidan Ekstrak Etanol Buah Jambu Biji, Jambu Biji Merah dan Jambu Biji Kristal
Dengan ini menyatakan bahwa skripsi yang saya buat adalah asli karya sendiri dan bukan plagiat. Apabila di kemudian hari diketahui skripsi saya tersebut terbukti plagiat karena kesalahan sendiri, maka saya bersedia diberi sanksi apapun oleh Program Studi Sarjana Farmasi Fakultas Farmasi Universitas Sumatera Utara. Saya tidak akan menuntut pihak manapun atas perbuatan saya tersebut.
Demikian surat pernyataan ini saya perbuat dengan sebenarnya dan dalam keadaan sehat.
PERBANDINGAN AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL BUAH JAMBU BIJI, JAMBU BIJI MERAH, DAN JAMBU BIJI KRISTAL
ABSTRAK
Latar Belakang: Penyakit degenerative telah menjadi permasalahan utama bagi tiap negara. Penyakit degenerative dapat dicegah dengan antioksidan. Tetapi tubuh tidak mempunyai antioksidan dalam jumlah berlebih sehingga membutuhkan antioksidan eksogen. Salah satu antioksidan eksogen alami adalah buah jambu.Buah jambu biji kaya akan karbohidrat, vitamin C, serta merupakan sumber zat besi yang baik dan sumber kalsium, fosfor dan vitamin A. Komposisi senyawa-senyawa ini diduga dapat mencegah terbentuknya radikal bebas dalam tubuh atau sebagai antioksidan serta diabetes melitus, demam berdarah dan diare.
Tujuan: Untuk mengetahui aktivitas antioksidan dari ekstrak etanol buah jambu biji, jambu biji kristal dan jambu biji merah.
Metode: Pengujian aktivitas antioksidan dari jambu biji (Psidium guajava) dilakukan dengan menggunakan metode 1,1-diphenyl-2-picryhydrazyl (DPPH) dengan alat spektrofotometer UV-Visibel .
Hasil:Hasil skrining fitokimia serbuk simplisia mengandung senyawa flavonoiddan tanin. Hasil pengukuran menunjukkan bahwa aktivitas antioksidan dari ekstrak etanol jambu biji, jambu biji kristal dan jambu biji merah kuat yaitu sebesar 62,03 µg/ml, 59,64 µg/ml., 56,93 µg/ml. Hasil pengukuran aktivitas antioksidan dari vitamin C sangat kuat yaitu sebesar 4 µg/ml. Hasil karakterisasi simplisia buah jambu biji diperoleh kadar air 8,67%, kadar sari larut air 55,31%, kadar sari larut etanol 29,48%, kadar abu total 7,46%, kadar abu tidak larut asam 2,37%. Hasil karakterisasi simplisia buah jambu kristal diperoleh kadar air 7,99%, kadar sari larut air 57,03%, kadar sari larut etanol 29,61%, kadar abu total 7,12%, kadar abu tidak larut asam 2,27%. Hasil karakterisasi simplisia buah jambu biji merah diperoleh kadar air 9,33%, kadar sari larut air 57,26%, kadar sari larut etanol 30,38%, kadar abu total 7,45%, kadar abu tidak larut asam 2,01%.
Kesimpulan: Berdasarkan hasil penelitian yang dilakukan dapat disimpulkan bahwa ekstrak etanol jambu biji memiliki aktivitas sebagai antioksidan dan aktivitas antioksidan ekstrak etanol jambu biji lebih lemah dibandingkan vitamin C.
Kata Kunci: jambu biji, antioksidan, DPPH, ekstrak etanol, Psidium guajava
COMPARISON OF ANTIOXIDANT ACTIVITIES ETHANOL EXTRACT FROM GUAVA, RED GUAVA AND PEARL GUAVA
ABSTRACT
Background: Degenerative diseases have become a major problem for each country. Degenerative diseases can be prevented by antioxidants. But the body does not have excessive amounts of antioxidants that require exogenous antioxidants. One of the natural exogenous antioxidants is guava fruit.Guava fruit is rich in carbohydrates, vitamin C, and is a good source of iron and a source of calcium, phosphorus and vitamin A. The composition of these compounds is thought to prevent the formation of free radicals in the body or as antioxidants and diabetes mellitus, dengue fever and diarrhea
Objective: The aim of the study was to know the antioxidant activity from the ethanol extract of guava, red guava and pearl guava.
Methods: The 1,1-diphenyl-2-picryhydrazl (DPPH) method together with UV- Visible spectrophotometer was used to determine the antioxidant activity of guava fruit (Psidium guajava).
Results: Phytochemical screening showed there were flavonoidsand tannin. The measurement results showed that the antioxidant activity of guava ethanol extract, crystal guava and red guava was high at 62.03 μg / ml, 59.64 μg / ml., 56.93 μg / ml. The results of the measurement of antioxidant activity of vitamin C were high at 4 μg / ml. From the characteristic result of guava simplicia, we obtained 8,67%
water value, 55,31% water soluble extract, 29,48% ethanol soluble extract, 7,46%
total ash value, and 2,37% the acid insoluble ash value. From the characteristic result of pearl guava simplicia, we obtained 7,99% water value, 57,03% water soluble extract, 29,61% ethanol soluble extract, 7,12% total ash value, and 2,27%
the acid insoluble ash value. From the characteristic result of red guava simplicia, we obtained 9,33% water value, 57,26% water soluble extract, 30,38% ethanol soluble extract, 7,45% total ash value, and 2,01% the acid insoluble ash value Conclusions: Based on the results of the research conducted it can be concluded that the guava ethanol extract has antioxidant activity and the antioxidant activity of guava ethanol extract is weaker than vitamin C.
Keywords: guava, antioxidant, DPPH, ethanol extract, Psidium guajava
DAFTAR ISI
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
SURAT PERNYATAAN ORISINALITAS ... vi
ABSTRAK ... vii
ABSTRACT . ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xii
DAFTAR GAMBAR. ... xiii
DAFTAR LAMPIRAN. ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Pikir Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Uraian Tumbuhan ... 6
2.1.1 Sistematika Tumbuhan ... 6
2.1.2 Nama Daerah ... 6
2.1.3 Morfologi Tumbuhan ... 7
2.1.4 Kandungan Kimia ... 7
2.2 Simplisia ... 9
2.3 Ekstrak ... 10
2.3.1 Pengertian Ekstrak ... 10
2.3.2 Pengertian Ekstraksi ... 10
2.4 Radikal Bebas ... 12
2.4.1 Pengertian Radikal Bebas ... 12
2.4.2 Reaksi Pembentukan Radikal ... 13
2.5 Antioksidan ... 14
2.5.1 Pengertian Antioksidan ... 14
2.5.2 Penggolongan Antioksidan ... 15
2.5.3 Sumber Antioksidan ... 16
2.5.4 Aktivitas Antioksidan Berbagai Buah-buahan ... 17
2.6 Metode-metode Penentuan Aktivitas Antioksidan ... 18
2.7 Penentuan Aktivitas Antioksidan dengan Metode DPPH ... 21
2.8 Spektrofotometer UV-Vis ... 22
BAB III METODE PENELITIAN ... 25
3.1 Alat dan Bahan... 26
3.1.1 Alat ... 26
3.1.2 Bahan ... 26
3.2 Penyiapan Sampel ... 27
3.2.1 Pengumpulan Bahan Tumbuhan ...27
3.2.2 Identifikasi Tumbuhan ... 27
3.2.3 Pembuatan Simplisia ... 27
3.3 Pembuatan Ekstrak ... 27
3.4 Pembuatan Larutan Pereaksi ...28
3.4.1 Pereaksi Besi (III) Klorida 1% ...28
3.4.2 Pereaksi Timbal (II) Asetat 0,4 M ...28
3.4.3 Pereaksi Natrium Hidroksida 2 N ...28
3.4.4 Pereaksi Asam Klorida 2 N ...28
3.4.5 Pereaksi DPPH ... 28
3.4.6 Pereaksi Asam Sulfat 2 N ...28
3.4.7 Pereaksi Mayer... 29
3.4.8 Pereaksi Mollish ... 29
3.4.9 Pereaksi Dragendorff ... 29
3.4.10 Pereaksi Bouchardat ... 29
3.4.11 Pereaksi Lieberman-Burchard ...29
3.5 Pemeriksaan Karakterisasi Simplisia ...30
3.5.1 Penetapan Kadar Air ... 30
3.5.2 Penetapan Kadar Sari Larut Air ...30
3.5.3 Penetapan Kadar Sari Larut Etanol ...31
3.5.4 Penetapan Kadar Abu Total ...31
3.5.5 Penetapan Kadar Abu Tidak Larut Asam ...31
3.6 Skrining Fitokimia ...32
3.6.1 Pemeriksaan Alkaloid ...32
3.6.2 Pemeriksaan Flavonoid ...32
3.6.3 Pemeriksaan Glikosida ...33
3.6.4 Pemeriksaan Saponin ...33
3.6.5 Pemeriksaan Tanin ...33
3.6.6 Pemeriksaan Steroid/Triterpenoid ...34
3.7 Pengujian Aktivitas Antioksidan Menggunakan Metode Penangkapan Radikal Bebas DPPH ...34
3.7.1 Pembuatan Larutan Blanko ...34
3.7.2 Pengukuran Panjang Gelombang Serapan Maksimum DPPH ...34
3.7.3 Penentuan Waktu Kerja (Operating Time) ... 34
3.7.4 Pembuatan Larutan Induk ... 35
3.7.5 Analisis Aktivitas Antioksidan Ekstrak Buah Jambu ...35
3.7.6 Pembuatan Kurva Kalibrasi Larutan Uji Sampel ...35
3.7.7 Pembuatan Larutan Induk Vitamin C ...35
3.7.8 Pembuatan Kurva Kalibrasi Larutan Uji Vitamin C ...36
3.7.9 Analisis Persen Pemerangkapan Radikal Bebas DPPH ...36
3.7.10 Analisis Nilai IC50 ... 36
BAB IV HASIL DAN PEMBAHASAN ...37
4.1 Identitas Tumbuhan ... 37
4.2 Karakterisasi Simplisia ... 37
4.2.1 Skrining Fitokimia ... 39
4.3 Aktivitas Antioksidan ... 39
4.3.1 Panjang Gelombang Serapan Maksimum ...39
4.3.2 Penentuan Operating Time ...40
4.3.3 Persamaan Regresi ... 40
4.3.4 Aktivitas Antioksidan Sampel Uji ...40
4.3.5 Nilai IC50... 42
BAB V KESIMPULAN DAN SARAN... 44
5.1 Kesimpulan ... 44
5.2 Saran ... 44
DAFTAR PUSTAKA ... 45
LAMPIRAN ... 48
DAFTAR TABEL
2.1 Kandungan dan Komposisi Gizi Jambu Biji ... 8
2.2 Kandungan dan Komposisi Gizi Jambu Biji Merah ... 9
4.1 Pemeriksaan Karakteristik SerbukSimplisiaJambu Biji ... 36
4.2 Pemeriksaan Karakteristik Serbuk Simplisia Jambu Biji Kristal ... 36
4.3 Pemeriksaan Karakteristik Serbuk Simplisia Jambu Biji Merah ... 36
4.4 Hasil Skrining Fitokimia Simplisia ... 37
4.5 Hasil Persamaan Regresi dan Nilai IC50Sampel Uji dan Pembanding ... 41
DAFTAR GAMBAR
1.1 Kerangka Pikir Penelitian ... 5
2.1 Struktur DPPH ...20
4.1 Kurva Absorbansi DPPH Menggunakan Spektrofotometer UV-Vis...34
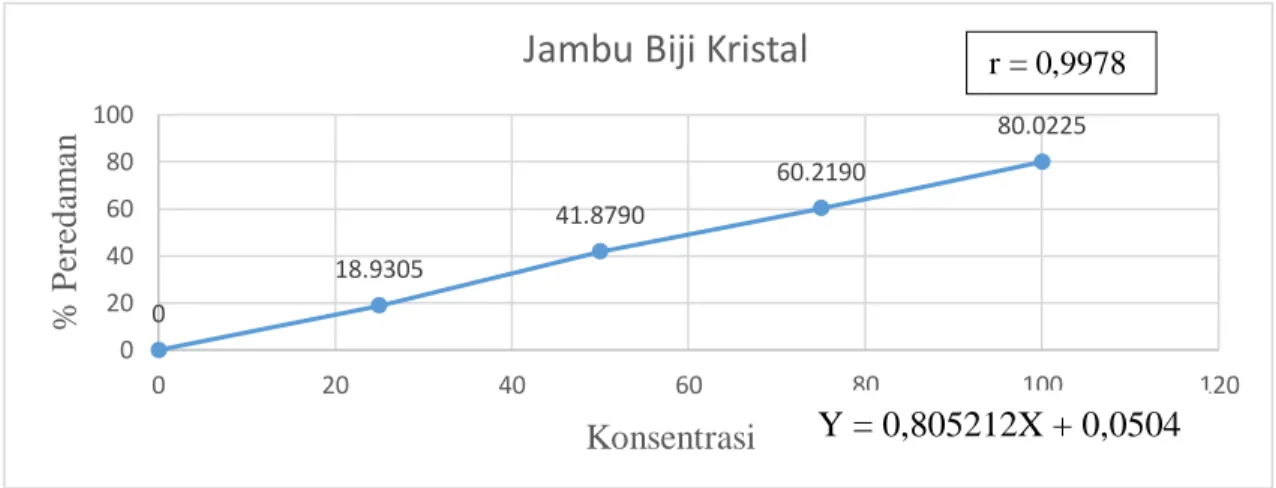
4.2 Kurva Kalibrasi Peredaman DPPH oleh Ekstrak Jambu Biji Kristal ...40
4.3 Kurva Kalibrasi Peredaman DPPH oleh Ekstrak Jambu Biji Merah ...40
4.4 Kurva Kalibrasi Peredaman DPPH oleh Ekstrak Jambu Biji ...40
DAFTAR LAMPIRAN
1.Surat hasil identifikasi tumbuhan ...46
2.Simplisia jambu ...49
3.Larutan sampel ...50
4.Gambar alat ...51
5.Gambar buah jambu ...52
6.Bagan kerja penelitian ...53
7.Hasil perhitungan karakterisasi simplisia ...54
8.Pengujian aktivitas antioksidan ...64
9.Perhitungan Nilai IC50 ... 65
10.Pengujian aktivitas antioksidan vitamin C sebagai pembanding ...68
11.Data Spektro Operating Time ... 69
12.Data Spektro Pengukuran Sampel ...71
12.Data Spektro Pengukuran Vitamin C ...74
BAB I PENDAHULUAN 1.1.Latar Belakang
Penyakit degeneratif sejak beberapa dasawarsa silam telah menjadi segmentasi permasalahan tersendiri bagi tiap negara di seluruh dunia. Hingga saat ini penyakit degeneratif telah menjadi penyebab kematian terbesar di dunia.
Hampir 17 juta orang meninggal lebih awal setiap tahun akibat epidemi global penyakit degeneratif. Indonesia menanggung beban ganda penyakit di bidang kesehatan, yaitu penyakit infeksi yang masih merajalela dan penyakit-penyakit degeneratif (Handajani dkk., 2010).
Kandungan senyawa bioaktif alami dapat mencegah kerusakan sel dan deoxyribonucleic acid (DNA) yang disebabkan oleh radikal bebas dan oksigen reaktif, dapat meningkatkan aktivitas enzim yang dapat mendetoksifikasi toksin dan karsinogen, memacu sintesis kolesterol dan metabolisme hormon, mereduksi agregasi platelet, menurunkan tekanan darah, stimulasi sistem imun, anti bakteri, dan antivirus (Lampe, 1999).
Radikal bebas adalah spesi kimia yang memiliki pasangan elektron bebas di kulit terluar sehingga sangat reaktif dan mampu bereaksi dengan protein, lipid, karbohidrat dan DNA yang berujung pada timbulnya penyakit. Radikal bebas dapat masuk ke dalam dan terbentuk ke dalam tubuh melalui pernapasan, kondisi lingkungan yang tidak sehat seperti asap rokok, pembakaran yang tidak sempurna dari kendaraan bermotor, bahan pencemar dan polusi udara serta makanan berlemak. Selain itu munculnya radikal bebas juga dapat dipicu olek stress fisik
dan mental, kurang olahraga, alkohol, bahan pengawet, pewarna dan pestisida (Mailandari, 2012).
Timbulnya radikal bebas dalam tubuh dapat diredam dengan antioksidan yaitu senyawa yang mempunyai struktur molekul yang dapat memberikan elektronnya kepada molekul radikal bebas dan dapat memutus reaksi berantai dari radikal bebas. Antioksidan juga dapat menghambat spesies oksigen reaktif/spesies nitrogen reaktif (ROS/RNS) dan radikal bebas sehingga antioksidan dapat mencegah penyakit-penyakit yang dihubungkan dengan radikal bebas seperti karsinogenesis dan kardiovaskuler. Radikal bebas yang umumnya digunakan sebagai model dalam penelitian antioksidan adalah 1,1-difenil-2-pikrihidrazil (DPPH) merupakan metode yang mudah, cepat, dan murah untuk menetapkan aktivitas antioksidanpenuaan (Hanani dkk, 2005; Mailandari, 2012).
Jambu biji (Psidium guajava L.) merupakan buah yang dapat dimanfaatkan sebagai bahan pangan fungsional karena memiliki fungsi untuk kesehatan. Sifat fungsional yang dimiliki jambu biji disebabkan oleh terdapatnya vitamin C yang cukup tinggi. Dalam buah jambu biji terdapat zat kimia lain yang dapat mempengaruhi aktivitas antioksidan, seperti senyawa flavanoid, kombinasi saponin dengan asam oleanolat, guaijavarin dan quercetin. Buah jambu biji kaya akan karbohidrat, vitamin C, serta merupakan sumber zat besi yang baik dan sumber kalsium, fosfor dan vitamin A. Komposisi senyawa-senyawa ini diduga dapat mencegah terbentuknya radikal bebas dalam tubuh atau sebagai antioksidan serta diabetes melitus, demam berdarah dan diare. Senyawa-senyawa tersebut dapat mencegah timbulnya penyakit-penyakit degeneratif. Buah jambu biji merah diharapkan dapat digunakan sebagai agen anti penyakit degeneratif. Aktivitas
antioksidan pada buah jambu biji dapat dipengaruhi oleh beberapa factor.
Aktivitas antioksidan pada buah jambu biji dipengaruhi oleh tingkat kematangan, bagian buah dan varietas jambu biji (Djanis dan Hanafi, 2009).
1.2 Perumusan masalah
Berdasarkan latar belakang diatas, maka perumusan masalah pada penelitian ini adalah:
a. Berapakah kekuatan aktivitas antioksidan ekstrak etanol jambu biji, jambu biji merah dan jambu biji kristal bila dibandingkan dengan aktivitas antioksidan vitamin C?
b. Apakah Jambu Biji merah mempunyai antivitas antioksidan lebih tinggi?
1.3 Hipotesis
Berdasarkan perumusan masalah diatas, maka hipotesis pada penelitian ini adalah:
H1: Jambu biji merah mempunyai aktivitas antioksidan yang lebih tinggi daripada jambu biji dan jambu biji kristal.
1.4 Tujuan penelitian
Tujuan penelitian ini adalah:
a. Untuk mengetahui kekuatan antioksidan dari ekstrak etanol jambu biji, jambu biji Kristal dan jambu biji merah dibandingkan dengan vitamin C
b. Untuk mengetahui apakah aktivitas antioksidan pada jambu merah lebih tinggi
1.5 Manfaat penelitian
Hasil dari penelitian ini, diharapkan dapat memberikan informasi mengenai aktivitas antioksidan ekstrak etanol jambu biji, jambu biji merah dan jambu biji kristalsehingga dapat menambah data ilmiah yang berkaitan dengan antioksidan.
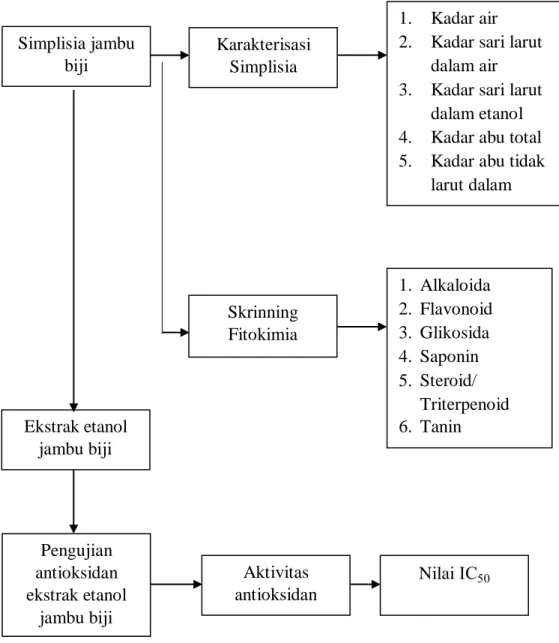
1.6 Kerangka Pikir Penelitian
Penelitian ini dilakukan dengan kerangka piker yang dapat dilihat pada Gambar 1.1
Simplisia jambu biji
Skrinning Fitokimia
1. Alkaloida 2. Flavonoid 3. Glikosida 4. Saponin 5. Steroid/
Triterpenoid 6. Tanin Ekstrak etanol
jambu biji
Karakterisasi Simplisia
1. Kadar air 2. Kadar sari larut
dalam air 3. Kadar sari larut
dalam etanol 4. Kadar abu total 5. Kadar abu tidak
larut dalam asam
Nilai IC50 Aktivitas
antioksidan Pengujian
antioksidan ekstrak etanol
jambu biji
Gambar 1.1 Kerangka Pikir Penilitian
BAB II
TINJAUAN PUSTAKA 2.1 Uraian Tumbuhan
Uraian tumbuhan meliputi sistematika tumbuhan, nama daerah, nama morfologi tumbuhan dan khasiat tumbuhan.
2.1.1 Sistematika Tumbuhan
Sistematika dari tumbuhan menurut Herbarium Medanense (MEDA) USU (2019) adalah sebagai berikut :
Kingdom: Plantae
Divisi : Spermatophyta Kelas : Dicotyledonae Ordo : Myrtales Famili : Myrtaceae Genus : Psidium
Spesies : Psidium guajava L.
2.1.2 Nama Daerah
Sumatera : glima breueh ( Aceh), glimeu beru (Gayo), galiman (Batak Karo), masiambu. (Nias), biawas, jambu biawas, j. biji, j.batu,j. klutuk (Melayu).
Jawa : jambu klutuk. (Sunda), bayawas, jambu krutuk, jambu krikil, petokal (Jawa), hambu bhender (Madura). Nusa Tenggara : sotong (Bali), guawa (Flores), goihawas (Sika). Sulawesi : gayawas . (Manado), boyawat (Mongondow), koyawas (Tonsaw), dambu (Gorontalo), jambu paratugala (Makasar), jambu paratukala (Bugis), jambu (Baree), kujabas (Roti), biabuto.
(Buol). Maluku : kayawase (Seram Barat), kujawase (Seram Selatan), laine hatu, luhu hatu. (Ambon), gayawa (Ternate, Halmahera) (Hapsoh dan Hasanah, 2011).
2.1.3 Morfologi
Perdu atau pohon kecil, tinggi 2-10 m, percabangan banyak. Batangnya berkayu, keras, kulit batang licin, mengelupas, berwarna cokelat kehijauan. Daun tunggal, bertangkai pendek, letak berhadapan, daun muda berambut halus, permukaan atas daun tua licin. Helaian daun berbentuk bulat telur agak jorong, ujung tumpul, pangkal membulat, tepi rata agak meleskuk ke atas, pertulangan menyirip, panjang 6-14 cm, lebar 3-6 cm, berwarna hijau. Bunga tunggal, bertangkai, keluar dari ketiak daun, berkumpul 1-3 bunga, berwarna putih.
Buahnya buah buni, berbentuk bulat sampai bulat telur, berwarna hijau sampai hijau kekuningan. Daging buah tebal, buah yang masak bertekstur lunak, berwarna putih kekuningan atau merah jambu. Biji buah banyak mengumpul di tengah, kecil-kecil, keras, berwarna kuning kecokelatan (Hapsoh dan Hasanah, 2011).
Tanaman jambu biji mudah beradaptasi dengan lingkungan kering, pH rendah. Di daerah tropik tanaman jambu biji akan tumbuh di dataran rendah hingga ketinggian 1500 m dpl. Meskipun dapat tumbuh pada temperatur antara 15-45oC, namun hasil terbaik pada suhu antara 23oC- 28oC dengan curah hujan 1000-2000 mm/tahun. Rasa buah jambu pada musim hujan kurang manis dibandingkan dengan buah hasil panen pada musim kemarau. Tampaknya hal ini disebabkan pengaruh intensitas sinar matahari. Tanaman jambu sangat toleran terhadap kisaran pH 4,5-8,2 serta terhadap salinitas (Hapsoh dan Hasanah, 2011).
2.1.4 Kandungan Kimia
Buah mengandung asam amino (triptofan, lisin), pectin kalsium, fosfor, besi, mangan, magnesium, belerang, dan vitamin (A, B1 dan C), saat menjelang
matang, kandungan vitamin C dapat mencapai 3-6 kali lipat lebih tinggi dari jeruk. Jambu biji juga kaya dengan serat yang larut dalam air, terutama di bagian kulitnya sehingga dapat mengganggu penyerapan glukosa dan lemak yang berasal dari makanan dan membuangnya ke luar tubuh (Hapsoh dan Hasanah, 2011).
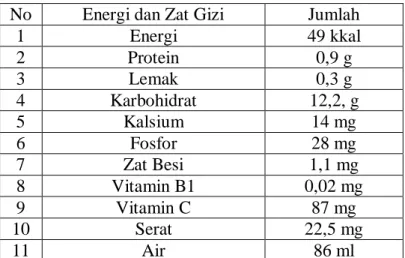
Buah jambu biji mempunyai warna daging yang berbeda, ada yang berwarna putih, dan ada yang daging buahnya berwarna merah. Kandungan gizi antara jambu biji ini juga berbeda, jambu biji dengan daging berwarna merah mempunyai kandungan gizi yang lebih komplitra dengan kandungan vitamin C lebih tinggi (Ramayulis, 2013).
Tabel 2.1 Kandungan dan komposisi gizi jambu biji/100 g buah No Energi dan Zat Gizi Jumlah
1 Energi 49 kkal
2 Protein 0,9 g
3 Lemak 0,3 g
4 Karbohidrat 12,2, g
5 Kalsium 14 mg
6 Fosfor 28 mg
7 Zat Besi 1,1 mg
8 Vitamin B1 0,02 mg
9 Vitamin C 87 mg
10 Serat 22,5 mg
11 Air 86 ml
(Ramayulis, 2013).
Tabel 2.2 Kandungan dan komposisi gizi jambu biji merah/ 100 g buah
No Energi dan Zat Gizi Jumlah
1 Energi 51 kkal
2 Protein 0,82 g
3 Lemak 0,6 g
4 Karbohidrat 11,8 g
5 Kalsium 20 mg
6 Fosfor 25 mg
7 Zat Besi 0,31 mg
8 Magnesium 10 mg
9 Kalium 284 mg
10 Natrium 3 mg
Sambungan Tabel 2.2 Halaman 8
11 Vitamin C 183,5 mg
12 Vitamin B1 0,05 mg
13 Vitamin B2 22,5 mg
14 Vitamin B3 1,2 mg
15 Asam pantothenat 0,15 mg
16 Vitamin B6 0,143 mg
17 Asam Folat 14 mcg
18 Vitamin E 1,12 mg
19 Serat Pangan 5,4 mg
20 Air 86,10 mg
(Ramayulis, 2013)
2.2 Simplisia
Simplisia adalah bahan alamiah yang dipergunakan sebagai obat yang belum mengalami pengolahan apapun juga dan kecuali dikatakan lain, berupa bahan yang telah dikeringkan. Simplisia dibedakan simplisia nabati, simplisia hewani dan simplisia pelican (mineral). Simplisia nabati adalah simplisia yang berupa tumbuhan utuh bagian tumbuhan atau eksudat tumbuhan. Eksudat tumbuhan ialah isi sel yang secara spontan keluar dari tumbuhan atau isi sel yang dengan cara tertentu dikeluarkan dari selnya atau senyawa nabati lainnya yang dengan cara tertentu dipisahkan dari tumbuhannya dan belum berupa senyawa kimia murni. Simplisia hewani adalah simplisia yang merupakan hewan utuh, sebagian hewan atau zat-zat berguna yang dihasilkan oleh hewan dan belum berupa zat kimia murni. Simplisia pelikan atau mineral adalah simplisia yang berupa bahan pelikan atau mineral yang belum diolah dengan cara yang sederhana dan belum berupa zat kimia murni (Ditjen POM dan DPOT, 2000).
2.3 Ekstrak
2.3.1 Pengertian Ekstrak
Ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi senyawa aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dari massa atau serbuk tersisa yang diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan. Sebagian ekstrak dibuat dengan mengesktraksi bahan baku secara perkolasi. Seluruh perkolat biasanya dipekatkan secara destilasi dengan pengurangan tekanan, agar bahan sedikit mungkin terkena panas (Ditjen POM dan DPOT, 2000).
2.3.2 Pengertian Ekstraksi
Ekstraksi adalah proses penarikan kandungan kimia yang terdapat dalam suatu bahan yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan menggunakan pelarut (Putri, 2014).
Menurut Ditjen POM dan DPOT (2000), ada beberapa metode ekstraksi yang sering digunakan antara lain yaitu :
A. Cara Dingin 1. Maserasi
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan (kamar). Cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif yang akan larut, karena adanya perbedaan kosentrasi larutan zat aktif di dalam sel dan di luar sel maka larutan terpekat didesak keluar. Proses ini berulang sehingga terjadi keseimbangan konsentrasi
antara larutan di dalam dan diluar sel. Cairan penyari yang digunakan dapat berupa air, etanol, metanol, etanol-air atau pelarut lainnya. Secara teknologi, termasuk ekstraksi dengan prinsip metode pencapaian konsentrasi keseimbangan.
Maserasi kinetic berarti dilakukan pengadukan kontiniu (terus-menerus).
Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama dan seterusnya.
2. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna (exhaustive extaction) yang umumnya dilakukan pada temperature ruangan. Proses terdiri dari tahapan pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya (penetasan/penampungan ekstrak), terus menerus sampai diperoleh ekstrak (perkolat) yang jumlahnya 1-5 kali bahan.
B. Cara Panas 1. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relative konstan dengan adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna.
2. Sokletasi
Soklet adalah ekstraksi menggunakan pelarut yang selalu baru yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relative konstan dengan adanya pendingin balik.
3. Digesti
Digesti adalah maserasi kinetic (dengan pengadukan kontinu) pada temperature yang lebih tinggi dari temperature ruangan (kamar), yaitu secara umum dilakukan pada temperature 40-50OC.
4. Infus
Infus adalah ekstrakasi dengan pelarutt air pada temperature penangas air (bejana infus tercelup dalam penangas air mendidih, temperature terukur 96- 98OC) selama waktu tertentu (15-20 menit).
5. Dekok
Dekok adalah infus pada waktu yang lebih lama (≥30OC) dan temperature sampai titik didih air.
2.4 Radikal Bebas
2.4.1 Pengertian Radikal Bebas
Radikal bebas adalah molekul yang mengandung elektron tidak berpasangan di orbit luarnya dan yang dapat eksis secara independen. Adanya electron yang tidak berpasangan menyebabkan senyawa tersebut sangat reaktif mencari pasangan, dengan cara menyerang dan mengikat elektron molekul yang berada disekitarnya. Radikal bebas merupakan pemicu tumbulnya sebagian penyakit seperti jantung koroner, kanker, penuaan, radang sendi, katarak, dan kemunduran saraf (Putro, 2013; Clarkson dan Thomson, 2000).
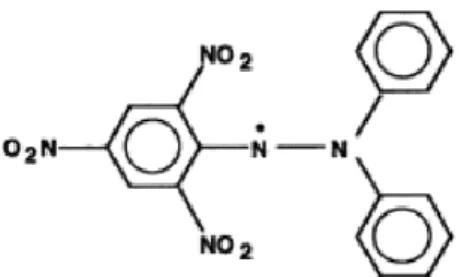
Radikal bebas yang biasa digunakan sebagai model dalam mengukur daya penangkapan radikal bebas adalah 1,1difenil-2-pikrihidazil (DPPH). DPPH merupakan senyawa radikal bebas yang stabil sehingga apabila digunakan sebagai
pereaksi dalam uji penangkapan radikal bebas cukup dilarutkan dan bila disimpan dalam keadaan kering dengan kondisi penyimpanan yang baik dan stabil selama bertahun-tahun. Nilai absorbansi DPPH berkisar antara 515-520 nm (Tristantini dkk., 2016).
Metode peredaman radikal bebas DPPH didasarkan pada reduksi dari larutan methanol radikal bebas DPPH yang berwarna oleh penghambatan radikal bebas. Ketika larutan DPPH yang berwarna ungu bertemu dengan bahan pendonor elektron maka DPPH akan tereduksi, menyebabkan warna ungu akan memudar dan digantikan dengan warna kuning yang berasal dari gugus prikil (Tristantini dkk., 2016)
Radikal bebas bersifat tidak stabil dan sangat reaktif yakni cenderung bereaksi dengan molekul lainnya untuk mencapai kestabilan. Radikal dengan kereaktifan yang tinggi ini dapat memulai sebuah reaksi berantai dalam sekali pembentukannya sehingga menimbulkan senyawa yang tidak normal dan memulai reaksi berantai yang dapat merusak sel–sel penting dalam tubuh. Radikal bebas dapat diatasi dengan penggunaan antioksidan (Tristantini dkk., 2016).
2.4.2 Reaksi Pembentukan Radikal
Menurut Clarkson dan Thomson (2000) reaksi radikal bebas dapat dibagi menjadi 3, yaitu:
1. Inisiasi, Tahap inisiasi adalah pembentukan awal dari radikal-radikal bebas
Cl–Cl 2Cl • ---(1)
2. Propagasi, Pembentukan radikal bebas akan mengakibatkan terbentuknya radikal baru dengan suatu reaksi yang disebut reaksi rantai
Cahaya UV atau kalor
Cl• + CH4 CH3• + HCl --- (2) Cl2 + CH3 CH3Cl + Cl• --- (3)
3. Terminasi, Reaksi rantai yang terjadi akan berhenti pada tahap terminasi yaitu ketika radikal bebas bergabung dengan radikal bebas yang lain sehingga tidak membentuk radikal bebas yang baru.
Cl• + •CH3 CH3Cl --- (4)
2.5 Antioksidan
2.5.1 Pengertian Antioksidan
Antioksidan adalah zat yang dapat melindungi sel dari kerusakan yang disebabkan oleh molekul tidak stabil yang dikenal sebagai radikal bebas.
Antioksidan berinteraksi dengan dan menstabilkan radikal bebas dan dapat mencegah beberapa kerusakan yang bisa ditimbulkan oleh radikal bebas.
Kerusakan radikal bebas dapat menyebabkan kanker. Contoh antioksidan termasuk beta-karoten, likopen, vitamin C, E, A dan zat lainnya (Hamid, dkk., 2010).
Antioksidan merupakan senyawa yang dapat menghambat reaksi oksidasi, dengan cara mengikat radikal bebas dan molekul yang sangat reaktif.
Salah satu bentuk senyawa oksigen reaktif adalah radikal bebas, senyawa ini terbentuk di dalam tubuh dan dipicu oleh bermacam-macam faktor (Hamid, dkk., 2010).
2.5.2 Penggolongan Antioksidan
Penggolongan Antioksidan berkaitan dengan fungsinya senyawa-senyawa antioksidan dapat diklasifikasikan dalam 5 (lima) tipe antioksidan (Vaya and Aviram, 2001), yaitu:
1.) Antioksidan Primer Antioksidan ini berfungsi untuk mencegah terbentuknya radikal bebas baru karena ia dapat merubah radikal bebas yang ada menjadi molekul yang berkurang dampak negatifnya, yaitu sebelum bereaksi. Contoh antioksidan ini adalah flavonoid, tokoferol dan asam ascorbat yang dapat memutus reaksi rantai radikal bebas melalui donor elektron peoksil radikal dari asam lemak dan menghentikan tahap propagasi, enzim glutathion peroksidase yang bertindak sebagai antioksidan reaksi reduksi oksidasi lemak dan fosfolipid hidroperoksida.
2.) Antioksidan Sekunder yaitu senyawa-senyawa yang mempunyai kemampuan untuk mendekomposisi hidroperoksida menjadi produk akhir yang stabil. Pada umumnya tipe antioksidan ini berfungsi menangkap senyawa serta mencegah terjadinya reaksi berantai. Contoh antioksidan sekunder adalah vitamin E, vitamin C, betakaroten, asam urat, bilirubin dan albumin.
3.) Antioksidan Tersier, Merupakan senyawa yang memperbaiki sel-sel dan jaringan yang rusak karena serangan radikal bebas. Biasanya yang termasuk kelompok ini adalah jenis enzim misalnya metionin sulfoksidan reduktase yang dapat memperbaiki DNA dalam inti sel. Enzim tersebut bermanfaat untuk perbaikan DNA pada penderita kanker.
4.) Penangkap Oksigen yaitu senyawa-senyawa yang berperan sebagai pengikat oksigen sehingga tidak mendukung reaksi oksidasi. Dalam hal ini senyawa
tersebut akan mengadakan reaksi dengan senyawa oksigen yang berada dalam sistem sehingga jumlah oksigen akan berkurang. Contoh senyawa senyawa kelompok ini adalah vitamin C (asam askorbat).
5.) Senyawa Pengkhelat, Kemampuan antioksidan dalam mengkhelat ion logam transisi melalui reaksi langsung dan tak langsung dari reduksi oksidasi logam yang dapat mengkatalisis logam manjadi radikal bebas.
2.5.3 Sumber Antioksidan
Sumber Antioksidan menurut (Mailandari, 2012), dibagi dalam tiga kelompok yaitu antioksidan yang dibuat oleh tubuh sendiri, antioksidan alami (hasil ekstraksi bahan alami) dan antioksidan sintetik (diperoleh dari hasil sintesa reaksi kimia).
a.) Antioksidan yang dibuat oleh tubuh sendiri
Yaitu berupa enzim antara lain superoksida dismutase, glutation peroksidase, peroksidase dan katalase (Mailandari, 2012).
b.) Antioksidan alami
Antioksidan alami tersebar dibeberapa bagian tanaman seperti pada kayu, kulit kayu, akar, daun, buah, bunga, biji dan serbuksari. Senyawa antioksidan alami tumbuhan umumya adalah senyawa fenolat atau polifenol yang dapat berupa golongan flavonoid turunan asam sinamat, kumarin, tokoferol dan asam- asam organik polifungsional (Muchtaridi dkk, 2005).
c.) Antioksidan sintetik
Adalah senyawa antioksidan yang diidsolasi dari sumber alami dan ditambahkan ke makanan sebagai bahan tambahan. Beberapa contoh antioksidan sintetik yang diijinkan untuk makanan yang penggunaannya meluas dan menyebar
diseluruh dunia yaitu butil hidroksi anisol (BHA), butil hidroksi toluen (BHT), propil gallat, tertier butil hidroksi quinon (TBHQ) dan tokoferol (Mailandari, 2012).
2.5.4 Aktivitas Antioksidan Berbagai Buah-buahan
Aktivitas antioksidan dari berbagai sumber buah-buahan pada umumnya diekstrak dengan pelarut air, etanol, methanol, eter, etil asetat,dan butanol.
Aktivitas antioksidan pada buah belimbing wuluh Fraksi eter dan air memiliki aktivitas antioksidan terhadap radikal DPPH dengan nilai IC50 50,36 ppm dan 44,01 ppm, dan sebagai pembanding memiliki nilai IC50 sebesar 7,00 ppm (Kuncahyo dan Sunardi, 2007).
Strawberi dan buah naga memiliki aktivitas antioksidan karena mengandung senyawa antosianin. Jenis antosianin yang paling dominan di dalam strawberi adalah pelargonidin-3-glukosida (83% dari total antosianin), setelah itu terdapat pelargonidin-3rutinosida (8%) dan Sianidin-3-glukosida (7%). Aktivitas antioksidan buah naga dengan nilai IC50 73,2772 ppm, sedangkan kadar total rata-rata antosianin diperoleh sebesar 58,0720 ± 0,0001 ppm dan jenis antosianin yang terkandung dalam ekstrak etanol kulit buah naga super merah adalah sianidin dengan membentuk puncak maksimum pada panjang gelombang 547 nm (Putri, dkk, 2015).
Buah Jamblang mengandung flavonoid, juga mengandung beberapa senyawa golongan polifenol lain seperti halnya tannin. Kandungan senyawa lain dalam Buah Jamblang diantaranya antosianin, glukosa, fruktosa, asam sitrat, sianidin diglikosida, petunidin, dan malvidin. Aktivitas antioksidan menunjukkan
ekstrak daun lebih aktif : IC50 12,84 ppm dari buah jamblang : 319,89 ppm (Marliani, dkk., 2014).
Buah kemloko menunjukkan mengandung fenolat total, flavonoid total dan aktivitas peredaman radikal DPPH dilakukan terhadap ekstrak atau fraksi yang menunjukan test positif fenolat dan flavonoid. Hasil penelitian menunjukkan bahwa fraksi n-heksana dan fraksi diklorometana negatif pada uji fenolat dan flavonoid. Kandungan fenolat total ekstrak metanol, fraksi etil asetat dan fraksi air berturut turut adalah 351, 436 dan 111 mg ekuaivalen asam galat/g ekstrak atau fraksi, sedangkan flavonoid total berturut-turut 200, 216 dan 70 mg ekuivalen quercetin/g ekstrak atau fraksi. Aktivitas antioksidan ketiga sampel uji tersebut memiliki IC50 berkisar 58,4 sampai 120,9. Fraksi etil asetat merupakan sampel uji yang paling aktif sebagai antioksidan, selain memiliki kadar fenolat total dan flavonoid total tertinggi (Marliani, dkk., 2014).
2.6. Metode-metode Penentuan Aktivitas Antioksidan a) Metode Ferric Reducing Antioxidant Power (FRAP)
Adalah salah satumetoda penentuan kandungan antioksidan secara spektrofotometri yang berdasarkan pada reduksi analog ferroin, kompleks Fe3+
dari tripiridiltriazin Fe(TPTZ)3+ menjadi kompleks Fe2+, Fe(TPTZ)2+ yang berwarna biru intensif oleh antioksidan pada suasana asam. Hasil pengujian diinterpretasikan dengan peningkatan absorbansi pada panjang gelombang 593 nm dan dapat disimpulkan sebagai jumlah Fe2+ (dalam mikromolekular) ekuivalen dengan antioksidan standar.Penentuan nilai TAC (Total Antioxidant Capacity) pada sampel dilakukan dengan mencampurkan reagen FRAP dengan ekstrak
sampel. Dalam reagen FRAP terdapat campuran TPTZ, FeCl3 dan buffer asetat, sehingga reagen FRAP merupakan senyawa komplek Fe3+-TPTZ yang tidak berwarna (berbeda dengan komplek Fe2+ yang berwarna biru). Senyawa Fe3+- TPTZ mewakili senyawa oksidator yang mungkin terdapat di dalam tubuh dan dapat merusak sel-sel tubuh, sedangkan ekstrak sampel mengandung antioksidan yang kemudian dapat mereduksi Fe3+-TPTZ menjadi Fe2+TPTZ sehingga senyawa Fe3+-TPTZ tidak akan melakukan reaksi yang merusak sel-sel tubuh. Semakin banyak konsentrasi Fe3+TPTZ yang direduksi oleh sampel menjadi Fe2+-TPTZ, maka aktivitas antioksidan dari sampel juga semakin besar (Yefrida, dkk, 2015).
b) Metode Cuprac
Pengujian antioksidan dilakukan juga dengan metode untuk melihat daya antioksidan senyawa-senyawa polifenol, dan vitamin E yang dikenal mudah untuk dilakukan dan berbiaya rendah. Metode ini menggunakan reagen Copper(II)- neocuropine (Cu(II)-Nc). Metode ini dapat juga digunakan untuk mengetahui kapasitas antioksidan senyawa-senyawa fenolik (Nugraha, dkk, 2017).Pada pengujian CUPRAC (Cupric ion reducing antioxidant capacity), reangen Cu(II)- neokuproin (Cu(II)-(Nc)2) digunakan sebagai agen pengoksidasi kromogenik karena reduksi ion Cu(II) dapat diukur. Pereaksi CUPRAC merupakan pereaksi yang selektif karena memiliki nilai potensial reduksi yang rendah. metode pengukuran kapasitas antioksidan dengan menggunakan metode CUPRAC memiliki kelebihan jika dibandingkan dengan metode pengukuran antioksidan yang lain yaitu reagen CUPRAC cukup cepat untuk mengoksidasi tiol jenis antioksidan, pereaksi CUPRAC merupakan pereaksi selektif karena potensi redoksnya lebih rendah. Reagen CUPRAC lebih stabil dan dapat diakses dari
reagen kromogenik lainnya (mis., ABTS, DPPH). Metode ini mudah dan berlaku dilaboratorium konvensional menggunakan standar kolorimeters tidak peralatan memerlukan canggih dan operator yang memenuhi syarat. Metode ini dapat mengukur hidrofilik dan lipofilik dari antioksidan (misalnya, β-karoten dan α - tokoferol) (Maryam, dkk, 2015).
c) Metode Ferric Ion Chelating (FIC)
Ferrous Ion Chelating (FIC) merupakan metode yang digunakan untuk menguji kemampuan suatu senyawa dalam mengkelat logam Fe. Metode ini mengukur kemampuan antioksi dan suatu senyawa untuk bersaing dengan ferrozine dalam mengkelat ionbesi. Secara kuantitatif ferrozine memiliki kemampuan dalam mengkelat Fe2+ sehingga terbentuk senyawa kompleks.
Senyawa kompleks tersebut akan terganggu oleh adanya senyawa pengkelat logam lainnya (Coky, dkk, 2014).
d) Metode DPPH
Radikal bebas yang biasa digunakan sebagai model dalam mengukur daya penangkapan radikal bebas adalah 1,1- difenil-2-pikrihidazil (DPPH). DPPH merupakan senyawa radikal bebas yang stabil sehingga apabila digunakan sebagai pereaksi dalam uji penangkapan radikal bebas cukup dilarutkan dan bila disimpan dalam keadaan kering dengan kondisi penyimpanan yang baik dan stabil selama bertahun-tahun. Nilai absorbansi DPPH berkisar antara 515-520 nm. Metode peredaman radikal bebas DPPH didasarkan pada reduksi dari larutan methanol radikal bebas DPPH yang berwarna oleh penghambatan radikal bebas. Ketika larutan DPPH yang berwarna ungu bertemu dengan bahan pendonor elektron
maka DPPH akan tereduksi, menyebabkan warna ungu akan memudar dan digantikan warna kuning yang berasal dari gugus pikril. (Tristantini, 2016).
2.7 Penentuan Aktivitas Antioksidan dengan Metode DPPH
Senyawa DPPH(2,2-diphenil-1-picrylhydrazyl) adalah radikal bebas yang stabil berwarna ungu. Metode DPPH berfungsi untuk mengukur elektron tunggal seperti aktivitas transfer Hx sekalian juga untuk mengukur aktifitas penghambatan radikal bebas. Metode DPPH berfungsi untuk mengukur elektron tunggal seperti aktivitas transfer hidrogen dan untuk mengukur aktivitas penghambatan radikal bebas. Metode ini sangat cocok untuk skrining awal berbagai sampel terutama ekstrak tumbuhan. Campuran reaksi berupa larutan sampel yang dilarutkan dalam etanol absolut dan di inkubasikan pada suhu 37oC selama 30 menit, dibaca pada panjang gelombang 517 nm (Pezzuto dan Park, 2002).
Gambar 2.1 Struktur DPPH (Molyneux, 2004).
Metode DPPH (1,1-difenil-2-pikrilhidrazil) adalah metode yang paling umum digunakan untuk menentukan kapasitas antioksidan dalam makanan ataupun minuman karena bersifat cepat, sederhana, akurat, dan juga murah. Dasar dari uji DPPH adalah pada perubahan warna radikal DPPH akibat reaksi antara radikal bebas DPPH dengan satu atom hidrogen yang dilepaskan oleh senyawa yang terkandung dalam bahan uji yang membentuk senyawa 1,1-difenil-2-
pikrilhidrazin yang berwarna kuning. Prinsip dari metode uji aktivitas antioksidan ini adalah pengukuran aktivitas antioksidan secara kuantitatif yaitu dengan melakukan penangkapan radikal DPPH oleh suatu senyawa yang mempunyai aktivitas antioksidan dengan menggunakan spektrofotometri UV–Vis, sehingga dengan demikian akan diketahui nilai aktivitas peredaman radikal bebas yang dinyatakan dengan nilai IC50 (Inhibitory Concentration). Nilai IC50 didefinisikan sebagai besarnya konsentrasi senyawa uji yang dapat meredam radikal bebas sebanyak 50%. Semakin kecil nilai IC50 maka aktivitas peredaman radikal bebas semakin tinggi. Prinsip kerja dari pengukuran ini adalah adanya radikal bebas stabil yaitu DPPH yang dicampurkan dengan senyawa antioksidan yang memiliki kemampuan mendonorkan hidrogen, sehingga radikal bebas dapat. Absorbansi yang diukur adalah absorbansi larutan DPPH yang tidak bereaksi dengan senyawa antioksidan. Tingkat aktivitas antioksidan suatu sampel dapat dilihat dari nilai IC50 (konsentrasi yang ekuivalen memberikan 50% efek aktivitas antioksidan.
Semakin kecil nilai IC50, maka semakin aktif sampel tersebut sebagai antioksidan (Budilaksono, dkk, 2014).
2.8 Spektrofotometer UV-Vis
Spektrofotometri sesuai dengan namanya adalah alat yang terdiri dari spektrometer dan fotometer. Spektrofotometer menghasilkan sinar dari spectrum dengan panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan atau diabsorbsi. Jadi spektrofotometer digunakan untuk mengukur energy relatif jika energy tersebut ditransmisikan, direfleksikan atau diemisikan sebagai fungsi panjang gelombang. Kelebihan spektrofotometer
dengan fotometer adalah panjang gelombang dari sinar putih dapat lebih di deteksi dan cara ini diperoleh dengan alat pengurai seperti prisma, grating atau celah optis. Pada fotometer filter dari berbagai warna yang mempunyai spesifikasi melewatkan trayek pada panjang gelombang tertentu (Mustikaningrum, 2015).
Spektrum elektromagnetik dibagi dalam beberapa daerah cahaya. Suatu daerah akan diabsorbsi oleh atom atau molekul dan panjang gelombang cahaya yang diabsorbsi dapat menunjukan struktur senyawa yang diteliti. Spektrum elektromagnetik meliputi suatu daerah panjang gelombang yang luas dari sinar gamma gelombang pendek berenergi tinggi sampai pada panjang gelombang mikro. Spektrum absorbsi dalam daerah-daerah ultra ungu dan sinar tampak umumnya terdiri dari satu atau beberapa pita absorbsi yang lebar, semua molekul dapat menyerap radiasi dalam daerah UV-tampak. Oleh karena itu mereka mengandung electron, baik yang dipakai bersama atau tidak, yang dapat dieksitasi ke tingkat yang lebih tinggi. Panjang gelombang pada waktu absorbsi terjadi tergantung pada bagaimana erat elektron terikat di dalam molekul. Elektron dalam satu ikatan kovalen tunggal erat ikatannya dan radiasi dengan energy tinggi, atau panjang gelombang pendek, diperlukan eksitasinya (Mustikaningrum, 2015).
Keuntungan utama metode spektrofotometri adalah bahwa metode ini memberikan cara sederhana untuk menetapkan kuantitas zat yang sangat kecil.
Selain itu, hasil yang diperoleh cukup akurat, dimana angka yang terbaca langsung dicatat oleh detector dan tercetak dalam bentuk angka digital ataupun grafik yang sudah diregresikan. Sedangkan untuk kekurangannya adalah absorbsi dipengaruhi oleh pH larutan, suhu dan adanya zat pengganggu dan kebersihan dari
kuvet.; hanya dapat dipakai pada daerah ultra violet yang panjang gelombang
>185nm dan sinar yang dipakai harus monokromatis (Mustikaningrum, 2015).
Komponen utama spektrofotometer menurut Mustikaningrum (2015).
yaitu:
a. Sumber sinar
Sumber sinar yang biasa digunakan pada spektroskopi absorbs adalah lampu wolfarm, deuterium lampu hidrogen. Lampu wolfarm digunakan untuk daerah visible (tampak) sedangkan untuk lampi hidrogen atau deuterium digunakan untuk sumber daerah UV.
b. Monokromator
Monokromator merupakan serangkaian alat optik yang menguraikan radiasi polikromatik dan berfungsi untuk memunculkan garis resonansi dari semua garis yang tidak diserap yang dipancarkan oleh sumber radiasi.
c. Sel sampel
Berfungsi sebagai tempat untuk meletakkan sampel menggunakan kuvet sebagai tempat untuk memasukkan sampel. Kuvet biasanya terbuat dari kuarsa atau gelas, namun kuvet dari kuarsa memiliki kualitas yang lebih baik.
d. Detektor
Peranan detector penerima adalah memberikan respon terhadap cahaya pada berbagai panjang gelombang. Detektor yang digunakan dalam UV–Vis disebut “detector fotolistrik”. Persyaratan–persyaratan penting untuk detektor meliputi:
a. Sensitivitas tinggi hingga dapat mendeteksi tenaga cahaya mempunyai tingkatan rendah sekalipun
b. Waktu respon pendek c. Stabilitas yang panjang
d. Sinar elektronik yang mudah diperjelas dan system pembacaan e. Penguat (Amplifier)
Berfungsi untuk memperbesar arus yang dihasilkan oleh detektor agar dapat dibaca oleh indikator.
f. Indikator dapat berupa: rekorder dan computer.
BAB III
METODE PENELITIAN
Penelitian ini dilakukan dengan menggunakan metode deskriptif di Laboratorium Fitokimia dan Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara meliputi pengumpulan dan preparasi sampel bahan tanaman, skrining fitokimia, dan pengujian aktivitas antioksidan dengan metode DPPH.
3.1 Alat dan Bahan 3.1.1 Alat
Alat-alat yang digunakan dalam penelitian ini adalah: alat-alat gelas yang diperlukan dalam penelitian, batang pengaduk, blender, cawan penguap, flakon tertutup, hot plate, kertas aluminium foil, kertas saring, kertas kuvet, neraca analitik (Mettler Toledo), penyaring vakum, oven (Memmert), spatula, spektrofotometer UV-Vis (Shimadzu), dan tabung reaksi.
3.1.2 Bahan
Bahan tumbuhan yang digunakan dalam penelitian ini adalah Jambu Biji, Jambu Biji Merah dan Jambu Biji Kristal, 2,2-diphenyl-1-picryl-hydrazil (DPPH), air suling, alfa naftol, amil alkohol, asam asetat anhidrat, asam klorida pekat, asam nitrat pekat, asam sulfat pekat, besi (III) klorida, bismuth nitrat, etanol 96%, etilasetat, iodium, isopropanol, kaliums iodida, kloralhidrat, kloroform, methanol pro analisis, natrium hidroksida, natrium klorida, raksa (II) klorida, serbuk magnesium, timbal (II) asetat.
3.2 Penyiapan Sampel
3.2.1 Pengumpulan Bahan Tumbuhan
Bahan tumbuhan yang digunakan adalah buah jambu yang masih segar.
Pengambilan sampel dilakukan secara sampling purposif, artinya sampel dipilih hanya atas dasar pertimbangan peneliti yang menganggap unsur-unsur yang dikehendaki telah ada dalam anggota sampel yang diambil. Sampel diambil dari daerah Talun Kenas, Deli Serdang, Sumatera Utara.
3.2.2 Identifikasi Tumbuhan
Identifikasi buah jambu dilakukan di Herbarium Medanense, Departemen Biologi FMIPA USU.
3.2.3 Pembuatan Simplisia
Buah jambu yang segar dikumpulkan dan dicuci dengan air, dipisahkan daging buah dari bijinya.Ditiriskan kemudian ditimbang sebagai berat basah.
Dikeringkan di lemari pengering hingga kering, kemudian ditimbang sebagai berat kering. Dihaluskan bahan dengan menggunakan blender. Dimasukkan simplisia dalam wadah plastik dan diikat, diberi etiket lalu disimpan di tempat kering terlindung dari sinar matahari.
3.3 Pembuatan Ekstrak
Pembuatan ekstrak dilakukan dengan cara maserasi menggunakan pelarut etanol 96%. Masukkan 10 bagian serbuk simplisia ke dalam wadah berwarna gelap, dituang 75 bagian etanol 96%, tutup dan dibiarkan selama 5 hari terlindung dari cahaya sambil sering diaduk, serkai, peras, cuci ampas dengan etanol 96%
secukupnya hingga diperoleh 100 bagian. Pindahkan kedalam bejana tertutup,
biarkan ditempat sejukterlindung dari cahaya selama 2 hari, saring. Kemudian dipekatkan dengan alat rotary evaporator pada suhu ±40°C sampai diperoleh ekstrak kental (Ditjen POM, 1995).
3.4 Pembuatan larutan pereaksi 3.4.1 Pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air secukupnya hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.4.2 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam air suling bebas karbon dioksida sebanyak 100 ml (Ditjen POM, 1995).
3.4.3 Pereaksi natrium hidroksida 2 N
Sebanyak 8 g kristal natrium hidroksida dilarutkan dengan air suling sebanyak 100 ml (Ditjen POM, 1995).
3.4.4 Pereaksi asam klorida 2 N
Sebanyak 17 ml larutan asam klorida pekat ditambahkan air suling hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.4.5 Pembuatan Pereaksi DPPH 0,5 M
Sebanyak 20 mg DPPH ditimbang kemudian dilarutkan dalam metanol hingga diperoleh volume larutan 100 ml (konsentrasi 200 ppm (Molyneux, 2004).
3.4.6 Pereaksi asam sulfat 2 N
Sebanyak 5,5 ml larutan asam sulfat pekat ditambahkan air suling sampai 100 ml ((Ditjen POM, 1995).
3.4.7 Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida dilarutkan dalam air suling hingga 60 ml pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu dilarutkan dalam 10 ml air suling, kedua larutan dicampurkan dan ditambahkan air suling hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.4.8 Pereaksi Mollish
Sebanyak 3 g α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.4.9 Pereaksi Dragendorff
Sebanyak 0,8 g bismut (III) nitrat ditimbang, dilarutkan dalam 20 ml asam nitrat pekat, pada wadah lain ditimbang sebanyak 27,2 g kalium iodida, dilarutkan dalam 50 ml air suling, kemudian kedua larutan dicampurkan dan didiamkan sampai memisah sempurna. Larutan yang jernih diambil dan diencerkan dengan air suling hingga volume larutan 100 ml (Ditjen POM, 1995).
3.4.10 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, dilarutkan dalam air suling secukupnya, lalu ditambahkan 2 g iodium kemudian ditambahkan air suling hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.4.11 Pereaksi Liebermann-Burchard
Sebanyak 5 bagian volume asam sulfat pekat dicampurkan dengan 50 bagian volume etanol 95%, lalu ditambahkan dengan hati-hati 5 bagian volume asam asetat anhidrida ke dalam campuran tersebut dan didinginkan (Ditjen POM, 1995).
3.5 Pemeriksaan Karakterisisasi Simplisia 3.5.1 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode Azeotropi. Alat terdiri dari labu alas bulat 500 ml, alat penampung dan pendingin, tabung penyambung dan penerima 10 ml, dan pemanas listrik.
a. Penjenuhan Toluen
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan kedalam labu alas bulat lalu dipasang alat penampung dan pendingin kemudian didestilasi selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, volume air dalam tabung penerima dibaca dengan ketelitian 0,05 ml.
b. Penetapan Kadar Air Simplisia
Sebanyak 5 g serbuk simplisia yang telah ditimbang seksama dimasukkan kedalam labu yang berisi toluen yang telah dijenuhkan lalu dipanaskan hati-hati selama 15 menit. Setelah toluen mendidih, kecepatan tetesan diatur 2 tetes untuk tiap detik sampai sebagian besar air terdestilai, kemudian kecepatan destilasi dinaikkan sampai 4 tetes tiap detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluena memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persenv/b (WHO, 1992).
3.5.2 Penetapan Kadar Sari Larut Dalam Air
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dengan 100 ml air- kloroform (2,5 ml kloroform dalam air suling sampai 1 liter) dalam labu
bersumbat, dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam, kemudian disaring. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Ditjen POM, 1995).
3.5.3 Penetapan Kadar Sari Larut Dalam Etanol
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100 ml etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Kemudian disaring cepat untuk menghindari penguapan etanol. Sejumlah 20 ml filtrat diuapkann sampai kering dalam cawan penguap yang berdasar rata yang telat dipanaskan dan ditara. Sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang larut dalam etanol 96% dihitung terhadap bahan yang telah dikeringkan (Ditjen POM, 1995).
3.5.4 Penetapan Kadar Abu Total
Sebanyak 2 g serbuk simplisia dimasukkan dalam kurs porselin yang telah dipijar dan ditara, kemudian diratakan. Kurs dipijar perlahan-lahan sampai arang habis, pijaran dilakukan pada suhu 600oC selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan (Ditjen POM, 1995).
3.5.5 Penetapan Kadar Abu Tidak Larut Dalam Asam
Abu yang diperoleh dalam penetapan kadar abu total dididihkan dalam 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring bebas abu, dicuci dengan air panas.
Residu dan kertas saring dipijar sampai bobot tetap, kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan (Ditjen POM, 1995).
3.6 Skrining Fitokimia
Skrining fitokimia meliputi pemeriksaan golongan senyawa alkaloid, flavonoid, glikosida, saponin, tanin dan steroid/triterpenoid.
3.6.1 Pemeriksaan Alkaloid
Sampel uji ditimbang sebanyak 0,5 g, kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk uji alkaloid. Ke dalam 3 tabung reaksi dimasukkan 0,5 ml filtrat. Pada masing-masing tabung reaksi : 1. ditambahkan 2 tetes pereaksi Mayer, akan terbentuk endapan berwarna putih atau kuning. 2. ditambahkan 2 tetes pereaksi Dragendorff, akan terbentuk endapan berwarna coklat atau jingga kecoklatan. 3. ditambahkan 2 tetes pereaksi Bouchardat, akan terbentuk endapan berwarna coklat sampai kehitaman. Alkaloid positif jika terjadi endapan atau kekeruhan pada dua dari tiga pereaksi di atas (Ditjen POM, 1995).
3.6.2 Pemeriksaan Flavonoid
Sebanyak 10 g sampel uji ditambahkan 100 ml air panas, dididihkan selama 5 menit dan disaring dalam keadaan panas, ke dalam 5 ml filtrat ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan memisah. Flavonoid positif jika terjadi warna merah atau kuning atau jingga pada lapisan amil alkohol (Ditjen POM, 1995).
3.6.3 Pemeriksaan Glikosida
Sampel uji ditimbang sebanyak 3 g, lalu disari dengan 30 ml campuran etanol 95% dengan air (7:3) dan 10 ml asam klorida 2 N, direfluks selama 2 jam, didinginkan dan disaring. Diambil 20 ml filrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform (2:3), dilakukan berulang sebanyak 3 kali. Sari air dikumpulkan dan diuapkan pada temperatur tidak lebih dari 50°C. Sisanya dilarutkan dalam 2 ml metanol. Larutan metanol digunakan untuk percobaan berikut: 0,1 ml larutan percobaan dimasukan dalam tabung reaksi dan diuapkan diatas penangas air. Pada sisa ditambahkan 2 ml air dan 5 tetes pereaksi Molish, kemudian secara perlahan-lahan ditambahkan 2 ml asam sulfat pekat melalui dinding tabung, terbentuknya cincin berwarna ungu pada batas kedua cairan menunjukkan ikatan gula (Ditjen POM, 1995).
3.6.4 Pemeriksaan Saponin
Sampel uji ditimbang sebanyak 0,5 g dan dimasukan ke dalam tabung reaksi, lalu ditambahkan 10 ml air panas, dinginkan kemudian dikocok kuat-kuat selama 10 detik. Terbentuk busa setinggi 1-10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2 N menunjukkan adanya saponin (Ditjen POM, 1995).
3.6.5 Pemeriksaan Tanin
Sampel uji ditimbang sebanyak 1 g, dididihkan selama 3 menit dalam 100 ml air suling lalu didinginkan dan disaring. Pada filtrat ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%, jika terjadi warna biru kehitaman atau hijau kehitaman menunjukan adanya tannin (Ditjen POM, 1995).
3.6.6 Pemeriksaan Steroid/triterpenoid
Sampel uji ditimbang sebanyak 1 g, dimaserasi dengan 20 ml n-heksan selama 2 jam, lalu disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan beberapa tetes pereaksi Liebermann-Burchard. Timbulnya warna biru hijau atau warna merah ungu menunjukkan adanya steroid/triterpenoid (Ditjen POM, 1995).
3.7 Pengujian Aktivitas Antioksidan Menggunakan Metode Pemerangkapan Radikal Bebas DPPH
3.7.1 Pembuatan Larutan Blanko
Larutan DPPH 0,5 mM (konsentrasi 200 ppm) dipipet sebanyak 5 ml, kemudian dimasukkan ke dalam labu tentukur 25 ml, lalu dicukupkan dengan metanol sampai garis tanda (konsentrasi 40 μg/ml) (Molyneux, 2004).
3.7.2 Pengukuran Panjang Gelombang Serapan Maksimum DPPH
Larutan DPPH konsentrasi 40 µg/ml dihomogenkan dan diukur serapannya pada panjang gelombang 400-800 nm yang merupakan panjang gelombang sinar tampak (Molyneux, 2004).
3.7.3 Penentuan Waktu Kerja (Operating Time)
Larutan DPPH konsentrasi 40 ppm dihomogenkan dan diukur absorbansi larutan pada panjang gelombang 516 nm setiap 1 menit selama 80 menit dan diamati waktu larutan tersebut mulai menghasilkan absorbansi yang stabil, yang akan digunakan sebagai operating time.
3.7.4 Pembuatan Larutan Induk
Sebanyak 25 mg ekstrak buah jambu ditimbang kemudian dilarutkan dalam labu tentukur 25 ml dengan metanol lalu volumenya dicukupkan dengan metanol sampaigaris tanda (konsentrasi 1000 ppm).
3.7.5 Analisis Aktivitas AntioksidanEkstrak Buah Jambu
Larutan induk dipipet sebanyak 0,625 ml; 1,25 ml; 1,875 ml; 2,5 ml kemudian masing-masing dimasukkan ke dalam labu tentukur 25 ml (untuk mendapatkan konsentrasi 25 ppm, 50 ppm, 75 ppm, 100 ppm), kemudian dalam masing-masing labu tentukur ditambahkan 5 ml larutan DPPH 0,5 mM (konsentrasi 40 ppm) lalu volume dicukupkan dengan metanol sampai garis tanda, didiamkan di tempat gelap, lalu diukur serapannya dengan spektrofotometer sinar tampak pada panjang gelombang 515 nm.
3.7.6 Pembuatan Kurva Kalibrasi Larutan Uji Sampel
Pembuatan kurva kalibrasi larutan uji sampel didapatkan dari pengukuran absorbsi pada berbagai konsentrasi yaitu konsentrasi 25 μg/ml, 50 μg/ml, 75 μg/ml dan 100 μg/ml dari sampel ekstrak etanol Buah Jambu Biji, Jambu Biji Merah dan Jambu Biji Kristal.
3.7.7 Pembuatan Larutan Induk Vitamin C
Serbuk vitamin C ditimbang 25 mg, dimasukkan ke dalam labu tentukur 25 ml dilarutkan dengan metanol lalu volumenya dicukupkan dengan metanol sampai garis tanda (konsentrasi 1000 μg/ml).
3.7.8 Pembuatan Kurva Kalibrasi Larutan Uji Vitamin C
Pembuatan kurva kalibrasi larutan uji vitamin c didapatkan dari pengukuran absorbsi pada berbagai konsentrasi yaitu konsentrasi 2 μg/ml, 4 μg/ml, 6 μg/ml dan 8 μg/ml dari sampel vitamin C.
3.7.9 Analisis Persen Pemerangkapan Radikal Bebas DPPH
Menurut Molyneux (2004), penentuan persen pemerangkapan radikal bebas oleh ekstrak buah jambu dengan vitamin C sebagai kontrol positif, menggunakan metode pemerangkapan radikal bebas 1,1- diphenyl-2-picryhydrazil (DPPH), yaitu dihitung dengan rumus sebagai berikut:
Aktivitas pemerangkapan radikal bebas (%) = 𝐴 𝑘𝑜𝑛𝑡𝑟𝑜𝑙−𝐴 𝑠𝑎𝑚𝑝𝑒𝑙
𝐴 𝑘𝑜𝑛𝑡𝑟𝑜𝑙 𝑥 100 % Keterangan: A kontrol = Absorbansi tidak mengandung sampel
A sampel = Absorbansi sampel 3.7.10 Analisis nilai IC50
Data antioksidan pada radikal DPPH (% penghambatan) sampel esktrak buah jambu dianalisis dan dihitung nilai IC50. Semakin kecil nilai IC50 berarti aktivitas antioksidan semakin kuat. Pada penelitian ini nilai IC50 dianalisis dan dihitung menggunakan persamaan regresi linear.
Data % hambatan dan konsentrasi larutan digunakan untuk mencari nilai IC50 dengan persamaan regresi linear y = ax + b, dimana y adalah % hambat 50 (senilai 50) dan x adalah nilai IC50.
Nilai IC50 merupakan konsentrasi efektif ekstrak yang dibutuhkan untuk meredam 50% dari total DPPH, sehingga nilai 50 disubstitusikan untuk nilai y.
Setelah mensubstitusikan nilai 50 pada nilai y, akan didapat nilai x sebagai nilai IC50 (Tristantini dkk., 2016).