Teruntuk ayah, mama, dan keluarga terkasih…
Untuk doa yang selalu dipanjatkan..
Untuk cinta dan kasih sayang yang tulus..
Untuk semangat yang tak pernah pudar..
Untuk pengorbanan yang tiada henti..
OPTIMASI PENGGUNAAN IgY DAN IgG SEBAGAI
ANTIBODI PENANGKAP DAN PENDETEKSI ANTIGEN
EKSKRETORI SEKRETORI (ES) Fasciola gigantica DALAM
UJI ELISA
RISMA ADELIA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2011
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan judul “Optimasi Penggunaan IgY dan IgG sebagai Antibodi Penangkap dan Pendeteksi Antigen Ekskretori Sekretori (ES) Fasciola gigantica dalam Uji ELISA” adalah benar merupakan hasil karya saya dengan arahan dari dosen pembimbing dan belum pernah diajukan dalam bentuk apapun ke Perguruan Tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang telah diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Juli 2011
Risma Adelia B04070010
ABSTRACT
RISMA ADELIA. Optimation IgY and IgG as Capture and Detection Antibody of Fasciola gigantica Excretory Secretory (ES) Antigen in ELISA Assay. Under direction of FADJAR SATRIJA and SRI MURTINI.
Fasciolosis is a parasitic disease of domestic ruminant that cause high economic loss. Currently diagnosis of fasciolosis relies on microscopic examination of Fasciola sp. eggs in fecal sample. Serological test such as ELISA has been developed to improve the diagnostic method of fasciolosis. This study was designed to optimize the use of polyclonal antibodies (IgY and IgG) as capture antibody and detection antibody in ELISA assay to detect excretory secretory (ES) of Fasciola gigantica. The conformation was done in two models which compared IgY (9,57 mg/ml) and IgG (3,75 mg/ml) as capture antibody. The first conformation was IgY as capture antibody in 1:1000 dilution and IgG as detection antibody in 1:100, 1:1000, and 1:10000 dilutions. The second conformation was IgG as capture antibody in 1:1000 dilution and IgY as detection antibody in 1:100, 1:1000, and 1:10000 dilutions. The results showed that IgY as capture antibody in 1:1000 dilution and IgG as detection antibody in 1:100, 1:1000, 1:10000 dilutions were able to capture ES antigen 3,87; 2,85; and 1,65 times than cut off value. The other conformation with IgG as capture antibody in 1:1000 dilution was able to capture ES antigen as much as 1,91 times than cut off value with IgY as detection antibody in 1:100 dilution. This showed that the good optimation ELISA was IgY as capture antibody in 1:1000 dilution and IgG as detection antibody in 1:100 dilution.
RINGKASAN
RISMA ADELIA. Optimasi Penggunaan IgY dan IgG sebagai Antibodi Penangkap dan Pendeteksi Antigen Ekskretori Sekretori (ES) Fasciola gigantica dalam Uji ELISA. Dibimbing oleh FADJAR SATRIJA dan SRI MURTINI.
Fasciolosis merupakan penyakit parasitik pada ruminansia domestik yang menyebakan kerugian ekonomi yang besar. Diagnosis fasciolosis saat ini mengandalkan pemeriksaan mikroskopik telur Fasciola sp. pada sampel feses. Tes serologis seperti ELISA sudah dikembangkan untuk meningkatkan metode diagnostik fasciolosis. Penelitian ini dirancang untuk optimasi penggunaan antibodi poliklonal (IgY dan IgG) sebagai antibodi penangkap dan antibodi pendeteksi untuk mendeteksi ekskretori sekretori (ES) Fasciola gigantica dalam uji ELISA. Konformasi pengujian dilakukan dalam dua permodelan dengan membandingkan IgY (9,57 mg/ml) dan IgG (3,75 mg/ml) sebagai antibodi penangkap. Konformasi pertama adalah IgY sebagai antibodi penangkap dengan pengenceran 1:1000 dan IgG sebagai antibodi pendeteksi dengan pengenceran 1:100, 1:1000, dan 1:10000. Konformasi kedua adalah IgG sebagai antibodi penangkap dengan pengenceran 1:1000 dan IgY sebagai antibodi pendeteksi dengan pengenceran 1:100, 1:1000, dan 1:10000. Hasil pengujian menunjukkan IgY sebagai antibodi penangkap pada pengenceran 1:1000 dan IgG sebagai antibodi pendeteksi pada pengenceran 1:100, 1:1000, dan 1:10000 mampu menangkap antigen ES 3,87; 2,85; dan 1,65 kali dari nilai cut off. Konformasi lain dengan IgG sebagai antibodi penangkap pada pengenceran 1:1000 hanya mampu menangkap antigen ES 1,91 kali dari nilai cut off dengan IgY sebagai antibodi pendeteksi pada pengenceran 1:100. Hasil menunjukkan bahwa optimasi yang baik adalah IgY sebagai antibodi penangkap pada pengenceran 1:1000 dan IgG sebagai antibodi pendeteksi pada pengenceran 1:100.
© Hak Cipta milik IPB tahun 2011
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa
mencantumkan atau menyebutkan sumbernya. Pengutipan hanya
untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah,
penyusunan laporan, penulisan kritik atau tinjauan suatu masalah,
dan pengutipan tersebut tidak merugikan kepentingan yang wajar
IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh
karya tulis dalam bentuk apapun tanpa izin IPB.
OPTIMASI PENGGUNAAN IgY DAN IgG SEBAGAI
ANTIBODI PENANGKAP DAN PENDETEKSI ANTIGEN
EKSKRETORI SEKRETORI (ES) Fasciola gigantica DALAM
UJI ELISA
RISMA ADELIA
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2011
Judul Skripsi : Optimasi Penggunaan IgY dan IgG sebagai Antibodi Penangkap dan Pendeteksi Antigen Ekskretori Sekretori (ES) Fasciola gigantica dalam Uji ELISA
Mahasiswa : Risma Adelia NIM : B04070010
Disetujui,
drh. Fadjar Satrija, MSc, PhD Dr. drh. Sri Murtini, MSi Pembimbing 1 Pembimbing 2
Diketahui,
Dr. Nastiti Kusumorini Wakil Dekan
RIWAYAT HIDUP
Penulis dilahirkan di Payakumbuh, Sumatera Barat pada tanggal 11 Juli 1989. Penulis merupakan anak kedua dari empat bersaudara pasangan ayah drh. Erry Marsal dan ibu Dewi Darmasari.
Penulis menyelesaikan pendidikan dasar di SD PIUS Payakumbuh tahun 2001. Pada tahun 2004 penulis lulus dari SMP FIDELIS Payakumbuh, pada tahun 2007 penulis lulus dari SMAN 1 Payakumbuh, dan pada tahun yang sama penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) pada program studi Kedokteran Hewan.
Selama kuliah penulis aktif dalam berbagai organisasi dan kepanitiaan dalam kampus. Penulis pernah menjadi Dewan Gedung Asrama A3 (2007-2008), anggota Bicycle Community (2007-2008), Manajer Periklanan Koran Kampus IPB (2008-2009), Ketua Departemen Informasi dan Komunikasi Unit Kegiatan Mahasiswa Uni Konservasi Fauna IPB (UKM UKF IPB) (2008-2009), Ketua Divisi Pendidikan dan Pelatihan Himpunan Minat dan Profesi Ruminansia FKH IPB (Himpro Ruminansia FKH IPB) (2009-2010), Sekretaris Bidang Sosial Lingkungan UKM UKF IPB (2009-2010), Ketua Lembaga Struktural Bina Desa Badan Eksekutif Mahasiswa Kabinet Katalis FKH IPB (LS Bina Desa BEM FKH IPB) (2009-2010). Penulis pernah mengikuti kegiatan Pengabdian Masyarakat di Kabupaten Kediri (2010) yang diadakan oleh FKH IPB. Beasiswa yang pernah penulis dapatkan adalah Tanoto Foundation (2008-2010). Prestasi akademik dan nonakademik yang pernah penulis raih adalah Mahasiwa Berprestasi Tingkat 3 FKH IPB (2011) dan Juara 3 Kontes Penjurian Sapi Perah Tingkat Nasional Kategori Mahasiswa Grup (2010) yang diadakan oleh Cattle Buffalo Club Universitas Padjadjaran Bandung (CBC UNPAD). Penulis pernah mengikuti kegiatan magang kerja di Pusat Latihan Gajah (PLG) Taman Nasional Way Kambas Lampung (2008), Balai Inseminasi Buatan Daerah (BIBD) Tuah Sakato (2009), dan Koperasi Peternak Bandung Selatan (KPBS) Pangalengan (2010). Penulis juga pernah menjadi asisten praktikum mata kuliah Ilmu dan Teknologi Reproduksi (2011).
PRAKATA
Alhamdulillahirrabil’alamin. Puji syukur penulis panjatkan ke hadirat Allah SWT atas segala rahmat dan karunia yang telah diberikan, sehingga penulis dapat menyelesaikan skripsi yang berjudul Optimasi Penggunaan IgY dan IgG sebagai Antibodi Penangkap dan Pendeteksi Antigen Ekskretori Sekretori (ES) Fasciola gigantica dalam Uji ELISA. Skripsi ini disusun sebagai salah satu syarat memperoleh gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Penulisan skripsi ini tidak lepas dari dukungan dan bantuan dari berbagai pihak. Oleh karena itu, dengan rasa tulus dan hormat, penulis mengucapkan terima kasih kepada:
1. Orang tua dan keluarga besar (ayah, mama, kakak Megasari Marsela, adik Andhika Nugraha, adik Darmawan Sentosa, teh Donnawatty) atas doa, kasih sayang, motivasi, dukungan, dan nasihat, yang menjadi sumber semangat dan insipirasi bagi penulis.
2. drh. Fadjar Satrija, MSc, PhD dan Dr. drh. Sri Murtini, MSi sebagai pembimbing skripsi atas arahan, kesabaran, motivasi, waktu, dan pemikiran selama proses penelitian dan penyelesaian skripsi ini.
3. Dr. drh. Elok Budi Retnani, MS sebagai pembimbing akademik dan penilai seminar atas motivasi, kesabaran, perhatian, arahan, dan masukan.
4. Dr. drh. Sus Derthi, Msi dan drh. Kusdiantoro, MSi sebagai dosen penguji, serta drh. Okti Nadia Poetri, MSi sebagai moderator seminar atas saran, kritik, dan masukan ilmu untuk perbaikan skripsi.
5. Sonni Martahadi, SKH; Aidell Fitri, Auliya Indiarti, Bagus Setiawan, Megasari Kusuma atas semangat, perhatian, kesabaran, motivasi, bantuan, kekeluargaan, dan kasih sayangnya.
6. Rekan sepenelitian (Retno Setyaningsih, Joko Utomo, dan Ibu Samarang) atas kerja sama, bantuan, dan semangat selama penelitian dan penyelesaian skripsi. 7. Bapak Sulaeman, mba Selin, mba Ade, pak Kosasih, bu Wiwik, pak Agus, dan
8. Keluarga besar Gi44nuzzi (Ridi, Nyit, Amalia, Antok, Rahman, dll) atas tahun-tahun kebersamaan, pengalaman, dan pelajaran berharga.
9. Keluarga besar UKF, terutama UKF ‘5 (Hanna, jeung ‘5, dll) atas kekeluargaan, bantuan, pengalaman, pelajaran, dan ekspedisi berkesan.
10. Goblet ’42 (kak Sheva’Ciripa’, kak Othel, dll), Aesculapius ’43 (kak Unita, kak Tika, kak Putri, mas Umar, kak Roby, dll), Avenzoar ‘45, dan WCC Veteriner (mas Wawan, mas Bian) atas bantuan dan dukungannya.
11. Teman-teman Wisma Nusakambangan (Yasmin, kak Breth, mba Lulu, Icha) atas kebersamaan dan dorongan semangat.
12. Semua pihak yang tidak dapat disebutkan satu per satu yang telah memberikan bantuan, baik secara langsung maupun tidak langsung dalam penyelesaian skripsi ini. Semoga Allah senantiasa membalas kebaikan mereka dan melimpahkan rahmat-Nya.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna. Saran dan kritik untuk penyempurnaan skripsi ini sangat diharapkan. Akhir kata, semoga skripsi ini dapat bermanfaat bagi pembaca.
Bogor, Juli 2011
DAFTAR ISI
Halaman
DAFTAR ISI ... xi
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
1. PENDAHULUAN ……….. 1.1 Latar Belakang ………... 1.2 Tujuan ……… 1.3 Manfaat ……….. 1 1 2 3 2. TINJAUAN PUSTAKA ……… 2.1 Immunoglobulin Y (IgY) ...……… 2.2 Immunoglobulin G (IgG) ……….. 2.3 Fasciola gigantica ………. 2.3 Ekskretori Sekretori ………... 2.4 ELISA ……… 4 4 5 7 10 12 3. METODOLOGI PENELITIAN ……….. 3.1 Waktu dan Tempat Penelitian ……… 3.2 Metode Penelitian ……….. 3.2.1 Pemurnian Immunoglobulin Y (IgY) ………... 3.2.2 Pemurnian Immunoglobulin G (IgG) ………... 3.2.3 Pengukuran Konsentrasi Immunoglobulin Y (IgY) ………. 3.2.4 Pengukuran Konsentrasi Immunoglobulin G (IgG)……….. 3.2.5 Pengujian ELISA ……….……. 3.2.6 Analisis Data ……….…… 14 14 14 14 15 16 16 17 20
4. HASIL DAN PEMBAHASAN ………. 21
5. SIMPULAN DAN SARAN ….………...………... 5.1 Simpulan ……… 5.2 Saran ……….. 29 29 29 DAFTAR PUSTAKA ……… 30
DAFTAR TABEL
No Halaman
1 2
Pengenceran larutan BSA dengan aquabides steril ...………… Nilai cut off konformasi uji ELISA ………...
17 22 3 Perbandingan hasil absorbansi uji ELISA konformasi pertama
dengan nilai cut off ….………... 24 4 Perbandingan hasil absorbansi uji ELISA konformasi kedua
DAFTAR GAMBAR
No Halaman
1 2
Struktur IgG ……….. Siklus hidup cacing hati ………
6 9 3
4
Konformasi pengujian ELISA .………... Nilai absorbansi ELISA konformasi pertama ...……….
17 22 5 Nilai absorbansi ELISA konformasi kedua ..……… 23 4 Perbedaan struktur IgG manusia dengan IgY ……….……….. 26
1. PENDAHULUAN
1.1 Latar Belakang
Fasciolosis merupakan penyakit parasitik yang disebabkan oleh cacing digenetik trematoda yaitu Fasciola hepatica dan Fasciola gigantica yang biasa menyerang ternak ruminansia. Kasus fasciolosis secara epidemiologi merupakan penyakit ternak yang bersifat kosmopolitan karena distribusinya di negara-negara yang memelihara hewan ruminansia (Mitchell 2007). Penyakit ini dapat mengakibatkan kerugian ekonomi karena penurunan produksi daging, susu, wool, bahkan kematian serta pengafkiran hati.
Fasciolosis juga menjadi zoonosis penting di berbagai negara di dunia. Penyakit ini tidak lagi terbatas pada daerah geografi spesifik, namun sudah menyebar ke seluruh dunia. Kasus pada manusia dilaporkan meningkat dari Eropa, Amerika, Oceania, Afrika, dan Asia. Penularan fasiolosis awalnya dipercaya akibat bekerja di peternakan yang terinfeksi. Namun fakta lain menyebutkan bahwa penularan dapat terjadi dari manusia ke manusia. Kasus fasciolosis pada manusia terjadi akibat mengonsumsi tanaman air yang tercemar metaserkaria. Infeksi dapat juga terjadi akibat meminum air yang mengandung metaserkaria dan mengonsumsi makanan serta peralatan dapur yang dicuci air yang mengandung metaserkaria (WHO 2011).
Diagnosis fasciolosis secara konvensional dilakukan melalui pemeriksaan telur cacing pada sampel feses. Metode ini memiliki banyak kekurangan antara lain tingkat sensitifitasnya yang rendah karena telur cacing tidak ditemukan pada periode prepatent. Selain memakan banyak waktu dan tenaga, metode ini juga membutuhkan jumlah dan volume feses yang tepat. Metode ini kurang akurat digunakan pada kasus infeksi kronis karena dapat menghasilkan negatif palsu akibat sekresi telur melalui feses dalam fase infeksi ini bersifat intermitten. Kekurangan lain metode ini adalah tidak dapat mendiagnosis kasus fasciolosis ektopik ketika Fasciola sp. berkembang di jaringan selain di hati (Cauvin et al. 1995; Awad et al. 2009).
Berbagai teknik diagnosa lain telah dikembangkan untuk mengatasi kekurangan pemeriksaan telur cacing dalam feses. Salah satu metode diagnosa
alternatif yang berkembang adalah uji ELISA (Enzime Linked Immunosorbent Assay) untuk mendeteksi antigen cacing dalam tubuh induk semang. Antigen yang dapat dideteksi dalam uji ini antara lain berupa ekstrak kasar cacing, ekskretori sekretori, pemurnian atau molekul rekombinan seperti cathepsin L-1, dan deteksi antigen sirkulasi, serta coproantigen (Carnevale et al. 2001).
Coproantigen adalah antigen cacing yang dilepaskan ke sirkulasi darah dan dikeluarkan ke dalam feses induk semang definitif. Coproantigen umumnya berupa protein ekskretori sekretori (ES) yang merupakan hasil metabolisme cacing sejak cacing berparasit di dalam tubuh inangnya. Ekskretori sekretori yang dihasilkan oleh cacing Fasciola gigantica merupakan salah satu jenis antigen dalam feses ruminansia yang dapat dideteksi dengan uji serologis ELISA (Ridi et al. 2007, Awad et al. 2009).
Pengujian keberadaan suatu antigen membutuhkan antibodi penangkap dan pendeteksi berupa antibodi anti-ekskretori sekretori. Selama ini, antibodi penangkap dan pendeteksi yang umum digunakan berupa antibodi poliklonal dari kelinci dan antibodi monoklonal yang dikembangkan dengan kultur jaringan (Fagbemi 1997; Estuningsih et al. 2004). Penelitian yang dilakukan oleh Satrija et al. (2007) telah menggunakan IgY sebagai antibodi penangkap dari ekskretori sekretori cacing pita Raillietina sp.
Imunoglobulin Y (IgY) belum banyak digunakan dalam berbagai pengujian ELISA, terutama sebagai antibodi penangkap ataupun pendeteksi. IgY memiliki banyak keuntungan dibandingkan antibodi mamalia dalam mendeteksi antigen mamalia. Penelitian ini menguji kemampuan IgY dan IgG sebagai antibodi penangkap dan pendeteksi ekskretori sekretori Fasciola gigantica sehingga dapat diketahui konformasi yang baik untuk digunakan dalam pengujian kasus fasciolosis.
1.2 Tujuan Penelitian
Penelitian ini bertujuan untuk optimasi kemampuan antibodi poliklonal berupa immunoglobulin Y (IgY) dan immunoglobulin G (IgG) sebagai antibodi penangkap dan antibodi pendeteksi untuk mendeteksi ekskretori sekretori hasil metabolisme cacing Fasciola gigantica.
1.3 Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai konformasi pengujian antibodi poliklonal yang lebih baik digunakan sebagai antibodi penangkap dan pendeteksi ekskretori sekretori Fasciola gigantica, sehingga dapat digunakan untuk mendeteksi antigen ekskretori sekretori Fasciola gigantica dalam uji ELISA. Informasi ini dapat digunakan untuk pengembangan kit diagnostik bagi pemeriksaan fasciolosis.
2. TINJAUAN PUSTAKA
2.1 Immunoglobulin Y (IgY)
Immunoglobulin Y atau IgY merupakan antibodi utama pada ayam dan memiliki struktur yang homolog dengan IgG pada mamalia. Perbedaan antara IgY dengan IgG terletak pada fungsi region konstan. IgY ayam tidak memiliki persamaan imunologis dengan IgG mamalia dan urutan DNA IgY ayam lebih menyerupai urutan DNA pada IgE manusia (Carlander 2002). IgY ditemukan oleh Klemperer tahun pada 1893, yang menggambarkan adanya kekebalan pasif terhadap toksin tetanus yang diturunkan dari induk ke anak ayam. Selain pada ayam, IgY juga dapat ditemukan pada serum dan kuning telur pada reptil dan amphibi (Larsson et al. 1993). IgY terdapat dalam kuning telur dan serum ayam dalam bentuk molekul immunoglobulin yang konsentrasinya sekitar 10-20 mg/ml (Patoja et al. 2000).
IgY ditransfer melalui dua cara, yaitu melalui epitel folikel dari ovarium selama masa oogenesis, serupa transfer IgG melalui plasenta pada mamalia (transplacenta), dan melalui kantung kuning telur selama masa embrio (Rose dan Orlans 1981; Gassman et al. 1990). Ig Y memiliki sifat biologik yang merupakan gabungan dari sifat biologik IgE dan IgG (Carlander 2002; Michael 2010).
Immunoglobulin Y merupakan protein yang stabil dan lebih tahan terhadap suhu serta perubahan pH dibandingkan IgG, tapi sangat sensitif terhadap denaturasi (Larsson et al. 1993; Silva dan Tambourgi 2010). Aktivitas IgY dapat dipertahankan cukup lama pada suhu 37 ºC. Aktivitas IgY masih baik sampai jangka waktu 6 bulan dan bahkan dapat dipertahankan selama 10 tahun pada penyimpanan suhu 4 ºC (Larsson et al. 1993). Aktivitas IgY tidak stabil pada suhu di atas 70 ºC dan pH di bawah 4. Inkubasi pada pH di atas 4 masih dapat ditoleransi namun pada pH 2 dengan suhu 37 ºC, aktivitas IgY menurun drastis. Penurunan aktivitas tersebut disebabkan oleh perubahan konformasi (Higgins 1995; Szabo et al. 1998; Michael et al. 2010).
Komponen penyusun IgY sebagian besar berupa molekul protein. Protein merupakan makromolekul amfoter yaitu setiap molekulnya memiliki muatan listrik positif dan negatif. Perbedaan ukuran dan muatan listrik pada setiap
kelompok protein menyebabkan protein dapat dipisahkan (Wilson dan Walker 2000). Ig Y lebih mudah dipisahkan dari protein lain dengan cara pemisahan fraksi yang terlarut pada air. Beberapa metode telah digunakan untuk isolasi dan purifikasi skala besar IgY dari kuning telur. Pada dasarnya tahap pemurnian atau purifikasi protein terdiri dari dua tahap yaitu tahap pertama yang bertujuan untuk mendapatkan larutan protein dan tahap kedua yang bertujuan untuk memisahkan protein berdasarkan ukuran molekul protein (Polson et al. 1980).
Immunoglobulin Y dapat dimurnikan dari serum atau plasma, namun sejauh ini kuning telur menjadi sumber utama untuk pemurnian IgY. Kuning telur dapat dikoleksi setiap hari dari induk ayam yang sama dengan lebih dari 100 mg IgY dari satu telur ayam (Silva dan Tambourgi 2010). Berbagai metode dapat digunakan untuk isolasi IgY dari kuning telur. Metode pemurnian immunoglobulin terbagi dalam dua tahapan yaitu diferensiasi kelarutan bahan dan kromatografi. Pemurnian diferensiasi kelarutan bahan meliputi garam, PEG, dan presipitasi asam kaprilat, sedangkan pemurnian secara kromatografi meliputi filtrasi gel, pertukaran ion, hidroksi apatit, dan afinitas. Bhanushali et al. (1994) telah mengenalkan sebuah metode yang sederhana dan tidak mahal untuk memurnikan IgY melalui pengenceran dengan aqua destilata dan ammonium sulfat 29%. Selain metode tersebut, IgY dapat pula dimurnikan dengan aliran cepat Q Sepharose kromatografi untuk menghilangkan protein nonimmunoglobulin (Silva dan Tambourgi 2010).
2.2 Immunoglobulin G (IgG)
Immunoglobulin G merupakan antibodi monomer yang umum pada mamalia dan diproduksi setelah IgM. IgG dibuat dan disekresikan oleh sel plasma di limpa, limfonodus, dan sumsum tulang. IgG ditemukan dalam jumlah paling besar di dalam darah yaitu sebesar 75% dari seluruh jumlah antibodi sehingga memiliki peranan penting dalam mekanisme perlawanan oleh antibodi (Tizard 2004; Guyton dan Hall 2007). IgG merupakan satu-satunya antibodi yang diturunkan transplasenta untuk menyediakan antibodi bagi perkembangan fetus hingga kekebalan fetus terbentuk sempurna (Harlow dan Lane 1988).
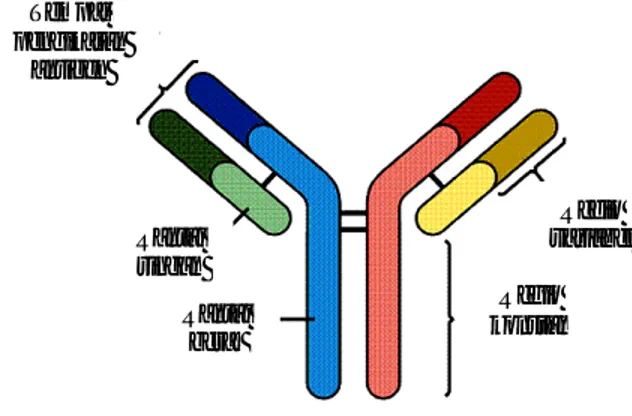
Berat molekul IgG sekitar 180 kDa dan memiliki dua rantai berat serta dua rantai ringan yang identik. Dengan mikroskop elektron, IgG terlihat berupa molekul berbentuk Y dengan “lengan” dari Y yang mampu mengikat antigen (Gambar 1). Kedua fragmen “lengan” dari molekul adalah identik dan masih memiliki kemampuan untuk mengikat antigen. Bagian hipervariabel pada rantai ringan dan rantai berat bersama-sama membentuk suatu tempat pengikatan antigen tunggal. Kekhususan interaksi antara antigen dan antibodi dijelaskan berdasarkan susunan asam amino pada bagian hipervariabel mengakibatkan terjadinya tempat pengikatan antigen yang berbentuk unik. Bentuk konformasi dari tempat pengikatan antigen dengan immunoglobulin itulah yang menentukan determinan antigen khusus yang akan bereaksi dengannya (Tizard 2004).
Gambar 1 Struktur IgG (Mader 1997).
IgG memiliki struktur yang kecil sehingga lebih mudah bersirkulasi di dalam darah. IgG berperan khusus dalam reaksi inflamasi jaringan dengan meningkatkan permeabilitas vascular. IgG merupakan antibodi yang paling efisien dalam mempresipitasi reaksi imun. Waktu paruh biologik IgG ialah selama 23 hari dan merupakan imunitas paling baik sebagai serum transfer (Tizard 2004).
Molekul IgG dibentuk dan diedarkan oleh sel plasma dalam 4 sub-tipe yaitu IgG1, IgG2, IgG3, IgG4. IgG dapat mengaktifkan makrofag untuk mencerna partikel antigen dengan menempelkannya pada antibodi. Keberadaan molekul antibodi yang terdapat di permukaan bakteri dapat menyebabkan aglutinasi dan opsonisasi. IgG juga dihubungkan dengan hipersensitivitas tipe II dan III. IgG
Tempat pengikatan antigen Rantai ringan Rantai berat Regio variabel Regio konstan
dapat mengaktifkan komponen jalur klasik ketika molekul yang dibutuhkan berakumulasi di permukaan antigen (Tizard 2004).
IgG adalah antibodi pertama yang terlibat dalam respon imunitas lanjutan. Keberadaan IgG tertentu pada umumnya diartikan sebagai puncak respon antibodi terhadap antigen. IgG dapat mengikat berbagai macam patogen seperti
virus, bakteri, dan fungi. Patogen dihancurkan dengan cara aglutinasi dan immunisasi. Selanjutnya sistem kekebalan komplemen diaktifkan melalui jalur klasik dengan menggunakan fragmen konstan untuk mengikat patogen. Patogen diopsonisasi dan ditelan oleh makrofag serta neutrofil dengan proses fagositosis dan netralisasi toksin. IgG juga memiliki peran penting dalam mengikat sel NK
(Natural Killer) pada ADCC (Antibody Dependent Cell-mediated Cytotoxicity) (Tizard 2004).
2.3 Fasciola gigantica
Fasciola sp atau biasa disebut cacing hati termasuk dalam Kingdom Animalia, Filum Platyhelminthes, Kelas Trematoda, Subkelas Digenea, Ordo Echinostomida, Family Fasciolidae, dan Genus Fasciola (Kusumamihardja 1992). Cacing ini merupakan salah satu cacing parasit yang banyak menyerang ternak ruminansia seperti domba, kambing, sapi, dan kerbau. Cacing ini juga dapat menjadi parasit pada hewan lain seperti babi, anjing, rusa, zebra, kelinci, marmot, kuda, bahkan manusia (Soulsby 1986). Penyakit yang disebabkan oleh cacing ini dikenal dengan nama fasciolosis, liver rot, ovine fascioliasis,’pokey jaw’, atau distomosis (Foreyt 2001; Mitchell 2007).
Cacing yang biasa ditemukan di Indonesia adalah spesies Fasciola gigantica, sedangkan spesies Fasciola hepatica umumnya ditemukan pada ternak yang diimpor ke Indonesia (Kusumamihardja 1992). Hal ini dikarenakan inang antara yang berperan dalam siklus hidup Fasciola hepatica yaitu Lymnaea truncatula tidak ditemukan di Indonesia, sedangkan inang antara Fasciola gigantica yaitu Lymnaea rubiginosa dapat ditemukan di Indonesia (Kusumamihardja 1992; Mitchell 2007).
Fasciola sp. berbentuk pipih dorsoventral, seperti daun tanpa rongga tubuh. Fasciola gigantica di Indonesia berukuran 14-54 mm, dengan sisi kiri dan
kanan yang hampir sejajar dan bahu yang kurang jelas. Alat penghisap ventral sejajar dengan bahu, besarnya hampir sama dengan alat penghisap mulut, dan kutikula dilengkapi dengan sisik. Usus buntunya bercabang-cabang sejajar dengan sumbu badan, sirus tumbuh sempurna dan kantong sirus mengandung kelenjar prostat serta kantong semen, ovarium bercabang terletak di sebelah kanan garis median, kelenjar vitelin mengisi bagian lateral tubuh (Kusumamihardja 1992).
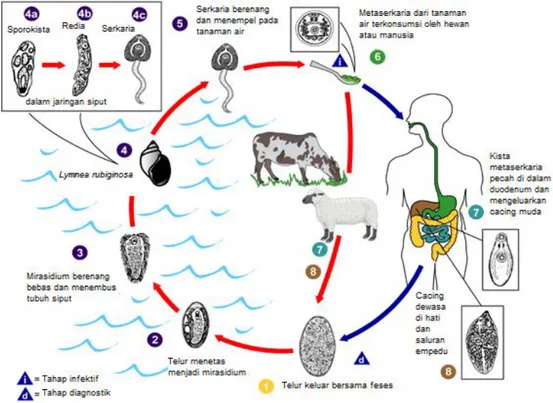
Siklus hidup Fasciola sp. bersifat tidak langsung dan memerlukan inang antara berupa siput air (Gambar 2). Perkembangan dari stadium telur sampai metaserkaria hanya dapat terjadi pada lingkungan yang tergenang air dan bertindak sebagai faktor pembatas siklus hidup cacing di luar tubuh ternak. Cacing dewasa hidup di dalam hati dan saluran empedu inang defenitif. Telur Fasciola gigantica masuk ke dalam duodenum bersama empedu dan keluar bersama tinja hospes definitif. Di luar tubuh ternak, telur berkembang menjadi mirasidium.
Mirasidium memiliki masa hidup hanya beberapa jam sehingga harus segera masuk ke tubuh inang antara yaitu Lymnaea rubiginosa dengan alat penggeraknya berupa silia. Mirasidium masuk ke dalam tubuh siput dengan cara menempel pada bagian ventral siput dan dengan bantuan enzim protease, sehingga epitel kulit siput dapat dihancurkan. Di dalam tubuh siput, mirasidium berkembang menjadi sporokista, redia, dan serkaria. Sporokista yang pecah akan menyebabkan redia terbebas dan secara aktif berpindah menuju hati dan pankreas siput. Sporokista memperbanyak diri dengan pembelahan transversal sehingga dari satu mirasidium terbentuk banyak sporokista. Gumpalan sel di dalam sporokista kemudian tumbuh menjadi redia setelah 10 hari siput terinfeksi mirasidium. Redia yang berbentuk silinder dengan otot kalung leher selanjutnya menghasilkan serkaria dari pembelahan sel pertumbuhannya. Serkaria akan keluar dari tubuh siput, berenang, dan menempel pada tumbuhan air. Serkaria akan berubah menjadi metaserkaria yang berbentuk kista pada tempat yang cocok. Ternak akan terinfeksi apabila minum air atau makan tanaman yang mengandung kista (Soulsby 1986; Mitchell 2007).
Gambar 2 Siklus hidup cacing hati (DPD CDC 2009).
Fasciolosis dapat menyebabkan kerugian ekonomi yang besar akibat kematian ternak, hati yang diafkir, predisposisi penyakit lain, dan biaya perawatan dokter hewan. Patogenesa dan gejala klinis yang ditimbulkan akibat fasciolosis tergantung pada jumlah dan tahap perkembangan cacing hati, tingkat kerusakan yang terjadi, lokasi di dalam tubuh inang, jumlah cacing yang menginfeksi, invasi telur, larva, dan cacing dewasa di dalam jaringan. Fasciola sp. hidup sebagai parasit di saluran empedu dengan merusak sel-sel epitel dan menghisap darang inangnya. Fasciolosis pada kerbau dan sapi biasanya bersifat kronik, sedangkan pada domba dan kambing dapat bersifat akut. Kejadian akut dapat menyebabkan kematian tiba-tiba, sedangkan kejadian kronis menyebabkan anemia, pengafkiran hati, dan penurunan produksi (Soulsby 1986; Mitchell 2007).
Kasus fasciolosis merupakan penyakit ternak yang bersifat kosmopolitan dan distribusinya di negara-negara yang memelihara hewan ruminansia. Prevalensi fasciolosis yang tinggi ditentukan pada bagian dunia dengan curah hujan tinggi dan padang rumput yang basah (Dunn 1994). Malek (1980)
menyatakan faktor penting yang mendukung siklus hidup dan penyebaran Fasciola sp. adalah jumlah ternak yang terinfeksi, keberadaan siput sebagai inang antara, iklim, suhu, kelembaban, komposisi kimia tanah, flora air, dan kecukupan suplai air. Kontrol fasciolosis yang dapat dilakukan antara lain manajemen pakan, anthelmentik, kontrol biologi, vaksinasi, dan nutrisi tambahan (Subandriyo et al. 2004)
2.4 Ekskretori Sekretori (ES)
Cacing umumnya melepaskan protein ekskretori sekretori sebagai produk metabolisme. ES dapat berperan sebagai molekul antigen pemicu respons imunitas inang definitif (Rhoads dan Fetterer 1997). Fasciola sp. menghasilkan berbagai jenis antigen ekskretori sekretori yang berbeda-beda pada berbagai tahap hidupnya yang beredar pada sirkulasi inangnya. Antigen tersebut menjadi pembelajaran terbaik dan potensial untuk diagnostik, yang dikenal dengan gut-associated antigen. Molekul tersebut berasal dari usus parasit dan dilepaskan ke sirkulasi inang melalui regurgitasi regular isi pencernaan usus. Kehadiran ES menjadi indikasi infeksi aktif cacing yang masih hidup ( Shehab et al. 1999).
Cacing dapat melepaskan ekskretori sekretori pada kondisi in vivo dan in vitro. Secara in vivo, ES dilepaskan selama cacing menjalani proses infeksi dan menetap pada inang definitifnya. Secara in vitro, ekskretori sekretori dilepaskan sebagai akibat metabolisme, dan sebagai upaya cacing untuk mendapatkan nutrisi dari lingkungannya (Cock et al. 1993). Rhoads dan Fetterer (1997) menyatakan bahwa pelepasan ekskretori sekretori disebabkan oleh proses perkembangan dan pertahanan parasit seperti penetasan telur dan molting. Ekskretori sekretori dapat merangsang respons imunitas dan berpotensi sebagai alergen.
Ekskretori sekretori (ES) merupakan antigen yang dapat memicu tanggap kebal inang definitif (McKeand et al. 1995). Selain antigen ES, terdapat antigen somatik dan antigen permukaan yang juga merupakan antigen parasit yang dapat dikenali oleh inangnya. Antigen somatik hanya dapat dikenali oleh inang jika cacing tersebut telah mati dan dihancurkan. Antigen permukaan selalu berubah seiring dengan rangkaian perkembangan cacing yang mengalami molting sepanjang hidupnya. Inang definitif sulit untuk memberi respon tanggap kebal
terhadap antigen somatik maupun antigen permukaan. Antigen ES mempunyai sifat untuk lebih dapat dikenali oleh sistem tanggap kebal daripada antigen somatik dan antigen permukaan sehingga diduga lebih protektif untuk memicu respon tanggap kebal (Chowdhury dan Tada 1994).
Antigen ES mengandung glikoprotein yang menutupi kulit cacing dan juga mengandung sebagian kecil enzim sehingga mempermudah migrasi cacing (Bird dan Jean 1991). Enzim tersebut secara konstan dilepaskan untuk memudahkan migrasi ke jaringan inang. Berdasarkan sifatnya tersebut, ES sering digunakan sebagai salah satu upaya untuk mengatasi penyakit kecacingan. Aplikasi ES tersebut antara lain untuk kontrol biologi, pembuatan vaksin ataupun obat dengan menggunakan bahan biologi asal cacing untuk memanipulasi respon kekebalan inang (Wulandari 2004).
Efektifitas penggunaan bahan biologi asal cacing perlu dipertimbangkan karena dapat menimbulkan efek samping yang dapat merugikan. Implikasi akibat terbentuknya kompleks ES dan antibodi dapat menimbulkan lesi patologik, misalnya dalam kasus pemberian vaksin yang berasal dari larva Schistosoma mansoni yang diinduksikan pada baboon kenya menunjukkan perubahan patologi. Mukosa colon ileum terlihat inflamasi berupa granuloma, lesion, hipertropi otot, dan atropi vili (Farah dan Nyindo 1996). Namun perubahan patologik tersebut hanya bersifat sementara dan akan hilang dalam beberapa waktu (Wulandari 2004).
Analisis dua dimensi gel elektroforesis mengindikasikan bahwa Fasciola hepatica melepaskan sekitar 60 protein dalam substansi ekskretori sekretori. Sebanyak 29 protein merupakan protein esensial yaitu cathepsin L protease, superoxide dismuthase, thioredoxin peroxidase, glutathione S transferase, dan protein yang terikat pada asam lemak. Cathepsin L menempati jumlah yang paling banyak ditemukan dalam ES Fasciola sp. (Ridi et al. 2007).
2.5 Enzime Linked Immunosorbent Assay (ELISA)
ELISA atau biasa dikenal juga dengan Enzime Immunoassay (EIA) merupakan salah satu teknik uji serologis yang mulai dikenalkan pada tahun 1971 oleh Engvall dan Perlmann. Prinsip pengujian ini adalah mengukur langsung interaksi antara antigen dan antibodi sehingga termasuk dalam uji pengikatan primer seperti halnya FAT dan RIA (Tizard 2004). Selain uji pengikatan primer, terdapat uji pengikatan sekunder yang mengukur hasil interaksi antigen-antibodi secara in vitro, yaitu uji AGPT, SAT, dan CFT. Uji pengikatan primer lebih sensitif dibanding uji pengikatan sekunder.
ELISA merupakan uji pengikatan primer yang paling banyak digunakan karena hasilnya sangat akurat terutama untuk imunodiagnostik pada penyakit parasitik (Tizard 2004). ELISA dapat digunakan untuk diagnosis penyakit infeksi misalnya dalam mendeteksi adanya antigen (bakteri, virus, parasit atau jamur) atau antibodi. ELISA dapat digunakan untuk mendiagnosa penyakit noninfeksi, seperti evaluasi program vaksinasi, memonitor hormon, obat-obatan, antibiotika, toksin, pestisida, komponen serum, protein onkofetal, sitokin ataupun penyakit-penyakit autoimun (Suwarno 2003).
Ligan dalam reaksi ELISA mengikat antibodi atau antigen yang akan dideteksi oleh antibodi yang telah dikonjugasi dengan enzim. Enzim tersebut akan menghidrolisis substrat yang ditambahkan ke dalam komplek antigen - antibodi. Hidrolisis substrat biasanya berlangsung dalam waktu tertentu dan reaksi dihentikan dengan membubuhkan asam atau basa kuat. Enzim akan menginduksi perubahan warna dari substratnya dan kemudian diukur oleh spektrofotometer (ELISA reader) secara otomatis. Jenis enzim yang biasa digunakan adalah horseradish peroksidase, alkalin fosfatase, glukosa oksidase, dan beta galaksidase. Enzim yang digunakan tidak boleh mengurangi sifat imunologik antigen maupun antibodi (Kresno 2001). Jenis substrat yang digunakan harus disesuaikan dengan enzim yang digunakan untuk mengkonjugasi. Kromogen yang terdapat dalam substrat merupakan indikator warna terjadinya reaksi enzim dengan substrat. Tingkat perubahan warna sebagai indikator reaksi enzim dengan substrat tersebut merupakan penanda konsentrasi antigen atau antibodi yang
diukur (Murtini 2010). Substrat yang paling sering digunakan adalah ortho phenylenediamine (OPD) dan tetramethylbenzidine (TMB) (Kresno 2001).
Hasil pengujian ELISA dapat dinilai secara kualitatif maupun kuantitatif. Penilaian kualitatif dapat dibaca secara visual melalui perubahan warna yang terjadi dan dibedakan dari kontrol yang tidak berwarna (positif atau negatif). Penilaian secara kuantitatif dilakukan dengan membaca perubahan warna yang terbentuk menggunakan ELISA reader. Ada beberapa macam konfigurasi ELISA yang penggunaannya disesuaikan dengan kepentingan penelitian yang dilakukan yaitu ELISA langsung, ELISA tidak langsung, ELISA sandwich, ELISA penangkap antibodi, dan ELISA kompetitif (Burgess 1995). Pengujian ELISA memiliki spesifisitas dan sensitifitas yang tinggi sehingga sangat baik digunakan untuk menetapkan diagnosis secara akurat. ELISA menjadi tes serologis yang paling banyak digunakan karena sederhana, terpercaya dengan mekanisme yang mudah (Awad et al. 2009).
3. METODOLOGI PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Juli 2010 sampai dengan Maret 2011 bertempat di Laboratorium Immunologi Terpadu, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
3.2 Metode Penelitian
3.2.1 Pemurnian Immunoglobulin Y (IgY)
Kuning telur yang digunakan dalam penelitian ini adalah kuning telur yang telah memberikan reaksi positif terhadap antigen Fasciola gigantica dalam uji AGPT. Telur tersebut dihasilkan oleh ayam yang telah diimunisasi dengan antigen ES Fasciola gigantica. IgY diperoleh dengan pemurnian kuning telur menggunakan Kit EGGstarct® IgY Purrification System (PROMEGA). Sampel yang digunakan merupakan kuning telur anti-Fasciola gigantica domba yang diperoleh dari penelitian Satrija et al. (2009). Telur yang akan dimurnikan, sebelumnya dikondisikan dalam suhu ruang sebelum dipecah kerabang telurnya. Kerabang telur kemudian dipecah dan kuning telur dipisahkan dari putih telurnya. Kuning telur ditampung dalam gelas piala steril dan ditimbang beratnya. Selanjutnya ditambahkan larutan presipitasi A sebanyak tiga kali volume kuning telur dan diaduk selama 5 menit untuk menggumpalkan lemak, lalu disentrifuse dengan kecepatan 10000 x g selama 15 menit pada suhu 4 oC. Supernatan hasil sentrifuse disaring melalui 4 lapis kain kasa steril. Filtrat hasil penyaringan ditampung dalam gelas piala steril lalu dengan perlahan-lahan diaduk dan ditambahkan larutan B sebanyak 1/3 dari volume filtrat. Campuran tersebut terus
diaduk selama 5 menit kemudian disentrifuse dengan kecepatan 10000 x g selama 15 menit pada suhu 4 oC.
Pelet presipitat yang terkumpul di dasar tabung dipindahkan ke tabung lain dan supernatan hasil sentrifuse dibuang. Tingkat kemurnian IgY ditingkatkan dari 63% menjadi 90% dengan cara memproses ulang pellet presipitat ulang dengan penambahan larutan B sebanyak 1/3 dari volume filtrat sebelum dilakukan
pengulangan langkah-langkah. Presipitat yang telah terkumpul ditambah dengan PBS sebanyak volume awal kuning telur. Selanjutnya campuran tersebut dihomogenkan lalu dibagi aliquot 1 ml dalam tabung mikro. IgY yang telah dimurnikan disimpan dalam suhu -20 oC sebelum digunakan.
3.2.2 Pemurnian Immunoglobulin G (IgG)
Serum kelinci yang digunakan dalam penelitian ini adalah serum yang telah memberikan reaksi positif terhadap antigen Fasciola gigantica dalam uji AGPT. Serum dihasilkan dari kelinci yang telah diimunisasi dengan antigen ES Fasciola gigantica. Sampel yang digunakan merupakan serum kelinci anti-Fasciola gigantica domba yang diperoleh dari penelitian Satrija et al. (2010). Pemurnian Ig G dilakukan menggunakan Montage® Antibody Purification Kit and Spin Columns (PROSEP®-A Media). Media PROSEP®-A yang digunakan dipre-ekuilibrasi dengan 10 ml Binding Buffer A dan disentifuse dengan spin column pada kecepatan 500 x g selama 30 menit pada suhu 4 oC. Sampel tersebut disaring menggunakan Steriflip-GP filter 0,2 µm.
Serum sebanyak 10 ml ditambahkan dengan 10 ml Binding Buffer A dimasukkan ke dalam spin column untuk disentrifuse pada kecepatan 500 x g selama 30 menit. Supernatan yang berada di dasar tabung dibuang dan spin column dibilas menggunakan 20 ml Binding Buffer A. Larutan disentrifus kembali pada kecepatan 500 x g selama 30 menit pada suhu 4 oC untuk menghilangkan kontaminan yang tidak terikat. Supernatan yang berada di dasar tabung kembali dibuang.
Sebanyak 1,3 ml Neutralization Buffer C dan 10 ml Elution Buffer B2 ditambahkan ke dalam spin column. Selanjutnya disentrifuse kembali pada kecepatan 4500 x g selama 40 menit dengan suhu 4 oC. Supernatan yang berada di dasar tabung diambil dan disaring dengan Amicon 30000, lalu disetrifus dengan kecepatan 4500 x g selama 25 menit pada suhu 4 oC. Cairan yang masih berada di saringan diambil untuk disimpan dalam mikrotube pada suhu -20 oC.
3.2.3 Pengukuran Konsentrasi Immunoglobulin Y (IgY)
Pengukuran konsentrasi IgY dilakukan dengan menggunakan metode EGGstract® IgY Purrification System (PROMEGA). IgY yang akan diukur konsentrasinya dilarutkan dalam PBS dengan perbandingan volume 1:10. Selanjutnya dimasukkan dalam kuvet spektrofotometer dan sebagai kontrol pembanding, digunakan aquades pada kuvet yang lain. Pengukuran konsentrasi dilakukan pada panjang gelombang 280 nm untuk mendapatkan nilai absorbansi. Setelah nilai absorbansi didapatkan, dilakukan perhitungan sesuai dengan ketentuan perhitungan EGGstract® IgY Purification System PROMEGA yaitu:
Konsentrasi IgY (mg/ml) = nilai absorbansi (OD)280 x 10 / 1.36
3.2.4 Pengukuran Konsentrasi Immunoglobulin G (IgG)
Pengukuran konsentrasi IgG dilakukan dengan metode Bradford. Reagen Bradford terdiri dari 100 mg Commasie Briliant Blue yang dilarutkan dalam 50 ml etanol 95% dan ditambahkan 100 ml asam fosfat 85% (w/v). Larutan kemudian diencerkan dengan aquabides hingga volume larutan mencapai 1 liter dan disaring menggunakan kertas saring. Reagen Bradford kemudian diencerkan dengan dua kali pengenceran menggunakan aquades dengan perbandingan 1:4 dan 1:9.
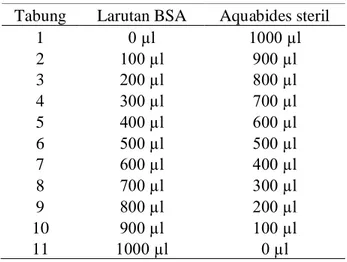
Larutan protein standar yang digunakan adalah Bovine Serum Albumin/ BSA. Sebanyak 1 mg BSA dilarutkan ke dalam 1 ml aquades dan dihomogenkan. Kemudian 11 tabung reaksi steril disiapkan dan diisi dengan larutan BSA serta aquabides steril (Tabel 1). Setelah dihomogenkan, diambil 100 µl dari setiap
tabung dan dimasukkan ke tabung baru yang sebelumnya telah diisi 5 ml larutan Bradford.
Larutan protein BSA digunakan untuk membuat grafik konsentrasi protein standar, yang diukur dengan spektrofotometer pada panjang gelombang 595 nm sebelum mengukur konsentrasi sampel. Sampel berupa antigen ES yang akan diperiksa dibuat duplo. Pembacaan konsentrasi sampel dilakukan dengan spektrofotometer pada panjang gelombang 595 nm.
Tabel 1 Pengenceran larutan BSA dengan aquabides steril Tabung Larutan BSA Aquabides steril
1 0 µl 1000 µl 2 100 µl 900 µl 3 200 µl 800 µl 4 300 µl 700 µl 5 400 µl 600 µl 6 500 µl 500 µl 7 600 µl 400 µl 8 700 µl 300 µl 9 800 µl 200 µl 10 900 µl 100 µl 11 1000 µl 0 µl 3.2.5 Pengujian ELISA
Pengujian ELISA dilakukan dengan dua konformasi lembar kerja yang bertujuan untuk optimasi hasil kedua konformasi sehingga diketahui konformasi yang terbaik (Gambar 3). Perbedaan kedua konformasi yang digunakan terletak pada antibodi penangkap dan antibodi pendeteksi yang digunakan. Pada ELISA konformasi pertama menggunakan IgY sebagai antibodi penangkap dan IgG sebagai antibodi pendeteksi. Sebaliknya pada ELISA konformasi kedua menggunakan IgG sebagai antibodi penangkap dan IgY sebagai antibodi pendeteksi.
A B
Gambar 3 Konformasi pengujian ELISA: (A) Konformasi pertama, (B) Konformasi kedua.
IgG antibodi pendeteksi Substrat Konjugat anti-rabbit Microplate IgY antibodi penangkap Antigen ES Fasciola gigantica IgY antibodi pendeteksi Microplate IgG antibodi penangkap Substrat Konjugat anti-chicken Antigen ES Fasciola gigantica
3.2.5.1 Konformasi 1: IgY sebagai Antibodi Penangkap dan IgG sebagai Antibodi Pendeteksi
IgY anti-Fasciola gigantica domba yang telah diukur konsentrasinya, diencerkan dalam larutan buffer bicarbonate dengan perbandingan 1:1000. Setiap sumur microplate diisi dengan 100 µl IgY dan diinkubasi selama semalam pada
suhu 4 ºC. Microplate yang telah diinkubasi dibilas sebanyak tiga kali dengan 300
µl PBS Tween 0,05% dan dikeringkan.
Tahap selanjutnya adalah blocking menggunakan PBS-skim 5%. Setiap
sumur diisi dengan 100 µl susu skim dan diinkubasi pada suhu 37 oC selama 1 jam. Microplate yang telah diinkubasi dicuci kembali dengan 300 µl PBS Tween
sebanyak tiga kali dan dikeringkan.
Antigen ekskretori sekretori Fasciola gigantica yang diperoleh dari penelitian Satrija et al. (2009), diencerkan ke dalam larutan PBS dengan
perbandingan 1:100. Antigen kemudian dimasukkan 100 µl ke dalam sumur
sesuai lembar kerja dan diinkubasi selama 1 jam pada suhu 37 ºC dan kemudian microplate dicuci dengan 300 µl PBS Tween 0,05% sebanyak tiga kali lalu dikeringkan.
Antibodi pendeteksi yang digunakan adalah IgG anti-Fasciola gigantica domba. IgG diencerkan dengan konsentrasi 1:100, 1:1000, dan 1:10000. Sebanyak
100 µl/ml IgG anti-Fasciola gigantica domba yang telah diencerkan, dimasukkan
ke dalam setiap sumur sesuai dengan lembar kerja dan diinkubasi selama 1 jam pada suhu 37 ºC. Setiap sumur microplate dicuci kembali dengan 300 µl PBS Tween 0,05% sebanyak tiga kali lalu dikeringkan
Microplate kemudian diisi dengan konjugate anti-rabbit yang telah diencerkan dengan pengenceran 1:10000 pada setiap sumur. Selanjutnya microplate diinkubasi selama 1 jam pada suhu 37 ºC . Setiap sumur microplate kemudian dicuci kembali dengan 300 µl PBS Tween 0,05% lalu dikeringkan dan diisi dengan substrat TMB pada setiap sumur dalam keadaan gelap. Selanjutnya diinkubasi kembali selama 30 menit pada suhu ruang. Terakhir dilakukan pembacaan hasil ELISA dengan menggunakan ELISA reader.
3.2.5.2 Konformasi 2: IgG sebagai Antibodi Penangkap dan IgY sebagai Antibodi Pendeteksi
IgG anti-Fasciola gigantica domba yang telah diukur konsentrasinya, diencerkan dalam larutan buffer bicarbonate dengan perbandingan 1:1000. Setiap sumur microplate diisi dengan 100 µl IgG dan diinkubasi selama semalam pada
suhu 4 ºC. Microplate yang telah diinkubasi dibilas sebanyak tiga kali dengan 300
µl PBS Tween 0,05% dan dikeringkan.
Tahap selanjutnya adalah blocking menggunakan PBS-skim 5%. Setiap
sumur diisi dengan 100 µl susu skim dan diinkubasi pada suhu 37 oC selama 1 jam. Microplate yang telah diinkubasi dicuci kembali dengan 300 µl PBS Tween
sebanyak tiga kali dan dikeringkan.
Antigen ekskretori sekretori Fasciola gigantica yang diperoleh dari penelitian Satrija et al. (2009), diencerkan ke dalam larutan PBS dengan
perbandingan 1:100. Antigen kemudian dimasukkan 100 µl ke dalam sumur
sesuai lembar kerja dan diinkubasi selama 1 jam pada suhu 37 ºC dan kemudian microplate dicuci dengan 300 µl PBS Tween 0.05% sebanyak tiga kali lalu
dikeringkan.
Antibodi pendeteksi yang digunakan adalah IgY anti-Fasciola gigantica domba. IgY diencerkan dengan konsentrasi 1:100, 1:1000, dan 1:10000. Sebanyak
100 µl/ml IgY anti-Fasciola gigantica domba yang telah diencerkan, dimasukkan
ke dalam setiap sumur sesuai dengan lembar kerja dan diinkubasi selama 1 jam pada suhu 37 ºC. Setiap sumur microplate dicuci kembali dengan 300 µl PBS
Tween 0,05% sebanyak tiga kali lalu dikeringkan
Microplate kemudian diisi dengan konjugate anti-chicken yang telah diencerkan dengan pengenceran 1:10000 pada setiap sumur. Selanjutnya microplate diinkubasi selama 1 jam pada suhu 37 ºC . Setiap sumur microplate kemudian dicuci kembali dengan 300 µl PBS Tween 0,05% lalu dikeringkan dan diisi dengan substrat TMB pada setiap sumur dalam keadaan gelap. Selanjutnya diinkubasi kembali selama 30 menit pada suhu ruang. Terakhir dilakukan pembacaan hasil ELISA dengan menggunakan ELISA reader.
3.2.6 Analisis Data
Analisis data dilakukan dengan membandingkan nilai absorbansi dari konformasi pengujian ELISA dengan nilai cut off masing-masing pengujian.
Ratio = rata-rata absorbansi pengujian nilai cut off
Cut off adalah batas nilai absorbansi positif dan negatif dari suatu pengujian. Nilai cut off ditentukan dengan rata-rata absorbansi kontrol negatif masing-masing pengujian ditambah dengan tiga kali nilai standar deviasi (Ath 1995). Hasil uji yang memiliki nilai perbandingan (ratio) yang paling besar merupakan pengujian yang terbaik.
4. HASIL DAN PEMBAHASAN
Konsentrasi immunoglobulin Y (IgY) yang diperoleh dalam penelitian ini adalah 9,57 mg/ml dan immunoglobulin G (IgG) adalah 3,75 mg/ml. Pada penelitian ini, antibodi yang dilapiskan diencerkan 1:1000, sehingga besarnya protein IgY yang dilapiskan adalah 9,57 µg/ml dan IgG sebesar 3,75 µg/ml.
Pelapisan antibodi dengan pengenceran 1:1000 tersebut merupakan konsentrasi yang cukup, karena menurut Stewart et al. (1990) konsentrasi suatu antibodi yang dilapiskan (coating) pada permukaan microplate berkisar 1-10 µg/ml.
Konformasi pertama uji ELISA dilakukan dengan menggunakan IgY sebagai antibodi penangkap antigen ekskretori sekretori (ES) Fasciola gigantica diikuti IgG sebagai antibodi pendeteksi. Uji ELISA konformasi kedua menggunakan IgG sebagai antibodi penangkap ES Fasciola gigantica diikuti IgY sebagai antibodi pendeteksi. Pada kedua uji tersebut, batas nilai penentuan deteksi antigen ES Fasciola gigantica positif terdeteksi, dilihat dari perbedaan cut off pada masing-masing uji. Nilai cut off pada masing-masing uji dihitung dari rataan nilai absorbansi kontrol negatif yang ditambahkan dengan tiga kali nilai standar deviasi. Kontrol negatif yang digunakan adalah larutan PBS yang tidak menggunakan antigen ES Fasciola gigantica. Rataan nilai absorbansi hasil pengujian yang lebih besar dari nilai cut off merupakan hasil pengujian yang bernilai positif. Sebaliknya, rataan nilai absorbansi hasil pengujian yang lebih kecil dari nilai cut off merupakan hasil pengujian yang bernilai negatif.
Nilai cut off pada ELISA konformasi pertama adalah 0,1026, yang didapatkan dengan menjumlahkan nilai absorbansi 0,0735 dengan 3 kali standar deviasi 0,0097. Nilai cut off pada ELISA konformasi kedua dengan IgG sebagai antibodi penangkap dan IgY sebagai antibodi pendeteksi adalah 0,1172, yang didapatkan dengan menjumlahkan nilai absorbansi 0,0648 dengan tiga kali standar deviasi 0,0175. Nilai cut off masing-masing pengujian dijabarkan pada Tabel 2.
Tabel 2 Nilai cut off konformasi uji ELISA Konformasi Antibodi penangkap Antibodi pendeteksi Nilai absorbansi Standar
deviasi Cut off 1 IgY IgG 0,0735 0,0097 0,1026 2 IgG IgY 0,0648 0,0175 0,1172
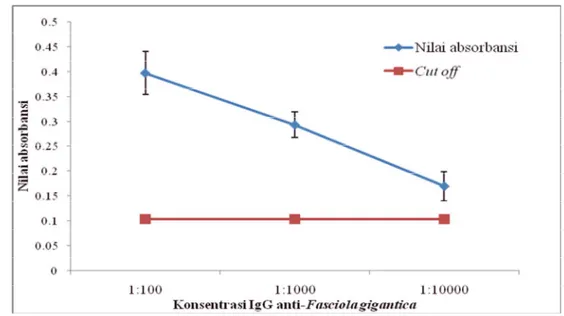
Hasil pengujian ELISA konformasi pertama (Gambar 4) menunjukkan seluruh nilai absorbansi hasil pengujian positif karena berada di atas nilai cut off. Konsentrasi ikatan antigen antibodi yang terbentuk semakin mengecil seiring dengan penurunan konsentrasi IgG anti-Fasciola gigantica sebagai antibodi pendeteksi. Nilai absorbansi yang paling tinggi berada pada konsentrasi IgG anti-Fasciola gigantica sebagai antibodi pendeteksi dengan pengenceran 1:100 yaitu 0,3970 ± 0,04298. Pada pengenceran 1:1000 nilai absorbansi menjadi 0,2927 ± 0,02586 dan nilai absorbansi yang terendah dengan pengenceran 1:10000 yaitu 0,1691 ± 0,02947.
Gambar 4 Nilai absorbansi (OD) ELISA konformasi pertama dengan IgY sebagai antibodi penangkap dan IgG sebagai antibodi pendeteksi.
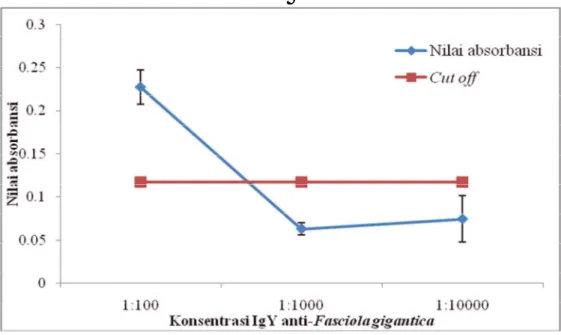
Hasil pengujian ELISA konformasi kedua (Gambar 5) menunjukkan hasil yang fluktuatif. Nilai absorbansi tertinggi dicapai pada IgY sebagai antibodi
deteksi dengan pengenceran 1:100 yaitu 0,2275 ± 0,01985 dan bernilai positif karena berada di atas nilai cut off. Pada pengenceran 1:1000 dan 1:10000, nilai absorbansi menurun menjadi 0,0628 ± 0,00725 dan 0,0742 ± 0,0270. Kedua nilai absorbansi tersebut bernilai negatif karena berada di bawah nilai cut off.
Gambar 5 Nilai absorbansi (OD) ELISA konformasi kedua dengan IgG sebagai antibodi penangkap dan IgY sebagai antibodi pendeteksi.
Hasil pengujian ELISA konformasi pertama dengan menggunakan IgY sebagai antibodi penangkap memiliki sensitifitas yang lebih tinggi dibandingkan IgG sebagai antibodi penangkap. IgY masih dapat mendeteksi antigen ekskretori sekretori Fasciola gigantica dengan IgG sebagai antibodi pendeteksi hingga pengenceran 1:10000, sedangkan ELISA konformasi kedua, IgG hanya dapat menangkap antigen ekskretori sekretori Fasciola gigantica dengan IgY sebagai antibodi pendeteksi pada pengenceran 1:100. Perbedaan kemampuan ini disebabkan karena perbedaan konsentrasi immunoglobulin yang dilapiskan pada permukaan microplate.
Hasil konformasi pertama uji ELISA (Tabel 3) menunjukkan pada pengenceran antibodi pendeteksi 1:100, IgY mampu menangkap antigen 3,87 kali dari nilai cut off. Pada pengenceran antibodi pendeteksi 1:1000 dan 1:10000, IgY mampu menangkap antigen 2,85 hingga 1,65 kali dari nilai cut off. Berbeda
dengan konformasi kedua uji ELISA (Tabel 4), IgG hanya mampu menangkap antigen 1,91 kali dari nilai cut off. Nilai tersebut diperoleh dari pengenceran antibodi pendeteksi 1:100. Pada konsentrasi antibodi pendeteksi 1:1000 dan 1:10000, IgG sudah tidak mampu menangkap antigen ekskretori sekretori Fasciola gigantica dan bernilai negatif.
Tabel 3 Perbandingan hasil absorbansi uji ELISA konformasi pertama dengan nilai cut off
Cut off Pengenceran IgG antibodi deteksi 1: 100 1:1000 1:10000
0,1026 0,397 ± 0,04298 0,2927 ± 0,02586 0,1691 ± 0,02947 3,87 2,85 1,65
Tabel 4 Perbandingan hasil absorbansi uji ELISA konformasi kedua dengan nilai cut off
Cut off Pengenceran IgY antibodi deteksi
1: 100 1:1000 1:10000
0,1172 0,2275 ± 0,01985 0,0628 ± 0,00725 0,0742 ± 0,0270
1,91 0,54 0,63
Hasil pengujian tersebut menunjukkan bahwa optimasi yang baik diperoleh dari konformasi pertama yaitu IgY sebagai antibodi penangkap dengan pengenceran 1:1000 dan IgG sebagai antibodi pendeteksi dengan pengenceran 1:100. Konformasi tersebut mampu menghasilkan nilai absorbansi paling jauh dari nilai cut off yaitu 3,87 kali. Penelitian yang dilakukan oleh Estuningsih (2006), dengan menggunakan IgG anti-ekskretori sekretori Fasciola gigantica sebagai antibodi penangkap (1:1600) dan antibodi pendeteksi (1:1600), mampu menghasilkan nilai absorbansi 7 kali dari nilai cut off. Berdasarkan hasil tersebut, dapat diketahui bahwa IgY memiliki kemampuan sebagai antibodi penangkap dalam pengujian ELISA.
Antibodi IgY memiliki potensi untuk dikembangkan sebagai antibodi penangkap dalam berbagai pengujian ELISA. Dalam berbagai pengujian deteksi
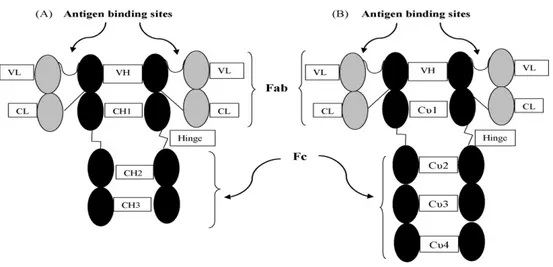
fasciolosis dengan uji ELISA, belum ada pengujian yang menggunakan IgY sebagai antibodi penangkap ekskretori sekretori Fasciola gigantica. Menurut Silva dan Tambourgi (2010), IgY dapat mengenali lebih banyak epitop antigenik dibandingkan dengan antibodi yang diproduksi mamalia. Perbedaan kemampuan kedua immunoglobulin dalam menangkap antigen disebabkan karena perbedaan struktur kedua immunoglobulin tersebut. Struktur ini yang berpengaruh pada kemampuan IgY dalam menangkap antigen. Perbedaan struktur IgY dan IgG terletak pada bagian leher IgY yang disebut hinge.
Struktur immunoglobulin terdiri dari empat rantai polipeptida dasar yang terdiri dari 2 rantai berat (heavy chain) dan dua rantai ringan (light chain) yang identik (Gambar 6). Setiap rantai terikat pada rantai berat melalui ikatan disulfide (S-S), demikian pula rantai berat satu dengan lainnya dihubungkan dengan ikatan S-S (Schade et al. 1999). Rantai berat IgY (65 105 Da) sering disebut dengan
“upsilon”, υ, mempunyai satu bagian variable (VH) dan empat bagian konstan
(Cυ1, Cυ2, Cυ3, Cυ4), serta tidak memiliki daerah lengan. Rantai ringan (18 660
Da) tersusun atas satu bagian variable (VL) dan satu bagian konstan yang tetap
(CL). Berbeda dengan IgG yang memiliki empat rantai pada rantai beratnya, yaitu tiga rantai konstan (Cγ1, Cγ2, dan Cγ3) dan satu rantai variable (VH) (Schade et
al. 1999). Pada struktur IgG, daerah Cγ2 dan Cγ3 berhubungan erat dengan daerah
Cγ3 dan Cγ4, dan saat Cγ2 absen, maka digantikan oleh daerah lengan yang
disebut hinge, yang menjadi keunikan struktur antibodi mamalia (Schade et al. 1999; Michael et al. 2010).
Bagian leher (hinge) IgY tidak fleksibel seperti pada IgG (Warr et al. 1995). Pembatasan gerakan region hinge (Cυ2) dalam rantai berat membuat IgY menjadi tidak fleksibel. Selain itu, terdapat beberapa regio pada IgY yang berisi sisa proline dan glycin sehingga membatasi kefleksibelan IgY. Hal ini akan berpengaruh pada kemampuan antibodi untuk mempresipitasi ataupun mengaglutinasi antigen (Carlander 2002).
Gambar 6 Perbedaan struktur IgG manusia (A) dengan IgY (B). (Silva dan Tambourgi 2010)
Sebagian besar fungsi efektor biologi immunoglobulin diaktifkan oleh region Fc yang merupakan perbedaan utama struktur IgG dan IgY. Regio inilah yang bertanggung jawab terhadap perilaku IgY ketika dikombinasikan dengan antigen. Regio Fc pada IgY tidak mengaktifkan faktor komplemen, tidak berikatan dengan protein A dan protein G, dan tidak berikatan dengan antibodi mamalia (Gao et al 2008; Chai dan Chen 2009; Michael et al. 2010). Faktor ini menyebabkan hasil negatif palsu maupun positif palsu pada pengujian immunologi dapat diminimalisasi.
Antibodi IgY maupun IgG merupakan antibodi poliklonal. Antibodi poliklonal memiliki sifat yang relatif stabil dibandingkan dengan antibodi monoklonal. Antibodi poliklonal memiliki campuran kompleks antibodi dengan spesifisitas, afinitas, dan isotipe yang berbeda. Antibodi poliklonal bereaksi dengan sejumlah antigen determinan yang berbeda pada antigen. Reaktivitas multipel ini dapat mengakibatkan terbentuknya kompleks antigen antibodi yang besar yang memiliki aplikasi praktis dalam presipitasi antigen (Smith 1995).
Antibodi poliklonal lebih mudah menimbulkan reaksi silang. Reaksi ini terjadi akibat kehadiran antibodi terhadap antigen selain antigen yang digunakan yang tidak berkaitan dan tidak relevan. Reaksi silang dapat terjadi karena epitop yang sama dimiliki oleh antigen yang berbeda atau epitop yang secara struktur
mirip atau memiliki keserupaan dengan epitop pembuat peka (priming epitop) yang dikenali oleh antibodi (Smith 1995).
Struktur IgY yang lebih rigid dapat meminimalisasi terjadinya reaksi silang karena memiliki spesifisitas yang tinggi. Berbeda dengan IgG, karena strukturnya yang lebih fleksibel, sehingga antibodi ini memiliki sensitifitas yang tinggi. Hal inilah yang menjadi salah satu keunggulan penggunaan IgY dalam berbagai pengujian serologis.
Jarak filogenetik yang jauh antara unggas dan mamalia, menjadikan unggas sebagai produsen potensial penghasil antibodi untuk melawan protein mamalia yang terkonservasi. Evolusi tersebut menunjukkan bahwa tidak ada reaksi silang imunologis antara IgY dengan IgG. Serum kelinci akan menghasilkan 1% hingga 5% antibodi untuk melawan antigen mamalia yang spesifik. Kuning telur unggas mampu menghasilkan 2% hingga 10% antibodi untuk melawan antigen mamalia yang spesifik. Selain itu, antibodi untuk melawan protein mamalia yang terkonservasi seringkali gagal dihasilkan dari respon imun kelinci, namun antibodi tersebut sering sukses dihasilkan dari sistem imun unggas (Carlander 2002).
Keunggulan lain menggunakan IgY dalam pengujian serologis adalah IgY tidak bereaksi dengan faktor rheumatoid (RF) dan Human Anti-Mouse Antibodi IgG (HAMA). RF dan HAMA seringkali menyebabkan hasil positif palsu maupun negatif palsu dalam pengujian immunologi. RF merupakan autoantibodi yang bereaksi dengan bagian Fc pada IgG mamalia. RF ataupun HAMA dapat bereaksi dengan antibodi penangkap dan antibodi pendeteksi dalam uji ELISA sandwich. Reaksi dengan antibodi pendeteksi akan menghasilkan kompleks imun. HAMA juga akan bereaksi dengan antigen yang berikatan dengan epitop dan menghambat pengikatan antigen. Adanya RF dan HAMA ini akan meningkatkan sensitifitas pengujian ELISA. IgY tidak bereaksi dengan RF ataupun HAMA sehingga hasil pengujian negatif palsu ataupun positif palsu dapat ditekan (Larsson dan Sjoquist 1990; Carlander 2002; Zhang 2003; Michael et al. 2010).
Teknik ELISA dengan menggunakan IgY anti-Fasciola gigantica sebagai antibodi penangkap dapat digunakan dalam teknik diagnosis kasus fasciolosis. Teknik ini diharapkan dapat menciptakan suatu bentuk kit ELISA yang dapat mendeteksi fasciolosis melalui feses ternak (coproantigen). Ekskretori sekretori Fasciola gigantica akan dikeluarkan oleh cacing bersamaan dengan feses ternak. Dengan demikian, melalui ekskretori sekretori yang terdapat dalam feses akan ditangkap oleh IgY anti-Fasciola gigantica.
5. SIMPULAN DAN SARAN
5.1 Simpulan
Optimasi yang baik dalam pengujian ini diperoleh dari konformasi IgY sebagai antibodi penangkap pada pengenceran 1:1000 (9,57 µg/ml) dan IgG
sebagai antibodi pendeteksi pada pengenceran 1:100 (37,5 µg/ml). Konformasi
tersebut mampu menghasilkan nilai absorbansi 3,87 kali dari nilai cut off.
5.2 Saran
Penelitian lebih lanjut dengan menggunakan feses ternak yang mengandung antigen ekskretori sekretori Fasciola gigantica dari ternak yang positif terinfeksi Fasciola gigantica.
DAFTAR PUSTAKA
[DPD CDC]. 2009. Fascioliasis. [terhubung berkala]. http://www.dpd.cdc.gov/dpdx [4 Desember 2010].
Ath G de. 1995. ELISA sebagai Proses Pengukuran: Beberapa Pertimbangan Statistik. Di dalam: Artama WT, penerjemah; Burgess GW, editor. Teknologi ELISA dalam Diagnosis dan Penelitian. Yogyakarta: Gadjah Mada University Press. Terjemahan dari: ELISA Technology in Diagnosis and Research.
Awad WS, Ibrahim AK, Salib FA. 2009. Using indirect ELISA to assess different antigens for the serodiagnosis of Fasciola gigantica infection in cattle, sheep, and donkeys. Res Vet Sci 86:466-471.
Bird AF, Jean B. 1991. The Structure of Nematodes Second Edition. California, San Diego: Academic Press Inc.
Burgess GW. 1995. Prinsip Dasar ELISA dan Variasi Konfigurasinya. Di dalam: Artama WT, penerjemah; Burgess GW, editor. Teknologi ELISA dalam Diagnosis dan Penelitian. Yogyakarta: Gadjah Mada University Press. Terjemahan dari: ELISA Technology in Diagnosis and Research.
Cai YC, Chen JX. 2009. Chicken egg yolk immunoglobulin and its application in medicine. Zhongguo Ji Sheng Chong Xue Yu Ji Sheng Chong Bing Za Zhi 27(6):527-530.
Carlander D. 2002. Avian Ig-Y Antibody: In Vitro and In Vivo. Comprehensive Summaries of Uppsala Disertations from the Faculty of Medicine 1119. Uppsala: Acta Universities Upsaliensis.
Carnevale S, Rodríguez MI, Santillán G, Labbé JH, Cabrera MG, Bellegarde EJ, Velásquez JN, Trgovcic JE, Guarnera EA. 2001. Immunodiagnosis of human fascioliasis by an Enzyme-Linked Immunosorbent Assay (ELISA) and a micro-ELISA. Clin Diag Lab Immun 8:174-177.
Cauvin A, Bouvet G, Boulard C. 1995. Humoral and cellular immune responses to Fasciola hepatica experimental primary and secondary infection in sheep. Int J Parasitol 25:1227-1241.
Chowdhury N, Tada I. 1994. Helminthology. New Delhi: Spinger – Verlag, Norasa Publising House.
Cock H de, Knox DP, Claerebout E, Graaf DC de. 1993. Partial characterization of proteolytic enzymes in different developmental stages of Ostertagia ostertagi. J Helminthol 67:271-278.
Dunn P. 1994. The Goatkeeper’s Veterinary Book Third Edition. London: Farming Press.
Estuningsih SE. 2006. Diagnosis of Fasciola gigantica infection in cattle using capture ELISA assay for detecting antigen in faeces JITV 11(3):229-234. Estuningsih SE, Widjajanti S, Adiwinata G, Piedrahita D. 2004. Detection of
coproantigen by sandwich ELISA in sheep experimentally infected with Fasciola gigantica. Trop Biomed 21(2):51-56.
Fagbemi BO, Aderibigde AO, Guobadia EE. 1997. The use of monoclonal antibody for immunodiagnosis of Fasciola gigantica infection in cattle. Vet Parasitol 69:231-240.
Farrah IO, Nyindo M. 1996. Schistosoma mansoni induces in the kenya baboon a novel intestinal pathology that manifestly modulated by an irradiated cercarial vaccine. J Parasitol. 72:285-308.
Foreyt WJ. 2001. Veterinary Parasitology Reference Manual Fifth Edition. America: Lowa State University Press.
Gao J, Zhou YC, Huang YF. 2008. Purification and clinical application of egg yolk immunoglobulins. Zhonghua Nan Ke Xue 14(2):166-170.
Gassman M, Pia T, Thomas W, Ulrich H. 1990. Efficient production of chicken egg yolk antibodies against a conserved mammalian protein. Foseb J 4:2528-2532.
Guyton AC, Hall JE. 2007. Buku Ajar Fisiologi Kedokteran Edisi ke-11. Irawati, et al, penerjemah; Rachman LY, editor. Jakarta: EGC. Terjemahan dari: Textbook of Medical Physiology11th Edition.
Harlow E, Lane D. 1988. Antibodies, A Laboratory Manual. USA: Cold Spring Harbor Laboratory
Higgins DA, Cromie RL, Liu SS, Magor KE, Warr GW. 1995. Purification of duck immunoglobulin: an evaluation of protein A and protein G affinity chromatography. Vet Immunol Immunop 44:169-180.
Kresno SB. 2001. Imunologi: Diagnosis dan Prosedur Laboratorium. Edisi ke-4. Jakarta: Balai Penerbit FKUI.
Kusumamihardja S. 1992. Parasit dan Parasitosis pada Hewan Ternak dan Hewan Piaraan di Indonesia. Bogor: Pusat Antar Universitas Bioteknologi IPB.
Larsson A, Ballow RM, Lindahl TL, Frosberd PO. 1993. Chicken antibodies: taking advantages of evolution a review. Poultry Sci 72:1807-1812.