Menerapkan teori atom mekanika kuantum untuk menuliskan konfiurasi elektron dan diairam orbital serta meniiunakannya pada penentuan letak unsur dalam tabel priodik
A. Teori atom mekanika kuantum/gelombang:
Teori atom Niels bohr walaupun telah mengalami modifikasi masih memiliki banyak kekurangan, oleh karena itu masih dimungkinkan lahirnya teori tentang struktur atom yang lebih modern.
Pendekatan secara modern diawali dengan dikemukakannya azas de Broglie (1923-1924) yang mengatakan bahwa “Energi radiasi yang dipancarkan oleh materi merupakan paket-paket kecil yang disebut kuanta” Energi radiasi tersebut selain bersifat gelombangjuga bersifat sebagai materi yang terdiri atas partikel-partikel . Partikel radiasi itu oleh Einstein menyebutnya sebagai Foton. Energi foton bergantung pada frekuensinya sesuai persamaan : E = h.f Dimana : E = energi
h = tetapan Planck ( 6,63 x 10-34 J det )
f = frekuensi
Sebagai akibat dari sifat dualisme partikel golombang, seorang ahli fisika jerman bernama Werner Karl Heisenberg (1901-1968) pada tahun 1927 mengemukakan prinsip ketidakpastian yang menyatakan :“ tidak mungkin kita dapat menentukan posisi dan momentum yang pasti dari suatu elektron dalam atom, yang dapat ditentukan adalah kebolehjadian menemukan elektron disuatu daerah pada jarak tertentu dari intinya”, Prinsip ketidakpastian ini merupakan hasil penjabaran logis sifat gelombang dari paetikel, karena sifat gelombang akan menyebar ke segala arah. oleh karena itu elektron dalam atom tidak dapat dijumpai dalam orbit seperti yang dikemukakan oleh Bohr, tetapi kebolehjadian untuk menemukan elektron pada suatu daerah tertentu dalam ruang disekitar inti yang disebut Orbital.
Pada tahun yang sama Erwin Schrodinger mengembangkan teori baru sebagai akibat dari penemuan de Broglie dan prinsip ketidakpastian dari Heisenberg yang disebut teori Mekanika kuantum. Persamaan yang paling umum digunakan dalam mekanika kuantum adalah persamaan dari schrodinger berupa persamaan gelombang yang menggambarkan bentuk dan kelakuan dari suatu elektron dalam atom yang diturunkan secara matematik yaitu:
δ
2ψ
δ x
2+
δ
2ψ
δ y
2+
δ
2ψ
δ z
2+
8
π
2m
h
2(
w
−
v
)
ψ
=
0
, dan untuk gerakan gelombang diperoleh :d
2ψ
dx
2+
8
π
2m
h
2(w
−v
)
ψ=0
Jadi menurut teori atom mekanikan kuantum, elektron-elektron dalam atom bergerak mengelilingi inti pada tingkat-tingkat tertentu. Suatu tingkat-tingkat energi terdiri atas satu atau lebih subtingkat-tingkat (subkulit) dan setiap subkulit terdiri atas satu atau lebih orbital. Dalam orbital tertentu elektron-elektron mempunyai energi tertentu yang berbeda dengan elektron-elektron pada orbital yang lain, oleh karena itu orbital menggambarkan tingkat energi elektron.
B. Bilangan Kuantum
Menurut teori mekanika Kuantum, elektron berada dalam orbital. Setiap orbital mempunyai bentuk dan tingkat energi tertentu. Untuk menyatakan kedudukan atau posisi elektron dalam suatu atom dan membedakannya dari elektron yang lain dapat digunakan dengan 4 jenis bilanga kuantum, yaitu
1. Bilangan Kuantum Utama (Principle Quantum Number = n)
Yaitu bilangan kuantum yang menyatakan letak elektron pada lintasan / kulit elektron ataupun tingkat energi. Harga n = 1, 2, 3, …dst
n = 1, elektron terletak pada kulit K (kulit yang paling dekat pada inti atom) n = 2, elektron terletak pada kulit L
n = 3, elektron terletak pada kulit M n = 4, elektron terletak pada kulit K dan seterusnya
Makin besar harga n, makin jauh letaknya dari inti atom (tingkat energinya semakin besar)
2. Bilangan Kuantum azimut /sudut (Azimuthal Quantum Number = l )
Yaitu bilangan kuantum yang menyatakan letak elektron pada subkulit/orbital. Harga l = 1, 2, 3, …dst
l = 1, elektron terletak pada subkulit/orbital s
l = 2, elektron terletak pada subkulit/orbital p
l = 3, elektron terletak pada subkulit/orbital d
l = 4, elektron terletak pada ubkulit/orbital f dan seterusnya.
Catatan : sampai saat ini elektron-elektron baru menempati sub kulit-sub kulit s, p, d dan f, sedangkan sub kulit g, h dan seterusnya belum berisi elektron
3. Bilangan Kuantum Magnetik (Magnetic Quantum Number = m)
Yaitu bilangan kuantum yang menyatakan kedudukan elektron pada orbital dan orientasi dari orbital itu. Untuk setiap harga l , terdapat (2 l + 1) macam harga m
l = 1, m = 0, ( terdapat 1 macam harga m artinya subkulit s mempunyai 1 orbital)
l = 2, m = -1, 0, +1 (terdapat 3 macam harga m, artinya subkulit p mempunyai 3 orbital
l = 3, m = -2, -1, 0, +1, +2 (terdapat 4 macam harga m, artinya subkulit d mempunyai 5 orbital)
l = 4, m = -3, -2, -1, 0, +1, +2, +3 (terdapat 5 macam harga m, artinya subkulit f mempunyai 7 orbital)
4. Bilangan kuantum spin (Spin Quantum Number = s)
Yaitu bilangan kuantum yang menyatakan arah rotasi elektron. Untuk setiap harga m terdapat dua macam kemungkinan harga s yaitu s = +½ dan s = -½.
Menurut perjanjian elektron yang berotasi searah jarum jam harga s = +½ dan elektron yang berotasi berlawa-nan arah dengan putaran jarum jam, harga s = -½. Oleh karena pada satu orbital hanya berisi maksimum dua elektron, maka arah spin yang berlawanan dilambangkan dengan dua anak panah yang memiliki arah yang berlawanan
+½ -½
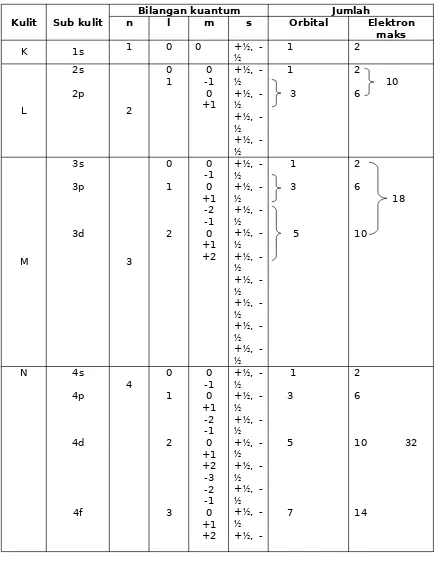
Tabel 1 : Hubungan Bilangan Kuantum dengan banyaknya elektron maksimum tiap kulit
Kulit Sub kulit
Bilangan kuantum Jumlah
n l m s Orbital Elektron
maks
K 1s 1 0 0 +½, -½ 1 2
L 2s 2p 2 0 1 0 -1 0 +1 +½, -½ +½, -½ +½, -½ +½, -½ 1 3 2 10 6 M 3s 3p 3d 3 0 1 2 0 -1 0 +1 -2 -1 0 +1 +2 +½, -½ +½, -½ +½, -½ +½, -½ +½, -½ +½, -½ +½, -½ +½, -½ +½, -½ 1 3 5 2 6 18 10 N 4s 4p 4d 4f 4 0 1 2 3 0 -1 0 +1 -2 -1 0 +1 +2 -3 -2 -1 0 +1 +2 +½, -½ +½, -½ +½, -½ +½, -½ +½, -½ +½, -½ +½, -½ +½, 1 3 5 7 2 6
10 32
14
+3 ½ +½, -½ +½, -½ +½, -½ +½, -½ +½, -½ +½, -½ +½, -½ +½, -½
Dari tabel di atas tampak bahwa : Sub kulit s maksimum berisi 2 elektron Sub kulit p maksimum berisi 6 elektron Sub kulit d maksimum berisi 10 elektron Sub kulit f maksimum berisi 14 elektron dituliskan : s1-2, p1-6, d1-10, f1-14
Contoh soal 1:
Tentukan harga n, l, m dan s untuk elektron yang berada pada orbital 3p Jawab :
n = 3 ( terletak pada kulit M)
l = 1 ( sub kulit p )
m = -1, 0, +1 ( sub kulit p mempunyai 3 orbital ) s = +½ dan -½
C. Konfigurasi elektron
Adalah gambaran tentang penyebaran elektron-elektron ke dalam orbital-orbital dari kulit elektron. Atom suatu unsur mempunyai konfigurasi elektron yang khas untuk unsur tersebut. Untuk memahami penulisan konfigurasi elektron suatu unsur, perlu diketahui terlebih dahulu aturan-aturan pengisian orbital oleh elektron tersebut yaitu :
1. Prinsip Aufbau :
Menyatakan bahwa orbital atom terisi elektron sesuai dengan energi relatifnya.Orbital dengan energi yang lebih rendah terisi elektron lebih dulu. Dengan demikia elektron pertama selalu akan masuk ke dalam orbital 1s, jika orbital 1s sudah penuh maka elektron berikutnya akan masuk ke dalam orbital 2s dan seterusnya sesuai jumlah elektron yang dimiliki unsur itu.
Urutan tingkat energi sub kulit adalah sebagai berikut :
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
Contoh pengisian elektron-elektron dalam orbital beberapa unsur: Atom H : mempunyai 1 elektron, konfigurasinya 1s1
Atom C : mempunyai 6 elektron, konfigurasinya 1s2 2s2 2p2
Atom K : mempunyai 19 elektron, konfigurasinya 1s2 2s2 2p6 3S2 3p6 4s1
Contoh soal 2 :
Tuliskan konfigurasi elektron dari : 7N, 10Ne dan 27Co
Jawab :
7N : 1s2 2s2 2p3 ( dibaca: satu es dua, dua es dua, dua pe tiga ) 10Ne : 1s2 2s2 2p6
27Co : 1s2 2s2 2p63s2 3p6 4s2 3d7
Elektron terletak pada orbital 2p
Elektron terakhir berada pada orbital pertama (paling kiri) dari sub kulit p dengan arah spin elektron ke bawah
Menyatakan bahwa dalam suatu atom tidak boleh ada 2 elektron yang mempunyai ke empat bilangan kuantum sama. Jika 2 elektron memiliki bilangan kuantum utama (n), azimut (l) dan magnetik (m) sama, maka bilangan kuantum spin (s) nya harus berlawanan satu sama lain yaitu yang satu harga s = +½ dan elektron yang lainnya mempunyai harga s = -½
Contoh :
Akibat larangan Pauli ini, tiap orbital hanya bisa diisi oleh 2 elektron.
3. Kaidah Hund :
Menyatakan bahwa pada pengisian orbital setingkat seperti orbital p, d dan f, yang memiliki tingkat energi yang sama (pada sub kulit yang sama) elektron mengisi orbital satu persatu dengan arah spin yang sama, baru kemudian diisi dengan elektron berikutnya dengan arah spin yang berlawanan.
Contoh :
2 elektron pada orbital p (p2) = bukan
3 elektron pada orbital p (p3) = bukan
4 elektron pada orbital p (p4) = bukan
Contoh soal 3 :
Tentukan harga bilangan kuantum n, l, m dan s untuk elektron terakhir dari 15P.
Jawab :
15P : 1s2 2s2 2p6 3s2 3p3
Atom P mempunyai 15 elektron, sehingga elektron terakhir adalah elektron ke-15 yaitu elektron yang terdapat pada sub kulit 3p
1s 2s 2p 3s 3p
elektron ke-15 (terakhir)
sehingga elektron terakhir memiliki :
n = 3 ( kulit L ) m = +1 (elektron terletak pada kotak ke-3, harga m = +1)
l = 1 ( sub kulit p ) s = +½ (spin searah dengan putaran jarum jam/ arah anak panah ke atas)
Contoh 4 :
Suatu atom X dimana elektron terakhirnya memiliki harga bilangan kuantum n = 3, l = 2, m = =1 dan s = -½. Tentukanlah nomor atom unsur tersebut
Jawab :
Pertama sekali kita mentukan sub kulit berdasarkan harga n dan l n = 2
l = 1
kemudian kita tentukan jumlah elektron dari harga m dan s m = -1
s = -½
dengan demikiam pada orbital ini terdapat 2 elektron (sepasang) sedangkan pada orbital ke dua (m=0) dan orbital ke tiga (m=+1) hanya terdapa satu buah elektron lihat diagram orbital berikut
akhirnya kita memperoleh bahwa konfigurasi elektron terakhir adalah 3p4 , sehingga jika kita tuliskan
konfigurasi elektron yang lengkap adalah : 1s2 2s2 2p6 3s2 3p4 maka jumlah elektron seluruhnya adalah :
C. Orbital penuh dan setengah penuh
Konfigurasi elektron suatu unsur menggambarkan sifat dari unsur tersebut. Hasil eksperimen menunjuk-kan bahwa konfigurasi elektron unsur Cr mengandung 6 elektron yang tidak berpasangan.ini menunjukkan adanya penyimpangan terhadap asas Aufbau tentang pengisian elektron. Menurut azas Aufbau konfigurasi elektron Krom (Z=24) dan Tembaga (Z=29) adalah sebagai berikut :
24Cr : [Ar] 3d4 4s2 dan 29Cu : [Ar] 3d9 4s2
Namun berdasarkan hasil eksperimen konfigurasi elektron Cr dan Cu adalah sebagai berikut :
24Cr : [Ar] 3d5 4s1 dan 29Cu : [Ar] 3d10 4s1
Konfigurasi elektron untuk dua subkulit terakhir d4 s2 atau d9 4s2 cenderung berubah menjadi d5 s1 atau d10 s1
Hal ini disebabkan karena subkulit d yang terisi penuh (d10 ) atau setengah penuh (d5 ) lebih stabil.
D. Hubungan Konfigurasi elektron dan Sistem Periodik
Perkembangan sistem periodik dimulai pada akhir abad ke 18 setelah Boyle memberikan penjelasan tentang konsep unsur, Pada tahun 1769 Lavoisier menerbitkan daftar unsur-unsur yang dikelompokkan atas Logam dan nonlogam dan pada waktu iti baru dikenal sekitar 21 jenis unsur. Pada permulaan abad ke 19 setelah teori atom Dalton
dipublikasikan orang mulai terdorong untuk mencari hubungan antara sifat-sifat unsur dengan atom. Tahun 1817
John W. Dobreiner adalah orang pertama yang menemukan adanya hubungan antara sifat unsur dan massa atom relatifnya, Ia menyusun unsur-unsur dalam kelompok tiga unsur yang disebut Triade. Pada tahun 1863 J. Newlands
menemukan adanya pengu-langan sifat pada setiap unsur ke delapan jika unsur-unsur disusun berdasarkan kenaikan massa atom-nya.keadaan ini disebutnya dengan Hukum Oktaf. Pada tahun 1869 dua orang ilmuwan Kimia yaitu Julius Lothar Meyer (jerman) dan Dimitri Mendeleeff (Rusia) menemukan hubungan yang lebih jelas antara sifat unsur dan massa atom, Lothar Meyer menyususn unsur-nsaur berdasarkan sifat Fisika sedangkan Mendeleeff menyusun unsur-unsur berdasarkan sifat kimia. Tahun 1913 Henry G. J Moseley berhasil menemukan bahwa ada hubungan antara frekuensi sinar-x dengan nomor atom, Dia menyimpulkan bahwa unsur-unsur dalam sistem periodik harus disusun berdasarkan kenaikan nomor atom, bukan nomor massa. Sistem Periodik yang disusun berdasarkan kenaikan nomor atom terdiri dari Lajut mendatar (horizontal) yang disebut Perioda dan lajur tegak (vertikal) yang disebut Golongan.
Perioda unsur menunjukkan jumlah kulit yang telah terisi elektron. Nomor periode ditentukan oleh bilangan kuantum utama (n) terbesar. Dalam sistem periodik terdapat 7 periode yaitu :
Perioda ke
Nama
Kulit Nama Perioda
Jumlah
Unsur Terdiri dari Golongan Unsur
1 2 3 4 5 6 7 K L M N O P Q Sangat Pendek Pendek Pendek Panjang Panjang Sangat Panjang Belum Lengkap 2 8 8 18 18 32 25
Gol. Utama 2 Unsur Gol. Utama 8 Unsur Gol. Utama 8 Unsur
Gol. Utama 8 Unsur, Gol. Transisi 10 Unsur Gol. Utama 8 Unsur, Gol. Transisi 10 Unsur Gol. Utama 8 Unsur, Gol. Transisi 24 Unsur Gol. Utama 2 Unsur, Gol. Transisi 23 Unsur
H dan He Li sd Ne Na sd Ar K sd Kr Rb sd Xe Cs sd Rn Fr sd Ds
Golongan Unsur menunjukkan Jumlah elektronvalensi unsur itu.Sistim Periodik Modern terdiri dari 8 Golongan Utama ( Gol. IA sd VIIB ) dan 8 Golongan Transisi ( Gol. IB sd VIIIB )
Unsur Golongan Utama (Representatif) Unsur Golongan Transisi
Golonga n
Nama Golongan Konf. Elektron terluar Golongan Konf.elektron terluar
IA IIA IIIA IVA VA VIA VIIA VIIIA Alkali Alkali Tanah Boron Karbon Nitrogen Oksigen Halogen Gas Mulia ns1 ns2
ns2 np1
ns2 np2
ns2 np3
ns2 np4
ns2 np5
ns2 np6
IB IIB IIIB IVB VB VIB VIIB VIIIB
(n-1)d10 ns1
(n-1)d10 ns2
(n-1)d1 ns2
(n-1)d2 ns2
(n-1)d3 ns2
(n-1)d5 ns1
(n-1)d5 ns2
(n-1)d6 ns2 (Fe,Ru,Os,Hs)
(n-1)d7 ns2 (Co,Rh,Ir,Mt)
(n-1)d8 ns2 (Ni,Pd,Pt,Ds)
Berdasarkan jenis orbital yang terisi oleh elektron terakhir, unsur-unsur dalam sistem periodik dapat dikelompokkan atas :
Blok f, yaitu Unsur-unsur yang elektron terakhirnya berada pada orbital f, seperti Golongan Transisi Dalam (Actinida dan Lantanida)E. Hal-hal penting dalam Penulisan Konfigurasi Elektron
1. Penulisan sesuai dengan aturan Aufbau
Contoh Konfigurasi elektron dari
28Ni ditulis sebagai berikut:
1s
22s
22p
63s
23p
64s
23d
82. Menuliskan semua subkulit dalam suatu kulit, lalu diikuti dengan subkulit dari kulit berikutnya
Contoh Konfigurasi elektron dari
28Ni ditulis sebagai berikut:
1s
22s
22p
63s
23p
63d
84s
2Cara ini memperjelas ketika Ni mengalami ionisasi, dimana elektron yang pertama kali dilepaskan
adalah elektron dari subkulit 4s bukan dari 3d, oleh karena itu ada baiknya subkulit 3d lebih dahulu
ditulis baru diikuti dengan sub kulit 3d
3. Menyingkat penulisan konfigurasi elektron
19
K : 1s
22s
22p
63s
23p
64s
1 18Ar : 1s
22s
22p
63s
23p
6Berdasarkan kedua konfigurasi elektron di atas maka konfigurasi elektron dari
19K dapat ditulis sebagai
berikut :
19
K : [
18Ar]4s
1hal ini dapat diterima karena konfigurasi elektron
19K sama dengan konfigurasi elektron
18Ar ditambah dengan 4s
1Petunjuk : Jawablah pertanyaan berikut dengan singkat dan jelas !
A. Teori atom Mekanikan Kuantum.
1. Jelaskan dimanakah letak elektron menurut Niels Bohr
Jawab : ………..………. ……… ……… 2. Jelasakan bagaimana pendapat de Broglie tentang lintasan elektron !
Jawaban : ……… ……… ……… ……… 3. Jelasakan prinsip ketidakpastian dari Heisenberg
Jawab : ………...……… ………...………... ………... ………...……… 4. Jelaskan teori atom menurut Mekanika Kuantum/mekanikan gelombang
Jawab : ………. ……… ……… ……… 5. Menurut teori Mekanikan Kuantum/ mekanikan gelombang, elektron di dalam atom terletak pada
Jawab : ……… 6. Apa yang dimaksu dengan orbital, jelaskan !
Jawab : ……… ……… ………
1. Menurut teori Mekanika Kuantum, ada 4 bilangan kuantum yang menentukan letak/posisi elektron di dalam atom. Sebutkan jenis dan fungsi dari ke empat bilangan Kuantum tersebut
Jawab : A.
……… B. ……….………... C. ………... D. ……….. 2. Tentukan harga n, l, m dan s untuk elektron terakhir dari orbital 3d5
Jawab :
………... ………... ……… ……… ……… 3. Tentukan harga n, l, m dan s untuk elektron terakhir dari atom 22X
Jawab : ………. ……….. ……….. 4. Berapakah jumlah orbital yang dimiliki oleh sub kulit 2s, 3p, 3d, dan 4f ?
Jawab : ………. ……… ………. 5. a. Tentukan jumlah elektron maksimum yang terdapat pada kulit dengan n = 3
b. Tuliskan penyebarannya dalam orbital-orbitalnya
Jawab : ……… ……… ……… 6. Berapa jumlah elektron maksimum yang dapat ditempatkan pada orbital 3s, 4p, 5p, 5f, dan 6d,
Jawab : ……… ………..
C. Konfiurasi Elektron
1. Jelaskan urutan pengisian elektron dalam orbital menurut aturan Aufbau
Jawab : ………. ……….. ……….. 2. Tuliskan konfigurasi elektron atom/ion berikut
a. Na (Nomor Atom =11) d. K+ (Nomor Atom = 19)
b. Fe (Nomor Atom = 26) e. Ca2+ (Nomor Atom = 20)
c. Xe (Nomor Atom = 54) f. S2- (Nomor Atom = 16)
Jawab :
a. ……….. b. ……….. c. ……….. d. ……….. e. ……… f. ………... 3. Unsur X setelah menangkap elektron berubah menjadi ion X2-. Jika atom X mempunyai Nomor massa 17 dan
jumlah neutron sebanyak 9. a. Tentukan Nomor atom unsur X b. Tuliskan konfigurasi elektron unsur X Jawab :
a..………. ……….. b……….. 4. Jelaskan bagaimana cara pengisian elektron ke dalam orbital menurut kaidah Hund ?
Jawab : ………...……… ………. ………. 5. Isikan elektron-elektron yang tersedia ke dalam orbitalnya sesuai kaidah Hund
Subkulit Jumlah elektron Pengisian pada orbital
d 5
d 6
f 7
D. Hubungan Konfigurasi elektron dan Sistem Periodik
1. Tuliskan golongan dan periode dari unsur-unsur berikut :
2P, 15Q, 21R, 28S, 39T
2. Tentukan golongan dan periode unsur-unsur di bawah ini jika konfigurasi elektronnya adalah sebagai berikut : a. X- : 1s2 2s2 2p6 3s2 3p6
b. Y3+ : [
18Ar]3d7
c. Z+ : [
18Ar] 3d10 4s2 3p4
3. Tentukan golongan dan periode unsur A, B dan C jika diketahui harga-harga keempat bilangan kuantum untuk elektron terakhirnya adalah sebagai berikut :
A : n = 2, l = 1, m = +1 dan s = +½ B : n = 3, l = 2, m = +1 dan s = -½ C : n = 4, l = 1, m = 0 dan s = -½
Petunjuk : Pilih salah satu jawaban yang paling tepat !
1. Dasar teori atom modern adalah..
A. ditemukannya elektron dan proton dalam atom B. adanya orbital-orbital dalam atom
C. adanya tingkat-tingkat energi elektron dalam atom D. elektron mempunyai sifat sebagai gelombang dan materi E. teori Quantum dari Plank dan postulat Bohr
2. Elektron yang bergerak dalam atom tidak dapat ditentukan kedudukan dan kecepatannya pada saat yang sama. Pernyataan ini diberikan oleh..
A. Plank D. Schrondinger
B. Einstein E. de Broglie C. Heisenberg
3. Kebolehjadian terbesar menemukan elektron dalam atom disebut…
A. kulit D. suborbital
B. subkulit E. lintasan C. orbital
4. Bentuk orbital ditentukan oleh…
A. bil. Kuantum azimut D. persamaan de Broglie B. bil. Kuantum utama E. persamaan schrondinger C. bil. Kuantum magnetik
5. jumlah orbital yang dimiliki oleh bilangan kuantum azimut, l =1 adalah… A. 1. B. 3. C. 5. D. 7. E. 9.
6. Elektron terluar yang menduduki orbital 3s1 mempunyai bilangan kuantum …
A. n =3, l =0, m =0, s =+½ D. n =3, l =1, m =-1, s =-½ B. n =3, l =1, m =0, s =+½ E. n =3, l =0, m =-1, s =+½ C. n =3, l =1, m =+1, s =+½
7. Elektron terluar yang menduduki orbital 3p1 mempunyai bilangan kuantum …
C. n =3, l =1, m =+1, s =+½
8. Konfigurasi elektron 25X dapat digambarkan sebagai...
A D.
B. E.
C.
9. Bilangan-bilangan kuantum yang mungkin dimiliki oleh suatu elektron adalah… A. n =2, l =2, m =0, s =+½ D. n =3, l =3, m =0, s =-½
B. n =3, l =0, m =+1, s =+½ E. n =2, l =0, m =0, s =-½ C. n =4, l =2, m =-3, s =+½
10. Bilangan kuantum yang mungkin untuk elektron valensi dari atom Fosforus (nomor atom 15) pada keadaan dasar adalah..
n l m s
A. 2 1 0 +½
B. 3 0 0 0
C. 3 1 -1 +½
D. 3 2 1 -½
E. 3 2 1 +½
11. Konfigurasi elektron yang benar untuk unsur Q dengan nomor atom 35 adalah… A. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5
B. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3
C. 1s2 2s2 2p6 3s2 3p6 3d9 4s1 4p4
D. 1s2 2s2 2p6 3s2 3p6 3d10 4s1 4p6
E. 1s2 2s2 2p6 3s2 3p6 3d10 4s2
12. Konfigurasi elektron suatu unsur dengan nomor atom 21 adalah. A. 1s2 2s2 2p6 3s2 3p6 3d3
B. 1s2 2s2 2p6 3s2 3p5 3d2 4s2
C. 1s2 2s2 2p6 3s2 3p6 3d2 4s1
D. 1s2 2s2 2p6 3s2 3p6 4s2 3d1
E. 1s2 2s2 2p6 3s2 3p6 4s0 3d3
13. Nomor atom unsur Al = 13. konfigurasi elektron dari ion Al3+ adalah..
A. 1s2 2s2 2p3 D. 1s2 2s2 2p6 3s2 3p4
B. 1s2 2s2 2p6 E. 1s2 2s2 2p6 3s2 3p2
C. 1s2 2s2 2p6 3s2
14. Suatu unsur dalam keadaan dasar mempunyai konfigurasi elektron: 1s2 2s2 2p6 3s2 3p6 4s2. unsur tersebut
terletak pada blok..
A. s B. p C. d D. f E. g
15. Ion Co2+ mempunyai konfigurasi elektron [Ar] 3d7. jumlah elektron tidak berpasangan dalam ion Co2+ adalah…
A. 1 B. 2 C. 3 D. 5 E. 7
16. Konfigurasi elekron ion L3+ adalah 1s2 2s2 2p6 3s2 3p6 3d3 dalam sistem periodik unsur L terletak pada…
A. periode 3, golongan VIIA B. periode 3, golongan VIA C. periode 4, golongan IVA D. periode 4, golongan IVB E. periode 4, golongan VIB
17. Unsur P nomor atomnya 30. unsur tersebut dalam sistem periodik terletak pada.. A. golongan IIA, periode 3
B. golongan IIB, periode 4 C. golongan IIA, periode 4 D. golongan VIIA, periode 4 E. golongan IVB, periode 4
18. Elektron terakhir suatu unsur mempunyai bilangan kuantum n =3, l = 1, m = 0 dan s = -½. Dalam sistem periodik unsur tersebut terletak pada…
A. periode 3 dan golongan IA B. periode 3 dan golongan IIA C. periode 3 dan golongan IIIA D. periode 3 dan golongan VA E. periode 3 dan golongan VIIA
19. Perhatikan tabel lambang unsur dengan nomor atomnya:
Unsur Nomor
Atom
I II
III IV V
24 40 56
Pasangan unsur yang terdapat dalam blok d pada sistem peri-odik adalah… A. I dan II D. III dan V
B. II dan IV E. IV dan V C. III dan IV
20 Suau unsur netral memiliki 2 elektron dalam kulit pertama, 8 elektron dalam kulit kedua dan 7 elektron dalam kulit ketiga. Jumlah total elektron dalam orbital s adalah…
A. 2 B. 6 C. 7 D. 8 E. 17
21. Jumlah orbital atom 7N yang berisi sepasang elektron adalah…
A. 9 B. 10 C. 5 D. 12 E. 6 22. Konfigurasi elektron Mn: 1s2 2s2 2p6 3s2 3p6 3d5 4s2
Orbital yang ditempati elektron valensi unsur Mn adalah…
A. 4s D. 3p dan 3d
B. 3d E. 2s dan 3p