BAB 2
TINJAUAN PUSTAKA
2.1. FISOLOGI NYERI
Definisi nyeri berdasarkan International Association for the Study of Pain (IASP, 1979)adalah pengalaman sensori dan emosi yang tidak menyenangkan dimana berhubungan dengan kerusakan jaringan atau potensial terjadi kerusakan jaringan3,4.Sebagai mana diketahui bahwa nyeri tidaklah selalu berhubungan dengan derajat kerusakan jaringan yang dijumpai. Namun nyeri bersifat individual yang dipengaruhi oleh genetik, latar belakang kultural, umur dan jenis kelamin. Kegagalan dalam menilai faktor kompleks nyeri dan bergantung pada pemeriksaan fisik sepenuhnya dan tes laboratorium mengarahkan kita pada kesalahpahaman dan terapi yang tidak adekuat terhadap nyeri, terutama pada pasien-pasien dengan resiko tinggi seperti orang tua, anak-anak dan pasien dengan gangguan komunikasi2,3,34,35,36.
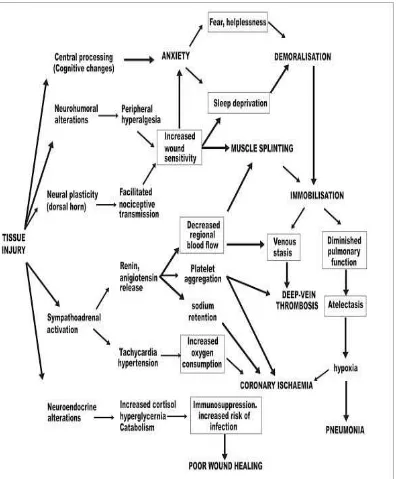
Setiap pasien yang mengalami trauma berat (tekanan, suhu, kimia) atau pascabedah harus dilakukan penanganan nyeri yang sempurna, karena dampak dari nyeri itu akan menimbulkan Metabolic Stress Respon (MSR) yang akan mempengaruhi semua sistem tubuh dan memperberat kondisi pasiennya. Hal ini akan merugikan pasien akibat timbulnya perubahan fisiologi dan psikologi seperti1,2,3,37,38 :
• Perubahan kognitif (sentral) : kecemasan, ketakutan, gangguan tidur dan putus asa
• Perubahan neurohumoral : peripheral hiperalgesia, peningkatan kepekaan luka
• Aktivasi simpatoadrenal : pelepasan renin, angiotensin, hipertensi, takikardi
• Perubahan neuroendokrin : peningkatan kortisol, peningkatan kadar gula darah, katabolisme
Nyeri pembedahan sedikitnya mengalami dua perubahan, pertama akibat pembedahan itu sendiri yang menyebabkan rangsangan nosiseptif dan yang kedua setelah proses pembedahan terjadi respon inflamasi pada daerah sekitar operasi, dimana terjadi pelepasan zat-zat kimia (prostaglandin, histamin, serotonin, bradikinin, substansi P dan leukotrien) oleh jaringan yang rusak dan sel-sel inflamasi. Zat-zat kimia yang dilepaskan ini berperan pada proses transduksi dari nyeri34,35,36,40.
2.2 MEKANISME NYERI
Nyeri merupakan suatu bentuk peringatan akan adanya bahaya kerusakan jaringan. Pengalaman sensoris pada nyeri akut disebabkan oleh stimulus noxious yang diperantarai oleh sistem sensorik nosiseptif. Sistem ini berjalan mulai dari perifer melalui medulla spinalis, batang otak, thalamus dan korteks serebri. Apabila telah terjadi kerusakan jaringan, maka sistem nosiseptif akan bergeser fungsinya dari fungsi protektif menjadi fungsi yang membantu perbaikan jaringan yang rusak36,41.
Nyeri inflamasi merupakan salah satu bentuk untuk mempercepat perbaikan kerusakan jaringan. Sensitifitas akan meningkat, sehingga stimulus nonnoxious atau noxious ringan yang mengenai bagian yang meradang akan menyebabkan nyeri. Nyeri inflamasi akan menurunkan derajat kerusakan dan menghilangkan respon inflamasi36,41.
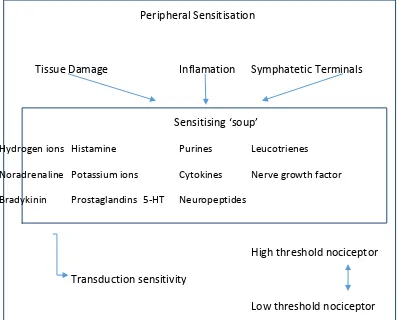
2.2.1 Sensitisasi Perifer
Komponen sensitisasi, misalnya prostaglandin E2 akan mereduksi ambang aktivasi nosiseptor dan meningkatkan kepekaan ujung saraf dengan cara berikatan pada reseptor spesifik di nosiseptor. Berbagai komponen yang menyebabkan sensitisasi akan muncul secara bersamaan, penghambatan hanya pada salah satu substansi kimia tersebut tidak akan menghilangkan sensitisasi perifer. Sensitisasi perifer akan menurunkan ambang rangsang dan berperan dalam meningkatkan sensitivitas nyeri di tempat cedera atau inflamasi41,42.
Peripheral Sensitisation
Tissue Damage Inflamation Symphatetic Terminals
Sensitising ‘soup’
Hydrogen ions Histamine Purines Leucotrienes
Noradrenaline Potassium ions Cytokines Nerve growth factor
Bradykinin Prostaglandins 5-HT Neuropeptides
High threshold nociceptor
Transduction sensitivity
Low threshold nociceptor
2.2.2 Sensitisasi Sentral
Sama halnya dengan sistem nosiseptor perifer, maka transmisi nosiseptor di sentral juga dapat mengalami sensitisasi. Sensitisasi sentral dan perifer bertanggung jawab terhadap munculnya hipersensitivitas nyeri setelah cedera. Sensitisasi sentral memfasilitasi dan memperkuat transfer sipnatik dari nosiseptor ke neuron kornu dorsalis. Pada awalnya proses ini dipacu oleh input nosiseptor ke medulla spinalis (activity dependent), kemudian terjadi perubahan molekuler neuron (transcription dependent) 41.
Sensitisasi sentral dan perifer merupakan contoh plastisitas sistem saraf, dimana terjadi perubahan fungsi sebagai respon perubahan input (kerusakan jaringan). Dalam beberapa detik setelah keruskan jaringan yang hebat akan terjadi aliran sensoris yang massif kedalam medulla spinalis, ini akan menjadi jaringan saraf didalam medulla spinalis menjadi hiperresponsif. Reaksi ini menyebabkan munculnya nyeri akibat stimulus non noxious dan daerah yang jauh dari jaringan cedera juga menjadi sensitif rangsangan nyeri41.
2.3 NOSISEPTOR (RESEPTOR NYERI)
Nosiseptor adalah reseptor ujung saraf bebas yang ada di kulit, otot, persendian, viseral dan vaskular. Nosiseptor-nosiseptor ini bertanggung jawab pada kehadiran stimulus noxious yang berasal dari kimia, suhu (panas, dingin), atau perubahan mekanikal. Pada jaringan normal, nosiseptor tidak aktif sampai adanya stimulus yang memiliki energi yang cukup untuk melampaui ambang batas stimulus (resting). Nosiseptor mencegah perambatan sinyal acak (skrining fungsi) ke central nervous system (CNS) untuk interpretasi nyeri5,36,43,44.
Kegagalan reseptor nyeri beradaptasi adalah untuk proteksi karena hal tersebut bisa menyebabkan individu untuk tetap awas pada kerusakan jaringan yang berkelanjutan. Setelah kerusakan terjadi, nyeri biasanya menimal. Mula datang nyeri pada jaringan karena iskemi akut berhubungan dengan kecepatan metabolisme. Sebagai contoh, nyeri terjadi pada saat beraktifitas kerena iskemia otot skeletal pada 15 sampai 20 detik tapi pada iskemi kulit 20 sampai 30 menit5,36,44.
Tipe nosiseptor spesifik bereaksi pada tipe stimulus yang berbeda. Nosiseptor C tertentu dan nosiseptor A-delta bereaksi hanya pada stimulus panas atau dingin, dimana yang lainnya bereaksi pada stimulus yang banyak (kimia, panas, dingin). Beberapa reseptor A-beta mempunyai aktivitas nociceptor-like. Serat –serat sensorik mekanoreseptor bisa diikutkan untuk transmisi sinyal yang akan menginterpretasi nyeri ketika daerah sekitar terjadi inflamasi dan produk-produknya. Allodynia mekanikal (nyeri atau sensasi terbakar karena sentuhan ringan) dihasilkan mekanoreseptor A-beta5,36,44.
Nosiseptor viseral, tidak seperti nosiseptor kutaneus, tidak didisain hanya sebagai reseptor nyeri karena organ internal jarang terpapar pada keadaan yang merusak. Banyak stimulus yang merusak (memotong, membakar, kepitan) tidak menghasilkan nyeri bila dilakukan pada struktur viseralis. Selain itu, inflamasi, iskemia, regangan mesenterik, dilatasi, atau spasme viseralis bisa menyebabkan spasme berat. Stimulus ini biasanya dihubungkan dengan proses patologis, dan nyeri yang dicetuskan untuk mempertahankan fungsi5,36,44.
2.4 PERJALANAN NYERI (NOCICEPTIVE PATHWAY)
modulasi dan persepsi, dimana terjadinya stimuli yang kuat diperifer sampai dirasakannya nyeri di susunan saraf pusat (cortex cerebri)3,5,38,45. 2.4.1 Proses Transduksi
Proses dimana stimulus noxious diubah ke impuls elektrikal pada ujung nervus. Suatu stimuli kuat (noxiousstimuli) seperti tekanan fisik kimia, suhu dirubah menjadi suatu aktifitas listrik yang akan diterima ujung-ujung saraf perifer (nerve ending) atau organ-organ tubuh (reseptor meisneri, merkel, corpusculum paccini, golgi mazoni). Kerusakan jaringan karena trauma baik trauma pembedahan atau trauma lainnya menyebabkan sintesa prostaglandin, dimana prostaglandin inilah yang akan menyebabkan sensitisasi dari reseptor-reseptor nosiseptif dan dikeluarkan zat-zat mediator nyeri seperti histamin, serotonin yang akan menimbulkan sensasi nyeri. Keadaan ini dikenal sebagai sensitisasi perifer3,5,38,43,45.
2.4.2 Proses Transmisi
Proses penyaluran impuls melalui saraf sensori sebagai lanjutan proses transduksi melalui serabut A-delta dan serabut C dari perifer ke medulla spinalis, dimana impuls tersebut mengalami modulasi sebelum diteruskan ke thalamus oleh tractus spinothalamicus dan sebagian ke traktus spinoretikularis. Traktus spinoretikularis terutama membawa rangsangan dari organ-organ yang lebih dalam dan viseral serta berhubungan dengan nyeri yang lebih difus dan melibatkan emosi. Selain itu juga serabut-serabut saraf disini mempunyai sinaps interneuron dengan saraf-saraf berdiameter besar dan bermielin. Selanjutnya impuls disalurkan ke thalamus dan somatosensoris di korteks serebri dan dirasakan sebagai persepsi nyeri3,5,38,43,45.
2.4.3 Proses Modulasi
ascenden yang dikontrol oleh otak. Analgesik endogen (enkefalin, endorphin, serotonin, noradrenalin) dapat menekan impuls nyeri pada kornu posterior medulla spinalis. Di mana kornu posterior sebagai pintu dapat terbuka dan tertutup untuk menyalurkan impuls nyeri untuk analgesik endogen tersebut. Inilah yang menyebabkan persepsi nyeri sangat subjektif pada setiap orang3,5,38,43,45.
2.4.4 Proses Persepsi
Gambar 3. Pain Pathway44.
2.5 MEKANISME KERJA OBAT ANALGETIK
Obat analgetik bekerja di dua tempat utama, yaitu di perifer dan sentral. Golongan obat Non Steroid Anti Inflammation Drug (NSAID)/ Anti Inflamasi Non Steroid (AINS) bekerja diperifer dengan cara menghambat pelepasan mediator sehingga aktifitas enzim siklooksigenase terhambat dan sintesa prostaglandin tidak terjadi. Sedangkan analgetik opioid bekerja di sentral dengan cara menempati reseptor di kornu dorsalis medulla spinalis sehingga terjadi penghambatan pelepasan transmitter dan perangsangan ke saraf spinal tidak terjadi3,5.
Prostaglandin merupakan hasil bentukan dari asam arakhidonat yang mengalami metabolisme melalui siklooksigenase. Prostaglandin yang lepas ini akan menimbulkan gangguan dan berperan dalam proses inflamasi, edema, rasa nyeri lokal dan kemerahan (eritema lokal). Selain itu juga prostaglandin meningkatkan kepekaan ujung-ujung saraf terhadap rangsangan nyeri (nosiseptif)3,5.
kardiogenesis. Regulasi COX-2 yang transien di medulla spinalis dalam merespon inflamasi pembedahan mungkin penting dalam sensitisasi sentral3,5,35.
2.6 KLASIFIKASI NYERI
Kejadian nyeri unik pada setiap individual bahkan jika cedera fisik tersebut identik pada individual lainnya. Adanya takut, marah, kecemasan, depresi dan kelelahan akan mempengaruhi bagaimana nyeri itu dirasakan. Subjektivitas nyeri membuat sulitnya mengkategorikan nyeri dan mengerti mekanisme nyeri. Salah satu pendekatan dengan mengklasifikasi nyeri berdasarkan durasi (akut, kronik), patofisiologi (nosiseptif, nyeri neuropatik) dan etiologi (pascabedah, kanker)3,5.
2.6.1 Nyeri Akut dan Kronik
Nyeri akut dihubungkan dengan kerusakan jaringan dan durasi yang terbatas setelah nosiseptor kembali ke ambang batas resting stimulus istirahat. Nyeri akut ini dialami segera setelah pembedahan sampai 7 hari4. Sedangkan nyeri kronik bisa dikategorikan sebagai malignan atau nonmalignan yang dialami pasien paling tidak 1 – 6 bulan. Nyeri kronik malignan biasanya disertai kelainan patologis dan indikasi sebagai penyakit yang life-limiting disease seperti kanker, end-stage organ dysfunction, atau infeksi Human Immunodeficiency Virus (HIV). Nyeri kronik mungkin mempunyai baik elemen nosiseptif dan neuropatik. Nyeri kronik nonmalignan (nyeri punggung, migrain, artritis, diabetik neuropati) sering tidak disertai patologis yang terdeteksi dan perubahan neuroplastik yang terjadi pada lokasi sekitar (dorsal horn pada spinal cord) membuat pengobatan menjadi lebih sulit4,5,34,35.
ataupun hilangnya tanda dan gejala otonom tidak menunjukkan ada atau tidaknya nyeri5,34,35.
2.6.2 Nosiseptifdan Nyeri Neuropatik
Nyeri organik bisa dibagi menjadi nosiseptif dan nyeri neuropatik. Nyeri nosiseptif adalah nyeri inflamasi yang dihasilkan oleh rangsangan kimia, mekanik dan suhu yang menyebabkan aktivasi maupun sensitisasi pada nosiseptor perifer (saraf yang bertanggung jawab terhadap rangsang nyeri). Nyeri nosiseptif biasanya memberikan respon terhadap analgesik opioid atau non opioid3,4,5,34,35.
Nyeri neuropatik merupakan nyeri yang ditimbulkan akibat kerusakan neural pada saraf perifer maupun pada system saraf pusat yang meliputi jalur saraf aferen sentral dan perifer dan biasanya digambarkan dengan rasa terbakar dan menusuk. Pasien yang mengalami nyeri neuropatik sering memberi respon yang kurang baik terhadap analgesik opioid3,4,5,34,35.
2.6.3 Nyeri Viseral
Penyebab nyeri viseral termasuk iskemia, peregangan ligamen, spasme otot polos, distensi struktur lunak seperti kantung empedu, saluran empedu, atau ureter. Distensi pada organ lunak terjadi nyeri karena peregangan jaringan dan mungkin iskemia karena kompresi pembuluh darah karena distensi berlebih dari jaringan5,34,35.
Impuls nyeri yang bersal dari sebagian besar abdomen dan toraks menjalar melalui serat aferen yang berjalan bersamaan dengan sistem saraf simpatis, dimana impuls dari esofagus, trakea dan faring melalui aferen vagus dan glossopharyngeal, impuls dari struktur yang lebih dalam pada pelvis dihantar melalui nervus parasimpatis di sakral. Impuls nyeri dari jantung menjalar dari sistem saraf simpatis ke bagian tengah ganglia cervical, ganglion stellate, dan bagian pertama dari empat dan lima ganglion thorasik dari sistem simpatis. Impuls ini masuk ke spinal cord melalui nervus torak ke 2, 3, 4 dan 5. Penyebab impuls nyeri yang berasal dari jantung hampir semua berasal dari iskemia miokard. Parenkim otak, hati, dan alveoli paru adalah tanpa reseptor. Adapun, bronkus dan pleura parietal sangat sensitif pada nyeri5,34,35.
2.6.4 Nyeri Somatik
Munculnya jalur nyeri viseral dan parietal menghasilkan lokalisasi darinyeri dari viseral pada daerah permukaan tubuh pada waktu yang sama. Sebagai contoh, impuls nyeri berasal dari apendiks yang inflamasi melalui serat – serat nyeri pada sistem saraf simpatis ke rantai simpatis lalu ke spinal cord pada T10 ke T11. Nyeri ini menjalar kae daerah umbilikus dan nyeri menusuk dan kram sebagai karakternya. Sebagai tambahan, impuls nyeri berasal dari peritoneum parietal dimana inflamasi apendiks menyentuh dinding abdomen, impuls – impluls ini melewati nervus spinalis masuk ke spinal cord pada L1 sampai L2. Nyeri menusuk berlokasi langsung pada permukaan peritoneal yang teriritasi di kuadran kanan bawah5,34,35.
2.7 PENILAIAN NYERI
Penilaian nyeri merupakan elemen yang penting untuk menentukan terapi nyeri pascabedah yang efektif. Skala penilaian nyeri dan keterangan pasien digunakan untuk menilai derajat nyeri. Intensitas nyeri harus dinilai sedini mungkin selama pasien dapat berkomunikasi dan menunjukkan ekspresi nyeri yang dirasakan3,5,46.
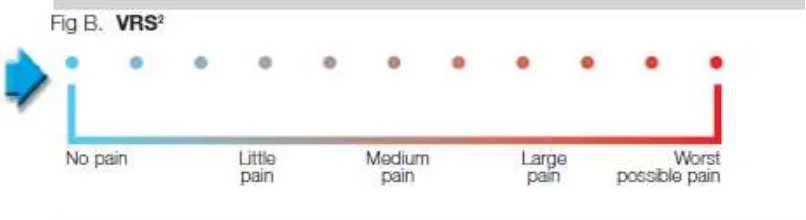
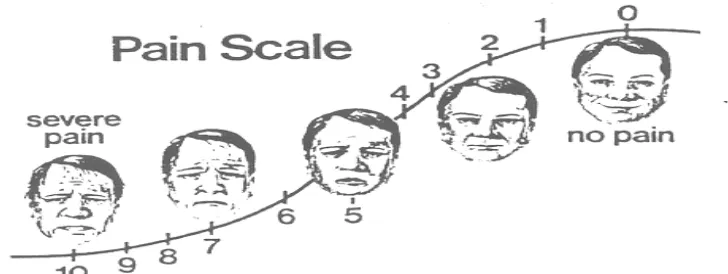
Ada beberapa skala penilaian nyeri pada pasien sekarang ini3,4,46,47,48,49,50:
1. Wong-Baker Faces Pain Rating Scale
Gambar 4. Wong Baker Faces Pain Rating Scale 2. Verbal Rating Scale (VRS)
Pasien ditanyakan tentang derajat nyeri yang dirasakan berdasarkan skala lima poin ; tidak nyeri, ringan, sedang, berat dan sangat berat.
Gambar 5. Verbal Rating Scale 3. Numerical Rating Scale (NRS)
Gambar 6. Numerical Rating Scale 4. Visual Analogue Scale (VAS)
Gambar 7. Visual Analogue Scale 2.8 PENANGANAN NYERI
Penanganan nyeri pascabedah yang efektif harus mengetahui patofisiologi dan pain pathway sehingga penanganan nyeri dapat dilakukan dengan cara farmakoterapi (multimodal analgesia), pembedahan, juga terlibat didalamnya perawatan yang baik dan teknik non-farmakologi (fisioterapi, psikoterapi)4,37.
2.8.1 Farmakologis
Modalitas analgetik pascabedah termasuk didalamnya analgesik oral parenteral, blok saraf perifer, blok neuroaksial dengan anestesi lokal dan opioid intraspinal3.
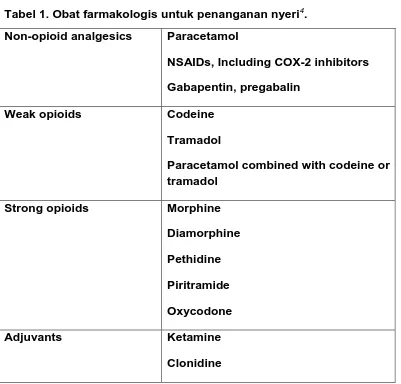
Tabel 1. Obat farmakologis untuk penanganan nyeri4. Non-opioid analgesics Paracetamol
NSAIDs, Including COX-2 inhibitors Gabapentin, pregabalin
Weak opioids Codeine
Tramadol
Paracetamol combined with codeine or tramadol
Strong opioids Morphine Diamorphine Pethidine Piritramide Oxycodone
Adjuvants Ketamine
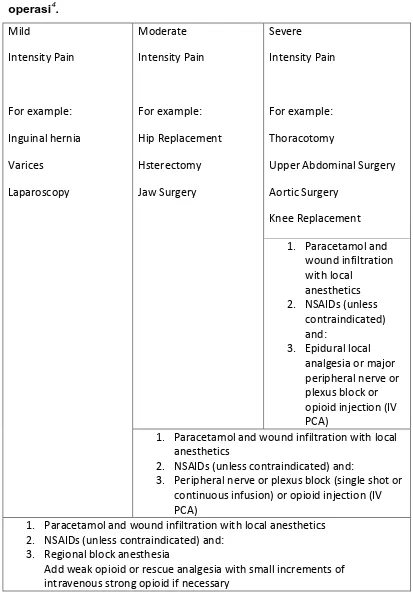
Tabel 2. Pilihan terapi untuk penanganan nyeri berdasarkan jenis
1. Paracetamol and wound infiltration
1. Paracetamol and wound infiltration with local anesthetics
2. NSAIDs (unless contraindicated) and:
3. Peripheral nerve or plexus block (single shot or continuous infusion) or opioid injection (IV PCA)
1. Paracetamol and wound infiltration with local anesthetics 2. NSAIDs (unless contraindicated) and:
3. Regional block anesthesia
2.8.1.1 Multimodal Analgesia
Analgesia multimodal menggunakan dua atau lebih obat analgetik yang memiliki mekanisme kerja yang berbeda untuk mencapai efek analgetik yang maksimal tanpa dijumpainya peningkatan efek samping dibandingkan dengan peningkatan dosis pada satu obat saja. Di mana multimodal analgesi melakukan intervensi nyeri secara berkelanjutan pada ketiga proses perjalanan nyeri, yakni3,4,37,38,51:
• Penekanan pada proses tranduksi dengan menggunakan AINS • Penekanan pada proses transmisi dengan anestetik lokal (regional) • Peningkatan proses modulasi dengan opioid
Analgesia multimodal merupakan suatu pilihan yang dimungkinkan dengan penggunaan parasetamol dan AINS sebagai kombinasi dengan opioid atau anestesi lokal untuk menurunkan tingkat intensitas nyeri pada pasien-pasien yang mengalami nyeri pascabedah ditingkat sedang sampai berat4. Analgesia multimodal selain harus diberikan secepatnya (early analgesia), juga harus disertai dengan inforced mobilization (early ambulation) disertai dengan pemberian nutrisi oral secepatnya (early alimentation)51.
2.8.1.2 Preemptive Analgesia
2.8.1.3 Patient Control Analgesia (PCA)
Pasien dikontrol nyerinya dengan memberikan obat analgesik itu sendiri dengan memakai alat (pump), dosis dan cara sudah diterangkan dan dipraktekkan sesuai dengan tingkatan nyeri yang dirasakan. PCA bisa diberikan dengan cara Intravenous Patient Control Analgesia (IVPCA) atau Patient Control Epidural Analgesia (PCEA), hanya dengan cara ini memerlukan biaya yang mahal baik peralatan maupun tindakannya3,38,52. 2.8.1.4. Ketamin
Identifikasi dari reseptor N-methyl-D-aspartate (NMDA) dan perannya dalam persepsi nyeri membawa ketertarikan baru banyak klinisi khususnya praktisi nyeri untuk memulai penelitian baru terhadap ketamin sebagai analgesia multimodal dalam penanganan nyeri.61
2.8.1.4.1. Farmakologi Ketamin
Ketamin, 2-(o-chlorophenyl)-2-(methylamine)-cycloexanone,
pertama kali disintesis pada tahun 1963 oleh Stevens dan pertama sekali
digunakan pada manusia pada tahun 1965 oleh Corssen dan Domino.62
Obat larut dalam lemak ini memiliki berat molekul 238g/mol, pKa 7,5 dan
digunakan dalam bentuk rasemik atau isomer levogyrous s(+) ketamin.62
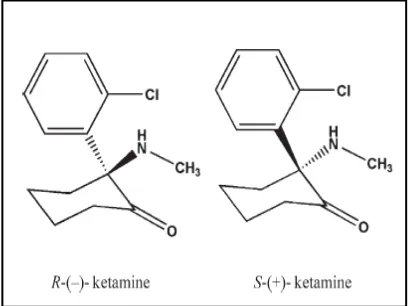
Ketamin memiliki atom karbon asimteris sehingga ketamin memiliki
2 isomer optikal yaitu S(+)-ketamin dan isomer dextrogyrous R(-)-ketamin.
S(+)-ketamin 3 sampai 4 kali lebih poten dari isomer R(-)-ketaminuntuk
penanganan nyeri, dan dalam dosis yang sama lebih sedikit menimbulkan
perubahan psikis dan agitasi daripada yang bentuk rasemik dan
dextrogyrous. S(+)-ketamin dua kali lebih poten dari rasemik dalam
mencegah spinalcord central sensitization. 3,5,62
Ketamin dapat diberikan melalui oral, intramuscular, intravena dan epidural. Ketamin memiliki bioavaibilitas 93% dan waktu paruh sampai 186 menit. Karena sangat liposoluble ketamin memiliki volume distribusi besar mencapai 3L/kg.62 Plasma puncak setelah pemberian intravena terjadi dalam waktu 1 menit, intramuscular dalam waktu 5 menit dan pemberian secara oral dalam waktu 30 menit.64 Ketamin terdistribusi ke organ yang memiliki perfusi tinggi seperti otak di mana konsentrasi puncak mencapai 4 sampai 5 kali kadar di plasma. Selanjutnya, peningkatan aliran darah otak oleh ketamin mampu memfasilitasi penghantaran obat dan meningkatkan pencapaian konsentrasi tinggi di otak. Kemudian, ketamin diredistribusi dari organ yang perfusinya baik ke tempat yang perfusinya kurang baik.5 Ketamin mengalami metabolisme konjugasi di hati melalui enzim sitokrom P 450.63
membuat efek analgesia ketamin dapat lebih panjang.65 Ketamin memiliki kelarutan lemak yang tinggi sehingga obat ini gampang melewati sawar darah otak. Ketaminmemiliki ikatan dengan protein plasma 12% dan waktu paruh tercapai dalam 10 menit.65
2.8.1.4.2. Mekanisme Kerja Ketamin
Ketamin bekerja pada susunan saraf pusat (otak dan sumsum tulang belakang) dan menurut beberapa penelitian ketamin memiliki aktivitas perifer. Efek kerja ketamin bekerja pada reseptor NMDA pada bagian kutub kalsium. Aktivasi reseptor NMDA menyebabkan hambatan influx kalsium ekstraseluler ke intraseluler. Peran kalsium adalah sebagai second messanger untuk reaksi nyeri selanjutnya melalui pelepasan neurotransmitter nyeri yang lain.3,5
Blok pada NMDA reseptor adalah cara kerja utama dari ketamindi
susunan saraf pusat dan medula spinalis. Sebagai tambahan bahwa
ketamin juga menghambat pelepasan dari glutamat yang bertindak
sebagai neurotransmitter eksitatori yang berperan sebagai
neurotransmitter nyeri. Mekanisme yang lain ketamin berikatan dengan
reseptor opioid yaitu mu dan kappa.Interaksi ini terjadi sangat kompleks.
Afinitas ketamin terhadap reseptor opioid ini 10 kali lebih lemah dari
ikatannya terhadap reseptor NMDA dengan adanya bukti bahwa naloxon
yang merupakan antagonis opioid tidak mengantagonis efek analgetik dari
ketamin. Ada bukti juga bahwa reseptor seperti monoaminergik,
muskarinik dan nikotinik menjadi tempat ikatan ketamin sekaligus ketamin
2.8.1.4.3. Efek Ketamin Pada Fungsi Organ
Ketamin memiliki kombinasi efek kardiovaskular yang unik, biasanya dikaitkan dengan takikardi, peningkatan tekanan darah, dan peningkatan cardiac output. Mekanisme tepat munculnya respon simpatik yang dimediasi sentral ini masih belum diketahui. Namun, pada absennya kontrol otonom, ketamin memiliki efek langsung depresi miokard, yang biasanya dikesampingkan oleh respon sentral ini. Dimungkinkan untuk mengurangi efek yang tidak diinginkan ini dengan cara memberikan ketamin sebagai infus berkala dan penggunaan bersama benzodiazepine.63
Ketamin memiliki efek minimal pada pusat pernapasan, meskipun penurunan sementara ventilasi dapat terjadi setelah pemberian bolus. Ketamin menyebabkan relaksasi otot polos bronkial, sehingga ketamin memiliki peran khusus pada pasien asma. Ketamin meningkatkan sekresi saliva, yang dapat menghasilkan potensial masalah pada anak-anak dengan menyebabkan obstruksi jalan nafas bagian atas. Meskipun refleks menelan, batuk, bersin, dan refleks muntah relatif utuh dengan ketamin, tetapi aspirasi dapat terjadi selama pasien terbius dengan ketamin.63
Sering dilaporkan adanya bunyi sonor pada penggunaan ketaminyang disangkakan laringospasme. Hal ini sebenarnya terjadi karena posisi saluran napas yang tidak bebas, dan masalah tersebut dapat dikelola secara sederhana hanya dengan melakukan reposisi kepala pasien. Laringospasme yang sebenarnya dapat terjadi pada penggunaan ketaminyang disebabkan oleh stimulasi dari pita suara oleh instrumentasi atau sekret. Sekret dapat dikurangi dengan memberikan premedikasi glycopyrrolate.63
Emergence reaction merupakan sensasi psikis setelah penggunaan
ilusi biasanya menghilang pada saat sadar penuh. Namun penting untuk mendiskusikan dengan pasien efek dari ketamintersebut dan efek ini muncul 5-30 % dari penggunaan ketamin.63 Kejadian emergence reaction lebih tinggi terkait faktor-faktor seperti meningkatnya usia, perempuan, pasien yang sering bermimpi, pemberian intravena yang cepat dan dosis besar.63 Ketamin telah diamati dapat mengaktifkan psikosis pada pasien dengan skizofrenia. Namun, belum terlihat adanya reaksi psikotik jangka panjang pada pasien tanpa penyakit kejiwaan sebelumnya. Premedikasi dapat diberikan untuk mengurangi emergence reaction, seperti midazolam (0,07-0,1 mg kg/bb), diazepam ( 0,15 - 0,3 kg/bb ), dan lorazepam ( 2-4 mg) intravena telah terbukti efektif. Insiden ini juga menurun bila digunakan bersama dengan hipnotik sedatif lain dan anestesi umum.63
Ketamin menghasilkan apa yang disebut sebagai anestesia 'disosiatif' yang digambarkan sebagai disosiasi fungsional dan elektrofisiologi antara sistem thalamo-neokorteks dan limbik. Electroencephalogram (EEG) menunjukkan aktivitas theta yang dominan dan menghilangnya irama alfa. Keadaan klinis unik yang dihasilkan oleh ketamin adalah keadaan kataleptik di mana mata tetap terbuka dengan tatapan nystagmus yang lambat, sedangkan refleks kornea dan cahaya tetap utuh. Berbagai tingkat hipertonus dan sesekali gerakan yang tidak terkait dengan stimulus nyeri tercatat pada keadaan anestesi yang adekuat untuk pembedahan. Studi-studi menunjukkan aktivitas eksitatori baik di thalamus dan sistem limbik tanpa bukti klinis aktivitas kejang setelah pemberian ketamin. Dengan demikian, ketamin mungkin tidak menyebabkan kejang pada pasien dengan gangguan kejang, dan pada kenyataannya, data eksperimen menunjukkan bahwa ketamin memiliki sifat anti kejang dan bahkan neuroprotektif.63
tekanan intrakranial. Pengaruh S-(+)-ketamin pada Intra Cranial Pressure(ICP) belum diketahui. Ketamin belum terbukti memiliki efek buruk pada hati dan sistem ginjal. Tekanan intraokular sedikit meningkat setelah pemberian ketamin. Ketamin menghasilkan peningkatan tonus otot dan kadang-kadang kejang otot, meskipun telah digunakan dengan aman pada miopati dan hipertermia maligna. Efek bervariasi dijumpai pada tonus uterus. Efek lainnya termasuk emesis, ruam sementara, dan agitasi.63
2.8.1.4.4. Penggunaan Klinis Ketamin
Campuran rasemik komersial ketamin adalah campuran setara R (-) dan S (+(-) isomer tersedia sebagai 10, 50, dan 100 mg/ml dengan pengawet, benzathonium hidroclorida. Isomer optik S-(+)-ketamin tersedia dalam 5 dan 25 mg/ml (tidak berlisensi di Inggris, saat ini). Ketamin dapat diberikan intravena, intramuscular, oral, rektal, dan untuk epidural pada sediaan bebas pengawet. Dosis tergantung pada rute pemberian dan efek terapi yang diinginkan. Benzodiazepine dapat diberikan baik secara oral (diazepam 10-30 mg, lorazepam 2-5 mg) 60-90 menit sebelum induksi atau intravena dengan dosis yang lebih kecil yang diberikan segera sebelum induksi. Dosis induksi anestesi ketamin yaitu 0.5–1.5 mg/kg intravena atau 4–10 mg/kgbb intramuscular. Dosis pemeliharaan untuk
anestesi 10-30 mcq/kg/menit intravena. Sedasi analgesia 0.2–0.75 mg/kg
intravena atau 2–4 mg/kgbb intramuscular diikuti infus berkala 5–20
mcg/kg/menit.63
ketamin masih dapat diberikan secara aman. Secara umum, hanya dosis subanestetik diperlukan untuk prosedur minor.63
Ketamin dapat digunakan sebagai suplemen intravena (IV) atau intramuskular (IM) selama anestesi regional. Hal ini juga dapat diberikan melalui rute epidural sebagai tambahan untuk anestesi lokal untuk memperpanjang durasi analgesia. Dosis rendah ketamin juga telah digunakan bersama dengan propofol untuk meningkatkan kualitas sedasi.63 Dosis rendah ketamin didefenisikan sebagai dosis ketamin yang diberikan ≤ 2 mg/kg bila diberikan intramuscular atau diberikan ≤ 1 mg/kg bila diberikan secara intravena atau epidural. Untuk pemberian kontinu intravena ketamin dosis rendah didefinisikan sebagai rerata infus ≤ 20 mcg/kg/menit.21 Dosis rendah ini sering digunakan untuk suplementasi anestesi yang lain. Sumber lain menyebutkan bahwa analgesia ketamin dapat dicapai dalam dosis 0,2-0,5mg/kg/ intravena.63 Efek anestesi ketaminsebagai NMDA antagonis mencegah sensitisasi sentral terhadap rangsangan nyeri hebat. Ketamin adalah satu-satunya NMDA antagonis yang tersedia dan penelitian telah menunjukkan bahwa dosis kecil ketaminyang diberikan perioperatif dapat mengurangi kebutuhan analgetik opioid pascaoperasi (rata-rata 40-60%).63 Pasien yang diberikan ketamin juga mengalami PONV yang lebih sedikit.66
Ketamin mungkin berbahaya pada pasien dengan fungsi cadangan ventrikel kanan yang terbatas dan peningkatan tahanan vaskular pulmonal. Pada pasien dengan penyakit saluran napas reaktif, ketamin (rasemik) dapat berguna karena memiliki efek bronkodilator dan analgesia mendalam yang memungkinkan pemberian oksigen inspirasi yang lebih besar. Ketaminjika dikombinasikan dengan benzodiazepine atau benzodiazepine dengan opioid, menurunkan takikardia yang tidak diinginkan, hipertensi dan juga reaksi psikomimetik pascaoperasi. Teknik ini menghasilkan gangguan hemodinamik minimal, analgesia yang mendalam, amnesia dan pemulihan tanpa efek samping yang berarti.63
Ketamin bebas pengawet telah ditambahkan ke bupivacaineuntuk meningkatkan durasi analgesia anestesi kaudal, tanpa mempengaruhi intensitas analgesik. Minat penggunaan ketamin ini tumbuh pesat dan dalam survei terbaru, 32% dari anestesi pediatrik Inggris melaporkan penggunaan ketaminepidural.63
Secara historis, telah diyakini bahwa ketamin merupakan kontraindikasi pada pasien dengan peningkatan tekanan intrakranial, namun adanya laporan tentang efek neuroregeneratif telah menghasilkan penelitian dalam topik ini.67 Ketamin dapat mencegah influks ion kalsium abnormal atau akumulasi glutamat melalui interaksi dengan reseptor NMDA. Peningkatan aliran darah otak setelah pemberian ketamin kurang dari peningkatanCerebral Metabolic Rate of O2 (CMRO2). S-(+)-ketamin mengurangi atau mempertahankan metabolisme serebral pada sebagian besar wilayah otak (studi eksperimental).68
mengurangi adhesi neutrofil, sedangkan R-(-)-ketamin memiliki efek negatif yaitu memperburuk kebocoran ke jaringan sekitarnya dari pembuluh darah coroner.
2.8.1.5 FENTANIL
2.8.1.5.1. Struktur, Rumus Bangun
Fentanil merupakan agonis opioid sintetis derivat fenilpiperidin yang strukturnya menyerupai meperidin. Sebagai analgesik, fentanil 75 – 125 kali lebih poten dibandingkan dengan morfin.5
Gambar 9.Rumus bangun Fentanil 2.8.1.5.2. Penggunaan Klinis Fentanil
Dalam praktek klinis, fentanil diberikan dalam rentang dosis yang luas. Dosis 1 – 2 μg/kg intravena diberikan untuk memberikan efek analgesi. Fentanil dosis 2 – 20 μg/kg intravena dapat diberikan untuk mengurangi respon kardiovaskuler pada tindakan laringoskopi dan intubasi endotrakhea karena cara kerjanya yang memblok rangsang nyeri, depresi tonus simpatis sentral dan aktivasi tonus vagal. Fentanil dengan dosis 2 – 20 μg/kg intravena juga dapat digunakan untuk mengatasi perubahan mendadak akibat stimulasi saat pembedahan. Sementara dosis besar fentanil 50 – 150 μg/kg intravena digunakan dalam surgical anesthesia sebagai obat anestesi tunggal.5
sebagai agen anestesi tunggal termasuk a) gagalnya pencegahan respon sistem saraf simpatik akibat rangsang nyeri hebat akibat pembedahan, b) kemungkinan sadarnya pasien, c) kemungkinan depresi nafas pascabedah.5
2.8.1.5.3 Farmakokinetik
Pemberian dosis tunggal fentanil intravena mempunyai mula kerja lebih cepat dan durasi yang lebih singkat dibandingkan morfin. Onset yang cepat ini menunjukkan bahwa fentanil mempunyai sifat larut lemak yang tinggi sehingga mudah melalui sawar darah otak. Sedangkan untuk durasinya yang singkat menunjukkan redistribusi cepat ke jaringan lemak, otot skeletal, serta paru-paru, hal ini dikaitkan dengan menurunnya kadar konsentrasi fentanil di plasma. Paru juga berperan sebagai tempat penyimpanan yang besar dan inaktif dari fentanil, dengan perkiraan 75% dari dosis inisial fentanil ditangkap saat melewati paru pertama kali. Fungsi non respirasi dari paru ini membatasi jumlah inisial obat yang mencapai sirkulasi sistemik dan dapat memainkan peran besar dalam profil farmakokinetik fentanil. Ketika beberapa dosis fentanil intravena diberikan atau ketika obat ini diberikan secara infus kontinu, saturasi progresif dari jaringan ini terjadi. Hasilnya, konsentrasi plasma fentanil tidak menurun secara cepat, dan durasi analgesia, sama halnya dengan depresi ventilasi, bisa memanjang.5
Meskipun fentanil mempunyai masa kerja singkat, namun fentanil mempunyai waktu paruh eliminasi yang lebih panjang daripada morfin, yang menunjukkan fentanil mempunyai kecepatan distribusi yang lebih besar. Hal ini disebabkan karena daya kelarutan lemaknya yang besar sehingga mudah masuk ke jaringan dibandingkan morfin yang kurang larut dalam lemak. Setelah bolus intravena, fentanil terdistribusi cepat ke jaringan yang kaya pembuluh darah. Lebih dari 80% dari dosis yang diinjeksikan keluar dari plasma <5 menit. Konsentrasi plasma fentanil terjaga dengan tangkapan kembali secara lambat dari jaringan yang tidak aktif, yang mana menggambarkan efek obat yang persisten yang berlaku parallel dengan waktu paruh eliminasi yang panjang. Namun pada pasien lanjut usia, eliminasi waktu paruh menjadi memanjang dikarenakan penurunan aliran darah hepatik, penurunan aktivitas enzim mikrosomal hepar, atau penurunan produksi albumin, dimana sebagian besar fentanil terikat pada protein (79 – 87%). Oleh karena itu, pemberian fentanil dalam periode waktu yang lama pada pasien lanjut usia lebih efektif daripada pasien dewasa.
Seiring durasi infus kontinu fentanil berjalan di atas 2 jam, context-sensitive half-time dari opioid ini menjadi lebih besar dari sufentanil. Hal ini merefleksikan saturasi dari fentanil pada jaringan inaktif selama infus kontinu yang lama dan kembalinya opioid ini dari kompartemen perifer plasma. Jaringan reservoir fentanil ini menggantikan fentanil yang dieliminasi oleh metabolism hepar yang akhirnya memperlambat laju penurunan konsentrasi fentanil dalam plasma pada saat infusnya dihentikan.5
2.8.1.5.4 Efek Samping
yang asam (perangkap ion). Fentanil yang diisolasi ini kemudian bisa diabsorbsi dari usus halus yang lebih alkali kembali ke sirkulasi untuk meningkatkan konsentrasi opioid di plasma dan depresi nafas bisa kembali terjadi. Tetapi hal ini mungkin bukan mekanisme kadar puncak kedua fentanil, karena fentanil yang diserap dari traktus gastrointestinal dan otot rangka, yang terpacu oleh pergerakan pada saat transfer dari kamar operasi, akan mengalami first pass metabolism oleh hepar. Penjelasan alternative untuk kadar puncak kedua fentanil adalah keluarnya opioid dari paru karena hubungan ventilasi dan perfusi paru kembali lagi pada periode pascabedah.5,71
Fentanil tidak mempengaruhi aliran darah paru dan hepar. Fentanil menyebabkan kekakuan otot khususnya otot thoraks, abdomen, dan ekstrimitas serta menyebabkan depresi ventilasi terutama pada pemberian intravena yang cepat.70
Dibandingkan dengan morfin, fentanil tidak menyebabkan pelepasan histamin meskipun dalam dosis yang besar, sehingga tidak terjadi dilatasi pembuluh vena yang berujung pada hipotensi. Namun bradikardi terlihat lebih nyata pada pemberian fentanil dibandingkan morfin karena meningkatnya tonus vagal sentral dan depresi nodus Sino Atrial (SA) dan Atrio Ventricular (AV), sehingga dapat menyebabkan penurunan tekanan darah dan curah jantung.72
Pemberian sulfas atropin dapat menurunkan kejadian bradikardi dan dianjurkan pada penggunaan fentanil dosis tinggi. Pemberian sulfas
atropin pada fentanil 10 μg/kg intravena dapat menurunkan kebutuhan
oksigen miokardium dan insufisiensi koroner.70
Pemberian fentanil pada pasien trauma kepala telah dihubungkan dengan peningkatan tekanan intrakranial 6 – 9 mmHg. Peningkatan tekanan intracranial ini biasanya disertai juga penurunan tekanan arteri rerata dan tekanan perfusi serebral. Hal ini menyatakan peningkatan tekanan intrakranial oleh sufentanil (mungkin juga oleh fentanil) mungkin disebabkan adanya penurunan autoregulasi tahanan vaskuler serebral akibat penurunan tekanan darah.5,72
2.8.2 Non-Farmakologis
2.9 KERANGKA TEORI
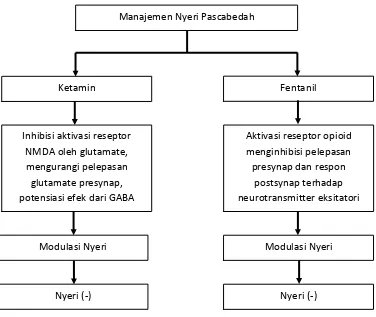
Gambar 10. Kerangka Teori
Manajemen Nyeri Pascabedah
Ketamin Fentanil
Inhibisi aktivasi reseptor NMDA oleh glutamate, mengurangi pelepasan glutamate presynap, potensiasi efek dari GABA
Aktivasi reseptor opioid menginhibisi pelepasan presynap dan respon
postsynap terhadap neurotransmitter eksitatori
Modulasi Nyeri
Nyeri (-)
Modulasi Nyeri
2.10 KERANGKA KONSEP
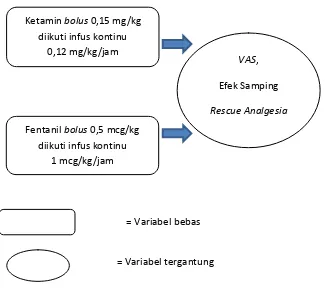
Gambar 11. Kerangka Konsep
Ketamin bolus 0,15 mg/kg diikuti infus kontinu
0,12 mg/kg/jam
Fentanil bolus 0,5 mcg/kg diikuti infus kontinu
1 mcg/kg/jam
VAS,
Efek Samping
Rescue Analgesia
= Variabel bebas