Oleh :
Joddi Iryadi Candra
C34102039
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2006
Dengan ini saya menyatakan bahwa skripsi dengan judul Isolasi dan Karakterisasi Bakteri Asam Laktat dari Produk Bekasam Ikan Bandeng (Chanos chanos) adalah karya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Juli 2006
Joddi Iryadi Candra NRP C34102039
ZAHIRUDDIN dan DESNIAR.
Bekasam merupakan salah satu produk hasil perikanan yang difermentasi dengan menggunakan aktivitas bakteri asam laktat. Pembuatan bekasam masih dilakukan secara tradisional dengan menerapkan fermentasi spontan. Hal ini menyebabkan jumlah dan jenis mikroba yang berperan dalam bekasam beraneka ragam, sehingga produk yang diperoleh mutunya tidak konsisten. Penelitian ini bertujuan untuk mengetahui karakteristik bakteri asam laktat yang diisolasi dari produk bekasam dan menduga jenisnya berdasarkan karakteristik sifat morfologi dan fisiologisnya.
Bekasam yang digunakan dalam penelitian ini adalah bekasam ikan bandeng (Chanos chanos) yang diperoleh dari pengolah tradisional di daerah Indramayu dan produk tersebut telah difermentasi selama 2 minggu. Penelitian ini dibagi menjadi tiga tahapan, yaitu analisis bahan, isolasi bakteri dengan menggunakan metode goresan kuadran dan karakterisasi bakteri berdasarkan sifat morfologi dan fisiologisnya. Hasil dari karakterisasi tersebut digunakan untuk menduga jenis bakteri yang terdapat dalam produk bekasam berdasarkan kunci identifikasi dari Cowan dan Steel (1974).
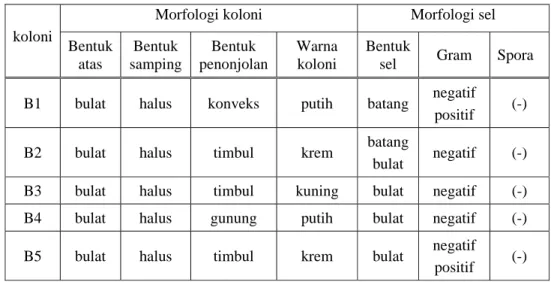
Bekasam ikan bandeng yang difermentasi selama 2 minggu mempunyai kadar NaCl 3,26 %, pH 4,46 dan total asam laktat 1,30 %. Hasil tersebut berguna sebagai informasi awal mengenai karakteristik bahan. Dari hasil kultur bakteri, dipilih 5 koloni dominan yang mempunyai morfologi berbeda satu sama lainnya. Kelima koloni tersebut diisolasi untuk mendapatkan isolat bakteri. Selanjutnya, kelima isolat diuji untuk mengetahui sifat morfologi dan fisiologisnya.
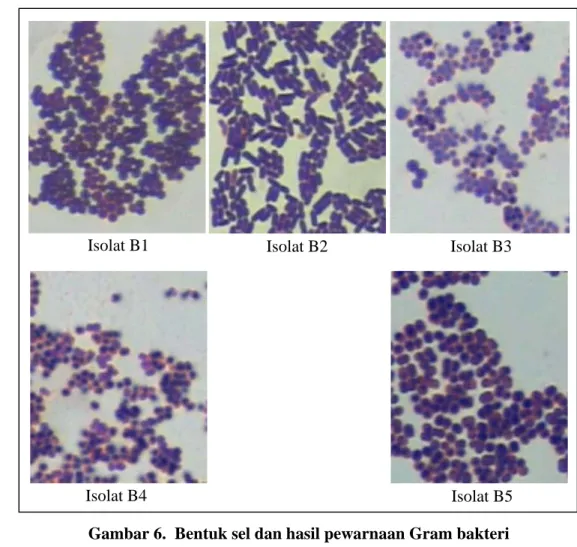
Isolat B1, B3 dan B5 mempunyai bentuk sel bulat, Gram positif, tidak berspora, non motil, katalase positif, oksidase negatif, bersifat fermentatif, uji kualiatatif Staphylococcus bersifat positif, koagulase negatif, indol negatif, tidak membentuk H2S, memfermentasi glukosa, menghasilkan asam, bersifat proteolitik dan amilolitik. Berdasarkan sifat tersebut diduga ketiga bakteri tersebut merupakan jenis Staphylococcus sp.
Isolat B2 mempunyai bentuk sel batang, Gram positif, tidak berspora, non motil, katalase negatif, oksidase negatif, bersifat fermentatif, koagulase negatif, indol negatif, tidak mereduksi nitrat, tidak menghasilkan H2S, memfermentasi glukosa dan laktosa atau sukrosa, membentuk asam tanpa gas, tidak mampu menggunakan sitrat, bersifat proteolitik, lipolitik dan amilolitik. Berdasarkan hasil uji tersebut, diduga isolat B2 adalah jenis Erysipelothrix atau Lactobacillus.
Isolat B4 merupakan bakteri dengan bentuk sel bulat, bersifat Gram positif, tidak berspora, non motil, katalase negatif, oksidase negatif, bersifat fermentatif, koagulase negatif, indol negatif, dapat mereduksi nitrat, tidak menghasilkan H2S, memfermentasi glukosa dan laktosa atau sukrosa, membentuk asam tanpa gas, tidak mampu menggunakan sitrat, lipolitik negatif, bersifat proteolitik dan amilolitik. Berdasarkan sifat tersebut diduga isolat B4 merupakan bakteri yang termasuk ke dalam famili Streptococcaceae, yang terdiri dari jenis Aerococcus, Streptococcus, Pediococcus dan Gemella.
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
Oleh :
Joddi Iryadi Candra C34102039
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR 2006
LAKTAT DARI PRODUK BEKASAM IKAN BANDENG (Chanos chanos)
Nama : Joddi Iryadi Candra
NRP : C34102039
Menyetujui,
Pembimbing II
Desniar, SPi, MSi NIP. 132 159 705 Pembimbing I
Ir. Winarti Zahiruddin, MS NIP. 130 422 706
Mengetahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Dr. Ir. Kadarwan Soewardi, M.Sc NIP. 130 805 031
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmat dan karunianya, sehingga penulis dapat menyelesaikan skripsi ini dengan baik.
Skripsi hasil penelitian ini disusun sebagai syarat untuk mendapatkan gelar sarjana Perikanan dan Ilmu Kelautan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Skripsi ini merupakan studi tentang Isolasi dan Karakterisasi Bakteri Asam Laktat dari Produk Bekasam Ikan Bandeng (Chanos chanos).
Pada kesempatan ini penulis mengucapkan terima kasih kepada:
1 Ibu Ir. Winarti Zahiruddin, MS dan Ibu Desniar, SPi, MSi selaku dosen pembimbing.
2 Bapak Ir. Djoko Poernomo, BSc dan Ibu Mala Nurilmala, SPi, MSi selaku dosen penguji
3 Dosen, Staf dan Laboran Departemen THP atas bantuan dan kerjasama selama penelitian.
4 Bapak Agus Somantri selaku Laboran pada Laboratorium Bakteriologi Fakultas Kedokteran Hewan Institut Pertanian Bogor
5 Ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
6 Semua pihak yang telah membantu, sehingga penulisan skripsi ini dapat diselesaikan dengan baik.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh sebab itu kritik dan saran yang bersifat membangun sangat penulis harapkan.
Bogor, Juli 2006
Penulis dilahirkan di Majalengka pada tanggal 14 Juli 1984 dari Ayah Johan Rosihan Candra dan Ibu Khaerani. Penulis merupakan putra pertama dari tiga bersaudara.
Penulis mengawali pendidikan formal di SD Negeri Tonjong 2 Majalengka pada tahun 1990 dan menyelesaikan pendidikan pada tahun 1996. Pada tahun yang sama penulis diterima di SLTP Negeri 2 Majalengka dan menyelesaikan pendidikannya pada tahun 1999. Penulis melanjutkan pendidikan di SMU Negeri 1 Majalengka dan menyelesaikan pendidikannya pada tahun 2002.
Pada tahun 2002, penulis diterima di Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis memilih Program Studi Teknologi Hasil Perikanan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan. Selama menjadi mahasiswa, penulis pernah mengikuti pelatihan Program Manajemen Mutu Terpadu (PMMT) berdasarkan konsepsi HACCP pada bulan Juli 2006.
DAFTAR TABEL ... viii DAFTAR GAMBAR... ix DAFTAR LAMPIRAN ... x 1 PENDAHULUAN... 1 1.1 Latar Belakang... 1 1.2 Tujuan ... 3 2 TINJAUAN PUSTAKA ... 4
2.1 Deskripsi, Klasifikasi dan Potensi Ikan Bandeng (Chanos chanos)... 4
2.2 Fermentasi... 5
2.3 Bekasam... 7
2.4 Morfologi dan Fisiologi Bakteri Asam Laktat... 9
2.4.1 Micrococcaceae ... 9
2.4.2 Lactobacillaceae ... 10
2.4.3 Streptococcaceae ... 11
2.5 Peranan Bakteri Asam Laktat ... 12
2.6 Faktor yang Mempengaruhi Pertumbuhan Bakteri Asam Laktat ... 14
2.6.1 Suhu... 15
2.6.2 Nilai pH ... 16
2.6.3 Garam ... 16
2.6.4 Karbohidrat... 18
2.7 Isolasi dan Karakterisasi Mikroba pada Produk Fermentasi ... 18
3 METODOLOGI ... 21
3.1 Tempat dan Waktu Penelitian... 21
3.2 Alat dan Bahan ... 21
3.3 Metode Penelitian ... 22
3.3.1 Analisis bahan ... 22
3.3.2 Isolasi bakteri ... 22
3.3.3 Karakterisasi bakteri... 23
3.4 Prosedur Analisis ... 23
3.4.1 Pengukuran kadar garam (NaCl) (Apriyantono et al. 1989) ... 25
3.4.2 Pengukuran nilai pH (AOAC 1995) ... 25
3.4.3 Total asam laktat (AOAC 1995) ... 25
3.4.4 Bentuk sel bakteri ... 26
3.4.9 Uji oksidase (Hadioetomo 1985)... 27
3.4.10 Uji oksidatif-fermentatif Baird Parker (Cowan dan Steel 1973) ... 27
3.4.11 Uji kualitatif Staphylococcus (Fardiaz 1989) ... 28
3.4.12 Uji koagulase (Fardiaz 1989) ... 28
3.4.13 Uji indol (Hadioetomo 1985) ... 28
3.4.14 Uji reduksi nitrat (Hadioetomo 1985) ... 28
3.4.15 Uji H2S, fermentasi glukosa dan pembentukan gas (Fardiaz 1989) ... 29
3.4.16 Uji pembentukan asam (Fardiaz 1989) ... 29
3.4.17 Uji sitrat (Cowan dan Steel 1974) ... 29
3.4.18 Uji aktivitas proteolitik (Fardiaz 1989) ... 30
3.4.19 Uji hidrolisis lemak (Fardiaz 1989)... 30
3.4.20 Uji hidrolisis pati (Fardiaz 1989) ... 30
3.5 Pendugaan Jenis Bakteri ... 30
4 HASIL DAN PEMBAHASAN ... 32
4.1 Analisis Bahan ... 32
4.2 Isolasi Bakteri Asam Laktat... 34
4.3 Karakterisasi Isolat Bakteri... 37
4.3.1 Sifat morfologi ... 37
4.3.2 Sifat fisiologis... 41
4.3.2.1 Uji katalase... 41
4.3.2.2 Uji oksidase... 43
4.3.2.3 Uji oksidatif-fermentatif Baird Parker ... 45
4.3.2.4 Uji kualitatif Staphylococcus ... 46
4.3.2.5 Uji koagulase... 47
4.3.2.6 Uji indol ... 48
4.3.2.7 Uji reduksi nitrat ... 49
4.3.2.8 Uji H2S, fermentasi glukosa, pembentukan gas dan asam... 50
4.3.2.9 Uji sitrat... 53
4.3.2.10 Uji aktivitas proteolitik ... 53
4.3.2.11 Uji hidrolisis lemak ... 55
4.3.2.12 Uji hidrolisis pati... 56
4.4 Pendugaan Jenis Bakteri ... 57
5 KESIMPULAN DAN SARAN ... 60
5.1 Kesimpulan ... 60
5.2 Saran ... 60
DAFTAR PUSTAKA ... 62
Halaman Nomor
1 Reaksi-reaksi pada medium TSIA... 29
2 Kunci identifikasi bakteri Gram positif (Cowan dan Steel 1974) ... 31
3 Analisis kimia sampel bekasam ikan bandeng (Chanos chanos)... 32
4 Morfologi koloni dan sel dari koloni terpilih ... 35
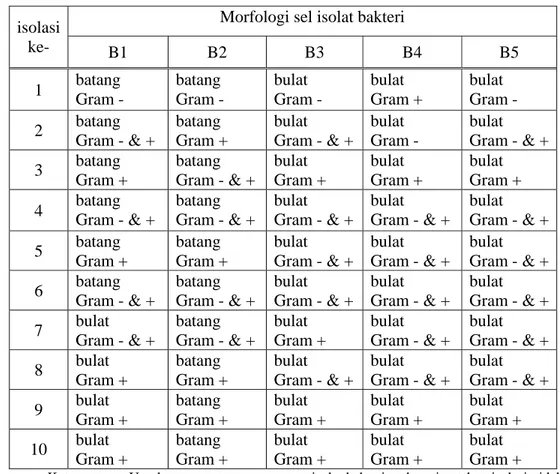
5 Morfologi sel dari setiap tahapan isolasi... 36
6 Morfologi koloni dan sel dari isolat bakteri ... 37
7 Sifat fisiologis isolat bakteri... 42
Halaman Nomor
1 Ikan bandeng (Chanos chanos) ... 5
2 Skema pembuatan bekasam (Murtini 1992)... 7
3 Produksi asam laktat melalui fermentasi glukosa secara homofermentatif (A) dan heterofermentatif (B) (Rahayu 1992)... 14
4 Tahapan isolasi bakteri asam laktat... 24
5 Bekasam ikan bandeng (Chanos chanos)... 32
6 Bentuk sel dan hasil pewarnaan Gram bakteri ... 39
7 Hasil pewarnaan spora isolat bakteri... 40
8 Hasil uji motilitas bakteri ... 41
9 Hasil uji oksidase... 44
10 Hasil uji oksidatif-fermentatif Baird Parker ... 45
11 Hasil uji kualitatif Staphylococcus ... 46
12 Hasil uji koagulase ... 47
13 Hasil uji indol ... 48
14 Hasil uji reduksi nitrat ... 49
15 Uji fermentasi glukosa dan pembentukan H2S... 51
16 Hasil uji pembentukan asam... 52
17 Hasil uji sitrat ... 53
18 Hasil uji aktivitas proteolitik ... 54
19 Hasil uji hidrolisis lemak... 55
20 Hasil uji hidrolisis pati... 57
Halaman Nomor
1 Contoh perhitungan analisis kimia sampel bekasam... 64 2 Gambar bentuk penampakan koloni terpilih ... 66 3 Gambar koloni bakteri dari tahapan isolasi... 67
1.1 Latar Belakang
Ikan dikenal sebagai sumber protein hewani yang mempunyai nilai gizi tinggi. Hal ini karena protein ikan lebih mudah dicerna dan mempunyai kandungan asam amino essensial yang lengkap dan seimbang. Di sisi lain, komoditas perikanan umumnya memiliki masa simpan yang singkat, karena sifatnya mudah rusak. Usaha memperpanjang umur simpan dan meningkatkan cita rasa dapat dilakukan dengan cara mengolah bahan pangan tersebut. Berbagai cara pengolahan ikan yang telah banyak dilakukan antara lain penggaraman, pengeringan, perebusan dan fermentasi, yang semuanya bertujuan untuk mengawetkan atau memperpanjang masa simpan ikan tersebut.
Pengolahan ikan dengan cara fermentasi merupakan cara pengawetan tradisional di Indonesia dan negara-negara Asia Tenggara lainnya, dimana prosesnya relatif mudah dan murah (Rahayu et al. 1992). Produk makanan yang difermentasi biasanya mempunyai nilai gizi yang lebih tinggi dari bahan asalnya. Hal ini disebabkan karena mikroba pada produk fermentasi dapat memecah komponen yang kompleks pada bahan pangan menjadi bahan-bahan yang lebih sederhana, sehingga lebih mudah dicerna dan juga mikroba tersebut dapat mensintesis beberapa vitamin seperti riboflavin, B12 dan provitamin A (Buckle et al. 1978).
Berdasarkan prosesnya, fermentasi ikan dibedakan menjadi 4 golongan, yaitu fermentasi menggunakan kadar garam tinggi, asam organik, asam mineral dan fermentasi dengan menggunakan bakteri asam laktat (Rahayu et al. 1992). Penggunaan bakteri asam laktat dalam proses fermentasi merupakan cara yang relatif mudah, murah dan aman. Bakteri tersebut dapat dirangsang pertumbuhannya dengan penambahan sumber karbohidrat dan garam dalam jumlah yang optimum pada kondisi anaerobik. Contoh produk fermentasi hasil perikanan yang sengaja ditambahkan garam dan sumber karbohidrat dalam proses pembuatannya adalah bekasam.
Bekasam merupakan suatu produk fermentasi ikan yang rasanya asam dan banyak dikenal di daerah Jawa Tengah, Sumatera Selatan dan Kalimantan
Tengah. Salah satu kekhasan dari produk ini adalah rasanya yang tidak terlalu asin, sehingga diharapkan dapat meningkatkan jumlah konsumsi atau intake protein yang berasal dari produk perikanan (Rahayu et al. 1992).
Selain di Jawa Tengah, Sumatera Selatan dan Kalimantan Tengah, bekasam juga dapat dijumpai di daerah Indramayu. Bekasam di daerah ini sebagian besar menggunakan jenis ikan bandeng sebagai bahan baku utama dalam pembuatannya. Selain dapat menghasilkan rasa bekasam yang khas, ikan bandeng juga dihasilkan dalam jumlah yang melimpah di daerah Indramayu. Produksi ikan bandeng di daerah ini mencapai 30.709 ton pada tahun 2005 (Dinas Perikanan Kabupaten Indramayu 2005).
Proses pembuatan bekasam sampai saat ini masih dilakukan secara tradisional dengan menerapkan fermentasi spontan, yaitu bakteri yang berperan, pertumbuhannya dirangsang dengan penambahan garam dan sumber karbohidrat dalam kondisi anaerobik. Proses seperti ini dapat mengakibatkan jumlah dan jenis mikroba yang berperan aktif dalam bekasam beraneka ragam, sehingga menyebabkan hasil yang diperoleh tidak seragam dan mutunya tidak menentu (Winarno dan Fardiaz 1984).
Penelitian yang menyangkut aspek-aspek fisika kimia bekasam telah banyak dilakukan dalam upaya mengembangkan produk tersebut agar diperoleh mutu yang baik dan konsisten. Namun, sejauh ini belum ada penelitian yang berkaitan dengan mikrobiologi bekasam, sehingga belum dapat diketahui secara pasti jenis mikroba yang berperan aktif di dalamnya.
Sebagai dasar untuk mengidentifikasi jenis mikroba yang terdapat dalam produk bekasam, diperlukan adanya isolasi dan karakterisasi mikroba tersebut berdasarkan sifat fisiologis dan morfologisnya. Setelah diperoleh biakan murni dan diidentifikasi jenisnya, diharapkan bakteri tersebut dapat dijadikan sebagai starter dalam proses pembuatan bekasam tahap selanjutnya. Penggunaan starter ini merupakan salah satu upaya untuk mengembangkan produk bekasam sehingga dapat dihasilkan mutu yang baik dan konsisten.
1.2 Tujuan
Penelitian ini bertujuan untuk mengetahui karakteristik bakteri asam laktat yang diisolasi dari produk bekasam ikan bandeng (Chanos chanos) dan menduga jenis bakteri tersebut berdasarkan karakteristik sifat morfologi dan fisiologisnya.
2.1 Deskripsi, Klasifikasi dan Potensi Ikan bandeng (Chanos chanos)
Ikan bandeng termasuk jenis ikan pelagis yang mencari makan di permukaan dan sering dijumpai di daerah pantai atau daerah literal. Secara
geografis, ikan ini hidup di daerah tropis maupun subtropis pada batas 30-40 o lintang selatan (Martosudarmo et al. 1984).
Klasifikasi ikan bandeng menurut Saanin (1984) adalah sebagai berikut: Phylum : Chordata
Sub Phylum : Vertebrata
Kelas : Pisces
Sub kelas : Teleostei
Ordo : Malacopterigii Famili : Chanidae Genus : Chanos
Spesies : Chanos chanos
Ciri-ciri morfologi ikan bandeng adalah badan memanjang agak pipih, tanpa scute pada bagian perutnya, mata diselaputi lendir, mempunyai sisik besar pada sirip dada dan sirip perut, sirip ekor panjang dan bercagak, sisik kecil dengan tipe cycloid, tidak bergigi, sirip anal jauh dibelakang sirip ventral (Saanin 1984). Ikan bandeng termasuk jenis ikan herbivora dengan makanan utama berupa plankton dan tumbuhan lumut. Pada waktu larva, jenis makanan dari ikan bandeng adalah phytoplankton dan zooplankton berukuran renik yang terdapat di permukaan laut.
Daerah penyebaran ikan bendeng terdapat di sekitar samudera Hindia sampai samudra Pasifik. Pada bagian barat dapat ditemukan di Laut Merah, pantai timur Afrika dan Madagaskar. Di bagian timur ditemukan di kepulauan Paumotu, penyebaran ke utara sampai di sebelah selatan Jepang dan penyebaran ke selatan sampai New South Wales (Martosudarmo et al. 1984). Gambar ikan bandeng dapat dilihat pada Gambar 1.
Gambar 1. Ikan bandeng (Chanos chanos)
Ikan bandeng merupakan jenis ikan yang banyak dibudidayakan pada tambak di daerah pesisir lautan. Produksi ikan bendeng di Indonesia cukup melimpah, dengan rata-rata tiap tahunnya mencapai 147.000 ton (Direktorat Jenderal Perikanan 2000).
2.2 Fermentasi
Fermentasi merupakan proses pemecahan karbohidrat dan asam amino secara anaerobik, yaitu tanpa memerlukan oksigen. Senyawa yang dapat dipecah dalam proses fermentasi terutama adalah karbohidrat, sedangkan asam amino hanya dapat difermentasi oleh beberapa jenis bakteri tertentu (Fardiaz 1992). Fermentasi timbul sebagai hasil dari metabolisme energi tipe anaerobik, dimana yang berfungsi sebagai donor dan aseptor elektronnya adalah senyawa organik (Winarno dan Fardiaz 1984). Dalam proses fermentasi terjadi perubahan kimia dalam bahan pangan yang disebabkan oleh aktivitas enzim. Enzim yang berperan tersebut dapat dihasilkan oleh mikroorganisme atau telah ada dalam bahan pangan (Buckle et al. 1978).
Fermentasi hanya dapat terjadi karena adanya aktivitas mikroba pada substrat organik yang sesuai. Peranan substrat yang terpenting adalah sebagai sumber energi bagi metabolisme sel, sebagai bahan pembentuk sel dan produk metabolisme (Rachman 1989). Bahan pangan umumnya merupakan substrat yang baik bagi pertumbuhan mikroorganisme. Proses fermentasi dapat mengakibatkan terjadinya perubahan fisik dan kimia pada bahan pangan tersebut. Perubahan-perubahan ini dapat memperbaiki aspek gizi, daya cerna serta daya simpan produk yang difermentasi (Buckle et al. 1978).
Fermentasi yang terjadi pada ikan merupakan proses penguraian secara biologis atau semi biologis terhadap senyawa-senyawa kompleks, terutama protein menjadi senyawa yang lebih sederhana dalam keadaan terkontrol. Selama proses fermentasi berlangsung, protein ikan akan terhidrolisis menjadi asam-asam amino dan peptida, kemudian asam amino ini akan terurai lebih lanjut menjadi komponen-komponen lain yang berperan dalam pembentukan cita rasa produk. Jika ke dalam bahan mentah tersebut ditambahkan sumber karbohidrat berupa pati atau nasi, maka selama fermentasi akan terjadi pemecahan karbohidrat menjadi senyawa yang lebih sederhana, seperti asam piruvat, asam laktat, asam asetat dan etanol (Rahayu et al. 1992).
Prinsip pengawetan pada produk fermentasi ikan disebabkan oleh beberapa faktor diantaranya penurunan aktivitas air oleh garam dan penurunan pH yang timbul akibat adanya pembentukan asam oleh mikroba. Berdasarkan prosesnya, fermentasi ikan dibedakan menjadi empat golongan, yaitu: fermentasi menggunakan kadar garam tinggi, fermentasi dengan menggunakan asam organik dan asam-asam mineral serta fermentasi dengan menggunakan bakteri asam laktat (Rahayu et al. 1992).
Fermentasi dengan kadar garam tinggi menyebabkan terbatasnya penggunaan produk hasil fermentasi ikan sebagai sumber protein karena rasanya terlalu asin. Fermentasi dengan menggunakan asam organik dan asam mineral mempunyai kelemahan bagi nelayan–nelayan tradisional, karena kurangnya pengetahuan mereka dalam menangani asam-asam kuat yang bersifat korosif. Penggunaan bakteri asam laktat dalam fermentasi merupakan cara yang relatif mudah, murah dan aman, karena untuk merangsang pertumbuhan bakteri tersebut cukup dirangsang dengan penambahan sumber karbohidrat dan garam dengan jumlah optimum dalam kondisi anaerob (Rahayu et al. 1992). Fermentasi yang menggunakan bakteri asam laktat, dapat mengakibatkan terbentuknya senyawa-senyawa asam, terutama asam laktat yang dapat berfungsi sebagai pengawet (Buckle et al. 1978). Senyawa asam tersebut dihasilkan dari pemecahan glukosa oleh aktivitas bakteri asam laktat, yang dibedakan menjadi dua kelompok, yaitu: bakteri asam laktat homofermentatif dan heterofermentatif (Rahayu et al. 1992).
2.3 Bekasam
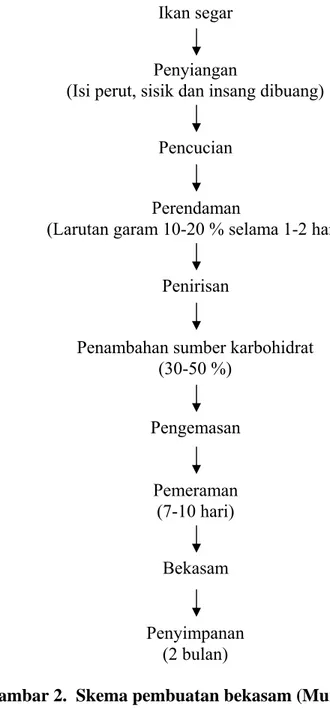
Bekasam merupakan hasil pengolahan tradisional secara fermentasi yang banyak dikenal di daerah Sumatera dan Kalimantan, terutama di Kalimantan Tengah. Hasil olahan ini dikenal dengan nama Wadi. Biasanya, bekasam disajikan sebagai pelengkap lauk yang sebelumnya dibumbui lagi dengan cabe dan gula (Rahayu et al. 1992). Bahan baku yang digunakan dalam proses pembuatan bekasam pada umumnya adalah ikan air tawar (Murtini 1992). Secara umum proses pembuatan bekasam dapat dilihat pada Gambar 2.
Pengemasan
Penambahan sumber karbohidrat (30-50 %)
Penirisan Perendaman
(Larutan garam 10-20 % selama 1-2 hari) Pencucian
Penyiangan
(Isi perut, sisik dan insang dibuang) Ikan segar Pemeraman (7-10 hari) Penyimpanan (2 bulan) Bekasam
Pembuatan bekasam secara prinsip ada tiga tahap, yaitu proses penggaraman, penambahan karbohidrat dan dilanjutkan dengan fermentasi. Dalam proses pembuatan bekasam secara tradisional pada umumnya digunakan garam untuk mencegah terjadinya pembentukan amonia dari senyawa nitrogen dan untuk menseleksi mikroba (Murtini 1992). Penambahan karbohidrat pada pembuatan bekasam bertujuan untuk merangsang pertumbuhan bakteri asam laktat. Bakteri asam laktat akan menguraikan karbohidrat menjadi senyawa-senyawa sederhana yaitu asam laktat, asam asetat, asam propionat dan etil alkohol. Senyawa-senyawa ini berguna sebagai pengawet dan pemberi rasa asam pada produk bekasam (Rahayu et al. 1992). Sumber karbohidrat yang ditambahkan pada umumnya adalah nasi, beras sangrai dan tape ketan serta proses fermentasinya berlangsung secara anaerobik. Kandungan karbohidrat dalam nasi adalah 40,6 % dengan kadar air 57,0 %, sedangkan tape ketan adalah 37,5 % dengan kadar air 58,9 % (Murtini 1992).
Produk-produk fermentasi ikan yang menggunakan garam dan bahan yang berfungsi sebagai sumber karbohidrat banyak terdapat di negara-negara Asia Tenggara. “Burongisda” adalah produk sejenis bekasam yang berasal dari Philipina. “Burongisda” ini dibuat dari campuran ikan air tawar, nasi, garam dan angkak (beras merah sebagai pewarna). Proses fermentasi pada pembuatan “burongisda” berlangsung sampai daging ikan menjadi lembut serta rasa dan bau asam mulai berkembang. Pada “burongisda”, bakteri asam laktat yang dominan adalah Leuconostoc mesenteroides, Pediococcus cereviceae dan Lactobacilus plantarum. Proses fermentasi “burongisda” berlangsung selama satu minggu dengan menghasilkan 0,9 % asam laktat dan pH sekitar 4,0 (Rahayu et al. 1992).
“Pla-ra” merupakan produk sejenis bekasam yang berasal dari Thailand dengan waktu fermentasi selama 6 bulan. Dalam proses pembuatan ”pla-ra” biasanya digunakan udang sebagai tambahan bahan baku yang berfungsi sebagai pembentuk aroma. Produk “pla-ra” mengandung protein sebesar 11,61-23,32 %, pH sekitar 4,10-6,90 dan asam laktat sebesar 0,17-1,94 %. Mikroba yang ditemukan pada produk ini adalah Pediococcus halophilus, Staphylococcus epidermidis, Micrococcus sp. dan Bacillus sp. (Rahayu et al. 1992).
2.4 Morfologi dan Fisiologi Bakteri Asam Laktat
Bakteri yang memproduksi asam laktat termasuk ke dalam golongan bakteri Gram positif, sebagian besar bersifat katalase negatif, tidak membentuk spora, berbentuk batang dan coccus. Golongan bakteri asam laktat ini dapat tumbuh dengan atau tanpa oksigen (Casida 1968). Kelompok bakteri asam laktat terdiri dari famili Micrococcaceae yaitu spesies dari genus Micrococcus dan Staphylococcus, famili Lactobacillaceae yaitu spesies dari genus Lactobacillus dan bakteri yang termasuk dalam famili Streptococcaceae, yaitu spesies dari genus Leuconostoc, Streptococcus, Pediococcus dan Aerococcus (Fardiaz 1992).
2.4.1 Micrococcaceae
Bakteri yang termasuk ke dalam famili Micrococcaceae terdiri dari genus Micrococcus dan Staphylococcus. Micrococcus merupakan bakteri berbentuk bulat yang hidup secara menggerombol tidak teratur atau membentuk tetrad. Bakteri ini bersifat Gram positif, aerobik dan katalase positif. Kebanyakan spesies Micrococcus membentuk pigmen berwarna kuning (misalnya M. flavus), oranye, merah atau merah muda (misalnya M. roseus). Bakteri ini mempunyai suhu optimum pertumbuhan 25-30 oC dan masih dapat tumbuh pada suhu 10 oC, tetapi tidak dapat tumbuh pada suhu 46 oC. Micrococcus dapat mengoksidasi glukosa menjadi asam, kebanyakan bersifat proteolitik, tetapi hanya beberapa yang bersifat lipolitik (Fardiaz 1992).
Staphylococcus merupakan bakteri berbentuk bulat yang terdapat dalam bentuk tunggal, berpasangan, tetrad atau berkelompok seperti buah anggur. Nama bakteri ini berasal dari bahasa Latin ”staphele” yang berarti anggur. Beberapa
spesies memproduksi pigmen berwarna kuning sampai oranye, misalnya S. aureus. Bakteri ini membutuhkan nitrogen organik (asam amino) untuk
pertumbuhannya (Fardiaz 1992).
Bakteri Staphylococcus bersifat fakultatif anaerobik, tetapi pertumbuhan pada keadaan anaerobik sangat lambat. Sel bakteri ini bersifat Gram positif, berbentuk bulat dan kecil dengan diameter 0,5-1,5 mikron, tidak membentuk spora dan tidak bergerak (Fardiaz 1983). Suhu optimum pertumbuhannya adalah 35-40 oC dan dapat tumbuh optimum pada pH sekitar 7,0-7,5. Walaupun tidak dikelompokkan ke dalam golongan bakteri halofilik, tetapi beberapa spesies
Staphylococcus mampu tumbuh pada konsentrasi garam sebesar 15 % (Buchanan dan Gibbons 1975). Beberapa galur Staphylococcus, terutama yang bersifat patogenik dapat memproduksi koagulase, bersifat proteolitik, lipolitik dan betahemolitik. Spesies lainnya, yaitu S. epidermidis merupakan bakteri yang tidak bersifat patogen dan merupakan flora normal yang terdapat pada kulit tangan dan hidung (Fardiaz 1992).
2.4.2 Lactobacillaceae
Bakteri asam laktat yang berbentuk batang, Gram positif dan tidak membentuk spora dapat digolongkan ke dalam famili Lactobacillaceae, yaitu spesies dari genus Lactobacillus. Ciri utama dari Lactobacillus adalah mempunyai bentuk sel batang yang panjang, anaerobik fakultatif dan katalase negatif. Suhu optimum pertumbuhan bakteri ini adalah sekitar 30 oC dan mulai terjadi pertumbuhan pada suhu 15 oC. Bakteri ini dapat dikelompokkan menjadi dua kelompok, yaitu homofermentatif dan heterofermentatif. Lactobacillus homofermentatif dapat memecah glukosa terutama menjadi asam laktat. Bakteri ini dapat tumbuh pada suhu 37 oC atau lebih tinggi. Spesies dari genus Lactobacillus yang tergolong homofermentatif adalah L. lactis, L. acidophilus dan L. bulgaricus. Bakteri heterofermentatif dapat memecah glukosa menjadi asam laktat, asam asetat, asam propionat dan etanol. Spesies dari genus Lactobacillus yang tergolong heterofermentatif adalah L. brevis dan L. fermentum. L. brevis dapat tahan terhadap asam pada konsentrasi 2,4 % dan suhu optimum pertumbuhan bakteri ini adalah sekitar 30 oC (Buchanan dan Gibbons 1975).
Lactobacillus sering dijumpai pada permukaan tanaman (sayuran) dan produk-produk susu. Lactobacillus mempunyai beberapa sifat yang menjadikan bakteri ini penting dalam mikrobiologi pangan (Fardiaz 1992), yaitu:
(1) Dapat memfermentasi gula dengan menghasilkan sejumlah asam laktat sehingga dapat digunakan dalam produksi makanan-makanan fermentasi, tetapi sebaliknya produksi asam laktat ini juga dapat menyebabkan kerusakan pada minuman anggur dan bir.
(2) Lactobacillus heterofermentatif memproduksi gas dan senyawa volatil lainnya yang penting sebagai pembentuk cita rasa dalam makanan fermentasi.
(3) Ketidakmampuan untuk mensintesa vitamin-vitamin yang dibutuhkan, menyebabkan bakteri ini tidak dapat tumbuh pada makanan yang kandungan vitaminnya rendah.
(4) Sifat ketahanan panas atau termodurik dari kebanyakan spesies Lactobacillus yang tumbuh pada suhu tinggi menyebabkan bakteri ini tahan terhadap proses pasteurisasi.
2.4.3 Streptococcaceae
Bakteri yang termasuk dalam famili Streptococcaceae, yaitu spesies dari genus Streptococcus, Leuconostoc, Pediococcus dan Aerococcus. Streptococcus merupakan bakteri berbentuk bulat yang hidup secara berpasangan atau membentuk rantai pendek dan panjang tergantung dari spesies dan kondisi pertumbuhannya. Bakteri ini bersifat homofermentatif dan beberapa spesies dapat memproduksi asam laktat secara cepat pada kondisi anaerobik. Oleh karena itu, bakteri ini sering digunakan dalam pengawetan makanan, terutama untuk menghambat pertumbuhan bakteri patogen dan pembentuk racun. Kebanyakan spesies bakteri ini bersifat proteolitik dan lipolitik (Fardiaz 1992). Ciri-ciri lain dari bakteri Streptococcus adalah bersifat Gram positif, non motil, pada umumnya bersifat fakultatif anaerob, katalase negatif dan mampu memfermentasi glukosa (Lay dan Hastowo 1992).
Leuconostoc merupakan jenis bakteri yang bersifat heterofermentatif, yaitu mampu memfermentasi gula menjadi asam laktat, asam asetat, asam propionat, etanol dan CO2. Sel bakteri ini berbentuk bulat dengan diameter 0,9-1,2 mikron dan tumbuh dengan baik pada suhu 21-25 oC (Buchanan dan Gibbons 1975). L. mesenteroides merupakan salah satu spesies dari genus Leuconostoc yang banyak ditemukan dalam fermentasi asam laktat. Untuk pertumbuhannya, L. mesenteroides memerlukan asam amino tertentu, vitamin, mineral dan gula. Sifat lain dari L. mesenteroides adalah tahan garam, sehingga sering berperan dalam fermentasi awal produk yang mengandung garam dan tahan terhadap konsentrasi gula tinggi yaitu sekitar 55-60 % (Fardiaz 1992).
Bakteri dari genus Pediococcus banyak terdapat pada produk fermentasi sayuran, susu dan bir yang rusak. Genus Aerococcus dan Pediococcus pada umumnya berbentuk tetrad, tetapi beberapa spesies Pediococcus membentuk
rantai pendek. Bakteri ini bersifat homofermentatif, yaitu dapat memecah gula menjadi asam laktat sampai mencapai konsentrasi 0,5-0,9 % dan tumbuh baik pada konsentrasi garam 5,5 %. Sifat lain dari bakteri ini adalah katalase negatif, bersifat mikroaerofilik, mampu tumbuh pada kisaran suhu 7-45 oC dengan suhu optimum 25-32 oC. P. cerevisiae sering tumbuh pada pikel dan menyebabkan
kerusakan pada bir dengan memproduksi diasetil dalam jumlah tinggi. P. halophilus merupakan bakteri yang bersifat halofilik dan dapat tumbuh baik
pada medium dengan konsentrasi NaCl sebanyak 7 % (Fardiaz 1992).
Aerococcus merupakan bakteri berbentuk bulat yang hidup secara berpasangan atau membentuk tetrad. Bakteri ini banyak terdapat pada produk fermentasi udang dan daging. Ciri utama dari bakteri Aerococcus adalah bersifat non motil, tidak mempunyai spora, bersifat fakultatif anaerobik, katalase bersifat negatif, oksidase negatif dan mampu memfermentasi glukosa tanpa membentuk gas. Sifat yang penting pada bahan makanan dari bakteri ini adalah tidak memproduksi lendir yang berlebihan pada makanan yang mengandung sukrosa (Cowan dan Steel 1974). Suhu optimum untuk pertumbuhan bakteri ini adalah 25 oC (Fardiaz 1992).
2.5 Peranan Bakteri Asam Laktat
Fermentasi merupakan proses metabolik dimana terjadi oksidasi karbohidrat dan komponen lainnya dengan terlepasnya energi (Jay 2000). Senyawa karbohidrat yang biasa dipecah menjadi asam laktat ialah glukosa, sukrosa dan laktosa. Bakteri asam laktat tidak hanya menurunkan pH media, tetapi juga menghasilkan antibiotik yang sering disebut sebagai bakteriocin, sehingga dapat menghambat pertumbuhan bakteri pembusuk (Fardiaz 1988).
Berdasarkan produk akhir dari metabolisme glukosa, bakteri asam laktat dapat dibagi menjadi dua kelompok, yaitu homofermentatif dan heterofermentatif. Bakteri asam laktat yang tergolong homofermentatif dapat mengubah 95 % dari glukosa atau heksosa lainnya menjadi asam laktat. Karbondioksida (CO2) dan asam-asam volatil lainnya juga dihasilkan, tetapi dalam jumlah yang sangat kecil. Beberapa contoh bakteri asam laktat yang bersifat homofermentatif adalah Streptococcus, Pediococcus, Aerococcus dan beberapa spesies Lactobacillus. Lactobacillus dapat dibedakan lagi menjadi dua kelompok, yaitu: bakteri yang
mempunyai suhu optimum relatif tinggi (37 oC atau lebih), seperti L. bulgaricus, L. helveticus, L. lactis, L. acidophilus, L. termophilus, L. delbrueckii dan yang mempunyai suhu optimum lebih rendah, seperti L. casei, L. plantarum dan L. leichmannii (Rahayu et al. 1992).
Bakteri asam laktat heterofermentatif mengubah glukosa dan heksosa lainnya menjadi asam laktat, etanol, asam asetat, asam format dan CO2 dalam jumlah yang hampir sama. Beberapa contoh bakteri asam laktat heterofermentatif adalah Leuconostoc dan beberapa spesies Lactobacillus, misalnya L. fermentum
yang mempunyai suhu optimum relatif tinggi, L. brevis, L. buchneri, L. pastorianus, L. hirgadii dan L. trichodes yang mempunyai suhu optimum
relatif rendah (Frazier dan Westhoff 1988) diacu dalam (Rahayu et al. 1992). Bakteri homofermentatif dapat memecah glukosa menjadi asam laktat melalui jalur Embden-Meyerhorf-Parnas (EMP) atau glikolisis. Enzim yang berperan dalam tahap glikolisis adalah enzim aldolase dan heksosa isomerase. Bakteri heterofermentatif mampu memecah glukosa menjadi asam laktat, asam asetat, asam propionat dan etanol melalui jalur oksidatif pentosa fosfat dengan bantuan enzim fosfoketolase. Bakteri heterofermentatif tidak mempunyai enzim fruktosadifosfat aldolase, transaldolase dan transketolase yang berperan dalam tahap glikolisis. Bakteri homofermentatif dapat menghasilkan energi sebesar dua kali energi yang dihasilkan oleh bakteri heterofermentatif dari sejumlah substrat yang sama (Fardiaz 1988).
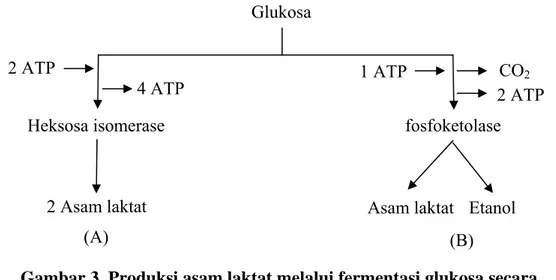
Bakteri asam laktat akan mengubah karbohidrat menjadi asam laktat dalam kondisi anaerob dan proses ini dapat dibagi menjadi tiga tahapan. Pada tahap awal, zat pati dari sumber karbohidrat akan dihidrolisa menjadi maltosa oleh α dan β amylase yang merupakan enzim ekstraseluler pada mikroorganisme, kemudian molekul maltosa ini akan dipecah menjadi glukosa oleh maltase dan pada tahap terakhir bakteri asam laktat akan mengubah glukosa menjadi asam laktat dan sejumlah kecil bahan lain seperti asam asetat, asam propionat dan etanol (Fardiaz 1988). Proses pemecahan glukosa menjadi asam laktat oleh bakteri homofermentatif dan heterofermentatif dapat dilihat pada Gambar 3.
Glukosa
2 ATP 1 ATP
4 ATP CO2
Heksosa isomerase fosfoketolase
Etanol 2 Asam laktat (A) 2 ATP Asam laktat (B)
Gambar 3. Produksi asam laktat melalui fermentasi glukosa secara homofermentatif (A) dan heterofermentatif (B) (Rahayu 1992).
Pada tahap awal fermentasi asam laktat produk perikanan, pertumbuhan mikroba akan didominasi oleh Leuconostoc mesenteroides. Bakteri ini bersifat heterofermentatif dan tahan konsentrasi garam tinggi, sehingga sering berperan dalam fermentasi awal produk yang mengandung garam (Fardiaz 1992). Setelah dua hari, populasi L. mesenteroides akan turun dengan cepat dan akan muncul Streptococcus faecalis. Kemudian setelah lima hari, pertumbuhan S. faecalis akan terhambat oleh asam yang tinggi dan pada tahap akhir fermentasi jumlah populasi pada produk yang difermentasi akan didominasi oleh Lactobacillus plantarum. Beberapa galur L. plantarum akan memfermentasi pentosa dan menghasilkan pigmen berwarna kuning tua (Casida 1968).
Bakteri asam laktat tahan terhadap semua asam, akan tetapi ketahanannya berbeda antara satu bakteri dengan bakteri lainnya. L. plantarum dapat tahan terhadap nilai total asam laktat 1,5-2,0 % (Buchanan dan Gibbons 1975). Secara umum genus Lactobacillus akan dominan pada akhir fermentasi, sedangkan Leuconostoc sp., Streptococcus sp. dan Pediococcus sp. akan lebih dominan pada tahap awal fermentasi (Fardiaz 1988).
2.6 Faktor yang Mempengaruhi Pertumbuhan Bakteri Asam Laktat
Keberhasilan proses pembuatan bekasam tergantung dari peranan bakteri asam laktat yang terdapat dalam produk. Oleh karena itu, perlu dibuat kondisi yang ideal bagi pertumbuhan bakteri tersebut. Faktor-faktor lingkungan yang
mempengaruhi pertumbuhan bakteri asam laktat antara lain adalah suhu, nilai pH, kadar garam dan karbohidrat.
2.6.1 Suhu
Suhu merupakan salah satu faktor lingkungan yang berpengaruh langsung pada kecepatan pertumbuhan mikroba. Pengaruh suhu terhadap pertumbuhan mikroba disebabkan karena suhu mempengaruhi aktivitas enzim yang mengkatalis reaksi-reaksi biokimia di dalam sel mikroba. Oleh karena itu, mikroba mempunyai suhu maksimum,minimum dan optimum untuk pertumbuhannya. Suhu optimum adalah suhu dimana aktivitas metabolisme mikroba akan berjalan dengan sebaik-baiknya, suhu minimum adalah suhu terendah dimana mikroba masih dapat hidup, sedangkan suhu maksimum adalah suhu maksimum bagi mikroba untuk tumbuh dan berkembang biak (Fardiaz 1992).
Berdasarkan suhu (minimum, optimum dan maksimum) untuk pertumbuhannya, mikroba dibedakan atas tiga grup (Fardiaz 1992), yaitu:
(1). Psikrofilik, yaitu mikroba yang dapat tumbuh pada suhu 0 oC, dengan suhu optimum 5-15 oC dan suhu maksimum 20 oC.
(2). Mesofilik, yaitu mikroba yang tumbuh baik pada suhu sekitar 20-40 oC. (3). Termofilik, yaitu mikroba yang dapat tumbuh pada suhu yang relatif tinggi,
dengan suhu minimum 25 oC, suhu optimum 45-55 oC dan suhu maksimum 60-65 oC.
Bakteri biasanya tumbuh pada suhu kamar, tetapi beberapa bakteri yang tergolong termofilik akan tumbuh dengan baik pada suhu tinggi, yaitu 45-55 oC atau kadang-kadang sampai 60 oC, sedangkan bakteri lainnya yang tergolong psikrofilik dapat tumbuh pada suhu pembekuan (Fardiaz 1992). Selain berpengaruh terhadap pertumbuhan sel, suhu juga berpengaruh pada pembentukan produk oleh mikroba. Hal ini berhubungan dengan jenis mikroba yang dominan selama fermentasi (Fardiaz 1988). Secara umum, pertumbuhan jasad renik terjadi pada suhu (antara suhu minimum dan maksimum) yaitu sekitar 30 oC. Kecepatan pertumbuhan jasad renik meningkat secara lambat dengan naiknya suhu sampai mencapai kecepatan pertumbuhan maksimum, sedangkan di atas suhu maksimum, kecepatan pertumbuhan menurun dengan cepat dengan naiknya suhu (Fardiaz 1992).
2.6.2 Nilai pH
Nilai pH medium merupakan salah satu parameter penting yang dapat mempengaruhi pertumbuhan mikroba. Bakteri pada umumnya tumbuh dengan baik pada pH sekitar 6,5-7,5. Namun, beberapa spesies dapat tumbuh dalam keadaan sangat asam atau alkali, misalnya Thiobacillus thiooxidans yang mampu tumbuh pada pH optimum 2,0-3,5, sedangkan Staphylococcus aureus mampu tumbuh pada pH maksimum 9,3 (Pelczar dan Chan 1986). Pada pH dibawah 5 dan diatas 8,5 bakteri tidak dapat tumbuh dengan baik, kecuali bakteri asam asetat (Acinetobacter suboksidans) dan bakteri sulfur (Fardiaz 1992). Fermentasi karbohidrat akan menghasilkan alkohol dan senyawa-senyawa asam yang dapat mencegah pertumbuhan mikroorganisme beracun seperti Clostridium botulinum. Pada pH kurang dari 4,6, Clostridium botulinum tidak dapat tumbuh dan membentuk racun. (Winarno et al. 1980)
Nilai pH selain berpengaruh pada pertumbuhan sel mikroba, juga mempengaruhi pembentukan produk selama fermentasi. Produk makanan yang mempunyai nilai pH rendah (di bawah 4,5) biasanya tidak dapat ditumbuhi oleh bakteri, tetapi dapat menjadi rusak karena pertumbuhan khamir dan kapang. Khamir dapat tumbuh pada kisaran nilai pH 2,5-8,5 dan tumbuh optimum pada pH 4-5, sedangkan kapang dapat tumbuh optimum pada nilai pH 5-7. Oleh karena itu, makanan yang mempunyai pH rendah relatif lebih tahan selama penyimpanan dibandingkan dengan makanan yang mempunyai nilai pH netral atau mendekati netral (Fardiaz 1992).
Bakteri yang berperan dalam fermentasi silase adalah bakteri asam laktat. Asam laktat yang dihasilkan akan menurunkan nilai pH pada lingkungan pertumbuhannya dan hal ini dapat menghambat pertumbuhan mikroba penyebab kebusukan makanan. Beberapa mikroorganisme dalam bahan pangan tertentu seperti khamir dan bakteri asam laktat tumbuh dengan baik pada kisaran nilai pH 3,0-6,0 dan sering disebut sebagai asidofil (Buckle et al. 1978).
2.6.3 Garam
Garam sering digunakan dalam proses fermentasi ikan. Garam dapat berfungsi sebagai pengikat air dan pemberi rasa yang sedap, selain itu juga garam dapat menghambat pertumbuhan mikroorganisme yang tidak dikehendaki. Pada
umumnya bakteri pembusuk relatif lebih sensitif terhadap garam. Garam dapat berfungsi sebagai bahan pengawet karena dapat menaikkan tekanan osmosis yang menyebabkan terjadinya plasmolisis pada sel mikroba (Buckle et al. 1978).
Penambahan garam merupakan tahapan penting pada proses pembuatan bekasam. Jumlah garam yang ditambahkan tergantung pada banyaknya faktor antara lain, kesegaran ikan, ukuran ikan, masa simpan serta karakteristik produk yang ingin dihasilkan. Pada umumnya jumlah garam yang ditambahkan dalam pembuatan bekasam berkisar antara 15-20 % dari berat ikan segar (Murtini 1992). Proses fermentasi akan terkontrol dengan baik bila perbandingan antara ikan dan jumlah garam yang ditambahkan tepat. Bila kadar garam yang ditambahkan tidak mencukupi, maka bakteri pembusuk dapat tumbuh dan menyebabkan bau yang menyimpang. Sebaliknya bila kadar garam terlalu tinggi, maka akan dihasilkan produk yang mempunyai rasa asin dengan konsistensi yang berbeda dari yang diharapkan (Rahayu et al. 1992).
Kebutuhan garam untuk pertumbuhan optimum mikroorganisme bervariasi, tergantung dari sifat dinding sel dan tekanan osmotik internalnya. Mikroorganisme yang tergolong halofilik ringan dapat tumbuh dengan baik pada konsentrasi garam 2-5 %, halofilik sedang tumbuh dengan baik pada konsentrasi 5-20 %, sedangkan halofilik ekstrem dapat tumbuh dengan baik pada konsentrasi garam 20-30 %. Jenis mikroorganisme yang bersifat halotoleran mampu tumbuh dengan atau tanpa garam. Bakteri yang tergolong halofilik dan halotoleran ini sering ditemukan pada makanan yang mengandung garam (Fardiaz 1992).
Pada kondisi aerob, mikroba-mikroba yang dapat hidup dalam konsentrasi garam tinggi adalah Micrococcus, ragi dan kapang, sedangkan pada kondisi anaerob yang dominan adalah bakteri asam laktat (Fardiaz 1988). Bakteri Staphylococcus aureus masih dapat tumbuh pada beberapa produk dengan kadar garam agak tinggi yaitu sekitar 7-10 %. Bakteri ini akan dihambat pertumbuhannya pada konsentrasi garam 15-20 % dan pH di bawah 4,5-5,0. Bakteri pembentuk toksin berbahaya yaitu Clostridium botulinum tipe E yang sering ditemukan pada ikan segar dapat dihambat pertumbuhannya pada konsentrasi garam 10-12 % dan pH di bawah 4,5. Salmonella akan terhambat pertumbuhannya pada konsentrasi garam 6 % (Rahayu et al. 1992).
2.6.4 Karbohidrat
Ikan hanya mengandung sejumlah kecil karbohidrat yang dapat difermentasi. Penambahan karbohidrat yang cocok akan dapat memperbaiki mutu produk fermentasi (Rahayu et al. 1992). Karbohidrat banyak terdapat dalam bahan nabati, baik berupa gula sederhana, heksosa, pentosa, maupun karbohidrat dengan berat molekul yang tinggi seperti pati, pektin, selulosa dan lignin. Salah satu sumber karbohidrat utama adalah beras, yang mengandung pati sebanyak 78,3 %. Pati adalah suatu polisakarida yang terdiri dari monomer-monomer monosakarida yang saling berikatan dan akan membentuk ikatan polimer, baik berupa rantai lurus atau bercabang serta dapat dihidrolisis dengan jenis enzim yang spesifik kerjanya (Winarno et al. 1980).
Karbohidrat dapat berfungsi sebagai sumber energi bagi bakteri asam laktat. Penambahan karbohidrat akan membuat lingkungan yang baik bagi pertumbuhan bakteri tersebut. Selama fermentasi, karbohidrat akan diuraikan menjadi senyawa-senyawa yang sederhana seperti, asam laktat, asam asetat, asam propionat dan etil alkohol. Senyawa-senyawa ini yang menyebabkan rasa asam pada produk dan dapat berfungsi sebagai pengawet (Rahayu et al. 1992).
2.7 Isolasi dan Karakterisasi Mikroba pada Produk Fermentasi
Secara alamiah, mikroba terdapat dalam bentuk campuran dari berbagai jenis. Untuk mempelajari sifat-sifat pertumbuhan, morfologi dan sifat fisiologis mikroba, maka masing-masing mikroba tersebut harus dipisahkan satu dengan yang lainnya, sehingga terbentuk kultur murni yaitu suatu biakan yang terdiri dari sel-sel satu spesies atau satu galur mikroba (Fardiaz 1987). Untuk mendapatkan isolat bakteri dari suatu bahan yang mengandung campuran mikroba dapat dilakukan isolasi dengan beberapa metode, tergantung dari jenis mikroorganismenya (Fardiaz 1988).
Isolasi mikroba merupakan upaya pemisahan mikroba jenis tertentu dari populasi campuran mikroba yang lain. Untuk memperoleh biakan murni mikroba dapat dilakukan pengenceran dengan menggunakan bahan cair atau bahan padat. Pada mulanya digunakan gelatin sebagai bahan pemadat. Gelatin terdiri dari protein sehingga dapat dicerna ataupun dicairkan oleh bakteri. Bahan pemadat yang kemudian ditemukan adalah agar yang merupakan polisakarida dari rumput
laut. Agar akan mencair pada suhu 100 oC, sedangkan pada suhu 44 oC masih dalam bentuk cair. Suhu ini masih memungkinkan bakteri dapat tumbuh, sehingga prinsip ini dipakai untuk mengisolasi bakteri dengan cara agar tuang (Lay 1994).
Mikroorganisme dibiakkan pada bahan nutrien yang disebut medium. Jenis medium sebagai sumber nutrisi bagi mikroba banyak macamnya, namun penggunaannya berbeda, tergantung dari jenis mikroorganisme yang akan ditumbuhkan (Pelczar dan Chan 1986). Secara umum terdapat 3 metode untuk mengisolasi mikroba menjadi biakan murni, yaitu: teknik penggoresan agar, agar tuang dan agar sebar (Lay 1994).
Isolasi menggunakan teknik penggoresan agar dilakukan dengan menggoreskan inokulum di permukaan medium nutrien agar secara steril. Teknik ini lebih menguntungkan bila ditinjau dari segi ekonomi dan waktu, tetapi memerlukan keterampilan. Penggoresan yang sempurna akan menghasilkan koloni yang terpisah (Lay 1994).
Isolasi teknik agar tuang merupakan cara isolasi yang menggunakan media cair sebagai medium pengenceran mikroba. Dasar melakukan pengenceran adalah penurunan jumlah mikroorganisme, sehingga pada pengenceran terakhir akan didapatkan jumlah sel yang semakin sedikit di dalam media. Pada cara agar tuang, dilakukan pengenceran dari satu mata loop suspensi bakteri ke dalam tiga cawan agar tuang, sehingga akan diperoleh lempengan dengan jumlah bakteri yang optimum untuk isolasi. Teknik ini lebih mudah dibandingkan dengan teknik penggoresan, karena tidak diperlukan keterampilan untuk mendapatkan koloni yang terpisah (Lay 1994).
Isolasi dengan menggunakan teknik agar sebar dilakukan dengan cara menyebarkan suspensi bakteri yang telah diencerkan sebelumnya pada permukaan nutrien agar dengan menggunakan alat penyebar yang terbuat dari gelas. Keuntungan dari teknik ini adalah pertumbuhan koloni akan menyebar, sehingga memudahkan dalam pengambilan koloni bakteri untuk tahap uji selanjutnya (Lay 1994).
Setelah diperoleh biakan murni, tahap selanjutnya yaitu mengidentifikasi jenis mikroba tersebut berdasarkan sifat-sifat yang dimilikinya. Ciri-ciri utama
suatu mikroorganisme yang perlu diketahui dalam mengkarakterisasi mikroba, meliputi: ciri morfologi, susunan kimiawi dari sel, sifat biakan, metabolisme, sifat antigenik, sifat genetik dan patogenisitas (Lay dan Hastowo 1992).
Untuk menentukan ciri-ciri mikroorganisme tersebut, maka diperlukan serangkaian uji, yang meliputi uji morfologi dan uji biokimia. Setiap uji yang dilakukan harus menggunakan kontrol untuk mengetahui bahwa media serta reagen yang digunakan memenuhi syarat. Selain itu kontrol digunakan untuk melihat bahwa teknik yang digunakan benar dan tepat (Lay 1994).
Uji yang digunakan dalam identifikasi bakteri tidaklah sama untuk semua kelompok. Sifat memfermentasikan laktosa merupakan ciri utama dalam identifikasi Enterobacteriaceae. Namun, ciri ini tidak dapat digunakan untuk identifikasi Staphylococcus atau Streptococcus. Untuk kedua kelompok bakteri ini digunakan uji katalase. Untuk identifikasi Bacillus digunakan uji motilitas, gelatin, nitrit, sitrat, urease, glukosa, arabinosa dan manitol (Lay 1994).
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Pangan, Departemen Teknologi Pangan dan Gizi, Fakultas Teknologi Pertanian, Institut Pertanian Bogor, Laboratorium Bakteriologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor dan Laboratorium Mikrobiologi, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Penelitian dilaksanakan dari bulan April sampai Juni 2006.
3.2 Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah pipet, erlenmeyer, tabung reaksi, tabung Durham, timbangan analitik, mortar, pengaduk, labu ukur, beaker glass, buret, pH-meter, gelas ukur, cawan petri, inkubator, oven, gelas objek, sudip, jarum ose, mikroskop cahaya, foto digital mikroskopik, water bath, pembakar bunsen, lemari es, autoklaf dan vortex.
Bekasam yang digunakan dalam penelitian ini adalah bekasam ikan bandeng (Chanos chanos) yang diperoleh dari pengolah tradisional di daerah Indramayu dan telah difermentasi selama 2 minggu. Bahan lain yang digunakan adalah NaCl, akuades, potasium khromat, perak nitrat, fenoftalein, NaOH 0,1 N, zat warna kristal violet, safranin, lugol, alkohol 96 %, alkohol 70 %, malachite green, minyak immersi, spiritus, H2O2 3 %, p-aminodimetilanilin oksalat 1 %, bromthymol blue, egg yolk steril, plasma kelinci, pereaksi Kovacs, asam sulfanilat, dimetil alpa-naphtylamin, serbuk seng, lemak 1 %, neutral red, kertas label, kapas, aluminium foil, kertas serap (tissue) dan parafin.
Media yang digunakan adalah nutrient agar, MRSA (deman ragosa sharpe agar), nutrient broth, TSA (trypticase soy agar), tryptone
broth, sulfit agar, nitrate broth, TSIA (triple sugar iron agar), SMA (skim milk agar), starch agar, Baird Parker agar (BPA), brain heart infusion
3.3 Metode Penelitian
Penelitian ini terbagi menjadi 3 tahapan, yaitu: (1) Analisis bahan, (2) Isolasi bakteri dari produk bekasam dan (3) karakterisasi isolat bakteri berdasarkan sifat morfologi dan fisiologis.
3.3.1 Analisis bahan
Analisis terhadap sampel bekasam ikan bandeng dilakukan sebagai informasi awal untuk mengetahui karakteristik bahan sebelum dilakukan tahap isolasi bakteri dari produk tersebut. Analisis yang dilakukan terdiri dari: pengukuran kadar garam (NaCl), nilai pH (derajat keasaman) dan total asam laktat.
3.3.2 Isolasi bakteri
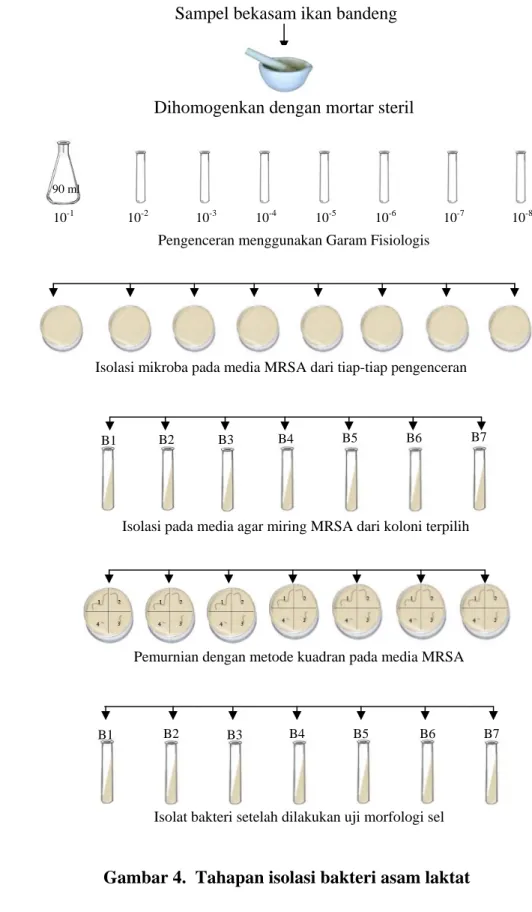
Isolasi bakteri dari produk bekasam bertujuan untuk mendapatkan isolat bakteri dari suatu bahan yang mengandung campuran mikroba. Tahap awal isolasi, bakteri dari sampel bekasam dikulturkan ke dalam media MRSA. Tahapan kultur bakteri tersebut adalah sebagai berikut: sebanyak 10 gram sampel bekasam dihancurkan dalam mortar steril untuk mendapatkan kondisi sampel yang homogen. Setelah sampel homogen, kemudian dimasukkan ke dalam erlenmeyer steril yang berisi 90 ml larutan pengencer garam fisiologis 0,85 % (pengenceran 10-1). Untuk pengenceran 10-2 diambil 1 ml suspensi contoh dan dimasukkan ke dalam tabung reaksi yang berisi 9 ml larutan pengencer garam fisiologis dan dikocok sampai homogen. Pengenceran selanjutnya dilakukan dengan cara yang sama, sampai diperoleh tingkat pengenceran 10-8.
Dari masing-masing pengenceran, dipipet 1 ml suspensi contoh dan dimasukkan ke dalam cawan petri steril, kemudian dituangkan medium agar cair MRSA. Cawan petri berisi biakan mikroba tersebut diinkubasi pada suhu 30 oC selama 1-2 hari. Kemudian dipilih koloni yang tumbuh dominan dan mempunyai morfologi berbeda satu sama lainnya. Pengamatan terhadap morfologi koloni meliputi bentuk koloni, bentuk permukaan, bentuk kemunculannya di atas permukaan agar dan warna koloni.
Koloni terpilih dari hasil kultur bakteri diisolasi dengan metode goresan kuadran pada cawan petri yang berisi media MRSA. Selanjutnya diinkubasi pada
suhu 30 oC selama 1-2 hari dan diharapkan dari metode goresan kuadran tersebut akan diperoleh koloni yang terpisah. Isolasi dilakukan beberapa kali sampai dihasilkan bakteri murni. Setiap melakukan goresan kuadran, koloni terpilih ditumbuhkan pada agar miring dan dilakukan pengujian terhadap morfologi sel yang meliputi bentuk sel, pewarnaan Gram dan spora bakteri. Jika dari hasil pengujian tersebut diperoleh hasil yang sama dengan pengujian morfologi sel pada tahap sebelumnya, maka dapat dinyatakan bahwa bakteri tersebut telah murni. Tahap-tahap isolasi bakteri, dapat dilihat pada Gambar 4.
3.3.3 Karakterisasi bakteri
Karakterisasi terhadap isolat bakteri bertujuan untuk mengetahui sifat morfologi dan fisiologisnya. Sifat morfologi yang diamati meliputi morfologi koloni dan morfologi sel yang terdiri dari: pewarnaan Gram, spora dan motilitas bakteri. Sedangkan pengamatan sifat fisiologis bakteri dilakukan dengan berbagai uji, antara lain adalah: uji katalase, oksidase, oksidatif-fermentatif Baird Parker, kualitatif Staphylococcus, koagulase, indol, reduksi nitrat, H2S, fermentasi glukosa, pembentukan gas dan asam, penggunaan sitrat sebagai sumber energi, aktivitas proteolitik, hidrolisis lemak dan hidrolisis pati.
3.4 Prosedur Analisis
Analisis yang dilakukan terhadap sampel bekasam ikan bandeng, terdiri dari: pengukuran kadar garam (NaCl), nilai pH dan total asam laktat. Sedangkan, uji yang dilakukan untuk mengetahui sifat morfologi dan fisiologis bakteri antara lain adalah: pengamatan bentuk sel, pewarnaan Gram dan spora, uji motilitas, katalase, oksidase, oksidatif-fermentatif Baird Parker, kualitatif Staphylococcus, koagulase, indol, reduksi nitrat, pembentukan H2S dan fermentasi glukosa dalam medium TSIA (triple sugar iron agar), pembentukan asam, penggunaan sitrat sebagai sumber energi, aktivitas proteolitik, hidrolisis lemak dan hidrolisis pati.
Sampel bekasam ikan bandeng
Dihomogenkan dengan mortar steril
10-2 10-3 10-4 90 ml
Pengenceran menggunakan Garam Fisiologis
10 10 10 10
10-1 -5 -6 -7 -8
Isolasi mikroba pada media MRSA dari tiap-tiap pengenceran
Isolasi pada media agar miring MRSA dari koloni terpilih
B1 B2 B3 B4 B5 B6 B7
Pemurnian dengan metode kuadran pada media MRSA
Isolat bakteri setelah dilakukan uji morfologi sel
B1 B2 B3 B4 B5 B6 B7
Gambar 4. Tahapan isolasi bakteri asam laktat
3.4.1 Pengukuran kadar garam (NaCl) (Apriyantono et al. 1989)
Pengukuran kadar garam dilakukan dengan menggunakan metode Mohr. Caranya adalah sebagai berikut: sampel sebanyak 5 gram dimasukkan ke dalam cawan porselin untuk diabukan pada suhu 600 oC selama 12 jam. Abu yang diperoleh tersebut dilarutkan dengan aquades sampai volumenya mencapai 100 ml dan kemudian disaring. Hasil dari penyaringan tersebut dipipet sebanyak 10 ml ke dalam beaker glass 50 ml, kemudian ditambahkan 3 ml K2CrO4 (kalium kromat) 5 % untuk dititrasi dengan AgNO3 (perak nitrat) 0,2 N. Titik akhir titrasi tercapai setelah terbentuk endapan perak khromat (Ag2CrO4) yang berwarna orange atau jingga. Perhitungan % NaCl adalah sebagai berikut:
% 100 contoh mg 58,4 10 AgNO N AgNO Volume NaCl % = 3× 3× × ×
Volume AgNO3 adalah jumlah perak nitrat yang dibutuhkan dalam titrasi (ml), Normalitas AgNO3 adalah 0,2 N dan faktor pengenceran sebesar 10.
3.4.2 Pengukuran nilai pH (AOAC 1995)
Sampel dalam wadah diukur pH-nya dengan menggunakan pH meter. Terlebih dahulu pH meter dinyalakan, kemudian elektroda pH-meter dimasukkan dalam buffer pH 4,31 dan 6,86. Sampel ditimbang sebanyak 1 gram, kemudian dilarutkan dalam 10 ml akuades dan dimasukkan ke dalam gelas ukur. Setelah itu elektroda dicelupkan pada larutan sampel dan dibiarkan beberapa saat sampai diperoleh pembacaan yang stabil. Nilai yang diperoleh dari hasil pembacaan pada pH meter sampai angka digital menunjukkan nilai pH tetap.
3.4.3 Total asam laktat (AOAC 1995)
Sebanyak 10 gram sampel dihancurkan dengan menggunakan mortar. Sampel yang telah homogen dilarutkan dengan akuades dalam gelas piala sampai tanda tera 100 ml. Kemudian sampel didiamkan selama 30 menit dan diaduk. Larutan yang berisi sampel tersebut disaring dan di pipet sebanyak 10 ml untuk dimasukkan ke dalam beaker glass. Ke dalam larutan tersebut ditambahkan 2-3 tetes fenoftalein dan dititrasi dengan NaOH 0,1 N sampai warna berubah menjadi merah muda. Persentase asam laktat yang terbentuk dihitung berdasarkan rumus:
% 100 e d c b a TA = × × × × Keterangan:
TA = Total Asam Laktat (%)
a = Jumlah NaOH yang dibutuhkan dalam titrasi (ml) b = Normalitas NaOH (0,1 N)
c = Berat equivalen asam laktat (90) d = Faktor pengenceran (10)
e = Berat sampel (mg)
3.4.4 Bentuk sel bakteri
Dari hasil isolasi bakteri yang tumbuh diamati bentuk selnya secara mikroskopik.
3.4.5 Pewarnaan Gram (Fardiaz 1989)
Secara aseptis dibuat lapisan tipis dari suspensi bakteri di atas gelas objek dan dilakukan fiksasi pada udara terbuka. Pada lapisan tipis ini ditetesi zat warna kristal violet dan dibiarkan selama 1 menit, kemudian dibilas dengan air kran dengan cara memegang gelas objek pada posisi miring. Sisa air yang tertinggal pada gelas objek dibuang dan ditetesi dengan lugol serta dibiarkan selama 1 menit. Setelah dicuci kembali dengan air, kemudian dihilangkan warnanya dengan menggunakan alkohol 96 % dan dibiarkan selama 10-20 detik. Setelah dicuci sebentar dengan air, kemudian diwarnai dengan safranin dan dibiarkan selama 10-20 detik. Objek gelas selanjutnya dibilas dengan air dan dikeringkan dengan kertas serap (tissue). Preparat ini diamati dibawah mikroskop dengan mengunakan lensa objektif yang telah diolesi minyak immersi. Dengan pengamatan secara mikroskopik, dapat ditentukan bentuk sel bakteri serta reaksi Gramnya. Bakteri Gram positif akan ditunjukkan dengan warna ungu, sedangkan bakteri Gram negatif akan ditandai dengan warna merah atau merah muda.
3.4.6 Pewarnaan spora (Fardiaz 1989)
Secara aseptis dibuat lapisan tipis dari suspensi bakteri di atas gelas objek dan difiksasi. Pada lapisan tipis ini ditetesi pewarna hijau malasit dan dibiarkan selama 20 menit tanpa pemanasan. Selanjutnya, preparat dibilas dengan air kran
dengan cara memegang gelas objek pada posisi miring dan dikeringkan dengan kertas serap (tissue). Setelah kering, kemudian ditambahkan beberapa tetes zat warna safranin dan dibiarkan selama 30 detik dan dicuci dengan air mengalir serta dikeringkan. Preparat ini diamati di bawah mikroskop dengan menggunakan lensa objektif yang telah diolesi minyak immersi. Dengan cara ini endospora yang masih terdapat dalam sel vegetatif maupun spora bebas akan berwarna hijau-biru, sedangkan sel vegetatif akan berwarna merah sampai merah muda.
3.4.7 Uji motilitas (Fardiaz 1989)
Pengujian motilitas bakteri dilakukan dengan cara sebagai berikut: secara aseptis dengan menggunakan jarum ose yang lurus bagian ujungnya, isolat bakteri ditusukkan ke dalam nutrient broth yang mengandung agar 0,5 % (agar lunak). Inkubasi dilakukan pada suhu 35 oC selama 2 hari. Bila pertumbuhan menyebar, maka bakteri tersebut bersifat motil dan bila pertumbuhan bakteri tidak menyebar, hanya berupa garis saja, maka bakteri tersebut bersifat non motil.
3.4.8 Uji katalase (Fardiaz 1989)
Secara aseptis diambil 1 loop isolat bakteri dan dipindahkan pada gelas objek. Preparat tersebut ditetesi dengan larutan 3 % H2O2. Adanya enzim katalase ditandai dengan terbentuknya gelembung-gelembung seperti busa sabun.
3.4.9 Uji oksidase (Hadioetomo 1985)
Dalam uji oksidase, kultur bakteri yang akan diuji ditumbuhkan pada medium trypticase soy agar (TSA) dan diinkubasi pada suhu 37 oC selama 1-2 hari. Koloni yang tumbuh digenangi dengan pereaksi untuk uji oksidase yaitu p-aminodimetilanilin oksalat 1 %. Uji positif ditandai dengan berubahnya koloni menjadi merah muda, merah tua, lalu merah gelap dan akhirnya hitam.
3.4.10 Uji oksidatif-fermentatif Baird Parker (Cowan dan Steel 1974)
Dalam uji oksidatif-fermentatif digunakan medium Baird Parker agar (BPA) dan indikator pH bromthymol blue. Bakteri yang akan diuji, secara aseptis dengan menggunakan loop ditusukkan ke dalam medium tegak Baird Parker agar (BPA) yang sudah disiapkan terlebih dahulu. Setiap bakteri yang akan diuji ditusukkan ke dalam dua tabung, dimana tabung pertama ditutupi dengan parafin 3-5 ml, sedangkan tabung kedua tanpa parafin. Inkubasi dilakukan pada suhu
30 oC selama 48 jam. Bila terjadi perubahan warna (terbentuk warna kuning) pada kedua tabung, maka bakteri tersebut bersifat fermentatif dan bila hanya tabung tanpa parafin yang berubah warna (terbentuk warna kuning), maka bakteri bersifat oksidatif, sedangkan bila tidak terjadi perubahan warna pada kedua tabung tersebut berarti uji oksidatif-fermentatif bersifat negatif.
3.4.11 Uji kualitatif Staphylococcus (Fardiaz 1989)
Untuk uji kualitatif Staphylococcus, medium yang digunakan adalah Baird Parker agar (BPA) yang dicampur dengan egg yolk steril. Bakteri yang akan diuji diinokulasikan ke dalam cawan petri yang berisi medium tersebut dan diinkubasi pada suhu 37 oC selama 1-2 hari. Uji dinyatakan positif apabila terbentuk koloni bakteri yang berwarna hitam pada medium yang terkena goresan.
3.4.12 Uji koagulase (Fardiaz 1989)
Dalam uji koagulase digunakan medium brain heart infusion (BHI) dan plasma kelinci. Bakteri yang akan diuji diinokulasi ke dalam tabung reaksi yang berisi BHI sebanyak 5 ml. Inkubasi dilakukan pada suhu 37 oC selama 24 jam. Setelah inkubasi, ditambahkan 0,3 ml plasma kelinci ke dalam tabung reaksi tersebut dan diinkubasi lagi pada suhu 37 oC selama 1-2 jam. Uji koagulase positif ditandai dengan terbentuknya koagulasi seperti fibrin.
3.4.13 Uji indol (Hadioetomo 1985)
Dalam uji indol digunakan medium tryptone broth. Bakteri yang akan diuji diinokulasikan ke dalam tabung reaksi yang berisi tryptone broth dan diinkubasi pada suhu 37 oC selama 1-2 hari. Setelah diinkubasi, masing-masing tabung ditambahkan 0,5 ml pereaksi Kovacs. Terbentuknya warna merah menunjukkan uji indol positif.
3.4.14 Uji reduksi nitrat (Hadioetomo 1985)
Dalam uji reduksi nitrat, bakteri diinokulasi ke dalam nitrate broth. Setelah inkubasi pada suhu 37 oC selama 48 jam, masing-masing bakteri yang akan diuji
diberi tiga tetes larutan asam sulfanilat dan tiga tetes larutan dimetil alpa-naphtylamin. Bila pada bakteri yang diuji dapat mereduksi nitrat menjadi
nitrit, maka akan segera terbentuk warna merah dan hal ini menunjukkan uji reduksi nitrat positif. Apabila perubahan warna tidak jelas, dapat ditambahkan
sedikit serbuk seng ke dalam tabung yang berisi inokulum bakteri. Apabila terbentuk warna merah berarti uji reduksi nitrat negatif, sedangkan bila tidak terjadi perubahan warna berarti uji reduksi nitrat positif.
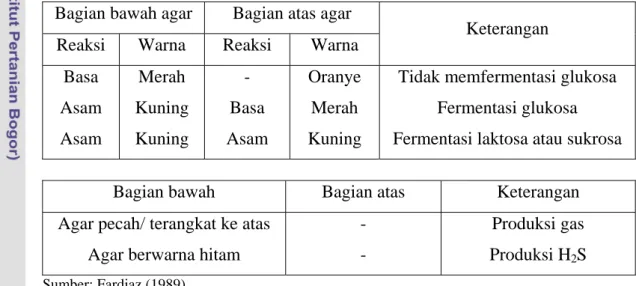
3.4.15 Uji H2S, fermentasi glukosa dan pembentukan gas (Fardiaz 1989) Dalam uji ini digunakan medium triple sugar iron agar (TSIA). Uji tersebut bertujuan untuk mengetahui kemampuan bakteri dalam memfermentasi glukosa, laktosa atau sukrosa, pembentukan gas dari glukosa dan produksi H2S. Prosedur uji ini adalah: Isolat yang akan diuji diinokulasi pada agar miring TSIA dengan cara membuat goresan pada media agar miring dan menusukannya pada bagian bawah agar. Inkubasi dilakukan pada suhu 37 oC selama 48 jam. Reaksi-reaksi yang terjadi pada medium TSIA dapat dilihat pada Tabel 1.
Tabel 1. Reaksi-reaksi pada medium TSIA Bagian bawah agar Bagian atas agar
Reaksi Warna Reaksi Warna Keterangan
Basa Asam Asam Merah Kuning Kuning - Basa Asam Oranye Merah Kuning
Tidak memfermentasi glukosa Fermentasi glukosa Fermentasi laktosa atau sukrosa
Bagian bawah Bagian atas Keterangan
Agar pecah/ terangkat ke atas Agar berwarna hitam
- -
Produksi gas Produksi H2S
Sumber: Fardiaz (1989)
3.4.16 Uji pembentukan asam (Fardiaz 1989)
Cara pengujian pembentukan asam adalah sebagai berikut: Isolat yang akan diuji digoreskan pada setengah bagian cawan yang berisi medium dextrose tripton bromkresol purple agar (DTBPA). Inkubasi dilakukan pada suhu 30 oC selama 24-48 jam. Uji ini dikatakan positif jika terbentuk areal berwarna kuning di sekitar koloni yang tumbuh.
3.4.17 Uji sitrat (Cowan dan Steel 1974)
Bakteri yang akan diuji diinokulasikan pada agar miring yang berisi medium Simmons citrate. Indikator pH yang digunakan untuk uji ini adalah
brothymol blue. Inkubasi dilakukan pada suhu 30 oC selama 48 jam. Uji sitrat positif akan ditandai dengan terjadinya perubahan warna pada medium dari warna hijau menjadi biru. Uji sitrat positif menandakan bahwa bakteri tersebut mampu mengunakan sitrat sebagai sumber karbon.
3.4.18 Uji aktifitas proteolitik (Fardiaz 1989)
Bakteri yang akan diuji digoreskan pada setengah bagian cawan yang berisi medium skim milk agar (SMA). Inkubasi dilakukan pada suhu 30 oC selama 48 jam. Koloni dari organisme yang bersifat proteolitik dan dapat mencerna kasein akan dikelilingi oleh areal yang bening, sedangkan bagian agar yang tidak diinokulasi akan terlihat agak keruh.
3.4.19 Uji hidrolisis lemak (Fardiaz 1989)
Bakteri yang akan diuji digoreskan pada setengah bagian cawan yang berisi medium nutrient agar (NA) ditambah dengan 1 % lemak (mentega) dan indikator neutral red sebagai substrat. Inkubasi dilakukan pada suhu 30 oC selama 48 jam. Koloni yang dapat menghidrolisis lemak menjadi gliserol dan asam lemak akan menyebabkan penurunan pH medium sehingga menyebabkan terbentuknya warna merah pada bagian bawah koloni. Hal ini menunjukkan bahwa uji hidrolisis lemak positif.
3.4.20 Uji hidrolisis pati (Fardiaz 1989)
Bakteri yang akan diuji digoreskan pada setengah bagian cawan yang berisi medium starch agar. Inkubasi dilakukan pada suhu 30 oC selama 48 jam. Setelah inkubasi, koloni yang tumbuh ditetesi larutan gram yodium sehingga semua bagian agar terendam. Uji hidrolisis pati positif ditandai dengan terbentuknya bagian yang transparan (bening) di sekeliling koloni yang tumbuh.
3.5 Pendugaan Jenis Bakteri
Data yang diperoleh dari hasil pengujian karakterisasi isolat bakteri digunakan untuk menduga jenis bakteri yang diisolasi dari produk bekasam. Pendugaan jenis bakteri dilakukan berdasarkan kunci identifikasi dari Cowan dan Steel (1974), kunci identifikasi tersebut dapat dilihat pada Tabel 2.
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 Shape S S S S S S S R R R R R R R R R R R R R R Acid fast - - - w + Spores - - - + + - - -Motility - - - - + - - + - - + - - - D D - - -Growth in air + + + + + + - + + + + + + - - - - + + + + Growth anaerobically - + w w + + + - + + + + - + + + + D - - x Catalase + + w - - - - + + + + - + + - - - + + + + Oxidase - - - X X X X X d - - -Glucose (acid) D + + + + + +/- - - + + + + + + - D D + + +
OF O/- F F F F F F/- - - F F F F F F - F/- F/O/- O O O/NT
Micrococcus + . . . . Staphylococcus + . . . . Aerococcus + + . . . . Streptococcus . . . + + . . . . Pediococcus . . . + . . 6,4 . . . . Gemella . . . + . . . . Anaerobic cocci . . . + . . . . Kurthia . . . + . . . . Corynebacterium . . . + + . . . . Listeria . . . + . . . . Erysipelothrix . . . + . . . . Lactobacillus . . . + . . . . Arachnia . . . + . . . . Rothia . . . + . . . . Propionibacterium . . . + . . . . Actinomycetes . . . + . . . . Bifidobacterium . . . + . . . . Eubacterium . . . + + 6,8 . . 6,9 . Clostridium . . . <> <> + . . . . Bacillus . . . <> <> <> . <> . . . . + . . . Nocardia . . . + + Mycobacterium . . . +
Keterangan: . : Peptococcus, Peptostreptococcus ( juga Leuconostoc )
+ : juga Actinomyces, Odontolyticus D : reaksi berbeda diantara species
d : reaksi berbeda diantara galur F : fermentatif
O : oksidatif w : reaksi lemah
x : tidak diketahui
<> : jenis yang tidak menghasilkan spora : bentuk tipikal S : bulat R : batang NT : tidak diuji 6,10 6,7 6,6 6,2 6,3 6,5
Tahap awal penelitian dilakukan analisis sampel bekasam ikan bandeng (Chanos chanos). Gambar bekasam ikan bandeng (Chanos chanos) yang digunakan dalam penelitian ini dapat dilihat pada Gambar 5.
Gambar 5. Bekasam ikan bandeng (Chanos chanos)
Tahap analisis bahan bertujuan untuk mengetahui karakteristik sampel sebagai informasi awal sebelum dilakukan isolasi dan karakterisasi bakteri asam laktat yang terdapat di dalamnya. Analisis sampel yang dilakukan meliputi: pengukuran kadar garam (NaCl), nilai pH (derajat keasaman) dan total asam laktat. Hasil pengujian terhadap sampel bekasam ikan bandeng (Chanos chanos) dapat dilihat pada Tabel 3.
Tabel 3. Analisis kimia sampel bekasam ikan bandeng (Chanos chanos)
Parameter Hasil analisis
Kadar garam (NaCl) 3,26 %
Nilai pH 4,46
Total asam laktat 1,30 %
Keterangan: Pengukuran dilakukan secara duplo dan contoh perhitungan dari ketiga analisis tersebut dapat dilihat pada Lampiran 1.
Kadar garam (NaCl) yang terdapat pada bekasam ikan bandeng (Chanos chanos) yang difermentasi selama dua minggu adalah 3,26 %. Berdasarkan pengukuran kadar garam, dapat diduga bahwa bakteri yang tumbuh