Materi Kimia SMA Kelas XI Semester 1/2 Lengkap Bab 2 Termokimia
Teks penuh
Gambar


Dokumen terkait
Sumber: Penerbit.. berupa zat warna, oksida logam, zat pereduksi, zat pencemerlang, bahan pengawet, dan bahan penstabil dihaluskan hingga berukuran partikel koloid
• Harga entalpi standar pembentukan dari senyawa dalam bentuk Harga entalpi standar pembentukan dari senyawa dalam bentuk larutan merujuk pada larutan dengan konsentrasi 1 M
menunjukkan adanya perubahan energy dalam bentuk kalor pada pereaksi dan hasil reaksi..
Menurut Marquis de Laplace, “ jumlah kalor yang dilepaskan pada pembentukan senyawa dari unsur-unsur penyusunnya = jumlah kalor yang diperlukan pada penguraian senyawa tersebut menjadi unsur-unsur
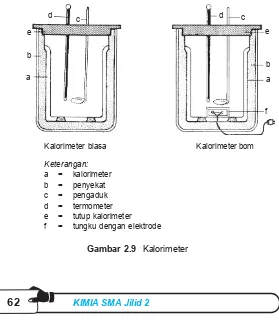
perubahan suhu maka semakin besar pula kalor yang diserap atau diterima oleh suatu zat.Sisa kalor yang dilepaskan oleh air panas diserap oleh kalorimeter.Pada percobaan pencampuran
Membedakan reaksi yang melepas kalor (eksoterm) dengan reaksi yang menerima kalor (endoterm) melalui diagram entalpi reaksi. Menuliskan persamaan reaksi termokimia.
@2020, Direktorat SMA, Direktorat Jenderal PAUD, DIKDAS dan DIKMEN 6 PETA KONSEP Jenis-jenis Entalpi Pembentukan Entalpi Reaksi Cara Penentuan Percobaan Perubahan Entalpi
Perubahan entalpi ( (H) suatu reaksi dapat ditentukan melalui berbagai cara yaitu melalui eksperimen, berdasarkan data perubahan entalpi pembentukan ( (Hfr), berdasarkan hukum Hess,