2.1.1. Infeksi dan Inflamasi
Infeksi adalah keberadaan berbagai kuman yang masuk ke dalam tubuh manusia yang berkembang biak dan menyebabkan kerusakan sekitar jaringan infeksi. Pada penyakit infeksi juga menyebabkan reaksi inflamasi. Meskipun proses inflamasi sama, namun intensitas dan luasnya tidak sama, tergantung luas infeksi dan respon tubuh. Inflamasi akut dapat terbatas pada lokasi infeksi saja atau dapat meluas serta menyebabkan tanda dan gejala sistemik (Guntur, 2007; Butterworth, 2013).
Inflamasi timbul sebagai reaksi jaringan vaskuler terhadap semua bentuk infeksi. Pada dasarnya inflamasi adalah suatu reaksi dari pembuluh darah, saraf, cairan, dan sel tubuh ditempat infeksi. Inflamasi akut merupakan respon langsung yang dini terhadap agen penyebab infeksi dan kejadian yang berhubungan dengan inflamasi akut sebagian besar diakibatkan oleh produksi dan pelepasan berbagai macam mediator inflamasi. Meskipun jenis jaringan yang mengalami inflamasi berbeda, mediator yang dilepas sama. Manifestasi klinis yang berupa inflamasi sistemik disebut systemic inflammation response syndrome (Guntur,2007; Butterworth, 2013).
2.1.2. Definisi Sepsis
Sepsis merupakan keadaan disfungsi organ yang mengancam jiwa dimana terjadi disregulasi respon tubuh terhadap infeksi. Secara klinis dapat dijabarkan bahwa disfungsi organ dapat terlihat dari peningkatan skor sequential organ failure assessment (SOFA) > 2 poin atau lebih yang berhubungan dengan peningkatan resiko kematian dirumah sakit >10% (Singer, 2016).
2.1.3. Definisi Syok Sepsis
Syok sepsis didefinisikan sebagai kondisi hipotensi yang persisten dan membutuhkan vasopresor untuk mempertahankan tekanan rerata arterial 65 mmHg atau lebih dan kadar serum laktat lebih besar dari 4 mmol/L (18mg/dL) dengan syarat sudah dilakukan resusitasi cairan yang adekuat (Dellinger et al., 2013).
2.1.4. Kriteria Sepsis
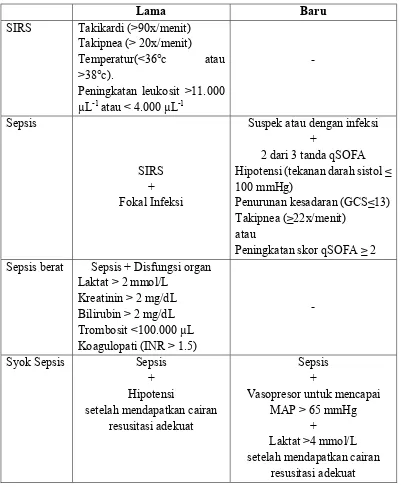
Berdasarkan studi dan konsesi mengenai definisi sepsis baru, yang dilakukan oleh European Society of Intensive Care Medicine’s dan The Society of Critical Care Medicine’s pada tahun 2016, ditetapkan kriteria sepsis yang terdapat pada tabel 2.1.
2.1.5. Epidemiologi
Sepsis merupakan penyebab kedua tertinggi kematian di UPI dan merupakan 10 penyebab tertinggi kematian di seluruh dunia secara keseluruhan. Selama dua dekade, insidensi sepsis meningkat dari 83 per 100.000 populasi pada tahun 1979 menjadi 140 per 100.000 populasi pada tahun 2000, menunjukkan peningkatan sebesar 9% setiap tahunnya. Kegagalan fungsi organ menimbulkan efek akumulasi yang berdampak langsung pada kematian. Mortalitas pasien sepsis tanpa disfungsi organ sebesar 15%, pasien dengan kegagalan fungsi organ sebesar 70%, dan syok septik sebesar 45-60% (Martin et al., 2003; Hommes et al., 2012).
jaringan. Peningkatan kadar laktat mempunyai hubungan yang signifikan dengan tingkat mortalitas dan morbiditas pada pasien syok septik. Peningkatan kadar laktat yang persisten > 24 jam berhubungan dengan tingkat mortalitas sebanyak 89%. Jika persisten > 48 jam maka tingkat mortalitas lebih tinggi (Nguyen, 2004).
Tabel 2.1 Perbandingan Kriteria Diagnostik Sepsis (dikutip dari Singer, 2016)
Lama Baru
Peningkatan skor qSOFA ≥ 2 Sepsis berat Sepsis + Disfungsi organ
2.1.6. Patofisiologi Sepsis
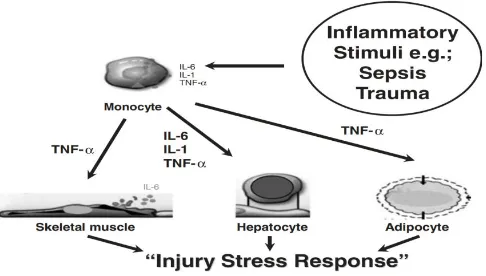
Inflamasi merupakan suatu mekanisme fisiologis yang terjadi sebagai respon terhadap organisme yang merusak integritas sel, seperti yang terjadi pada infeksi dan trauma. Pada keadaan Inflamasi, sel akan melepaskan sitokin dan beberapa mediator, yang mempunyai kontribusi terhadap penghancuran bakteri dan perbaikan pada jaringan. Dapat dibedakan antara sitokin seperti interleukin-1 (IL-1), interleukin-6 (IL-6), tumor necrosis factor (TNF), dan sitokin antiinflamasi seperti interleukin-10 (IL-10) dan interleukin-4 (IL-4). Mekanisme regulasi lokal akibat inflamasi merupakan gambaran penting terhadap proses menghilangkan sumber dari kerusakan dan mempertahankan homeostasis. Mediator humoral maupun neuronal memberikan kontribusi terhadap regulasi dari inflamasi. Mediator antiinflamasi humoral seperti IL-10 dan glukokortikoid menghambat efek pelepasan sitokin proinflamasi seperti dimana lipoxin dan resolvin berkontribusi terhadap perbaikan jaringan. Mediator humoral mencapai sel target pada beberapa organ dengan berdifusi melalui pembuluh darah. Aktivasi substansi yang dilepaskan oleh syaraf seperti norepinefrin. Asetilkolin akan mencapai target organ secara cepat (Ballina & Tracey, 2009).
Sepsis merupakan proses kompleks dan inflamasi sistemik terhadap infeksi yang umumnya akibat bakteri. Pada tahap awal, terjadi disregulasi dan ketidakseimbangan antara sitokin proinflamasi yang mengakibatkan kerusakan jaringan, organ, bahkan kematian. Pelepasan sitokin proinflamasi yang berlebihan memicu pelepasan vasoaktif amine dan chemokines maupun aktivasi sistem komplemen, koagulasi, dan pelepasan reactive oxgen spesies (ROS). Mediator-mediator inilah yang bertanggung jawab terhadap peningkatan permeabilitas vaskular, hipotensi, dan syok septik. Pada tahap lanjut, dilepasnya mediator seperti High Protein Group Box 1 (HMGB1), yang memungkinkan reaksi inflamasi tersebut berlanjut (Ballina & Tracey, 2009).
dapat menyebabkan peningkatan permeabilitas sawar darah-otak dan mencetuskan reaksi inflamasi. Mediator dari sirkulasi perifer dan sistem saraf otonom memegang peranan penting terhadap patogenesis neuroimun pada sepsis (Weismuller et al., 2012).
Hubungan dua arah antara susunan syaraf pusat dengan sistem imunitas dalam meningkatkan efektifitas pada kedua sistem tersebut, dalam konteks perbedaan inflamasi yang diakibatkan oleh sepsis dengan penyebab lain. Dua jalur yang menghubungkan antara sistem imunitas dengan susunan syaraf pusat adalah sistem saraf otonom dan aksis Hypothalamo-pituitary-adrenal (HPA). Aktivasi kedua jalur tersebut mempunyai peranan penting terhadap terjadinya sepsis (Weismuller et al., 2012).
2.1.6.1. Sistem Saraf Simpatis
Serabut aferen preganglionik yang meninggalkan susunan saraf pusat didalam saraf spinal torakal dan lumbal dinamakan sistem saraf simpatis atau sistem torakolumbal. Serabut post ganglionik memiliki inervasi ke organ melalui ganglia. Sistem saraf simpatis menginervasi semua organ limfoid dan memiliki transmiter epinefrin dan norepenefrin untuk memodulasi sistem imun. Sitokin proinflamasi mampu mengaktifkan aksis HPA maupun sistem saraf simpatis (Weismuller et al., 2012).
Berbagai macam sel dari sistem imun innate mengekspresikan reseptor α atau β-adrenergik. Biasanya, reseptor α tidak dapat ditemukan pada permukaan leukosit di darah perifer namun dapat ditemukan pada kondisi patologis. Norepinefrin berinteraksi dengan reseptor α yang akan mestimulasi makrofag untuk melepaskan TNF-α dan seterusnya akan berkontribusi dalam mempertahankan keadaan sepsis. Sebaliknya, interaksi dengan reseptor β akan menurunkan pelepasan IL-1 dan TNF-α dan meningkatkan sekresi IL-10 dari makrofag yang memiliki efek antiinflamasi (Weismuller et al., 2012; Preiser, 2014).
2.1.6.2.Aksis Hypothalamo-pituitary-adrenal (HPA)
proinflamasi juga mengaktifkan sel perivaskular di sawar darah otak. Sel perivaskular akan melepaskan eikosanoid yang memberikan efek pada hipotalamus. Sitokin yang berada di sirkulasi juga dapat memberikan efek pada organ sirkumventrikular seperti area postrema dimana tidak terdapat sawar darah otak. Sitokin menyebakan ekspresi Corticotropin Releasing Hormones (CRH) atau Arginin Vasopressin (AVP) di hipotalamus serta Adrenocorticotropic Hormones (ACTH) pada kelenjar hipofisis adrenal. ACTH dapat meningkatkan pelepasan kortisol di korteks adrenal. Kortisol memiliki efek antiinflamasi dalam mengurangi aktivasi nuclear factor-kappa B (NF-κB) dan meningkatkan sintesa sitokin antiinflamasi. Pro-opiomelanocortin (POMC) adalah prekursor peptida tidak hanya ACTH tetapi juga α-melanocyte stimulating hormones (α-MSH). α-MSH menurunkan NF-κB dan meningkatkan pelepasan IL-10 dan menghambat aktivitas. Pada keadaan syok septik sangat relevan bahwa terhambatnya pelepasan α-MSH setelah stimulasi CRH berdampak kepada kematian. Reaksi anti inflamasi sistemik penting terhadap respon imunitas yang efektif pada pasien sepsis. Berbagai studi klinis menunjukkan sitokin proinflamasi secara langsung mengaktifkan aksis HPA dan mengakibatkan pelepasan kortisol (Weismuller et al., 2012).
mungkin memiliki implikasi untuk meningkatkan pemahaman tentang kondisi kejiwaan seperti depresi.
Penelitian pada hewan, terbukti bahwa stresor psikologis kronis meningkatkan rasio produksi arginin vasopresin terhadap kortikotropin. Stresor psikososial secara intrinsik berkaitan dengan kondisi depresif. Adanya peningkatan arginin vasopresin pada studi tingkat depresi postmortem dan menurunnya kadar arginin vasopresin dalam CSF akibat penggunaan antidepresan, memunculkan pertanyaan tentang peran arginin vasopresin yang tepat dalam aktivitas yang berlebihan dari HPA pada keadaan depresi (Weismuller et al., 2012).
2.1.6.3.Kontrol Kolinergik Inflamasi
Beberapa tahun terakhir, jalur anti inflamasi kolinergik telah digambarkan sebagai mekanisme kontrol inflamasi neuronal melalui saraf aferen. Secara in vitro, asetilkolin menghambat pelepasan sitokin melalui makrofag. Secara in vivo, stimulasi elektrik saraf vagal menurunkan pelepasan HMGB1 dan meningkatkan angka kelangsungan hidup. Selanjutnya, asetilkolin menghambat pelepasan TNF-α dengan berikatan dengan reseptor α7-subunit asetilkolin. Sebagai tambahan, splenektomi yang dilakukan pada percobaan sepsis menurunkan pelepasan HMGB1 serta meningkatkan angka kelangsungan hidup. Sistem imun mendapat informasi dari organ perifer dan berperilaku sebagai organ sensorik yang menyediakan informasi proses inflamasi untuk otak. Reseptor IL-1 pada syaraf aferen vagal terlibat pada proses ini (Weismuller et al., 2012).
2.1.6.4.Aktivasi komplemen
Patogenesis sepsis sangat kompleks. Meskipun kemajuan ilmu kedokteran semakin maju namun patogenesis sepsis masih tetap tidak dimengerti. Utamanya, sepsis adalah hasil dari interaksi antara mikroorganisme dan respon host akibat dikeluarkan sitokin dan mediator lainnya. Komponen terpenting dari respon host adalah berkembangnya mekanisme alami awal untuk memproteksi organisme dari kerusakan. Akan tetapi pada sepsis, respon imun itu sendiri yang menimbulkan respon kaskade sekunder dimana mencetuskan disfungsi organ bahkan kematian, selain eradikasi dari invasi mikroorganisme. Konsep awal dari sepsis adalah respon proinflamasi tidak terkontrol dan juga gabungan dari disregulasi dari anti-inflamasi, koagulasi, dan jalur penyembuhan luka (Annane, 2005).
2.1.7. Patofisiologi Syok Sepsis
Patofisiologi dari syok sepsis masih belum diketahui secara jelas tetapi melibatkan interaksi yang kompleks antara patogen dan sistem imun host. Respon fisiologis yang normal untuk infeksi lokal melibatkan aktivasi dari mekanisme pertahanan host yang berupa aktivasi dari neutrofil dan monosit, pelepasan mediator inflamasi, vasodilatasi lokal, peningkatkan permeabilitas endotel, dan aktivasi dari jalur koagulasi. Respon mekanisme ini muncul pada syok sepsis, tetapi pada kala sistemik, mengarah pada kerusakan endotel, permeabilitas vaskular, vasodilatasi, dan trombosis dari kapiler organ. Kerusakan endotel sendiri akan berakhir mengaktivasi inflamasi dan kaskade koagulasi yang semakin merusak endotel dan kerusakan organ (Hommes, 2009).
Oksida nitrat (NO) menghasilkan sitokin-sitokin yang mempengaruhi dinding pembuluh darah. NO berperan penting pada perubahan hemodinamik dari syok sepsis dengan cara menyebabkan terjadinya vasodilatasi, yang merupakan permulaan dari terjadinya syok. Selain itu, sitokin-sitokin itu juga akan mempengaruhi kapiler sel endotel yang menyebabkan marginasi neutrofil, perlengketan trombosit, ketidakseimbangan dari mekanisme homeostasis yang mengarah pada koagulopati dan trombosis mikrovaskular, dan deplesi dari volume intravaskular. Kedua proses ini akan menyebabkan hipoksia sel dan menurunkan resistensi sistemik vaskular yang akan menyebabkan asidosis laktat yang menyebabkan kematian. Selain itu juga, sitokin-sitokin yang dikeluarkan ini akan mempengaruhi hipotalamus yang akan menyebabkan demam, takikardi, dan takipnea (Marino, 2007).
2.1.8. Stres Metabolik Pada Sepsis
dengan kebutuhan manusia sehat, namun pengurangan massa otot dan jaringan lemak masih tampak terjadi (Elamin & Camporessi, 2009).
Gambar 2.1 Variasi kondisi yang dapat menimbulkan CRHs di plasma meningkat.(Elamin & Camporessi, 2009).
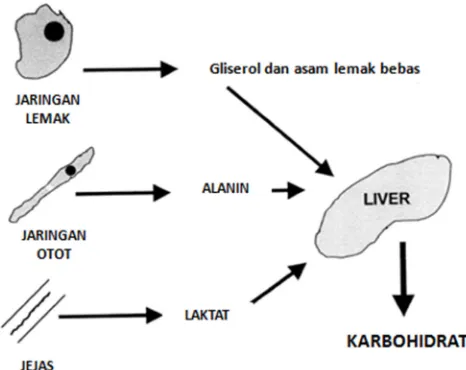
Respon metabolik terhadap stres memiliki dampak yang besar terhadap gangguan metabolisme karbohidrat. Peningkatan sekresi CRH menimbulkan peningkatan produksi karbohidrat endogen sebagai akibat akselerasi hepatik glukoneogenesis. Sumber substrat endogen untuk mendukung glukoneogenesis hepatik berasal gliserol (lipolisis), alanin (proteolisis), dan laktat (glikolisis anaerob). Peningkatan produksi karbohidrat ini dibarengi dengan resisten terhadap insulin yang menyebabkan hiperglikemia. Kadar insulin dalam batas normal atau diatas ambang normal, namun tidak cukup untuk mencegah hiperglikemia. Hiperglikemia dapat juga terjadi akibat penurunan aktivitas sintesa glikogen diotot. (Chiolero et al., 1997).
oksidasi dan 80-90% energi yang dibutuhkan untuk proses glukoneogesis hepatik berasal oksidasi lemak (Simsek et al., 2014).
Gambar 2.2 Glukoneogenesis hepatik (Chiolero et al., 1997)
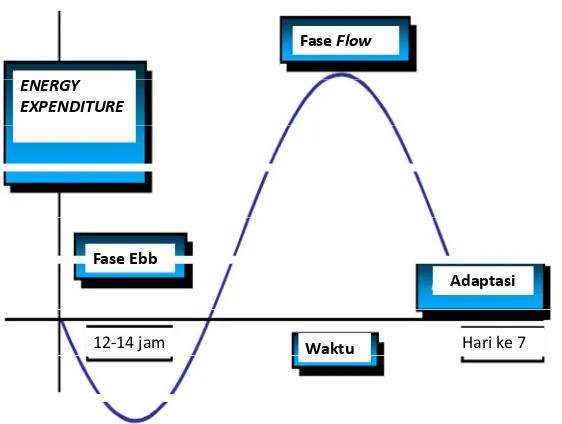
Respon metabolik tubuh terhadap stres terjadi melalui dua fase, yaitu fase ebb dan fase flow (Preiser, 2014).
1. Fase Ebb
mungkin terjadi pada fase ebb. Hiperglikemia terjadi akibat glikogenolisis hepar yang merupakan efek sekunder dari katekolamin dan akibat stimulasi simpatik langsung dari pemecahan glikogen. Hiperglikemia yang terjadi setelah trauma merupakan masalah penting untuk segera diatasi karena dapat menyebabkan berbagai komplikasi, masa penyembuhan yang lebih lama, memperpanjang waktu rawatan, bahkan kematian (Preiser, 2014).
2. Fase Flow
12-14 jam Fase Ebb
FaseFlow
ENERGY EXPENDITURE
Adaptasi
Waktu Hari ke 7
Gambar 2.3 Fase ebb dan fase flow (Preiser et al., 2014)
2.1.9. Manifestasi klinis
Perjalanan sepsis akibat bakteri diawali dengan proses infeksi yang ditandai dengan bakteremia selanjutnya berkembang menjadi systemic inflammatory response syndrome (SIRS) dilanjutkan sepsis, sepsis berat, syok sepsis dan berakhir pada multiple organ dysfunction syndrome (MODS) (Heyland, 2001; Annane, 2005).
Sepsis dimulai dengan tanda klinis respon inflamasi sistemik (yaitu demam, takikardia, takipnea, leukositosis) dan berkembang menjadi hipotensi pada kondisi vasodilatasi perifer (renjatan septik hiperdinamik atau “hangat”, dengan muka kemerahan dan hangat yang menyeluruh serta peningkatan curah jantung) atau vasokonstriksi perifer (renjatan septik hipodinamik atau “dingin” dengan anggota gerak yang biru atau putih dingin). Pada pasien dengan manifestasi klinis ini dan gambaran pemeriksaan fisik yang konsisten dengan infeksi, diagnosis mudah ditegakkan dan terapi dapat dimulai secara dini (Larosa, 2010).
sering ditemukan dengan manifestasi hipotermia dibandingkan dengan hipertermia, leukopenia dibandingkan leukositosis, dan pasien tidak dapat ditentukan skala takikardi yang dialaminya (seperti pada pasien tua yang mendapatkan beta blocker atau antagonis kalsium) atau pasien ini kemungkinan menderita takikardia yang berkaitan dengan penyebab yang lain (seperti pada bayi yang gelisah). Pada pasien dengan usia yang ekstrim, setiap keluhan sistemik yang non-spesifik dapat mengarahkan adanya sepsis, dan memberikan pertimbangan sekurang-kurangnya pemeriksaan skrining awal untuk infeksi, seperti foto toraks dan urinalisis (Cohen, 2002).
Pasien yang semula tidak memenuhi kriteria sepsis mungkin berlanjut menjadi gambaran sepsis yang terlihat jelas sepenuhnya selama di rawat di instalasi gawat darurat, dengan permulaan hanya ditemukan perubahan samar-samar pada pemeriksaan. Perubahan status mental seringkali merupakan tanda klinis pertama disfungsi organ, karena perubahan status mental dapat dinilai tanpa pemeriksaan laboratorium, dan mudah terlewatkan pada pasien tua, sangat muda, dan pasien dengan kemungkinan penyebab perubahan tingkat kesadaran, seperti intoksikasi. Penurunan produksi urin (≤0,5ml/kgBB/jam) merupakan tanda klinis yang lain yang mungkin terlihat sebelum hasil pemeriksaan laboratorium didapatkan dan digunakan sebagai tambahan pertimbangan klinis (Marino, 2007).
2.1.10. Diagnosis
curah jantung meningkat, dengan resistensi vaskuler sistemik yang rendah.Abnormalitas hitung darah lengkap, hasil uji laboratorium, faktor pembekuan, dan reaktan fase akut mungkin mengindikasikan sepsis (Shapiro,2010). 2.1.11. Laboratorium
Hasil laboratorium yang sering ditemukan adalah asidosis metabolik, trombositopenia, peningkatan laktat, pemanjangan waktu protrombin dan tromboplastin parsial, penurunan kadar fibrinogen serum dan peningkatan produk fibrin split, anemia, penurunan PaO2 dan peningkatan PaCO2, serta perubahan morfologi dan jumlah neutrofil. Peningkatan neutrofil serta peningkatan leukosit imatur, vakuolasi neutrofil, granular toksik cenderung menandakan infeksi bakteri. Neutropenia merupakan tanda kurang baik yang menandakan perburukan sepsis. Pemeriksaan cairan serebrospinal dapat menunjukkan neutrofil dan bakteri. Pada stadium awal meningitis, bakteri dapat dideteksi dalam cairan serebrospinal sebelum terjadi suatu respons inflamasi (Larossa, 2010; Higgins, 2011).
2.2. Laktat
Pada individual sehat terdapat siklus berkelanjutan dari metabolisme dan produksi laktat sehingga kadar laktat dalam darah rendah dalam keadaan normal. Kadar laktat tinggi ketika produksi lebih tinggi dari eliminasi, ketika kapasitas eliminasimenurun atau lebih sering keduanya terjadi secara bersamaan. Kadar laktat normal pada individual sehat 1 ± 0.5 mmol/L (Andersen, 2013; Malmir, 2014).
Glukosa dibentuk dari bagian gliserol lemak dan senyawa glukogenik yang dapat digolongkan ke dalam dua kategori yaitu:
Senyawa yang meliputikonversi netto langsung menjadi glukosa tanpa daur ulang, seperti beberapa asam amino serta propionat;
Senyawa kimia yang merupakan hasil proses glikolisis di dalam sel, kadar laktat dalam plasma merupakan hasil keseimbangan antara produksi dan bersihan yang dipengaruhi beberapa faktor. Bila suplai oksigen tidak dapat mencukupi pasokan oksigen seperti pada hipoksia dan syok, maka sel akan melakukan mekanisme adaptasi untuk menghasilkan ATP sebagai sumber energi. Pada kondisi tersebut laktat menjadi salah satu hasil metabolit perantara yang berperan untuk kelangsungan metabolisme dalam sel. Hiperlaktatemia pada kondisi sakit kritis dinilai sebagai penanda terjadinya metabolisme anaerob sel yang mengalami stres akibat ketersediaan oksigen yang tidak adekuat. Laktat merupakan penyebab utama terjadinya ketidakseimbangan asam basa dan 2/3 dari pasien kritis yang mengalami asidosis metabolik disebabkan hiperlaktemia (Moviat et al., 2003, Valenza et al., 2005).
2.2.1. Metabolisme Laktat
Konsentrasi kadar laktat arteri tergantung dari keseimbangan antara produksi dan konsumsi. Kadar normal laktat adalah < 18 mg/dL (2 mmol/L) dengan jumlah produksi 1500 mmol/L per hari. Secara fisiologis laktat diproduksi oleh semua jaringan tubuh, yang terbanyak adalah otot (25%), kulit (24%), otak (20%), usus halus (10%), dan sel darah merah yang tidak memliliki mitokondria (20%). Kadar laktat sering digunakan sebagai parameter dari metabolisme kerja otot karena otot merupakan organ yang paling besar pengaruhnya terhadap kadar laktat. Laktat dimetabolisme oleh tubuh di hati dan ginjal (Shapiro, 2010; Lubis, 2016).
Laktat diproduksi di sitoplasma, dan merupakan hasil metabolisme dari piruvat yang dikatalisasi oleh enzim laktat dehidrogenase (LDH):
Piruvat + NADH + H+ LDH Laktat + NAD+
Reaksi ini menghasilkan laktat dengan rasio laktat banding piruvat 10 kali lipat dan 2 molekul ATP untuk tiap molekul piruvat. Kadar laktat akan meningkat bila pembentukan piruvat melebihi penggunaannya di mitokondria. Piruvat dibentuk melalui proses glikolisis, sehingga kondisi apapun yang menyebabkan peningkatan glikolosis akan meningkatkan kadar laktat. Piruvat akan dimetabolisme di mitokondria melalui suatu reaksi oksidasi aerob oleh enzim piruvat dehydrogenase (PDH) dalam siklus Krebs:
Piruvat + CoA + NAD PDH Asetil-CoA + NADH + H + CO2
Laktat gunakan oleh sel otot yang bekerja sebagai substrat perantara reaksi oksidasi dalam jalur laktat (lactate shuttle). Sehingga laktat sekarang dianggap sebagai substrat perantara metabolisme yang mengalami oksidasi saat kebutuhan energi tubuh meningkat atau sebagai substrat yang berperan penting dalam glukoneogenesis. Laktat terbukti dapat berfungsi sebagai molekul penanda
(signaling) yang ikut mengatur fungsi selular dan sistemik (Van der Beek, 2001;
Vernon, 2010).
Teori lactate shuttle menunjukkan proses pembentukan senyawa laktat secara aerobik. Proses ini merupakan suatu mekanisme berbagai jaringan dan organ menggunakan sumber karbon yang sama untuk reaksi oksidasi atau glukoneogenesis (Hoffman, 2012).
2.2.2. Hiperlaktatemia
Peningkatan laktat dalam darah (hiperlaktatemia) merupakan respon fisiologis tubuh dalam keadaan beraktivitas berat tetapi peningkatan kadar laktat saat istirahat merupakan masalah serius yang ditemukan pada pasien yang dirawat. Peningkatan kadar laktat yang berhubungan dengan penurunan pH darah akan mengarah pada keadaan asidosis laktat. Asidosis laktat didefinisikan sebagai keadaan asidosis metabolik dengan kadar laktat ≥ 5 mmol/L dan pH arteri <7.35. Hiperlaktatemia terjadi pada pasien dengan kadar laktat > 2 mmol/L. Pada pasien kritis asidosis laktat biasanya memiliki angka mortalitas yang tinggi, pada konsentrasi > 8 mmol/L memprediksi kematian. Studi prospektif baru tentang kadar laktat melaporkan kematian mencapai 83% pada pasien dengan kadar laktat > 10 mmol/L. Tetapi pada setiap individu, prognosis sangat tergantung kepada penyakit dasar, dengan asidosis laktat sebagai indikator beratnya keadaan syok, dan responnya terhadap terapi (Andersen, 2013).
Cohen dan Woods pada tahun 1926 mencoba untuk membagi penyebab peningkatan laktat dihubungkan dengan adanya keadaan hipoksia jaringan pada tipe A dan tipe B. Klasifikasi asidosis laktat dibagi menjadi:
A. Keadaan sekunder yang berhubungan dengan hipoksia jaringan (tipe A): 1. Syok
2. Anemia berat 3. Hipoksemia berat 4. Hipoperfusi regional
5. Keracunan karbon monoksida
B. Keadaan sekunder oleh suatu mekanisme lain (tipe B): 1. Berhubungan dengan penyakit tertentu (tipe B1)
Sepsis, gagal hepar, defisiensi tiamin; (suatu kofaktor enzim yang berperan dalam metabolisme laktat); keganasan tertentu, (misal: limfoma, kanker paru, kanker payudara, feokromositoma, diabetes).
2. Akibat obat atau racun tertentu (tipe B2)
glikol, propilen glikol), merupakan pelarut obat-obat parenteral; obat simpatomimetik (epinefrin, terbutalin, ritodrin); overdosis asetaminofen dan asam salisilat; antiretrovirus; sorbitol dan silitol; sianida (metabolit natrium nitroprusida); isoniazid; fruktosa.
3. Suatu kelainan kongenital (tipe B3)
Penyakit von Gierke (penyakit gangguan penyimpanan glikogen tipe I); intoleransi fruktosa bawaan; defisiensi karboksilase piruvat; defisiensi 1.6 bifosfat fruktosa; gangguan fosforilasi oksidasi bawaan; defisiensi dehidrogenase piruvat; sindrom Kearns-Sayre; sindrom mitochondrial
encephalopathy with lactic acidosis and stroke (MELAS) (Gunnerson, 2006).
Faktor yang paling penting pada produksi laktat adalah proses glikolisis
(glycolytic flux). Menurut Connet et al. (1990) terdapat beberapa faktor yang
merangsang perpindahan glukosa selama proses glikolisis yaitu menurun atau terhambatnya proses fosforilasi di jaringan, pengaruh hormon dan stres seperti insulin, epinefrin, efek metabolik dari mediator inflamasi (TNF, IL1) dan alkalosis. Proses fosforilasi menurun atau terhambat karena terjadi penurunan sintesis ATP (akibat dari menurunnya oksigenasi jaringan, disfungsi mitokondria) atau peningkatan kebutuhan energi (kondisi hipermetabolik dan stres). Sakit kritis merupakan kondisi hiperadrenergik akibat meningkatnya sekresi katekolamin dan sering terjadi hipoperfusi, hipooksigenasi jaringan, dan disfungsi mitokondria. Hipotesis James dkk menyatakan bahwa laktat yang dihasilkan sel otot pada sepsis atau syok hemoragik bukan semata-mata karena proses glikolisis anaerob akibat hipoperfusi, melainkan dari meningkatnya proses glikolisis aerob akibat dari sekresi katekolamin meningkat. Penelitian Levy, dkk pada pasien dengan syok sepsis juga mendukung hipotesis tersebut (Levy, 2005).
2.3. Terapi Adjuvan, Support Hemodinamik dan Terapi Cairan pada Pasien Sepsis
Therapy (EGDT) merupakan penatalaksanaan pasien dengan sepsis berat dan syok septik, yang bertujuan memperbaiki penghantaran oksigen ke jaringan, dalam jangka waktu tertentu (Rivers et al., 2001).
Rivers et al. (2001) mempublikasikan penelitian mereka tentang EGDT, yaitu pada 263 pasien dewasa yang didiagnosis sepsis berat dan syok septik di unit gawat darurat. Pasien tersebut mendapat resusitasi cairan kristaloid dan koloid untuk mempertahankan tekanan vena sentral ≥ 8 mmHg, pemberian vasodilator dan vasopresor untuk mempertahankan mean arterial pressure (MAP) antara 65-90 mmHg, transfusi PRC untuk mempertahankan hematokrit ≥ 30% pada pasien dengan saturasi oksigen vena sentral ≤ 70%, serta pemberian inotropik. Resusitasi dini dilakukan dalam 6 jam pertama dan berhasil mengurangi mortalitas selain juga berhasil mencegah terjadinya kegagalan multiorgan. Keberhasilan pendekatan tatalaksana pasien sepsis berat dan syok septik dengan pendekatan EGDT yang dilaporkan oleh Rivers et al. berupa menurunnya angka mortalitas hingga 16,5% dibandingkan dengan kelompok yang mendapat terapi standar tanpa pendekatan EGDT dengan angka mortalitas yang lebih tinggi (Rivers et al., 2001).
Rekomendasi dari Surviving Sepsis Campaign 2012 yaitu resusitasi cairan untuk sepsis berat direkomendasikan penggunaan kristaloid sebagai pilihan cairan inisial untuk resusitasi cairan pada sepsis berat dan syok septik (grade 1B). Selain itu, juga tidak direkomendasikan penggunaan hydroxyethyl starches (HES) untuk resusitasi cairan pada sepsis berat dan syok septik (grade 1B) (Rekomendasi ini berdasarkan hasil dari percobaan VISEP, CRYSTMAS, dan CHEST) dan juga direkomendasikan penggunaan albumin untuk resusitasi cairan pada sepsis berat dan syok septik ketika pasien membutuhkan jumlah kristaloid yang substansial (grade 2C) (Dellinger et al., 2012).
untuk mengembalikan hemodinamika. Oleh karena itu, vasopresor diberikan segera setelah resusitasi cairan optimal diberikan. Pemberian vasoaktif direkomendasikan bila syok tidak teratasi dengan resusitasi cairan sampai dengan 30 mL/kgBB. Jenis obat yang digunakan yaitu katekolamin dan derivat sintetisnya, meliputi dopamin, dobutamin, epinefrin, norepinefrin (Dellinger et al., 2012).
Tabel 2.2 Surviving Sepsis Campaign (Dellinger et al., 2012)
Tabel 2.3 Rekomendasi: support hemodinamik dan terapi adjuvan (Dellinger et al., 2012)
Terapi cairan pada sepsis berat
1. Kristaloid sebagai pilihan cairan insial untuk resusitasi cairan pada sepsis berat dan syok septik (grade 1B).
2. Menentang penggunaan dari HES untuk resusitasi cairan pada sepsis berat dan syok septik (grade 1B).
3. Albumin dalam resusitasi cairan pada sepsis berat dan syok septik ketika pasien membutuhkan jumlah kristaloid yang substansial (grade 2C). 4. Tantangan cairan inisial pada pasien dengan sepsis yang mengakibatkan
albumin). Administrasi yang cepat dan jumlah cairan yang besar mungkin dibutuhkan pada beberapa pasien (grade 1C).
5. Teknik tantangan cairan dapat diaplikasikan pada saat administrasi cairan dilanjutkan sepanjang perbaikan hemodinamik apakah berdasarkan pada dinamik (contoh : perubahan pada tekanan nadi, variasi stroke volume) atau variabel statik (contoh : tekanan arterial, denyut jantung).
Vasopresor
1. Terapi vasopresor digunakan untuk mencapai target tekanan rerata arterial atau mean arterial pressure lebih dari 65 mmHg (grade 1C). 2. Norepinefrin sebagai pilihan pertama vasopresor (grade 1B).
3. Epinefrin (ditambahkan atau berpotensi menggantikan norepinefrin) ketika agen tambahan dibutuhkan untuk mempertahankan tekanan darah yang adekuat (grade 2B).
4. Vasopresin 0.03 unit/menit dapat ditambahkan ke norepinefrin (NE) dengan tujuan untuk meningkatkan MAP atau menurunkan dosis NE. 5. Vasopresin dosis rendah tidak direkomendasikan sebagai vasopresor
inisial untuk penatalaksanaan sepsis yang menyebabkan hipotensi dan dosis vasopresin lebih tinggi dari 0.03-0.04 unit/menit harus disediakan untuk terapi pilihan terakhir (jika terdapat kegagalan untuk mencapai MAP yang adekuat dengan agen vasopresor yang lain).
6. Dopamin sebagai agen vasopresor alternatif dari norepinefrin hanya digunakan pada pasien yang dipilih (contoh : pasien dengan resiko rendah takiaritmia dan bradikardi absolut atau relatif).
8. Dopamin dosis rendah tidak boleh digunakan untuk proteksi ginjal (grade 1A).
9. Semua pasien yang membutuhkan vasopresor harus dipasang kateter arterial setelah diberikan jika sumber tersedia.
Terapi Inotrop
1. Infus dobutamin sampai 20 mikrogram/kg/menit dapat diberikan atau dengan ke vasopresor (jika digunakan) jika terdapat (a) disfungsi miokardial yang ditandai dengan peningkatan tekanan pengisian jantung dan curah jantung yang rendah, atau (b) adanya tanda-tanda hipoperfusi, tanpa mencapai volume intravaskular yang adekuat dan MAP yang adekuat (grade 1C).
2. Tidak menggunakan strategi untuk meningkatkan indeks jantung untuk menentukan level supranormal (grade 1B).
Kortikosteroid
1. Tidak dapat digunakan untuk mengobati pasien dewasa dengan syok septik jika resusitasi cairan adekuat dan terapi vasopresor dapat mengembalikan kestabilan hemodinamik. Jika tidak tercapai, kita merekomendasikan penggunaan hidrokortison intravena sendiri dengan dosis 200 mg per hari (grade 2C).
2. Tidak menggunakan tes stimulasi ACTH untuk mengidentifikasi pasien dewasa dengan syok septik yang harus menerima hidrokortison (grade 2B).
3. Pada pasien yang mendapat hidrokortison dosis harus diturunkan perlahan jika vasopresor tidak dibutuhkan lagi (grade 2D).
4. Kortikosteroid tidak boleh diadministrasikan untuk penanganan sepsis jika tidak terdapat syok (grade 1D).
2.3.1. Norepinefrin
Norepinefrin atau sering disebut sebagai noradrenalin merupakan senyawa kimia dari golongan katekolamin yang berfungsi sebagai hormon dan neurotransmiter. Di dalam otak, norepinefrin diproduksi oleh sel dalam neuron atau nukleus yang terletak di pons. Di luar otak, norepinefrin digunakan sebagai neurotransmiter oleh ganglia simpatetis yang terletak di dekat korda spinalis dan dilepaskan ke dalam aliran darah oleh kelenjar adrenal (Marino, 2007).
Norepinefrin bekerja pada kedua reseptor adrenergik alfa dan beta menghasilkan vakonstriksi kuat dan kurang mempengaruhi peningkatan cardiac output (CO). Efek vasokonstriksi poten bekerja dengan meningkatkan aliran balik vena dan memperbaiki preload jantung. Efek vasokontriksi norepinefrin terlihat pada peningkatan tekanan darah sistolik yang tidak sesuai dibandingkan dengan tekanan diastolik yang menyebabkan suatu refleks bradikardi. Respon bradikardi ini sering berlawanan dengan efek kronotropik ringan norepinefrin, menyebabkan denyut jantung tidak berubah. Pada dosis rendah (2 µg/menit), norepinefrin menstimulasi reseptor beta adrenergik. Dosis yang biasanya digunakan dalam klinis (>3 µg/menit). Norepinefrin merangsang reseptor alfa untuk menghasilkan vasokonstriksi (Dellinger et al, 2012).
Di dalam otak, norepinefrin berfungsi sebagai neurotransmiter yang dikontrol oleh beberapa mekanisme. Setelah disintesis, norepinefrin dari sitosol dimasukkan ke dalam vesikel sinaps oleh vesicular monoamine transporter
(VMAT). Norepinefrin disimpan dalam bentuk vesikel dan akan dikeluarkan ke celah sinaps, setelah adanya potensial aksi yang menyebabkan vesikel itu pecah dan keluar langsung menuju celah sinaps dimana proses ini disebut eksositosis. Setelah berada di sinaps, norepinefrin akan berikatan dengan reseptornya. Potensial aksi dari molekul norepinefrin akan melepaskan ikatannya dengan reseptor. Norepinefrin akan diabsorbsi kembali ke dalam sel presinaps melalui NET. Setelah berada di dalam sitosol, norepinefrin dipecah oleh monoamin oksidase atau dimasukkan kembali ke dalam vesikel oleh VMAT (Marino, 2007).
COMT dan membentuk metabolit inaktif. NE akan diekresikan di urine (84-96%) (Dellinger et al., 2012).
Teori sebelumnya mengemukakan norepinefrin berpengaruh negatif pada lumen pembuluh darah paru yang menyebabkan vasokonstriksi dan berpotensi pada hipertensi pulmonal, meskipun hal ini telah disangkal oleh studi terbaru pada hewan percobaan. Seperti agen lainnya yang meningkatkan inotropik dan afterload, norepinefrin meningkatkan kebutuhan oksigen otot jantung. Hal ini diimbangi oleh keseimbangan perfusi relatif yang dihasilkan oleh aktivitas gabungan reseptor alfa dan beta, tetapi sebaiknya dipertimbangkan pada pasien dengan gangguan koroner. Seperti vasokonstriktor lainnya, norepinefrin dapat menyebabkan iskemia. Hal ini lebih terfokus pada ginjal dan lumen pembuluh darah splanikus, dimana vasokonstriksi tersebut dapat menyebabkan kerusakan organ yang tidak diinginkan. Efek negatif norepinefrin pada perfusi hepatosplanikus masih menjadi kontroversi (Dellinger et al, 2012).
Surviving Sepsis Campaign, norepinefrin digunakan sebagai lini pertama dalam support hemodinamik pada syok sepsis. Dalam kondisi emergensi, norepinefrin digunakan sebagai agen pilihan untuk menangani hipotensi yang berkaitan dengan sepsis. Norepinefrin juga dapat digunakan sebagai tambahan dalam kondisi vasodilatasi lainya, seperti syok anafilaksis dan neurogenik, dan mungkin berguna pada keadaan dengan disfungsi ventrikel (Ellender, 2008). 2.3.2. Vasopresin
Vasopresin dikenal sebagai hormon antidiuretik (ADH). Merupakan non-peptida yang disintesis di dalam hipotalamus, hormon ini mengandung arginin yang secara spesifik disebut sebagai arginine vasopressin (AVP). Vasopresin menyebabkan peningkatan osmolalitas plasma, penurunan tekanan arterial, dan reduksi volume jantung. Vasopresin dibutuhkan untuk proses osmoregulasi, kontrol kardiovaskular, dan homeostatis (Treschan dan Peters, 2006).
metabolisme vasopresin. Sintesis dari preprovasopresin terjadi pada neuron neurohipofiseal (juga dikenali sebagai neuron magnoselular) dari nukleus paraventrikular dan supraoptik dari hipotalamus. Provasopresin terdapat dalam granul neurosekretori dan ditransportasi sepanjang traktus suprahipofisis menuju hipofisis posterior. Kemudian, provasopresin diubah oleh proprotein seperti
subtilisin konvertase (SPC3) menjadi vasopresin (Russell, 2011).
Vasopresin dimetabolisme oleh beberapa vasopresinase secara acak seperti LNPEP dan IRAP. LNPEP memetabolisme vasopresin dan juga membersihkan oksitosin (vasodilator), GLUT4 (dimana memodulasi uptake selular dari glukosa) dan enzim pengubah angiotensin 4 (merubah angiotensin menjadi angiotensin vasokonstriktor yang poten), menunjukkan variasi dalam kadar dan fungsi LNPEP dapat menyebabkan efek kompleks dalam hemodinamik dan tekanan darah pada sepsis (Russell, 2011).
Vasopresin secara cepat didistribusikan dari plasma ke dalam volume cairan extraseluler. Vasopresin dimetabolisme di dalam hati dan ginjal, dan dalam jumlah kecil dibuang ke dalam urine. Waktu paruh dalam plasma adalah 4 – 20 menit, oleh karena itu infus kontinu dibutuhkan untuk mempertahankan efeknya. Vasopresin eksogen harus diberikan secara parenteral, karena peptida dihidrolisis cepat oleh tripsin (Treschan dan Peters, 2006).
Vasopresin menstimulasi sekelompok reseptor: AVPR1a (dikenal sebagai reseptor V1, terutama vaskular), AVPR1b (reseptor V3, terutama sentral), AVPR2 (reseptor V2, terutama renal), reseptor oksitosin dan reseptor purinergik. AVPR1a, reseptor G protein berpasangan, bertanggung jawab untuk vasokontriksi yang berhubungan dengan vasopressin dan diekspresikan pada otot polos vaskular, hepatosit dan platelet. Protein G menstimulasi jalur signal fosfatidil-inositol-kalsium yang menyebabkan kontraksi otot polos. Stimulasi dari reseptor AVPR1a juga menyebabkan produksi dari vasodilator nitrat oksida yang poten pada pembuluh darah koroner dan pembuluh darah pulmonal. Sepsis menyebabkan
AVPR1b (reseptor V3) yang diekspresikan pada kelenjar hipofisis dan hipokampus. Stimulasi AVPR1b oleh vasopresin melepaskan hormon adenokortikotropik (ACTH) karena vaspresin berdistribusi dari hipofisis posterior melalui kapiler portal hipofisis untuk mengikat AVPR1b pada sel kortikotropik hipofisis anterior. Sehingga vasopresin berinteraksi dengan aksis kortikosteroid dalam menanggapi stres seperti hipotensi. Vasopressin dan corticotropin releasing hormone menstimulasi sistem signaling yang berbeda dan efek sinergis pada pelepasan ACTH. Pada tikus, AVPR1b mengalami gangguan respons stres yang disebabkan respon ACTH yang menurun. Sebaliknya, ekspresi berlebih pada AVPR1b berhubungan dengan adenoma hipofisis dan sindroma ACTH ektopik (Russell, 2011).
AVPR2 (reseptor V2) diekspresikan pada duktus kolektivus ginjal. Vasopresin adalah faktor trophic dari loop of Henle distal sehingga memberi efek antidiuretik vasopresin. Stimulasi AVPR2 meningkarkan retensi air (aktivitas antidiuretik) dengan meningkatkan AMP siklik, yang menyebabkan pergerakan kanal aquaporin-2 dari sitoplasma pada membran apikal dari sel duktus kolektivus. Apabila ada defisiensi vasopresin, saluran aquaporin-2 menginternalisasi dari membran apikal ke vesikel subapikal sehingga tidak ada reabsorpsi air yang aktif. Reseptor V2 juga menyebabkan vasodilatasi dengan stimulasi jalur nitrit oksida (Russell, 2011).
Syok septik dikarakterisasi dengan vasodilatasi dan hipotensi walaupun terdapat peningkatan konsentrasi katekolamin dan aktifasi dari sistem renin-angiotensin. sementara oksida nitrat diketahui mempunyai efek vasodilatasi, kegagalan dari otot polos sistem vaskular untuk berkontraksi yang disebabkan rendahnya kadar vasopresin dalam plasma. Pada pasien dengan syok septik, konsentrasi vasopresin dalam plasma secara signifikan lebih rendah dibandingkan dengan pasien syok kardiogenik walaupun keadaan sama-sama mengalami hipotensi (Treschan dan Peters, 2006).
Syok septik
Edema Norepinefrin Vasopressin
Hipotensi
Maldistribusi aliran darah mikrosirkulasi
Hipoperfusi mikrosirkulasi
O2 delivery menurun
Metabolisme anaerob Adhesi
Leukosit Adhesi/Agregasi Trombosit Permeabilitas kapiler meningkat Vasodilatasi menurun Perfusi
Keterangan :
Identifikasi variabel
Variabel Bebas
Pemberian Norepinefrin dengan Plasebo
Pemberian Norepinefrin dengan Vasopresin
Variabel Tergantung
Kadar Laktat.