BAB 3
METODE PENELITIAN
3.1 Jenis Penelitian
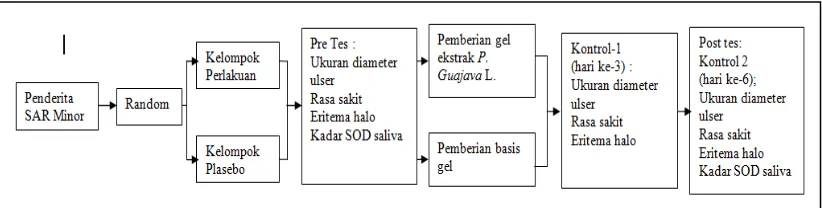
Jenis penelitian ini merupakan penelitian uji klinis dengan rancangan randomized pretest posttest single blinded control group. Pada penelitian ini terdapat 2 kelompok berbeda yang akan diuji, sebelum dan sesudah diberikan perlakuan. Kelompok pertama merupakan kelompok perlakuan diberikan sediaan gel ekstrak etanol P. guajava L. dan kelompok kedua merupakan kelompok kontrol yang akan diberikan plasebo yang tidak memiliki kandungan aktif (basis gel). (gambar 3.1)
Penentuan konsentrasi ekstrak mengacu pada penelitian sebelumnya (Octiarni, 2012).
Gambar 3.1. Bagan rancangan penelitian uji klinis
3.2 Lokasi dan waktu penelitian 3.2.1 Lokasi Penelitian
a. Laboratorium Farmakognonsi Fakultas Farmasi Universitas Sumatera Utara Pembuatan ekstrak gel daun jambu biji dilakukan di Laboratorium Obat Tradisional Farmasi Universitas Sumatera Utara. Laboratorium ini menjadi pilihan untuk penelitian karena merupakan salah satu laboratorium yang sering membuat dan menjadi rujukan dalam pembuatan ekstrak tanaman obat tradisional.
2
Lokasi pengambilan data dilakukan di Rumah Sakit Gigi dan Mulut Pendidikan Fakultas Kedokteran Gigi Universitas Sumatera Utara (RSGMP FKG USU) instalasi Ilmu Penyakit Mulut. Rumah sakit ini menjadi pilihan untuk penelitian karena merupakan satu-satunya rumah sakit khusus gigi dan mulut yang berpusat di kota Medan dan intstalasi Ilmu Penyakit Mulut merupakan salah satu tempat rujukan kasus penyakit jaringan lunak mulut di Kota Medan.
c. Laboratorium Terpadu Fakultas Kedokteran Universitas Sumatera Utara Analisa pemeriksaan Sodium Oxide Dismutase (SOD) saliva sebagai parameter status antioksidan subjek penelitian dilakukan di Laboratorium Terpadu Fakultas Kedokteran Universitas Sumatera Utara. Laboratorium ini merupakan laboratorium yang memiliki fasilitas dan sarana pemeriksaan biologi molekular.
3.2.2 Waktu Penelitian
Penelitian akan dilaksanakan dari bulan April sampai Oktober 2016.
3.3 Populasi dan Sampel Penelitian 3.3.1 Populasi Penelitian
Pasien SAR yang mencari perawatan di Rumah sakit Gigi dan Mulut Pendidikan Fakultas Kedokteran Gigi Universitas Sumatera Utara (RSGMP FKG USU).
3.3.2 Sampel Penelitian 3.3.2.1 Besar Sampel Penelitian
Penentuan besar sampel dilakukan dengan menggunakan rumus uji klinis perbedaan 2 kelompok independen seperti berikut (Sastroasmoro, 2011):
2 n = jumlah sampel setiap kelompok
SD = prediksi rerata standar deviasi gabungan perbedaan ukuran ulser berdasarkan penelitian sebelumnya (Guintu, 2013)
= 0,45 mm
Zα = tingkat kemaknaan hipotesis dua arah, jika α = 0,05 maka
Zα = 1,96
Zβ = kekuatan/ powerpenelitian, jika β = 0,2 maka Zβ = 0,84 X1-X2 = perbedaan rerata minimal ukuran ulser yang diharapkan berdasarkan penelitian sebelumnya (Guintu, 2013) (0,75-0,25 mm) = 0,5 mm
= 2 (6,35) = 13
Berdasarkan rumus besar sampel minimal di atas, maka peneliti mengambil jumlah sampel 16 orang untuk masing-masing kelompok dan untuk mengatasi subjek yang droup out. Total sampel yang didapatkan 32 orang subjek penelitian dengan 2 orang subjek drop out dikarenakan tidak dapat hadir kontrol sesuai jadwal penelitian.
3.2.2.2 Sampling Penelitian
Sampel penelitian diambil dengan cara single blind random sampling dengan metode randomisasi blok dengan jumlah subjek perblok sebanyak empat orang. Peneliti menetapkan setiap blok terdiri atas empat subjek dan pengobatan terdiri atas obat A merupakan ekstrak P. guajava L dan obat B merupakan kelompok kontrol negatif yang diberikan plasebo yang berisikan basic gel. Maka, jenis blok yang mungkin ada enam yaitu blok AABB, ABAB, ABBA, BBAA, BABA dan BAAB. Blok ini kemudian diberi kode 1 untuk AABB, kode 2 untuk ABAB, kode 3 untuk ABBA, kode 4 untuk BBAA, kode 5 untuk BABA dan kode enam untuk BAAB.
n= n1 = 2
(1,96+0,84).0,45
Kemudian dilakukan randomisasi dengan menggunakan komputerisasi. Hasil randomisasi untuk 30 sampel adalah: 2-2-1-3-6-6-5-6, ABAB-ABAB-AABB-ABBA-BAAB-BAAB-BABA-BAAB
3.4 Kriteria Inklusi dan Eksklusi 3.4.1 Kriteria Inklusi
1. Pasien yang sedang menderita Stomatitis Aftosa Rekuren (SAR) minor dan belum mengonsumsi obat apapun
2. Ulser yang terjadi tidak lebih dari 3 hari
3. Tidak menderita kelainan sistemik dan tidak mengonsumsi obat-obatan, vitamin atau suplemen makanan.
4. Tidak memiliki kebiasaan seperti merokok, mengonsumsi alkohol, menyirih dan menyuntil.
3.4.2 Kriteria Eksklusi
1. Pasien dengan Indeks Masa Tubuh (IMT) < 18,5 2. Pasien yang memiliki oral hiegene yang buruk
3. Pasien yang tidak kooperatif (tidak mengikuti intruksi yang diberikan oleh peneliti)
3.5 Variabel Penelitian 3.5.1 Identifikasi Variabel
1. Variabel bebas/pengaruh : gel ekstrak daun P. guajava Lyang menunjukkan aktivitas antioksidan ekstrak DJB
2. Variabel tergantung/terpengaruh :
a. Penyembuhan Stomatitis Aftosa Rekuren (SAR) minor (rasa sakit, halo eritema dan ukuran ulser)
- frekuensi aplikasi gel ekstrak DJB - nutrisi
- oral hiegene
3.5.2 Defenisi Operasional
Adapun definisi operasional pada penelitian ini adalah:
1. No Variabel Definisi Alat Ukur Hasil Ukur 2. Skala
peradangan pada mukosa rongga mulut yang ditandai dengan gambaran klinis berupa ulser, tunggal, bentuk oval dengan diameter kurang dari 1 cm, dangkal, berwarna abu-kuning (lapisan pseudomembran), berbatas jelas, dikelilingi oleh halo eritema yang kejadiannya rekuren dengan riwayat kambuhan minimal dua kali dalam satu tahun terakhir (Woo dan Greenberg, 2008).
a.Rasa sakit adalah perasaan nyeri dan panas pada mukosa rongga mulut lokasi SAR.
dengan pengurangan ukuran ulser. c.Eritema halo: batas pinggiran SAR yang berwarna merah sebagai tanda peradangan akibat pelebaran pembuluh darah kapiler yang bersifat reversibel
Bahan herbal yang mengandung flavonoid yang bersifat antiinflamasi dan antioksidan.
13.cara ukur menggunakan
3 15.Level
antioksidan SOD saliva
16.antioksidan metaloenzimatik yang bekerja mengkatalisis pemecahan
20.cara subjek peneliti menggunakan bahan eksperimen sebagai perawatan SAR
21.Menggunakan cotton bud yang diaplikasikan
24.Nutrisi 25.menilai angka kecukupan energi melalui perhitungan indeks masa tubuh (IMT).
mulut OHIS melalui pemeriksaan indeks debris dan indeks kalkulus yang dijumlahkan menjadi OHIS (Carranza dkk, 2006)
skor OHIS
0-3 pada
3.6 Alat dan Bahan Penelitian 3.6.1 Alat Penelitian
Alat yang digunakan pada penelitian ini adalah :
a. Perlengkapan laboratorium: timbangan, mixer, toples, erlenmeyer, gelas ukur, lemari pengering, kertas perkamen, blender, cawan porselin, batang pengaduk, perkolator, vaccum rotavapor, waterbath, refrigetaor -20oC dan -80oC, aluminium foil, nierbeken, pipet ukur, tabung reaksi, inkubator, spektrometer, labu ukur, microplate
b. Perlengkapan pengumpulan data: Formulir pencatat berupa blanko rekam medik penelitian, alat tulis, tiga serangkai (pinset, sonde, kaca mulut, pot penampung saliva, ice blue gel, termos es
3.6.2 Bahan Penelitian
Bahan yang digunakan pada penelitian ini adalah : a. Sampel saliva
b. Psidium guajava Linn.
c. EnzyChromTM Superoxide Dismutase Assay Kit (ESOD-100) Bufer : 20 mL - Diluent : 20 mL
Enzim SOD : 120 µ L - Enzim XO : 120 µ L Xanthine : 600 µ L - WST-1 : 600 µ L
d. Bahan lainnya: Etanol 96%, aquades, Caboxyl Methyl Cellulose (CMC), kain putih penyaring, kertas saring, kapas, masker, sarung tangan dan tissue
3.7 Prosedur Penelitian
3.7.1 Prosedur Pembuatan Simplisia dan Ekstrak Daun Psidium guajava L
pengering dengan suhu -40oC. Sortasi kering ditimbang kemudian dibuat serbuk. Serbuk ini disebut simplisia daun jambu biji (SDJB). (Gambar 3.2C)
Prosedur pembuatan ekstrak daun jambu biji (EDJB) dengan metode maserasi. Tehnik ini merupakan tehnik ekstraksi cara dingin yang paling sering digunakan. Prosedur pembuatan ekstrak daun jambu biji adalah sebagai berikut:
Sebanyak 500 g simplisia dimaserasi dengan etanol 96% yang sudah didestilasi sebanyak 3,75 L(75 bagian). Kemudian disaring dan ampasnya ditambah etanol 1,25 L(25 bagian) sehingga diperoleh 5 L maserat (Gambar 3.3A). Selanjutnya ekstrak dipekatkan dengan alat penguap rotari vacuum untuk mendapatkan ekstrak pekat, di-freeze dryer untuk menghilangkan sisa pelarut (DepKes, 1979). (Gambar 3.3B)
Gambar 3.2 : A. Pengumpulan daun P guajava L; B. Pencucian daun ;
Gambar 3.3: A. Proses maserasi; B. Ekstrak kental daun P guajava L
3.7.2 Pemeriksaan Karakteristik Simplisia Daun Psidium guajava L a. Penetapan kadar air
Bersihkan tabung penerima, pendingin, dan labu dengan asam pencuci. Bilas dengan air dan keringkan didalam lemari pengering. Penjenuhan toluena dilakukan dengan cara destilasi yaitu ukur 200 ml toluena masukkan kedalam labu destilasi tambahkan 2 ml air suling dan destilasi selama 2 jam. Biarkan mendingin selama setengah jam, baca volume air dengan ketelitian 0,01 ml (V1). Timbang seksama 5 g bahan masukkan kedalam labu destilasi, panaskan hati-hati selama 15 menit. Setelah toluena mulai mendidih destilasi dilakukan dengan kecepatan ± 2 tetes tiap detik, hingga sebagian besar air tersuling kemudian naikkan kecepatan penyulingan hingga 4 tetes per detik. Setelah semua air tersuling, cuci bagian dalam pendingin dengan toluena. Lanjutkan penyulingan selama 5 menit. Biarkan tabung penerima mendingin hingga suhu kamar. Baca volume air setelah air dan toluena memisah sempurna (V2). Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam simplisia yang diperiksa (WHO, 1992).
% � � = �
2− �1
� � 100%
b. Penetapan kadar sari larut dalam air
labu bersumbat sambil dikocok sesekali selama 6 jam, kemudian didiamkan selama 18 jam, lalu disaring. Sejumlah 20 ml filtrat pertama diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah ditara dan sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang larut dalam air dihitung ter-hadap bahan yang telah dikeringkan (DepKes, 1995).
% Kadar sari larut dalam air = x100%
c. Penetapan kadar sari larut dalam etanol
Sebanyak 5 g serbuk yang telah dikeringkan di udara, dimaserasi selama 24 jam dalam 100 ml etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian didiamkan selama 18 jam. Kemudian disaring cepat untuk meng-hindari penguapan etanol. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang larut dalam etanol 96% dihitung terhadap bahan yang telah dikeringkan (DepKes, 1995).
% Kadar sari larut dalam etanol = x100% krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, pijaran dilakukan pada suhu 600oC selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan
Abu yang diperoleh dalam penetapan kadar abu dididihkan dalam 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring, dipijarkan, kemudian didinginkan dan ditimbang sampai bobot tetap. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah
3.7.3 Prosedur Skrining Fitokimia Simplisia dan Ekstrak Daun Psidium guajava L
Penentuan golongan senyawa kimia skrining fitokimia dilakukan pemeriksaan senyawa golongan alkaloid, flavonoid, glikosida, glikosida antrakuinon (Depkes RI, 1995), saponin, tanin (Farnsworth, 1966), dan steroid/triterpenoid (Harborne, 1987).
a. Pemeriksaan alkaloid
Serbuk simplisia/ekstrak ditimbang sebanyak 0,5 g kemudian ditambahkan 1 mL asam klorida 2 N dan 9 mL air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan, dan disaring. Filtrat yang diperoleh dipakai untuk tes alkaloid. Diambil 3 ta-bung reaksi, lalu ke dalamnya dimasukkan 0,5 mL filtrat. Pada masing-masing tabung reaksi:
a. ditambahkan 2 tetes pereaksi Mayer. b. ditambahkan 2 tetes pereaksi Bouchardat. c. ditambahkan 2 tetes pereaksi Dragendorff.
Alkaloid positif jika terjadi endapan atau kekeruhan pada dua dari tiga percobaan di atas (Depkes RI, 1995).
b. Pemeriksaan flavonoid
0,1 g serbuk magnesium dan 1 mL asam klorida pekat dan 2 mL amil alkohol, dikocok dan dibiarkan memisah. Flavonoid positif jika terjadi warna merah atau kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1966).
c.Pemeriksaan glikosida
Serbuk simplisia/ekstrak ditimbang sebanyak 3 g, lalu disari dengan 30 mL campuran etanol 96% dengan air (7:3) dan 10 mL asam klorida 2 N, direfluks selama 2 jam, didinginkan dan disaring. Diambil 20 mL filtrat ditambahkan 25 mL air suling dan 25 mL timbal (II) asetat 0,4 M, dikocok, didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 mL campuran isopropanol dan kloroform (2:3), dilakukan berulang sebanyak 3 kali. Sari air dikumpulkan dan diuapkan pada temperatur tidak lebih dari 50٥C. Sisanya dilarutkan dalam 2 mL metanol. Larutan sisa digunakan untuk percobaan berikut: 0,1 mL larutan percobaan dimasukan dalam tabung reaksi dan diuapkan di atas penangas air. Pada sisa ditambahkan 2 mL air dan 5 tetes pereaksi Molish. Kemudian secara perlahan-lahan ditambahkan 2 mL asam sulfat pekat melalui dinding tabung, terbentuknya cincin berwarna ungu pada batas kedua cairan menunjukkan ikatan gula (Depkes RI, 1995).
d.Pemeriksaan saponin
Serbuk simplisia/ekstrak ditimbang sebanyak 0,5 g, dimasukan ke dalam tabung reaksi, lalu ditambahkan 10 mL air panas, didinginkan kemudian dikocok kuat selama 10 detik. Jika terbentuk busa setinggi 1-10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2 N, menunjukan adanya saponin (Depkes RI, 1995).
e. Pemeriksaan tanin
Serbuk simplisia/ekstrak ditimbang sebanyak 1 g, dididihkan selama 3 menit dalam 100 mL air suling lalu didinginkan dan disaring. Pada filtrat ditambahkan 1-2 tetes peraksi besi (III) klorida 1%. Jika terjadi warna biru kehitaman atau hijau kehitaman, menunjukan adanya tanin (Farnsworth, 1966).
f.Pemeriksaan steroid/triterpenoid
beberapa tetes pereaksi Liebermann-Burchard. Timbulnya warna biru atau biru hijau menunjukan adanya steroid, sedangkan warna merah, merah muda atau ungu menunjukkan adanya triterpenoid (Harborne, 1987).
3.7.4 Prosedur Pembuatan Gel Ekstrak Daun Psidium guajava L
Setiap 100 gram basic gel terdiri dari formula dasar gel dan gel ekstrak daun Psidium guajava L. Formulasi dasar gel terdiri dari:
R/ CMC-Na 25 gram
Aquades q.s ad 1000 gram
Cara pembuatannya: taburkan Caboxy Methyl Cellulose (CMC-Na) pada air panas sebanyak 20 kalinya. Kemudian campuran tersebut didiamkan selama 30 menit. Selanjutnya massa tersebut dipindahkan ke dalam mortal dan digerus hingga homogen. Sisa aquades ditambahkan dan digerus kembali hingga homogen.
Formulasi gel ekstrak DJB 3% terdiri dari: R/ ekstrak P. guajava L. 30 gram
Basic gel q.s ad 1000 gram
Cara pembuatannya: masukkan ekstrak DJB sebanyak 30 gram ke dalam mortar dan diencerkan dengan etanol 96% beberapa tetes. Selanjutnya sedikit demi sedikit basic gel ditambahkan dan dierus sehingga terbentuk massa yang homogen.
Formulasi gel ekstrak DJB 5% terdiri dari: R/ ekstrak P. guajava L. 50 gram
Basic gel q.s ad 1000 gram dan, Formulasi gel ekstrak DJB 7% terdiri dari: R/ ekstrak P. guajava L. 70 gram
Basic gel q.s ad 1000 gram
Gambar 3.4. A. Alat dan bahan yang digunakan untuk pembuatan gel ekstrak DJB; B. Proses pembuatan gel ekstrak dan C. Gel ekstrak diletakkan di dalam pot opat dan diberikan nomor sesuai randomisasi
3.7.5 Prosedur Pengambilan Data Penelitian
Adapun prosedur pengumpulan data subjek penelitian terdiri dari pengambilan data orientasi gel ekstrak DJB, data subjek penelitian dan prosedur laboratorium.
3.7.5.1 Pengumpulan Data Orientasi Gel Ekstrak DJB
3.7.5.2 Pengumpulan Data Subjek Penelitian
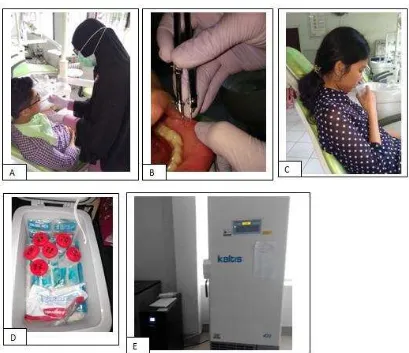
a. Pengumpulan data dilakukan di RSGM USU. Subjek diperiksa terlebih dahulu menderita SAR. Subjek yang memenuhi kriteria inklusi dan eksklusi diberikan lembar penjelasan penelitian dan ditanyakan kesediaannya untuk berpartisipasi dalam penelitian, apabila subjek bersedia, subjek diminta untuk menandatangani lembar informed consent. (Gambar 3.5A)
b. Data mengenai kondisi SAR diperoleh melalui pemeriksaan subjektif berupa anamnesis dan pemeriksaan klinis. Peneliti melakukan anamnesis untuk menanyakan ada atau tidak rasa sakit. (Gambar 3.5B)
Gambar 3.5: A. Menanyakan kesediaan subjek penelitian; B. Alat pengumpulan data subjek penelitian
c. Selanjutnya dilakukan pemeriksaan klinis melihat lokasi, ukuran dan ada tidaknya halo eritema dan dicatat pada blanko rekam medik. (Gambar 3.6A dan B)
d. Metode pengambilan saliva dilakukan dengan metode spitting yaitu saliva dibiarkan tergenang kemudian diludahkan setiap 60 detik selama 5 menit. Saliva ditampung di dalam pot saliva kemudian diberi label.(Gambar 3.6C)
penyimpanan khusus sampel. Standar operasional penyimpanan saliva adalah apabila saliva langsung dianalisis (30-90 menit setelah pengambilan sampel), sampel saliva dapat disimpan pada suhu kamar; apabila saliva dianalisis 3-6 jam setelah pengambilan sampel, sampel disimpan pada suhu 4oC; namun jika dianalisis lebih dari 1 hari sampai 1 bulan dari waktu pengambilan, sampel disimpan pada suhu -20oC dan akan lebih baik lagi jika disimpan pada suhu -80oC. (Gambar 3.6E)
Gambar 3.6: A. Pemeriksaan terhadap SAR tipe minor; B. Pengukuran diameter ulser; C. Pengumpulan saliva; D. Penyimpanan saliva yang telah dikumpulkan pada coolbox; E. Penyimpanan saliva pada refrigeraor -800C.
g. Subjek diberitahukan cara mengoleskan gel daun jambu biji yaitu selapis tipis sebesar kepala cotton bud dengan arah horizontal dan diinstruksikan pula waktu pengolesan gel daun jambu biji yaitu pagi setelah sarapan, setelah makan siang dan sebelum tidur.
h. Subjek juga diinstruksikan untuk tidak makan dan minum selama 30 menit sampai 1 jam setelah pengalikasikan gel ekstrak P. guajava L. untuk memaksimalkan kerja daun jambu biji pada SAR.
i. Pencatatan tanggal pemberian obat kepada subjek dilakukan pada rekam medis penelitian.
j. Subjek diminta untuk hadir kembali setiap 3 hari pertama (kontrol 1) dan 3 hari berikutnya (kontrol 2). Dilakukan anamnesis kembali untuk melhat tingkat rasa sakit, pemeriksaan klinis terhadap ada tidaknya halo eritema dan ukuran ulser.
k. Pencatatan hasil pengamatan kembali dilakukan pada rekam medis penelitian.
3.7.5.3 Prosedur Laboratorium
a. Penetapan kandungan flavonoid ekstrak etanol P guajava L. menggunakan metode kolorimetri aluminium klorida dengan pegukuran absorbansi secara spektrofotometer (Chang, dkk., 2002) dan sebagai satandar digunakan kuersetin.
Pembuatan larutan induk baku kuersetin: larutan kuersetin dibuat dengan konsentrasi 100 µg/ml dengan cara sebanyak 1 mg kuersetin dilarutkan dalam 10 ml metanol pro analysis.
Penentuan panjang gelombang maksimum kuersetin: Larutan kuersetin dengan konsentrasi 100 µg/ml diambil sebanyak 2 ml dan dimasukkan ke dalam labu tentukur. Diatambahkan 0,1 ml AlCl3 dan 0,1 ml natrium asetat. Kemudian dtambahkan akuades sebanyak 2,8 ml dan diinkubasi selama 40 menit. Ukur panjang gelombang maksimum menggunakan spektrometervisibel pada rentang 400-800 nm.
0,1 ml AlCl3 dan o,1 ml natrium asetat. Kemudian ditambahkan akuades sebanyak 2,8 ml dan diinkubasi selama 40 menit. Diukur absorbansinya pada panjang gelombang maksimum dan didapat kurva kalibrasi kuersetin serta persamaan garis linear y=ax+b. Penetapan kandungan flavonoid: Sebanyak 25 mg sampel ekstrak etanol P. guajava L dilarutkan dalam 25 ml metanol. Diambil larutan sebanyak 3 ml dan dimasukkan ke dalam labu tentukur 10 ml. Ditambahkan metanol sampai garis tanda sehingga konsentrasi larutan menjadi 300 µg/ml. Dari larutan dengan konsentrasi 300 µg/ml diambil 2 ml dan diukur dengan 2 kali pengulangan kemudian diambil 2 ml lainnya ditambahkan sebanyak 0,1 ml AlCl3, 0,1 ml natrium asetat dan 2,8 ml akuades. Ukur absorbansinya dengan menggunakan spektrofotometer visibel pada panjang gelombang 400-800 nm sebanyak 5 kali untuk satu kali pengukuran dan diambil rata-ratanya.
Kadar flavonoid ekstrak daun P guajava L. dihitung dengan menggunakan subsitusi nilai-nilai absorbansi rata-rata sampel ke dalam persamaan regresi linear yang didapat dari kurva kalibrasi untuk mengetahui konsentrasinya. Nilai konsentrasi sampel yang didapat kemudan disubsitusikan ke dalam rumus perhitungan kadar total flavonoid.
Kadar flavonoid = x. V .FP BS
Keterangan: x = Konsentrasi (µg/ml)
V = Volume larutan sampel (ekstrak) (L) FP = Faktor pengenceran larutan sampel BS = Berat sampel (g)
Kadar flovonoid didapatkan dalam satuan mg ekuivalen kuersetin/gram sampel (mg Q/g)
b. Pemeriksaan flavonoid dan pengujian kemampuan antioksidan dengan spektrofotometer visibel dengan metode penangkapan radikal bebas DPPH.
panas. Kemudian ke dalam 5 ml filtrat ditambahkan 0,1 g serbuk Mg, 1 ml asam klorida pekat dan 2 ml amil alkohol dikocok dan dibiarkan memisah. Flavonoid positif jika pada lapisan amil alkohol terjadi warna merah kekuningan atau jingga (Farnsworth, 1966).
Kemampuan antioksidan ekstrak P. guajava L. 3%, 5% dan 7% diuji dalam meredam proses oksidasi DPPH (1,1 diphenyl-2-picryl-hydrazyl) sebagai radikal bebas dalam larutan metanol (sehingga terjadi peredaman warna ungu DPPH) dengan nilai IC50 (konsentrasi sampel uji yang mampu meredam radikal bebas sebesar 50%) digunakan sebagai parameter untuk menentukan aktivitas antioksidan ekstrak P. guajava L. 3%, 5% dan 7%.
1. Pembuatan larutan blanko
Larutan DPPH 0,5 mM (konsentrasi 200 ppm) dipipet sebanyak 5 ml, kemudian dimasukkan ke dalam labu tentukur 25 ml, dicukupkan volumenya dengan metanol sampai garis tanda (konsentrasi 40 ppm).
2. Penentuan panjang gelombang serapan maksimum
Larutan DPPH konsentrasi 40 ppm dihomogenkan dan diukur serapannya pada panjang gelombang 400-800 nm.
3. Pembuatan larutan sampel uji
Sebanyak 25 mg sampel uji ditimbang kemudian dilarutkan dalam labu tentukur 25 ml dengan metanol lalu volumenya dicukupkan dengan metanol sampai garis tanda dan diperoleh larutan induk baku sampel (konsentrasi 1000 ppm). Konsentrasi ditetapkan setelah dilakukan beberapa orientasi. Larutan induk dipipet sebanyak 1,25 ml; 2,5 ml; 3,75 ml dan 5 ml ke dalam masing- masing labu tentukur 25 ml untuk mendapatkan konsentrasi larutan uji 50 ppm, 100 ppm, 150 ppm, 200 ppm, kemudian ditambahkan 5 ml larutan DPPH 0,5 mM (konsentrasi 200 ppm) lalu volumenya dicukupkan dengan metanol sampai garis tanda. Diamkan di tempat gelap selama 60 menit, lalu diukur serapannya menggunakan spektrofotometer uv-visibel pada panjang gelombang 516 nm.
Ditimbang Kuersetin sebanyak 100 mg, ditambahkan suspeni CMC Na 1% sedikit demi sedikit sambil digerus homogen, lalu diencerkan dengan suspensi CMC Na 1% hingga 20 ml.
5. Penentuan panjang gelombang serapan maksimum
Larutan DPPH konsentrasi 40 ppm dihomogenkan dan diukur serapannya pada panjang gelombang 400-800 nm dan diperoleh panjang gelombang 516 nm.
6. Penentuan operating time larutan DPPH
Waktu pengukuran (operating time) diperoleh dari hasil pengukuran larutan uji sampel P. guajava L. diukur pada panjang gelombang yang diperoleh (516 nm), diukur setiap 5 menit selama 80 menit. Sebanyak 1,25 ml larutan induk baku ekstrak etanol P. guajava L. dipipet ke dalam labu tentukur 25 ml, ditambahkan 5 ml larutan DPPH 0,5 mM lalu dicukupkan dengan metanol hingga garis tanda kemudian dihomogenkan dan selanjutnya diukur.
7. Analisis persen pemerangkapan radikal bebas
Menurut Molyneux (2004), penentuan persen pemerangkapan radikal bebas oleh sampel uji, P. guajava L. dengan Rutin sebagai pembanding, menggunakan metode pemerangkapan radikal bebas DPPH (1,1 diphenyl-2-picryl-hydrazyl).
Kemampuan antioksidan diukur sebagai penurunan absorbansi larutan DPPH (peredaman warna ungu DPPH) akibat adanya penambahan larutan uji. Nilai absorbansi larutan DPPH sebelum dan sesudah penambahan larutan uji tersebut dihitung sebagai persen peredaman.
Keterangan : A Kontrol = Absorbansi tidak mengandung sampel A Sampel = Absorbansi mengandung sampel
8. Penentuan nilai IC50
Nilai IC50 merupakan bilangan yang menunjukkan konsentrasi sampel uji (µg/ml) yang memberikan peredaman DPPH sebesar 50% (mampu menghambat/
A Kontrol - A Sampel
X 100% A Kontrol
meredam proses oksidasi sebesar 50%). Nilai 0% berarti tidak mempunyai aktivitas antioksidan, sedangkan 100% berarti peredaman total dan pengujian perlu dilanjutkan dengan pengenceran larutan uji untuk melihat batas konsentrasi aktivitasnya. Hasil perhitungan dimasukkan ke dalam persamaan regresi dengan konsentrasi ekstrak (µg/ml) sebagai absis (sumbu X) dan nilai % peredaman (antioksidan) sebagai ordinatnya (sumbu Y) (Shirwaikar dkk, 2006).
Secara spesifik, suatu senyawa dikatakan sebagai antioksidan sangat kuat jika nilai IC50 bernilai 100-150µg/ml, dan lemah jika IC50 bernilai 151-200 µg/ml (Mardawati, 2008). (Gambar 3.7)
Gambar 3.7 Spektofotometer uv-vis
c. Prosedur perhitungan Kadar Antioksidan (SOD) Saliva 1. Perlakuan terhadap sampel
Sampel saliva yang beku dipersiapkan untuk dilakukan pengujian (Gambar 3.8A). Saliva yang sudah mencair disentrifugasi 4000 rpm selama 10 menit pada suhu 4oC, bahagian atas diambil dan disimpan ke tabung kecil dengan suhu -20oC. Pemeriksaan SOD menggunakan supernatan. (Gambar 3.8B)
2. Prosedur pemeriksaan SOD (prosedur pada 96- well plate)
b. Standar. Campurkan 8 µ L Enzim SOD dengan 392 µ L zat pengencer untuk mendapatkan 3U/mL standar SOD. Standar Pengenceran seperti tabel di bawah ini
No 3U/mLSOD+Zat Pencair Standar (U/mL)
1 100 µ L + 0 µ L 3.0
2 80 µ L + 20 µ L 2.4
3 60 µ L + 40 µ L 1.8
4 40 µ L + 60 µ L 1.2
5 18 µ L + 82 µ L 0.54
6 8 µ L + 92 µ L 0.24
7 4 µ L + 96 µ L 0.12
8 0 µ L + 100 µ L 0.0
Pindahkan 20 µ L larutan SOD standar pada 8 well dari 96 well-plate tersebut, juga pindahkan 20 µL sampel pada sebagian well lainnya.
c. Reaksi. Persiapkan larutan kerja (Working reagent) untuk larutan standar SOD dan sampel. Campurkan 160 µ L Assay Buffer, 5 µ L Xanthine dan 5 µ L WST-1 ke setiap well dan diketuk ringan untuk menghomogenkan bahan-bahan tersebut. Tambahkan 160 µL working reagent (WR) untuk setiap well.
Encerkan enzim XO dengan perbandingan 1:20 zat pengencer dan dengan cepat tambahkan 20 µL pengenceran enzim XO unuk setiap well. Gunakan pipet yang multi-channel dan dihomogenkan dengan ketuk ringan. (Gambar 3.8C)
d. Pengukuran. Segera baca OD440 nm( OD 420-460 nm) (OD0) (Gambar 3.8D). Inkubasi selama 60 menit pada suhu ruangan 25oC yang gelap. Kemudian baca OD440 nm kembali (OD60) (Gambar 3.8E dan F).
a. Hitung ∆OD60 untuk setiap well baik sampel maupun standar dengan perhitungan ∆OD60 = OD60– OD0
4. Hitung ∆∆OD dengan perhitungan ∆∆OD = ∆ODstd8 -∆OD60 untuk setiap sampel dan standar yang mana ∆ODstd8 adalah ∆ODuntuk standar 8 (Standar yang diketahui tidak ada aktivitas SOD dan kemungkinan absorbansi yang tinggi)
5. Buatlah ilustrasi kurva standar ∆∆OD sebagai sumbu Y dan SOD (U/mL) sebagai sumbu X. Gambarkan ∆∆OD sampel untuk menentukan aktivitas SOD sampel dari kurva standar tersebut.
Gambar 3.8: C. Proses pipeting dengan menggunakan multichannel pipettor; D. Mesin Spketro Uv-vis; E. Inkubasi selama 60 menit; F. Perubahan warna sampel saliva well-plate
3.8 Etika Penelitian
Etika penelitian mencakup hal-hal yaitu:
a.Persetujuan Komisi Etik (Ethical Clearance)
Peneliti mengajukan lembar persetujuan pelaksanaan penelitian kepada Komisi Etik Penelitian Kesehatan di Fakultas Kedokteran Universitas Sumatera Utara berdasarkan ketentuan etika yang bersifat internasional maupun nasional.
b.Lembar Persetujuan (Informed Consent)
c.Kerahasiaan (Confidentially)
Data yang terkumpul dalam penelitian ini dijamin kerahasiaannya oleh peneliti karena data yang akan ditampilkan dalam bentuk data kelompok dan bukan merupakan data pribadi masing-masing subjek.
3.9 Analisis Data
Analisis data dilakukan pada penelitian ini meliputi analisis univariat dan (bivariat Sastroasmoro dan Ismael, 2011),
a. Analisis Univariat yaitu :
1. Mengetahui kadar antioksidan ekstrak P. guajava L
2. Mengetahui rata-rata kadar SOD saliva penderita SAR minor sebelum diberikan pengobatan
3. Mengetahui rata-rata kadar SOD saliva penderita SAR minor setelah diberikan pengobatan ekstrak P. guajava L
4. Rata-rata rasa sakit, ukuran ulser pada saat base line, kontrol 1 dan kontrol-2.
b.Analisis Satistik yaitu:
Metode yang digunakan untuk mengetahui distribusi data pada penelitian ini adalah dengan Saphiro-wilk dengan kriteria sebaran p>0,05 dan jumlah sampel (n) ≤50. Berdasarkan hasil distribusi data, analisis statistik yang dilakukan pada penelitian ini yaitu:
1. Analisis efek pemberian ekstrak terhadap ukuran ulser pada pasien SAR tipe minor kelompok perlakuan dibandingkan dengan kelompok plasebo menggunakan uji Annova repeated
3. Analisis efek pemberian ekstrak terhadap eritema halo pada pasien SAR tipe minor kelompok perlakuan dibandingkan dengan kelompok plasebo menggunakan uji Mc Nemar
4. Rata-rata kadar SOD saliva pada pasien SAR tipe minor sebelum perawatan pada setiap kelompok
5. Analisis efek pemberian ekstrak terhadap kadar SOD saliva pada pasien SAR tipe minor pada kelompok perlakuan dibandingkan dengan kelompok plasebo pada saat kontrol ke-2 (setelah 6 hari pemberian ekstrak) menggunakan uji T berpasangan
BAB 4
HASIL PENELITIAN
4.1 Identifikasi Tanaman
Hasil identifikasi/determinasi tanaman yang dilakukan di Herbarium Medanense, Universitas Sumatera Utara menunjukkan sampel sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta Class : Dicotyledonae Ordo : Myrtales Famili : Myrtaceae Genus : Psidium Spesies : Psidium guajava L. Nama Lokal : Jambu Biji.
Surat hasil identifikasi/determinasi tanaman terlampir.
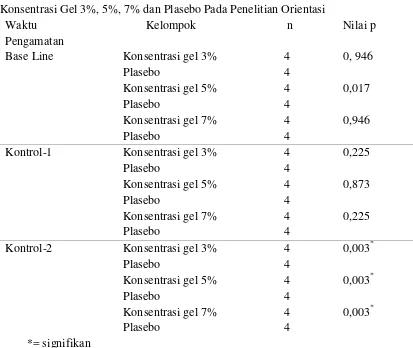
4.1. Orientasi Penelitian Penentuan Persentasi (%) Gel Ekstrak
Tabel 4.1 Analisis Pengurangan Diameter Ulser Perbandingan Antar Kelompok Konsentrasi Gel 3%, 5%, 7% dan Plasebo Pada Penelitian Orientasi
Waktu
4.3 Karakteristik, Skrining dan Aktivitas Antioksidan Ekstrak Daun P. guajava L.
Daun P guajava L atau DJB (daun jambu biji) yang segar pada penelitian ini dikumpulkan sebanyak 5 kg dari pohon yang sama. Peneliti memeroleh daun dari jalan Luku kecamatan Pancur batu Kabupaten Deli Serdang yang merupakan tanaman khas daerah Sumatera Utara.
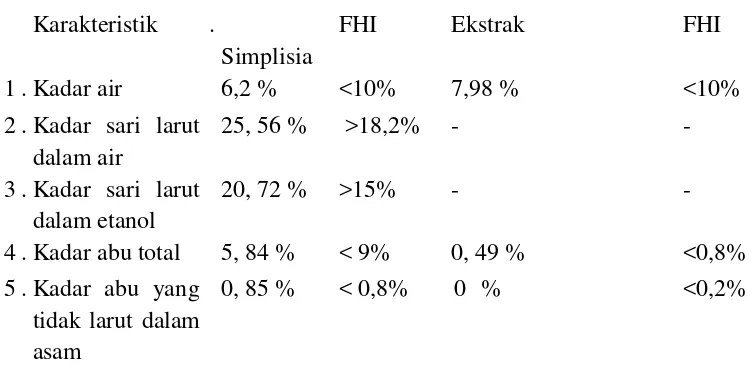
0,49 %. Karakteristik ini dibandingkan dengan karakteristik simplisia dan ekstrak daun jambu biji menurut Farmakope Herbal Indonesia (FHI) (Tabel 4.2).
Tabel 4.2 Hasil Pemeriksaan Karakteristik Simplisia dan Ekstrak 31.No Karakteristik 32.
Ekstraksi serbuk simplisia dilakukan secara maserasi. Penyarian 600 gram simplisia daun P guajava L menggunakan etanol 96% menghasilkan 44,1 gram ekstrak dengan persentase rendemen sebesar 7,35%.
Hasil skrining fitokimia menunjukkan bahwa metabolit sekunder yang terdapat pada daun P guajava L baik simplisia maupun ekstrak etanol adalah tanin, flavonoid, triterpen/steroid dan saponin tetapi tidak memiliki kandungan alkaloid (Tabel 4.3).
Menurut FHI, kadar flavonoid total pada ekstrak daun P guajava L tidak kurang dari 1,40%. Hasil perhitungan rata-rata kadar flavonoid total pada ekstrak daun P guajava L adalah 28,07 mg/g QE (2,81%).
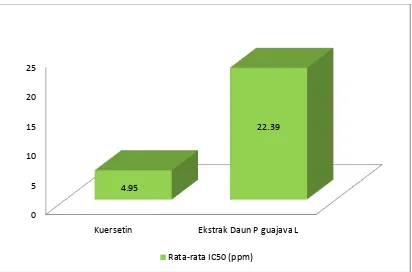
Perhitungan data absorbansi ekstrak etanol P guajava L menggunakan metode DPPH dengan angka serapan pada panjang gelombang 425 nm. Hasil rata-rata nilai IC50 kelima perlakuan sebesar 22,39 ppm. Aktivitas antioksidan ini dibandingkan dengan kuersetin dengan nilai 4,95 ppm. (Gambar 4.1). Analisis data aktivitas antioksidan mengacu pada Molyneux (2004) yang menyatakan bahwa senyawa antioksidan sangat kuat apabila nilai IC50 antara 50-100 ppm, sedang jika IC50 berkisar antara 100-150 ppm, dan lemah jika nilai IC50 berkisar antara 150-210 ppm. (Tabel 4.4). Berdasarkan analisis tersebut dapat disimpulkan bahwa ekstrak daun P guajava L memiliki aktivitas antioksidan yang sangat kuat.
Tabel 4.4 Analisis Aktivitas Antioksidan Menurut Molyneux (2004) Nilai IC50 (ppm) Aktivitas Antioksidan
50-100 Sangat Kuat
100-150 Sedang
Gambar 4.1 Diagram Batang rata-rata nilai IC50 pada kuersetin dan ekstrak daun P guajava L
4.4 Karakteristik Subjek Penelitian
Karakteristik subjek penelitian berdasarkan jenis kelamin, umur dan lokasi terjadinya SAR telah dilakukan antara kelompok perlakuan dan kelompok kontrol. Kelompok perlakuan merupakan kumpulan subjek penderita SAR minor yang diberikan gel ekstrak daun P guajava L 3%, sedangkan kelompok kontrol merupakan kumpulan subjek penderita SAR minor yang diberikan plasebo (basis gel).
Hasil penelitian menunjukkan bahwa persentase jenis kelamin perempuan 12 orang (80%) pada kelompok perlakuan dan 7 orang (46,7%) pada kelompok plasebo. Sedangkan jenis kelamin laki-laki dijumpai 3 orang (20%) pada kelompok perlakuan dan 8 orang (53,3%) pada kelompok plasebo. Berdasarkan hasil analisis uji Mc Nemar diketahui bahwa nilai p 0,125 sehingga secara statistik tidak ada perbedaan bermakna antara kelompok perlakuan dan kelompok plasebo (Tabel 4.5). Namun, berdasarkan jumlah keseluruan sampel akan didapatkan jumlah sampel berjenis kelamin perempuan 19 orang (63,33%) dan laki-laki 11 orang (36,67%).
0 5 10 15 20 25
Kuersetin Ekstrak Daun P guajava L
4.95
22.39
Tabel 4.5 Analisis Uji Mc Nemar Karakteristik Subjek Berdasarkan Jenis Kelamin Antara Kelompok Perlakuan dan Kelompok Plasebo
Kelompok Nilai p
Perlakuan Plasebo
n % n %
Jenis Kelamin
38.Perempuan 39. 12 40. 80 41. 7 42. 46,7 0,128 43.Laki-laki 44. 3 45. 20 46. 8 47. 53,3
Total 48. 15 49. 100 50. 15 51. 100
Karakteristik subjek berdasarkan umur diketahui bahwa nilai rata-rata usia pada kelompok perlakuan 26,47 ± 11,33 dan pada kelompok plasebo 21,53 ± 1,80. Hasil analisis uji t nilai p 0,117 yang menunjukkan makna bahwa tidak ada perbedaan yang bermakna berdasarkan usia pada masing-masing kelompok (Tabel 4.6).
Tabel 4.6 Analisis Uji t Karakteristik Subjek Berdasarkan Usia Antara Kelompok Perlakuan dan Kelompok Plasebo
Rata-Rata ± SD Nilai p
Umur Perlakuan (n=15) 26,47 ± 11,33 0,117
Plasebo (n=15) 21,53 ± 1,80
Tabel 4.7 Analisis Uji Two Sample Kolmogorov-Smirnov Karakteristik Subjek Berdasarkan Lokasi Terjadinya SAR Antara Kelompok Perlakuan dan Kelompok Plasebo
Kelompok Nilai p
Perlakuan Plasebo
n % n %
Lokasi SAR
Mukosa Labial
9 60 10 66,7 52.0,999
Mukosa Bukal
2 13,3 3 20
Lateral Lidah 2 13,3 0 0
Dasar Mulut 2 13,3 0 0
Mukogingiva 0 0 2 13,3
Total 15 100 15 100
4.5 Hasil Pemeriksaan Diameter Ulser, Skor Rasa Sakit dan Eritema
Halo
Rata-rata ukuran diameter ulser berturut-turut pada kelompok perlakuan saat base line, kontrol-1 dan kontrol-2 yaitu: 4,03 ± 1,07 mm; 2,16 ± 1,55 mm; dan 0,40 ± 0,73 mm. Sedangkan ukuran diameter ulser berturut-turut pada kelompok plasebo saat base line, kontrol-1 dan kontrol-2 yaitu: 3,76 ± 0,88 mm; 3,13 ± 1,57 mm; dan 2,00 ± 1,48 mm. Terdapat perbedaan yang bermakna terhadap pengurangan diameter ulser melalui uji Annova repeated pada kelompok perlakuan dibandingkan kelompok plasebo dengan nilai p 0,007 (Tabel 4.8).
Tabel 4.8 Hasil Pengukuran Rata-rata Diameter Ulser pada Saat Base line, Kontrol-1 dan Kontrol-2 Antar kelompok Perlakuan Dan Kelompok Plasebo
53.Kelompok Waktu Pengamatan 54.Rata-rata ± SD (mm) 55.Nilai P 56.Perlakuan Base line 4,03 ± 1,07 57. 0, 007*
Kontrol 1 2,16 ± 1,55
Kontrol 2 0,40 ± 0,73
58.Plasebo Base line 3,76 ± 0,88
Kontrol 1 3,13 ± 1,57
Kontrol 2 2,00 ± 1,48
*= signifikan
Gambar 4.2 Grafik pengurangan diameter ulser masing-masing kelompok pada 3 waktu pengamatan yaitu: base line, kontrol-1 dan kontrol-2.
Gambar 4.3 Grafik batang analisis hasil pengukuran rasa sakit masing-masing kelompok pada 3 waktu pengamatan yaitu: baseline, kontrol-1 dan kontrol-2
Analisis data melalui uji Friedman, diketahui bahwa pada saat base line kedua kelompok baik kelompok perlakuan maupun kelompok kontrol memiliki nilai median 3. Terdapat perbedaan pada saat kontrol-1 pada kelompok plasebo memiliki nilai median 2 sedangkan pada kelompok perlakuan kedua kelompok memiliki nilai median yang sama yaitu 1. Hasil analisis statistik uji Wilcoxon membandingkan pengurangan skor rasa sakit antara kelompok perlakuan dan kelompok plasebo baik pada saat base line, kontrol 1 dan kontrol 2 diketahui menunjukkan nilai p < 0,001 memberikan arti terdapat perbedaan yang bermakna (Tabel 4.9).
Tabel 4.9 Hasil Uji Friedman Pemeriksaan Skor Rasa Sakit pada Tiga Waktu Pengamatan Antar Kelompok Perlakuan dan Kelompok Plasebo
Pengamatan Sakit
63.Perlakuan Base line 3 (3-5) 64. <0, 001 Kontrol 1 1 (1-2)
Kontrol 2 1 (1-1) 65.Plasebo Base line 3 (3-4) Kontrol 1 2 (1-3) Kontrol 2 1 (1-2)
Uji Friedman. Nilai p pada post hoc Wilcoxon: baseline vs kontrol 1 <0,001; base line vs kontrol 2 <0,001 dan kontrol 1 vs kontrol 2 <0,001.
Tabel 4.10 Hasil Uji Mc Nemar Pemeriksaan Eritema halo pada Tiga Waktu
4.6 Hasil Pemeriksaan SOD Saliva
Pengukuran kadar SOD saliva dimulai dengan pembuatan kurva standar berdasarkan metode spektrofotometri UV-Vis dengan prosedur bioassay system (Enzy Chrom Superoxide Dismutase Assay Kit). Kurva standar diperoleh dengan mengukur absorbansi masing-masing larutan standar yaitu: 0; 0,12; 0,24; 0,54; 1,2; 1,8; 2,4; 3 U/ml pada panjang gelombang 440 nm. Nilai absorbansi setiap konsentrasi larutan standar bertutut-turut yaitu: 0; 0,0117; 0,0133; 0,0342; 0,0486; 0,0,0565; 0,0597; 0,0604 (Tabel 4.11).
Berdasarkan tabel 4.12 tersebut diperoleh kurva standar hubungan konsentrasi larutan standar SOD dengan nilai absorbansi.
Tabel 4.11 Nilai Absorbansi Standar SOD
7Konsentrasi SOD (U/ml) 8Absorbansi (440 nm)
0 0
Gambar 4.4. Kurva Larutan Standar SOD
Analisis statistik SOD saliva menggunakan uji T berpasangan diketahui rata-rata nilai SOD saliva sebelum perawatan pada kelompok perlakuan sebesar 4,06 ± 0,69 U/mL sedangkan pada kelompok plasebo 3,36 ± 0,54 (U/mL). Nilai rata-rata SOD sebelum dilakukan perawatan pada setiap kelompok diketahui terdapat
perbedaan yang bermakna setiap kelompok baik kelompok perlakuan maupun kelompok kontrol (Tabel 4.12).
Tabel 4.12 Nilai Rata-Rata SOD Saliva Sebelum Diberikan Perawatan pada Masing-Masing Kelompok Perlakuan dan Kelompok Plasebo
Nilai SOD saliva sebelum perawatan
Rata-rata ± SD (U/mL)
Nilai P
Kelompok perlakuan 4,06 ± 0,69
0,004* Kelompok kontrol 3,36 ± 0,54
*signifikan
Setelah 6 hari perlakuan didapati terjadi peningkatan level SOD saliva. Nilai rata-rata SOD saliva pada saat kontrol 2 sebesar 5,05 ± 0,79 U/mL pada kelompok perlakuan dan 4,31 ± 0,49 U/mL pada kelompok plasebo. Juga diketahui terjadinya peningkatan yang signifikan kadar SOD saliva setelah diberikan perawatan selama 6 hari enam perawatan (Tabel 4.13).
Tabel 4.13 Nilai Rata-Rata SOD Saliva Setelah Perawatan pada Hari Keenam Pada Masing-Masing Kelompok Perlakuan dan Kelompok Plasebo
Nilai SOD saliva setelah
Kelompok kontrol 4,31 ± 0,49 *= signifikan
Tabel 4.14 Perbandingan SOD Saliva Sebelum dan Sesudah Perawatan pada Kelompok Perlakuan
Nilai SOD saliva Rata-rata ± SD (U/mL)
Nilai P
BAB 5 PEMBAHASAN
Obat tradisional (OT) merupakan salah satu warisan budaya bangsa Indonesia yang telah digunakan selama berabad-abad untuk pemeliharaan dan peningkatan kesehatan serta pencegahan dan pengobatan penyakit. Salah satu jenis OT yang sering digunakan yaitu tanaman herbal. Dewasa ini penggunaan obat herbal cenderung terus meningkat, baik di negara sedang berkembang maupun di negara-negara maju. Oleh karena itu perkembangan penelitian tentang OT mencakup aspek pembuktian khasiat dan keamanannya, jaminan mutu, bentuk sediaan, cara pemberian, pengemasan dan penampilan serta teknologi produksi (Depkes RI, 2008).
Indonesia dikenal secara luas sebagai mega center keanekaragaman hayati (biodiversity) terbesar kedua setelah Brazil di dunia, yang terdiri dari tumbuhan tropis dan biota laut. Indonesia memiliki sekitar 30.000 jenis tumbuhan dan 7.000 di antaranya ditengarai memiliki khasiat sebagai obat (Hembing W, 2000). Salah satunya adalah P. guajava Linn.
5.1 Identifikasi Tanaman
Identifikasi/determinasi tanaman dilakukan di Herbarium Medanense, Universitas Sumatera Utara. Hasil identifikasi menunjukkan bahwa sampel termasuk suku Myrtaceae jenis Psidium guajava L. Hasil identifikasi tanaman dapat dilihat pada lampiran 1.
5.2 Orientasi Penelitian Penentuan Persentasi (%) Gel Ekstrak
Penelitian pendahuluan yang dilakukan pada penelitian ini berfungsi untuk menentukan % gel ekstrak yang efektif terhadap terapi SAR tipe minor. Penelitian ini dilakukan pada 16 orang pasien SAR tipe minor dengan rincian: kelompok perlakuan 1 menggunakan gel ekstrak daun P guajava L 3%, kelompok perlakuan II menggunakan gel ekstrak daun P guajava L 5%, kelompok III menggunakan gel ekstrak daun P guajava L 7% dan kelompok IV menggunakan basic gel. Jumlah sampel 4 orang untuk masing-masing kelompok. Dasar pemilihan konsentrasi 3%, 5% dan 7% berdasarkan penelitian yang dilakukan pada luka bakar di punggung mencit (Oktiarni dkk, 2012). Data yang yang dikumpulkan pada penelitian pendahuluan ini yaitu diameter ulser dengan analisis statistik uji one way Anova dengan Post Hoc Tukey HSD.
Pengumpulan data berdasarkan diameter ulser pada penelitian pendahuluan ini diketahui hasil yang signifikan untuk semua konsentrasi gel ekstrak baik 3%, 5% dan 7% yang dibandingkan dengan kelompok plasebo (basis gel) pada waktu pengamatan kontrol-2 atau 6 hari setelah pemberian ekstrak dengan nilai p 0,003. Hasil tersebut dapat dilihat pada tabel 4.1. Berdasarkan data tersebut, penulis menetapkan dosis optimum yang dapat memberikan efek penyembuhan adalah gel ektrak daun P guajava L 3%.
5.3 Karakteristik, Skrining dan Aktivitas Antioksidan Ekstrak Daun P. guajava L.
simplisia 25,56% dan kadar sari larut dalam etanol pada simplisia 20,72% keduanya memenuhi standar nilai kadar sari larut dalam air >18,2% dan kadar sari larut dalam etanol pada simplisia >15% (Depkes RI, 2008). Penentuan kadar sari sangat berguna untuk memberikan gambaran tentang banyaknya bahan yang terlarut dari simplisia.
Kadar abu total pada simplisia 5,84% dan kadar abu yang tidak larut dalam asam pada simplisia sebesar 0,85 %. Pemeriksaan kadar abu total simplisia memenuhi standar nilai <9%, sedangkan kadar abu yang tidak larut dalam asam sedikit di atas nilai standar <0,8% (Depkes RI, 2008). Kadar abu total dan kadar abu yang tidak larut dalam asam pada ekstrak etanol sebesar 0,49 % dan 0%. Pemeriksaan kadar abu total ektrak memenuhi standar <0,8% dan kadar abu yang tidak larut dalam asam pada ekstrak <0,2% (Depkes RI, 2008). Penetapan kadar abu bertujuan untuk mengetahui jumlah pengotor pada simplisia dan ekstrak. Abu yang tersisa setelah pembakaran berupa abu fisiologis yang berasal dari jaringan tanaman itu sendiri dan abu non fisiologis merupakan residu pengaruh dari luar seperti pasir dan tanah yang menempel pada sampel. Penetapan kadar abu dalam asam dimaksudkan untuk mengetahui jumlah silikat khususnya pasir yang terdapat pada simplisia dan ekstrak dengan cara melarutkan abu total menggunakan asam klorida. Semakin rendah kadar abu maka mutu simplisia dan ekstrak semakin baik (WHO, 1992). Persayaratan mutu simplisia dan ekstrak daun P guajava L sebagian besar memenuhi monografi tanaman di dalam buku Farmakope Herbal Indonesia (FHI). Oleh karena itu gel ektrak daun P guajava L dapat dijadikan obat tradisional terstandar.
Ekstraksi serbuk simplisia dilakukan secara maserasi. Penyarian 600 gram simplisia daun P guajava L menggunakan etanol 96% menghasilkan 44,1 gram ekstrak dengan persentase rendemen sebesar 7,35%. Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair (Depkes RI, 2000).
mengandung senyawa flavonoid. Menurut Depkes RI (2008), kadar flavonoid total pada ekstrak daun P guajava L tidak kurang dari 1,40%. Hasil perhitungan rata-rata kadar flavonoid total pada ekstrak daun P guajava L penelitian ini adalah 28,07 mg/g QE (2,81%). Hasil ini menunjukkan bahwa daun P guajava L memiliki kandungan flavonoid yang sangat besar.
Flavonoid adalah sekelompok besar senyawa polifenol tanaman. Berbagai sayuran dan buah-buahan yang dapat dimakan mengandung sejumlah flavonoid. Konsentrasi yang lebih tinggi berada pada daun dan kulitnya dibandingkan dengan jaringan yang lebih dalam (Winarsi, 2007). Sebagai antioksidan, flavonoid dapat menghambat penggumpalan keping-keping sel darah, merangsang produksi nitrit oksida dan menghambat pertumbuhan sel kanker. Selain berfungsi sebagai penangkap radikal bebas, flavonoid juga berfungsi sebagai hepatoprotektif, antitrombotik, antiinflamasi dan antivirus. Sifat antiradikal flavonoid terutama terhadap radikal hidroksil, anion superoksida, radikal peroksil dan alkoksil (Winarsi, 2007). Kuersetin merupakan senyawa flavonoid yang paling tinggi pada daun P guajava L. Flavonoid mengamankan sel dari serangan senyawa oksigen reaktif seperti oksigen singlet, superoksida, radikal peroksil, radikal hidroksil dan peroksinitrit.
kontrol DPPH (tanpa penambahan larutan uji). Terdapat penurunan nilai absorbansi DPPH yang diberi larutan uji pada setiap kenaikan konsentrasi dibandingkan absorbansi kontrol. Nilai absorbansi setiap konsentrasi dapat dilihat pada lampiran. Penurunan absorbansi yang semakin besar menunjukkan aktivitas antioksidan yang semakin besar pula. Penurunan nilai absorbansi inilah yang menunjukkan adanya aktivitas antioksidan dari sampel (Molyneux, 2004)
Nilai IC50 merupakan bilangan yang menunjukkan konsentrasi sampel uji (μg/ml) yang memberikan peredaman DPPH sebesar 50% (mampu menghambat/meredam proses oksidasi sebesar 50%). Hasil rata-rata nilai IC50 kelima perlakuan sebesar 22,39 ppm. Aktivitas antioksidan ini dibandingkan dengan kuersetin dengan nilai 4,95 ppm. Kuersetin adalah suatu senyawa flavonoid yang berpotensi sebagai antioksidan yang mana gugus hidroksilnya mampu menangkap langsung radikal bebas. Analisis data aktivitas antioksidan mengacu pada Molyneux (2004) yang menyatakan bahwa senyawa antioksidan sangat kuat apabila nilai IC50 antara 50-100 ppm, sedang jika IC50 berkisar antara 100-150 ppm, dan lemah jika nilai IC50 berkisar antara 150-210 ppm. Berdasarkan analisis tersebut dapat disimpulkan bahwa ekstrak daun P guajava L memiliki aktivitas antioksidan yang sangat kuat. Nilai IC50 diperoleh berdasarkan persamaan regresi linear yang didapatkan dengan cara memplot konsentrasi latutan uji dan persen peredaman DPPH sebagai parameter aktivitas antioksidan, dimana konsentrasi larutan uji (ppm) sebagai absis dan nilai persen peredaman sebagai ordinat. Persamaan regresi dan perhitungan nilai IC50 dapat dilihat pada lampiran.
5.4 Karakteristik Subjek Penelitian
Karakteristik subjek penelitian berdasarkan jenis kelamin, umur dan lokasi terjadinya SAR telah dilakukan antara kelompok perlakuan dan kelompok kontrol. Kelompok perlakuan merupakan kumpulan subjek penderita SAR minor yang diberikan gel ekstrak daun P guajava L 3%, sedangkan kelompok kontrol merupakan kumpulan subjek penderita SAR minor yang diberikan plasebo (basis gel).
Hasil penelitian ini diperoleh penderita SAR tipe minor berjumlah 32 orang namun dua orang drop out karena subjek tidak dapat datang sesuai jadwal yang ditentukan untuk kontrol sehingga jumlah total subjek penelitian sebanyak 30 orang. Berdasarkan jenis kelamin, hasil penelitian menunjukkan bahwa tidak ada perbedaan bermakna antara kelompok perlakuan dan kelompok plasebo. Hal ini memberikan gambaran bahwa sampel pada kedua kelompok tersebut homogen. Namun, jika dilihat berdasarkan keseluruhan sampel diketahui bahwa jumlah sampel berjenis kelamin perempuan 19 orang (63,33%) dan laki-laki 11 orang (36,67%). Beberapa literatur menyatakan bahwa SAR lebih sering dijumpai pada perempuan dibandingkan laki-laki. Hal ini disebabkan adanya pengaruh hormonal dan stress (Patil, 2014 dan Sumintarti, 2012). Suatu studi melaporkan terjadinya peningkatan stress oksidatif dapat menyebabkan meningkatnya kadar estrogen pada saat menstruasi yang memengaruhi fluktuasi hormonal. Superoksida memainkan peranan dalam pembuluh darah dan aliran menstruasi yang berdampak pada pelepasan prostaglandin menyebabkan dismenorhoe (Agarwal dkk, 2012).
menetralkannya maka kelebihan radikal bebas sangat potensial menyebabkan kerusakan sel (Suarsana, 2013). Kerusakan sel ini disebut kerusakan oksidatif yaitu kerusakan biomolekul penyusun sel. Adanya peningkatan stres oksidatif berdampak pada kerusakan pada membran lipid, kerusakan DNA dan protein, oksidasi enzim dan menstimulasi terlepasnya sitokin proinflamasi (Avci dkk, 2014).
Berdasarkan lokasi terjadinya SAR yang paling banyak terjadi pada mukosa labial 9 orang (60%) pada kelompok perlakuan dan 10 orang (66,7%) pada kelompok plasebo. Secara keseluruhan lokasi yang paling banyak terjadinya SAR minor yaitu mukosa labial 19 orang (63,33%). Hal ini disebabkan karena mukosa labial merupakan mukosa non keratin yang tipis sehingga kemampuan barrier mukosa yang lebih rendah akibatnya rentan terhadap iritasi (Neville, 2008).
5.5 Hasil Pemeriksaan Diameter Ulser, Skor Rasa Sakit dan Eritema
Halo
SAR tipe minor merupakan inflamasi pada mukosa rongga mulut yang ditandai dengan ulser yang berulang dan tidak berhubungan dengan penyakit sistemik (Greenberg dkk, 2008). SAR ditandai dengan ulser berbentuk oval (bulat) dengan diameter <1 cm, berwarna putih kelabu dikelilingi batas eritema halo dan menimbulkan gejala sangat sakit (Guallar dkk, 2014). Perawatan SAR diarahkan kepada mengurangi simtom dan mempercepat masa penyembuhan (Babaee dkk, 2014).
penyembuhan SAR berupa pengurangan diameter ulser (bentuk inflamasi), perubahan ada/tidaknya eritema halo (rubor) dan rasa nyeri (dolor) pada penelitian ini.
Rata-rata pengurangan ukuran diameter ulser berturut-turut pada kelompok perlakuan saat base line 4,03 ± 1,07 mm dan menjadi 0,40 ± 0,73 mm pada pertemuan ketiga setelah 6 hari penggunaan ekstrak. Sedangkan rata-rata ukuran diameter ulser pada kelompok plasebo saat base line 3,76 ± 0,88 mm dan berkurang menjadi 2,00 ± 1,48 mm pada pertemuan ketiga (Gambar 4.2). Terdapat perbedaan yang bermakna terhadap pengurangan diameter ulser melalui uji Annova repeated pada kelompok perlakuan dibandingkan kelompok plasebo dengan nilai p 0,007 (Tabel 4.8). Hal ini membuktikan bahwa daun P guajava L efektif mengurangi proses inflamasi.
Begitu juga dengan eritema halo yang merupakan tanda peradangan pada mukosa rongga mulut. Hasil penelitian ini terjadi pengurangan jumlah subjek yang signifikan terhadap eritema halo pada kelompok perlakuan yang semula keseluruhan subjek (15 orang) terdapat eritema halo berkurang menjadi 4 orang (26,7%) pada tiga hari perawatan dan tidak ada lagi subjek yang mengalami eritema halo pada enam hari perawatan. Uji Mc Nemar bahwa nilai p < 0,001 menunjukkan perbandingan hubungan yang bermakna terhadap pengurangan eritema halo antar kelompok baik pada saat base line dengan kontrol 1, pada saat base line dengan kontrol-2 maupun pada saat kontrol-1 dengan kontrol-2. (Tabel 4.11) Berdasarkan hasil uji ini disimpulkan bahwa ekstrak daun P guajava L efektif sebagai antiinflamasi.
dan kontrol 2 diketahui menunjukkan nilai p < 0,001 memberikan arti terdapat perbedaan yang bermakna. Fase penyembuhan SAR tipe minor dimulai pada hari ke-10 (Guallar, dkk., 2014; Boras, dan Savage, 2007)). Secara keseluruhan hasil penelitian ini menunjukkan bahwa diameter ulser, skor rasa sakit dan eritema halo berkurang signifikan pada hari keenam pengobatan dibandingkan kelompok kontrol sehingga dapat disimpulkan bahwa ekstrak daun P guajava L efektif sebagai antiinflamasi dan analgesik.
Daun P guajava L digunakan secara tradisional baik di dunia seperti Amerika latin, Afrika Barat, Afrika Tengah dan sebagain besar Asia maupun di Indonesia khususnya (HM Burkill, 1997). Khasiat daun P guajava L yang diketahui yaitu sebagai antidiabetes, antidiare, antimikroba, antioksidan, antitusif, antikanker dan antiinflamasi (Rishika dan Sharma, 2012). Aktivitasnya sebagai antiinflamasi dapat mempercepat masa penyembuhan dengan menghambat proses peradangan. Hal ini disebabkan karena kandungan polifenol (flavonoid, tanin, kuersetin) dan triterpenoid (Rishika dan Sharma, 2012; Denny dkk, 2013; Dutta dan Das, 2010). Ekstrak daun P guajava L efektif dalam mengurangi edema pada kulit tikus baik pada inflamasi akut dan kronis (Dutta dan Das, 2010). Menurut Oktiarni dkk (2012) diketahui bahwa ekstrak daun P guajava L dalam bentuk gel efektif terhadap penyembuhan luka bakar pada mencit bahwa semakin besar persentase gel semakin cepat pula masa penyembuhan.
membeku sehingga permukaan radang ditutupi lapisan nekrotik berwarna putih/ kuning kelabu. Lapisan ini dinamakan pseudomembran (Baratawidjaja dan Rengganis, 2012; Hirmawan, 1973).
Kemampuan flavonoid sebagai antiinflamasi berhubungan erat dengan peran antioksidan. Secara in vitro, flavonoid merupakan inhibitor yang kuat terhadap peroksidasi lipid, sebagai penangkap spesies oksigen dan nitrogen yang reaktif, dan juga mampu menghambat aktivitas enzim lipooksigenase dan siklooksigenase (Rohman dan Riyanto, 2005). Selain khasiat anntiinflamasi dan antioksidan, peran saponin dalam pembentukan kolagen juga turut andil dalam mempercepat proses penutupan luka (Oktiarni, 2012). Diduga saponin bersama dengan tanin merangsang terbentuknya pembuluh-pebuluh darah kapiler yang kaya akan fibroblast sehingga dengan cepat membentuk kolagen (Fatimatuzzahroh dkk, 2015).
Penyembuhan SAR juga didukung oleh perawatan penunjang dengan pencegahan infeksi sekunder. Infeksi sekunder dapat terjadi karena mikroorganisme di dalam rongga mulut menjadi patogen akibat kebersihan rongga mulut yang buruk. Ekstrak daun P. guajava L telah terbukti secara invitro dan invivo sebagai agen antiplak. Ekstrak etanol daun P guajava L efektif dalam menghambat kemampuan adhesi Streptococcus sanguinis, Streptococcus mitis dan Actinomyces sp. Pada permukaan gigi sebagai tahap awal pertumbuhan plak (Fathilah, 2011).
5. 6 Hasil Pemeriksaan SOD Saliva
Superoksida Dismutase (SOD) merupakan antioksidan primer (endogenus) atau disebut juga antioksidan enzimatis yang dapat memberikan atom hidrogen secara cepat kepada senyawa radikal, kemudian radikal antioksidan yang terbentuk segera berubah menjadi senyawa yang lebih stabil. Enzim SOD berfungsi sebagai katalisator reaksi dismutase dari anion superoksida menjadi hidrogen peroksida (H2O2) dan oksigen (O2). Sebagian besar SOD berada intraseluler sebagai imun seluler dan terdapat pada plasma maupun saliva. SOD melindungi sel-sel tubuh dan mencegah terjadinya inflamasi yang diakibatkan oleh radikal bebas (Winarsi, 2007).
Superoxide Dismutase Assay Kit) pada panjang gelombang 440 nm. Metode ini berdasarkan pada prinsip kolorimetri untuk penentuan aktivitas enzim SOD dalam sampel biologi secara kuantitatif. Superoksida (O2-) dihasilkan oleh reaksi katalis xanthine oxidase (XO) pada saat pengujian. O2- bereaksi dengan pewarna WST-1 untuk membentuk produk warna sehingga SOD mengumpulkan O2- oleh karena itu berkurangnya O2- berguna untuk reaksi kromogenik. Intensitas warna (OD440nm) digunakan untuk menentukan aktivitas SOD di dalam sampel. Semakin tinggi absorbansi yang diperoleh (∆∆OD)maka semakin tinggi aktivitas SOD. (Bioassay systems, 2012).
Berdasarkan kurva standar (kalibrasi) diperoleh nilai r2 yang bekisar antara 0 sampai 1 untuk menunjukkan seberapa dekat nilai perkiraan untuk analisis regresi yang mewakili data yang sebenarnya. Persamaan garis regresi yang dihasilkan y=0,034ln(x) – 0,003 dengan nilai r2= 0,961. Aktivitas SOD dihitung dengan mensubsitusikan nilai absorban (y) sampel pada panjang gelombang 440 nm ke dalam persamaan garis regresi logaritma y = a ln(x)+b sehingga diperoleh nilai aktivitas SOD (x).
Analisis statistik SOD saliva menggunakan uji T berpasangan diketahui setelah 6 hari perlakuan didapati terjadi peningkatan yang signifikan nilai SOD saliva pada kelompok perlakuan dibandingkan kelompok plasebo dengan nilai p = 0,005. Nilai rata-rata SOD saliva sebelum perawatan pada kelompok perlakuan sebesar 4,06 ± 0,69 U/mL menjadi 5,05 ± 0,79 U/mL pada saat kontrol kedua sedangkan pada kelompok plasebo nilai rata-rata SOD saliva 3,36 ± 0,54 (U/mL) pada saat base line dan meningkat meningkat 4,31 ± 0,49 U/mL. (Tabel 4.14)
dkk., 2003; Karincaoglu, dkk., 2005). Namun, terdapat perbedaan pada masing-masing hasil penelitian tersebut tentang kadar SOD penderita SAR. Beitollahi dkk (2010) dan Gupta dkk (2014) menyebutkan terjadinya penurunan jumlah SOD pada plasma darah penderita SAR yang bermakna jika dibandingkan dengan kelompok kontrol tanpa SAR sedangkan Cimen dkk (2003) melaporkan tidak terdapat hubungan yang signifikan terhadap kadar SOD plasma pada penderita SAR dibandingkan kelompok kontrol tanpa SAR. Perbedaan ini mungkin disebabkan oleh beberapa faktor seperti jumlah sampel, prosedur atau metode penelitian dalam pemeriksaan antioksidan, perbedaan gaya hidup pada masing-masing populasi juga makanan dan ketidakseimbangan nutrisi pada individu (Gupta, dkk., 2014).
Patogenesis SAR diduga mencakup mekanisme respon imun yang melibatkan produksi sel T, interleukin dan TNF-α yang merupakan sitokin proinflamasi. Perubahan juga dilaporkan terjadi pada elemen sistem pertahanan saliva seperti enzim superoksida dismutase (Beguerie dan Sabas, 2015). Mekanisme radikal bebas dalam menyebabkan kerusakan jaringan pada SAR yaitu dengan menstimulasi pelepasan sitokin proinflamasi oleh monosit dan makrofag. Sitokin diketahui memainkan peran utama dalam menginduksi respon inflamasi (Beitollahi dkk, 2010; Karincaoglu dkk, 2004).
Berdasarkan analisis data perkelompok, pada kelompok perlakuan didapati peningkatan level SOD saliva pada 6 hari setelah perlakuan dibandingkan pada saat base line yang sebelumnya 4,06 ± 0, 69 U/mL menjadi 5,05 ± 0, 79 U/mL (Tabel 4.15). Jika dibandingkan data sebelum dan sesudah perawatan maka dihasilkan ada hubungan yang bermakna (p = 0,000) sebelum dan sesudah dilakukan perawatan pada kelompok perlakuan.
kerusakan struktur protein dan DNA, proses oksidasi enzim dan menstimulai lepasnya sitokin mediator inflamasi (Avci, dkk., 2014).
Peningkatan jumlah SOD yang signifikan pada hari keenam perawatan sejalan dengan penyembuhan SAR tipe minor. Hal ini membuktikan bahwa kadar SOD saliva menggambarkan hubungan yang positif terhadap perbaikan jaringan atau berkurangnya inflamasi. Berdasarkan penelitian ini diketahui jumlah flavonoid total pada ekstrak 2,81 % dengan aktivitas antioksidan ektrak etanol berada pada level sangat kuat memengaruhi peningkatan SOD saliva dibandingkan kelompok kontrol. Flavonoid dapat menginduksi antioksidan seluler, menghambat kerja enzim xantin oksidase dan protein kinase C yang memproduksi radikal anoin superoksida (O2-) juga menghambat enzim siklooksigenase, lipooksigenase yang berperan dalam proses inflamasi (Pieta, 2000; Karincaoglu dkk, 2004; Yi Zhang dkk, 2002). Peran flavonoid yang menghambat proses peroksidasi lemak inilah yang berfungsi mengurangi radikal bebas sehingga dapat menghambat kematian jaringan, meningkatkan vaskularisasi, kolagen, mencegah kerusakan sel dan meningkatkan sintesa DNA (Fatimatuzzahroh, 2015).
BAB 6
KESIMPULAN DAN SARAN
6.1 Kesimpulan
Kesimpulan yang diperoleh dari penelitian ini adalah:
a. Ekstrak daun Psidium guajava L memiliki aktivitas antioksidan yang sangat kuat dan kandungan flavonoid total yang tinggi
b. Ekstrak etanol daun Psidium guajava L 3% efektif dalam menurunkan diameter ulser ulser pada penderita SAR minor
c. Ekstrak etanol daun Psidium guajava L 3% efektif dalam menurunkan skor rasa sakit pada penderita SAR minor
d. Ekstrak etanol daun Psidium guajava L 3% efektif terhadap eritema halo pada penderita SAR minor
e. Terdapat perbedaan bermakna kadar Superoksida Dismutase (SOD) saliva antara kelompok perlakuan dan kelompok kontrol pada saat sebelum perawatan
f. Terdapat pengaruh bermakna ekstrak etanol daun P guajava L 3% dalam meningkatkan kadar SOD saliva pada kelompok perlakuan dibandingkan kelompok kontrol
g. Ekstrak etanol daun Psidium guajava L efektif meningkatkan kadar SOD saliva setelah pengobatan (hari ke-6) dibandingkan sebelum pengobatan
6.2 Saran
Adapun saran yang dapat diberikan berdasarkan penelitian ini adalah:
a. Melakukan isolasi dan identifikasi terhadap jenis senyawa flavonoid yang terkandung dalam ekstrak daun P guajava L
b. Melakukan penelitian lebih lanjut tentang mekanisme antioksidan terhadap perubahan sel