Ikan bandeng merupakan salah satu jenis ikan budidaya air payau yang potensial dikembangkan. Jenis ikan ini mampu mentolelir salinitas perairan yang luas (0-158 ppt) sehingga digolongkan sebagai ikan euryhaline. Ikan bandeng
mampu beradaptasi terhadap perubahan lingkungan seperti suhu, pH, dan kekeruhan air serta tahan terhadap serangan penyakit (Ghufron & Kardi 1997).
Menurut Bagarinao (1994) ikan bandeng memiliki hubungan yang erat dengan ikan-ikan yang hidup di air tawar. Ikan bandeng diduga berasal dari wilayah Eropa dan Amerika Utara serta melakukan migrasi ke wilayah laut tropis. Saat ini ikan bandeng lebih banyak ditemukan pada daerah tropis.
Klasifikasi ikan bandeng menurut Saanin (1984) adalah sebagai berikut: Filum : Chordata
Sub filum : Vertebrata Kelas : Pisces Sub kelas : Teleostei Ordo : Malacopterigii Family : Chanidae Genus : Chanos
Spesies : Chanos chanos Forskal
Ikan bandeng mempunyai badan yang memanjang seperti terpedo dengan sirip ekor bercabang sebagai tanda bahwa ikan bandeng tergolong sebagai perenang cepat. Kepala ikan bandeng tidak bersisik, mulut kecil terletak di ujung
rahang tanpa gigi, lubang hidung terletak di depan mata. Mata diliputi oleh selaput bening (subcutaneus). Warna badan putih keperak-perakan dan
punggung biru kehitaman (Ghufron & Kardi 1997). Morfologi ikan bandeng secara lengkap disajikan pada Gambar 1.
Gambar 1 Morfologi ikan bandeng (Chanos chanos Forskal) Sumber : Oceanleader (2009)
Di Indonesia, ikan bandeng dapat dengan mudah ditemukan di daerah Sumatra Selatan, Borneo, Jawa, dan Sulawesi. Ikan bandeng mempunyai komposisi zat gizi yang cukup tinggi. Komposisi kimia ikan bandeng disajikan pada Tabel 1.
Tabel 1 Komposisi kimia ikan bandeng segar
Komponen kimia Kadar (%)
Air 74,00 Protein 20,00 Lemak 4,80 Abu 1,19
Sumber : Saparinto et al. (2006)
2.2 Deskripsi dan Klasifikasi Ikan Patin (Pangasius hypophthalmus)
Ikan patin memiliki badan memanjang berwarna putih seperti perak dengan punggung berwarna kebiru-biruan. Kepala ikan patin relatif kecil dengan mulut terletak di ujung kepala agak di sebelah bawah yang merupakan ciri khas golongan cat fish. Sirip punggung patin memiliki sebuah jari-jari keras yang
berubah menjadi patil yang bergerigi dan besar. Habitat asli ikan patin adalah di sungai-sungai besar dan muara sungai. Ikan patin termasuk ke dalam ikan dasar (demersal) (Susanto & Amri 1996).
Ikan patin sangat toleran terhadap derajat keasaman (pH) air. Artinya ikan ini dapat bertahan hidup pada kisaran pH air yang luas, yaitu dari perairan yang agak asam (pH 5) sampai perairan yang basa (pH 9). Kandungan oksigen terlarut yang dibutuhkan adalah berkisar antara 3-6 ppm, sementara karbondioksida yang bisa ditolerir berkisar antara 9-20 ppm (Khairuman & Suhenda 2002). Pada bidang perikanan dan jasa boga, ikan ini dikenal sebagai komoditi yang
berprospek cerah, rasa dagingnya lezat dan gurih mengakibatkan harga jual ikan patin tinggi (Susanto & Amri 1996).
Klasifikasi ikan patin menurut Saanin (1984) adalah sebagai berikut: Filum : Chordata
Sub filum : Vertebrata Kelas : Pisces Sub kelas : Teleostei Ordo : Ostariophysi Sub Ordo : Siluridae Family : Pangasidae Genus : Pangasius
Spesies : Pangasius hypophthalmus
Ikan patin tidak memiliki sisik tetapi memiliki sirip dubur yang panjang, terdiri dari 30-33 jari-jari lunak, sedangkan sirip perutnya memiliki enam jari-jari lunak. Sirip dada memiliki 12-13 jari-jari lunak, dan sebuah jari-jari keras yang berubah menjadi senjata yang dikenal sebagai patil (Susanto & Amri 1996). Morfologi ikan patin dapat dilihat pada Gambar 2.
Gambar 2 Ikan patin (Pangasiushypophthalmus) Sumber: Nautic Seafood (2009)
Ikan patin di alam bebas biasanya selalu bersembunyi di dalam liang-liang tepi sungai atau kali. Ikan ini baru keluar dari liang persembunyiannya pada malam hari setelah hari mulai gelap. Hal ini sesuai dengan sifat hidupnya yang
nocturnal (aktif pada malam hari). Ikan patin adalah ikan omnivora atau golongan
ikan pemakan segala (Khairuman & Suhenda 2002). Di alam, makanan ikan ini antara lain adalah ikan-ikan kecil, cacing, detritus, serangga, biji-bijian,
udang-udang kecil, dan moluska (Susanto & Amri 2002). Komposisi kimia ikan patin disajikan pada Tabel 2.
Tabel 2 Komposisi kimia ikan patin segar
Komposisi Kadar (%)
Air 75,70 Protein 16,10 Lemak 5,70 Abu 1,00 Sumber : BPMHP (1998) diacu dalam Erdiansyah (2006)
2.3 Mutu Ikan
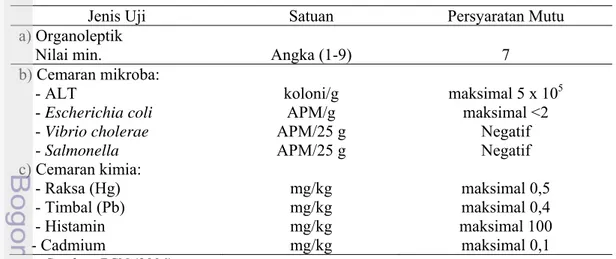
Mutu ikan segar adalah identik dengan kesegaran. Kesegaran ikan akan memberikan pengaruh bagi kesehatan orang yang mengkonsumsinya. Mutu pada ikan segar dapat diketahui melalui penilaian secara subjektif dan objektif (kimia/biokimia, fisika, dan mikrobiologi). Ikan yang sangat segar belum banyak mengalami perubahan-perubahan secara kimia, fisik, dan mikrobiologi (Alasavar & Taylor 2002). Adapun persyaratan mutu ikan segar dapat dilihat pada Tabel 3.
Tabel 3 Persyaratan mutu ikan basah (SNI 01-2729-2006)
Jenis Uji Satuan Persyaratan Mutu
a) Organoleptik
Nilai min. Angka (1-9) 7
b) Cemaran mikroba: - ALT - Escherichia coli - Vibrio cholerae - Salmonella c) Cemaran kimia: - Raksa (Hg) - Timbal (Pb) - Histamin - Cadmium koloni/g APM/g APM/25 g APM/25 g mg/kg mg/kg mg/kg mg/kg maksimal 5 x 105 maksimal <2 Negatif Negatif maksimal 0,5 maksimal 0,4 maksimal 100 maksimal 0,1 Sumber: BSN (2006)
Keterangan: ALT = Angka Lempeng Total, APM = Angka Paling Memungkinkan
2.4 Kemunduran Mutu Ikan
Segera setelah ikan mati, terjadi perubahan-perubahan yang dapat mengakibatkan penurunan mutu ikan. Penurunan tingkat kesegaran ikan ini terlihat dengan adanya perubahan fisik, kimia, dan organoleptik pada ikan yang
disebabkan oleh aktivitas enzim, bakteri, dan kimiawi. Lamanya waktu perubahan yang berlangsung pada ikan tergantung pada jenis ikan, ukuran, cara kematian, metode penangkapan, penanganan, dan suhu penyimpanan (Robb 2002). Urutan proses perubahan yang terjadi setelah ikan mati, meliputi perubahan pre rigor, rigos mortis, dan post rigor.
2.4.1 Pre rigor
Pre rigor merupakan kondisi pada saat otot ikan dalam keadaan relaksasi
setelah ikan mengalami kematian. Pada kondisi ini terjadi penurunan kreatin fosfat (CP) secara cepat. Konsentrasi ATP coba dipertahankan untuk beberapa saat dengan proses resintesis dari ADP dan CP (Iwamoto et al. 1988 diacu dalam
Wang et al. 1998). Pada kondisi pre rigor juga terjadi peristiwa terlepasnya lendir
dari kelenjar-kelenjar yang ada di dalam kulit (hyperaemia). Lendir tersebut
terdiri dari glukoprotein dan merupakan substrat yang baik untuk pertumbuhan bakteri (Dwiari et al. 2008).
2.4.2 Rigor mortis
Pada saat ikan mati, otot ikan seluruhnya dalam keadaan relaksasi dan memiliki tekstur daging yang elastis. Setelah itu, otot ikan mengalami kontraksi yang mengakibatkan tubuh ikan menjadi keras, kaku, dan tidak fleksibel (FAO 1995). Penurunan kelenturan otot terus berlangsung seiring dengan semakin sedikitnya jumlah ATP. Hilangnya kelenturan otot ikan ini akibat ion Ca2+ yang berikatan dengan protein troponin sehingga menyebabkan terjadinya ikatan elektrostatik antara filamen aktin dan miosin (aktomiosin) yang ditandai dengan terjadinya pengkerutan atau kontraksi serabut otot yang tidak dapat balik (irreversible) (Eskin 1990).
Adenosin triposfat merupakan sumber energi tertinggi bagi aktivitas ikan. Setelah ikan mati, ATP diperoleh dari penguraian kreatin fosfat. Kemudian ATP mulai mengalami penguraian ketika kandungan kreatin fosfat dan ATP mencapai titik yang sama. Hidrolisis ATP menjadi ADP dengan bantuan enzim ATPase akan menghasilkan energi. Penguraian tersebut terjadi berdasarkan reaksi berikut ini (Eskin 1990):
ATP + H O 2 ADP + H3PO4
ATPase
Otot ikan ketika baru mati memiliki pH netral atau sedikit basa. Selama
rigor mortis, nilai pH perlahan-lahan turun menjadi 6,2-6,5 karena akumulasi
asam laktat. Kandungan glikogen yang lebih banyak pada otot ikan mati akan memperlambat dan memperpanjang fase rigor mortis (Govidan 1985).
Penguraian ATP berkaitan erat dengan terjadinya rigor mortis. Pada saat
ATP mulai mengalami penurunan, rigor mortis pun mulai terjadi dan mencapai
kejang penuh (full-rigor) ketika kandungan ATP sekitar 1 µmol/g. Energi pada
jaringan otot ikan setelah ikan mati diperoleh secara anaerobik dari pemecahan glikogen melalui proses glikolisis menghasilkan ATP dan asam laktat. Akumulasi asam laktat selain menurunkan pH otot, juga diikuti oleh peristiwa rigor mortis
(Eskin 1990). 2.4.3 Post rigor
Pada saat otot ikan kembali elastis setelah melewati fase rigor mortis
terjadi kenaikan pH ikan secara perlahan-lahan dengan meningkatnya laju perubahan autolitik yang ditandai dengan proses pelunakan daging ikan (Govidan 1985). Pada fase post rigor terjadi pelunakan daging yang disebabkan
aktivitas enzim meningkat sehingga terjadi penguraian daging ikan yang selanjutnya menghasilkan substansi yang baik bagi pertumbuhan bakteri (Dwiari et al. 2008).
Setelah ikan mati, enzim masih mempunyai kemampuan untuk bekerja secara aktif. Namun sistem kerja enzim menjadi tidak terkontrol karena organ pengontrol tidak berfungsi lagi. Akibatnya enzim dapat merusak organ tubuh ikan itu sendiri. Peristiwa ini disebut autolisis. Ciri terjadinya perubahan secara autolisis adalah dengan dihasilkannya amoniak sebagai hasil akhir. Penguraian protein dan lemak karena aktivitas autolisis menyebabkan perubahan rasa, tekstur, dan penampakan ikan (Afrianto & Liviawaty 1989).
Selain terjadi penguraian protein, proses kemunduran mutu ikan juga ditandai dengan terjadinya kerusakan lemak akibat proses oksidasi menghasilkan sejumlah substansi yang dapat menyebabkan timbulnya bau dan rasa tengik yang disebut proses ketengikan. Tingginya kandungan asam lemak tidak jenuh pada daging ikan menyebabkan terjadinya autooksidasi radikal asam lemak tidak jenuh dengan oksigen membentuk senyawa hidroperoksida yang dapat menimbulkan
ketengikan. Proses ini dipercepat oleh adanya faktor enzim-enzim lipoksidase, cahaya, dan panas. Senyawa hasil pemecahan hidroperoksida merupakan produk sekunder yang sebagian besar berupa aldehid, keton, alkohol, asam karboksilat, dan alkana yang menyebabkan timbulnya diskolorisasi dan bau tengik pada ikan (FAO 1995).
2.5 Aktivitas Proteolitik Selama Fase Post Mortem Ikan
Aktivitas protease endogenus merupakan masalah serius selama post mortem ikan. Protease endogenus adalah enzim proteolitik yang berasal dari tubuh
ikan itu sendiri (Rondanelli 2002). Penguraian protein daging ikan karena aktivitas enzim proteolitik mengakibatkan daging ikan menjadi lunak, mudah dilepaskan dari tulang, kehilangan elastisitasnya, dan meninggalkan bekas jari pada saat ditekan (Govidan 1985).
Peptida berbobot molekul rendah dan asam-asam amino bebas dihasilkan dari penguraian protein oleh enzim. Aktivitas autolisis juga menyediakan lingkungan yang mendukung untuk pertumbuhan bakteri (FAO 1995). Seluruh proses pelunakan daging ikan selama post mortem diduga adalah hasil aktivitas
protease yang berasal dari sel di dalam daging ikan. Katepsin lisosomal diduga mempunyai peran dalam setiap aktivitas proteolitik dan pelunakan daging ikan selama fase post mortem (Rondanelli 2002).
2.6 Enzim Katepsin
Lisosom diketahui sebagai sumber katepsin yang memiliki peranan dalam perubahan daging ikan selama fase post mortem. Diantara enzim lisosom tersebut,
katepsin B,C, D, L, dan S berhasil dimurnikan dan dikarakterisasi dari daging ikan atau kerang. Jenis katepsin tersebut merupakan protease utama yang berperan dalam pemecahan protein intraseluler (Yamashita & Kanagaya 1990 diacu dalam Rondanelli 2002). Enzim katepsin di dalam tubuh ikan memiliki peranan yang penting selama ikan itu hidup, yaitu berperan dalam metabolisme intraseluler, aktivasi prohormon, proenzim, proalbumin, pembelahan sel, dan pelepasan fibrinogen (Olonen 2004; Otto & Schirmeister 1997).
Katepsin A termasuk jenis eksopeptidase yang memiliki pH optimum 5-6, serta inaktif oleh panas dan alkali (Shahidi & Botta 1994). Katepsin B merupakan
enzim utama pada daging ikan tetapi memiliki aktivitas proteolitik yang lemah dengan protein miosin dan miofibril (Warrier et al. 1988 diacu dalam
Shahidi & Botta 1994). Katepsin B merupakan sistein eksopeptidase yang memiliki berat molekul sebesar 30 kDa dan aktivitas maksimum pada pH 6,0 (Jiang 2000). Katepsin B mampu mendegradasi rantai miosin dengan cepat sementara katepsin L mampu mendegradasi troponin T, dan I, serta C-protein dengan cepat tetapi mendegradasi miosin, aktin dan tropomiosin dengan lambat. Katepsin D yang diisolasi dari daging putih Carassius auratus gibelio memiliki
berat molekul sebesar 38.000-50.000 Da dan pH optimum 3,5. Enzim Katepsin D mampu mendegradasi miosin, aktin, dan tropomiosin tetapi mampu dihambat oleh pepstatin (Dinu et al. 2002). Katepsin L merupakan jenis protease lain yang
sangat aktif dalam mendegradasi protein miofibril. Aktivitas molekular dari katepsin L dengan substrat miosin adalah 10 kali lebih besar dari pada katepsin B. Katepsin L dapat mendegradasi miofibril termasuk aktin, miosin, dan tropomiosin pada pH 6,5 (Shahidi & Botta 1994).
2.7 Peranan Katepsin dalam Kemunduran Mutu
Ketika ikan mati (fase pre rigor), maka kondisi menjadi anaerob dan ATP
terurai oleh enzim yang terdapat di dalam tubuh ikan dengan melepaskan energi. Proses ini kemudian diikuti dengan peristiwa glikolisis yang akan menguraikan glikogen menjadi asam laktat. Pembentukan asam laktat akan menyebabkan terjadinya penurunan pH (Afrianto & Liviawaty 1989). Pada saat pH turun selama proses glikolisis post mortem membuat dinding lisosom melepaskan protease
lisosomal, seperti katepsin B, H, dan L (Etherrington 1984; Jiang et al. 1994
diacu dalam Rondanelli 2002).
Pengaktifan enzim katepsin selanjutnya akan menyebabkan terjadinya penguraian protein menjadi senyawa-senyawa yang lebih sederhana. Hal ini menimbulkan terjadinya akumulasi metabolit dan pembentukan senyawa-senyawa basa volatil yang berakibat terhadap kenaikan pH dan peningkatan jumlah bakteri karena senyawa-senyawa basa tersebut merupakan media yang sangat cocok bagi pertumbuhan bakteri terutama golongan bakteri pembusuk (Lawrie 1985).
2.8 Inhibitor Enzim
Mekanisme enzim dalam suatu reaksi, yaitu melalui pembentukan kompleks enzim-substrat (ES). Oleh karena itu, hambatan atau inhibisi pada suatu reaksi yang menggunakan enzim sebagai katalis dapat terjadi apabila penggabungan pada bagian aktif enzim mengalami hambatan. Molekul atau ion yang dapat menghambat reaksi tersebut dinamakan inhibitor (Lehninger 1993). 2.8.1 Mekanisme kerja inhibitor enzim
Hambatan yang dilakukan oleh inhibitor dapat dibagi menjadi dua jenis, yaitu hambatan tidak dapat balik (irraversible) dan hambatan dapat balik
(reversible). Hambatan tidak dapat balik pada umumnya disebabkan karena
terjadinya proses destruksi atau modifikasi sebuah gugus atau lebih yang terdapat pada molekul enzim. Contoh inhibitor tidak dapat balik adalah senyawa
diisopropil fluoro fosfat (DFP) yang menghambat enzim asetilkolinesterase yang
penting di dalam proses transmisi impuls syaraf (Lehninger 1993).
Hambatan dapat balik (reversible) terdiri dari hambatan bersaing
(kompetitif) dan tidak bersaing (non-kompetitif). Hambatan bersaing disebabkan karena ada molekul yang mirip dengan substrat dan dapat pula membentuk kompleks, yaitu kompleks enzim inhibitor (EI). Pembentukan kompleks EI ini sama dengan pembentukan kompleks ES, yaitu melalui penggabungan inhibitor dengan enzim pada bagian aktif enzim sehingga terjadi persaingan antara inhibitor dengan sustrat terhadap bagian aktif enzim. Inhibitor bersaing menghalangi terbentuknya kompleks ES dengan cara membentuk kompleks EI. Berbeda dengan kompleks ES, kompleks EI tidak dapat membentuk produk (P). Ciri inhibitor kompetitif ini adalah penghambatan dapat dibalikkan atau diatasi hanya dengan meningkatkan konsentrasi substrat (Lehninger 1993).
Hambatan tidak bersaing (non-kompetitif) tidak dipengaruhi oleh besarnya konsentrasi substrat dan inhibitor yang melakukannya atau disebut juga inhibitor tidak bersaing. Inhibitor dapat bergabung dengan enzim pada suatu bagian enzim di luar bagian aktif. Penggabungan antara inhibitor dengan enzim bebas menghasilkan kompleks EI, sedangkan penggabungan inhibitor dengan kompleks ES menghasilkan kompleks ESI. Baik kompleks EI maupun ESI bersifat inaktif.
Ini berarti bahwa kompleks tersebut tidak dapat menghasilkan produk reaksi yang diharapkan (Lenhninger 1993).
2.8.2 Inhibitor protease alami
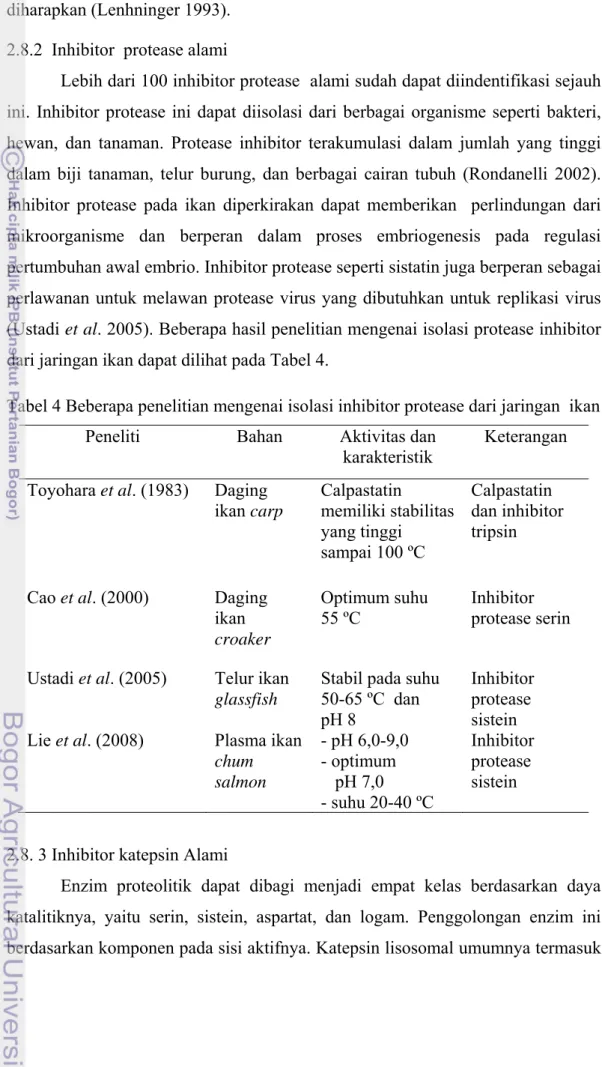
Lebih dari 100 inhibitor protease alami sudah dapat diindentifikasi sejauh ini. Inhibitor protease ini dapat diisolasi dari berbagai organisme seperti bakteri, hewan, dan tanaman. Protease inhibitor terakumulasi dalam jumlah yang tinggi dalam biji tanaman, telur burung, dan berbagai cairan tubuh (Rondanelli 2002). Inhibitor protease pada ikan diperkirakan dapat memberikan perlindungan dari mikroorganisme dan berperan dalam proses embriogenesis pada regulasi pertumbuhan awal embrio. Inhibitor protease seperti sistatin juga berperan sebagai perlawanan untuk melawan protease virus yang dibutuhkan untuk replikasi virus (Ustadi et al. 2005). Beberapa hasil penelitian mengenai isolasi protease inhibitor
dari jaringan ikan dapat dilihat pada Tabel 4.
Tabel 4 Beberapa penelitian mengenai isolasi inhibitor protease dari jaringan ikan
Peneliti Bahan Aktivitas dan
karakteristik Keterangan Toyohara et al. (1983) Daging ikan carp Calpastatin memiliki stabilitas yang tinggi sampai 100 ºC Calpastatin dan inhibitor tripsin Cao et al. (2000) Daging ikan croaker Optimum suhu 55 ºC Inhibitor protease serin Ustadi et al. (2005) Telur ikan
glassfish
Stabil pada suhu 50-65 ºC dan pH 8
Inhibitor protease sistein Lie et al. (2008) Plasma ikan
chum salmon - pH 6,0-9,0 - optimum pH 7,0 - suhu 20-40 ºC Inhibitor protease sistein
2.8. 3 Inhibitor katepsin Alami
Enzim proteolitik dapat dibagi menjadi empat kelas berdasarkan daya katalitiknya, yaitu serin, sistein, aspartat, dan logam. Penggolongan enzim ini berdasarkan komponen pada sisi aktifnya. Katepsin lisosomal umumnya termasuk
dalam kelompok besar protease sistein. Berdasarkan fungsi biologinya, sistein protease berperan dalam metabolisme intraseluler, aktivasi banyak prohormon dan proenzim. Kerja atau aksi dari protease sistein ini dapat dikendalikan dan dihambat oleh inhibitor alami sama baiknya dengan cara menambahkan logam atau mengatur pH lingkungan (Olonen 2004).
Inhibitor katepsin dapat diperoleh secara alami dari organisme hidup. Inhibitor katepsin alami diantaranya, yaitu sistatin (putih telur), leupeptin (Actinomycetes), pepstatin (streptomyces testaceus), dan α-macroglobulin
(plasma) (Carreno & Cortes 2000). Menurut penelitian Dinu et al. (2002),
inhibitor pepstatin dengan konsentrasi 1 µM mampu menghambat aktivitas katepsin E sampai dengan 98,2 % dan mengambat aktivitas katepsin D sebesar 97,5 %.