PENGUJIAN MORFOLOGI SPERMATOZOA SAPI
PASUNDAN MENGGUNAKAN PEWARNAAN
EOSIN-NIGROSIN DAN WILLIAMS
NENI FITRIYANI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
BOGOR 2016
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Pengujian Morfologi Spermatozoa Sapi Pasundan Menggunakan Pewarnaan Eosin-Nigrosin dan Williams adalah benar karya saya dengan arahan dari dosen pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2016
Neni Fitriyani
ABSTRAK
NENI FITRIYANI. Pengujian Morfologi Spermatozoa Sapi Pasundan Menggunakan Pewarnaan Eosin-Nigrosin dan Williams. Dibimbing oleh IIS ARIFIANTINI.
Sapi pasundan merupakan plasma nutfah asli dari Jawa Barat, Indonesia. Sapi pasundan memiliki potensi sebagai sapi potong. Penelitian ini bertujuan untuk menguji abnormalitas spermatozoa, mempelajari jenis abnormalitas spermatozoa dan membandingkan abnormalitas spermatozoa menggunakan pewarnaan eosin-nigrosin dan Williams pada sapi pasundan. Semen yang dikoleksi berasal dari tiga sapi pejantan dewasa kelamin dari Balai Pengembangan Perbibitan Ternak (BPPT) Sapi Potong Ciamis. Pengujian morfologi spermatozoa menggunakan pewarnaan Williams dilakukan dengan cara empat tetes semen dan satu tetes larutan NaCl 0.9% dicampurkan, kemudian diulas ke kaca objek, pewarnaan Williams dilakukan di Unit Rehabilitasi Reproduksi, Bogor. Pengujian morfologi spermatozoa menggunakan pewarnaan eosin-nigrosin dilakukan dengan cara satu tetes semen dan empat tetes pewarna dicampurkan dan ulas di atas kaca objek, kemudian dikeringkan menggunakan heating table. Pengamatan kedua sampel dilakukan menggunakan mikroskop dengan perbesaran 400 kali. Hasil menunjukkan rerata abnormalitas spermatozoa pada sapi pasundan menggunakan pewarnaan Williams sebesar 9.0±4.8% dan eosin-nigrosin sebesar 5.6±3.6%. Jenis abnormalitas yang paling banyak ditemukan menggunakan pewarnaan Williams adalah bowed tail dan menggunakan pewarnaan eosin-nigrosin adalah
abaxial. Pengujian morfologi spermatozoa lebih baik menggunakan pewarnaan Willams dibandingkan dengan eosin-nigrosin.
Kata kunci: sapi pasundan, morfologi spermatozoa, Williams, eosin-nigrosin
ABSTRACT
NENI FITRIYANI. Sperm Morphological Assesment of Pasundan Bull Using Eosin-Nigrosin and Williams Stain. Supervised by IIS ARIFIANTINI.
Pasundan bull is one of native cattle from West Java and has high potential as beef cattle. The aim of this research was to evaluate sperm abnormality, the types of sperm abnormality, and to compare the used of Williams and eosin-nigrosin stain to determine the sperm abnormality. Semen was collected from three bulls belong to Beef Cattle Breeding Center at Ciamis. For morphology assesment using Williams stain conducted by putting one drop of semen with four drops of NaCl 0.9%, then smear into warm slide glass, stainning with Williams conducted at IPB. For morphology with eosin nigrosin, condudted by puting one drop of semen and four drops of eosin nigrosin, then smear into warm glass, dry the slide above heating table. Both sample were examined using a bright field microscope with 400 magnification. The results showed that, the average of sperm abnormality of pasundan bull using Williams stain was 9.0±4.8% and using eosin-nigrosin was 5.6±3.6%. The higest abnormality type of spermatozoa using Williams stain was bowed tail and using eosin-nigrosin was abaxial. Morphological assessments were better using Williams than eosin-nigrosin stain. Keywords: pasundan bull, sperm morphology, Williams, eosin-nigrosin
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
PENGUJIAN MORFOLOGI SPERMATOZOA SAPI
PASUNDAN MENGGUNAKAN PEWARNAAN
EOSIN-NIGROSIN DAN WILLIAMS
NENI FITRIYANI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Skripsi : Pengujian Morfologi Spermatozoa Sapi Pasundan Menggunakan Pewarnaan Eosin-Nigrosin dan Williams
Nama : Neni Fitriyani NIM : B04120053
Disetujui oleh
Diketahui oleh
Prof Drh Agus Setiyono, MS, PhD, APVet Wakil Dekan Bidang Akademik dan Kemahasiswaan
Fakultas Kedokteran Hewan
Tanggal Lulus:
Prof Dr R Iis Arifiantini, MSi Pembimbing
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga tugas akhir berjudul Pengujian Morfologi Spermatozoa Sapi Pasundan Menggunakan Pewarnaan Eosin-Nigrosin dan Williams berhasil diselesaikan.
Terima kasih penulis ucapkan kepada Prof Dr R Iis Afriantini, MSi selaku dosen pembimbing yang telah memberikan bimbingan dan arahan selama proses penulisan tugas akhir ini, Dr Drh Ni Luh Putu Ika Mayasari selaku pembimbing akademik yang telah memberikan nasihat dan dukungan, Kepala Dinas Provinsi Jawa Barat Ir Dody Firman Nugraha dan Drh Susanto beserta staf Balai Pengembangan Perbibitan Ternak (BPPT) Sapi Potong Ciamis. Ucapan terima kasih juga penulis ucapkan kepada Drh Iin Indrasari, Abdullah Baharun, SPt MSi dan Meta Yuniar yang telah banyak berkontribusi dan mendukung proses penelitian serta bapak Bondan selaku laboran yang selalu sabar membantu dalam proses pengamatan. Tak lupa pula penulis ucapkan terima kasih kepada orang tua, kakak tersayang dan keluarga yang selalu memberi doa, dukungan dan kekuatan motivasi serta sahabat, teman-teman, dan Astrocyte FKH 49 yang selalu memberikan semangat.
Semoga hasil penelitian ini dapat bermanfaat.
Bogor, Agustus 2016
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
PENDAHULUAN 1 Latar Belakang 1 Tujuan Penelitian 2 Manfaat Penelitian 2 TINJAUAN PUSTAKA 2 Sapi Pasundan 2
Karakteristik Semen Sapi Pasundan 3
Morfologi Spermatozoa 4
Teknik Pewarnaan Spermatozoa 5
METODE 6
Waktu dan Tempat Penelitian 6
Penyiapan Pewarna 6 Eosin-Nigrosin 6 Williams 6 Sampel Semen 7 Koleksi Semen 7 Pewarnaan Spermatozoa 7 Eosin-Nigrosin 7 Williams 7
Pengamatan Morfologi Spermatozoa 8
Analisis Data 8
HASIL DAN PEMBAHASAN 8
Kondisi Lokasi Penelitian 8
Jenis Abnormalitas Spermatozoa Sapi Pasundan 8
Morfologi Spermatozoa Sapi Pasundan 12
SIMPULAN DAN SARAN 14
Simpulan 14
DARTAR PUSTAKA 14
LAMPIRAN 17
DAFTAR TABEL
1 Karakteristik bentuk abnormalitas spermatozoa mayor dan minor pada sapi 5 2 Jenis abnormalitas spermatozoa sapi pasundan menggunakan pewarnaan
Williams 10
4 Jenis abnormalitas spermatozoa sapi pasundan menggunakan pewarnaan
eosin-nigrosin 12
3 Morfologi spermatozoa sapi pasundan menggunakan pewarnaan eosin-
nigrosin dan Williams 13
DAFTAR GAMBAR
1 Sapi pasundan di BPPT sapi potong Ciamis 3
2 Spermatozoa dengan pewarnaan Williams 6
3 Koleksi semen menggunakan vagina buatan di BBPT Sapi Potong Ciamis 7 4 Bentuk normal dan abnormal spermatozoa sapi pasundan 9
DAFTAR LAMPIRAN
1 Hasil statistik morfologi spermatozoa menggunakan pewarnaan 17 eosin-nigrosin dan Williams
1
PENDAHULUAN
Latar Belakang
Sumber daya alam dan genetik ternak yang dimiliki Indonesia sangat beragam dan mempunyai potensi tinggi untuk dikembangkan. Salah satu genetik ternak asli Indonesia yaitu sapi pasundan yang berasal dari daerah Jawa Barat. Berdasarkan Keputusan Menteri Pertanian Nomor 1051/kpts/SR.120/10/2014 sapi pasundan adalah sapi lokal hasil program perkawinan silang antara sapi peranakan ongole, sapi bali dan sapi madura. Karakteristik yang dimiliki oleh sapi pasundan antara lain mudah beradaptasi terhadap lingkungan, mudah dipelihara dan relatif tahan terhadap penyakit tropis. Selain itu sapi pasundan mempunyai kemampuan reproduksi yang baik. Kelebihan lain yang dimilikinya adalah berpotensi sebagai sapi potong karena berat karkasnya mengandung proporsi tulang yang lebih sedikit. Hal tersebut mendorong perlunya upaya pelestarian sapi pasundan.
Upaya dalam melestarikan genetik ternak dapat dilakukan melalui pelestarian plasma nutfah (Thalib et al. 2001). Pelestarian plasma nutfah dilakukan melalui penentuan potensi reproduksi yang dimiliki seekor jantan dengan metode yang sudah dikembangkan yaitu metode breeding soundness evaluation (BSE) atau bull breeding soundness evaluation (BBSE) (Riyadhi et al.
2010). Kategori yang diuji pada metode BBSE antara lain organ reproduksi umum, indeks lingkar skrotum berdasarkan umur, molititas spermatozoa dan morfologi spermatozoa (Purwantara et al. 2010). Morfologi spermatozoa kurang mendapatkan perhatian di Indonesia, tidak seperti di Amerika, Swedia dan Belanda, morfologi spermatozoa menjadi faktor perhitungan pengencer dalam pembuatan semen cair dan semen beku (Arifiantini et al. 2006a).
Pengamatan morfologi spermatozoa sangatlah penting karena spermatozoa yang abnormal dapat memengaruhi fertilitas spermatozoa. Menurut Chenoweth (2005) spermatozoa yang abnormal akan mengakibatkan gagalnya spermatozoa dalam mencapai tempat terjadinya fertilisasi, atau karena ketidakmampuan untuk membuahi sel telur. Abnormalitas pada spermatozoa dapat dibagi dalam beberapa tipe yaitu abnormalitas primer, sekunder, mayor dan minor. Abnormalitas spermatozoa primer terjadi selama proses spermatogenesis sedangkan abnormalitas spermatozoa sekunder terjadi selama spermiogenesis. Abnormalitas mayor telah dibuktikan dapat mengganggu fertilitas sedangkan abnormalitas minor dianggap sebagai hal kecil yang mengganggu fertilitas.
Teknik dalam menentukan abnormalitas pada spermatozoa dapat dilakukan dengan beberapa cara yaitu dengan pewarnaan formosalin, eosin, eosin-nigrosin, dan carbolfuchsin (Williams) (Arifiantini et al. 2006b). Morfologi spermatozoa sapi telah dilakukan oleh beberapa peneliti, diantaranya pada sapi bali (Arifiantini
et al. 2006a), Friesian Holstein (Purwantara et al. 2010), dan Simental (Riyadhi et al. 2010).
2
Tujuan Penelitian
Penelitian ini bertujuan untuk menguji abnormalitas spermatozoa, mempelajari jenis abnormalitas spermatozoa, serta membandingkan morfologi spermatozoa dengan pewarnaan eosin-nigrosin dan Williams pada sapi pasundan.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi mengenai morfologi spermatozoa dan jenis abnormalitas spermatozoa sapi pasundan.
TINJAUAN PUSTAKA
Sapi Pasundan
Sapi pasundan telah ditetapkan sebagai sapi lokal asli Jawa Barat berdasarkan Keputusan Menteri Pertanian Republik Indonesia Nomor 1051/kpts/SR. 1230/10/2014. Sapi pasundan merupakan hasil adaptasi dari lebih 10 generasi antara sapi bali, sapi jawa, sapi madura, dan sapi sumba ongole. Menurut Baharun (2015) populasi sapi pasundan terdapat sekitar 52 540 ekor yang tersebar di beberapa kabupaten yakni di Ciamis (535 ekor), Pangandaran (5 130 ekor), Tasikmalaya (7 231 ekor), Cianjur (10 346 ekor), Sukabumi (12 897 ekor), Garut (1 842 ekor), Purwakarta (2 788 ekor), Kuningan (7 218 ekor), dan Majalengka (4 553 ekor). Tipe sapi pasundan dapat dibagi menjadi dua yaitu dengan tipe bergelambir dan tidak bergelambir. Selain itu juga, diduga sapi pasundan memiliki dua galur yaitu galur yang mirip sapi bali dan galur mirip sapi onggole.
Sapi pasundan memiliki bentuk tubuh yang ramping dan padat (Gambar 1). Warna tubuh dominannya adalah merah bata, pada bagian pelvis terdapat warna putih dan keempat kaki bagian bawah (tarsus dan carpus) mempunyai batasan yang tidak kontras. Pada punggungnya terdapat garis punggung atau garis belut yang berwarna lebih tua dari warna dominan. Setelah dewasa kelamin beberapa pejantan akan mengalami perubahan warna tubuh menjadi warna hitam dari asalnya bewarna merah bata. Hidung dan ujung ekor berwarna hitam. Tanduk dengan bentuk pendek, tidak seragam dan bervariasi dari kecil sampai besar. Sapi pasundan jantan memiliki ukuran tubuh (tinggi pundak, panjang badan, dan lingkar dada) secara berurutan adalah 115.74 ± 8.40 cm, 120.09 ± 9.80 cm, dan 150.22 ± 11.76 cm dengan bobot badan 240.40 ± 34.00 kg, sedangkan pada betina memiliki ukuran tubuh (tinggi pundak, panjang badan, dan lingkar dada) masing-masing adalah 109.74 ± 6.30 cm, 110.09 ± 9.80 cm, dan 138.22 ± 11.85 dengan bobot badan 220.30 ± 22.00 kg (Baharun 2015).
3
Karakteristik Semen Sapi Pasundan
Semen adalah cairan ejakulat yang terdiri atas plasma protein dan spermatozoa (Garner dan Hafez 2000). Menurut Ogbuewu et al. (2010) semen merupakan suspensi cairan seluler yang terdiri atas spermatozoa sebagai gamet jantan dan sekresi yang berasal dari kelenjar-kelenjar kelamin pelengkap pada saluran reproduksi hewan jantan. Cairan yang terkandung dalam semen yang dihasilkan pada saat ejakulat disebut plasma semen.
Plasma semen merupakan cairan yang disekresikan terutama oleh kelenjar aksesoris pada alat kelamin jantan. Fungsi plasma semen yaitu sebagai medium pembawa spermatozoa dari saluran reproduksi jantan ke saluran reproduksi betina selama ejakulasi. Plasma semen mengandung bahan makanan yang penting untuk mendukung hidup spermatozoa setelah deposisi ke traktus reproduksi betina. Menurut Salmah (2014) faktor-faktor yang memengaruhi kualitas semen adalah umur, bangsa ternak, genetik, lingkungan, pakan dan pengencer yang digunakan.
Fuquay et al. (2004) menyatakan bahwa komponen plasma semen terdiri atas glycosaminoglycan (GAG) yang merupakan suatu protein, natrium dan klorin yang berfungsi sebagai bahan anorganik, penyangga dan sebagai sumber energi bagi spermatozoa baik yang digunakan secara langsung seperti fruktosa dan sorbitol, maupun secara tidak langsung digunakan dalam bentuk glyceryl phosphoryl choline (GPC). Menurut Garner dan Hafez (2000) plasma semen mengandung asam sitrat dalam konsentrasi tinggi, ergotionin, fruktosa, GPC, dan sorbitol yang mempunyai fungsi sebagai energi cadangan apabila substrat yang lain telah habis. Morrell (2010) mengatakan, cairan isotonik plasma semen dipertahankan oleh substansi organik seperti fruktosa, sorbitol, inositol, asam sitrat, glyceryl phosphoryl choline, fosfolipid, prostaglandin, dan protein. Fruktosa merupakan sumber energi terbesar untuk spermatozoa dalam semen.
Menurut Purdy (2006) komponen kimiawi yang terdapat di dalam plasma semen memiliki beberapa peranan penting yaitu protein yang diperlukan untuk kestabilan dan permeabilitas membran plasma spermatozoa dan vitamin C berperan melindungi membran plasma spermatozoa dari kerusakan selama proses pembekuan semen dengan jalan mengikat radikal oksigen bebas sehingga mencegah terbentuknya peroksida lipid yang dapat menghambat glikolisis maupun motilitas. Selain itu, kalium, natrium dan klorida sangat diperlukan untuk menjaga integritas fungsional membran plasma spermatozoa dan berperan pula untuk mempertahankan di dalam dan di luar sel spermatozoa. Kalsium juga berperan dalam menginduksi motilitas dan hiperaktivasi spermatozoa. Komponen
4
lain seperti bikarbonat berperan sebagai agen penyangga untuk mencegah penurunan pH semen selama proses penyimpanan dan fruktosa dimanfaatkan sebagai sumber energi, baik dalam kondisi anaerob (penyimpanan) dan aerob di dalam saluran reproduksi betina.
Morfologi Spermatozoa
Spermatozoa normal terdiri dari dua bagian yaitu kepala dan ekor. Kepala spermatozoa terdiri dari dua daerah, yaitu akrosom anterior yang dibungkus oleh tudung akrosom dan post akrosom. Menurut Barth dan Oko (1989) akrosom atau tudung akrosom merupakan struktur berupa dua lapis kantong membran yang terdapat di antara plasma membran dan anterior dari kepala spermatozoa, bagian ini mengandung akrosin, hyaluronidase dan enzim hidrolitik lainnya yang berperan dalam menembus ovarium. Bagian ujung dari akrosom inilah yang akan menembus membran oosit.
Kepala spermatozoa berbentuk oval, memanjang, lebar dan datar. Bagian ini berisikan materi genetik berupa kromosom yang terdiri dari untaian rantai
deoxyribonucleic acid (DNA) yang terbentuk melalui tahapan meiosis dalam proses spermatogenesis sehingga jumlah kromosom pada DNA ini adalah diploid atau setengah dari DNA sel somatik dari spesies yang sama. Ekor spermatozoa dibagi menjadi tiga bagian yaitu mid piece, principal piece dan end piece. Bagian ekor ini terdiri dari aksonema yang tersusun dari sembilan pasang mikrotubulus yang melingkari dua inti filament. Aksonema dibungkus oleh banyak mitokondria yang tersusun secara helix yang mengelilingi serabut longitudinal dari ekor. Mitokondria ini digunakan sebagai sumber energi bagi motilitas spermatozoa, fruktosa dalam semen merupakan sumber proses pembentukan ATP di mitokondria. Ekor ini melakukan gerak lokomosi dengan gelombang yang dimulai di daerah implantasi ekor-kepala dan berjalan ke arah posterior sepanjang ekor, hal ini berkaitan dengan keberhasilan proses fertilisasi (Prastowo 2008).
Morfologi spermatozoa adalah salah satu bentuk evaluasi semen secara mikroskopis yang dilakukan dengan menghitung jumlah spermatozoa yang normal dan abnormal secara primer dan sekunder (Arifiantini dan Ferdian 2006). Morfologi spermatozoa dapat memengaruhi fertilitas. Abnormalitas spermatozoa yang melebihi 20% dapat menurunkan fertilitas (Ax et al. 2000). Abnormalitas pada ekor seperti coiled tail dan bent tail, akan mengganggu pergerakan spermatozoa sehingga menyebabkan kegagalan untuk mencapai tempat fertilisasi. Abnormalitas pada kepala dan akrosom, seperti pear shaped, knobbed acrosome defect, dan abnormal contour dapat menyebabkan ketidakmampuan spermatozoa untuk membuahi sel telur. Chenoweth (2005) mengkategorikan abnormalitas spermatoza menjadi dua yaitu abnormalitas mayor dan abnormalitas minor seperti pada Tabel 1. Abnormalitas yang bersifat mayor, seperti underdeveloped, pear-shaped defect, proximal droplet, diadem defect, abnormal contour, double forms,
dan knobbed acrosome defect, akan mengganggu fertilitas. Abnormalitas yang bersifat minor, seperti abaxial, narrow heads, simple bent tail, dan distal droplet, tidak mengganggu fertilitas.
5 Tabel 1 Klasifikasi bentuk abnormalitas spermatozoa mayor dan minor pada sapi
Mayor Minor
Underdeveloped Narrow heads
Double forms Small normal heads
Acrosome defect (knobbed acrosome) Giant and short broad heads Decapitated sperm defect (active tails) Free normal heads
Diadem defect Detached acrosome membranes
Pear-shaped defect Abaxial implantation
Narrow at base Distal droplet
Abnormal contour Simple bent tail
Small abnormal heads Terminally coiled tail Free pathological heads Other abnormal cells
Corkscrew defect Epithelial cells
Other midpiece defects (tail stump) Erythrocytes
Proximal droplet Medusa formation
Pseudodroplet Boat cells
Strongly coiled or folded tail (‘‘Dag’’ defect)
Round cells Pus cells Sumber : Chenoweth (2005).
Teknik Pewarnaan Spermatozoa
Spermatozoa dapat diamati dengan beberapa teknik pewarnaan. Tujuan pewarnaan adalah mempermudah dalam mengamati abnormalitas spermatozoa. Teknik pewarnaan yang dapat digunakan yaitu pewarnaan eosin, eosin-nigrosin,
carbolfuchsin, dan modifikasi Wright’s-Giemsa (Freshman 2002). Pengamatan
abnormalitas tanpa pewarnaan dapat dilakukan dengan mengamati preparat natif yang hanya mendapat perlakuan fiksasi basah (formolsalin). Pengamatan preparat natif baik digunakan untuk mengamati bagian ekor, karena tidak harus membuat preparat ulas yang dapat mempengaruhi keutuhan atau bentuk ekor.
Analisis morfologi dapat diamati pada preparat ulas yang diwarnai menggunakan pewarnaan eosin-y 1% dan nigrosin 10%. Nigrosin akan menghasilkan latar belakang gelap, sehingga sperma akan terlihat berwarna terang dan lebih jelas. Pewarnaan eosin-nigrosin selain untuk mengamati morfologi, dapat juga untuk menghitung jumlah spermatozoa yang hidup dan mati. Spermatozoa hidup tidak berwarna sedangkan spermatozoa mati akan berwarna merah (Ermayanti dan Suarni 2010).
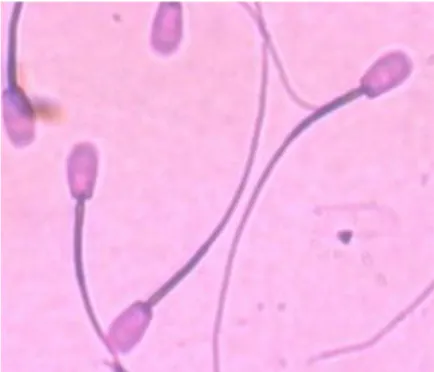
Pewarnaan yang sering digunakan untuk mengamati morfologi spermatozoa yaitu pewarnaan Williams atau pewarnaan carbolfuschin (Gambar 2). Pewarnaan Williams menggunakan basic fuschin dan eosin sebagai dasar zat pewarnanya. Kelebihan dari teknik pewarnaan ini yaitu sangat praktis karena pewarnaan dan evaluasi dapat dilakukan pada waktu yang berbeda. Selain itu, larutan cloramin
0.5% yang digunakan akan membuat preparat lebih bersih, sehingga mempermudah dalam pengamatan morfologi spermatozoa (Arifiantini 2012). Namun pewarnaan Williams tidak dapat digunakan untuk mengevaluasi jumlah spermatozoa yang hidup dan mati.
6
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Januari-Oktober 2015. Koleksi semen sapi dan pembuatan preparat ulas dilakukan di Balai Pengembangan Perbibitan (BPPT) Sapi Potong Ciamis, Jawa Barat. Pewarnaan dan pengamatan morfologi spermatozoa dilakukan di Unit Rehabilitasi Reproduksi, Divisi Reproduksi dan Kebidanan, Departemen Klinik Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor
Penyiapan Pewarna Eosin-Nigrosin
Larutan pewarna eosin-nigrosin terdiri dari nigrosin 20 g dan sodium sitrat 1.5 g dalam 300 mL distilated water, distirrer dan dihangatkan sampai larut, kemudian ditambahkan eosin yellow 3.3 g dalam larutan nigrosin. Sesuaikan pH sampai 6.8-7.0. Larutan dibiarkan beberapa hari dan disaring sebelum digunakan (Barth dan Oko 1989).
Williams
Pewarnaan dengan metode Williams dibuat dengan zat warna basic fuschin dan eosin (Yudi et al. 2010). Pewarna Williams dibuat dengan membuat larutan I, dengan mencampur 10 g basic fuchsin dalam 100 mL alkohol 95%. Kemudian dibuat basic fuchsin (larutan II) dalam larutan phenol dengan cara mencampur 10 mL larutan I dan 170 mL larutan phenol 5%. Membuat larutan III yaitu saturated bluish eosin alcohol 95%. Pewarna Williams dibuat dengan mencampur dua bagian dari larutan III dan satu bagian dari larutan II, biarkan selama 14 hari dan disaring sebelum digunakan.
7
Sampel Semen
Sampel semen yang digunakan dalam penelitian berasal dari tiga ekor sapi pasundan jantan dewasa berumur antara 3-5 tahun dengan bobot badan 300-350 kg dan memiliki reproduksi yang normal. Sapi tersebut dikandangkan secara individual yang dilengkapi dengan tempat pakan dan minum. Pemberian pakan hijauan segar berupa rumput gajah (Pennisetum purpureum) sebanyak dua kali sehari yaitu pada pagi dan sore hari sebanyak 10% dan ditambah konsentrat sebanyak 1% per ekor dari bobot badan per hari, serta air minum diberikan secara
ad libitum.
Koleksi Semen
Semen dikoleksi setiap jam 07.00 WIB. Koleksi semen berlangsung dua kali seminggu pada hari Selasa dan Kamis menggunakan vagina buatan selama satu bulan dengan delapan kali penampungan (Gambar 3). Jumlah seluruh preparat baik untuk pewarnaan Williams dan eosin-nigrosin adalah 48 buah tetapi dilihat dari kerapatan preparat dan kualitas pewarnaan diambil 30 preparat. Preparat 30 buah tersebut terdiri dari 15 buah untuk pewarnaan Williams dan 15 buah untuk pewarnaan eosin-nigrosin. Masing-masing pejantan memiliki lima buah preparat untuk kedua pewarnaan.
Pewarnaan Spermatozoa Eosin-Nigrosin
Pembuatan preparat ulas dilakukan dengan cara mencampur semen segar dan eosin-nigrosin dengan perbandingan 1:4. Selanjutnya dibuat preparat ulas tipis pada gelas objek dan dikeringkan di atas meja pemanas (heating table). Sampel disimpan pada slide box yang kedap udara sampai waktu pengamatan.
Williams
Pewarnaan Williams dikenal juga dengan sebutan pewarnaan
carbolfuschin. Metode kerja dari pewarnaan Williams (Arifiantini et al. 2006) yaitu preparat ulas dibuat menggunakan semen segar (fresh semen) dan larutan NaCl 0.9% dengan perbandingan 1:4, dikeringkan kemudian disimpan. Preparat ulas tersebut kemudian difiksasi menggunakan bunsen. Setelah difiksasi, dicuci dengan alkohol absolut selama empat menit dan dikeringkan. Lalu, dilakukan perendaman preparat pada chloramin solution 0,5% selama 1-2 menit. Langkah
8
selanjutnya, preparat dicuci dalam distilated water, dan dicuci lagi dengan alkohol 95%. Kemudian, preparat diwarnai dengan pewarnaan Williams dengan cara direndam selama 8-10 menit. Hasil pewarnaan dibersihkan dengan cara dibilas dengan air mengalir dan dikeringkan.
Pengamatan Morfologi Spermatozoa
Morfologi spermatozoa diamati pada preparat yang telah diwarnai baik pewarnaan eosin-nigrosin dan pewarnaan Williams. Mikroskop binokuler (Nikon Eclipse E600) dengan perbesaran 400 kali digunakan untuk mengamati morfologi spermatozoa. Morfologi diamati pada 10 lapang pandang atau 200 sel spermatozoa pada tiap preparat. Setiap jenis abnormalitas didokumentasikan.
Analisis Data
Data penelitian dikelompokkan, dirancang, dan dirata-ratakan menggunakan
Miscosoft Excel. Selain itu, dilakukan pair T-test menggunakan program SPSS 20 untuk melihat perbedaan abnormalitas spermatozoa menggunakan pewarnaan Williams dan pewarnan eosin-nigrosin.
HASIL DAN PEMBAHASAN
Kondisi Lokasi Penelitian
Balai Pengembangan Perbibitan Ternak (BPPT) Sapi Potong Ciamis secara geografis terletak tujuh kilometer dari Kota Ciamis tepatnya di Dusun Kidul, Desa Cijeunjing, Kecamatan Cijeunjing. Menurut Baharun (2015) suhu udara di daerah tersebut cukup panas, berkisar antara 28-32 oC dengan kelembaban udara 62%-71% dan curah hujan berkisar 22 414 mm per tahun.
Sapi Pasundan yang terdapat di BPPT Sapi Potong Ciamis berjumlah lima ekor pejantan, tetapi hanya tiga ekor pejantan yang dapat dikoleksi semennya. Selain melakukan upaya pembibitan ternak, BBPT Sapi Potong Ciamis juga dilengkapi dengan satu laboratorium untuk pengolahan semen beku sapi Pasundan. Laboratorium tersebut memiliki fasilitas yang cukup memadai dan dilengkapi alat canggih seperti computer assisted sperm analyzed (CASA) yaitu Androvision® (Minitub, Germany) untuk menentukan motilitas spermatozoa dan photometer
SDM6 menu bull concentration and measuarment untuk menentukan konsentrasi spermatozoa.
Jenis Abnormalitas Spermatozoa Sapi Pasundan
Morfologi spermatozoa merupakan hal yang sangat penting dilakukan dalam menentukan jenis-jenis abnormalitas yang ditemukan pada sampel. Pengamatan morfologi spermatozoa diamati dari kepala sampai ke ekor. Jenis
9 abnormalitas pada kepala yang dapat ditemukan yaitu knobbed head, pyriform
atau pearshape, macrocephalic, dan microcephalic. Jenis abnormalitas yang ditemukan pada ekor spermatozoa antara lain abaxial, absent head, bent, bowed tail, coiled tail, detached head, detached tail, fracture midpiece, dan loop
(Gambar 4).
Gambar 4 Bentuk normal dan abnormalitas spermatozoa sapi pasundan pada perbesaran 400 kali menggunakan pewarnaan eosin-nigrosin dan Williams: a) Normal, b)
Abaxial, c) Absent head, d)Bent, e) Bowed tail, f) Coiled tail, g) Deatched head, h) Detached head, i) Fracture midpiece, j) Knobbed head, k) Loop, l) Narrow,
m) Macrocephalic, n) Microcephalic, o) Pyriform.
Jenis spermatozoa yang abnormal juga dapat dilihat dari masing-masing pejantan. Setiap pejantan memiliki jenis abnormalitas yang berbeda (Tabel 2). Berdasarkan hasil penelitian dari tiga pejantan persentase bowed tail merupakan jenis abnormalitas tertinggi dengan persentase sebesar 2.4±0.9%. Jenis abnormalitas tertinggi pada pejantan R05 yaitu bowed tail dengan rerata sebesar 3.2±3.1%. Pada pejantan lain kelainan jenis ini juga cukup tinggi berkisar antara 1.4±1.4%-2.5±3.0%. Menurut Barth dan Oko (1989) bowed tail merupakan bagian dari kelainan midpiece di mana ekor melengkung seperti membentuk huruf U atau berbentuk seperti pelangi. Jenis abnormalitas ini sering ditemukan pada pembuatan preparat yang salah atau abnormalitas saat ejakulasi. Bowed tail tidak menyebabkan penurunan fertilitas.
a b c d e
f g h i j
10
Tabel 2 Jenis abnormalitas spermatozoa sapi pasundan menggunakan pewarnaan Williams (Rerata±SD)
Jenis Abnormalitas Pejantan (%) Rerata±SD (%)
R05 R04 R03 Abaxial 0.0±0.0 0.8±0.9 1.9±2.8 0.9±0.9 Absent head 0.0±0.0 0.9±0.9 0.7±1.0 0.5±0.5 Bent 0.5±1.1 0.0±0.0 0.1±0.2 0.2±0.3 Bowed tail 3.2±3.1 2.5±3.0 1.4±1.4 2.4±0.9 Coiled tail 2.5±3.7 1.0±1.0 0.0±0.0 1.2±1.3 Detached head 2.0±1.8 2.6±1.6 0.9±1.2 1.8±0.8 Fracture midpiece 0.3±0.8 0.6±0.6 0.3±0.7 0.4±0.1 Knobbed head 0.2±0.5 0.4±0.9 0.0±0.0 0.2±0.2 Loop 1.1±1.4 1.3±1.1 0.3±0.6 0.9±0.6 Macrocephalic 0.0±0.0 0.6±0.9 0.0±0.0 0.2±0.3 Microcephalic 0.0±0.0 0.1±0.2 0.0±0.0 0.0±0.0 Narrow 0.0±0.0 0.0±0.0 0.4±0.6 0.1±0.2 Pyriform 0.1±0.3 0.1±0.2 0.4±0.9 0.2±0.2
Keterangan : R05, R04, R03 menunjukkan identitas pejantan
Jenis abnormalitas yang ditemukan tinggi pada pejantan R04 adalah
detached head dengan rerata sebesar 2.6±1.6%. Pejantan lain memiliki jenis abnormalitas ini tidak terlalu tinggi berkisar antara 0.9±1.2% sampai 2.0±1.8%.
Detached head merupakan kelainan dimana kepala spermatozoa terputus dengan ekor, biasanya jenis kelainan ini tidak banyak ditemukan dalam ejakulat.
Detached head berhubungan erat dengan faktor herediter (Barth dan Oko 1989) dan dapat disebabkan oleh faktor buruk yang mempengaruhi pematangan spermatozoa (Chenoweth 2005). Biasanya kelainan ini ditemukan dalam jumlah kecil (<10%) dan sering dihubungkan dengan hipoplasia testis (Purwantara et al.
2010).
Ekor spermatozoa yang seharusnya berada pada tengah dari kepala bergeser menjadi berada dipinggir merupakan salah satu jenis abnormalitas spermatozoa yang disebut abaxial. Abaxial merupakan jenis abnormalitas tertinggi pada pejantan R03 dengan rerata 1.9±2.8%. Pejantan lain seperti R04 ditemukan jenis abnormalitas ini dengan persentase yang sedikit yaitu 0.8±0.9% sedangkan pada pejantan R05 tidak ditemukan abnormalitas jenis ini. Abaxial dapat disebabkan oleh kenainan genetik yang herediter (Barth dan Oko 1989).
Coiled tail merupakan bentuk abnormalitas spermatozoa dimana bagian ujung ekor membentuk lingkaran bulat seperi cincin. Menurut Barth dan Oko (1989) abnormalitas ini disebabkan oleh kesalahan saat pembuatan preparat dan kelainan dalam proses pematangan spermatozoa. Hasil penelitian menunjukkan penjantan R05 dan R04 memiliki persentase abnormalitas spermatozoa jenis ini yang cukup tinggi antara 1.0±1.0%-2.5±3.7%. Sedangkan, pada pejantan R03 tidak ditemukan abnormalitas jenis ini.
Bent principal pieces merupakan abnormalitas spermatozoa yang terjadi pada ekor yang ditandai dengan ekor yang membengkok (bent) dan ekor yang membentuk lingkaran oval pada ujung ekor (loop). Abnormalitas bent ditemukan
11 pada pejantan R05 dan R03 dengan persentase 0.1±0.2%-0.5±1.1% sedangkan pada pejantan R04 tidak ditemukan. Abnormalitas jenis loop pada hasil penelitian ini cukup tinggi pada masing-masing pejantan R05, R04 dan R03 berkisar antara 0.3±0.6%-1.3±1.1%. Menurut Barth dan Oko (1989) abnormalitas bent principal pieces disebabkan spermatozoa normal terpapar oleh larutan hipotonis, kesalahan ketika preparasi praparat dan proses abnormal saat ejakulasi.
Jenis abnormalitas lain yang memiliki efek pada kerusakan spermatozoa adalah absent head dan fracture midpiece. Absent head yaitu abnormalitas dimana pada preparat hanya terlihat ekor spermatozoa saja tanpa kepala. Kelainan
fracture midpiece terjadi ketika ekor spermatozoa tidak panjang seperti seharusnya, ekor spermatozoa mengalami patah pada pertengahan ekor. Kedua abnormalitas ini disebabkan oleh kesalahan pada saat preparasi sampel. Menurut Barth dan Oko (1989) fracture midpiece tidak memengaruhi motilitas dan fertilitas. Berdasarkan hasil penelitian abnormalitas fracture midpiece terjadi pada ketiga pejantan, namun jumlahnya tidak tinggi yaitu antara 0.3±0.7%-0.6±0.6%.
Absent head tidak ditemukan pada pejantan R05 namun pada pejantan R03 dan R04 ditemukan jumlah yang cukup tinggi yaitu 0.7±1.0%-0.9±0.9%.
Pyriform merupakan jenis abnormalitas yang mengakibatkan kepala spermatozoa mengalami penyempitan pada bagian post acrosome (Purwantara et al 2010). Jenis abnormalitas ini memiliki bentuk kepala spermatozoa mirip seperti buah pir maka dinamakan juga sebagai pearshape. Kejadian abnormalitas ini pada hasil penelitian tidak terlalu tinggi. Setiap pejantan ditemukan abnormalitas jenis ini dengan persentase antara 0.1±0.2%-0.4±0.9%. Pyriform bersifat genetik, spermatozoa yang mengalami abnormalitas ini tidak dapat membuahi sel ovum karena ketidakmampuan menembus zona pelusida (Barth dan Oko 1989).
Knobbed head merupakan jenis abnormalitas spermatozoa dimana bagian ujung kepalanya tidak rata, terdapat lekukan ke arah dalam. Knobbed head dapat disebabkan oleh faktor genetik dan lingkungan (Chenoweth 2005). Hasil penelitian mendapatkan adanya abnormalitas jenis ini pada pejantan R05 dan R04 sebesar 0.2±0.5%-0.4±0.9% tetapi pada R03 tidak ditemukan jenis abnormalitas ini
Abnormalitas jenis narrow hampir menyerupai abnormalitas pyriform, perbedaannya pada jenis narrow kepala spermatozoa mengalami penyempitan baik pada daerah acrosome dan post acrosome. Penyempitan tersebut diakibatkan perkembangan yang tidak sempurna ketika proses spermatogenesis. Spermatozoa dengan abnormalitas jenis ini dapat memengaruhi fertilitas (Barth dan Oko 1989). Pada penelitian ini, narrow hanya ditemukan pada pejantan R03 sebesar 0.4±0.6%.
Jenis abnormalitas macrocephalic dan microcephalic termasuk dalam abnormalitas variable size (Riyadhi et al. 2010). Spermatozoa dengan abnormalitas macrocephalic memiliki ukuran kepala yang lebih besar dari spermatozoa normal. Sedangkan spermatozoa dengan abnormalitas microcephalic
memiliki ukuran kepala yang lebih kecil. Menurut Barth dan Oko (1989) abnormalitas ini terjadi akibat pengurangan atau penambahan kromatin inti yang menghasilkan kehilangan atau kelebihan kromosom inti. Selain itu, jenis abnormalitas sangat berhubungan dengan genetik. Hasil penelitian menujukkan hanya pejantan R04 yang memiliki kedua jenis abnormalitas ini dengan jumlah sebesar 0.6±0.9% (macrocephalic) dan 0.1±0.2% (microcephalic).
12
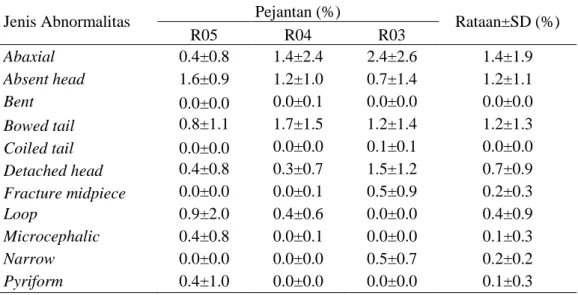
Jenis abnormalitas spermatozoa yang diamati selain menggunakan pewarnaan Williams juga dilakukan menggunakan pewarnaan eosin-nigrosin. Berdasarkan hasil yang diperoleh terdapat 11 jenis abnormalitas spermatozoa menggunakan pewarnaan eosin-nigrosin (Tabel 3). Jenis abnormalitas tertinggi yaitu abaxial sebesar 1.4±1.9%. Selain itu terdapat jenis abnormalitas yang juga memiliki persentase spermatozoa yang cukup tinggi yaitu bowed tail sebesar 1.2±1.3% dan absent head sebesar1.2±1.1%.
Tabel 3 Jenis abnormalitas spermatozoa sapi pasundan menggunakan pewarnaan eosin-nigrosin (Rerata±SD)
Jenis Abnormalitas Pejantan (%) Rataan±SD (%)
R05 R04 R03 Abaxial 0.4±0.8 1.4±2.4 2.4±2.6 1.4±1.9 Absent head 1.6±0.9 1.2±1.0 0.7±1.4 1.2±1.1 Bent 0.0±0.0 0.0±0.1 0.0±0.0 0.0±0.0 Bowed tail 0.8±1.1 1.7±1.5 1.2±1.4 1.2±1.3 Coiled tail 0.0±0.0 0.0±0.0 0.1±0.1 0.0±0.0 Detached head 0.4±0.8 0.3±0.7 1.5±1.2 0.7±0.9 Fracture midpiece 0.0±0.0 0.0±0.1 0.5±0.9 0.2±0.3 Loop 0.9±2.0 0.4±0.6 0.0±0.0 0.4±0.9 Microcephalic 0.4±0.8 0.0±0.1 0.0±0.0 0.1±0.3 Narrow 0.0±0.0 0.0±0.0 0.5±0.7 0.2±0.2 Pyriform 0.4±1.0 0.0±0.0 0.0±0.0 0.1±0.3
Keterangan : R05, R04, R03 menunjukkan identitas pejantan
Setiap pejantan memiliki jenis abnormalitas yang berbeda. Jenis abnormalitas pada kepala yang ditemukan yaitu abaxial (0.4±0.8%-2.4±2.6%),
absent head (0.7±1.4%-1.6±0.9%), detached head (0.3±0.7%-1.5±1.2%),
microcephalic (0.0±0.1%-0.4±0.8%), narrow (0.5±0.7%) dan pyriform
(0.4±1.0%). Selain itu ditemukan juga jenis abnormalitas pada ekor berupa bent
(0.0±0.1%), bowed tail (0.8±1.1%), coiled tail (0.1±0.1%), fracture midpiece
0.0±0.1%), dan loop (0.4±0.6%).
Morfologi Spermatozoa Sapi Pasundan
Tingkat abnormalitas spermatozoa antar pejantan berbeda. Persentase abnormalitas spermatozoa pada pejantan R03 menggunakan pewarnaan Williams paling rendah dibandingkan pejantan lain yaitu sebesar 6.1±2.9%. Pejantan R04 memiliki abnormalitas spermatozoa terendah pada pewarnaan eosin-nigrosin dengan persentase 4.8±3.8%.
13 Tabel 4 Morfologi spermatozoa sapi pasundan menggunakan pewarnaan eosin- nigrosin dan Williams (Rerata±SD)
Sampel Normal Abnormal
Williams Eosin-nigrosin Williams Eosin-nigrosin
R05 90.0±6.0 95.2±3.8 10.0±6.0 4.8±3.8
R04 89.1±4.3 94.9±4.2 10.9±4.3 5.1±4.2
R03 93.9±2.9 93.1±3.2 6.1±2.9 6.9±3.2
Total 91.0±4.8 94.4±3.6 9.0±4.8 5.6±3.6
Keterangan: R05, R04, R03 menunjukkan identitas pejantan. Nilai pada kolom berbeda menunjukkan hasil yang berbeda nyata (p<0.05).
Hasil yang didapat berdasarkan pengujian morfologi spermatozoa dari tiga ekor sapi Pasundan jantan, ternyata terdapat perbedaan persentase abnormalitas antara pewarnaan eosin-nigrosin dan Williams (Tabel 4). Rerata persentase spermatozoa abnormal menggunakan pewarnaan Williams sebesar 9.0±4.8% dan menggunakan pewarnaan eosin-nigrosin sebesar 5.6±3.6%. Hasil tersebut menunjukkan spermatozoa abnormal lebih tinggi pada pewarnaan Williams dibandingkan pewarnaan eosin-nigrosin. Pengamatan morfologi spermatozoa menggunakan pewarnaan Williams lebih mudah diamati karena dalam proses pewarnaan terdapat tahap pencucian preparat yang telah difiksasi menggunakan larutan chloramin 0.5% yang berfungsi menghilangkan lendir sisa dari plasma semen (Arifiantini et al. 2006b). Selain dapat membuat preparat lebih jelas dalam pengamatan morfologi spermatozoa, pewarnaan Williams mempunyai kelebihan lain yaitu praktis dalam prosedurnya. Hal ini karena proses pembuatan, pewarnaan dan pengamatan dapat dilakukan dalam waktu yang berbeda (Purwantara et al.
2010; Riyadhi et al. 2010).
Hasil penelitian menunjukkan bahwa persentase spermatozoa abnormal baik pada pewarnaan Williams dan eosin-nigrosin tidak lebih dari 20% (Tabel 4). Berdasarkan hasil tersebut, semen pada sapi pasundan memiliki kualitas baik. Abnormalitas yang melebihi 20% dapat menurunkan fertilitas (Ax et al. 2000) dan menghambat berhasilnya program inseminasi buatan (Saacke 2008). Berbeda dengan Makhzoomi et al. (2007) yang menyatakan abnormalitas spermatozoa lebih dari 10% dapat berpengaruh terhadap fertilitas.
Hasil penelitian abnormalitas spermatozoa menggunakan pewarnaan Williams hanya sebesar 9.0±4.8% dan eosin-nigrosin sebesar 5.6±3.6% dengan jenis abnormalitas tertinggi yaitu bowed tail. Abnormalitas spermatozoa pada penelitian ini hampir sama dengan abnormalitas spermatozoa pada sapi bali sebesar 9.38% (Arifiantini et al. 2006a). Habitat sapi Bali yang digunakan untuk penelitian tersebut berada di daerah tinggi yang memiliki suhu dingin sedangkan sapi pasundan diternakkan pada daerah yang bersuhu panas. Pernah dilaporkan oleh Qisthon dan Suharyanti (2007) suhu yang tinggi dan kelembaban yang rendah (34oC) akan menyebabkan hewan kambing akan mengalami heat stress
yang menyebabkan meningkatnya spermatozoa abnormal. Hal ini terjadi karena suhu testes meningkat sehingga mengganggu termolegurator skrotum yang berakibat pada menurunnya abnormalitas spermatozoa. Selain itu, lingkungan yang panas akan menyebabkan penurunan persentase spermatozoa normal (Hafez 1993). Hal tersebut memperlihatkan bahwa sapi pasundan sebagai sapi lokal hasil
14
persilangan yang sudah memiliki kemampuan adaptasi yang baik, walaupun habitatnya di daerah yang panas namun memiliki morfologi spermatozoa yang baik. Perbandingan abnormalitas spermatozoa antara sapi pasundan dengan sapi eksotik seperti sapi Limousin tidak berbeda jauh yaitu sebesar 10.40±0.73% (Nugroho et al. 2014). Hasil pengamatan abnormalitas spermatozoa yang berbeda antar peneliti pada sapi dipengaruhi oleh teknik pengumpulan, penanganan semen,
breed dan kualitas hewan (Toelihere 1993).
SIMPULAN DAN SARAN
Simpulan
Persentase abnormalitas spermatozoa sapi pasundan menggunakan pewarnaan Williams adalah 9.0±4.8% dan menggunakan pewarnaan eosin-nigrosin adalah 5.6±3.6%. Jenis abnormalitas yang paling banyak ditemukan menggunakan pewarnaan Williams adalah bowed tail dan menggunakan pewarnaan eosin-nigrosin adalah abaxial. Pewarnaan Williams lebih baik untuk menguji morfologi spermatozoa dibandingkan dengan eosin-nigrosin.
DARTAR PUSTAKA
Afriantini RI, Ferdian F. 2006. Tinjauan aspek morfologi dan morfomerti spermatozoa kerbau rawa (Bubalus bubalis) yang dikoleksi dengan teknik masase. J Vet. 7:83-91.
Arifiantini RI, Wresdiyati T, Retnani EF. 2006a. Pengujian morfologi spermatozoa sapi Bali (Bos Sondaicus) menggunakan pewarnaan Williams.
J Ind Trop Anim Agric. 31(2):105-110
Arifiantini RI, Wresdiyati T, Retnani EF. 2006b. Kaji banding morfometri spermatozoa sapi Bali (Bos sondaicus) menggunakan pewarnaan Williams, eosin, eosin-nigrosin dan formol-saline. J Sci Vet 24(1):65-70.
Arifiantini RI. 2012. Teknik Koleksi dan Evaluasi Semen pada Hewan. Bogor (ID): IPB Pr.
AxRL, Dally MR, Didion BA, Lenz RW, Love CC, Varner DD, Hafez B, Bellin ME. 2000. Semen Evaluation. Hafez ESE, Hafez B, editor. Reprod in Farm Anim. 7th Ed. Philadelphia (US): Lippincot Wiliams and Wilkins. Baharun A. 2015. Potensi Reproduksi serta Keberhasilan Pembekuan Semen
Menggunakan Pengencer Tris Kuning Telur dan Tris Soya pada Sapi Pasundan [tesis]. Bogor (ID): Institut pertanian Bogor.
Barth AD, Oko. 1989. Abnormal Morfology of Bovine Spermatozoa. Iowa (US): Iowa State University Press.
15 Ermayanti Ni Gusti AM, Suarni Ni Made R. 2010. Kualitas spermatozoa mencit (Mus musculus L.) setelah perlakuan infus kayu amargo (Quassia amara
Linn.) dan pemulihannya. J Biol. 1:45-49.
Freshman JL. 2002. Semen Collection and Evaluation. USA (US): Elsevier Science.
Fuquay JW, Bearden HJ, Willard ST. 2004. Applied Animal Reproduction. Ed ke-6. New Jersey (US): Pearson education Inc.
Garner DL, Hafez ESE. 2000. Spermatozoa and Seminal Plasma. In Hafez B, Hafez ESE. 2000. Reprod in Farm Anim. 7th Ed. Philadelphia (US): Lippincott Williams and Wilkins.
Hafez ESE. 2000. Reproduction in Farm Animals 7th Ed. Philadelphia (US): Lippincott Williams & Wilkins.
Hafez ESE. 1993. Reproduction in Darm Animals 6th Ed. Philadelphia (US): Lea and Febiger.
[Kementan] Kementerian Pertanian. 2014. Keputusan Menteri Pertanian Republik Indonesia Nomor 1051 Tahun 2014 tentang Penetapan Rumpun Sapi Pasundan. Jakarta (ID): Kementan.
Makhzoomi A, Lundeheim N, Haard M, Rodriguez-Martinez. 2007. Spem morphology and fertility of progenty tested-AI Swedish dairy bull. J Anim Vet Advan. 8:975-980.
Morrell JM. 2010. Artificial Insemination: Current and Future Trends. Swedia (SE): University of Agricultural Sciences.
Nugroho Y, Susilawati T, Wahjuningsih S. 2014. Kualitas semen sapi limousin selama pendinginan menggunakan pengencer cep-2 dengan penambahan berbagai konsenterasi kuning telur dan sari buah jambu biji (Psidium guajava). J Trnk Trop. 15(1): 31-42.
Ogbuewu IP, Aladi NO, Etuk IF, Opara MN, Uchegbu MC, Okoli IC, Iloeje MU. 2010. Relevance of oxygen free radicals and antioxidants in sperm production and function. J Res Vet Sci. 3(3):138-164.
Prastowo A. 2008. Morfologi dan Morfometri Spermatozoa Babi Yorkshire dalam Nilai Ejakulat dengan Pewarnaan Williams [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Purdy PH. 2006. A review on goat sperm cryopreservation. Small Rumin Res. 63: 215-225.
Purwantara B, Arifiantini RI, Riyani M. 2010. Sperm morphologycal assessment of Friesian Holstein semen collected from three aritificial insemination center in Indonesia. J Ind Trop Anim Agric. 35(2):90-94.
Qisthon A, Suharyati S. 2007. Pengaruh penggunaan naungan terhadap kualitas semen kambing peranakan Ettawa. Anim Prod. 9(2):72-78.
Riyadhi M, Arifantini RI, Purwantara B. 2010. Kajian morfologi Sapi Simental di beberapa balai inseminasi buatan di Indonesia. Ind J Vet Sci Med. 1(2):1-7. Riyadhi M, Arifiantini RI, Purwantara B. 2012. Korelasi morfologi abnormalitas
primer spermatozoa terhadap Umur pada beberapa bangsa sapi potong.
Agroscientiae. 19(2):79-85.
Saacke RG. 2008. Sperm Morphology: Its revelance to conpensable and unconpensable traits in semen. Therigenology. 70:473-478.
16
Salmah N. 2014. Motilitas, Persentase Hidup dan Abnormalitas Spermatozoa Semen Beku Sapi Bali pada Pengencer Andromed dan Tris Kuning Telur [skripsi]. Makassar (ID): Universitas Hananuddin.
Thalib A, Sitepu P, dan Matondang RH. 2001. Pengaruh Flushing terhadap Performans Sapi Dara Turunan Brahman. Prosiding Seminar Nasional Teknologi Peternakan dan Veteriner. Bogor (ID): Balai Penelitian Ternak Ciawi.
Toelihere MR. 1993. Inseminasi Buatan pada Ternak. Bandung (ID): Angkasa. Yudi, Tuty LY, Purwantara B, Agil M, Wresdiyati T, Sajuthi D, Aditya,
Manangsang J, Sudarwati R, Hastuti TY. 2010. Morphology and morfometri of spermatozoa of the Anoa (Bubalus sp) stained using Williams’s and eosin-nigrosin. Media Petern. 33(2):88-94.
17 Lampiran 1 Hasil statistika morfologi spermatozoa menggunakan pewarnaan
eosin-nigrosin dan Williams
Paired Samples Correlations
N Correlation Sig
.
Pair 1 nwilliam & n.EN 15 -.011 .968
Pair 2 an.William & an.EN 15 -.011 .968
Paired Samples Statistics
Mean N Std. Deviation Std. Error Mean
Pair 1 nwilliam 91.0067 15 4.75311 1.22725 n.EN 94.3867 15 3.61166 .93253 Pair 2 an.William 8.9933 15 4.75311 1.22725 an.EN 5.6133 15 3.61166 .93253
Paired Samples Test
Paired Differences t df Sig. (2-tailed) Mean Std. Deviation Std. Error Mean 95% Confidence Interval of the Difference Lower Upper
Pair 1 nwilliam - n.EN -3.38000 6.00169 1.54963 -6.70363 -.05637 -2.181 14 .047
18
RIWAYAT HIDUP
Penulis dilahirkan di Cianjur, Jawa Barat pada tanggal 4 Juli 1994 sebagai anak bungsu dari pasangan Kapten Inf. Misilan (alm) dan Yuyun Yuhana. Tahun 2012 penulis lulus dari SMA Titian Teras Jambi dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur undangan Seleksi Masuk IPB dan diterima di Fakultas Kedokteran Hewan.
Selama mengikuti perkuliahan, penulis menjadi asisten praktikum Anatomi I pada tahun ajaran genap 2013/2014, asisten praktikum Histologi Veteriner I pada tahun ajaran genap 2013/2014 dan asisten praktikum Ilmu Bedah Khusus I pada tahun ajaran genap 2015-2016. Penulis juga pernah aktif menjadi anggota Gugus Disiplin Asrama (GDA) pada saat TPB tahun 2012, Sekertaris 2 Ikatan Kedokteran Hewan Indonesia (IMAKAHI) pada tahun 2014, Ketua Divisi Zoolipmask IMAKAHI pada tahun 2015, anggota dalam Himpunan Minat Profesi (Himpro) Ruminansia pada tahun 2014 dan Sekertaris Divisi Eksternal Himpro Ruminansia.