BAB 2
TINJAUAN PUSTAKA
2.1 Mikobakterium
2.1.1 Mycobacterium tuberculosis complex
Tuberkulosis adalah suatu penyakit yang disebabkan oleh M. tuberculosis complex, termasuk M. tuberculosis, M. bovis, M. africanum, M. pinnipedii, M. microti, M. caprae, M. canettii. (Public health Agency of Canada, 2010).
2.1.2 Patogenesis mikobakterium
Terdapat perbedaan yang bermakna dalam kemampuan berbagai mikobakterium untuk menyebabkan lesi pada berbagai macam spesies penjamu. Manusia dan marmut sangat sensitif terhadap infeksi M. tuberculosis, sementara unggas dan sapi resisten terhadap M. tuberculosis dan M. bovis. Pada negara maju, M. bovis saat ini sangat jarang muncul. Beberapa mikobakterium "atipikal" (misalnya, Mycobacterium kansasii) menyebabkan penyakit pada manusia yang tidak dapat dibedakan dari tuberkulosis. Mikobakterium yang lain (misalnya, M. fortuitum) hanya menyebabkan lesi pada permukaan atau berfungsi sebagai oportunis (Brooks, 2007).
2.1.3 Morfologi dan struktur Mycobacterium tuberculosis
Mikobakteria berbentuk batang ramping yang sering menunjukkan bentuk koloni filamen bercabang menyerupai miselium jamur. Maka nama “mikobakteria“ artinya adalah bakteri yang seperti jamur. Dalam kultur cair mereka membentuk cetakan seperti kulit tipis (pelikel) (Ananthanarayan dan Paniker, 2005).
Mikobakteria adalah genus basil gram-positif yang menunjukkan karakteristik pewarnaan tahan asam. Mycobacterium tuberculosis adalah agen etiologik tuberkulosis yang paling penting. Tuberkulosis merupakan salah satu penyakit tertua dan penyebab utama kematian akibat penyakit infeksi di seluruh dunia saat ini (Ryan dan Ray, 2010).
Mycobacterium tuberculosis termasuk genus Mycobacterium dari familia Mycobacteriaceae, ordo Actinomycetales . Bersifat non-motil , aerob obligat yang tidak membentuk spora. Dinding sel terdiri dari peptidoglikan, dan mirip dengan organisme gram-positif lainnya yang banyak mengandung polisakarida rantai cabang, protein dan lipid (Ryan dan Ray, 2010).
2.1.4 Genetika biosintesis dinding sel mikobakterium
Patogenitas M. tuberculosis terhadap manusia sebagian disebabkan karena dinding selnya yang atipik, merupakan struktur berlapis yang mengandung peptidoglikan, arabinogalaktan (AG), asam mikolat, glikolipid dan kapsul polisakarida yang berada dibagian luar membran plasma. Struktur ini bersifat impermiabel sehingga berperan sebagai pelindung alami terhadap serangan, baik dari sistem imunitas tubuh host maupun dari banyak antibiotik. Dengan demikian, dinding sel memainkan peran penting dalam kelangsungan hidup M. tuberculosis (Briken et al., 2004).
Dinding sel mikobakteria sangat kaya lipid (sampai dengan 60% dari total massa dinding sel), dan dari urutan genom M. tuberculosis terungkap bahwa sebagian besar gen dikhususkan untuk produksi dan metabolisme lipid. Beberapa komponen dinding sel M. tuberculosis seperti cord factor lipoarabinomannan (LAM) dan asam mikolat menjadi salah satu faktor pendukung proses virulensi
dan penggangguan respon imun dari host, sedangkan komponen lain, misalnya Arabinogalaktan dan peptidoglikan memiliki peran lebih pada struktur M. tuberculosis. Hal ini menunjukkan pentingnya regulasi dinding sel baik untuk pertumbuhan, virulensi dan bahkan basil ini mampu mengubah komposisi dinding sel mereka sebagai respon terhadap perubahan lingkungan (Goude dan Parish, 2008).
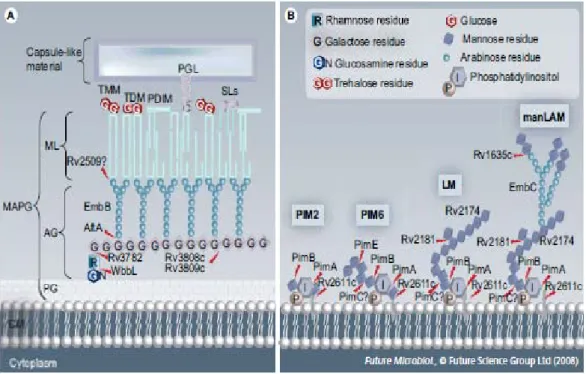
Komponen utama dari dinding sel mikobakteria adalah lapisan mycolyl-arabinogalactan-peptidoglycan (Gambar 2.1). Stuktur dinding sel ini terdiri dari beberapa komponen yang saling berhubungan, peptidoglikan terletak di luar membran plasma yang secara kovalen terkait dengan arabinogalaktan (AG), pada akhirnya akan teresterifikasi dengan asam mikolat. Polimer ini (mycolyl-arabinogalactan-peptidoglycan) membentuk kerangka struktural dari dinding sel serta membentuk barier hidrofobik yang bertanggung jawab atas resistensi intrinsik mikobakteria ke sejumlah antibiotik. Lapisan ini merupakan bagian penting dari struktur sel, dan telah terbukti terdapat sejumlah enzim penting dalam proses sintesisnya (Sacco et al., 2007; Amin et al., 2008).
Sejumlah studi terbaru mengidentifikasi enzim yang terlibat dalam biosintesis struktur arabinogalaktan. Biosintesis arabinogalaktan sebagian besar dikatalisis oleh enzim yang dikode dalam fragmen 50kb dari Rv3779 ke Rv3809c, fragmen ini disebut “AG biosintesis gen cluster” (Mikusova et al.,2006).
Gambar 2.1 (A) Skema selubung sel M. tuberculosis. CM, AG, ML, PG, PGL, PDIM, TDM, TMM dan SL. (B) struktur LAM, LM and PIM. AG: Arabinogalactan; CM: Cytoplasmic membrane (membran sitoplasma); LAM: Lipoarabinomannan; LM: Lipomannan; MAPG: Mycolyl-arabinogalactanpeptidoglycan; ML: Mycolic acid; PDIM: Phthiocerol dimycocerosate; PG: Peptidoglycan; PGL: Phenolic glycolipid; PIM: Phosphatidylinositol mannoside; SL: Sulpholipid; TDM: Trehalose dimycolate; TMM: Trehalosemonomycolate (Goude dan Parish, 2008).
Asam mikolat merupakan asam lemak α-alkil-β-hidroksi kompleks yang sangat panjang (C60-C90). Ditemukan baik terikat secara kovalen pada dinding sel
atau dalam bentuk trehalosa monomikolat (TMM) atau trehalosa dimikolat (TDM). Lapisan ini menyebabkan permeabilitas yang sangat rendah dari dinding sel mikobakteria dan menjelaskan ketahanan alami mikobakteria terhadap antibiotik. Asam mikolat juga terlibat dalam virulensi M. tuberculosis. Biosintesis asam mikolat melibatkan produksi asam lemak rantai panjang (meromikolat) dan derivat asam lemak karboksilat yang lebih pendek, kemudian diikuti oleh kondensasi untuk membentuk molekul akhir. Dinding sel M. tuberculosis terdiri dari tiga jenis asam mikolat (α, metoksi dan keto), perbedaan ketiganya hanya
dalam kelompok-kelompok fungsional yang ditemukan dalam rantai meromikolat (Goude dan Parish, 2008).
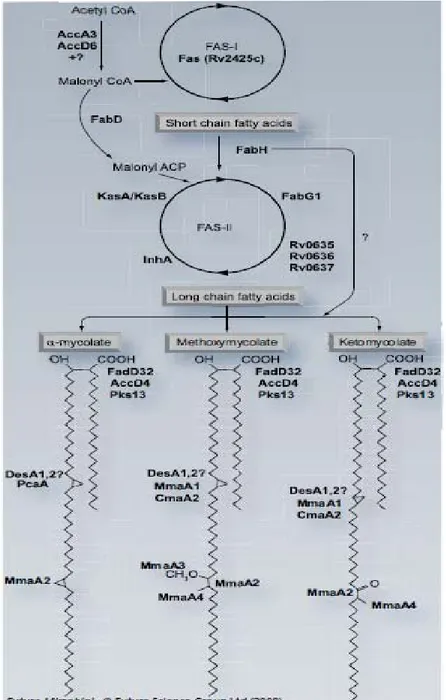
Sintesis rantai asam lemak dimulai oleh asetil-KoA karboksilase, terdiri dari subunit α (AccA3) dan β (AccD6) yang mengatur aktivasi malonil-KoA untuk berperan sebagai perantara bagi Fatty Acid Sinthase (FAS). Mikobakteria memiliki dua sistem FAS, yaitu sistem FAS tipe I (FAS-I) dan tipe 2 (FAS-II) (Gambar 2.2). FAS–I dikode oleh fas (Rv2524c). FAS-I adalah enzim multidomain berukuran besar (326kDa), yang melakukan beberapa aktivitas katalitik. Enzim ini bertanggung jawab untuk sintesis de novo asam lemak rantai pendek, studi terbaru menunjukkan bahwa ia juga bertanggung jawab dalam produksi heksakosanoil-S-KoA pendek yang berperan dalam tahap kondensasi akhir dengan rantai meromikolat. Kemudian asam lemak yang disintesis oleh FAS-I diperpanjang oleh sistem FAS-II untuk menghasilkan asam meromikolat. FAS-II adalah sistem yang multiprotein, terdiri dari empat aktivitas enzimatik untuk memperpanjang asam lemak dengan dua unit karbon pada setiap siklusnya. Pada setiap siklus terjadi aktivitas yang berurutan, yaitu dari β-ketoacyl-ACP reductase (FabG1), trans-2-enoil-ACP reductase (inhA), (3R)-hydroxyacyl-ACP dehydratasedan β-ketoacyl-ACP synthetase (Goude dan Parish, 2008).
Gambar 2.2 Biosintesis asam mikolat M. tuberculosis dan skema 3 tipe asam mikolat yang ditemukan pada M. tuberculosis. FAS-I memproduksi asam lemak rantai pendek, yang selanjutnya diperpanjang oleh FAS-II untuk sintesis meromikolat atau digunakan sebagai cabang α asam mikolat. Berbagai enzim yang terlibat pada masing – masing reaksi ditunjukkan dengan cetak tebal (Goude dan Parish, 2008).
2.1.5 Genom Mycobacterium tuberculosis
Mycobacterium tuberculosis memiliki sebuah kromosom sirkular dengan jumlah DNA 4.411.532 bp dengan 4.031 gen pengkode dan 4109 transkrip gen. Keseluruhan genom ini mengandung 65.5 % G (guanin) dan C (sitosin). Menurut
data terakhir dari The Sanger Centre pemetaan sekuens genomnya telah lengkap dianalisa (Portillo et al., 2007; Ensembl, 2015).
2.1.6 Enzim katalase – peroksidase Mycobacterium tuberculosis
Katalase – peroksidase adalah enzim hasil ekspresi gen KatG M. tuberculosis yang terdiri dari 740 asam amino. Merupakan enzim yang memiliki dua fungsi (bifunctional enzyme) dengan aktivitas katalase dan peroksidase yang luas (broad-spectrum). Berperan dalam aktivitas oksidasi NADH sebagai ekivalen pereduksi dan pemasangan isoniazid aktif dengan NADH membentuk isonicotinic acyl-NAD complex. Kemungkinan berperan dalam survival intraseluler M. tuberculosis dan mungkin terlibat dalam repair DNA. Persamaan aktivitas katalitiknya adalah, donor + H2O2 = donor teroksidasi + 2 H2O, juga 2H2O2 = O2
+ 2H2O. Mengikat 1 heme B (iron-protoporphyrin IX) sebagai ko-faktornya
(Uniprot, 2015).
2.2 Tuberkulosis Paru 2.2.1 Epidemiologi
Sumber infeksi yang paling sering berasal dari spesimen yang diekskresikan manusia terutama dari traktus respiratorius berupa basil tuberkel dalam jumlah banyak. Kontak erat (misalnya, dalam sebuah keluarga) dan pajanan masif (misalnya, pada petugas kesehatan) membuat transmisi melalui droplet paling mungkin terjadi. (Brook, 2007).
Pembagian penderita TB menjadi kasus baru dan kasus pengobatan ulangan didasarkan pada riwayat pengobatan sebelumnya. Kasus baru adalah penderita yang belum pernah diobati dengan OAT atau sudah pernah menelan
OAT kurang dari satu bulan (4 minggu). Sedangkan kasus pengobatan ulangan adalah kasus yang sebelumnya pernah diobati dan menelan OAT selama 1 bulan atau lebih, termasuk diantaranya kasus kambuh (relaps), kasus setelah putus berobat (default), dan kasus setelah gagal (failure) (KEMENKES RI, 2011).
Kasus kambuh (relaps) adalah penderita tuberkulosis yang sebelumnya pernah mendapat pengobatan tuberkulosis dan telah dinyatakan sembuh atau pengobatan lengkap, didiagnosis kembali dengan BTA positif (apusan atau kultur). Kasus setelah putus berobat (default) adalah pasien yang telah berobat dan putus berobat 2 bulan atau lebih dengan BTA positif. Kasus setelah gagal (failure) adalah pasien yang hasil pemeriksaan dahaknya tetap positif atau kembali menjadi positif pada bulan kelima atau lebih selama pengobatan (KEMENKES RI, 2011).
Resistensi Obat Anti Tuberkulosis (OAT) diklasifikasikan berdasarkan tes kerentanan terhadap obat / drug susceptibility testing (DST) meliputi; mono-resistence: kekebalan terhadap satu OAT lini pertama saja,; polydrug-resistance: kekebalan terhadap lebih dari satu OAT, selain kombinasi isoniazid dan rifampisin,; multidrug-resistance (MDR): kekebalan terhadap sekurang-kurangnya isoniazid dan rifampisin,; extensive drug-resistance (XDR): MDR ditambah kekebalan terhadap salah satu obat golongan flourokuinolon, dan sedikitnya salah satu dari OAT injeksi lini kedua (kapreomisin, kanamisin dan amikasin) (WHO, 2013; Soepandi, 2010).
Secara umum resistensi terhadap OAT dibagi menjadi: resistensi primer, resistensi sekunder dan resitensi inisial. Resistensi primer adalah resistensi yang terjadi pada M. tuberculosis terhadap OAT, dimana penderita tidak memiliki riwayat pengobatan OAT atau pernah mendapat pengobatan OAT, namun kurang
dari 1 bulan. Sedangkan resistensi sekunder, pasien telah mempunyai riwayat pengobatan OAT minimal 1 bulan. Pada resistensi inisial, bila tidak diketahui pasti apakah pasien sudah ada riwayat pengobatan OAT sebelumnya atau belum pernah (Sihombing, 2012).
2.2.2 Diagnosis
Seseorang ditetapkan sebagai tersangka penderita tuberkulosis paru apabila ditemukan gejala klinis utama (simtom kardinal) pada dirinya. Gejala utama pada tersangka tuberkulosis paru adalah : batuk berdahak lebih dari tiga minggu, batuk berdarah, sesak nafas, nyeri dada. Gejala lainnya adalah berkeringat pada malam hari, demam tidak tinggi/meriang, dan penurunan berat badan. Dahak penderita harus diperiksa dengan pemeriksaan mikroskopik. Untuk menegakkan diagnosa penyakit tuberkulosis dilakukan pemeriksaan laboratorium untuk menemukan BTA (basil tahan asam) positif. Pemeriksaan lain yang dilakukan yaitu pemeriksaan kultur bakteri dan tes kepekaan obat. Alat diagnostik lain adalah pemeriksaan radiologis dan tuberculin skin test. Metode pemeriksaan dahak (bukan liur) sewaktu, pagi, sewaktu (SPS) dengan pemeriksaan mikroskopis membutuhkan 5 ml dahak dan biasanya menggunakan pewarnaan panas dengan metode Ziehl- Nielsen (ZN) atau pewarnaan dingin Kinyoun-Gabbet menurut Tan Thiam Hok. Bila dari dua kali pemeriksaan didapatkan hasil BTA positif, maka pasien tersebut dinyatakan positif mengidap tuberkulosis paru (Andina, 2012).
Secara teoritis metode polimerase chain reaction (PCR) lebih sensitif dibandingkan metode konvensional mikroskopik. Metode PCR akan memberikan hasil positif walaupun hanya terdapat 1-10 kuman dalam spesimen pemeriksaan,
dan juga PCR dapat memberikan hasil positif walaupun kuman mati/dormant atau secara pewarnaan Ziehl-Nielsen telah konversi akibat pengobatan OAT lini pertama (Lina et al., 2009; Andina, 2012).
Pada penelitian sputum menggunakan teknik PCR yang dilakukan terhadap 36 pasien TB paru BTA negatif, didapatkan hasil pemeriksaan PCR positif sebanyak 13 sampel (36.11%). Penelitian pada tahun 1996 di Rio de Jeneiro terhadap TB paru mikroskopis BTA mendapatkan PCR positif sebesar 44.9% (Andina, 2012). Oleh sebab itu penelitian yang akan peneliti lakukan akan menggunakan metode PCR untuk menentukan ada tidaknya M. tuberculosis pada sputum subjek yang telah meminum INH sampai akhir minggu ke-4.
Saat ini, untuk menegakkan diagnosis resistensi obat TB diawali dengan mengenali faktor resiko dan mempercepat dilakukannya diagnosis laboratorium. Deteksi lebih awal dan memulai terapi TB-MDR merupakan faktor penting mencapai keberhasilan pengobatan. Pemeriksaan dilakukan meliputi sputum BTA, uji kultur M. tuberculosis dan resistensi obat. Kemungkinan resistensi obat TB secara simultan dipertimbangkan dengan pemeriksaan sputum BTA sewaktu menjalani panduan terapi awal. Diagnosis terjadinya resistensi OAT dilakukan berdasarkan uji laboratorium untuk menunjukkan isolat M. tuberculosis yang menginfeksi tubuh secara in vitro sensitif atau telah resisten terhadap satu atau lebih obat-obat anti tuberkulosis (Andina, 2012).
2.2.3 Pengobatan
Obat anti tuberkulosis (OAT) dibagi menjadi dua kelompok yang dikenal dengan OAT lini pertama (first line) dan lini kedua (second line). Istilah lini pertama digunakan untuk obat pilihan utama (isoniazid, etambutol, rifampisin,
pirazinamid, streptomisin) yang telah lama dipakai secara klinis serta menunjukkan efikasi yang baik dan efek samping paling minimal. OAT lini kedua (asam para-aminosalisilat, etionamid, sikloserin, flouroquinolon, kanamisin, amikasin) digunakan ketika dijumpai resistensi M. tuberculosis terhadap obat lini pertama atau ada obat lini pertama yang dikontraindikasikan pada penderita tertentu. (Ryan KJ dan Ray CG, 2010).
Menurut KEMENKES RI (2011), kasus TB baru (TB paru BTA positif, TB paru BTA negatif foto toraks positif, dan TB ekstra paru) yang belum pernah mendapat pengobatan dikelompokkan sebagai kategori 1. OAT pada kategori 1 ini adalah OAT lini pertama yang pemberiannya dalam 2 tahap, yaitu tahap intensif (inisial) dan tahap lanjutan. Pada tahap intensif penderita menelan isoniazid (H), rifampisin (R), pirazinamid (Z) dan etambutol (E) setiap hari selama 2 bulan, sedangkan pada tahap lanjutan penderita menelan isoniazid (H) dan rifampisin (R) tiga kali seminggu selama 4 bulan. Totalnya penderita menelan OAT selama 6 bulan. Panduan ini biasa disingkat penulisannya dengan 2(HRZE)/4(H3R3).
Sedangkan kasus BTA positif yang sebelumnya sudah pernah diobati (kambuh, gagal dan setelah putus berobat) dikelompokkan sebagai kategori 2. OAT pada kategori 2 ini adalah OAT lini pertama yang pemberiannya dalam 2 tahap, yaitu tahap intensif dan tahap lanjutan. Pada tahap intensif, awalnya penderita mendapat isoniazid (H), rifampisin (R), pirazinamid (Z), etambutol (E) dan streptomisin (S) setiap hari selama 2 bulan, kemudian dilanjutkan dengan isoniazid (H), rifampisin (R), pirazinamid (Z) dan etambutol (E) setiap hari selama 1 bulan berikutnya. Pada tahap lanjutan penderita menelan isoniazid (H), rifampisin (R) dan etambutol (E) tiga kali seminggu selama 5 bulan. Totalnya
penderita menelan OAT selama 8 bulan. Panduan ini biasa disingkat penulisannya dengan 2(HRZES)/HRZE/5(H3R3E3).
2.3 Farmakologi INH 2.3.1 Penemuan dan struktur
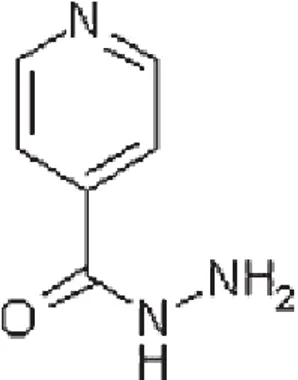
Gambar 2.3. Struktur Isoniazid (Becker et al., 2007)
Isoniazid disintesis oleh Meyer dan Mally di University of Prague Jerman pada tahun 1912. Pada tahun 1952 secara independen dilakukan rediscovery oleh Bayer Laboratories di Jerman, Hoffman-La Roche Laboratories di Switzerland / USA, dan Squibb Laboratories di USA, masing-masing bekerja tanpa sepengetahuan satu sama lain (IUATLD, 2002).
Nama generiknya adalah Isoniazid / Isonicotinic acid hydrazide (INH) / 4-Pyridinecarboxylic acid hydrazide dengan struktur seperti terlihat pada gambar 2.3 (Becker et al., 2007).
2.3.2 Mekanisme kerja dan indikasi terapi
Isoniazid hanya aktif terhadap mikobakteria. Efeknya terutama terhadap M. tuberculosis complex, dan pada tingkat lebih rendah terhadap beberapa spesies mikobakteria lain misalnya, M. kansasii. Minimum Inhibition Concentration (MIC) M. tuberculosis adalah 0.025-0.05 mg/L dalam kaldu dan 0.1-0.2 mg/L dalam piring agar, hal ini menunjukkan ketidakpastian seputar penentuan MIC.
Isoniazid memiliki awal aktivitas bakterisidal yang paling ampuh dibandingkan semua OAT lain. Menambahkan obat lain tidak akan meningkatkan aktivitas INH tersebut. Dengan demikian, segera dapat diamati penurunan kemampuan mikobakteria dalam penularan selama pengobatan tahap intensif, kemungkinan besar ini disebabkan aktivitas bakterisidal dari isoniazid yang baik tersebut (IUATLD, 2002).
WHO merekomendasikan rentang dosis 4-6 mg/kg, dengan dosis harian maksimum tidak melebihi 300 mg. Dosis maksimum 300 mg juga digunakan untuk terapi pencegahan pada populasi dengan resiko tinggi. Pada dosis ini umumnya INH ditoleransi dengan baik (Becker et al., 2007).
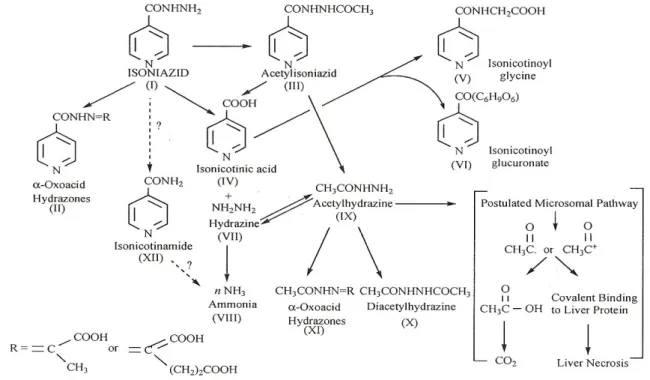
Pada proses kinetikanya, INH cepat diserap melalui saluran cerna pada pemberian per-oral (Sweetman, 2009; Becker et al., 2007; Teixeira et al., 2013) dan mencapai hati melalui sistem vena porta. Sebelum mencapai sirkulasi sistemik INH akan mengalami metabolisme lintas awal (first pass metabolism) dihati dan terjadi pengurangan bioavailabilitasnya. Sekitar 75% - 95% dari INH diekskresikan oleh ginjal dalam 24 jam pertama, terutama sebagai metabolit berbentuk asam asetilisoniazid dan asam isonikotinat (Texeira et al., 2013). Dalam jumlah yang kecil INH diekskresikan melalui feses, dan terbuang pada proses hemodialisa (Sweetman, 2009).
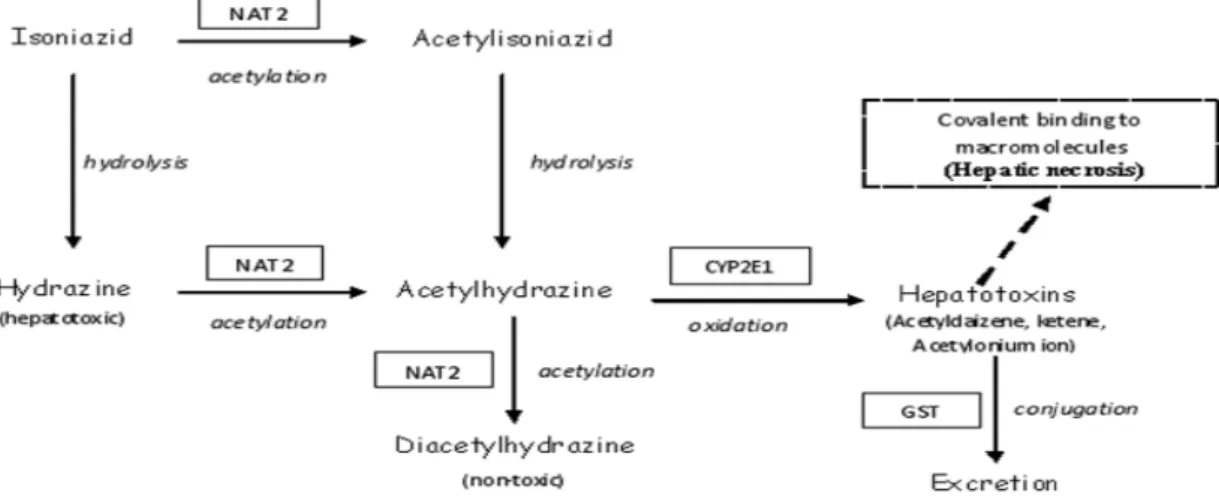
Rute metabolik utama asetilasi isoniazid menjadi asetilisoniazid oleh enzim N-asetiltransferase 2 (NAT2) ditemukan di hati dan usus halus. Dalam hati, INH dimetabolisme menjadi asetilisoniazid oleh N-asetiltransferase 2 (NAT2), diikuti oleh proses hidrolisis untuk menjadi asetilhidrazin dan kemudian dioksidasi oleh sitokrom P4502E1 (CYP2E1) menjadi senyawa intermediet yang
bersifat hepatotoksik. Metabolit ini dapat merusak sel hepatosit, baik dengan cara mengganggu homeostasis sel atau dengan memicu reaksi imunologis dimana metabolit yang bersifat reaktif ini terikat pada protein plasma sel hepatosit dan bertindak sebagai hapten. Jalur metabolisme lain yang berperan untuk menghasilkan metabolit toksik adalah hidrolisis langsung INH menjadi hidrazin (hepatotoksin yang poten). N-asetiltransferase 2 (NAT2) juga bertanggung jawab untuk mengkonversi asetilhidrazin menjadi diasetilhidrazin (komponen nontoksik). Glutation S-transferase (GST) merupakan enzim detoksifikasi penting pada fase II, berperan protektif sebagai pemungut/pengikat radikal bebas intraseluler, melalui reaksi konjugasi glutation dengan metabolit toksik yang dihasilkan dari CYP2E1. Konjugasi sulfhidril memfasilitasi pengeluaran metabolit dari tubuh dan mengurangi efek toksik. Dalam beberapa tahun terakhir, semakin banyak penelitian yang menunjukkan bahwa polimorfisme genetik pada gen NAT2, CYP2E1 dan GST berkaitan dengan kerentanan terhadap kejadian hepatotoksisitas yang diinduksi obat (drug-induced hepatotoxicity) selama pengobatan TB (Gambar 2.4 a & b) (Teixeira et al., 2013).
Gambar 2.4a. Alur metabolisme INH dan enzim – enzim utama yang terlibat (terdapat didalam tanda kotak) (Teixeira et al., 2013).
Gambar 2.4b. Alur metabolisme INH (Preziosi, 2007).
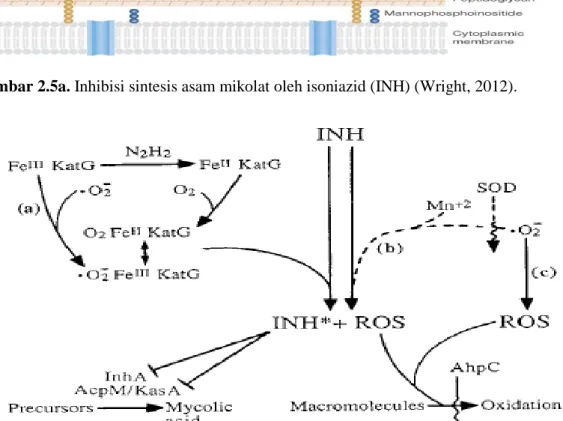
Isoniazid masuk ke dalam sel M. tuberculosis secara difusi pasif. Isoniazid merupakan prodrug yang diaktivasi oleh enzim katalase-peroksidase (KatG) yang berada didalam sel M. tuberculosis. Enzim KatG memasangkan isonicotinic acyl (bentuk aktif INH) dengan NADH untuk membentuk isonicotinic acyl-NAD complex. Kompleks ini berikatan erat pada enoylacyl-acyl carrier protein (ACP) reductase yang dikenal sebagai InhA sehingga memblokade substrat alaminya (enoyl-AcpM) untuk dapat berikatan dan memblokade aktivitas sintesis asam lemak. Proses ini menghambat sintesis asam mikolat yang diperlukan untuk dinding sel mikobakteria (gambar 2.5 a & b) (FAD, 2013). Kompleks AcpM-KasA yang terlibat dalam sintesis asam mikolat berikatan dengan INH aktif (Wang et al, 1997). Mekanisme kerja isoniazid secara detail masih tetap sulit untuk dipahami, hanya mekanisme kerjanya secara umum yang telah dipahami dengan baik (IUATLD, 2002).
Gambar 2.5a. Inhibisi sintesis asam mikolat oleh isoniazid (INH) (Wright, 2012).
Gambar 2.5b. Potensi keterlibatan superoksida dalam aktivitas INH . INH sebagai prodrug yang diaktifkan oleh protein KatG (katalase - peroksidase) atau oleh Mn2+. Di sebelah kiri gambar adalah skema yang menunjukkan bentuk KatG non-aktif (FeIII KatG) yang diubah menjadi bentuk aktif oleh dua jalur, salah satunya (a) membutuhkan superoksida (O2
-). Di sebelah kanan adalah skema yang menunjukkan aktivasi INH oleh jalur dependen Mn2+ yang juga melibatkan superoksida (b), jalur ini dapat dihambat oleh superoksida dismutase (SOD). Jalur ini ditunjukkan dengan garis putus-putus karena mungkin tidak signifikan secara in vivo. INH aktif (INH*) menghambat sintesis asam mikolat dengan cara menonaktifkan InhA dan ACPM - KasA. Spesies oksigen reaktif (ROS) timbul selama aktivasi INH atau akibat kehadiran superoksida (c). Protein AhpC muncul untuk membatasi akumulasi kerusakan oksidatif makromolekul yang diharapkan timbul dari aktivasi INH atau adanya superoksida. Garis bergelombang menunjukkan penghambatan jalur, dan jalur dengan bar tegak lurus menunjukkan penghambatan enzim (Wang et al., 1997).
2.4 Resistensi Mycobacterium tuberculosis Terhadap INH 2.4.1 Mutasi dan mekanisme resistensi
Mutasi adalah perubahan pada materi genetik suatu mahluk hidup yang terjadi secara tiba-tiba dan acak, merupakan dasar bagi sumber variasi organisme hidup yang bersifat terwariskan (heritable). Menurut kejadiannya, mutasi dapat terjadi secara spontan (spontaneous mutation) dan juga dapat terjadi melalui induksi (induced mutation). Mutasi spontan adalah mutasi yang terjadi akibat adanya sesuatu pengaruh yang tidak jelas, baik dari lingkungan luar maupun dari internal organisme itu sendiri. Sedangkan mutasi terinduksi adalah mutasi yang terjadi akibat paparan dari sesuatu yang jelas misalnya paparan sinar UV, senyawa kimia mutagenik, obat – obatan dll. Secara mendasar tidak terdapat perbedaan antara mutasi yang terjadi secara alami dan mutasi hasil induksi (Warianto, 2011).
Resistensi terhadap OAT terutama terjadi karena mutasi pada gen M. tuberculosis. Penyebaran resistensi M. tuberculosis terjadi paska amplifikasi kuman resisten yang diinduksi oleh inadekuatnya obat disekitar kuman (Sjahrurachman, 2010).
Beberapa mutasi gen pada M. tuberculosis yang berperan sebagai penyebab resistensi INH telah dapat diidentifikasi. Mutasi yang terpenting berlokasi di gen KatG. Kepekaan terhadap INH tergantung pada keberadaan enzim katalase-peroksidase yang dikode oleh gen KatG. Mutasi pada gen ini menyebabkan tingginya angka kejadian resistensi INH (IUATLD, 2002).
2.4.2 Gen KatG dan mutasi kodon Ser315Thr (G944C)
Gen KatG berada di posisi antara 2,153,445 – 2,156,555 dari keseluruhan genom M. tuberculosis, dengan panjang 2223 bp dan merupakan bagian dari
pengkode protein katalase – peroksidase. Mutasi poin pada basa ke 944 dimana G berubah menjadi C menghasilkan perubahan kodon 315 dari AGC ACC. Hal ini menyebabkan perubahan asam amino serin menjadi treonin (SerThr) yang akan mengekspresikan protein katalase - peroksidase mutan (missense mutation) (Ensembl, 2015; Genbank, 2015; Ahmad et al., 2002; Mokrosov et al., 2002; Guo et al., 2006; Bostanabad et al., 2008; Marahatta et al., 2011).
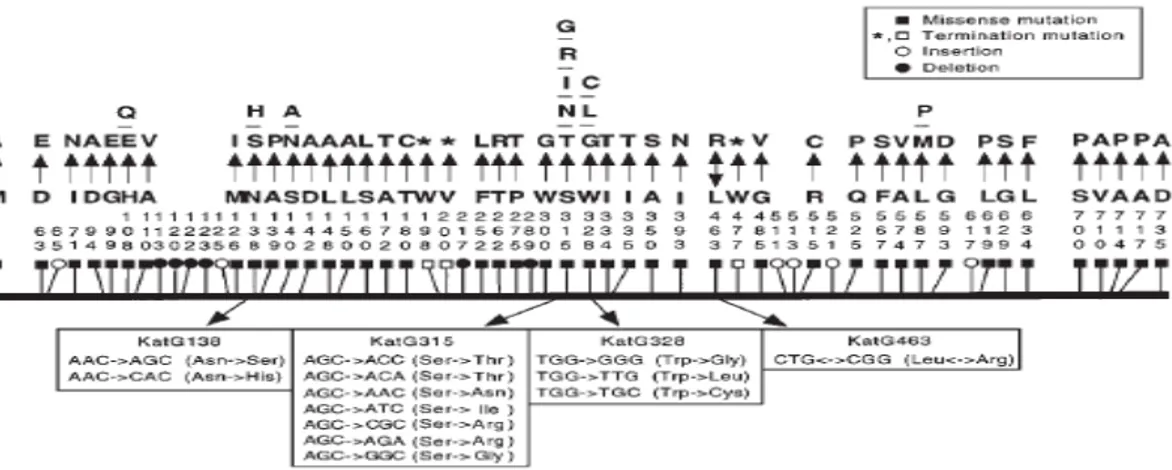
Beberapa dekade terakhir, studi isolat M. tuberculosis pasien TB mencatat bahwa terdapat hubungan antara resistensi INH dan hilangnya aktifitas enzim katalase-peroksidase. Pengamatan ini mengarahkan untuk dilakukannya kloning dan skuensing struktur gen KatG yang mengekspresikan enzim tersebut. Studi genetika molekuler menegaskan bahwa KatG berperan dalam memediasi kepekaan terhadap INH. Peneliti – peneliti dari beberapa benua melaporkan bahwa terdapat beragam mutasi KatG yang unik terjadi pada strain M. tuberculosis resisten INH, dan pergantian asam amino yang terletak pada posisi kodon 315Ser adalah yang paling banyak terjadi (gambar 2.6) (Ramaswamy dan Musser, 1998).
Terdapat beberapa varian mutasi pada kodon 315 gen KatG M. tuberculosis yaitu Ser315Thr (AGCACC), Ser315Thr (AGCACA), Ser315Asn (AGCAAC), Ser315Ile (AGCATC), Ser315Arg (AGCCGC), Ser315Arg (AGCAGA) dan Ser315Gly (AGCGGC) (Ramaswamy dan musser, 1998), tetapi mutasi terbanyak adalah tipe mutasi Ser315Thr (AGCACC). Seperti pada penelitian Bostanabad et al di Belarusia pada tahun 2008 mendapatkan dari 40 isolat DNA M. tuberculosis yang berasal dari sputum penderita TB paru aktif dengan mutasi pada kodon 315 gen KatG, didapatkan 36
isolat (85%) merupakan mutasi Ser315Thr (G944C) (Bostanabad et al., 2008). Mutasi gen KatG Ser315Thr (G944C) sangat potensial menjadi marker genetik untuk menentukan strain M. tuberculosis resisten INH (Bostanabad et al., 2008; Marahatta et al., 2011).
Gambar 2.6. Polimorfisme protein KatG pada M. tuberculosis INHR. Varian asam amino diberi nomor secara vertikal. Dipakai singkatan asam amino satu huruf. Tampak dibawah skema perubahan nukleotida dan asam amino yang muncul pada kodon dengan 2 atau lebih varian kodon. A: alanin; C: sistein; D: asam aspartat; E: asam glutamat; F: fenilalanin; G: glisin; H: histidin; I: isoleusin; M: metionin; N: asparagin; P: prolin; Q: glutamin; R: arginin; S: serin; T: treonin; W: triptofan; V: valin (Ramaswamy dan Musser, 1998).
2.5 Metode Pemeriksaan Yang Berperan Pada Deteksi Mutasi Gen KatG Ser315Thr (G944C)
2.5.1 Pewarnaan ziehl-nielsen
Adalah suatu alat ukur untuk mendeteksi bakteri M. tuberculosis dengan metode pewarnaan bakteri tahan asam dan dilihat dibawah mikroskop dengan pembesaran 1000x. Prinsip pewarnaan ini adalah bahwa M. tuberculosis mempunyai lapisan dinding lipid (asam mikolat) yang tahan terhadap asam. Proses pemanasan mempermudah masuknya carbol fuchsin kedalam dinding sel, dan sel tetap mengikat zat warna carbol fuchsin walaupun didekolorisasi dengan asam alkohol (KEMENKES RI, 2012). Cara mengukurnya adalah dengan
menemukan bakteri tahan asam per-lapangan pandang. Hasil pengukuran pada pemeriksaan mikroskopis dengan mengacu pada skala International Union Against Tuberculosis and Lung Disease (IUATLD) yaitu:
− Negatif : tidak ditemukan BTA dalam 100 lapang pandang
− Scanty : ditemukan 1-9 BTA dalam 100 lapang pandang (ditulis jumlah BTAyang ditemukan)
− 1+ : ditemukan 10 – 99 BTA dlm 100 lapang pandang
− 2+ : ditemukan 1 – 10 BTA setiap 1 lapang pandang (periksa minimal 50 lapang pandang)
− 3+ : ditemukan ≥ 10 BTA dalam 1 lapang pandang (periksa minimal 20 lapang pandang) (KEMENKES RI, 2012).
Pada penelitian ini, pasien dengan mikroskpik BTA positif (Scanty, 1+, 2+, 3+) pada pemeriksaan awal sputum sebelum meminum OAT akan dimasukkan kedalam sampel yang diinginkan, apabila M. tuberculosis – nya belum mengalami mutasi gen KatG Ser315Thr (G944C) yang dikonfirmasi dengan PCR-RFLP. Selanjutnya, setelah akhir minggu ke 4 minum OAT M. tuberculosis sputum diperiksa kembali pola mutasinya dengan PCR-RFLP, dinilai dan dihubungkan dengan tingkat kepatuhan selama pengobatan INH.
2.5.2 Polymerase chain reaction – Restriction fragment length polymorphism (PCR-RFLP) dan elektroforesis
Polymerase chain reaction – Restriction fragment length polymorphism (PCR-RFLP) dan elektroforesis digunakan sebagai alat ukur dan metode visualisasi untuk mendeteksi gen KatG M. tuberculosis dengan mutasi Ser315Thr (G944C).
Cara mengukurnya adalah dengan melipatgandakan secara eksponensial suatu sekuens nukleotida tertentu dengan cara in vitro menggunakan metode enzimatis. PCR dilakukan dengan tiga tahap yaitu denaturasi, annealing dan extension. Hasil PCR akan diinkubasi dengan enzim restriksi (metode RFLP). Hasil akan divisualisasikan dengan agarosa. Visualisasi elektroforesis hasil amplifikasi gen KatG dengan primer KatGF dan KatGR akan tampak pada band 200 bp. Pada proses restriksi, enzim MspI akan memotong di situs C↓CGG yang palindrom pada gen . Apabila terjadi mutasi gen KatG kodon 315 AGC ACC / basa ke 944 GC maka akan terbentuk situs tambahan C↓CGG yang dapat dipotong enzim MspI. Hasil produk RFLP terpanjang yang diperoleh adalah fragmen 153 bp gen KatG wild type dan 132 bp fragmen gen KatG mutan yang divisualisasikan dengan metode elektroforesis. Hasil pemotongan lain yang pendek (6 – 21 bp) tidak diperhitungkan karena tidak terlihat pada hasil elektroforesis dan dianggap tidak bermakna (gambar 2.7).
Gambar 2.7. Skema ilustrasi fragmen 200bp KatG yang di amplifikasi dengan primer KatG. Garis lurus merupakan representasi situs restriksi Mspl (C↓CGG). Pada wild type, produk PCR gen KatG tidak ada situs tambahan untuk restriksi Mspl dan fragmen terpanjang adalah 153bp. Pada mutan produk PCR gen KatG ada tambahan situs restriksi Mspl akibat basa ke 944 G C dan menyebabkan fragmen terpanjang adalah 132bp (Shrestha et al., 2011).
2.5.3 Mengukur kepatuhan terhadap pengobatan INH dan pemeriksaan metabolit INH menggunakan Taxo urine test strip metode Arkansas Metode untuk mengukur kepatuhan terhadap pengobatan INH meliputi pelaporan langsung penderita secara personal (patient self-report), penghitungan tablet (tablet counting), tes metabolit INH dalam urin (urine testing for INH metabolites) dan perangkat elektronik yang merekam ketika kemasan tablet dibuka (electronic devices that record when tablet containers opened). Tes metabolit INH dalam urin adalah yang paling objektif dibandingkan metode yang lain (Hanifa et al., 2007).
The Arkansas Departement of Public Health mengembangkan sebuah metode yang simpel untuk mengecek metabolit INH urin. Metode ini dikembangkan oleh Potts, Cozart dan Reagan, tetapi tidak pernah mereka publikasikan. Sampai kemudian Henderson yang bekerja pada laboratorium yang sama dengan mereka mempublikasikannya. Metode Arkansas menggunakan 30 mg asam barbiturat, larutan kloramin-T 14 g/dl, larutan potasium sianida 5 g/dl. 4 tetes urin pasien dimasukkan ke dalam tabung reaksi yang sudah berisi 30 mg asam barbiturat, kemudian ditambahkan masing – masing 2 tetes larutan kloramin-T dan potasium sianida. Tabung reaksi dikocok selama ±10 detik. Prinsip reaksi metode Arkansas pada ini adalah, cincin piridin dari asam nikotinat yang terdapat pada INH dan metabolitnya akan dipecah oleh sianogen klorida untuk membentuk derivat glutakonaldehid. Derivat ini akan berkondensasi dengan asam barbiturat membentuk polimetin berwarna biru – ungu (Schraufnagel et al., 1990).
Taxo urine test strip menggunakan prinsip metode Arkansas yang dikembangkan oleh Kilburn et al, untuk memonitor pasien yang mendapat pengobatan INH. Tes ini membantu tenaga medis untuk mengetahui apakah pasien patuh menelan INH dengan cara yang lebih sederhana dan mudah. Potongan kertas (paper strip) yang telah diresapi reagen berupa kloramin T, potasium tiosianat, asam sitrat dan asam barbiturat ini akan mendeteksi keberadaan INH dan metabolitnya didalam urin.
Pada pemeriksaan dengan Taxo urine test strip, munculnya warna biru, ungu, biru kehijauan atau hijau pada paper strip menunjukkan hasil positif terdapatnya INH atau metabolit INH dalam spesimen urin. Hasil positif didapat pada larutan INH / metabolitnya pada konsentrasi antara 100 µg/mL – 5 µg/mL. Hasil dinyatakan negatif apabila tidak terjadi perubahan warna pada strip, atau terjadi perubahan warna selain warna untuk hasil positif (Hanifa et al., 2007).
Metode Arkansas memiliki sensitifitas dan spesifisitas yang tinggi pada populasi di Eropa, sensitifitasnya sebesar 96 – 99% sampai 24 jam setelah menelan INH (Schraufnagel et al., 1990; Hanifa et al., 2007). Tidak ada publikasi data mengenai perbedaan karakteristik metode Arkansas pada populasi tipe asetilator cepat dibandingkan dengan populasi tipe asetilator lambat (Meissner et al 2002; Hanifa et al., 2007).
2.6 Kepatuhan Terhadap Pengobatan OAT
Di negara berkembang kepatuhan terhadap pengobatan OAT menghadapi masalah tersendiri akibat keadaan epidemiologik dan sosial ekonomi yang ada. Studi yang dilakukan di Aleksandria Mesir tentang hubungan karakteristik
demografi dengan kepatuhan terhadap pengobatan OAT menunjukkan adanya perbedaan – perbedaan tingkat kepatuhan akibat perbedaan karakteristik demografi penderita. Perbedaan karakteristik demografi tersebut berupa usia, ras, jenis kelamin, tingkat pendidikan, dan status sosial ekonomi penderita (Gad et al., 1997).
Perbedaan karakteristik demografi tersebut memunculkan perbedaan – perbedaan seperti berikut:
• Pemahaman dan pengetahuan tentang regimen pengobatan • Persepsi penderita atas manfaat yang diperoleh dari pengobatan • Persepsi penderita atas hambatan – hambatan dalam pengobatan
• Dukungan sosial dan stresor dari kehidupan. Dukungan sosial biasanya akan kurang pada tunawisma, penyakit mental, sosial ekonomi lemah.
• Keyakinan budaya tertentu tentang penggunaan obat, proses penularan penyakit, dan perkembangan penyakit.
Perbedaan – perbedaan karakteristik tersebut mengakibatkan perbedaan tingkat kepatuhan dalam menjalankan proses pengobatan tuberkulosis (Frank et al., 2005).
Jika ditelaah lebih mendalam, kepatuhan adalah sebuah fenomena multi-dimensi yang mencakup lima faktor penting, yaitu:
1. Faktor terkait sosial ekonomi.
Beberapa kondisi sosioekonomi yang dapat mempengaruhi kepatuhan pada pengobatan tuberkulosis adalah tidak adanya sistem dukungan yang efektif, lingkungan yang tidak stabil, faktor budaya sekitar, stigma, mahalnya biaya medikasi, mahalnya biaya transportasi, dan lain sebagainya.
2. Faktor terkait sistem layanan kesehatan.
Pelayanan kesehatan yang buruk, dan adanya hubungan yang kurang baik antara pasien dengan penyedia layanan kesehatan, petugas yang kurang terlatih, serta ketidaktersediaan dokter ahli, berakibat kepatuhan pasien menjadi berubah.
3. Faktor terkait kondisi.
Beberapa kondisi khusus yang dialami oleh pasien dapat memberikan pengaruh buruk pada kepatuhan meminum obat, misalnya kasus asimtomatik, penurunan kesadaran akibat penyalahgunaan obat, stres psikologis, dan depresi.
4. Faktor terkait terapi.
Pengobatan TB merupakan hal yang kompleks, tidak jarang menimbulkan efek samping dan dapat pula menimbulkan efek toksik sebagai akibat dari mengkonsumsi obat.
5. Faktor terkait pasien.
Pada dasarnya, seluruh aspek kepatuhan dikembalikan kembali pada sifat dari pasiennya. Kepatuhan yang buruk akan ditemui pada pasien pelupa, pasien dengan penyalahgunaan obat, depresi, stres, maupun pasien yang terasingkan sebagai akibat dari stigma yang ada. Kondisi berbeda akan ditemui pada pasien yang telah mendapatkan motivasi yang cukup ataupun percaya benar pada efektifitas terapi (WHO, 2003).
2.7 Kerangka Konsep
Ruang lingkup penelitian:
=variabel dependent Gambar 2.8. Kerangka Konsep =variabel independent
Patuh Gen KatG
M. tuberculosis
Kepatuhan meminum INH selama pengobatan Mutasi spontan gen
KatG Ser315Thr (G944C) sebelum mulai pengobatan
Mutasi gen KatG Ser315Thr (G944C) diinduksi inadekuatnya kadar terapeutik
INH selama pengobatan
Mutasi gen KatG Ser315Thr (G944C) Tidak patuh Wild type Mutan Enzim INH (prodrug ) INH (drug) ekspresi aktivasi Gen KatG M. tuberculosis (mutan) Pasien TB paru BTA (+) Analisa