i
UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN RADIKAL 1,1-DIFENIL-2-PIKRILHIDRAZIL (DPPH) DAN PENETAPAN KANDUNGAN FENOLIK TOTAL FRAKSI ETIL ASETAT EKSTRAK METANOL KULIT BUAH JERUK LEMON (Citrus x limon (L.) Burm. f.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Wisnu Brahmana Putra
NIM: 098114111
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
vi
vii PRAKATA
Puji dan Syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa atas kasih dan penyertaan yang diberikan hingga penuli dapat menyelesaikan skripsi yang berjudul “UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN RADIKAL
1,1-DIFENIL-2-PIKRILHIDRAZIL (DPPH) DAN PENETAPAN KANDUNGAN FENOLIK TOTAL FRAKSI ETIL ASETAT EKSTRAK
METANOL KULIT BUAH JERUK LEMON (Citrus x limon (L.) Burm. f.)”.Penelitian ini dilakukan untuk memenuhi salah satu syarat tugas akhir untuk
mencapai gelar sarjana ilmu Farmasi bidang studi Farmasi Universitas Sanata Dharma Yogyakarta.
Penulis menyadari bahwa penulisan skirpsi ini tidak terwujud tanpa
bimbingan, bantuan dan pengarahan berbagai pihak. Pada kesempatan ini penulis
mengucapkan terima kasih kepada:
1. Bapak Ipang Djunarko, M.Sc., Apt sebagai Dekan Universitas Sanata
Dharma Yogyakarta.
2. Bapak Yohanes Dwiatmaka, M.Si. sebagai Dosen Pembimbing utama
skripsi ini atas segala kesabaran dan perhatian dalam memberikan
bimbingan, pengarahan, tuntunan, dukungan dan motivasi selama
penelitian dan penyusunan skripsi.
3. Bapak Prof. Dr. C. J. Soegihardjo, Apt. sebagai Dosen Penguji skripsi atas
bantuan, masukan, dan perhatian kepada penulis demi kemajuan skripsi
ini.
4. Dra. Maria Margaretha Yetty Tjandrawati, M.Si sebagai Dosen Penguji
skripsi yang banyak memberikan saran demi kemajuan skripsi ini.
5. Ibu Rini Dwiastuti, M.Si.,Apt. selaku Kepala Laboratorium Farmasi yang
telah memberikan izin penggunaan fasilitas laboratorium guna penelitian
viii
6. Semua staf laboratorium Farmasi yang bersedia membantu selama
penelitian berlangsung terkhusus laboran Laboratorium
Farmakognosi-Fitokimia (Mas Wagiran) dan Kimia Analisis Instrumen (Mas Bimo).
7. Theresia Nindy, Tri Pamulatsih, Yenny, Augustinus Teti, Febrin Nessy,
Putut Wibisono untuk semua semangat saling menguatkan selama
pengerjaan skripsi.
8. Agustina Erni Purnamasari yang telah banyak membantu dan atas semua
kesabarannya mendengarkan setiap keluh kesah.
9. Semua pihak yang penulis tidak dapat sebutkan satu persatu yang turut
membantu selama penyusunan skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan,
karena itu penulis mengharapkan kritik dan saran yang membangun dan
bermanfaat demi pengembangan ilmu pengetahuan, serta menjadi acuan bagi
penelitian-penelitian selanjutnya.
Yogyakarta, 12 Juli 2013
ix DAFTAR ISI
HALAMAN JUDUL ...i
HALAMAN PERSETUJUAN PEMBIMBING ...ii
HALAMAN PENGESAHAN ...iii
PERNYATAAN KEASLIAN KARYA ...iv
LEMBAR PERNYATAAN PERSETUJUAN KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ...v
LEMBAR PERSEMBAHAN ...vi
PRAKATA ...vii
DAFTAR ISI ...ix
DAFTAR TABEL ...xiii
DAFTAR GAMBAR ...xiv
DAFTAR LAMPIRAN ...xv
INTISARI ...xvi
ABSTRACT ...xvii
BAB I. PENGANTAR ...1
A. Latar Belakang ...1
1. Perumusan masalah ...3
2. Keaslian penelitian ...3
3. Manfaat penelitian ...4
B. Tujuan Penelitian ...4
x
2. Tujuan khusus ...4
BAB II. PENELAAHAN PUSTAKA...5
A. Jeruk Lemon. ...5
1. Keterangan botani ...5
2. Morfologi ...6
B. Antioksidan ...6
1. Radikal Bebas...6
2. Antioksidan ...7
C. Metode DPPH (1,1-difenil-2-pikrilhidrazil) ...8
D. Fenolik ...9
E. Flavonoid ...10
F. Rutin ...11
G. Ekstraksi ...12
H. Kromatografi Lapis Tipis (KLT) ...12
I. Spektrofotometer Visible ...13
J. Validasi Metode ...14
K. Landasan Teori ...16
L. Hipotesis ...17
BAB III. METODOLOGI PENELITIAN ...18
A. Jenis Penelitiandan Rancangan Penelitian ...18
B. Variabel Penelitian ...18
1. Variabel utama ...18
xi
C. Definisi Operasional...19
D. Bahan dan Alat Penelitian ...20
1. Bahan penelitian ...20
2. Alat penelitian ...20
E. Tata Cara Penelitian ...20
1. Determinasi tanaman ...20
2. Pemilihan dan pengumpulan sampel ...21
3. Pembuatan simplisia ...21
4. Ekstraksi dan fraksinasi simplisia ...21
5. Penetapan aktivitas antioksidan ...22
a. Kualitatif ...22
b. Kuantitatif ...22
6. Penetapan kadar fenolik dalam ekstrak ...25
F. Analisis Hasil ...26
BAB IV. HASIL DAN PEMBAHASAN ...27
A. Hasil Determinasi ...27
B. Hasil Preparasi Sampel ...27
1. Hasil ekstraks sampel ...27
2. Hasil fraksinasi ekstrak metanol kulit lemon ...29
C. Hasil Uji Kualitatif Flavonoid dengan Metode KLT ...31
D. Hasil Optimasi Metode Uji Aktivitas Antioksidan ...34
1. Penentuan operating time (OT) ...34
xii
antioiksidan ...35
E. Hasil Validasi Metode Uji Aktivitas Antioksidan ...36
1. Linearitas ...39
2. Presisi ...40
3. Spesifitas ...41
F. Hasil Penentuan Aktivitas Antioksidan dengan Radikal DPPH ...42
G. Hasil Optimasi Metode Penetapan Kandungan Fenolik Total ...45
1. Penentuan operating time (OT) ...45
2. Penentuan panjang gelombang maksimum ...46
H. Hasil Validasi Metode Penetapan Kandungan Fenolik Total ...46
1. Linearitas ...48
2. Presisi ...48
3. Spesifitas ...49
I. Hasil Penetapan Kandungan Fenolik Total ...49
BAB V. KESIMPULAN DAN SARAN ...53
A. Kesimpulan ...53
B. Saran ...53
DAFTAR PUSTAKA ...54
LAMPIRAN ...57
xiii
DAFTAR TABEL
Tabel I. Rentang Accuracy yang Diperbolehkan ... 15
Tabel II. Rentang CV yang masih Diterima... 15
Tabel III. Hasil Scanning Panjang Gelombang Maksimum DPPH ... 36
Tabel IV. Hasil Pengukuran Absorbansi Seri Baku Rutin yang
Direaksikan dengan Radikal DPPH ... 37
Tabel V. Hasil Pengukuran Absorbansi Seri Fraksi Etil Asetat yang
Direaksikan dengan Radikal DPPH ... 38
Tabel VI. Nilai % CV Uji Aktivitas Antioksidan Rutin dan Fraksi
Etil Asetat ... 40
Tabel VII. Hasil Perhitungan IC50 Rutin dan Fraksi Etil Asetat Ekstrak
Metanol Kulit Buah Lemon... 43
Tabel VIII. Tingkat Kekuatan Antioksidan Senyawa Uji dengan
Metode DPPH ... 43
Tabel IX. Hasil Scanning Panjang Gelombang Maksimum Penetapan
Kandungan Fenolik Total pada Asam Galat ... 46
Tabel X. Hasil Pengukuran Absorbansi Baku Asam Galat ... 48
Tabel XI. Nilai % CV Penetapan Kandungan Fenolik Total ... 49
Tabel XII. Kadar Asam Galat dan Absorbansinya Setelah Direaksikan
dengan Pereaksi Folin-Ciocalteu yang Diukur pada
750 nm ... 52
xiv
DAFTAR GAMBAR
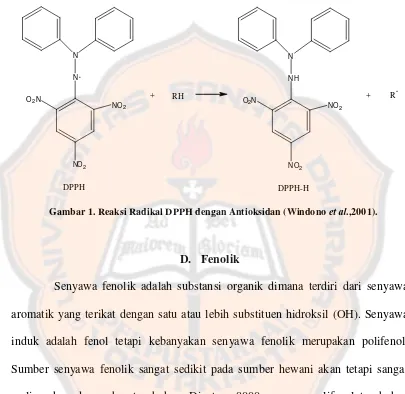
Gambar 1. Reaksi Radikal DPPH dengan Antioksidan ... 9
Gambar 2. Struktur Hesperidin dan Naringin ... 11
Gambar 3. Struktur Rutin ... 11
Gambar 4. Hasil Kromatogram Uji Kualitatif dengan Uap Ammonia ... 32
Gambar 5. Hasil Kromatogram Uji Kualitatif dengan Semprot Besi (III) Klorida ... 33
Gambar 6. Grafik Penentuan OT Rutin... 34
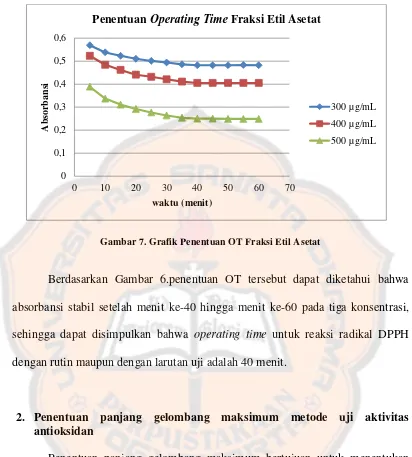
Gambar 7. Grafik Penentuan OT Fraksi Etil Asetat ... 35
Gambar 8. Kurva Persamaan Regresi Linear Aktivitas Antioksidan Rutin ... 38
Gambar 9. Kurva Persamaan Regresi Linear Aktivitas Antioksidan Fraksi Etil Asetat ... 39
Gambar 10. Grafik Penentuan OT Asam Galat ... 45
Gambar 11. Grafik Penentuan OT Fraksi Etil Asetat ... 45
Gambar 12. Kurva Persamaan Regresi Linear Penentapan Kadar Fenolik Total Asam Galat ... 48
Gambar 13. Struktur Asam Galat ... 51
Gambar 14. Reaksi Senyawa Fenol dengan Reagen Folin-Ciocalteu ... 51
xv
DAFTAR LAMPIRAN
Lampiran 1. Gambar Buah Jeruk Lemon ... 58
Lampiran 2. Perhitungan Rendemen ... 58
Lampiran 3. Data Penimbangan untuk Pengujian Aktivitas Antioksidan ... 59
Lampiran 4. Perhitungan Rf Rutin dan Fraksi Etil Asetat ... 60
Lampiran 5. Data konsentrasi bahan untuk pengujian aktivitas antioksidan ... 61
Lampiran 6. Scanning Larutan Pengkoreksi untuk Pengujian Aktivitas ... 63
Lampiran 7. Optimasi Metode Uji Aktivitas Antioksidan ... 66
Lampiran 8. Uji Aktivitas Antioksidan Menggunakan Radikal DPPH ... 68
Lampiran 9. Perhitungan Nilai IC50 Rutin dan Fraksi Etil Asetat Ekstrak Metanol Kulit Lemon ... 71
Lampiran 10. Penimbangan Uji Kandungan Fenolik Total ... 72
Lampiran 11. Scanning Kontrol Asam Galat ... 73
Lampiran 12. Optimasi Penentuan Kandungan Fenolik Total ... 75
Lampiran 13. Penentuan Kandungan Fenolik Total ... 77
xvi Intisari
Radikal bebas dapat berasal dari polusi, debu, maupun metabolisme dari dalam tubuh. Oleh karenanya diperlukan suatu substansi yang berfungsi untuk melindungi tubuh dari dampak negatif radikal bebas, yaitu antioksidan. Antioksidan alami dapat berasal dari buah dan sayuran salah satu sumber antioksidan adalah kulit jeruk lemon (Citrus x limon (L.) Burm. f.) yang diketahui mengandung senyawa golongan flavonoid yaitu naringin dan hesperidin. Penelitian ini bertujuan untuk mengetahui aktivitas antioksidan dan menetapkan kandungan fenolik total dari fraksi etil asetat ekstrak metanol kulit buah lemon.
Pengujian aktivitas antioksidan menggunakan radikal 1,1-difenil-2-pikrilhidrazil (DPPH) dan dinyatakan dengan nilai Inhibition Concentration 50 (IC50). Keberadaan senyawa beraktivitas antioksidan akan mengubah warna
larutan DPPH dari ungu menjadi kuning. DPPH memiliki maksimum di 516,0 nm. Ketika elektronnya berpasangan oleh keberadaan senyawa antioksidan, maka absorbansinya menurun secara stokiometri sesuai jumlah elektron yang diambil. Penentuan kandungan fenolik total dilakukan dengan pereaksi Folin-Ciocalteu dengan menggunakan baku standar asam galat. Hasil penelitian menunjukkan bahwa fraksi etil asetat ekstrak metanol kulit buah lemon mempunyai nilai IC50
sebesar 407,5 ± 6,32 µg/mL dan memiliki kandungan fenolik total sebesar 6,8 ± 1,19 mg ekivalen asam galat per gram fraksi etil asetat ekstrak metanol kulit buah lemon.
xvii
Abstract
Free radicals can derived from pollution, dust, and metabolism of the body. Therefore needed a substance that serves to protect the body from the negative effects of free radicals, which is an antioxidant. Natural antioxidants can be derived from fruit and vegetable sources of antioxidants is one of the lemon peel (Citrus x limon (L.) Burm. f.) Are known to contain flavonoid compounds that naringin and hesperidin. This study aims to determine the antioxidant activity and total phenolic content sets from ethyl acetate fraction of methanol extract of lemon peel.
Radical antioxidant activity assays using 1,1-diphenyl-2-pikrilhidrazil (DPPH) and is expressed by the value Inhibition Concentration 50 (IC50). The
existence of active antioxidant compounds will change DPPH solution color from
purple to yellow. DPPH has a maximum at 516.0 nm. When the electron pairs by the presence of antioxidant compounds, the absorbance decreases corresponding stoichiometric number of electrons captured. Determination of total phenolic content performed by Folin-Ciocalteu reagent using gallic acid standarization. The results showed that the ethyl acetate fraction of methanol extract of lemon peel had IC50 values of 407,5 ± 6,32 µg/mL and has a total
phenolic content of 6,8 ± 1,19 mg gallic acid equivalents per gram of ethyl acetate fraction of methanol extract of the lemon peel.
Keywords:lemon peel(Citrus x limon (L.) Burm. f.), antioxidant, DPPH, IC50,
1 BAB I PENGANTAR
A. Latar Belakang
Seiring berjalannya waktu makhluk hidup akan mengalami proses
menjadi lebih tua secara alami, akan tetapi proses menjadi tua atau penuaan ini
terkadang terlalu cepat yang disebabkan oleh banyak faktor, misalnya radikal
bebas.
Radikal bebas dapat berasal dari polusi, debu, maupun metabolisme dari
dalam tubuh. Oleh karena itu diperlukan suatu substansi yang berfungsi untuk
melindungi tubuh dari dampak negatif radikal bebas, yaitu antioksidan.
Antioksidan dapat didefinisikan sebagai senyawa yang apabila dalam konsentrasi
rendah berada bersama substrat yang dapat teroksidasi, dapat menunda atau
menghambat oksidasi senyawa tersebut (Halliwell, 1994).
Di dalam tubuh sudah terdapat antioksidan yang dihasilkan secara alami
misalnya enzim SOD (superoxyde dismutase), glutation, dan katalase, akan tetapi
diperlukan suplai antioksidan dari luar untuk melindungi tubuh dari radikal bebas
dalam jumlah besar.
Sumber-sumber antioksidan dapat berupa antioksidan sintetik maupun
antioksidan alami. Tetapi saat ini penggunaan antioksidan sintetik mulai dibatasi
karena ternyata dari hasil penelitian yang telah dilakukan bahwa antioksidan
binatang percobaan dan bersifat karsinogenik. Oleh karena itu industri makanan
dan obat-obatan beralih mengembangkan antioksidan alami dan mencari
sumber-sumber antioksidan alami baru (Takashi dan Takayumi, 1997).
Antioksidan alami dapat berasal dari buah dan sayuran. Salah satu
sumber antioksidan adalah jeruk lemon. Berdasarkan penelitian sebelumnya telah
diketahui adanya kandungan flavonoid naringin dan hesperidin pada jeruk, kulit,
maupun biji (Tripoli, Guardia, Giammanco, Majo and Giamanco, 2007). Oleh
karena itu peneliti ingin menggali informasi lebih spesifik yaitu apakah kulit buah
jeruk lemon (Citrus x limon (L.) Burm. f.)memiliki daya antioksidan, dan
seberapa besar kemampuannya dalam meredam dampak dari radikal bebas.
Ekstraksi senyawa dilakukan dengan metode maserasi menggunakan
pelarut metanol dan fraksinansi dengan etil asetat. Pemilihan pelarut ini
didasarkan karena adanya gugus hidroksi yang terdapat pada senyawa fenolik
yang larut dalam pelarut polar.
Metode yang digunakan untuk pengujian antioksidan pada penelitian ini
adalah metode DPPH (1,1-difenil-2-pikrilhidrazil). Berdasarkan metode ini,
kemampuan antioksidan suatu senyawa dinyatakan oleh nilai IC50. Metode DPPH
memberikan informasi reaktivitas senyawa yang diuji dengan suatu radikal bebas.
DPPH memberikan serapan kuat pada panjang gelombang 517 nm dengan warna
violet gelap. Penangkap radikal bebas menyebabkan elektron menjadi
berpasangan yang kemudian menyebabkan penghilangan warna yang sebanding
1. Perumusan masalah
Berdasarkan latar belakang diatas, maka rumusan masalah dari
penelitian ini adalah sebagai berikut:
a. Apakah fraksi etil asetat ekstrak metanol kulit buah jeruk lemon memiliki
aktivitas antioksidan?
b. Berapa nilai aktivitas antioksidan fraksi etil asetat ekstrak metanol kulit
buah lemon dengan menggunakan radikal bebas DPPH yang dinyatakan
dengan IC50?
c. Berapakah kadar fenolik total fraksi etil asetat ekstrak metanol kulit buah
lemonyang dinyatakan dengan massa ekivalen asam galat?
2. Keaslian penelitian
Uji aktivitas antioksidan kulit jeruk lemon ini berbeda dengan
penelitian yang dilakukan oleh Rafaela Guimaraes, Lillian Barros, Joao
Barreira, Mª Joao Sousa, Ana Maria Carvalho, Isabel Ferreira (2009) dengan
judul penelitian Targeting Excessive Free Radicals with Peels and Juices of
Citrus Fruits: Grapefruit, Lemon, Lime and Orange. Pada penelitian yang
dilakukan oleh Guimaraes dkk.(2009) menggunakan metode liofilisasi untuk
pengeringannya, sedangkan dalam penelitian ini dilakukan pengeringan
dengan oven pada suhu 50˚C. Berdasarkan pengamatan penulis, modifikasi
3. Manfaat penelitian
a. Manfaat teoritis
Penelitian ini diharapkan dapat digunakan untuk pengembangan ilmu
pengetahuan dan kesehatan masyarakat tentang penggunaan obat
alternatif dalam bidang kesehatan.
b. Manfaat praktis
Penelitian ini diharapkan dapat memberikan informasi kepada
masyarakat tentang penggunaan dan manfaat kulit buah jeruk lemon
sebagai antioksidan.
B. Tujuan Penelitian 1. Tujuan umum
Memberi informasi tambahan baru tentang antioksidan alami dalam
rangka pemanfaatan limbah dan ikut berpartisipasi dalam memberi
sumbangsih dalam dunia penelitian.
2. Tujuan khusus
a. Mengetahuifraksi etil asetat ekstrak metanol kulit buah jeruk lemon
memiliki daya antioksidan.
b. Mengetahui kadar antioksidan yang terkandung dalam kulit buah jeruk
lemon dengan menggunakan radikal DPPH yang dinyatakan dengan IC50.
c. Mengetahui nilai kandungan fenolik total fraksi etil asetat ekstrak
metanol kulit buah jeruk lemonyang dinyatakan dalam mg ekivalen asam
5 BAB II
PENELAAHAN PUSTAKA
A. Jeruk Lemon 1. Keterangan botani
Klasifikasi tanaman jeruk lemon menurut Anonim, 2012 sebagai
berikut:
a. Klasifikasi
Kingdom : Plantae
Subkingdom : Tracheobionta
Super Divisi : Spermatophyta
Divisi : Magnoliophyta
Kelas : Magnoliopsida
Sub Kelas : Rosidae
Ordo : Sapindales
Famili : Rutaceae
Genus : Citrus
Spesies : Citrus x limon (L.) Burm. f.
b. Nama umum
Sinonim : Citrus limon
Indonesia :Jeruk asam
2. Morfologi tanaman
Pohon lemon tingginya bisa mencapai 10 sampai 20 kaki (3- 6
meter) dan terdapat duri tajam pada rantingnya. Daunnya ketika masih muda
berwarna kemerahan, tetapi ketika sudah tua menjadi hijau gelap pada bagian
atas dan berwarna hijau terang pada bagian bawah. Bentuk daunnya lonjong,
elips ataupun oval. Panjang dari daunnya 6,25 sampai 11,25 cm. Bunganya
memiliki 4 atau 5 kelopak. Berwarna putih pada bagian dalam, sedangkan
luarnya berwarna keunguan. Buahnya berbentu oval dengan panjang 7
sampai 12 cm dan terdapat tonjolan puting. Kulit buah lemon ini berwarna
kuning bercahaya dengan kelenjar minyak. Biji buah lemon berbentuk oval,
tetapi beberapa lemon tidak memiliki biji (Morton, 1987).
B. Antioksidan 1. Radikal bebas
Radikal bebas adalah atom atau molekul yang memiliki elektron
tidak berpasangan (unpaired electron). Adanya elektron yang tidak
berpasangan menyebabkan senyawa tersebut sangat reaktif mencari
pasangan, dengan cara menyerang dan mengikat elektron molekul yang
berada di sekitarnya (Winarsi, 2007).
Target utama radikal bebas adalah protein, asam lemak tak jenuh
dan lipoprotein, serta unsur DNA termasuk karbohidrat. Dari
molekul-molekul target tersebut, yang paling rentan terhadap serangan radikal bebas
merusak asam lemak tak jenuh ganda pada membran sel sehingga dinding sel
menjadi rapuh, merusak basa DNA sehingga mengacaukan sistem genetika,
dan berlanjut pada pembentukan sel kanker (Winarsi, 2007).
2. Antioksidan
Antioksidan merupakan senyawa pemberi elektron (electron donor)
atau reduktan. Senyawa ini mampu menginaktivasi berkembangnya reaksi
oksidasi, dengan cara mencegah terbentuknya radikal (Winarsi, 2007).
Antioksidan juga dapat didefinisikan sebagai senyawa yang apabila
dalam konsentrasi rendah berada bersama substrat yang dapat teroksidasi,
dapat menunda atau menghambat oksidasi senyawa tersebut (Halliwell,
1994).
Secara garis besar, mekanisme penangkapan radikal bebas dapat
dibedakan menjadi dua macam, yaitu secara enzimatik dan non-enzimatik.
Enzim yang dapat berperan sebagai antioksidan adalah superoksida
dismutase, katalase, glutation peroksidase, dan glutation reduktase (Winarsi,
2007).
Secara non-enzimatik, senyawa antioksidan bekerja melalui empat
cara, yaitu sebagai berikut:
a) Penangkap radikal bebas, misalnya vitamin C dan vitamin E,
b) Pengkelat logam transisi, misalnya EDTA,
d) Kofaktor enzim antioksidan, misalnya selenium sebagai kofaktor glutation
peroksidase (Huang, et al., 2005).
Aktivitas senyawa polifenol (flavonoid) sebagai antioksidan
meliputi tiga mekanisme sebagai berikut.
a. Aktivitas penangkapan radikal seperti reactive oxygen species (ROS)
ataupun radikal yang dihasilkan dari peroksidasi lipid seperti R·, RO·,
dan ROO· dengan proses transfer elektron melalui atom hidrogen.
b. Mencegah spesies senyawa reaktif produksi katalisis transisi metal seperti
reaksi melalui khelasi metal.
c. Interaksi dengan antioksidan lainnya, seperti lokalisasi dan penggabungan
dengan antioksidan lainnya (Niki dan Noguchi, 2000).
C. Metode DPPH (1,1-difenil-2-pikrilhidrazil)
Metode yang paling sering digunakan untuk menguji aktivitas
antioksidan tanaman obat adalah metode uji dengan menggunakan radikal bebas
DPPH (Shivaprasad, et al., 2005).
DPPH merupakan radikal bebas yang dapat bereaksi dengan senyawa
yang dapat mendonorkan atom hidrogen, dapat berguna untuk pengujian aktivitas
antioksidan komponen tertentu dalam suatu ekstrak (Dinis, Maderia, dan
Almeida,1994).
Karena adanya elektron yang tidak berpasangan, DPPH memberikan
serapan kuat pada 517 nm. Ketika elektronnya menjadi berpasangan oleh
stokiometri sesuai jumlah elektron yang diambil. Keberadaan senyawa
antioksidan dapat mengubah warna larutan DPPH dari ungu menjadi kuning
(Dehpour, Ebrahimzadeh, Fazel, dan Mohammad, 2009).
N
Gambar 1. Reaksi Radikal DPPH dengan Antioksidan (Windono et al.,2001).
D. Fenolik
Senyawa fenolik adalah substansi organik dimana terdiri dari senyawa
aromatik yang terikat dengan satu atau lebih substituen hidroksil (OH). Senyawa
induk adalah fenol tetapi kebanyakan senyawa fenolik merupakan polifenol.
Sumber senyawa fenolik sangat sedikit pada sumber hewani akan tetapi sangat
melimpah pada sumber tumbuhan. Diantara 8000 senyawa polifenol tumbuhan
yang diketahui, golongan yang terbanyak adalah flavonoid (Mann, Davidson,
Hobbs, Banthorpe, dan Harborne, 1994).
Sejauh ini, senyawa fenolik tumbuhan merupakan golongan
mayoritas senyawa yang bertindak sebagai antioksidan atau penangkapan radikal
fenolik total pada ekstrak tanaman yang telah dipilih (Veeru, Kishkar, dan
Meennakashi, 2009).
Mekanismenya melalui kemampuan gugus fenol menangkap radikal
bebas dengan memberikan atom hidrogennya, sehingga senyawa fenolik
berubah menjadi radikal fenoksil. Radikal fenoksil ini terstabilkan oleh
resonansi ( Brunneton, 1999).
E. Flavonoid
Aktivitas antioksidan dimiliki oleh sebagian besar flavonoid, hal
inidisebabkan adanya gugus hidroksi fenolik dalam struktur molekulnya. Ketika
senyawa-senyawa ini bereaksi dengan radikal bebas, mereka membentuk radikal
baru yang distabilisasi oleh efek resonansi inti aromatik. Dengan demikian fase
propagasi yang meliputi reaksi radikal berantai dapat dihambat (Cuvelier,
Richards, and Besset, 1991). Menurut Peterson et al. (2006) flavonoid yang
dominan dalam jeruk (citrus) adalah didymin, eriocitrin, hesperidin, naringin,
narirutin, neoeriocitrin, neohesperidin, poncirin.
Penyarian flavonoid dari dalam simplisia tumbuhan dapat dilakukan
dengan menggunakan pelarut polar, semi polar, maupun non polar sesuai dengan
kelarutan flavonoid yang diekstraksi. Kelarutan flavonoid berbeda-beda sesuai
golongan dan substitusinya (Robinson, 1995). Pelarut yang kurang polar
digunakan untuk mengekstraksi aglikon flavonoid, sedangkan pelarut yang lebih
polar digunakan untuk glikosida flavonoid atau antosianin. Flavonoid merupakan
tidaktersubstitusi. Oleh karena itu, umumnya flavonoid cukup larut dalam pelarut
polar seperti etanol, metanol, etil asetat, dimetilsulfoksida, dimetilformamid dan
air (Markham, 1998).
hesperidin naringin
Gambar 2. Struktur Hesperidin dan Naringin (Peterson et al.,2006)
F. Rutin
Rutin biasa disebut juga kuersetin-3-rutinoside karena merupakan
gilkosida dari kuersetin, sehingga keduanya memiliki kemiripan struktur dan
memiliki aktivitas antioksidan yang kuat karena memiliki tiga ciri pada
strukturnya, yaitu: 3’,4’-dihidroksi pada cincin B; 2,3-ikatan rangkap pada cincin
C. Rutin merupakan komponen yang terdapat pada asparagus, soba, dan keluarga
jeruk (Astawan dan Leomitro, 2008).
C
G. Ekstraksi
Penyarian merupakan peristiwa perpindahan mzat aktif yang semula
berada dalam sel, ditarik oleh cairan penyari sehingga terjadi larutan zat aktif
dalam cairan penyari tersebut (Trevor, 1995). Ekstrak adalah sediaan kental yang
diperoleh dengan mengekstraksi senyawa aktif dari simplisia nabati atau simplisia
hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua
pelarut diuapkan (Direktorat Jendral Pengawasan Obat dan Makanan RI,1995).
H. Kromatografi Lapis Tipis(KLT)
Kromatografi lapis tipis adalah cara pemisahan dengan adsorbsi pada
lapisan tipis adsorben. Kromatografi lapis tipis digunakan untuk memisahkan
berbagai senyawa organik, komplek senyawa organik alam maupun sintetik.
Metode pemisahan dengan kromatografi lapis tipis memiliki keuntungan yaitu
waktu lebih cepat dan diperoleh pemisahan yang lebih baik dibandingkan
kromatografi kertas (Sastrohamidjojo, 2007).
Fase diam yang digunakan dalam KLT adalah bahan penjerap
(adsorben). Dua sifat penting yang harus diperhatikan untuk KLT adalah besar
dan kecilnya partikel penjerap serta homogenitasnya, sebab daya lekat pada
pendukung sangat ditentukan oleh kedua sifat tersebut. Partikel yang kasar tidak
dapat memberikan pemisahan yang baik dan untuk memperbaikinya dapat
digunakan partikel yang halus (umumnya 1-25 µm). Beberapa macam penjerap
yang digunakan alumunium, selulosa, sephadex, keiselguhr, celite, poliamid, dan
Fase gerak adalah suatu medium angkut dan terdiri atas satu atau
beberapa pelarut. Pemilihan fase gerak untuk KLT tergantung pada polaritas
pelarut tersebut. Efek elusi dapat naik dengan kenaikan kepolaran pelarut,
sedangkan laju rambat tergantung kepada viskositas pelarut (Sastrohamidjojo,
2007).
KLT dapat digunakan untuk uji identifikasi. Parameter pada KLT yang
digunakan untuk identifikasi adalah nilai Rf. Dua senyawa dikatakan identik jika
mempunyai nilai Rf yang sama jika diukur pada kondisi KLT yang sama (Gandjar
dan Rohman, 2010).
Harga Rf dapat ditentukan sebagai berikut :
Rf =
Harga Rf ini adalah tetapan fisika yang dipengaruhi oleh bebrapa factor
seperti tebal lapisan, kelembaban udara, fase gerak, bahan penjerap dan suhu
(Sastrohamidjojo, 2007).
I. Spektrofotometri Visibel
Instrumen yang digunakan untuk mempelajari serapan atau emisi radiasi
elektromagnetik sebagai fungsi dari panjang gelombang disebut “spektrometer”
atau spektrofotometer (Sastrohamidjojo, 2007).
Prinsip spektrofotometri adalah adanya interaksi dari energi radiasi
elektromagnetik dengan zat kimia. Dari interaksi ini dikembangkan teknik-teknik
analisis kimia yang memanfaatkan sifat-sifat interaksi tersebut (Sudarmadji,1991).
1. Sumber tenaga radiasi yang stabil,
2. Sistem yang terdiri atas lensa-lensa, cermin, celah-celah, dan lain-lain,
3. Monokromator untuk mengubah radiasi menjadi komponen-komponen
panjang gelombang tunggal,
4. Tempat cuplikan yang transparan, dan
5. Detektor radiasi yang dihubungkan dengan pencatat (Sastrohamidjojo, 2007).
J. Validasi Metode
Validasi metode analisis adalah suatu tindakan penilaian terhadap
parameter tertentu, berdasarkan percobaan laboratorium, untuk membuktikan
bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita,
2004).
Parameter-parameter validasi metode analisis yang diperlukan untuk
menilai ketepatan metode analisis antara lain meliputi akurasi, presisi, linearitas,
dan spesifitas.
1. Akurasi
Akurasi metode analisis adalah ukuran yang menunjukkan derajat
kedekatan hasil analisis dengan kadar analit yang sebenarnya. Kecermatan
dinyatakan sebagai persen perolehan kembali (recovery) analit yang
ditambahkan. Kriteria kecermatan sangat bergantung kepada konsentrasi
analit dalam matriks sampel dan pada keseksamaan metode (RSD). Akurasi
ditentukan dengan % recovery (Harmita, 2004).
Analit pada matrik
Keseksamaan adalah ukuran yang menunjukkan derajat kesesuaian
antara hasil uji individual, diukur melalui penyebaran hasil individual dari
rata-rata jika prosedur diterapkan secara berulang pada sampel-sampel yang
diambil dari campuran yang homogen (Harmita, 2004).
Presisi dinyatakan dalam standar deviasi atau Coeffisien of variant, dan
tabel berikut merupakan syarat presisi yang dapat diterima berdasarkan kadar
analit.
Tabel II. Rentang CV yang masih dapat Diterima (Harmita, 2004)
Analit pada matrik
Linieritas pada suatu metode analisis dari suatu prosedur analisis
merupakan kemampuannya untuk mendapatkan hasil uji yang secara
Persyaratan data linieritas yang bisa diterima jika memenuhi nilai koefisien
korelasi (r) > 0,999 (Mulja dan Hanwar, 2003).
4. Spesifitas
Spesifitas suatu metode adalah kemampuan yang hanya mengukur zat
tertentu saja secara cermat dan seksama dengan adanya komponen lain yang
mungkin ada dalam matriks sampel. Spesifitas metode ditentukan dengan
membandingkan hasil analisis sampel yang mengandung cemaran, hasil urai,
senyawa sejenis, senyawa asing lainnya atau pembawa placebo dengan hasil
analisis sampel tanpa penambahan bahan-bahan tadi. Penyimpangan hasil
merupakan selisih dari hasil uji keduanya (Harmita, 2004).
K. Landasan Teori
Radikal bebas adalah atom atau molekul yang memiliki elektron tidak
berpasangan (unpaired electron). Adanya elektron yang tidak berpasangan
menyebabkan senyawa tersebut sangat reaktif mencari pasangan, dengan cara
menyerang dan mengikat elektron molekul sekitarnya misalnya protein, asam
lemak tak jenuh, dan lipoprotein, serta unsur DNA termasuk karbohidrat.
Antioksidan merupakan senyawa pemberi elektron (electron donor) atau
reduktan yang mampu menginaktivasi terjadinya radikal. Kulit buah jeruk lemon
(Citrus x limon (L.) ini diduga memiliki daya antioksidan karena mengandung
flavonoid yaitu naringin dan hesperidin.
Metode DPPH adalah metode yang dapat digunakan untuk mengukur
dapat bereaksi dengan senyawa yang dapat mendonorkan atom hidrogen.
Keberadaan dari senyawa antioksidan ini akan menurunkan intensitas warna
DPPH dari ungu menjadi kuning.
L. Hipotesis
Fraksi etil asetat ekstrak metanol kulit buah lemon mempunyai aktivitas
antioksidan menggunakan radikal bebas DPPH. Kadar fenolik dalam fraksi etil
asetat ekstrak metanol kulit buah lemon mempengaruhi aktivitasnya sebagai
18 BAB III
METODOLOGI PENELITIAN
A. Jenis Penelitian dan Rancangan Penelitian
Penelitian ini termasuk penelitian eksperimental karena adanya perlakuan
terhadap senyawa uji, dengan tahapan penelitian sebagai berikut.
1. Pemilihan dan pengumpulan sampel,
2. Pembuatan simplisia,
3. Ekstraksi dan fraksinasi simplisia,
4. Penetapan aktivitas antioksidan,
5. Penetapan kadar fenolik dalam fraksi etil asetat kulit buah jeruk lemon.
B. Variabel Penelitian 1. Variabel utama
a. Variabel bebas: konsentrasi fraksi etil asetat ekstrak metanol kulit buah
lemon.
b. Variabel tergantung: aktivitas antioksidan (%IC) fraksi etil asetat ekstrak
metanol kulit buah lemon.
2. Variabel pengacau
a. Variabel pengacau terkendali: cara pengeringan dan pembuatan simplisia,
b. Variabel pengacau tak terkendali: tempat tumbuh tanaman, waktu
pemanenan, umur lemon yang dipanen, cara panen, cahaya matahari,
cuaca atau musim, curah hujan, dan kelembaban ruang.
C. Definisi Operasional
1. Kulit buah jeruk lemon adalah kulit dari buah jeruk lemon yang didapatkan
dari salah satu supermarket di Yogyakarta, buah berbentuk oval dengan
tonjolan puting pada bagian ujung buah, dan berwarna kuning.
2. Ekstrak kulit buah lemon adalah ekstrak kental kulit buah jeruk lemonyang
diperoleh dari hasil maserasi dengan metanol.
3. Fraksi etil asetat adalah hasil fraksinasi ekstrak metanol kulit buah lemon
dengan menggunakan etil asetat yang telah difraksinasi dengan air dan
washbensin.
4. Persen inhibition concentration (%IC) adalah kemampuan fraksi etil asetat
ekstrak metanol kulit buah lemon untuk menangkap radikal DPPH yang
dinyatakan dalam persen.
5. Inhibition concentration 50 (IC50) merupakan nilai konsentrasi fraksi etil
asetat ekstrak metanol kulit buah lemon yang mampu menangkap 50% radikal
D. Bahan dan Alat Penelitian 1. Bahan penelitian
Bahan yang digunakan dalam penelitian ini antara lain: kulit buah
lemon (Citrus x limon (L.) Burm. f.) yang didapatkan dari salah satu
supermarket di Yogyakarta. Bahan kimia kualitas pro analitik (E.merck)
meliputi metanol dan kloroform. Bahan kimia kualitas pro analitik Sigma.
Co., USA meliputi DPPH, rutin, reagen Folin-Ciocalteu, asam galat. Bahan
kimia kualitas teknis Brataco Chemica meliputi metanol, washbensin, dan etil
asetat. Bahan kimia kualitas farmasetis berupa akuades.
2. Alat-alat penelitian
Alat-alat yang digunakan dalam penelitian ini berupa vortex (junke &
kunkel), spetrofotometer UV-Vis Mini 1240, blender, corong, Buchner, oven,
mikropipet 10-1000 µL, makropipet 1-10 mL, neraca analitik, vacum rotary
evaporator (junke & kunkel), dan alat-alat gelas yang lazim digunakan di
laboratorium analisis (Pyrex-Germany, dan Iwaki).
E. Tatacara Penelitian 1. . Determinasi tanaman
Determinasi buah jeruk lemon dilakukan dengan membandingkan
ciri-ciri buah lemon dengan ciri-ciri-ciri-ciri buah lemon yang disebutkan Morton (1987)
2. Pemilihan dan pengumpulan sampel
Sampel kulit buah jeruk lemon didapatkan dari salah satu supermarket
di Yogyakarta. Kulit buah jeruk lemon yang digunakan adalah buah jeruk
lemon yang siap dikonsumsi.
3. Pembuatan simplisia
Kulit buah jeruk lemon dicuci bersih, ditiriskan dan diiris tipis.
Kemudian dikeringkan dalam oven pada suhu 50o C selama 3 x 24 jam.
Simplisia kering ditandai dengan kult jeruk yang telah menjadi rapuh
kemudian diserbuk kasar dengan menggunakan mesin penyerbuk dan
dilewatkan ayakan dengan ukuran 40 mesh.
4. Ekstraksi dan fraksinasi simplisia
Sebanyak 1 kg serbuk simplisia kulit buah lemon dimasukkan ke
dalam bejana maserasi, ditambah dengan metanol sampai terendam sempurna
dan dicampur homogen. Campuran dimaserasi pada suhu ruangan selama tiga
hari. Filtrat diperoleh melalui penyaringan menggunakan kertas saring dengan
bantuan corong Buchner dan pompa vakum. Ampas penyaringan
diremaserasi dengan metanol kembali selama dua hari. Kemudian filtrat
dicampur dengan filtrat terdahulu. Keseluruhan filtrat diuapkan pelarutnya
dengan vacuum rotary evaporator sehingga diperoleh ekstrak metanol kental
Ekstrak metanol kental kulit buah lemon dilarutkan dalam 300 ml air
hangat dan dilakukan ekstraksi cair-cair menggunakan washbensin dengan
perbandingan larutan ekstrak : washbensin (1:1 v/v), dihasilkan fraksi air dan
washbensin. Kemudian fraksi air diekstraksi kembali menggunakan etil
asetat, sehingga didapatkan fraksi air dan fraksi etil asetat. Fraksi etil asetat
diuapkan dengan vacuum rotary evaporator sehingga didapatkan fraksi etil
asetat kental. Fraksi etil asetat ini yang digunakan untuk analisis selanjutnya.
5. Penetapan aktivitas antioksidan
a. Kualitatif
Fraksi etil asetat ekstrak metanol kulit buah lemon dan standar rutin
masing-masing dilarutkan dalam metanol kemudian ditotolkan pada
lempeng selulosa gel. Lempeng tersebut dielusi dengan fase gerak
kloroform : metanol (1:1 v/v). Setelah dielusi, bercak diamati pada UV
365 nm dengan jarak rambat 10 cm. Pereaksi semprot yang digunakan
adalah uap ammonia dan besi (III) klorida.
b. Kuantitatif
1. Pembutan larutan DPPH 0,4 mM
Sebanyak 15,8 mg serbuk DPPH dimasukkan ke dalam labu
takar 100,0 ml, lalu ditambahkan metanol hingga batas tanda.
2. Pembuatan larutan rutin 0,250 mg/ml
Sebanyak 2,5 mg rutin dimasukkan dalam labu takar 10 ml,
masukkan metanol hingga batas tanda. Buat larutan pembanding
dengan konsentrasi 12,25; 19,25; 26,25; 33,25; dan 40,25 g/mL.
3. Pembuatan larutan uji aktivitas antioksidan
Ekstrak kulit buah jeruk lemonditimbang sebanyak 100 mg
ditambahkan metanol sampai 25,0 ml. Larutan tersebut kemudian
dibuat larutan uji dengan konsentrasi 300,0; 350,0; 400,0; 450,0; dan
500,0 µg/mL.
4. Penentuan operating time
Sebanyak 1,0 ml larutan DPPH 0,4 mM dimasukkan ke dalam
labu takar 5,0 ml, ditambahkan masing-masing 1 mL larutan
pembanding rutin 12,25; 26,25; 40,25 µg/mL. Kemudian tambahkan
metanol hingga batas tanda. Larutan dihomogenkan dengan vortex
selama 30 detik. Setelah itu baca absorbansinya pada 517 nm tiap 10
menit selama 1 jam. Tentukan operating time reaksi. Dilakukan
demikian juga untuk larutan uji 300; 400; 500 µg/mL.
5. Penentuan panjang gelombang serapan maksimum
Pada 3 labu ukur 10 mL, dimasukkan masing-masing 12,12;
26,25, dan 40,25 µg/mL larutan DPPH 0,4 mM. Setelah itu di add
hingga batas tanda dan divortex selama 30 detik. Diamkan selama OT.
dengan spektrofotometri visibel pada panjang gelombang 400-600 nm.
Dilakukan demikian juga untuk larutan uji 300; 400; 500 µg/mL.
6. Penentuan aktivitas antioksidan
Sebanyak 1,0 ml larutan DPPH 0,4 mM dimasukkan ke dalam
labu takar 5,0 ml kemudian ditambahkan 1,0 ml larutan uji atau
pembanding pada berbagai konsentrasinya. Tambahkan metanol
hingga batas tanda. Larutan divortex selama 30 detik dan didiamkan
selama operating time. Baca absorbansinya dengan spektrofotometer
visibel pada panjang gelombang maksimum hasil optimasi. Pengujian
dilakuakan dengan 3 kali replikasi.
Aktivitas antioksidan (%IC) dihitung dengan rumus:
% IC = -
x 100%
7. Validasi metode uji aktivitas antioksidan
Hasil dari prosedur 6. divalidasi dengan parameter akurasi (%
recovery), presisi (% CV), spesifitas (spektra kontrol), dan linearitas
(nilai r).
% Recovery
x 100%
% CV =
6. Penetapan kadar fenolik dalam ekstrak
a. Pembuatan larutan asam galat
Dibuat larutan asam galat dengan konsentrasi 500 g/ml dalam aquades :
metanol p.a (1:1). Diambil sebanyak 1,0;1,5; 2,0; 2,5; 3,0 ml. Larutan
tersebut kemudian ditambahkan aquades: metanol p.a (1:1) ad sampai 10
ml, sehingga diperoleh konsentrasi larutan baku asam galat 50; 75; 100;
125; dan 150 µg/mL.
b. Pembuatan kurva baku asam galat
Sebanyak 0,5 ml larutan asam galat konsentrasi 50; 75; 100; 125; dan 150
µg/mL ditambahan dengan 5 ml reagen Folin-Ciocalteu yang telah
diencerkan dengan air (1:10 v/v). Larutan selanjutnya ditambahkan
dengan 4,0 ml Na2CO3 1 M. Setelah OT, baca absorbansi pada panjang
gelombang maksimum terhadap blangko yang terdiri dari aquades :
metanol p.a (1:1), reagen Folin-ciocalteu, dan larutan Na2CO3 1 M.
Pengerjaan dilakukan 3 kali.
c. Validasi metode penetapan kandungan fenolik total
Hasil dari prosedur pembuatan kurva baku asam galat divalidasi
berdasarkan parameter akurasi (% recovery), presisi (% CV), linearitas
(nilai r), serta spesifitas (spektra kontrol).
d. Estimasi kandungan fenolik total larutan uji
Larutan uji 1000 µg/mL diambil 6,5 ml lalu dimasukkan ke dalam tabung
reaksi dan dilanjutkan sebagaimana perlakuan pada pembuatan kurva
ekivalen asam galat (mg ekivalen asam galat per gram fraksi etil asetat).
Lakukan 3 kali replikasi.
F. Analisis hasil
Data aktivitas antioksidan digunakan untuk menghitung IC50 dengan
menggunakan persamaan regresi linear dengan konsentrasi larutan uji sebagai
sumbu x dan % IC sebagai sumbu y. Setelah itu dianalisis dengan
menggunakan statistik untuk melihat ada tidaknya perbedaan bermakna
antara IC50 larutan pembanding dengan larutan uji.
Dari uji kandungan fenolik total didapatkan nilai mg ekivalen asam
galat per g fraksi etil asetat ekstrak metanol kulit buah lemon. Nilai tersebut
didapatkan dari analisis regresi linear dengan data kurva baku secara
27 BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi
Determinasi perlu dilakukan untuk menghindari terjadinya kesalahan
dalam menggunakan buah jeruk lemon. Buah lemon yang digunakan memiliki
ciri-ciri bentuk oval dengan tonjolan puting pada ujung buahnya, kulitnya
berwarna kuning dengan kelenjar minyak. Daging buahnya berwarna kuning
pucat, dan memiliki biji berbentuk elips. Hal ini berarti bahan yang digunakan
memang benar kulit yang berasal dari buah jeruk lemon karena sesuai dengan
ciri-ciri buah lemon yang disebutkan Morton (1987) dengan nama spesies Citrus
limon.
B. Hasil Preparasi Sampel 1. Hasil ekstrak sampel
Ekstraksi bertujuan untuk menarik kandungan kimia yang diinginkan
dari sampel menggunakan pelarut yang sesuai dimana komponen yang
diinginkan dapat larut di dalamnya. Dasar dari ekstraksi adalah perpindahan
massa aktif yang semula berada dalam sel, ditarik oleh cairan penyari
sehingga terjadi larutan zat aktif dalam cairan penyari tersebut (Trevor, 1995).
Semakin banyak permukaan simplisia yang bersentuhan dengan penyari maka
Pembuatan ekstrak kulit buah lemon diawali dengan melakukan
sortasi basah. Sortasi basah ini bertujuan untuk menghilangakn pengotor
seperti debu dan tanah dari kulit buah jeruk lemon. Setelah itu kulit buah
lemon di angin-anginkan untuk menghilangkan air sisa pencucian yang
terdapat pada kulit buah lemon. Sebelum di blender, kulit buah lemon di oven
terlebih dahulu selama 3 hari pada suhu pengeringan yanitu 50˚C untuk
memudahkan dalam pemblenderan. Kulit buah lemon di blender bertujuan
untuk memperkecil ukuran kulit buah lemon sehingga luas permukaan akan
semakin besar. Semakin besar luas permukaan maka kesempatan sampel
untuk bersentuhan dengan cairan penyari akan semakin besar sehingga proses
penyarian akan lebih efektif.
Penyari yang digunakan dalam ekstraksi ini adalah metanol. Metanol
merupakan pelarut yang biasa digunakan untuk melarutkan senyawa organik.
Pemilihan metanol dibandingkan dengan etanol yaitu karena metanol memiliki
kepolaran yang lebih besar daripada etanol (metanol= 6.6 dan etanol= 5.2)
sehingga lebih mudah berinteraksi dengan senyawa fenolik yang cenderung
polar. Selain itu viskositas metanol lebih kecil dibandingkan dengan etanol,
sehingga metanol dapat berdifusi menembus sel-sel dibandingkan etanol.
Meode ekstraksi yang digunakan adalah maserasi. Dibandingkan
dengan metode ekstraksi yang lain, maserasi memiliki cara kerja yang
sederhana dan tidak menggunakan pemanasan seperti perkolasi dan soxhletasi,
karena flavonoid mudah rusak dengan adanya pemanasan. Maserasi dilakukan
penyari, yaitu metanol dan menggunakan bantuan alat pengadukan yaitu
shaker. Pengadukan sendiri bertujuan untuk meningkatkan kontak antara
cairan penyari dengan sampel sehingga penyarian lebih efektif. Selain itu,
pengadukan juga diperlukan untuk meratakan konsentrasi larutan di luar
sampel sehingga tetap terjaga adanya derajat perbedaan konsentrasi yang
sekecil-kecilnya antara larutan di dalam dan di luar sel (Baraja, 2008).
Setelah maserasi berlangsung selama 3 hari, dilakukan penyaringan
dan remaserasi menggunakan penyari metanol selama 2 hari. Remaserasi ini
bertujuan untuk memaksimalkan proses penyarian senyawa-senyawa yang
tidak tersari akibat penyari yang sudah jenuh sebelumnya. Selama proses
maserasi labu ditutup dengan alumunium foil untuk meminalisir rusaknya
fenolik akibat terpapar sinar matahari dan UV. Hasil dari maserasi dan
remaserasi di saring dengan kertas saring dengan corong Buchner dan pompa
vacuum. Setelah itu sari metanol diuapkan dengan vaccum rotary evaporator
pada suhu 50˚C dan tekanan rendah hingga diperoleh sari pekat metanol. Sari
pekat kemudian di uapkan dengan oven hingga terbentuk ekstrak kental.
Bobot ekstrak metanol yang didapat adalah 52,74 g dan rendeman yang di
dapat adalah 35,16 % (lampiran 2).
2. Hasil fraksinasi ekstrak metanol kulit lemon
Fraksinasi bertujuan untuk mendapatkan fraksi yang berisi senyawa
murni. Ekstrak metanol merupakan pelarut yang dapat menyari
dan mineral. Fraksinasi dilakukan untuk memisahkan senyawa target dengan
senyawa non target berdasarkan kesamaan karakteristik fisikokimianya
sehingga didapatkan senyawa yang diinginkan seperti senyawa fenolik.
Ekstrak metanol yang didapat dilarutkan dengan air hangat agar lebih
melarutkan ekstrak metanol. Larutan tersebut kemudian di partisi dengan
menggunakan washbensin. Partisi ini dilakukan dengan perbandingan pelarut
air : washbensin 1:1 v/v dimana bagian yang polar akan cenderung larut dalam
air dan bagian yang non polar akan larut dalam washbensin. Fraksi
washbensin akan berada di bagian atas karena berat jenis air (0,996) lebih
besar daripada berat jenis washbensin (0,730) (Direktorat Jendral Pengawasan
Obat dan Makanan RI, 1995). Fraksi washbensin akan mengandung senyawa
yang tidak diperlukan untuk analisis seperti lemak, minyak, dan vitamin,
sedangkan senyawa fenolik akan tertinggal didalam fraksi air.
Fraksi air tersebut kemudian difraksi kembali dengan etil asetat. Etil
asetat merupakan pelarut semi polar dan dapat melarutkan senyawa semi polar
pada dinding sel seperti aglikon flavonoid (Harborne, 1987). Fraksi air dan etil
asetat akan terpisah, fraksi etil asetat akan berada di atas sedangkan fraksi air
akan berada di bawah karena berat jenis air lebih besar (0,996) daripada berat
jenis etil asetat (0,898).
Fraksi etil asetat yang telah dipisahkan kemudian diupakan dengan
vaccum rotary evaporator untuk meminimalkan pemanasan agar stabilitas
dengan oven sampai didapatkan ekstrak kental. Bobot fraksi air yang didapat
sebesar 0,64 g dengan rendemen fraksi yaitu 0,4267% (lampiran 2).
C. Hasil Uji Kualitatif Flavonoid dengan Metode KLT
Pada penelitian ini dilakukan uji kualitatif terhadap fraksi etil asetat untuk
mengetahui apakah di dalam kulit buah lemon mengandung flavonoid. Sebagai
pembanding digunakan rutin yang merupakan senyawa golongan flavonoid.
Metode yang digunakan adalah KLT (kromatografi lapis tipis). Fase diam yang
dipakai adalah selulosa dan fase gerak yang dipakai adalah kloroform : metanol
1:1 v/v. Fase diam yang digunakan selulosa bukan silica gel GF254 karena adanya
ikatan Ca yang terdapat pada gypsum (perekat) silica gel GF254 terhadapflavonoid
A B
Gambar 4. Kromatogram KLT Uji Kualitatif Flavonoid dengan Uap Ammonia Keterangan: Fase gerak= kloroform : metanol 1:1v/v a = Fraksi etil asetat bercak a
Fase diam = selulosa b = Fraksi etil asetat bercak b Jarak elusi = 10 cm A = Pada cahaya tampak Pereaksi = Uap ammonia B = Deteksi UV 365
Deteksi bercak menggunakan uap ammonia. Bercak tidak nampak
sebelum dan setelah di uapi dengan uap ammonia untuk baku rutin dan sampel
pada cahaya tampak. Ketika dilihat pada UV 365 terdapat tiga bercak, dua bercak
berasal dari fraksi etil asetat sedangkan satu bercak berasal dari baku rutin. Bercak
rutin dengan warna ungu gelap dengan Rf 0,43 Sedangkan untuk fraksi etil asetat
kedua bercak memberikan warna yang berbeda-beda. Bercak a berwarna ungu
gelap sama dengan rutin dengan Rf 0,98 untuk bercak b memberikan warna ungu
terang dengan Rf 0,92. Hal tersebut membuktikan bahwa di dalam kulit lemon
Rf
terdapat flavonoid yang ditunjukan dari bercak a yang memiliki warna yang sama
dengan bercak rutin, tetapi flavonoid yang terkandung dalam kulit buah
lemonbukanlah rutin karena nilai Rf bercak a berbeda dengan nilai Rf rutin.
Sedangkan bercak b diperkirakan golongan flavonol.
A B
Gambar 5. Kromatogram KLT Uji Kualitatif Flavonoid dengan Semprot Besi (III) Klorida Keterangan : Fase gerak= kloroform : metanol 1:1v/v a = Fraksi etil asetat bercak a
Fase diam= selulosa b = Fraksi etil asetat bercak b Jarak elusi= 10 cm A = Pada cahaya tampak Deteksi = Besi (III) Klorida B = Deteksi UV 365
Penyemprotan dengan besi (III) klorida memberikan kromatogram mirip
dengan perlakuan menggunakan uap ammonia, hanya saja bercak a pada fraksi
etil asetat terlihat lebih jelas jika dibandingkan dengan bercak a pada perlakuan
dengan uap ammonia, tetapi untuk Rf-nya tidak mengalami perubahan. Bercak
Rf
rutin memiliki Rf 0,43; bercak a dengan Rf 0,98; sedangkan bercak b dengan Rf
0,92.
D. Hasil Optimasi Metode Uji Aktivitas Antioksidan 1. Penentuan operating time ( OT )
Penentuan OT bertujuan untuk menentukan rentang waktu yang tepat
ketika reaksi telah berjalan optimal. Penentuan OT dilakukan dengan mengukur
absorbansi DPPH setiap 5 menit selama 60 menit pada larutan pembanding, yaitu
rutin yang telah direaksikan dengan DPPH dan juga larutan uji, yaitu sampel yang
telah direaksikan dengan DPPH. Panjang gelombang maksimum yang digunakan
untuk penentuan OT adalah maksimum teoritis, yaitu 517 nm (Dehpour, 2009).
Gambar 6. Grafik Penentuan OT Rutin 0
Penentuan Operating Time Rutin
12,25 µg/mL
26,25 µg/mL
Gambar 7. Grafik Penentuan OT Fraksi Etil Asetat
Berdasarkan Gambar 6.penentuan OT tersebut dapat diketahui bahwa
absorbansi stabil setelah menit ke-40 hingga menit ke-60 pada tiga konsentrasi,
sehingga dapat disimpulkan bahwa operating time untuk reaksi radikal DPPH
dengan rutin maupun dengan larutan uji adalah 40 menit.
2. Penentuan panjang gelombang maksimum metode uji aktivitas antioksidan
Penentuan panjang gelombang maksimum bertujuan untuk menentukan
panjang gelombang dimana senyawa uji dapat memberikan absorbansi paling
optimum. Dalam penelitian ini senyawa yang diukur adalah absorbansi dari
DPPH. DPPH mampu memberikan serapan karena memiliki gugus kromofor dan
auksokrom pada struktur kimianya, adanya delokalisasi elektron pada DPPH akan
menghasilkan warna violet.
Penentuan Operating Time Fraksi Etil Asetat
300 µg/mL
400 µg/mL
Penentuan panjang gelombang dengan melarut DPPH dengan metanol
tanpa ditambahakan dengan sampel kemudian dibuat tiga konsentrasi larutan
DPPH yang kemudian di scanning pada panjang gelombang 400-600 nm.
Pengukuran serapan DPPH tanpa ditambahkan sampel bertujuan untuk mengukur
serapan DPPH saja tanpa adanya gangguan dari senyawa-senyawa yang terdapat
di dalam sampel.
Tabel III. Hasil Scanning Panjang Gelombang Maksimum DPPH
Konsentrasi
Dari hasil scanning ketiga konsentrasi ditetapkan maksimum 516,0 nm.
Hal ini dikarenakan dari scanning ketiga konsentrasi, panjang gelombang yang
sering muncul adalah pada panjang gelombang 516,0 nm. Panjang gelombang
maksimum yang di dapat berbeda dengan panjang gelombang maksimum teoritis
yaitu 517,0 nm. Hal ini diperbolehkan sesuai ketentuan yang tercantum dalam
Farmakope Indonesia edisi IV dimana batas pergeseran maksimum yang
diperbolehkan adalah 2 nm sehingga panjang gelombang yang diperoleh pada
penelitian ini diperbolehkan untuk digunakan.
E. Hasil Validasi Metode Uji Aktivitas Antioksidan
Tujuan dilakukan validasi metode analisis adalah untuk memastikan atau
parameter-parameter yang sesuai dan benar. Parameter-parameter-parameter tersebut adalah akurasi,
presisi, linieritas dan spesifitas.
Validasi analisis ini dilakukan dengan menggunakan tiga kali replikasi
larutan pembanding rutin dan larutan uji fraksi etil asetat ekstrak metanol kulit
buah lemon sehingga didapatkan tiga persamaan regresi linier antara konsentrasi
rutin dan larutan uji dengan %IC.
Tabel IV. Hasil Pengukuran Absorbansi Seri Baku Rutin yang Direaksikan dengan Radikal
DPPH
Dari tiga persamaan yang terdapat pada Tabel IV. kemudian dipilih 1
persamaan yang memiliki nilai r paling mendekati 1 atau -1, sehingga didapatkan
untuk seri baku rutin digunakan persamaan regresi liniear dari replikasi 3,yaitu y
Tabel V. Hasil Pengukuran Absorbansi Seri Fraksi Etil Asetat yang Direaksikan dengan
Sedangkan untuk seri konsentrasi fraksi etil asetat ektrak metanol kulit
buah lemon pada tabel V. digunakan persamaan regresi linear dari replikasi 3,
yaitu y = 0,10174x + 7,7 dengan r = 0,99512.
Gambar 8. Kurva Persamaan Regresi Linear Aktivitas Antioksidan Rutin y = 1,770x + 5,895
Gambar 9. Kurva Persamaan Regresi Linear Aktivitas Antioksidan Fraksi Etil Asetat
1. Linearitas
Linearitas menunjukkan kemampuan metode untuk dapat
menghasilkan hasil uji yang secara langsung proporsional dengan konsentrasi
analit dalam sampel. Linearitas ini diindikasikan dari nilai koefisien
korelasinya (r). Dari tiga kali replikasi untuk seri baku rutin didapatkan nilai
koefisien korelasi (r) yang paling baik adalah replikasi tiga dengan nilai r =
0,997, sedangkan untuk seri konsentrasi fraksi etil asetat ekstrak metanol
kulit buah lemon digunakan replikasi tiga dengan nilai r = 0,99512. Menurut
APVMA (2004), persyaratan koefisien korelasi yang dapat diterima adalah >
0,99, sehingga dapat disimpulkan nilai koefisien korelasi rutin dan fraksi air
ekstrak metanol kulit buah lemon masih memenuhi persyaratan linearitas
yang baik.
250 300 350 400 450 500 550
A
2. Presisi
Presisi merupakan simpangan baku dari beberapa kali keterulangan
penentuan kadar yang dianalisis dengan metode yang sesuai. Presisi dari
metode analisis dinyatakan dalam CV (Coeffisien of Variant). Semakin kecil
nilai CV semakin baik presisinya dan semakin terjamin metode yang
digunakan.
Tabel VI. Nilai %CV Uji Aktivitas Antioksidan Rutin dan Fraksi Etil Asetat
Rutin Fraksi etil asetat Konsentrasi Keterangan:SD = Standard Deviation; CV = Coefficient of Variation
Berdasarkan Tabel VI, dapat diketahui bahwa nilai %CV rutin yang
tertinggi adalah 0,138264%, sedangkan untuk %CV fraksi etil asetat ekstrak
metanol kulit buah lemon yang tertinggi adalah 0,053294%. Menurut
APVMA (2004), persyaratan %CV yang baik untuk analit konsentrasi 100
ppm adalah %CV< 5%, sedangkan untuk bahan alam %CV < 15%.Hal ini
berarti %CV rutin dan fraksi etil asetat ekstrak metanol kulit buah lemon
memenuhi syarat presisi yang baik.
3. Spesifitas
Spesifitas adalah kemampuan suatu metode untuk mengukur secara
spektrofotometri visibel untuk mengukur rutin dan fraksi etil asetat ekstrak
metanol kulit buah lemon, spesifikasi metode dapat dilihat dari ada tidaknya
serapan dari komponen-komponen lain seperti sampel maupun pelarut yang
mengganggu pengukuran absorbansi DPPH pada panjang gelombang 515,0
nm.
Hasil scanning pada larutan pembanding rutin (lampiran 5c.) dan
larutan uji fraksi etil asetat ekstrak metanol kulit buah lemon (lampiran 5e.)
pada panjang gelombang 515,0 nm tidak terdapat serapan, sehingga ketika rutin
direaksikan dengan radikal DPPH maka yang terbaca hanya absorbansi DPPH
hasil reaksi, sehingga dapat disimpulkan baik pada rutin maupun pada fraksi
etil asetat ekstrak metanol kulit buah lemon bahwa metode ini memiliki
spesifitas yang baik.
F. Hasil Penentuan Aktivitas Antioksidan dengan Radikal DPPH
Tujuan dari penentuan aktivitas antioksidan adalah untuk mengetahui ada
tidaknya dan seberapa besar aktivitas antioksidan dari fraksi etil asetat ekstrak
metanol kulit buah lemon dalam mengurangi radikal bebas. Uji aktivitas
antioksidan dengan metode penangkapan radikal terhadap radikal
1,1-difenil-2-pikrilhidrazil (DPPH) dengan prinsip adanya penangkapan radikal DPPH oleh
senyawa antioksidan. Radikal DPPH akan bereaksi dengan senyawa antioksidan
sehingga DPPH akan tereduksi oleh proses donasi hidrogen yang menyebabkan
warnanya dari ungu menjadi kuning yang kemudian dapat diukur menggunakan
spektrofotometer visibel karena adanya penurunan absorbansi.
Pada penentuan aktivitas antioksidan fraksi etil asetat ekstrak metanol
kulit buah lemon ini digunakan rutin sebagai senyawa pembanding rutin
digunakan sebagai senyawa pembanding karena rutin merupakan senyawa
flavonoid yang sudah diketahui memiliki aktivitas antioksidan karena memiliki
OH fenolik.
Aktivitas antioksidan ini dinyatakan dengan IC50. IC50 merupakan
konsentrasi senyawa antioksidan yang dapat menurunkan 50% radikal DPPH.
Nilai IC50 ini dihitung dari hubungan antara konsentrasi uji dengan persen
aktivitas antioksidan dalam persamaan regresi linear. Semakin kecil nilai IC50
berarti semakin baik senyawa uji tersebut dalam menurunkan radikal bebas,
karena semakin kecil nilai IC50 berarti semakin sedikit konsentrasi yang
diperlukan untuk menurunkan 50% radikal DPPH.
Tabel VII. Hasil Perhitungan IC50 Rutin dan Fraksi Etil Asetat Ekstrak Metanol Kulit Buah Lemon
Bahan Uji
IC50 (µg/mL)
Replikasi Rata-rata
(µg/mL) SD CV (%)
1 2 3
Rutin 24,463 23,088 24,918 24,2 0,78 3,217
Fraksi
Tabel VIII. Tingkat Kekuatan Antioksidan Senyawa Uji dengan Metode DPPH (Ariyanto cit., Widodo, 2011)
Bahan Uji IC50 (µg/mL)
Tingkat Aktivitas Antioksidan (nilai IC50) dengan metode
DPPH
µg/mL. Berdasarkan nilai IC50 tersebut dapat diketahui bahwa aktivitas
antioksidan rutin memiliki aktivitas antioksidan yang sangat kuat karena kurang
dari 50 µg/mL sedangakn untuk fraksi etil asetat ekstrak metanol kulit buah lemon
memiliki aktivitas antioksidan yang lemah karena lebih dari 150 µg/mL.
Untuk menguji kebermaknaan nilai IC50 rutin dengan IC50 fraksi etil asetat
esktrak metanol kulit buah lemon maka dilakukan analisis secara statistik
menggunakan software R-2.14.1. Untuk mengetahui kebermaknaan perlu dilihat
normalitas distribusinya terlebih dahulu dengan menggunakan uji Shapiro-Wilk
karena sampel yang digunakan ≤50. Dari perhitungan didapatkan nilai signifikansi
(p) rutin adalah 0,1509 dan nilai p fraksi etil asetat adalah 0,5213. Hal ini berarti
%IC rutin maupun fraksi etil asetat memiliki distribusi normal karena memiliki
nilai p yang lebih besar dari nilai p yang ditentukan, yaitu 0,05 (taraf kepercayaan
95%).
Setelah itu dilanjutkan dengan uji parametrik menggunakan Independent
Sample T-Test. Digunakan Independent Sample T-Test karena nilai IC50 antara
digunakan adalah nilai IC50 rutin lebih besar daripada nilai IC50 fraksi etil asetat,
dan hipotesis null (H0) adalah nilai IC50 rutin tidak lebih kecil dari nilai IC50 fraksi
etil asetat. Dari hasil pengujian didapatkan nilai p-nya sebesar 0,000 antara rutin
dan fraksi etil asetat. Nilai p ini lebih kecil daripasa nilai p yang ditentukan, yaitu
0,05 maka H0 ditolak. Sehingga dapat disimpulkan bahwa nilai IC50 rutin lebih
kecil daripada nilai IC50 fraksi etil asetat ekstrak metanol kulit buah lemon.
G. Hasil Optimasi Metode Penetapan Kandungan Fenolik Total 1. Penentuan Operating time (OT)
Penentuan OT bertujuan untuk menentukan rentang waktu yang tepat
ketika reaksi telah berjalan optimal. Penentuan OT dilakukan dengan
mengukur absorbansi reaksi antara asam galat dengan pereaksi
Folin-Ciocalteu setiap 5 menit selama 60 menit.
Gambar 10. Grafik Penentuan OT Asam Galat 0
Penentuan Operating Time Asam Galat
50 µg/mL
100 µg/mL
Gambar 11. Grafik Penentuan OT Fraksi Etil Asetat
Dari grafik pada gambar 10 didapatkan bahwa pada grafik penentuan
OT untuk asam galat didapatkan absorbansi senyawa molybdenum blue, yaitu
hasil reaksi antara asam galat dengan pereaksi Folin-Ciocalteu stabil pada
menit ke-30 hingga menit ke-60, sedangakan untuk absorbansi reaksi fraksi
etil asetat dengan Folin-Ciocalteu memberikan kestabilan pada menit ke-45
hingga menit ke-60. Hal ini dapat disimpulkan bahwa operating time untuk
asam galat adalah 30 menit dan operating time untuk fraksi etil asetat adalah
45 menit.
2. Penentuan panjang gelombang maksimum
Penentuan panjang gelombang maksimum bertujuan untuk
menentukan panjang gelombang dimana senyawa uji dapat memberikan
absorbansi paling optimum. Dalam penelitian ini senyawa yang diukur adalah
absorbansi dari molybdenum blue, yaitu hasil reaksi antara asam galat dengan
0
Penentuan Operating Time Fraksi Etil Asetat
pereaksi Folin-Ciocalteu. Menurut Zhang et al.,(2006) panjang gelombang
maksimum untuk pereaksi Folin-Ciocalteu dengan senyawa fenolik adalah
750 nm.
Tabel IX. Hasil Scanning Panjang Gelombang Maksimum Penetapan Kandungan
Fenolik Total pada Asam Galat
Konsentrasi asam galat
(µg/mL) maksimum
maksimum
teoritis
50 750
750
100 750
150 747
Dari hasil scanning ketiga konsentrasi asam galat ditetapkan panjang
gelombang maksimum yang digunakan adalah 750 nm sesuai dengan teoritis. Hal
ini karena dari kedua konsentrasi yaitu konsentrasi rendah dan sedang
menunjukkan serapan panjang gelombang maksimum pada 750 nm. Sehingga
untuk menentukan kandungan fenolik total digunakan panjang gelombang 750nm.
H. Hasil Validasi Metode Penetapan Kandungan Fenolik Total
Validasi metode penetapan kandungan Fenolik total dapat dilakukan
dengan mengukur akurasi, presisi, linearitas, dan spesifitas dari ketiga replikasi
baku asam galat. Di buat persamaan regresi linier antara konsentrasi asam galat
dengan absorbansi yang diperoleh dari reaksi antara asam galat dengan
Tabel X. Hasil Pengukuran Absorbansi Baku Asam Galat
Replikasi Konsentrasi
(µg/mL) Absorbansi Persamaan regresi linier
I
Dari ketiga persamaan tersebut kemudian dipilih persamaan dengan nilai r
yang mendekati 1 atau -1, sehingga didapatkan persamaan dari replikasi ke-3
dengan y = 0,0054x – 0,051 (r = 0,99969)
Gambar 12. Kurva Persamaan Regresi Linear Absorbansi Baku Asam Galat y = 0,0054x - 0,051