BAB II
TINJAUAN PUSTAKA
2.1 Protein
Protein berasal dari bahasa Yunani yaitu proteos, yang berarti yang utama atau yang di dahulukan. Kata ini diperkenalkan oleh ahli kimia Belanda, Geraldus Mulder (1802-1880). Ia berpendapat bahwa protein adalah zat yang paling penting dalam setiap organisme. Molekul protein mengandung unsur-unsur C, H, O, dan N. Protein mempunyai molekul besar dengan bobot molekul bervariasi antara 5000 sampai jutaan. Ada 20 jenis asam amino yang terdapat dalam molekul protein. Asam-asam amino ini terikat satu dengan lain oleh ikatan peptida(Sediaoetama, 2008; Poedjiadi, 1994).
Komposisi dasar dari protein sekitar 55 % karbon, 7 % hidrogen, 23 % oksigen, 16 % nitrogen, 1 % sulfur dan kurang dari 1 % fosfor. Protein dapat digolongkan menurut struktur susunan molekulnya, larutannya, adanya senyawa lain dalam molekul, tingkat degradasinya dan fungsinya (Winarno, 1984).
2.1.1 Asam Amino
Struktur dasar asam amino dapat dilihat pada Gambar 2.1. H
NH2 CCOOH
R
Gambar 2.1 Struktur Dasar Asam Amino (Almatsier, 2004)
Tubuh memerlukan 20 jenis asam amino yang terdiri dari 11 asam amino non-esensial dan 9 asam amino esensial. Asam amino non-esensial adalah asam amino yang dapat disintesis tubuh yang sehat dalam jumlah yang cukup, sedangkan asam amino esensial adalah asam amino yang tidak dapat disintesis oleh tubuh dalam jumlah yang cukup sehingga harus terdapat dalam diet (Wardlaw, dkk., 2004). Klasifikasi asam amino dapat dilihat pada tabel 2.1 berikut:
Tabel 2.1 Klasifikasi Asam Amino
Asam Amino Esensial Asam Amino Semi Esensial
Sumber: Wardlaw, dkk. (2004).
2.1.2 Sifat-sifat asam amino
amino dengan asam karboksilat dan terlihat pula pada titik leburnya. Asam amino mempunyai titik lebur yang lebih tinggi bila dibandingkan dengan asam karboksilat atau amina. Apabila asam amino larut dalam air, gugus karboksilat akan melepas ion H+, sedangkan gugus amino akan menerima ion H+. Oleh adanya gugus tersebut maka asam amino dapat membentuk ion yang bermuatan positif dan juga bermuatan negatif (zwitterion) atau ion amfoter (Poedjiadi, 1994). 2.1.3 Penggolongan Protein
Menurut Girindra (1993), berdasarkan strukturnya protein digolongkan atas empat golongan yaitu:
i. Struktur primer, pada struktur ini ikatan antar asam amino hanya ikatan peptida. ii. Struktur sekunder adalah struktur protein di mana asam amino bukan hanya dihubungkan oleh ikatan peptida tetapi juga diperkuat oleh ikatan hidrogen.
iii. Struktur tersier adalah rantai polipeptida yang cenderung untuk membentuk struktur yang kompleks.
iv. Struktur kuartener adalah struktur yang terbentuk dari beberapa bentuk tersier. Menurut Budiyanto (2004), berdasarkan keanekaragaman penyusun struktur protein maka penggolongan protein dilakukan dengan berbagai kriteria sebagai berikut:
a. Berdasarkan bentuknya protein digolongkan atas dua golongan yaitu:
i. Protein fibriler (skleroprotein) yaitu protein yang berbentuk serabut. Contoh protein fibriler adalah kolagen yang terdapat pada tulang rawan, miosin pada otot, keratin pada rambut, dan fibrin pada gumpalan darah.
b. Berdasarkan kelarutannya dalam air atau pelarut lain, protein digolongkan atas beberapa golongan yaitu:
i. Albumin: larut dalam air dan terkoagulasi oleh panas. Contohnya adalah albumin telur, albumin serum, laktalbumin dalam susu.
ii. Globulin: tidak larut dalam air, terkoagulasi oleh panas. Contohnya adalah miosinogen dalam otot dan ovoglobulin dalam kuning telur.
iii. Glutelin: tidak larut dalam pelarut netral, tetapi larut dalam asam atau basa encer. Contohnya adalah glutelin gandum, orizenin beras.
iv.Prolamin (gliadin): larut dalam alkohol 70-80% dan tidak larut dalam air maupun alkohol absolut. Contohnya adalah prolamin dalam gandum.
v. Protamin: larut dalam air dan tidak terkoagulasi dalam panas.
vi. Histon: larut dalam air dan tidak larut dalam amonia encer. Contohnya adalah histon dalam hemoglobin.
c. Berdasarkan senyawa pembentuknya dibagi atas dua golongan yaitu: i. Protein sederhana (protein saja) contohnya adalah hemoglobin.
ii. Protein konyugasi dan senyawa non protein: protein yang mengandung senyawa lain yang non protein disebut protein konyugasi sedangkan protein yang tidak mengandung senyawa non protein disebut protein sederhana. Contohnyaglikoprotein terdapat pada hati, lipoprotein terdapat pada susu dan kasein terdapat pada kuning telur.
d. Berdasarkan asam amino pembentuknya, protein digolongkan sebagai berikut: i. Protein sempurna (mengandung semua asam amino esensial).
2.1.4 Fungsi Protein
Menurut Muchtadi (2000), protein memiliki beberapa fungsi, yaitu: a. Untukpertumbuhandanpemeliharaanjaringan
Protein tubuh berada dalam keadaan dinamis yang konstan secara bergantian di pecah-pecah : sekitar 3% protein tubuh diganti setiap hari, dinding usus kecil yang diganti setiap hari 4-6 hari memerlukan sintesis protein sebanyak 70 gr perhari, untungnya tubuh sangat efisien dalam menghemat protein dan menggunakan kembali asam-asam amino hasil pemecahan suatu jaringan untuk membentuk kembali jaringan yang sama atau jaringan lain.
b. Pembentukan senyawa tubuh yang esensial
Hormon yang diproduksi dalam tubuh, seperti insulin, epinefrin dan tiroksin adalah protein, sebagai tambahan setiap sel dalam tubuh mengandung banyak sekali enzim yang berbeda dan semua adalah protein, enzim ini mengkatalisis banyak sekali perubahan biokimia yang essensial untuk kesehatan sel-sel jaringan. c. Regulasi keseimbangan air
Bila protein darah berkurang, tekanan protein yang menarik cairan kembali ke sirkulasi darah tidak sekuat tekanan osmotik yang menekannya keluar dari aliran darah. Hal ini akan mengakibatkan terjadinya akumulasi cairan dalam jaringan yang membuatnya menjadi lunak dan nampak mengembung dan dikenal sebagai tanda awal dari defisiensi protein.
d. Transpor nutrient
e. Mempertahankan netralitas tubuh
Protein dalam darah berfungsi sebagai buffer yaitu bahan yang dapat bereaksi baik dengan asam atau basa untuk menetralkannya. Hal ini merupakan fungsi yang sangat penting karena sebagian jaringan tubuh tidak dapat berfungsi bila pH-nya berubah dari normal.
f. Pembentukan antibodi
Kemampuan untuk menghilangkan racun dari tubuh di kontrol oleh enzim yang terutama berlokasi dalam hati. Dalam keadaan kekurangan protein, kemampuan untuk melawan pengaruh zat racun tersebut menjadi rendah, sehingga individu yang menderita kekurangan protein lebih mudah mengalami keracunan. 2.1.5 Sumber Protein
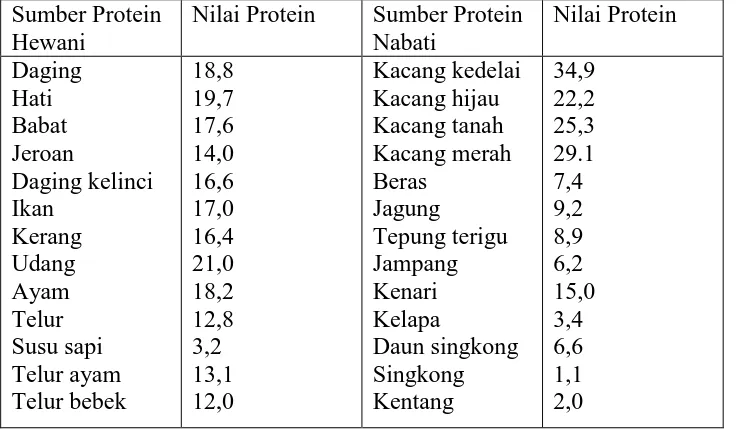
Berdasarkan sumbernya, protein terdiri dari protein hewani dan protein nabati. Nilai protein dalam berbagai bahan makanan dapat dilihat pada Tabel 2.1 berikut ini:
Tabel 2.1Nilai Protein Berbagai Bahan Makanan (gram/100 gram)
Sumber Protein Hewani
2.1.6Denaturasi Protein
Denaturasi protein terjadi akibat perubahan pada struktur sekunder, tersier, dan kuaterner protein tanpa perubahan pada struktur primer. Denaturasi mengubah sifat-sifat dari protein seperti hilangnya aktivitas enzim. Kebanyakan protein makanan dikonsumsi dalam keadaan terdenaturasi. Denaturasi protein dapat diinginkan maupun tidak tergantung pada keadaannya. Denaturasi meningkatkan daya cerna dari suatu protein, terkadang pula membuat makanan menjadi lebih lezat. Denaturasi dapat terjadi secara parsial atau sempurna, dapat pula bersifat reversibel maupun irreversibel(Ustunol, 2015).
Menurut Brown dan Rogers (1981), penyebab denaturasi protein adalah sebagai berikut:
1. Pemanasan. Kebanyakan protein globular mengalami denaturasi ketika dipanaskan pada suhu diatas 50-60°C. Contohnya, pendidihan atau penggorengan telur menyebabkan protein pada putih telur mengalami denaturasi dan membentuk massa yang tidak larut.
2. Perubahan pH yang drastis. Penambahan asam atau basa pekat pada larutan protein menyebabkan perubahan sifat rantai samping yang dapat terionisasi dan menganggu interaksi ion atau garam.
3. Deterjen. Penambahan natrium dodesilsulfat pada larutan protein dapat menyebabkan konformasi protein terbuka dan memaparkan rantai samping nonpolar protein. Rantai samping ini kemudian distabilkan oleh interaksi hidrofobik dengan rantai panjang hidrofobik dari deterjen.
5. Perlakuan mekanis. Kebanyakan protein globular dalam larutan mengalami denaturasi ketika diaduk atau dikocok dengan kuat. Contohnya, pengocokan putih telur untuk membuat krim.
6. Urea dan guanidin hidroklorida. Pereaksi ini menyebabkan gangguan pada ikatan hidrogen dan interaksi hidrofobik protein.
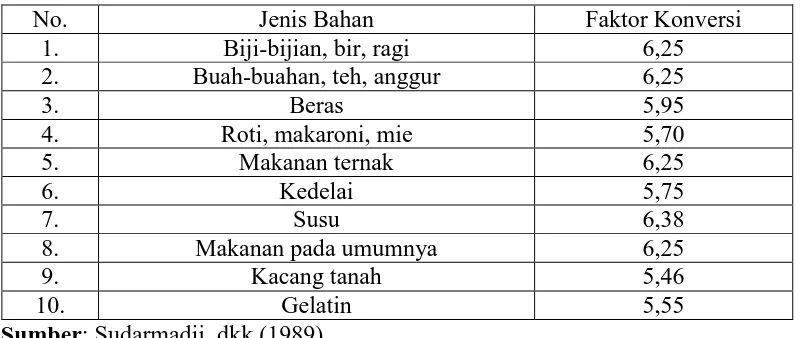
2.1.7 Faktor Konversi
Umumnya campuran protein murni terdiri dari 16% nitrogen. Apabila jumlah N dalam bahan telah diketahui, maka jumlah protein dihitung dengan mengalikan jumlah N dengan faktor konversi 6,25 (100/16). Besarnya faktor konversi tergantung pada persentase nitrogen yang menyusun protein dalam bahan pangan. Pada protein tertentu yang telah diketahui komposisinya dengan tepat, maka faktor konversi yang lebih tepatlah yang dipakai (Sudarmadji, dkk., 1989).
Tabel 2.2 Faktor konversi
No. Jenis Bahan Faktor Konversi
1. Biji-bijian, bir, ragi 6,25
2. Buah-buahan, teh, anggur 6,25
3. Beras 5,95
4. Roti, makaroni, mie 5,70
5. Makanan ternak 6,25
6. Kedelai 5,75
7. Susu 6,38
8. Makanan pada umumnya 6,25
9. Kacang tanah 5,46
10. Gelatin 5,55
Sumber: Sudarmadji, dkk (1989).
2.2 Analisis Protein
Analisis protein dapatdilakukandenganduacarayaitu (i)
secaratidaklangsungdenganmenghitungjumlah nitrogen yang terkandung di dalambahan (Rhee, 2005).
2.2.1Metode Kjeldahl
Metode kjeldahl dilakukan untuk menganalisis kadar protein kasar dalam bahan makanan secara tidak langsung, karena yang dianalisis dengan cara ini adalah kadar nitrogennya (Winarno, 1986).
Prinsip metode Kjeldahl ini adalah senyawa-senyawa yang mengandung nitrogen tersebut mengalami oksidasi dan dikonversi menjadi ammonia dan bereaksi dengan asam pekat membentuk garam amonium. Kemudian ditambahkan basa untuk menetralisasi suasana reaksi dan kemudian didestilasi dengan asam dan dititrasi untuk mengatahui jumlah N yang dikonversi (Estiasih, dkk., 2012).
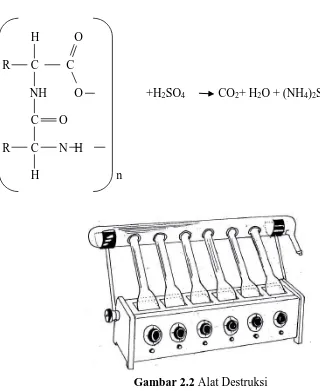
Tahapan kerja pada metode Kjeldahl dibagi tiga, yaitu: a. Tahap Destruksi
Pada tahap ini, sampel dipanaskan dalam asam sulfat pekat sehingga terjadi destruksi menjadi unsur-unsurnya. Elemen karbon (C) dan hidrogen (H) teroksidasi menjadi karbon monoksida (CO), karbondioksida (CO2), dan air
(H2O). Elemen Nitrogen akan berubah menjadi amonium sulfat. Banyaknya asam
H O
R C C
NH O +H2SO4 CO2+ H2O + (NH4)2SO4
C O R C N H
H n
Gambar 2.2 Alat Destruksi
(Sudarmadji, dkk., 1989).
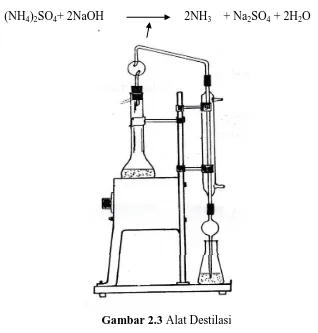
b. Tahap Destilasi
Pada tahap destilasi, amonium sulfat dapat dipecah menjadi amonia, yaitu dengan penambahan larutan NaOH sampai alkalis dan dipanaskan. Amonia yg dibebaskan ditangkap oleh larutan asam. Asam yg dapat dipakai adalah H2SO4.
Reaksi yang terjadi pada tahap destilasi yaitu :
(NH4)2SO4+ 2NaOH 2NH3 + Na2SO4 + 2H2O
Gambar 2.3 Alat Destilasi
c. Tahap Titrasi
Apabila penampung destilat yang digunakan adalah larutan asam sulfat, maka sisa asam sulfat yang tidak bereaksi dengan amonia dititrasi dengan NaOH 0,025 N menggunakan indikator mengsel (indikator campuran metil red dan metil blue). Selisih jumlah titrasi sampel dan blanko merupakan jumlah nitrogen. Reaksi yang terjadi pada tahap titrasi ini yaitu:
NH3 + H2SO4 (NH4)2SO4
Kelebihan H2SO4 + 2 NaOH Na2SO4 + 2H2O
Keuntungan menggunakan metode Kjeldahl ini adalah dapat diaplikasikan untuk semua jenis bahan pangan, tidak memerlukan biaya yang mahal untuk pengerjaannya, dapat dimodifikasi sesuai kuantitas protein yang dianalisis. Adapun kerugiannya adalah yang ditentukan adalah jumlah total nitrogen yang terdapat didalamnya bukan hanya nitrogen dari protein, waktu yang diperlukan relatif lebih lama (minimal 4 jam untuk menyelesaikannya), presisi yang lemah, pereaksi yang digunakan ada yang bersifat beracun, korosif dan berbahaya bagi kesehatan, dan adanya variasi faktor konversi untuk masing-masing sampel (Chang, 2003).
2.2.2Metode Spektrofotometri
Penentuankadar protein denganmenggunakaninstrumentdibagimenjadiduayaitu: i)
metodepengukuranlangsungpadapanjanggelombang 205 nm dan 280 nm dan ii) metodepembentukanwarnadenganpereaksitertentu (Simonian, 2005).
1. Metodepengukuranlangsungpadapanjanggelombang 205 nm dan 280 nm
Absorbansipadapanjanggelombang 205 nm dan 280 nm
digunakanuntukmenghitungkonsentrasi protein denganterlebihdahuludistandarisasidengan protein standar.Metodeinidapatdenganmudahdiaplikasikandansederhana,
cocokuntuklarutan protein yang telahdimurnikan.Penetapannyaberdasarkanabsorbansisinar ultraviolet olehasam
2. Metodepembentukanwarnadenganpereaksitertentu a. Pereaksi Biuret
Prinsippenetapan protein metode Biuret adalahpadakondisibasa, Cu2+dariCuSO4 dalamsuasanabasaakanmembentukkompleksdenganikatanpeptida,
kompleks ini akan menghasilkanwarnaungu, merah violet, ataubiru violet, sehinggakadar protein sampeldapatditetapkandenganspektrofotometer (Estiasih, dkk., 2012).
Keuntungandarimetodeiniadalahprosedur yang sederhana, tidakmemerlukanbiaya yang mahal, waktu yang digunakanrelativesingkat,
deviasiwarnasangatsedikitbiladibandingkandengan Lowry, Bradford danmetodeturbidimetrisehinggaabsorpsiwarnanyarelativestabil,
sangatsedikitsenyawayangberinteraksidenganpereaksi Biuret, dantidakmendeteksi nitrogen darisumber non-protein.Kerugiannyaadalahkurangsensitif dibandingkandengan Lowry, konsentrasigaram ammonium yang sangattinggi,
adanyavariasiwarnauntukbeberapa protein tertentu,
bilabahanmengandunglemakdankarbohidrat yang sangattinggidapatmenyebabkanlarutanmenjadiburamsehinggatidakdapatditembusc
ahaya UV (Chang, 2003). b. Pereaksi Lowry
Prinsip penetapan protein metode Lowrytidakjauhberbedadengan Biuret, dimana ion tembagaakanmembentukkompleksdenganikatanpeptida
kemudiandenganadanyapereaksifosfotungstik-fosfomolibdatakanmengoksidasirantaisampingasam amino
dapatdiukurdenganspektrofotometer. Warnakebiruan yang terbentukdibacapadapanjanggelombang 750 nm (sensitivitastinggiuntukkonsentrasi protein tinggi) atau 500 nm
(mempunyaisensitivitasrendahuntukkonsentrasi protein tinggi) (Chang, 2003). Keuntungan analisis dengan pereaksi ini adalah 50-100 kali lebih sensitif daripada metode biuret, 10-20 kali lebih sensitif daripada metode absorpsi UV pada 280 nm, kurang terganggu oleh turbiditas sampel, lebih spesifik daripada metode lainnya, sederhana, dapat diselesaikan dalam 1–1,5 jam. Kerugian analisis dengan pereaksi Lowry adalah variasi warnanya yang lebih banyak dibanding dengan pereaksi Biuret, warna yang terbentuk tidak secara tepat menggambarkan konsentrasi protein, reaksinya sangat dipengaruhi oleh senyawa-senyawa pengganggu seperti glukosa danlemak (Chang, 2003).
c. Pereaksi Bradford
Padatahun 1976, Marion Bradford
memperkenalkanpenggunaanpereaksiCoomassive Blue untukpenetapansecarakuantitatifkonsentrasi total protein.Coomasive Blue
iniakanberikatandengan protein, warnaakanberubahdarikemerahanmenjadikebiruan,
danabsorpsimaksimumdariwarnaakanberubahdari 465 nm menjadi 595 nm (Krohn, 2005; Chang, 2003).
Keuntungananalisisdenganpereaksi Bradford adalahcepat (reaksihanyaberlangsungselama 2 menit), reprodusibel, sensitif, tidakmengalamigangguanoleh ammonium sulfat, polifenol,
Mg2+.Kerugiannyaadalahanalisisinitergangguolehadanyadeterjennonionik
danionik, komplekswarna-protein dapatbereaksidengankuvetkuarsa (menggunakankuvetkacaatauplastik), warnaberbedatergantungpadajenis protein sehingga protein standarharusdipilihdenganhati-hati (Chang, 2003).
2.2.3 Metode Titrasi Formol
Prinsip metode ini adalah dengan adanya air dan penambahan Kalium oksalat, protein akan dihidrolisis menjadi asam-asam amino. Selanjutnya dengan penambahan formaldehid akan memblokade gugus basa asam amino membentuk gugus dimethilol sehingga tidak mengganggu reaksi antara NaOH dengan gugus asam dari asam amino dan konsentrasi protein dapat ditentukan. Titrasi formol ini kurang tepat untuk menentukan kadar protein dan lebih tepat digunakan untuk menunjukkan proses hidrolisis protein (Estiasih, dkk., 2012).
2.2.4 Metode Dumas
Pada metode ini sampel dioksidasi pada suhu sangat tinggi (700-900°C). Hasil oksidasi menghasilkan gas O2, N2 dan CO2. Gas nitrogen yang dilepaskan
dikuantitasi menggunakan kromatografi gas dengan detektor konduktivitas termal (Thermal Detector Conductivity/TDC) kemudian jumlah nitrogen yang diperoleh dikonversi. Jumlah nitrogen sebanding dengan kadar proteinnya (Chang, 2003).
diukur adalah total nitrogen sehingga nitrogen non-protein juga terukur sebagai protein, memiliki variasi faktor konversi, membutuhkan sampel dalam jumlah besar untuk analisis (Chang, 2003).
2.3 Lemak
Secara umum lemak diartikan sebagai trigliserida yang dalam kondisi suhu ruang berada dalam keadaan padat. Sedangkan minyak adalah trigliserida yang dalam suhu kamar berbentuk cair. Secara pasti tidak ada batasan yang jelas untuk membedakan lemak dan minyak ini (Sudarmadji, dkk., 1989).
Pada struktur kimianya terdiri dari ikatan antara asam-asam lemak dan gliserol. Asam lemak adalah asam organik yang terdapat sebagai trigliserida atau lemak, baik yang berasal dari hewan atau tumbuhan. Asam ini adalah asam karboksilat yang mempunyai rantai karbon panjang baik karbon jenuh atau tidak jenuh terdiri atas 4 sampai 24 buah atom karbon. Rantai atom yang jenuh adalah rantai karbon yang tidak mengandung ikatan rangkap, sedangkan yang mengandung ikatan rangkap disebut rantai karbon tidak jenuh (Poedjadi, 1994).
Dalam proses hidrolisis, lemak akan terurai menjadi asam lemak dan gliserol. Proses ini dapat berjalan dengan menggunakan asam, basa atau enzim tertentu. Proses hidrolisis yang menggunakan basa akan menghasilkan gliserol dalam garam asam lemak atau sabun (Poedjadi, 1994).
O
H2C – O – C – R1 CH2 - OH
O O
HC – O – C – R2 + 3H2O 3R – C + CH - OH
H2C – O – C – R3 CH2 - OH
Trigliserida Asam Lemak Gliserol
2.3.1 Sifat-sifat Lemak
Lemak adalah senyawa organik yang terdiri dari atom karbon (C), hidrogen (H) dan oksigen (O). Lemak bersifat tidak larut dalam air tetapi larut dalam dalam pelarut lemak, seperti benzene, eter, petroleum dan sebagainya. Lemak yang mempunyai titik lebur tinggi berbentuk padat pada suhu kamar disebut lemak, sedangkan yang mempunyai titik lebur rendah berbentuk cair disebut minyak. Lemak hewan pada umumnya berupa zat padat pada suhu ruangan, sedangkan lemak yang berasal dari tumbuhan berupa zat cair. Lemak yang mempunyai titik lebur tinggi mengandung asam lemak jenuh, sedangkan lemak cair atau yang biasa mengandung asam lemak tidak jenuh (Poedjadi, 1994). 2.3.2 Penggolongan Lemak
Menurut Poedjadi (1994), senyawa yang termasuk lemak dapat dibagi dalam beberapa golongan, yaitu:
a. Lemaksederhana, yaitu ester asam lemakdenganrantaipendek, contohnyalemakataugliserida.
b. Lemak gabungan, yaitu ester asam lemak dengan rantai panjang, contohnya fosfolipid.
c. Derivat lemak, yaitu senyawa yang dihasilkan oleh proses hidrolisis, contohnya gliserol dan sterol.
2.3.3 Fungsi Lemak
tidak berubah kedudukannya, dan melindungi tubuh agar tidak mudah rusak akibat luka. Disamping itu lemak membantu transport atau absorbsi vitamin-vitamin yang larut dalam lemak. Didalam lambung, lemak menekan sekresi lambung, dengan demikian memperlambat rasa lapar seseorang (Poedjadi, 1994). 2.3.4 Sumber Lemak
Menurut Winarno (2002),berdasarkan sumbernya protein terdiri dari protein hewani dan protein nabati.
Tabel 3.Klasifikasi Lemak Berdasarkan Sumbernya
Sumber Keterangan
Berasal dari tanaman (lemaknabati)
- biji-biji palawija.
Contoh: minyak jagung,biji kapas - kulit buah tanaman tahunan.
Contoh: minyak zaitun,minyak kelapa sawit -biji-bijitanamantahunan.
Contoh:kelapa,coklat,intisawit Berasal dari
hewan(lemak hewani)
- susu hewan peliharaan contoh: lemak susu - daginghewanpeliharaan contoh: lemaksapi,oleosterin
- hasil laut
contoh: minyak ikan sardin,minyak ikan paus. Sumber: Winarno (2002).
2.4 Analisis Lemak
Menurut Rohman (2007), karakteristik fisikokimia dari lemak yang digunakan untuk membedakan lemak darikomponen lain dalam makanan adalah kelarutannya dalam pelarut organik, ketidakcampuran dengan air dan karakteristik fisik. Metode analisis berdasarkan ketiga karakteristik di atas diklasifikasikan menjadi:
(ii) ekstraksi non-solven (iii) metode instrumental. 2.4.1 Metode Sokletasi
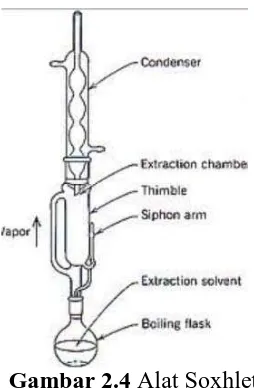
Sokletasimerupakan proses ekstraksi yang menggunakanpenyarianberulangdanpemanasan.
Penggunaanmetodesokletasiadalahdengancaramemanaskanpelaruthinggamembent
ukuapdanmembasahisampel.Pelarut yang sudahmembasahisampelkemudianakanturunmenujulabupemanasandankembalime
njadiuapuntukmembasahisampel,
sehinggapenggunaanpelarutdapatdihematkarenaterjadisirkulasipelarut
yangselalumembasahisampel. Proses inisangatbaikuntuksenyawa yang tidakterpengaruholehpanas (Darwin, 2000). Gambar alat soxhlet dapat dilihat pada Gambar 2.4.
Gambar 2.4 Alat Soxhlet
2.4.2 Metode Goldfish
ekstraksi, tapi dengan kerugian bisa terjadi“saluran solven” dimana solven akan melewati jalur tertentu dalam sampel sehingga ekstraksimenjadi tidak efisien. Masalah ini tidak terjadi pada metode Soxhlet, karena sampel terendam dalam solven (Rohman, 2007).
2.4.3 Metode Babcock
Sejumlah sampel dipipet secara akurat ke dalam botol Babcock. Asam sulfat dicampurdengan susu, yang akan mendigesti protein, menghasilkan panas dan merusak lapisan yangmengelilingi droplet lemak, sehingga melepaskan lemak. Sampel kemudian disentrifuse saatmasih panas (55-60°C) yang akan menyebabkan lemak cair naik ke leher botol. Leher botoltelah diberi skala yang menunjukkan persen lemak. Metode ini membutuhkan waktu 45menit, dengan presisi hingga 0,1%. Metode ini tidak menentukan kadar fosfolipid dalam sampel, karena berada di fase air atau di antara fase lemak dan air (Rohman, 2007).
2.4.4 Metode Gerber
Metode ini mirip dengan metode Babcock, tapi menggunakan asam sulfat dan isoamilalkohol, dengan bentuk botol yang sedikit berbeda. Metode ini lebih cepat dan sederhanadibanding metode Babcock. Isoamil alkohol digunakan untuk mencegah pengarangan gulakarena panas dan asam sulfat, yang pada metode Babcock menyebabkan sulitnya pembacaanskala. Sama seperti metode Babcock, metode ini tidak menentukan posfolipid (Rohman, 2007).
2.4.5 Metode Instrumentasi
pengukuran kemampuan absorpsi radiasi gelombangelektromagnetik, dan (iii) pengukuran kemampuan memantulkan radiasi gelombangelektromagnetik. Masing-masing metode mempunyai keuntungan dan kerugian, sertakelompok sampel makanan yang memungkinkan untuk diuji (Rohman,2007).
2.5 Ikan Lele
Ikan lele adalah salah satu jenis ikan air tawar yang termasuk ke dalam ordo Siluriformes dan digolongkan ke dalam ikan bertulang sejati. Lele dicirikan dengan tubuhnya yang licin dan pipih memanjang, serta adanya sungut yang menyembul dari daerah sekitar mulutnya. Nama ilmiah Lele adalah Clarias spp. yang berasal dari bahasa Yunani "chlaros", berarti "kuat dan lincah". Dalam bahasa Inggris lele disebut dengan beberapa nama, seperti catfish, mudfish dan walking catfish. Ikan lele mempunyai ciri-ciri khas dengan tubuhnya yang licin,
agak pipihmemanjang serta memiliki sejenis kumis yang panjang, mencuat dari sekitar bagian mulutnya. Ikan lele dilengkapi dengan alat pernapasan tambahan pada lembar insang kedua dan keempat berupa modifikasi insang berbentuk bunga yang disebut arborescent organ yang memungkinkan lele untuk mengambil oksigen langsung dari udara. Karena itulah, lele dapat hidup pada lingkungan perairan dengan kadar oksigen rendah dan kadar CO2 tinggi (Suyanto, 1992).
memiliki kepala dengan bagian seperti tulang mengeras di bagian atasnya. Mata ikan lele berukuran kecil dengan mulut di ujung moncong berukuran cukup lebar. Dari daerah sekitar mulut menyembul empat pasang barbel (sungut peraba) yang berfungsi sebagai sensor untuk mengenali lingkungan dan mangsa. Lele memiliki alat pernapasan tambahan yang dinamakan Arborescent. Arborescent ini merupakan organ pernapasan yang berasal dari busur insang yang telah termodifikasi. Pada kedua sirip dada lele terdapat sepasang duri (patil), berupa tulang berbentuk duri yang tajam. Pada beberapa spesies ikan lele, duri-duri patil ini mengandung racun ringan. Hampir semua species lele hidup di perairan tawar (Witjaksono, 2009).
2.5.1 Ikan LeleLokal
Menurut Linnaeus (1758), klasifikasi ikan lele lokal adalah sebagai berikut:
Kingdom : Animalia Filum : Chordata Kelas : Actinopterygii Ordo : Siluriformes Famili : Clariidae Genus : Clarias
Spesies : Clarias batrachus
bagian sirip ekor. Tidak memiliki sirip lemak. Sirip anal memanjang. Sirip pectoral memiliki patil yang tajam. Warna tubuh bagian dorsal hitam pekat. Bagian lateral memiliki bintik-bintik putih kecil yang banyak. Warna bagian ventral kehitam-hitaman dan keabu-abuan (Departemen Biologi Fakultas MIPA Universitas Sumatera Utara, 2015).
2.5.2 Ikan LeleDumbo
Menurut Linnaeus (1758), klasifikasi ikan lele dumbo adalah sebagai berikut:
Kingdom : Animalia Filum : Chordata Kelas : Actinopterygii Ordo : Siluriformes Famili : Clariidae Genus : Clarias
Spesies : Clarias gariepinus
2.5.3 Ikan LeleSangkuriang
Menurut Burchell (1822), klasifikasi ikan lele sangkuriang adalah sebagai berikut:
Kingdom : Animalia Filum : Chordata Kelas : Actinopterygii Ordo : Siluriformes Famili : Clariidae Genus : Clarias
Spesies : Clarias gariepinus var. Sangkuriang
Ciri-ciri khusus ikan lele sangkuriang adalah panjang kepala sekitar 5,5 cm. Panjang ekor 3,6 cm, tinggi badan 4,2 cm, lebar kepala 4,1 cm. Barbels spesies ini terdiri dari 8 helai, yang terdiri dari 4 pada rahang atas dan 4 rahang bawah. Dua pasang pada rahang atas sekitar 6,8 cm hingga menyentuh patil dan 2,6 cm dekat pada nares. Dua pasang barbels terdapat pada rahang bawah berukuran sekitar 5,5 cm dan 3 cm. Memiliki sirip dorsal memanjang dari ujung kepala belakang hingga mengenai bagian sirip ekor. Tidak memiliki sirip lemak. Sirip anal memanjang. Sirip pectoral memiliki patil yang tidak tajam. Bagian dorsal hingga lateral berwarna hitam kemerah-merahan, bagian ventral putih dari ventral kepala hingga ujung sirip anal (Departemen Biologi Fakultas MIPA Universitas Sumatera Utara, 2015).
2.5.4 Komposisi Gizi Ikan Lele
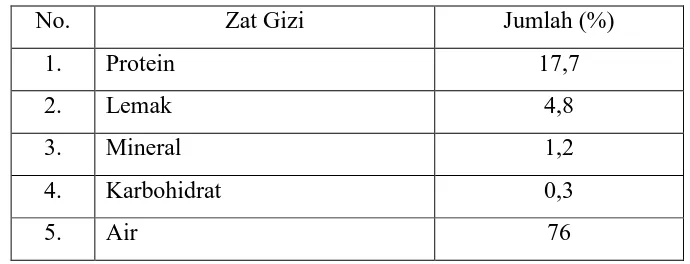
selain mengandung gizi yang penting seperti protein juga mengandung asam amino esensial seperti yang dapat dilihat pada Tabel 2.5 berikut :
Tabel 2.5 Komposisi Gizi pada Ikan Lele
No. Zat Gizi Jumlah (%)
1. Protein 17,7
2. Lemak 4,8
3. Mineral 1,2
4. Karbohidrat 0,3
5. Air 76