DIAGRAM TERNER SISTEM ZAT CAIR TIGA KOMPONEN CAMPURAN
AIR – KLOROFORM – ASAM ASETAT GLASIAL DAN AIR– CCl4 – ETANOL
Made Indra Dwitama (1108105026)
Jurusan Kimia Fakultas Matematika dan Ilmu Pengtahuan Alam Universitas Udayana, Bukit Jimbaran
ABSTRAK
Diagram Terner merupakan suatu diagram fasa berbentuk segitiga sama sisi dalam satu bidang datar yang dapat menggambarkan sistem tiga komponen zat dalam berbagai fasa. Dalam percobaan ini telah dilakukan eksperimen tentang diagram terner sistem zat cair tiga komponen dari campuran air – kloroform – asam asetat glasial dan campuran air – CCl4 – etanol dengan berbagai variasi volume dalam
suatu fasa cair yang dapat saling melarut. Tujuan dari percobaan ini adalah untuk membuat kurva kelarutan suatu cairan yang terdapat dalam suatu campuran cairan tertentu. Prinsip kerja dari eksperimen ini adalah pemisahan suatu campuran yang terdiri dari dua komponen cair yang saling melarut sempurna. Eksperimen ini meliputi penentuan presentase fraksi mol suatu cairan dengan metode titrasi. Metode titrasi ini dapat digunakan untuk memisahkan campuran yang terdiri dari dua cairan yang saling melarut sempurna dititrasi dengan zat yang tidak larut dengan campuran tersebut. Hasil percobaan menunjukkan bahwa terdapat kecenderungan makin banyak volume titran yang diperlukan seiring meningkatnya perbandingan suatu komponen zat. Campuran akan mengalami kekeruhan jika salah satu cairan terpisah dan menyebabkan terbentuknya dua lapisan. Asam asetat glasial dan air, asam asetat glasial dan kloroform, air dan etanol, serta CCl4 dan etanol dapat tercampur seluruhnya, tetapi air dengan kloroform
dan air dengan CCl4 hanya tercampur sebagian saja. Hal tersebut dikarenakan air bersifat polar, asam
asetat glasial dan etanol bersifat semipolar serta kloroform dan CCl4 bersifat nonpolar.
Kata kunci: Diagram terner, fraksi mol, kepolaran, campuran tiga komponen, titrasi
PENDAHULUAN
Sistem adalah suatu zat yang dapat diisolasikan dari zat-zat lain dalam suatu wadah inert, yang menjadi pusat perhatian dalam mengamati pengaruh perubahan temperature,tekanan serta konsentrasi zat tersebut. Sedangkan komponen adalah apa yang ada dalam sistem, seperti zat terlarut dan pelarut dalam senyawa biner. Banyaknya komponen dalam suatu sistem C adalah jumlah minimum spesies bebas yang diperlukan untuk menentukan komposisi semua fase yang ada dalam sistem. Definisi ini mudah diberlakukan jika spesies yang ada dalam sistem tidak bereaksi sehingga kita dapat menghitung jumlahnya.
Campuran adalah zat yang terbentuk dari beberapa jenis zat dan memiliki sifat-sifat zat pembentuknya tetap. Campuran suatu larutan menjadi satu fasa bila kelarutan cairan pertama dalam cairan
cairan terlampaui dan karenanya akan terjadi bentuk dua fasa yang masing– masingnya merupakan larutan jenuh.
Kumpulan partikel yang secara terus-menerus mengalami deformasi (arus) di bawah tegangan geser disebut dengan zat cair. Dalam perubahan bentuk dari molekul cairan bervariasi, dengan kekuatan diterapkan kepada mereka, yaitu mengalir.[1] Fasa merupakan keadaan materi yang seragam di seluruh bagiannya, tidak hanya dalam komposisi kimianya tetapi juga dalam keadaan fisiknya. Derajat kebebasan sistem adalah bilangan terkecil dari variabel intensif yang harus dispesifikasikan untuk menetapkan nilai dari semua variabel intensif yang tersisa.
Kepolaran dalam ikatan kimia adalah suatu keadaan dimana distribusi penyebaran elektron tidak merata atau
DIAGRAM TERNER SISTEM ZAT CAIR TIGA KOMPONEN CAMPURAN AIR – KLOROFORM – ASAM ASETAT GLASIAL DAN AIR– CCl4 – ETANOL satu atom. Komponen terdapat di dalam sistem, seperti zat terlarut dan pelarut dalam senyawa biner. Jumlah komponen adalah bilangan terkecil yang menunjukkan spesi kimia independen yang harus dispesifikasi agar komponen dalam setiap fasa bisa terdeskripsikan.[2]
Partikel-partikel zat terlarut baik berupa molekul maupun berupa ion selalu berada dalam keadaan terdehidrasi (terikat oleh moleku-molekul pelarut air). Makin banyak partikel zat terlarut makin banyak pula molekul air yang diperlukan untuk menghindari partikel zat terlarut itu. Setiap pelarut memiliki batas maksimum dalam melarutkan zat. Untuk larutan yang terdiri dari dari dua jenis larutan elektrolit maka dapat membentuk endapan (dalam keadaan jenuh).
Satu fasa membutuhkan dua derajat kebebasan untuk menggambarkan sistem secara sempurna, dan untuk dua fasa dalam kesetimbangan, satu derajat kebebasan. Jadi, dapat digambarkan diagram fasa dalam satu bidang. Cara terbaik untuk menggambarkan sistem tiga komponen adalah dengan mendapatkan suatu kertas grafik segitiga.[3]
Suatu sistem tiga komponen mempunyai dua pengubah komposisi yang
bebas, katakanlah X2 dan X3. Jadi komposisi
suatu sistem tiga komponen dapat dialurkan dalam koordinat cartesius dengan X2 pada
salah satu sumbunya, dan X3 pada sumbu
yang lain dengan dibatasi garis X2+X3=1.
Karena X tidak simetris terhadap ketiga komponen, komposisi dialurkan pada suatu segitiga sama sisi dengan setiap sudutnya menggambarkan suatu komponen murni.Bagi suatu segitiga sama sisi, jumlah jarak dari seberang titik didalam segitiga ketiga sisinya sama dengan tinggi segitiga tersebut. Jarak antara setiap sudut ke tengah – tengah sisi dibagi yang berhadapan dibagi 100 bagian sesuai dengan komposisi dalam persen. Untuk memperoleh titik tertentu dilakukan dengan mengukur jarak terdekat ketiga sisi segitiga.[4]
Konsentrasi dapat dinyatakan dalam istilah % berat atau fraksi mol. sistem tiga komponen pada temperatur dan tekanan tetap mempunyai jumlah derajat kebebasan paling banyak. Jumlah fasa dalam sistem zat cair tiga komponen bergantung pada daya saling larut antar zat cair tersebut dan temperatur. Dalam eksperimen ini, metode titrasi digunakan untuk memisahkan campuran yang terdiri dari dua cairan yang saling melarut sempurna.
EKSPERIMENTAL Bahan
Bahan-bahan yang digunakan dalam eksperimen ini adalah air (aquades), asam asetat glasial, kloroform, Karbon tetraklorida (CCl4), dan etanol.
Peralatan
Peralatan yang digunakan dalam eksperimen ini adalah labu bertutup 100 ml, labu Erlenmeyer 250 ml, buret 50 ml, neraca Westphal, thermometer (10-100oC).
Prosedur Pengerjaan
Ke dalam labu Erlenmeyer yang bersih, kering dan bertutup, dibuat 5 macam campuran cairan A dan C yang saling larut. Dengan komposisi sebagai berikut :
Labu ke -... Aquades Asam asetat glasial 1 1 ml 9 ml 2 3 ml 7 ml 3 5 ml 5 ml 4 7 ml 3 ml 5 9 ml 1 ml Tahap 1.
Semua pengukuran dilakukan dengan buret. Untuk setiap labu, ditimbang dengan kondisi kosong terlebih dahulu. Kemudian ditambahkan cairan A (Air) dan ditimbang lagi, kemudian ditambahkan dengan cairan C (asam asetat glasial) dan ditimbang lagi. Dengan demikian, massa cairan A dan C diketahui untuk setiap labu. Tahap 2.
Setiap campuran dalam labu 1 sampai dengan 5 dititrasi dengan zat B (Kloroform) sampai tepat timbul kekeruhan dan volume jumlah zat B yang digunakan dicatat. Titrasi dilakukan dengan perlahan-lahan. Setiap labu ditimbang sekali lagi untuk menentukan massa cairan B dalam setiap labu.
Tahap 3.
Tahap 1 dan 2 diulangi dengan menggunakan cairan B (CCl4) dan C
(etanol) dengan penambahan cairan A (air) sebagai titran.
Tempat Pengerjaan
Keseluruhan eksperimen yang dilakukan ini dilakukan dalam Laboratorium Kimia Fisik Jurusan Kimia Fakultas MIPA Universitas Udayana.
DIAGRAM TERNER SISTEM ZAT CAIR TIGA KOMPONEN CAMPURAN AIR – KLOROFORM – ASAM ASETAT GLASIAL DAN AIR– CCl4 – ETANOL
HASIL DAN PEMBAHASAN
Diagram Terner merupakan suatu diagram fasa berbentuk segitiga sama sisi dalam satu bidang datar yang dapat menggambarkan sistem tiga komponen zat dalam berbagai fasa. Pada eksperimen ini dilakukan percobaan mengenai diagram terner sistem zat cair tiga komponen dengan metode titrasi.
Tujuan dari percobaan ini adalah untuk menggambarkan kurva kelarutan suatu cairan yang terdapat dalam campuran dua cairan tertentu. Prinsip fundamental eksperimen ini adalah pemisahan suatu campuran yang terdiri dari dua komponen cair yang saling larut dengan sempurna. Pemisahan dapat dilakukan dengan menggunakan pelarut yang tidak larut dengan sempurna terhadap campuran, tetapi dapat melarutkan salah satu komponen (solute) dalam campuran tersebut. Teknik pemisahan ini juga berkaitan dengan kepolaran dari komponen-komponen zat itu, seperti halnya prinsip like-dissolve-like. Suhu awal dan suhu ruangan laboratorium kimia fisika universitas udayana sebesar 30oC.
Analisis Data Pengamatan
Dalam eksperimen ini dilakukan dalam dua percobaan. Percobaan pertama cairan yang digunakan adalah air (aquadest) – kloroform – asam asetat glasial. Pada percobaan ini air dan asam asetat dititrasi dengan zat yang tidak larut dengan campuran tersebut yaitu kloroform. Adapun hasil pengamatan dari percobaan 1 dapat dilihat pada tabel 1. Melalui tabel 1 terlihat bahwa dilakukan variasi perbandingan volume antara air dengan asam asetat glasial. Ditemukan suatu kecendrungan bahwa semakin banyak volume air yang dimasukkan ke dalam Erlenmeyer maka semakin sedikit volume titran (kloroform) yang diperlukan untuk mentitrasi campuran air dengan asam asetat glasial hingga
menjadi keruh. Sedangkan semakin banyak volume asam asetat glasial yang dimasukkan ke dalam Erlenmeyer maka semakin banyak volume titran (kloroform) yang diperlukan untuk mentitrasi campuran air dengan asam asetat glasial menjadi keruh.
Kesetimbangan selain dipengaruhi oleh suhu dan tekanan juga dipengaruhi komposisi sistem. Dalam hal ini, air dan asam asetat glaisal memiliki daya saling larut yang tinggi. Hal ini disebabkan karena sifat kepolaran antara masing-masing komponen zat tersebut. Yaitu air bersifat polar dan asam asetat glasial bersifat semi polar. Sesuai prinsip like disolve like komponen dengan sifat kepolaran serupa akan melarutkan sesamanya. Penambahan kloroform yang memiliki sifat kepolaran non-polar, mengakibatkan perubahan komposisi sistem tersebut.
Hasil tersebut diperoleh karena antara air (H2O) dengan asam asetat glasial
CH3COOH dapat saling berikatan. Molekul
air pada bagian –OH membentuk ikatan hidrogen yang kuat dengan molekul asam asetat dari gugus –COOH. Ketika titrasi dengan kloroform dilakukan, terjadi pemisahan diantara campuran air dengan asam asetat, hal ini dikarenakan asam asetat dengan klorofrom (CHCl3) dapat saling
berikatan. CHCl3 dapat berikatan di sekitar
gugus metil dari CH3COOH yang bersifat
non-polar pada gugus CH3-nya. Tetapi,
asam asetat yang berikatan dengan kloroform hanya sedikit. Hal ini disebabkan karena ikatan hidrogen antara air dengan asam asetat sangat kuat dan sulit untuk dilepaskan. Dimana akan menyebabkan sebagian besar kloroform berikatan sendiri dan akan terpisah dari campuran air dengan asam asetat serta membentuk 2 larutan terner terkonjugasi yang ditandai dengan terbentuknya larutan yang keruh.
Tabel 1. Hasil pengamatan percobaan 1 Perbandingan volume zat A : C Massa Erlenmeyer kosong (g) Massa Erlenmeyer + Zat A (air) (g) Massa Erlenmeyer + Zat A (air) + Zat C (asam asetat glasial)
(g) Vol.Titran zat B (kloroform) (ml) Massa Erlenmyer setelah titrasi (g) 1 : 9 86,96 88,34 97,53 16,80 120,93 3 : 7 108,04 111,27 118,77 4,60 125,03 5 : 5 101,38 106.44 111,36 0,90 112,64 7 : 3 128,73 135,77 138,37 0,30 138,68 9 : 1 126,46 135,79 136,55 0,15 136,67
Pada percobaan kedua cairan yang digunakan adalah air – CCl4 –etanol. Adapun hasil
pengamatan dari percobaan 2 dapat dilihat pada tabel 2. Tabel 2. Hasil pengamatan percobaan 2
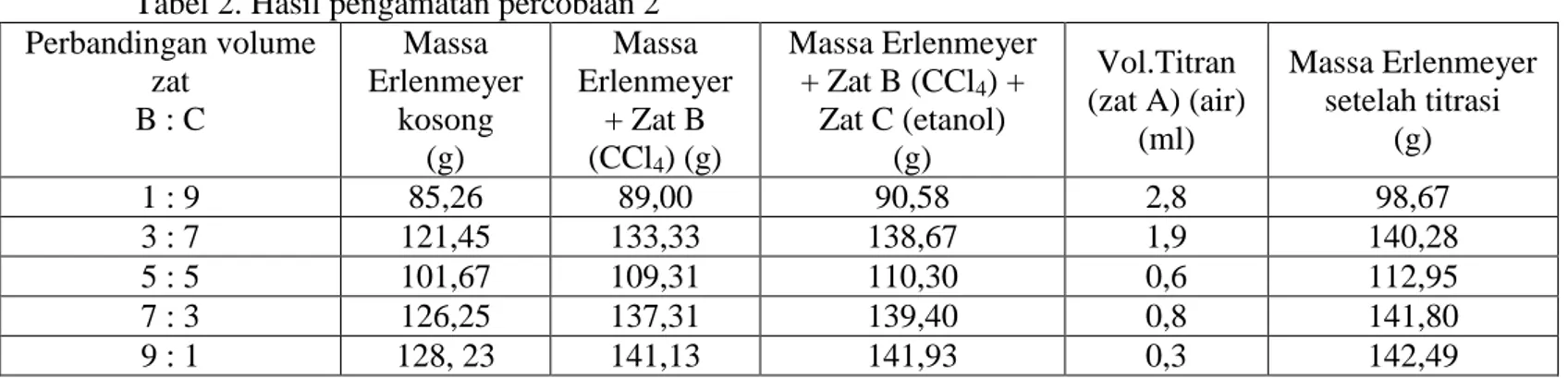
Perbandingan volume zat B : C Massa Erlenmeyer kosong (g) Massa Erlenmeyer + Zat B (CCl4) (g) Massa Erlenmeyer + Zat B (CCl4) + Zat C (etanol) (g) Vol.Titran (zat A) (air) (ml) Massa Erlenmeyer setelah titrasi (g) 1 : 9 85,26 89,00 90,58 2,8 98,67 3 : 7 121,45 133,33 138,67 1,9 140,28 5 : 5 101,67 109,31 110,30 0,6 112,95 7 : 3 126,25 137,31 139,40 0,8 141,80 9 : 1 128, 23 141,13 141,93 0,3 142,49
DIAGRAM TERNER SISTEM ZAT CAIR TIGA KOMPONEN CAMPURAN AIR – KLOROFORM – ASAM ASETAT GLASIAL DAN AIR– CCl4 – ETANOL Berdasarkan tabel 2 dilakukan variasi perbandingan volume antara CCl4 dengan
air seperti halnya pada percobaan 1. Ditemui suatu kecendrungan bahwa semakin banyak volume CCl4 dan semakin sedikit volume
etanol yang dimasukkan ke dalam Erlenmeyer maka semakin sedikit volume titran (air) yang diperlukan untuk mentitrasi campuran CCl4 dengan etanol menjadi
keruh. Hal ini disebabkan karena adanya perbedaan kepolaran yakni CCl4 bersifat
nonpolar sedangkan etanol bersifat semipolar. Dari percobaan, cairan B dan C mampu melarut dengan baik. Hasil tersebut diperoleh karena antara CCl4 dengan etanol
dapat saling berikatan. Dimana, CCl4 dapat
berikatan di sekitar gugus etil dari CH3CH2OH yang bersifat non-polar pada
gugus CH3CH2- nya. Ketika titrasi dengan
aquades dilakukan, terjadi pemisahan diantara campuran CCl4 dengan etanol, hal
ini dikarenakan etanol membentuk ikatan hidrogen yang lebih kuat dengan molekul air pada bagian –OH dari gugus –OH etanol. Oleh karena itu, etanol yang awalnya berikatan dengan CCl4 akan terpisahkan dan
berikatan dengan air. Hal ini disebabkan karena sifat CCl4 yang tidak melarut dengan
air sehingga CCl4 yang mulanya berikatan
dengan etanol akan terlepas dan terpisah membentuk 2 larutan terner terkonjugasi
yang ditandai dengan terbentuknya larutan yang keruh. Karena kemampuannya yang dapat melarut dengan air dan juga CCl4,
maka etanol dikenal sebagai pelarut yang bersifat semipolar.
Pengolahan Data
Dari hasil percobaan dapat ditentukan presentase fraksi mol ketiga komponen cairan dapat dicari dengan persamaan berikut: A A A Mr m n ; B B B Mr m n ; C C C Mr m n % 100 C B A A A n n n n X ; % 100 C B A B B n n n n X ; % 100 C B A C n n n n Xc Keterangan :
X = fraksi mol zat (%) n = mol zat (%) m = massa zat (gram) Mr = massa molekul zat (gram/mol).
Data nilai presentase fraksi mol ketiga komponen pada percobaan 1 dan 2 dapat dilihat pada tabel 3 dan tabel 4.
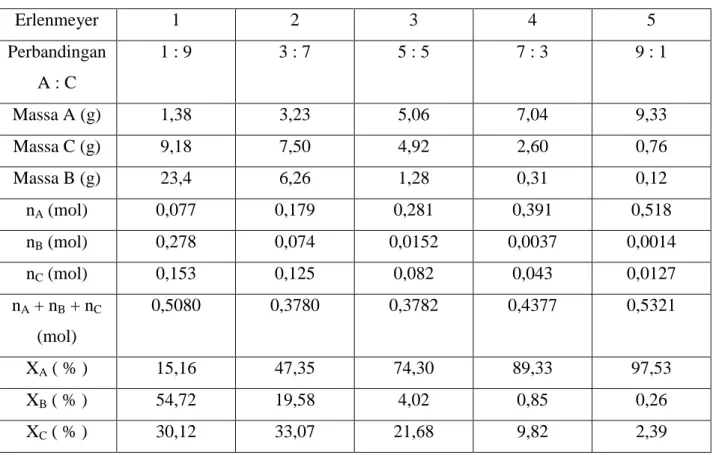
Tabel 3. Hasil perhitungan konsentrasi dalam % mol ketiga komponen percobaan 1 Erlenmeyer 1 2 3 4 5 Perbandingan A : C 1 : 9 3 : 7 5 : 5 7 : 3 9 : 1 Massa A (g) 1,38 3,23 5,06 7,04 9,33 Massa C (g) 9,18 7,50 4,92 2,60 0,76 Massa B (g) 23,4 6,26 1,28 0,31 0,12 nA (mol) 0,077 0,179 0,281 0,391 0,518 nB (mol) 0,278 0,074 0,0152 0,0037 0,0014 nC (mol) 0,153 0,125 0,082 0,043 0,0127 nA + nB + nC (mol) 0,5080 0,3780 0,3782 0,4377 0,5321 XA ( % ) 15,16 47,35 74,30 89,33 97,53 XB ( % ) 54,72 19,58 4,02 0,85 0,26 XC ( % ) 30,12 33,07 21,68 9,82 2,39
Tabel 4. Hasil perhitungan konsentrasi dalam % mol ketiga komponen percobaan 2
Erlenmeyer 1 2 3 4 5 Perbandingan B : C 1 : 9 3 : 7 5 : 5 7 : 3 9 : 1 Massa B (g) 3,78 11,88 7,64 11,06 12,90 Massa C (g) 1,54 5,34 0,99 2,09 0,80 Massa A (g) 8,09 1,61 2,65 2,40 0,56 nB (mol) 0,082 0,258 0,159 0,240 0,280 nC (mol) 0,010 0,034 0,006 0,013 0,005 nA (mol) 0,449 0,089 0,147 0,133 0,031 nA + nB + nC (mol) 0,541 0,381 0,312 0,386 0,316 XB ( % ) 15,16 67,71 50,93 62,15 88,60 XC ( % ) 1,88 8,96 1,95 3,37 1,58 XA ( % ) 82,96 23,33 47,12 34,48 9,82
Berdasarkan tabel 3 dan tabel 4, perbedaan persentase pada setiap cairan disebabkan oleh volume dari masing-masing komponen berbeda, sehingga terjadi perubahan daya saling larut antara komponen-komponen larutan tersebut. Pada
tinggi dikarenakan sifar air yang sangat polar.
Setiap penambahan air pada campuran tersebut menyebabkan perubahan daya larut antar larutan, hal ini kemudian
DIAGRAM TERNER SISTEM ZAT CAIR TIGA KOMPONEN CAMPURAN AIR – KLOROFORM – ASAM ASETAT GLASIAL DAN AIR– CCl4 – ETANOL penggambaran diagram terner percobaan 1 dan 2 diperoleh masing – masing lima titik diagram terner, di mana masing–masing titik menggambarkan komposisi–komposisi zat pada tiap campuran. Dari setiap perlakuan berarti diperoleh lima diagram terner yang berarti ada lima titik dalam kelima diagram terner tersebut.. Dengan menggabungkan kelima titik tersebut,
diperoleh sebuah garis lengkung yang disebut kurva binodal. Kurva binodal yang telah dibuat tersebut diperoleh dengan cara menghubungkan titik-titik dari 1 sampai 5 dengan menarik sebuah garis kesetimbangan dari susunan masing-masing larutan pada percobaan 1 maupun percobaan 2. Gambar diagram terner untuk percobaan 1 dan 2 dapat dilihat pada gambar 1 dan 2.
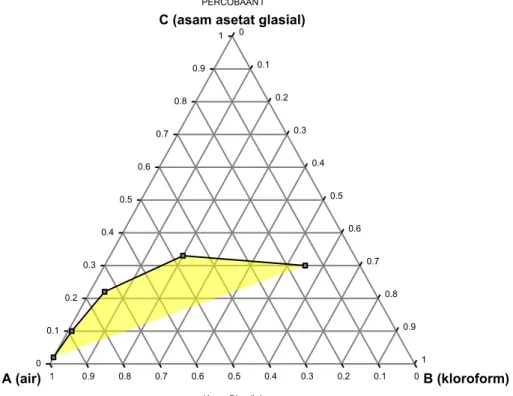
Gambar 1. Diagram terner dengan kurva binodial pada percobaan 1.
Melalui gambar 1 dapat diartikan bahwa asam asetat lebih suka bercampur dengan air dibandingkan kloroform. Hal ini diakibatkan oleh bertambahnya kelarutan asam asetat dalam air lebih cepat dibandingkan kelarutan asam asetat dalam kloroform. Selain itu asam asetat lebih suka ke air karena massa jenis asam asetat lebih dekat dengan ρ air yaitu 1,05 g/mL dan 1 g/mL. Hasil ini telah sesuai dengan teori bahwa asam asetat lebih suka pada air dibandingkan kloroform.
Sedangkan pada gambar 2, diketahui bahwa etanol lebih suka bercampur dengan air dibandingkan karbon tetraklorida. Hal ini terjadi karena bertambahnya kelarutan etanol dalam air lebih cepat dibandingkan kelarutan etanol dalam kloroform. Hasil ini telah sesuai dengan teori bahwa etanol lebih suka pada air dibandingkan kloroform.
KESIMPULAN
Berdasarkan hasil percobaan yang diperoleh, dapat disimpulkan:
1. Campuran air – kloroform – asam asetat glasial dan campuran air– CCl4 –etanol
merupakan sistem 3 komponen yang dapat campur sebagian dan dapat digambarkan dalam diagram terner. 2. Asam asetat glasial dan air, asam asetat
glasial dan kloroform, air dan etanol, serta CCl4 dan etanol dapat tercampur
seluruhnya, tetapi air dengan kloroform dan air dengan CCl4 tidak dapat
tercampur seluruhnya,hanya tercampur sebagian saja. Hal ini dikarenakan air bersifat polar, asam asetat glasial dan
etanol bersifat semipolar serta kloroform dan CCl4 bersifat nonpolar.
3. Titik akhir titrasi air (H2O) dan asam
asetat glasial (CH3COOH) dengan
kloroform (CHCl3) dan titik akhir titrasi
CCl4 dan etanol dengan air (H2O) di
tandai dengan timbulnya kekeruhan. 4. Semakin banyak volume air dan
semakin sedikit volume asam asetat glasial pada percobaan 1 maka semakin sedikit volume titran (kloroform) yang diperlukan untuk mentitrasi campuran tersebut. Serta semakin banyak volume CCl4 dan semakin sedikit volume etanol
pada percobaan 2 maka semakin sedikit volume titran (air) yang diperlukan untuk mentitrasi campuran tersebut. 5. Penambahan kloroform pada larutan air
dan asam asetat glasial serta penambahan air pada larutan CCl4 dan
etanol pada komposisi yang berbeda menyebabkan perubahan daya saling larut antara kedua zat tersebut.
DAFTAR PUSTAKA
[1]
Nawazir. 2012. Pengertian Zat Cair. http://ilmualambercak.blogspot.com/ 2013/03/diagram-terner-sistem-zat-cair-tiga.html. diakses pada 16 april 2013
[2]
Adam. 2011. Diagram Terner Sistem
Zat Cair Tiga Komponen
http://www.scribd.com/doc/8837443 1/Kimfis-Adam-Levine. diakses pada 16 april 2013
[3]
Dogra. 2009. Kimia Fisik Dan Soal
– Soal. Bandung: Erlangga
[4]
Dedi, et al. 2011. Laporan Praktikum Kimia Fisika Terapan II.
Bandung: Jurusan Teknik Kimia Politeknik Negeri Bandung