8 BAB II
TINJAUAN PUSTAKA
A. Penyakit Ginjal Kronis
Batasan PGK menurut pedoman K/ DOQI adalah kerusakan ginjal yang terjadi selama atau lebih dari 3 bulan, berdasarkan kelainan patologik atau petanda kerusakan ginjal seperti kelainan pada urinalisis. Selain itu, batasan ini juga memperhatikan derajat fungsi ginjal atau laju filtrasi glomerulus ( LFG ) (K/ DOQI, 2002).
Penyakit Ginjal Kronis (PGK) merupakan suatu proses patofisiologis dengan etiologi yang beragam yang mengakibatkan penurunan fungsi ginjal secara progresif dan akan berakhir dengan gagal ginjal, yang ditandai dengan penurunan fungsi ginjal yang irreversibel, dimana pada suatu derajat sehingga memerlukan terapi pengganti ginjal yang tetap, baik berupa dialisis atau transplantasi ginjal (Suwitra, 2006). Pada individu dengan PGK, klasifikasi stadium ditentukan oleh nilai LFG, yaitu stadium yang lebih tinggi menunjukkan nilai LFG yang lebih rendah, seperti terlihat pada tabel 2.1.
Tabel 2.1. Klasifikasi PGK atas dasar derajat penyakit (K/ DOQI, 2002).
Derajat Penjelasan LFG 1 2 3 4 5
Kerusakan ginjal dengan LFG normal Kerusakan ginjal dengan LFG turun ringan Kerusakan ginjal dengan LFG turun sedang Kerusakan ginjal dengan LFG turun berat Gagal ginjal
60 - 89 30 - 59 15 - 29 < 15 / dialisa
B. Penyakit Kardiovaskuler pada Penyakit Ginjal Kronis
Kematian tersering pada pasien PGK diakibatkan oleh PKV dengan mortalitas hampir 40% hingga 50% jika disertai gangguan serebrovaskuler pada pasien yang dilakukan dialisis reguler. Patofisiologi terjadinya PKV salah satunya melalui aterosklerosis yang menyebabkan kerusakan vaskuler (Payson et al., 2004). Faktor penting yang berperan pada kerusakan vaskuler pasien dengan PGK yaitu : faktor resiko klasik dan non klasik seperti yang terpapar pada gambar 2.1 (Stinghen, 2007).
Gambar 2.1. Faktor risiko aterosklerosis pada uremia (Stinghen, 2007) Aterosklerosis adalah penyakit progresif dan dinamis yang merupakan kombinasi disfungsi endotel dan inflamasi (Tavares, 2011). Marker inflamasi dan disfungsi endotel digunakan untuk mengetahui resiko pasien terhadap perkembangan aterosklerosis. Aterosklerosis melibatkan beberapa komponen inflamasi, remodeling dan deposit lemak vaskuler, fibrosis serta trombosis
(Sarnak et al., 2003). Aterosklerosis merupakan proses proliferasi dan respon inflamasi yang berlebihan dari proliferasi dan migrasi otot polos vaskuler, infiltrasi sel inflamasi, neovaskularisasi, produksi matriks ekstraseluler dan akumulasi lemak. Faktor yang berperan terhadap inflamasi pada aterosklerosis adalah DM, dislipidemia, hipertensi, obesitas, infeksi dan juga PGK (Nolan, 2005; Guntur 2006; Bambang, 2012 B). Pada obesitas sentral terdapat peningkatan free fatty acid (FFA), adinopektin dan leptin. Adiponektin mengeluarkan IL-6 yang akan merangsang sel hepatosit membuat hs-CRP. Free fatty acid akan meningkatkan fosforilasi serin yang akan mengakibatkan peningkatan inhibition kB (IkB) selanjutkan akan mempengaruhi transkripsi DNA pada NF-kB sehingga terjadi ekspresi sitokin proinflamasi yaitu TNF- -6 (Guntur, 2006). Adanya aterosklerosis pada PGK memiliki resiko yang lebih besar untuk terjadinya morbiditas dan mortalitas akibat PKV (Nolan, 2005; Bambang, 2012 A).
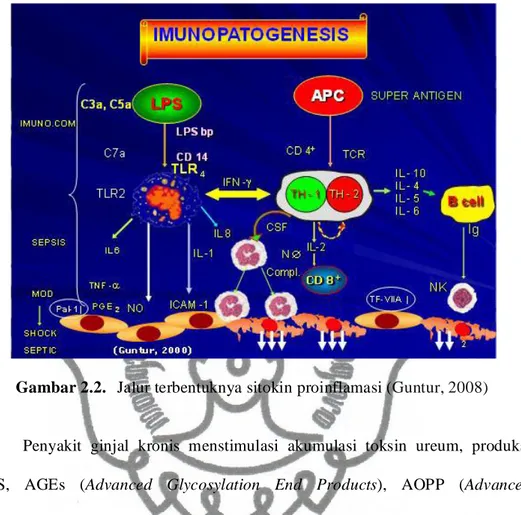
PGKmerupakan suatu penyakit inflamasi, dimana stimulus inflamasi yang banyak terdapat pada pasien PGKmenyebabkan dilepaskannya sitokin termasuk interleukin (IL-1, IL-6 dan TNF- ). Meningkatnya kadar TNF- terdapat pada keadaan inflamasi akut dan kronik ( Guntur, 2008; Bambang, 2012 A).
Gambar 2.2. Jalur terbentuknya sitokin proinflamasi (Guntur, 2008)
Penyakit ginjal kronis menstimulasi akumulasi toksin ureum, produksi ROS, AGEs (Advanced Glycosylation End Products), AOPP (Advanced Oxidation Protein Products) serta gangguan metabolisme mineral (Arici, 2001; Tesch, 2010). Akibatnya, akan menstimulasi sitokin pro inflamasi sistemik seperti TNF- -1 merangsang pembentukan CRP dan fibrinogen serta respon vaskuler (MCP-1, IL- -1 dan VCAM-1), yang nantinya akan menyebabkan stimulasi disfungsi endotel, memudahkan terjadinya pembentukan plak dan proses terjadinya aterosklerosis (Guntur, 2006; Cachofeiro, 2008; Gosmanova, 2011).
Uremia pada pasien PGK yang menjalani dialisis, diduga menyebabkan peningkatan kadar sitokin (Himmerfarb et al., 2002). Indoxyl sulfat merupakan salah satu molekul toksin uremik yang dapat menginduksi stres oksidatif pada sel
tubulus, sel mesangial, sel otot polos vaskuler, sel endotel dan osteoblas yang akan menyebabkan terjadinya kalsifikasi pada pembuluh darah, meningkatkan progresivitas PGK, PKV dan osteodistrofi (Niwa, 2010; Silverstein, 2009). Proses dialisis pun turut memberikan kontribusi terhadap peningkatan sekresi sitokin. Tetapi dengan dialisis yang rutin dan jangka panjang akan terjadi penurunan jumlah sitokin secara bermakna bila dibanding dengan pasien PGK yang hanya diterapi konservatif (Malaponte, 2002). Pasien dengan hiperuremia kronis yang disebabkan baik oleh faktor-faktor renal maupun non renal, faktor-faktor risiko penyakit jantung dan aterosklerosis saling mempengaruhi sebagai komorbiditas (Arici, 2001).
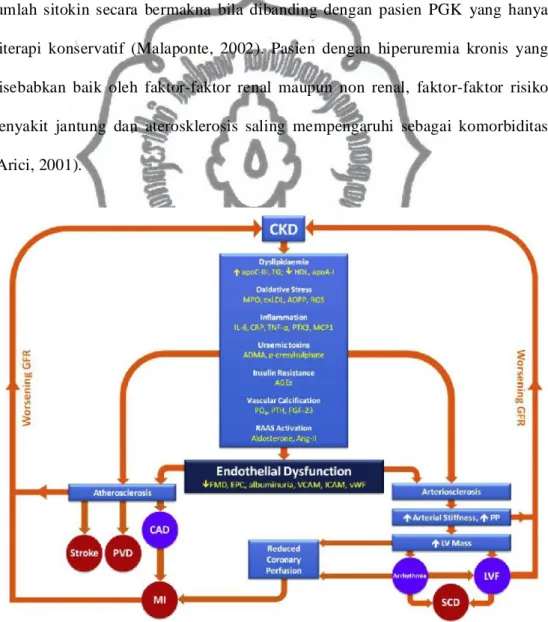
Gambar 2.3. Mekanisme penyakit kardiovaskuler dan disfungsi endotel pada penyakit ginjal kronis (William, 2012).
C. Penyakit Ginjal Kronis dan Disfungsi Endotel
Komplikasi kardiovaskuler pada PGK didasari aterosklerosis ditandai adanya disfungsi endotel secara dini. Endotelium adalah selapis sel yang membatasi lumen interior diding pembuluh darah yang berfungsi sangat kompleks sebagai regulator homeostasis vaskuler. Endotel berfungsi mengatur tonus dan menghasilkan suatu molekul yang disebut sebagai endothelium derived relaxing factor (EDRF) yang identik dengan mediator vasoaktif yang dikenal sebagai nitric oxide (NO) (Gosmanova, 2011; Bambang, 2012 B). Nitric oxide endogen disintesis dari metabolisme arginine, suatu asam amino esensial menjadi L-citruline dibantu oleh enzim endothelial NO synthase (eNOS). Disfungsi endotel ditandai dengan penurunan bioavailabilitas produksi NO endotel yang dihasilkan NO synthase (NOS). Disfungsi endotel dapat menyebabkan peningkatan vasokonstriktor dan atau penurunan vasodilator (Montesa et al., 2009; Bambang, 2012 B).
Endotel mengeluarkan substansi khusus yang secara garis besar dibagi menjadi 2 golongan yaitu endothelium derived relaxing factors (EDRFs) dan endothelium derived contracting factors (EDCFs). Substansi yang dikeluarkan endotel dijabarkan dalam tabel 2.2 berikut :
Tabel 2.2 Substansi yang dikeluarkan endotel (Deanfield et al., 2007) Vasodilator Nitric oxide, prostasiklin, endothelium derived hyperpolarizing
factor(EDHF), bradikinin, adrenomedulin, C-natriuretic peptide
Vasokonstriktor Endotelin-1, angiotensin-II, tromboksan A2, radikal oksigen,
Antitrombotik Nitric oxide, prostasiklin, plasminogen activator, protein C, tissue factor inhibitor
Protrombotik Endotelin-1, radikal oksigen, plasminogen activator inhibitor-1, von Willebrand factor, tromboksan A2, fibrinogen, tissue
factor
Nitric oxide merupakan faktor terpenting yang memelihara fungsi vaskuler dan mempunyai sifat anti aterogenik seperti menghambat proliferasi otot polos vaskuler, menghambat agregasi ptatelet dan mencegah thrombosis. Jika terjadi salah satu gangguan fungsi pada endotel disebut sebagai disfungsi endotel ( Deanfield et al., 2007; Bambang, 2012 B). Disfungsi endotel dapat menyebabkan peningkatan vasokonstriktor dan atau penurunan vasodilator (Montesa et al., 2009; Bambang, 2012 B). Gangguan pada endotel atau jalur pembentukan NO akan mengganggu tonus dan struktur pembuluh darah di seluruh tubuh dan juga menyebabkan terjadinya aterosklerosis yang berhubungan erat dengan PKV (Mysliwiec , 2004; Gosmanova, 2011).
D. Evaluasi Disfungsi Endotel pada Penyakit Ginjal Kronis
Identifikasi adanya disfungsi endotel awalnya hanya berdasarkan gangguan vasodilatasi tetapi saat ini istilah tersebut meluas tidak hanya terbatas pada vasodilatasi tetapi juga status proinflamasi dan protrombik. Belum ada uji tunggal dan menjadi standard penilaian disfungsi endotel in vivo (Sitia et al., 2010). Endotel meregulasi beberapa fungsi vaskuler dan penilaian terhadap fungsi-fungsi tersebut merupakan cara yang potensial untuk menilai integritas vaskuler. Pendekatan yang sering dilakukan untuk mengevaluasi disfungsi endotel adalah
dengan melakukan pengukuran aliran darah dan reaktivitas vaskuler (Celermajer, 2008; Ellins, 2011; Innaba et al., 2010).
Teknik pengukuran disfungsi endotel non invasif meliputi ultrasonografi FMD, pulse wave analysis (PWA) atau pulse contour analysis (PCA), magnetic resonance imaging (MRI), flowmetri laser Doppler serta pulse amplitudo tonometry (PAT). Ultrasonografi FMD arteri brachialis merupakan metode yang paling banyak digunakan baik pada penelitian skala kecil maupun besar pada pediatrik dan dewasa serta telah digunakan sebagai gold standard di berbagai negara (Celermajer et al., 1994; Celermajer, 2008; Ellins, 2011). Pengukuran FMD menggunakan USG dinilai lebih murah, mudah dan dapat dilakukan dalam skala besar (Celermajer et al., 1994; Al-Qaisi et al., 2008).
Penanda disfungsi endotel pada PGK secara biokimiawi yang banyak digunakan saat ini tetapi tidak rutin dikerjakan, hanya terbatas digunakan dalam penelitian adalah inhibitor NOS yaitu asymmetric dimethylarginin (ADMA) Asymmetric dimethylarginin merupakan hasil dari metilasi postranskripsi L-arginin oleh protein L-arginine methyltranferases (PRMTs) (Chhabra, 2009; Landim et al., 2009). Asymmetric dimethylarginine juga menunjukkan korelasi terbalik dengan FMD arteri brachialis pada pasien dengan proteinuria (Martens, 2011). Selain ADMA, disfungsi endotel dapat diukur menggunakan NO, soluble vasculer adhesion molecule diantaranya adalah vascular cell adhesion molecule (VCAM), intracelluler adhesion molecule (ICAM), endothelin-1 (ET-1), kadar dan marker koagulasi dan fibrinolisis seperti plasminogen activator inhibitor-1 (PAI-1), faktor von Willebrand dan marker inflamasi seperti C reactive protein
(CRP), interleukin-1 (IL-1), IL-6 dan tumor necrosis factor (TNF)- hnol et al., 2007; Zocali et al., 2003).
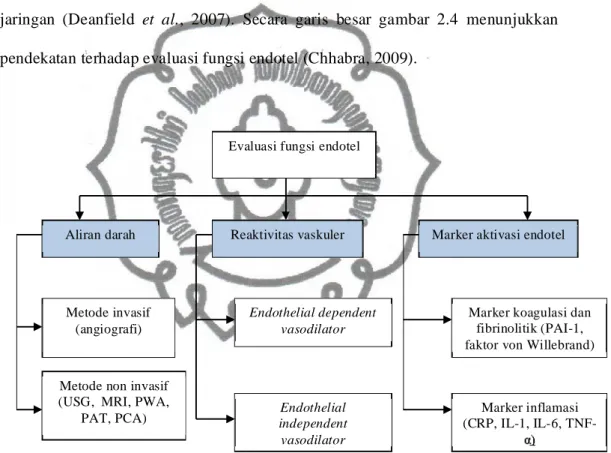
Identifikasi dan kuantifikasi circulating endothelial cells (CECs) merupakan penemuan baru saat ini dan teknik tersebut berkorelasi dengan marker fungsi endotel yang lain seperti FMD, faktor von Willebrand dan aktivator plasminogen jaringan (Deanfield et al., 2007). Secara garis besar gambar 2.4 menunjukkan pendekatan terhadap evaluasi fungsi endotel (Chhabra, 2009).
Gambar 2.4 Pendekatan evaluasi disfungsi endotel.
USG=ultrasonografi, FMD=flow mediated dilatation, MRI=magnetic resonance imaging, PWA=pulse wave analysis, PAT=pulse amplitude tonometry, PCA=pulse contour analysis, PAI=plasminogen activator inhibitor, TNF=tumor necrosis factor, IL=interleukin (Chhabra, 2009)
Evaluasi fungsi endotel
Aliran darah Reaktivitas vaskuler Marker aktivasi endotel
Metode non invasif (USG, MRI, PWA,
PAT, PCA) Metode invasif (angiografi) Endothelial dependent vasodilator Endothelial independent vasodilator
Marker koagulasi dan fibrinolitik (PAI-1, faktor von Willebrand)
Marker inflamasi (CRP, IL-1, IL-6,
TNF-E. Flow Mediated Dilatation (FMD)
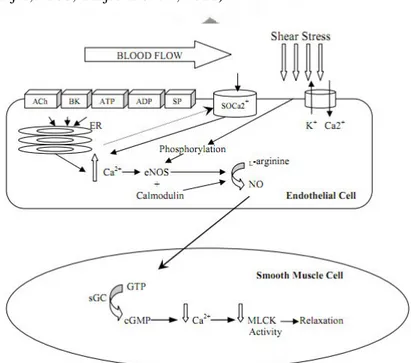
Peran endothelium dalam berbagai proses patologi dan fisiologi sangat besar, meliputi regulasi tonus otot polos, mengontrol thrombosis, menghambat adhesi lekosit dan trombosit serta meningkatkan permeabilitas intra arteri. Beberapa substansi vasoaktif yang dilepaskan endotel melipuri prostasiklin, endotelin, endothelial growth factors (ECGF), interleukin, inhibitor plasminogen, dan NO yang merupakan mediator vasodilatasi utama (Inaba et al., 2010; Deanfield et al., 2007). Selama 30 tahun NO telah diteliti dan penurunan bioavailabilitas NO bersinonim dengan keadaan yang disebut disfungsi endotel. Aterosklerosis dapat disebabkan disfungsi endotel. Endotel merupakan lapisan sel tunggal yang memisahkan dinding vaskuler dari sirkulasi. Gangguan terhadap lapisan sel tersebut terjadi pada awal pathogenesis PKV. Pemeriksaan FMD merupakan alat standar untuk menilai disfungsi endotel (Reriani, 2010; Moreno et al., 2011). FMD dinyatakan sebagai prosentase perubahan reaktivitas diameter dinding pembuluh darah bagian dalam dibanding baseline sebelum diberikan rangsangan shear-stress stimulus yang merupakan representasi aktifitas NO, dengan demikian FMD sering dianggap sebagai index bioavailabilitas NO. Penurunan FMD merupakan penanda awal terjadinya aterosklerosis dan telah dipercaya kapasitasnya untuk memprediksi kemungkinan terjadinya PKV dimasa depan (Celermajer, 2008; Padilla et al., 2008).
Pada tahun 1994 Celermajer menemukan teknik FMD sebagai metode non invasif untuk mengukur fungsi endotel. Penilaian FMD menggunakan USG sebagai respon terhadap oklusi yang menginduksi hiperemia telah ditetapkan
sebagai pengukuran fungsi endotel yang dapat dipercaya, non invasif dan dapat dikorelasikan dengan penilaian fungsi endotel secara invasif. Dalam istilah popular, FMD dideskripsikan sebagai vasodilatasi arteri yang disebabkan peningkatan aliran darah didalam lumen dan shear stress dinding internal (Celermajer, 2008; Thijssen et al., 2011).
Gambar 2.5. Shear stress yang menghasilkan NO dan efek relaksasi pada sel otot polos (Coretti et al., 2002).
Flow mediated dilatation diukur menggunakan peralatan ultrasonografi Doppler, panjang gelombang optimal probe 7-14 Mhz, sudut pengambilan gambar 60 derajat (Coretti et al., 2002; Deanfield et al., 2007).
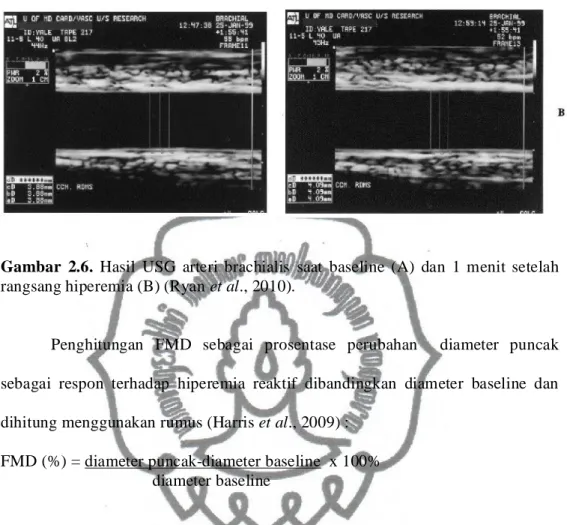
Gambar 2.6. Hasil USG arteri brachialis saat baseline (A) dan 1 menit setelah rangsang hiperemia (B) (Ryan et al., 2010).
Penghitungan FMD sebagai prosentase perubahan diameter puncak sebagai respon terhadap hiperemia reaktif dibandingkan diameter baseline dan dihitung menggunakan rumus (Harris et al., 2009) :
FMD (%) = diameter puncak-diameter baseline x 100% diameter baseline
Pemeriksaan FMD arteri brachialis bermanfaat untuk mengukur NO yang terikat fungsi endotel. Secara kasar, FMD dapat dipakai sebagai prediktor awal faktor risiko kardiovaskuler sejak dini dan lebih dominan kearah faktor risiko non tradisional, juga dapat digunakan untuk mengevaluasi pemberian terapi. Keunggulan lainnya, FMD bersifat non invasif, murah, mudah, dapat dilakukan dengan alat USG sederhana (Al-Qaisi et al., 2008, Moreno, 2011).
F. Malondialdehida (MDA) sebagai Biomarker Stres Oksidatif
Radikal bebas memiliki waktu paruh yang sangat pendek sehingga sulit diukur dalam laboratorium. Kerusakan jaringan lipid akibat ROS dapat diperiksa dengan mengukur senyawa MDA yang merupakan produk peroksidasi lipid.
Malondialdehida (MDA) adalah salah satu hasil akhir dari peroksidasi lipid dan telah lama digunakan untuk menunjukkan peningkatan stres oksidatif pada CKD (Abdollahzad, 2009).
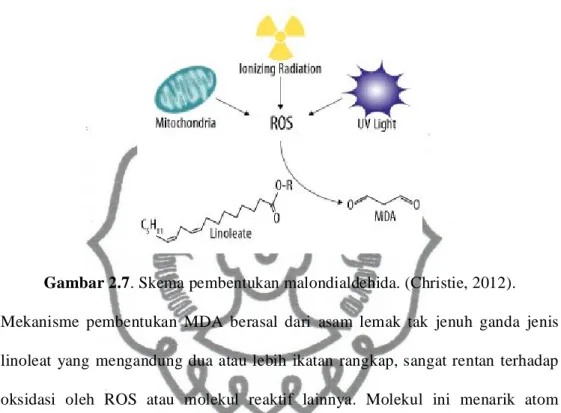
Gambar 2.7. Skema pembentukan malondialdehida. (Christie, 2012). Mekanisme pembentukan MDA berasal dari asam lemak tak jenuh ganda jenis linoleat yang mengandung dua atau lebih ikatan rangkap, sangat rentan terhadap oksidasi oleh ROS atau molekul reaktif lainnya. Molekul ini menarik atom hidrogen dari ikatan rangkap asam lemak tak jenuh dan membentuk radikal peroksi lipid. Radikal ini kemudian bereaksi dengan asam lemak tak jenuh lainnya membentuk hidroperoksida lipid dan radikal peroksi lipid yang baru, yang kemudian meneruskan reaksi oksidasi terhadap lipid lainnya yang dikenal dengan auto-oksidasi lipid (Christie, 2012). Malondialdehida mampu bereaksi lebih jauh dibandingkan F2-isoprostan dan menyebabkan percampuran protein dan DNA sehingga kadar MDA harus diiterpretasikan dengan hati-hati. Malondialdehida bersama dengan produk lipid peroksidase lain seperti 4-hydroxyalkenals, adalah substansi reaktif asam barbiturat (TBARS). Ekstraksi
kromatografi cairan MDA dari plasma dianggap sebagai suatu alat pengukuran stres oksidatif yang dapat dipercaya (Miler et al., 2006., Christie, 2012).
Produksi ROS secara tidak langsung dinilai dengan kadar peroksidasi lipid. Pengukuran kadar MDA serum dapat dilakukan melalui tes thiobarbituric acid-reactive subtance (TBARS). Dasar pemeriksaan adalah reaksi spektrofotometrik sederhana, dimana satu molekul MDA akan terpecah menjadi 2 molekul 2-asam thiobarbiturat. Reaksi ini berjalan pada pH 2-3. Thiobarbituric acid akan memberikan warna pink-chromogen yang dapat diperiksa secara spektrofotometrik (Miler et al., 2006)
Tes TBA selain mengukur kadar MDA yang terbentuk karena proses peroksidasi lipid juga mengukur produk aldehid lainnya termasuk produk non-volatil yang terjadi akibat panas yang ditimbulkan pada saat pengukuran kadar MDA serum yang sebenarnya. Kadar MDA mempunyai rentang standard antara 0.250 - yang dapat diperiksa baik di plasma, jaringan maupun urin (Olayaki et al., 2008).
Meskipun F2 isoprostan juga merupakan marker stres oksidasi seperti halnya MDA, namun MDA terbentuk lebih dahulu baru kemudian F2 isoprostan. Kondisi ini diduga menjadi penyebab adanya perbedaan keeratan hubungan antara kadar F2 isoprostan dan kadar MDA dengan jumlah sel busa pada perkembangan awal aterosklerosis (Jung, 2004., Miler et al., 2006).
G. Antioksidan pada Penyakit Ginjal Kronik
Antioksidan merupakan senyawa-senyawa yang dapat meredam dampak negatif oksidan, termasuk enzim-enzim dan protein-protein pengikat logam dalam meredam dampak negatif oksidan. Fungsi antioksidan adalah mencegah terbentuknya radikal hidroksil, memutus rantai reaksi oksidan, mereduksi oksidan menjadi zat lain yang kurang reaktif misalnya H2O dan O2, menghambat
peroksidase lipid dan scavenger langsung dari ROS. Pencegahan stres oksidatif pada pasien PGK yang menjalani hemodialisis difokuskan pada perbaikan hemokompatibiliti sistem dialisis, suplementasi antioksidan dan modulasi NADPH oksidase (Oberg et al., 2004; Singer, 2010).
Mekanisme pertahanan antioksidan pada pasien hemodialisis sangat lemah disebabkan berbagai gangguan. Defisiensi vitamin C terjadi karena pembatasan diet buah dan sayuran segar untuk menghindari resiko hiperkalemia serta kehilangan vitamin C selama proses dialisis. Berat molekul vitamin C yang rendah dan kelarutannya yang tinggi di dalam air sehingga vitamin C mudah hilang saat dialisis. Defisiensi vitamin C pada pasien hemodialisis bukan hanya pada kuantitasnya tetapi juga kualitas (Adly, 2010).
1. Vitamin C sebagai Antioksidan
Asam askorbat atau vitamin C adalah suatu monosakarida, termasuk antioksidan larut air yang ditemukan pada berbagai jenis sayuran dan buah-buahan yang sering mengalami kerusakan dalam proses pemasakan sampai sedikitnya setengah dari kandungan vitamin C-nya. Salah satu enzim yang diperlukan untuk membuat asam askorbat yaitu gulanolactone oxidase telah
hilang oleh mutasi selama evolusi manusia, karena itu asam askorbat harus diperoleh dari makanan dan vitamin. Asam askorbat berarti asam antiskorbut atau no-scurvy acid. Istilah vitamin C sebenarnya tidak hanya digunakan untuk L-asam askorbat (bentuk tereduksi) tetapi juga bentuk teroksidasinya, dehydroascorbic acid (Kim et al., 2002). Oksidasi bolak balik L-asam askorbat menjadi L-asam dehidroaskorbat terjadi bila bersentuhan dengan tembaga, panas atau alkali. Kedua bentuk vitamin C aktif secara biologik tetapi bentuk tereduksi adalah yang paling aktif dan banyak terdapat dalam keadaan normal (80%) dari vitamin C dalam sirkulasi dan bentuk teroksidasi yang meningkat dalam kedaan patologis. Oksidasi lebih lanjut asam dehidroaskorbat menghasilkan asam diketo L-gulonat dan oksalat yang tidak dapat direduksi kembali yang berarti telah kehilangan sifat antiskorbutnya (Davies, 1991., Langlois et al., 2001).
Gambar 2.8. Struktur Molekul Vitamin C (Langlois et al., 2001)
Di dalam tubuh manusia vitamin C memiliki banyak fungsi tetapi fungsi yang paling penting dari vitamin ini adalah kemampuannya untuk bertindak sebagai katalis redoks dan kofaktor dalam banyak reaksi dan proses biokimia tubuh manusia. Fungsi utama asam askorbat adalah bertindak sebagai pembersih
radikal bebas dengan menemukan molekul radikal bebas dalam darah dan kemudian menyumbang elektron agar molekul menjadi stabil dan tidak reaktif. Sebagai antioksidan, vitamin C bertindak sebagai donor elektron untuk menghentikan reaksi meluas yang disebabkan oleh kehadiran radikal bebas seperti hidroksil dan superoksida (Iqbal et al., 2004). Vitamin C menangkap secara efektif radikal superoksida maupun singlet oksigen dan memutuskan rantai radikal yang dihasilkan melalui peroksidase lipid. Asam askorbat itu sendiri teroksidasi selama proses dan bentuk semi dehidroaskorbat yang merupakan radikal tetapi tidak reaktif dan tidak kuat dan tidak mengurangi oksidasi. Dua askorbil radikal dapat bergabung membentuk satu molekul askorbat dan salah satu dari dehidroaskorbat. Bentuk yang teroksidasi dehidroaskorbat tidak stabil dan lebih lanjut rusak membentuk oksalat dan asam treonik (Padayatty et al., 2003).
Vitamin C merupakan protektor (antioksidan) yang secara terus menerus akan bertindak sebagai scavenger terhadap radikal bebas yang terbentuk sehingga dimungkinkan tidak terjadi gangguan keutuhan dan fungsi sel. Vitamin C merupakan antioksidan non enzimatik yang mudah larut dalam air sehingga vitamin ini terdapat dicairan extra seluler. Vitamin C mempunyai sifat polaritas yang tinggi karena banyak mengandung gugus hidroksil sehingga membuat vitamin ini akan mudah diubah tubuh. Oleh karena itu vitamin C dapat bereaksi dengan radikal bebas yang bersifat aqueous dan mampu menetralisir radikal bebas (Bjelakovic G et al., 2007).
Vitamin C mereduksi besi feri menjadi fero dalam usus halus sehingga mudah diabsorpsi. Vitamin C menghambat pembentukan hemosiderin yang sukar
dimobilisasi untuk membebaskan besi bila diperlukan. Absorpsi besi dalam bentuk nonheme meningkat empat kali lipat bila ada vitamin C. Vitamin C berperan dalam memindahkan besi dari transferin di dalam plasma ke feritin hati. Vitamin C juga membantu absorpsi kalsium dengan menjaga agar kalsium berada dalam bentuk larutan (Bor-yann et al., 2006). Vitamin C juga terlibat dalam biosintesis kortikosteroid dan aldosteron, konversi kolesterol menjadi asam empedu, dan metabolisme tirosin (Iqbal et al., 2004).
2. Pengaruh Vitamin C terhadap Penyakit Ginjal Kronik
Bila ada lebih banyak radikal bebas dalam tubuh manusia dari antioksidan, kondisi ini disebut stres oksidatif dan memiliki dampak memperberat penyakit ginjal kronis. Orang-orang mengalami stres oksidatif memiliki kadar askorbat lebih rendah dari 45,0 mmol/ L, dibandingkan dengan individu sehat yang berkisar antara 61,4-80 mmol/ L (Bjelakovic et al., 2007; Kim et al., 2002)
Singer tahun 2011 menyatakan dalam penelitiannya bahwa pemberian vitamin C oral 250 mg 3 kali/minggu pasca hemodialisis selama 2 bulan terbukti tidak merubah kadar stres oksidatif dan marker inflamasi pada pasien PGK dengan hemodialisis (Singer, 2011). Penelitian yang dilakukan oleh Khosroshashi tahun 2011 menyatakan bahwa pemberian vitamin C intravena 500 mg 2 kali/minggu setelah dialisis selama 2 bulan dapat menurunkan kadar CRP dan
TNF- emiliki
efek sebagai antioksidan juga dapat berperan sebagai antiinflamasi (Khosroshashi et al., 2011). Pemberian vitamin C selama 3 bulan pada pasien hemodialisis secara
intravena 1000 mg 3 kali/minggu menurunkan kadar stres oksidatif dan memperbaiki vasodilatasi terikat NO ( Ting et al., 2009).
Gambar 2.9. Antioksidan menghambat sitokin proinflamasi (Guntur, 2008) Vitamin C sebagai antioksidan berperan sebagai inhibitor terhadap Inhibitor kinase (IKK) sehingga aktifasi nucleus factor (NF ) terhambat akibatnya terjadi penurunan jumlah sitokin proinflamasi diantaranya IL-6 dan
TNF-tampak pada gambar 2.7. TNF- memicu terjadinya stres oksidatif (Guntur, 2008; Carcamo, 2004). Vitamin C dapat memperbaiki disfungsi endotel dengan cara merubah kembali BH4 teroksidasi menjadi kondisi tak teroksidasi yang akan menormalkan produksi NO. Vitamin C dapat mencegah oksidasi BH4 oleh ROS dengan bereaksi sebagai penangkap ROS atau dapat secara langsung mengurangi hasil antara yang teroksidasi seperti BH3 (Alph N., 2004; DuPont et al., 2011).
Gambar 2.10. Vitamin C ( asam ascorbat) mengurangi degradasi BH4 menjadi BH3 yang bersifat radikal bebas (Alph N. 2004). Mekanisme vitamin C sebagai antioksidan yang mencegah penurunan NO diantaranya (May JM., 2000) :
1. Vitamin C menginduksi penurunan oksidasi LDL. 2. Menangkap superoksid intraselluler.
3. Meningkatkan pelepasan NO dari sirkulasi. 4. Mereduksi secara langsung nitrite menjadi NO. 5. Mengaktivasi NO synthase.
.
3. Angka kecukupan gizi dan kebutuhan vitamin C
Angka kecukupan gizi untuk vitamin C pada pria dewasa sehat adalah 90 mg/ hari dan wanita dewasa 75 mg/ hari. Angka kecukupan gizi ini tergantung kebutuhan tubuh seseorang juga dipengaruhi jenis kelamin, berat badan, tinggi badan, aktivitas fisik dan stres, tetapi tidak terlalu jauh dari 100 mg/ hari untuk vitamin C. Kebutuhan vitamin C setiap hari sangat berfluktuasi, tergantung kondisi tubuh. Apabila kekebalan tubuh sedang rendah, maka diperlukan vitamin
C dosis tinggi. Angka kecukupan gizi tersebut berdasarkan kadar vitamin C hampir maksimal pada neutrofil (leukosit) dengan ekskresi urin minimal. Kebutuhan vitamin C juga meningkat pada saat operasi atau luka bakar karena jaringan yang hilang lebih banyak. Hal ini disebabkan oleh banyaknya kolagen yang dihasilkan untuk mengganti jaringan yang hilang tersebut (Hamrick, 2008). Tahun 1999 RDA telah menyetujui meningkatkan dosis vitamin C menjadi 120 mg/hari pada kasus-kasus tertentu untuk mengurangi risiko PKV dan kanker. Dosis vitamin C yang lebih tinggi (500 mg/hari) dibutuhkan untuk mencapai target penurunan tekanan darah dan vasodilatasi (Kim et al., 2002).
Penyakit ginjal kronis membutuhkan vitamin C lebih dari AKG dewasa normal hanya belum ada patokan yang pasti mengenai dosis vitamin C yang direkomendasikan untuk pasien PGK dengan dialisis (Montesa et al., 2009). Pemberian vitamin C oral 1-1,5 gram/minggu atau parenteral 300 mg/sesi dialisis direkomendasikan untuk mengganti defisiensi vitamin C meskipun hal tersebut belum menjadi patokan. Batas maksimum yang diizinkan untuk mengkonsumsi vitamin C adalah 1000 mg/ hari (Adly, 2010).