Mengubah bahan baku menjadi produk yang lebih
bernilai melalui sintesis kimia banyak dilakukan di
industri
Asam sulfat, ammonia, etilena, propilena, asam
fosfat, klorin, asam nitrat, urea, benzena, metanol,
etanol, dan etilen glikol
Serat/benang, cat, deterjen, plastik, karet, kertas,
pupuk, insektisida, dll.
2Jelas, seorang sarjana Teknik Kimia harus
memahami bagaimana merancang dan
• Kecepatan dan konversi keseimbangan reaksi kimia
tergantung pada temperatur, tekanan, dan komposisi reaktan.
• Misal oksidasi SO2 menjadiSO3.
2 SO2 (g) + O2 (g) 2 SO3 (g)
• Kecepatan reaksi bertambah dengan naiknya
temperatur.
• Konversi keseimbangan SO3 turun dengan naiknya temperatur, yaitu dari 90% pada 520°C menjadi 50% pada 680°C.
V2O5
300C
• Konversi keseimbangan menyatakan konversi
maksimum yang dapat dicapai (dengan atau tanpa
katalis).
• Keseimbangan dan kecepatan reaksi harus
diperhatikan ketika kita memanfaatkan reaksi kimia
untuk tujuan komersial.
• Meskipun kecepatan reaksi tidak berkaitan dengan
termodinamika, tetapi konversi keseimbangan
berkaitan.
• Tujuan dari bab ini adalah untuk mempelajari
pengaruh temperatur, tekanan, dan komposisi awal
terhadap konversi keseimbangan suatu reaksi
• Kebanyakan reaksi di industri tidak
dilangsung-kan sampai tercapai keseimbangan; biasanya
reaktor dirancang terutama berdasarkan
kecepatan reaksi.
• Meskipun demikian, pemilihan kondisi operasi
dipengaruhi oleh keseimbangan.
Reaksi secara umum: . . . A A . . . A A1 2 2 3 3 4 4 1 i
adalah koefisien stoikiometri reaksi Konvensi tanda untuk i:
• Positif (+) untuk produk • Negatif (–) untuk reaktan
CONTOH: CH4 + H2O CO + 3 H2 3 1 1 1 2 2 4 H O CO H CH (1) 8
Perubahan mol spesies yang ada dalam reaksi berbanding lurus dengan bilangan stoikiometrinya.
Jika 3 mol CH4 berkurang karena bereaksi, maka H2O juga berkurang 3 mol, sementara itu 3 mol CO dan 9 mol H2
terbentuk. . dst dn dn dn dn 1 1 3 3 1 1 2 2 d dn dn dn dn dn i i 4 4 3 3 2 2 1 1 d dni i ( i = 1, 2, 3, ..., N) Koordinat reaksi (2) (3) CH4 + H2O CO + 3 H2 (1) (2) (3) (4)
3 1 3 dn 1 1 3 1 3 dn 2 2 3 1 3 dn 3 3 3 3 9 dn 4 4 CH4 H2O H2 CO 10
(4) Pers. (2) dan (3) menyatakan perubahan akibat
perubahan jumlah mol spesies yang bereaksi.
Definisi dari dilengkapi dengan pernyataan = 0 untuk kondisi awal sistem, sebelum reaksi.
Jadi integrasi pers. (3) dari kondisi awal sebelum reaksi dengan = 0 dan ni = ni0 ke kondisi setelah reaksi:
0 i n n i d dn i 0 i i i i n0 n ( i = 1, 2, 3, ..., N) i i i n0 n
Penjumlahan untuk semua spesies: i i i i i i 0 n n n n0 n i i n n i i 0 n 0 n i i Dengan:
Jadi fraksi mol yi dari satu spesies jika dihubungkan dengan : 0 i i i i n n n n y 0 (5) 12
CONTOH
Untuk sistem dengan reaksi: CH4 + H2O CO + 3 H2
Mula-mula ada 2 mol CH4, 1 mol H2O, 1 mol CO, dan 4 mol H2. Tentukan pernyataan untuk yi sebagai fungsi .
PENYELESAIAN
2 1 1 1 3 i i 8 4 1 1 2 n n i i 0 0 0 i i i i n n n n y 0 2 8 2 y 4 CH 2 8 1 yH O 2 2 8 1 yCO 2 8 3 4 y 2 H 14
CONTOH
Sebuah tangki berisi hanya n0 uap air. Jika dekomposisi terjadi menurut reaksi
H2O H2 + ½ O2
Tentukan pernyataan yang menghubungkan jumlah mol dan fraksi mol tiap spesies dengan koordinat reaksi.
PENYELESAIAN
5 , 0 1 5 , 0 1 i i Jumlah mol masing-masing spesies:
i i i n0 n
0 O H n n 2 2 H n 0,5 n 2 O n 0,5 n 0 5 , 0 n n y 0 0 O H2 5 , 0 n y 0 H2 5 , 0 n 5 , 0 y 0 O2 i i i n0 n 16
Jika ada dua atau lebih reaksi independen yang
berlangsung bersamaan, maka digunakan subskrip j sebagai indeks untuk reaksi.
j : koordinat untuk reaksi j.
i,j : bilangan stoikiometri untuk spesies i dalam reaksi j
Karena jumlah mol satu spesies ni dapat berubah karena beberapa reaksi, maka persamaan umum yang analog dengan persamaan (3) adalah:
j i,j j i d dn ( i = 1, 2, 3, ..., N) d dni i
Integrasi dari ni = ni0 dan j = 0: j i,j j i i n 0 n ( i = 1, 2, 3, ..., N) (6) Jika semua spesies dijumlahkan:
j i i,j j 0 i j i,j j i i i i n n n n 0
Definisi dari bilangan stoikiometri total ( i i):
i i,j j j j j 0 n n j j j j i,j j i i i n n n n y 0 ( i = 1, 2, 3, ..., N) (7) 18
j 1,j j 1 1 n 0 n j 2,j j 2 2 n 0 n (+) j 2,j j 2 j 1,j j 1 2 1 n n 0 n 0 n n i j i,j j i i i i j i,j j i i 0 0 n n n n
CONTOH
Untuk sistem dengan reaksi:
CH
4+ H
2O
CO + 3 H
2(1)
CH
4+ 2H
2O
CO
2+ 4 H
2(2)
Mula-mula ada 2 mol CH
4dan 3 mol H
2O, tentukan
pernyataan untuk y
isebagai fungsi
1dan
2.
PENYELESAIAN
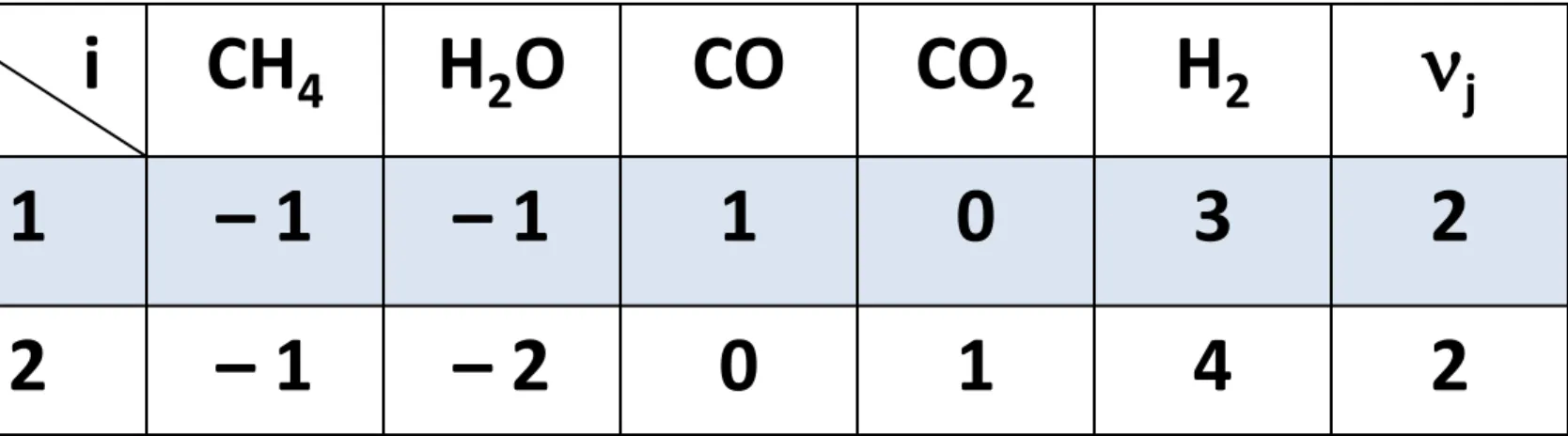
Tabel bilangan stoikiometri:
CH4 H2O CO CO2 H2 j 1 – 1 – 1 1 0 3 2 2 – 1 – 2 0 1 4 2 i j j i,j j i i n 0 n 2 1 j 1,j j 1 1 CH n n 2 n 0 4 2 1 j 2,j j 2 2 O H n n 3 2 n 0 2
Pers. (7): 1 j 3,j j 3 3 CO n n 0 n 2 j 4,j j 4 4 CO2 n n 0 n 2 1 j 4,j j 5 5 H n n 3 4 n 0 2 2 1 j j j 0 5 2 2 n n j j j j i,j j i i i n n n n y 0 22
2 1 2 1 CH CH 2 2 5 2 n n y 4 4 2 1 2 1 O H O H 2 2 5 2 3 n n y 2 2 2 1 1 CO CO 2 2 5 n n y 2 1 2 CO CO 2 2 5 n n y 2 2 2 1 2 1 H H 2 2 5 4 3 n n y 2 2
Energi Gibbs total dari suatu sistem tertutup pada T
dan P konstan akan berkurang selama proses
irreversibel dan kondisi keseimbangan akan dicapai
jika G
tmencapai nilai minimum.
Pada kondisi keseimbangan,
dGt T,P 0Jadi jika suatu campuran kimia tidak berada pada
keseimbangan kimia, maka reaksi kimia yang terjadi
pada T dan P konstan akan menurunkan energi
Gibbs total dari sistem.
Gambar1. Hubungan energi Gibbs total dengan koordinat reaksi 26
Karena
merupakan satu-satunya variabel yang
menyatakan progres dari suatu reaksi, maka
komposisi dari sistem dan energi Gibbs total dari
sistem pada T dan P konstan ditentukan oleh
.
Tanda panah pada kurva di Gambar 1 menyatakan
arah perubahan (G )
T,Pyang mungkin terjadi.
Koordinat reaksi pada keseimbangan,
e, adalah nilai
Gambar 1 menunjukkan 2 fitur dari keadaan
keseimbangan pada T dan P tertentu:
• Energi Gibbs total G
tmencapai minimum.
• Diferensialnya = 0
Masing-masing fitur tersebut merupakan kriteria
keseimbangan.
Jadi, kita bisa menulis persamaan untuk G
tsebagai
fungsi
dan mencari nilai
yang menyebabkan G
tminimum, atau kita dapat mendiferensialkan
persamaan tersebut, menyamakannya dengan nol,
dan menyelesaikannya untuk memperoleh nilai
.
Persamaan fundamental sifat-sifat termodinamis untuk sistem reaksi tunggal:
i i i dn dT nS dP nV nG dJika perubahan jumlah mol ni merupakan akibat dari
suatu reaksi tunggal dalam sebuah sistem tertutup, maka dengan persamaan (2) masing-masing dni dapat diganti dengan i d. Persamaan (1) menjadi: (2)
i i i d dT nS dP nV nG d (3) 30
i i i d dT nS dP nV nG d
d i i i dT nS d dP nV d nG d P konstan dP = 0 T konstan dT = 0
i i i d nG d (T dan P konstan)
i i i P , T nGKarena nG merupakan state function, maka ruas kanan persamaan tersebut merupakan pernyataan diferensial eksak; sehingga
P , T t P , T i i i G nG iii menyatakan kecepatan perubahan energi Gibbs
total dari sistem akibat perubahan koordinat reaksi pada T dan P konstan.
Gambar 1 menunjukkan bahwa besaran ini sama dengan nol pada keadaan keseimbangan.
Oleh karena itu kriteria untuk keseimbangan reaksi kimia adalah: 0 i i i (4) (5) 32
Definisi fugasitas suatu komponen dalam larutan:
ii
i T RT lnfˆ
(6)
Energi bebas Gibbs untuk komponen murni i pada keadaan standar dan temperatur yang sama:
0 i i 0 i T RTlnf G (7)Selisih antara kedua persamaan di atas adalah:
0 i i 0 i i f fˆ ln RT G (8)
34 0 i i 0 i i f fˆ ln RT G 0 i i 0 i i f fˆ ln RT G
Jika pers. (8) disubstitusikan ke pers. (5) maka akan diperoleh persamaan untuk keadaan keseimbangan pada reaksi kimia:
0 f fˆ ln RT G i i0 i 0 i i
fˆ f 0 ln RT G i 0 i i i 0 i i i
RT G f fˆ ln i 0 i i 0 i i i i (9) (11) (10)
i 0 i i i 0 i i i i 0 i i i i f fˆ ln RT f fˆ ln RT f fˆ ln RT 3 2 1 0 3 3 0 2 2 0 1 1 f fˆ ln f fˆ ln f fˆ ln RT 3 2 1 0 3 3 0 2 2 0 1 1 f fˆ f fˆ f fˆ ln RT i 0 i i i f fˆ ln RT 360 f fˆ ln RT G i 0 i i i i 0 i i
fˆ f 0 ln RT G i 0 i i i 0 i i i RT G f fˆ ln i 0 i i 0 i i i i i 0 i i 0 i i i f G fˆ ln RT i38
RT G K ln f fˆ ln i 0 i i 0 i i i i RT G K ln i 0 i i RT G exp K i 0 i iDalam bentuk eksponensial, persamaan (11) menjadi (12)
fˆ f0 i K i i i RT G exp K 0Pers. (13) ini mendefinisikan K; yang juga dapat dinyatakan dengan: RT G K ln 0 (13) (14)
Karena G
i0merupakan property dari komponen murni
i pada keadaan standar dan tekanan tetap, maka
nilainya hanya tergantung pada temperatur.
Menurut pers. (15)
G
0, dan juga K, hanya merupakan
fungsi dari temperatur.
K disebut konstanta keseimbangan reaksi;
i
iG
i0,
dinyatakan dengan
G
0, disebut perubahan energi
Gibbs standar dari reaksi.
G
0juga didefisinikan dengan:
i 0 i i 0 G G(15)
Rasio fugasitas pada pers. (12) menyatakan
hubungan antara keadaan keseimbangan dengan
keadaan standar dari masing-masing komponen.
Keadaan standar itu sembarang, tetapi harus selalu
pada temperatur keseimbangan T.
Keadaan standar harus sama untuk semua
komponen yang terlibat dalam suatu reaksi kimia.
Untuk suatu komponen, keadaan standar yang
dinyatakan dengan G
i0harus sama dengan keadaan
Fungsi G0 =
i i Gi0 dalam pers. (15) merupakan selisih
antara energi Gibbs produk and reaktan (dikalikan dengan koefisien stoikiometri) jika masing-masing berada dalam keadaan standar pada temperatur yang sama.
Nilai G0 untuk suatu reaksi dapat dihitung apabila
temperaturnya sudah ditentukan. Nilainya tidak tergantung pada tekanan dan komposisi keseimbangan.
Perubahan property standar lainnya dapat ditentukan dengan cara yang sama.
Untuk property umum M:
0 i 0 M M (16) 42
Sebagai contoh, hubungan antara panas reaksi
standar dan perubahan energi Gibbs dari reaksi dapat
ditulis untuk komponen i pada keadaan standar:
dT RT G d RT H 0 i 2 0 i Pada pers. (17) digunakan derivat total karena
property pada keadaan standar hanya merupakan
fungsi dari temperatur.
Jika pers. (17) dikalikan dengan i dan dijumlahkan untuk semua komponen: dT RT G d RT H i 0 i i 2 i 0 i i (18)
dT RT G d RT H 0 2 0 (19) atau: 44Karena temperatur keadaan standar adalah temperatur campuran keseimbangan, maka perubahan property
standar dari reaksi, seperti G0 dan H0, bervariasi dengan temperatur keseimbangan.
Ketergantungan G0 pada T dinyatakan dengan pers.
(17), yang juga dapat ditulis sebagai:
2 0 0 RT H dT RT G d Sementara itu, pers. (14) menyatakan
(14) RT G K ln 0 46 (20)
RT G d K ln d 0 Diferensiasi pers. (14):Jika pers. (20) disubtitusikan ke persamaan terakhir:
2 0 RT H dT K ln d (21)Pers. (21) menyatakan pengaruh temperatur
terhadap konstanta keseimbangan, dan juga
konversi keseimbangan.
Jika
H
0< 0 (eksotermis)
K turun ketika T naik
Jika
H
0> 0 (endotermis)
K naik ketika T naik
Jika
H
0dianggap tidak tergantung pada T, integrasi
pers. (21) dari temperatur T' ke T akan
menghasilkan:
' T 1 T 1 R H ' K K ln 0(22)
48Akan tetapi, jika H0 tergantung pada T, sebagaimana
dinyatakan dalam persamaan (11) di bab sebelumnya:
2 0 RT H dT K ln d T T P 0 0 0 dT R C R H H dT dT R C T 1 RT H K ln d T T P 2 0 0 50
dT dT R C T 1 RT H K ln d T T P 2 0 0 T T T T P 2 0 K ln K ln 0 0 0 dT dT R C T 1 RT H K ln d T T T T P 2 0 0 0 0 dT dT R C T 1 RT H K ln K ln T T T T P 2 0 0 0 0 dT dT R C T 1 RT H K K ln
52 T T T T P 2 0 0 0 0 dT dT R C T 1 RT H K K ln T T T T P 2 0 0 0 0 dT dT R C T 1 RT H exp K K T T T T P 2 0 0 0 0 dT dT R C T 1 RT H exp K K
T T T T P 2 0 0 0 0 dT dT R C T 1 RT H exp K K T T T T P T T 2 0 0 0 0 0 dT dT R C T 1 exp dT RT H exp K K K1 K2 T T T T T T P 2 0 0 0 0 0 dT dT R C T 1 dT RT H exp K K
Integrasi dari T0 ke T menghasilkan: 2 1 0 K K K K 0 0 0 0 RT G exp K 1 1 RT H exp T T 1 RT H exp K 0 0 0 0 0 0 0 1
0 2 2 1 T B 2 1 1 ln A exp K
2 2 2 0 2 2 0 1 T D 2 1 2 1 T C 6 1 (23) (24) (25) (26) 54CONTOH
Hitung konstanta keseimbangan untuk hidrasi fasa uap
etilena pada temperatur 418,15 K dan 593,15K.
SOLUTION
Reaction:
C2H4 H2O C2H5OH – 1 – 1 + 1 A 1,424 3,470 3,518 B 14,394 10-3 4,450 10-3 20,001 10-3 C – 4,392 10-6 0 – 6,002 10-6 D 0 0,121 105 0 H0 f,298 52.510 – 241.818 – 235.100 G0 f,298 68.460 – 228.572 – 168.490 56
376 , 1 470 , 3 424 , 1 518 , 3 A
3 3 10 157 , 4 10 450 , 1 394 , 14 001 , 20 B
6 6 10 610 , 1 10 000 , 0 392 , 4 002 , 6 C
5 5 10 121 , 0 10 121 , 0 000 , 0 000 , 0 D
1 0 298 235.100 52.510 241.818 45.792 J mol H
1 0 298 168.490 68.490 228.572 8.378 J mol G
8,314
298,15
29,366 378 . 8 exp RT G exp K 0 0 0 0 Untuk T = 418,15K T T 1 RT H exp K 0 0 0 0 1
418,15 4,985 10 3 15 , 298 1 15 , 298 314 , 8 792 . 45 exp 4025 , 1 15 , 298 15 , 418 T T 0 9860 , 0 K2
3
1 2 1 0 K K 29,366 4,985 10 0,9860 1,443 10 K K 58Untuk T = 593.15K T T 1 RT H exp K 0 0 0 0 1