N-HEKSANA DAUN BINAHONG (Anredera cordifolia (Ten.) Steenis)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi
Program Studi Farmasi
Oleh:
Margaretha Efa Putri
NIM : 088114075
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
N-HEKSANA DAUN BINAHONG (Anredera cordifolia (Ten.) Steenis)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi
Program Studi Farmasi
Oleh:
Margaretha Efa Putri
NIM : 088114075
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iii
Karya Kecil ini KupersembahKan untuK:
Guru sejatiku, Yesus, yang senantiasa mengajar, membimbing, dan
menyertai setiap langkahku.
Orang tuaku tercinta, Mama Kanthi dan Papa Tri yang senantiasa
mendoakan, mendukung, dan membimbingku dengan penuh
kesabaran, cinta, dan kasih sayang yang tak ada habisnya.
Serta adik-adikku tersayang, Satrio, Hiro, dan Agung yang terus
memberiku kasih sayang dan semangat.
“Dalam hal inilah Bapa-Ku dipermuliakan,
yaitu jika kamu berbuah banyak dan dengan
vii
Segala pujian dan syukur penulis haturkan kepada Tuhan karena hanya
dengan berkat dan pertolongan-Nya, penulis dapat menyelesaikan penelitian dan
penyusunan skripsi yang berjudul ”Identifikasi Senyawa Fraksi IV Ekstrak n-Heksana Daun Binahong (Anredera cordifolia (Ten.) Steenis)”. Skripsi ini disusun guna memenuhi salah satu syarat untuk memperoleh gelar Sarjana Strata
Satu Program Studi Farmasi (S.Farm) pada Fakultas Farmasi Universitas Sanata
Dharma, Yogyakarta.
Selama penelitian hingga penyusunan skripsi ini, penulis banyak
mendapat bantuan dari berbagai pihak berupa bimbingan, pengarahan, saran,
dukungan, maupun sarana. Oleh karena itu, penulis ingin menyampaikan
penghargaan dan ucapan terima kasih kepada:
1. Ibu Lucia Wiwid Wijayanti, M.Si. selaku Dosen Pembimbing yang telah
memberikan petunjuk, saran, arahan, dan bimbingan kepada penulis dalam
proses penyusunan skripsi ini,
2. Bapak Yohanes Dwiatmaka, M.Si. dan Pak Enade Perdana Istyastono, Ph.D,
Apt. selaku Dosen Penguji skripsi yang telah memberikan saran dan masukan
demi kesempurnaan skripsi ini,
3. Bapak Ipang Djunarko, M.Sc., Apt. selaku Dekan dan segenap dosen Fakultas
Farmasi Universitas Sanata Dharma Yogyakarta,
4. Bapak-bapak Laboran dan staf laboratorium yang telah membantu dalam
proses penyelesaian skripsi di laboratorium Fakultas Farmasi Universitas
viii
Spectrometer (GC-MS) Fakultas MIPA Universitas Gadjah Mada, yang telah
membantu proses pengerjaan kromatografi gas-spektrometri massa serta
diskusi yang membantu dalam pengerjaan penelitian ini,
6. Semua keluarga yang selalu mendukung dan menyemangati dalam suka dan
duka selama proses pengerjaan skripsi,
7. Wilfrida, teman sekelompok skripsi yang telah membantu dan menemani
selama proses pengerjaan skripsi,
8. Bu Yuli dan beberapa pihak lain yang telah bersedia menyumbangkan banyak
sampel daun binahong,
9. Seluruh teman-teman dari fakultas farmasi USD, khususnya kelas B angkatan
2008 dan FST 2008 yang telah banyak berbagi keceriaan dan kesedihan,
10. Semua teman-teman, yang selalu mendukung, menemani dan menyemangati
11. Serta semua pihak yang telah membantu penyusunan skripsi ini yang tidak
dapat disebutkan satu per satu.
Penulis menyadari bahwa penulisan skripsi ini masih banyak kekurangan
dan kelemahan karena keterbatasan kemampuan dan pengalaman penulis. Untuk
itu penulis mengharapkan saran dan kritik yang membangun dari semua pihak.
Akhir kata semoga skripsi ini dapat berguna dan bermanfaat bagi pembaca semua,
ix
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PERSEMBAHAN ... iii
HALAMAN PENGESAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
PERNYATAAN PERSTUJUAN PUBLIKASI KARYA ILMIAH ... vi
PRAKATA ... vii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xvii
INTISARI ... xviii
ABSTRACT ... xix
BAB I PENGANTAR ... 1
A. Latar Belakang Masalah ... 1
B. Permasalahan ... 4
C. Keaslian Penelitian ... 5
D. Tujuan Penelitian ... 6
E. Manfaat Penelitian ... 6
x
BAB II PENELAAHAN PUSTAKA ... 8
A. Tanaman Binahong (Anredera cordifolia (Ten.) Steenis) ... 8
B. Ekstraksi ... 10
C. Metabolit Sekunder pada Tanaman... 11
1. Senyawa Fenolik ... 11
2. Alkaloid ... 15
3. Terpenoid ... 16
D. Kromatografi Kolom ... 18
E. Kromatografi Lapis Tipis ... 22
F. Kromatografi Lapis Tipis Preparatif ... 24
G. Elusidasi Struktur ... 27
1. Kromatografi gas-spektrometri massa ... 27
2. Spektrometri ultraviolet-sinar tampak (UV-Vis) ... 31
H. Kandungan Binahong ... 37
I. Landasan Teori ... 39
J. Hipotesis ... 41
BAB III METODE PENELITIAN ... 42
A. Jenis dan Rancangan Penelitian ... 42
B. Variabel dan Definisi Operasional ... 42
1. Klasifikasi Variabel ... 42
2. Definisi Operasional ... 42
xi
E. Tata Cara Penelitian ... 44
1. Determinasi Tanaman Binahong ... 44
2. Preparasi Sampel ... 44
3. Uji pendahuluan ekstrak ... 45
4. Fraksinasi ekstrak n-heksan daun binahong dengan kromatografi kolom (KK) ... 48
5. Isolasi dengan kromatografi lapis tipis preparatif (KLTP) ... 50
6. Elusidasi Struktur ... 52
F. Analisis Hasil ... 52
BAB IV HASIL DAN PEMBAHASAN ... 54
A. Determinasi Tanaman ... 54
B. Preparasi Serbuk Simplisia Daun Binahong ... 54
C. Ekstraksi Serbuk Simplisia Daun Binahong ... 57
D. Uji Pendahuluan Ekstrak ... 58
1. Identifikasi flavonoid ... 58
2. Identifikasi tanin ... 60
3. Identifikasi alkaloida ... 62
4. Identifikasi saponin ... 65
5. Identifikasi triterpenoid dan steroid ... 66
E. Isolasi dengan Kromatografi Kolom ... 70
1. Optimasi fase gerak KK dengan metode pendekatan KLT ... 71
xii
F. Isolasi dengan Kromatografi Lapis Tipis Preparatif (KLTP) ... 80
G. Kromatografi Gas-Spektrometri Massa (KG-SM) ... 83
H. Spektroskopi Ultraviolet-Visibel (UV-Vis) ... 100
I. Analisis Hasil ... 106
BAB V PENUTUP ... 109
A. Kesimpulan ... 109
B. Saran ... 109
DAFTAR PUSTAKA ... 110
LAMPIRAN ... 114
xiii
Tabel I. Warna flavonoid dengan sinar tampak dan sinar
ultraviolet ... 14
Tabel II. Klasifikasi sinar tampak dengan warna komplementernya ... 32
Tabel III. Hasil identifikasi flavonoid dengan KLT ... 60
Tabel IV. Hasil identifikasi alkaloid dengan KLT ... 65
Tabel V. Hasil KLT identifikasi triterpenoid dan steroid ... 68
Tabel VI. Hasil uji fitokimia ekstrak n-heksan daun binahong ... 69
Tabel VII. Kepolaran fase gerak yang digunakan ... 72
Tabel VIII. Hasil KLT ekstrak dengan berbagai fase gerak ... 74
Tabel IX. Hasil KLT eluat dari kromatografi kolom ... 77
Tabel X. Hasil identifikasi fraksi IV dengan KLT ... 79
Tabel XI. Hasil KLTP ... 81
Tabel XII. Uji kemurnian isolat ... 83
Tabel XIII. Hasil Kromatografi Gas-Spektrometri Massa ... 99
Tabel XIV. Panjang gelombang maksimum isolat dalam spektra UV-Vis dengan pelarut kloroform... 102
Tabel XV. Spektra UV-Vis beberapa karotenoid dalam pelarut kloroform ... 102
xiv
Gambar 1. Tanaman binahong (Anredera cordifolia (Ten.) Steenis) .. 8
Gambar 2. Struktur fenol ... 12
Gambar 3. Kerangka umum senyawa golongan flavonoid ... 12
Gambar 4. Proses kromatografi kolom ... 19
Gambar 5. Proses kromatografi lapis tipis ... 22
Gambar 6. Skema peralatan spektrofotometer massa ... 27
Gambar 7. Skema peralatan kromatografi gas-spektrofotometer massa ... 31
Gambar 8. Transisi elektronik oleh sinar UV-Vis ... 33
Gambar 9. Skema peralatan spektrofotometer UV-Vis ... 36
Gambar 10. Beberapa senyawa boussingosida dalam daun binahong .. 38
Gambar 11. Hasil uji flavonoid dengan serbuk seng dan magnesium ... 59
Gambar 12. Hasil KLT identifikasi flavonoid ... 59
Gambar 13. Hasil reaksi uji identifikasi tanin dengan FeCl3 ... 60
Gambar 14. Hasil uji identifikasi tanin dengan larutan gelatin ... 61
Gambar 15. Hasil Uji Identifikasi Alkaloid dengan Wagner LP ... 62
Gambar 16. Hasil Uji Identifikasi Alkaloid dengan Mayer LP ... 63
Gambar 17. Hasil Uji Identifikasi Alkaloid dengan Dragendorff LP ... 63
Gambar 18. Hasil KLT identifikasi alkaloid dengan reagen Dragendorff ... 64
xv
Gambar 21. Hasil uji identifikasi triterpenoid dan steroid ... 67
Gambar 22. Identifikasi triterpenoid dan steroid dengan KLT ... 68
Gambar 23. Hasil KLT ekstrak dengan berbagai fase gerak ... 73
Gambar 24. Kromatografi Kolom Ekstrak n-Heksan Daun Binahong .. 76
Gambar 25. Hasil KLT masing-masing eluat dari kromatografi kolom ... 76
Gambar 26. Hasil uji identifikasi fraksi IV ekstrak n-heksan daun binahong ... 79
Gambar 27. Hasil KLTP ... 81
Gambar 28. Isolat pekat dari proses isolasi ... 82
Gambar 29. Uji kemurnian isolat ... 82
Gambar 30. Kromatogram KG-SM isolat ... 84
Gambar 31. Spektra peak 1 KG-SM isolat... 86
Gambar 32. Struktur Naftalen ... 87
Gambar 33. Spektra peak 3 KG-SM isolat ... 87
Gambar 34. Fragmentasi 1-alkena ... 87
Gambar 35. Fragmentasi senyawa 1-pentadekena ... 88
Gambar 36. Spektra peak 4 KG-SM isolat... 89
Gambar 37. Fragmentasi senyawa 1-oktadekena ... 90
Gambar 38. Spektra peak 8 KG-SM isolat... 91
xvi
Gambar 41. Fragmentasi trikosanol dengan pemutusan-α dan tata
ulang hidrogen ... 94
Gambar 42. Spektra peak 11 KG-SM isolat ... 94
Gambar 43. Fragmentasi senyawa siklotetrakosana ... 95
Gambar 44. Spektra peak 14 KG-SM isolat ... 96
Gambar 45. Fragmentasi bis-(2-etilheksil) ftalat... 97
Gambar 46. Spektra peak 16 KG-SM isolat ... 98
Gambar 47. Fragmentasi senyawa 1-oktadekana ... 99
Gambar 48. Spektra UV-Vis isolat dengan pelarut kloroform... 101
Gambar 49. Struktur lutein ... 103
Gambar 50. Spektra UV-Vis isolat dengan pelarut metanol ... 104
xvii
Lampiran 1. Surat Determinasi Binahong
(Anredera cordifolia (Ten.) Steenis) ... 114
Lampiran 2. Perhitungan Rendemen Ekstrak ... 115
Lampiran 3. Perhitungan Kepolaran Kloroform:Methanol (1:1) ... 115
Lampiran 4. Contoh Perhitungan Nilai Rf KLT ... 115
Lampiran 5. Hasil Kromatografi Gas-Spektrometri massa ... 116
Lampiran 3. Spektrum UV/Vis ... 141
xviii
Penelitian ini dilakukan untuk mengetahui struktur salah satu senyawa metabolit sekunder dalam fraksi IV ekstrak n-heksana daun binahong (Anredera cordifolia (Ten.) Steenis). Informasi mengenai struktur senyawa yang terkandung tanaman ini dapat digunakan untuk mengembangkan obat baru. Senyawa ini dapat juga berguna dalam proses standardisasi untuk mendapatkan bukti dalam pengembangan obat tradisional.
Fraksi IV ekstrak n-heksana daun binahong didapatkan melalui proses pemisahan pada proses kromatografi kolom dengan fase diam silika dan fase gerak kloroform. Identifikasi senyawa dalam fraksi IV dilakukan dengan uji fitokimia. Elusidasi struktur senyawa yang terkandung dalam isolat, dilakukan dengan KG-SM dan Spektrometri UV-Vis. Isolat didapatkan dari pemisahan fraksi IV dalam proses kromatografi lapis tipis preparatif dengan fase diam silika dan fase gerak kloroform.
Dari hasil uji fitokimia, didapatkan bahwa fraksi IV mengandung steroid. Elusidasi struktur menunjukkan bahwa isolat mengandung lutein dan senyawa steroid dengan kerangka kolesta-2,4-diena, pentadekena, heptadekena, 1-oktadekena, 4-tetradekanol, trikosil alkohol, dan n-oktadekana.
Kata Kunci: Identifikasi Senyawa, Ekstrak n-Heksana, Daun Binahong,
xix
This research was conducted to determine the structure of one of the secondary metabolites in fourth fraction of n-hexane’s extract of binahong leaf (Anredera cordifolia (Ten.) Steenis). The information about the structure of compounds discovered in this plant could be used as a lead in developing new medicines. The compounds could also be useful in the standardization process in order to gather evidences in the development of traditional medicine.
The fourth fraction of n-hexane extract was obtained by separation at a column chromatography process with silica as the stationary phase and chloroform as the mobile phase. Identification of compounds in the fourth fraction was conducted by phytochemical screening. Structure elucidation of the compounds discovered in the isolate was conducted by GC-MS and UV-Vis spectrometry. Isolate was obtained by the fourth fraction separation in a preparative thin layer chromatography process with silica as the stationary phase and chloroform as the mobile phase.
From the phytochemical screening, it was discovered that the fourth fraction contains steroid. Structure elucidation showed that the isolate contained lutein and compounds of a steroid with cholesta-2,4-diene skeleton, 1-pentadecene, 1-heptadecene, 1-octadecene, 4-tetradecanol, tricosyl alcohol, and n-octadecane.
Keywords: Compounds Identification, n-Hexane Extract, Binahong Leaves,
1
PENGANTAR
A.Latar Belakang Masalah
Dewasa ini, penemuan obat baru tidak lagi dilakukan dengan coba-coba,
melainkan dengan mengembangkan senyawa-senyawa aktif yang telah ada.
Penemuan senyawa obat baru memiliki proses yang relatif lama dan rumit.
Banyak usaha pengembangan obat dilakukan dengan mengeksplorasi senyawa
aktif dari sumber daya alam yang banyak tersedia, misalnya tumbuhan. Senyawa
aktif yang banyak dikembangkan ini merupakan hasil metabolisme sekunder
tanaman. Metabolit sekunder inilah yang banyak bertanggung jawab pada efek
farmakologis pada manusia. Metabolit sekunder tiap tanaman berbeda, sehingga
khasiat tiap-tiap tanaman pun berbeda.
Banyak analisis tumbuhan dipusatkan pada isolasi dan identifikasi
kandungan metabolit sekunder dalam kelompok jenis tumbuhan. Analisis ini
bertujuan untuk menemukan beberapa kandungan yang merupakan senyawa baru
ataupun tidak biasa. Selain itu, tujuan dilakukannya analisis fitokimia adalah
untuk menentukan senyawa aktif penyebab efek racun maupun bermanfaat
(Harborne, 1984).
Daun tanaman binahong (Anredera cordifolia (Ten.) Steenis) atau
madeira vine dipercaya dapat mengobati kerusakan ginjal, diabetes,
pembengkakan jantung, muntah darah, tifus, wasir, rematik, pemulihan pasca
darah, sembelit, sesak napas, sariawan berat, pusing-pusing, sakit perut,
menurunkan panas tinggi, menyuburkan kandungan, maag, asam urat, keputihan,
pembengkakan hati, meningkatkan vitalitas dan daya tahan tubuh (Manoi, 2009).
Khasiat yang dipercaya ini, harus dapat dibuktikan melalui suatu penelitian bahwa
kandungan metabolit sekunder di dalam daun binahong dapat memenuhi khasiat
tersebut. Daun binahong menurut hasil penelitian sebelumnya secara kultur in
vitro mengandung flavonoid, alkaloid, terpenoid, dan saponin (Manoi, 2009).
Flavonoid, alkaloid, terpenoid, dan saponin merupakan suatu cara
penggolongan senyawa, dimana masing-masing golongan memiliki banyak
anggota senyawa. Oleh karena itu, dilakukan penelitian ini agar diketahui
kandungan senyawa metabolit sekunder dalam tanaman binahong.
Senyawa yang diteliti pada penelitian ini, dikhususkan pada
senyawa-senyawa metabolit sekunder yang non-polar yang larut dalam pelarut n-heksana
dalam ekstraksi daun tanaman binahong yang digunakan. Senyawa metabolit
sekunder yang non-polar yang kemungkinan besar terekstraksi ke dalam ekstrak
n-heksana daun binahong, terdiri dari golongan triterpenoid dan steroid.
Terpenoid diketahui sangat berguna bagi penyembuhan beberapa
penyakit seperti;
1. glikosida jantung sebagai peningkat kontraksi jantung,
2. saponin-spirostane, sitosterol, dan stigmasterol, untuk pengobatan steroidal
agen antiinflamasi, analgesik, dan sebagainya (Bruneton, 1999).
Aktivitas farmakologis dari triterpenoid dan steroid yaitu sebagai agen
antiinflamasi berkaitan erat dengan aktivitas farmakologis daun binahong sebagai
agen penyembuh luka. Sehingga muncul dugaan bahwa aktivitas daun binahong
sebagai penyembuh luka disebabkan oleh kandungan senyawa golongan
triterpenoid dan steroid. Oleh karena itu, penelitian ini dilakukan untuk
mengetahui adanya triterpen dan steroid, dengan menganalisis struktur salah satu
senyawanya.
Analisis struktural dari salah satu senyawa yang terdapat dalam ekstrak
n-heksana daun binahong dilakukan dengan metode elusidasi. Hal ini untuk
memastikan senyawa yang terkandung dalam daun binahong. Penelitian struktur
senyawa ini bermanfaat dalam pengembangan obat dengan menggunakan
senyawa dari tanaman sebagai senyawa penuntun (lead compound) yang
bermanfaat dalam mensintesis senyawa baru yang memiliki efek farmakologis.
Selain itu, informasi struktur senyawa dari tanaman ini berguna untuk
mengembangkan obat tradisional yang semula berdasarkan pada keterangan
empiris, yaitu pengalaman yang diajarkan secara turun-temurun, berubah menjadi
obat tradisional yang memiliki khasiat berdasarkan bukti penelitian (evidence
based), serta sebagai awal dari proses standardisasi obat tradisional.
Bahan dari alam terutama tumbuhan, mengandung sangat banyak
senyawa didalamnya. Oleh karena itu, dalam menganalisis struktur salah satu
beberapa pemisahan yang dilakukan dengan proses kromatografi kolom yang
dilanjutkan dengan kromatografi lapis tipis preparatif.
Dari hasil kromatografi kolom eluat dikelompokkan menjadi 5 fraksi.
Fraksi I telah dianalisis oleh Du’a (2012), yaitu gabungan eluat dengan profil KLT
(kromatografi lapis tipis) dengan Rf 0,86-0,92 pada fase diam silika gel dan fase
gerak kloroform. Fraksi II, III, dan V tidak dianalisis karena berwarna hijau,
sehingga diperkirakan mengandung klorofil. Oleh karena itu, fraksi IV yang
dianalisis dalam penelitian ini.
Untuk menganalisis kandungan dalam fraksi IV, dilakukan isolasi
lanjutan dengan kromatografi lapis tipis, sehingga dapat dihasilkan isolat yang
murni secara KLT. Analisis struktur senyawa kimia dalam isolat tersebut dapat
dilakukan dengan menggunakan spektrofotometri massa (MS) dan
spektrofotometri Ultraviolet-Visibel (UV-VIS).
B.Permasalahan
Dari latar belakang di atas, maka dapat disimpulkan bahwa permasalahan
yang dijumpai adalah:
1. Golongan senyawa metabolit sekunder apakah yang terkandung dalam fraksi
IV ekstrak n-heksana daun binahong?
2. Bagaimanakah struktur dari senyawa metabolit sekunder yang terkandung di
Penelitian yang telah dilakukan terhadap daun binahong lebih banyak
terkonsentrasi pada pengujian efek ekstraknya. Telah dilakukan penelitian
penetapan kadar asam ursolat dalam ekstrak kloroform daun binahong dengan
metode kromatografi cair kinerja tinggi fase terbalik (Wibisono, 2010). Dalam
penelitian tersebut dinyatakan bahwa dari kromatogram yang didapat, waktu
retensi salat satu peak sama dengan waktu retensi baku asam ursolat. Maka,
penelitian ini tidak sama dengan penelitian yang dilakukan Wibisono (2010).
Penelitian yang telah dilakukan untuk mengidentifikasi senyawa kimia
dilakukan secara in vitro yang mengidentifikasikan adanya flavonoid, alkaloid,
terpenoid, dan saponin dalam daun Binahong (Manoi, 2009).
Penelitian lain dilakukan untuk mengisolasi senyawa triterpenoid dari
ekstrak metanol, dilakukan oleh Muhammad (2011) dan Saroh, Winarti, dan
Djamil (2012), yang didapatkan senyawa yang mirip dengan boussingosida
(Muhamad, 2011) serta diperkirakan terdapat senyawa adenin. Djamil, Wahyudi,
Wahono, dan Hanafi (2012), berhasil mengisolasi dan mengidentifikasi
8-glucopyranosyl-4’,5,7,-trihydroxyflavone dari ekstrak methanol daun binahong.
Ketiga penelitian ini berbeda dengan penelitian yang dilakukan, dimana
identifikasi akan dilakukan pada ekstrak n-heksana daun Binahong. Karena
polaritas metanol dan n-heksana sangat berbeda, maka diperkirakan kandungan
senyawa dalam kedua ekstrak tersebut berbeda.
Penelitian terbaru dilakukan oleh Facrhiyah dan Kusrini (2012) yang
dengan metode kromatografi kolom dan kromatografi lapis tipis preparatif. Isolat
yang didapatkan dianalisis strukturnya dan didapatkan senyawa stigmasterol.
Penelitian ini berbeda dengan penelitian ini mengingat bahwa di dalam ekstrak n
-heksana masih terdapat banyak senyawa lain yang tidak teridentifikasi oleh
Facrhiyah dan Kusrini (2012).
D.Tujuan Penelitian
Tujuan dilakukan penelitian ini adalah untuk mengetahui golongan
senyawa serta untuk mengetahui struktur dari salah satu senyawa metabolit
sekunder yang terkandung dalam fraksi IV ekstrak n-heksana daun binahong.
E.Manfaat Penelitian 1. Manfaat praktis
Manfaat dilakukannya penelitian ini adalah untuk mendapatkan informasi
mengenai salah satu kandungan senyawa dari daun tanaman binahong.
2. Manfaat teoretis
Manfaat teoretis dilakukannya penelitian ini adalah untuk
mengembangkan senyawa obat baru dengan memodifikasi struktur (sebagai lead
compound). Selain itu, serta sebagai awal dalam proses standardisasi obat
tradisional dan pengembangan obat tradisional yang berdasarkan pada bukti
penelitian (evidence based). Obat tradisional yang berdasarkan penelitian
tanaman dan kadar zat berkhasiat dalam tanaman. Penelitian ini merupakan awal
dari standarisasi dimana, sebelum menetapkan profil farmakologis dan kadar zat
8
BAB II
PENELAAHAN PUSTAKA
A.Tanaman Binahong (Anredera cordifolia (Ten.) Steenis)
Gambar 1. Tanaman binahong
Tanaman binahong atau Anredera cordifolia (Ten.) Steenis, menurut
Wagner et al (cit. Starr, Starr, and Loope, 2003) masuk dalam family Basellaceae dan
genus Anredera yang terdiri dari 5-10 spesies dari Amerika bagian tropis. Anredera
cordifolia (Ten.) Steenis memiliki sinonim Bossingaultia cordifolia Ten.:
Boussingaultia gracilis Miers: serta Boussingaultia pseudobasselloides Haum. Nama
umum yang sering digunakan yaitu: Madeira vine, mignonette vine, lamb’s tail, serta
Tanaman binahong merupakan tanaman sepanjang tahun, tanaman
merambat, menutup semak atau tanah. Batang ramping, melilit, dan tanpa bulu
hingga sekitar 30 meter panjangnya, awalnya berwarna hijau kemerahan dan berupa
herba (berbatang basah), kemudian menjadi coklat, mengelupas dan menjadi berkayu
dan mencapai diameter 2–3 cm. Madeira vine menghasilkan umbi berdaging pada
kedua akar (rimpang dengan diameter sekitar 20 cm) dan pada buku-buku batangnya.
Umbi pada batang ini seperti kutil kecil yang tidak teratur berwarna cokelat terang
atau hijau dan variasi ukuran dengan diameter 5 mm-25 cm, sering membawa
sejumlah tunas pada ketiak daun. Daun subsessile atau hampir duduk pada batang,
berbentuk jantung atau dengan tangkai daun hingga 1–12 cm (dan jarang di atas 15
cm) panjangnya, secara luas berbentuk bulat telur, kadang berbentuk lanset, maupun
berbentuk jantung, berdaging hingga berair tergantung pada paparan; ujung daun
tumpul. Helaian daun berwarna hijau terang, hijau gelap pada permukaan atas,
mengkilap, terasa basah ketika disentuh, 1–15 cm panjangnya dan 0.8–11 cm
lebarnya (Smith, Lawson, Turnbull, dan Downey, 2007).
Bracteola atas rata dengan bunga, bulat hingga elips, bunga tandan tidak
bercabang atau bercabang 2-4 dengan malai tipis, panjang 4-25 cm; bractea lebih
rendah dari tangkai bunga, gigih; tangkai bunga 1,5-2 mm; bracteola terendah
berwarna putih kehijauan, sedikit lebih pendek dari perianth (kelopak dan mahkota
bunga), perianth berwarna putih, tingginya 5,5-8 mm, cuping bulat telur-lonjong,
Amerika Selatan, di Jawa dibudidayakan pada ketinggian rendah (Backer dan Van
den Brink, 1965).
Daun tanaman binahong atau madeira vine dipercaya dapat mengobati
kerusakan ginjal, diabetes, pembengkakan jantung, muntah darah, tifus, wasir,
rematik, pemulihan pasca operasi, pemulihan pasca melahirkan, menyembuhkan
segala luka dalam dan khitanan, radang usus, melancarkan dan menormalkan
peredaran dan tekanan darah, sembelit, sesak napas, sariawan berat, pusing-pusing,
sakit perut, menurunkan panas tinggi, menyuburkan kandungan, maag, asam urat,
keputihan, pembengkakan hati, meningkatkan vitalitas dan daya tahan tubuh (Manoi,
2009).
B.Ekstraksi
Ekstraksi merupakan penarikan zat utama yang diinginkan dari bahan
mentah obat dengan menggunakan pelarut yang dapat melarutkan zat yang diinginkan
tersebut (Ansel, 2005). Direktorat Jendral Pengawasan Obat dan Makanan RI (1995)
dalam farmakope IV menyatakan bahwa : “Ekstrak adalah sediaan pekat yang
diperoleh dengan mengekstrasi zat aktif dari simplisia nabati atau simplisia hewani
menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut
diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian hingga
memenuhi baku yang ditetapkan”.
Pemilihan pelarut penting untuk menentukan senyawa metabolit eksoseluler
rendah sebagian besar hanya mengekstraksi metabolit eksoseluler saja. Tetapi pada
pelarut alkoholik dapat memecah membran sel dan mengekstraksi sebagian besar
material endoseluler (Colegate dan Molyneux, 1993).
Telah diketahui sebelumnya bahwa senyawa organik hanya dapat cenderung
larut dalam pelarut organik daripada larut dalam air, serta garam anorganik hanya
dapat larut dalam air. Hanya senyawa organik yang memiliki gugus polar seperti
hidroksil, sulfonat, nitrat dan gugus hidrofilik lainnya yang memiliki kemungkinan
yang cukup tinggi untuk larut dalam air (Basset, Denney, Jeffery, Mendham, 1994).
C.Metabolit Sekunder pada Tanaman 1. Senyawa fenolik
Senyawa fenolik merupakan suatu senyawa yang setidaknya memiliki satu
gugus aromatis yang terikat setidaknya satu gugus hidroksil, bebas, ataupun terikat
dengan gugus yang lain. Beberapa fenol dapat dilihat secara kasat mata, atau dapat
dilihat dibawah sinar UV ataupun dengan reaksi warna. Senyawa fenolik biasanya
berada dalam ekstrak etanolik suatu tumbuhan (Bruneton, 1999). Cara klasik untuk
mendeteksi senyawa fenol sederhana ialah dengan menambahkan larutan besi (III)
klorida 1 % dalam air atau etanol kepada larutan cuplikan, yang menimbulkan warna
O H
Gambar 2. Struktur fenol
Secara umum, fenol larut dalam pelarut organik polar, larut di natrium
hidroksida, dan larutan karbonat. Asam fenolat larut dengan bikarbonat dan dapat
diekstraksi dengan pelarut organik dengan kondisi sedikit asam. Glikosida dari
komponen fenolik, umumnya larut di air. Semua senyawa fenolik tidak stabil. Semua
fenol dapat dengan segera teroksidasi khususnya pada kondisi basa (Bruneton, 1999).
a.Flavonoid. Flavonoid hampir selalu larut dalam air. Flavonoid adalah
senyawa yang bertanggung jawab pada pembentukkan warna pada tanaman.
Flavonoid yang tidak berwarna berkontribusi pada warna tanaman sebagai
kopigment: sebagai contoh kopigmen flavon dan flavonol yang tidak berwarna
melindungi antosianin. Dalam beberapa kasus, molekul menyerap daerah spektrum
dekat UV, yang berfungsi sebagai atraktan pada beberapa jenis serangga (Bruneton,
1999). .
O
O
Secara umum glikosida larut di air dan alkohol, hanya beberapa senyawa
yang sukar larut dalam air (rutin dan hesperidin). Aglikonnya kebanyakan larut di
pelarut nonpolar, ketika terdapat setidaknya satu gugus fenolik bebas, yang larut
dalam larutan alkali hidroksida (Bruneton, 1999).
Flavonoid lipofil dari jaringan “superficial leaf” secara langsung terekstrasi
dengan pelarut dengan polaritas medium (seperti diklormetan); kemudian harus
dipisahkan dari lilin dan lemak yang diekstraksi secara berkelanjutan (dapat dicuci
heksana) (Bruneton, 1999). .
Glikosida dapat terekstraksi, sering pada suhu tinggi dengan aseton atau
alkohol (etanol, metanol) yang dicampur dengan air (20 – 50 %). Petroleum eter
dengan ekstraksi cair-cair dapat menghilangkan klorofil dan lipid. Dietil eter akan
mengekstrak aglikon bebas, dan etil asetat dapat melarutkan sebagian besar glikosida.
Sakarida bebas tertinggal dalam fase air dengan glikosida yang sangat polar sedikit
terikut didalamnya (Bruneton, 1999).
Ada beberapa reaksi warna untuk mengidentifikasi flavonoid dalam bentuk
glikosida maupun aglikonnya.
i. Reaksi Cyanidin, dengan serbuk magnesium (untuk flavanon dan dihidroflavanol)
atau dengan zink, dengan adanya asam hidroklorida.
ii. Dengan dilihat dibawah sinar UV sebelumnya dan disemprot dengan ammonium
klorida dan setelah diuapi ammonia (perubahan warna maupun fluorosent yang
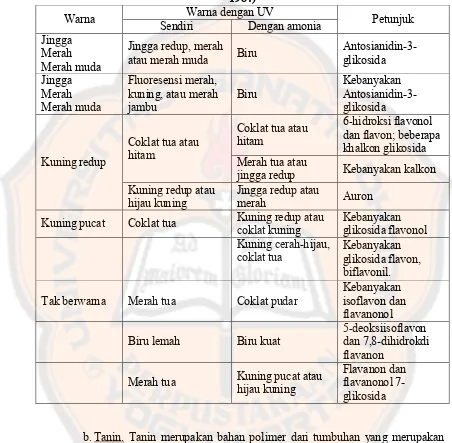
Tabel I. Warna flavonoid dengan sinar tampak dan sinar ultraviolet (Harborne, 1984)
Warna Warna dengan UV Petunjuk
Sendiri Dengan amonia
jingga redup Kebanyakan kalkon Kuning redup atau
hijau kuning
Jingga redup atau
merah Auron
Kuning pucat Coklat tua Kuning redup atau coklat kuning
Tak berwarna Merah tua Coklat pudar
Kebanyakan
Merah tua Kuning pucat atau hijau kuning
Flavanon dan flavanonol 7-glikosida
b.Tanin. Tanin merupakan bahan polimer dari tumbuhan yang merupakan
senyawa polifenol. Secara kimia terdapat 2 jenis tanin, yaitu tanin terkondensasi
(seperti protosianidin) dan tanin yang terhidrolisiskan (seperti asam galat dan asam
elagat). Penentuan struktur kimia tanin sukar dilakukan karena tingkat kerumitan
Dalam pengujiannya, tanin direaksikan dengan FeCl3 dan larutan gelatin.
Perubahan warna menjadi hijau kehitaman pada reaksi dengan FeCl3 menunjukkan
adanya tanin terhidrolisa, jika menjadi hijau kecoklatan menunjukkan adanya tanin
terkondensasi. Jika terbentuk endapan dengan larutan gelatin maka larutan uji positif
mengandung tanin (Levita, Musfiroh, Mustarichie, 2011).
2. Alkaloid
Penemu alkaloid, W. Meisner memperkenalkan senyawa alam yang bereaksi
seperti basa. Pada awalnya alkaloid didefinisikan sebagai senyawa yang mengandung
nitrogen. Karena berasal dari alam dan distribusinya yang terbatas, alkaloid memiliki
struktur yang kompleks (Bruneton, 1999).
Alkaloid memiliki range berat molekul dari 100 hingga 900. Dimana
kebanyakan basa tidak mengandung atom oksigen dalam bentuk cair, sedangkan yang
mengandung atom oksigen terdapat dalam bentuk kristal padat. Hampir semua kristal
basa memiliki rotasi optis, dan memiliki titik leleh yang tajam, tanpa terdekomposisi,
pada suhu dibawah 200°C. Secara umum alkaloid tidak larut atau sukar larut dalam
air, larut dalam nonpolar atau hanya sedikit yang larut dalam pelarut organik polar,
dan larut pada larutan asam hidroalkoholik encer (Bruneton, 1999).
Karakter umum alkaloid dalam tanaman berada dalam bentuk garam dengan
asam mineral (hidroklorit, sulfat, nitrat) atau asam organik (tartrat, sulfamat, maleat).
Garam alkaloid secara umum larut di air dan larutan alkohol, dan tidak larut dalam
Metode deteksi yang paling umum digunakan adalah dengan reaksi
pengendapan dengan menggunakan reagen umum untuk alakaloid. Reaksi
pengendapan dengan membentuk kombinasi alkaloid dengan metal dan metalloid:
bismuth, merkuri, tungsten, dan iodine. Dalam prakteknya, reagen yang biasa
digunakan adalah larutan yang mengandung iodine dan iodide, atau larutan yang
mengandung kalium iodide dan merkuri klorida (reagen Mayer), atau reagen yang
mengandung bismuth nitrat dan kalium iodide (reagen Dragendorff). Untuk pereaksi
semprot alkaloid pada KLT, digunakan reagen Dragendorff, larutan iodine-iodida,
kalium iodoplatinat, cerium dan ammonium sulfat (Bruneton, 1999).
3. Terpenoid
Triterpenoid dan steroid terbentuk dari beberapa jumlah 5 atom karbon pada
2-metilbutadiena (unit isoprena). Terpenoid di alam terbagi menjadi beberapa
golongan yaitu; monoterpen (minyak esensial, oleoresin, dan iridoid), monoterpen
ireguler (pyrethrins), sesquiterpen (minyak esensial dan sesquiterpen lakton),
diterpen, triterpen dan steroid (saponin, glikosida jantung, fitosterol, dan triterpen
termodifikasi), karotenoid, serta poliisopren) (Bruneton, 1999).
Cara umum deteksi ialah dengan menyemprot dengan KMnO4 0,2 % dalam
air, antimoni klorida dalam kloroform, H2SO4 pekat atau vanillin-H2SO4. Setelah
disemprot, pelat dipanaskan pada 100-105°C sampai pembentukan warna sempurna
a.Triterpen dan steroid. Terdiri dari 30 atom karbon, yang berasal dari
siklisasi epoksi-3S-2,3-epoksi-2,3-dihidro-squalena. Steroid, seperti fitosterol,
saponin, ekdisteroid, glikosida jantung, dan steroidal alkamin memiliki kerangka
struktur yang sama. Glikosida jantung dapat meningkatkan kontraksi jantung, likorisa
sebagai pemanis rendah kalori, serta triterpen sebagai sitostatik, insektisida,
antiinflamasi, analgesik, dan sebagainya (Bruneton, 1999).
Uji yang banyak digunakan adalah reaksi Liebermann-Burchard (anhidrida
asetat-H2SO4 pekat) dengan kebanyakan triterpena dan sterol memberikan warna
hijau biru. Pereaksi Liebermann-Burchard telah disesuaikan untuk KLT. Pelat
disemprot dengan campuran H2SO4 pekat 1 mL, anhidrida asetat 20 mL, dan
kloroform 50 mL lalu dipanaskan 85°-95°C selama 15 menit. Untuk mendeteksi
steroid digunakan H2SO4 50 % lalu dipanaskan akan menghasilkan warna merah, dan
dengan UV berfluoresensi hijau (Harborne, 1984).
b.Saponin. Saponin merupakan senyawa glikosida, yang memiliki
karakteristik sebagai surfaktan. Secara structural, saponin dibagi menjadi 2, yaitu
steroidal saponin dan triterpenoid saponin (Araliaceae, Caryophyllaceae,
Cucurbitaceae, Fabales, Primulaceae, Ranunculaceae, Rosaceae, dan Sapindaceae)
(Bruneton, 1999).
Saponin larut di air atau menggunakan alkohol ataupun larutan
hidroalkoholik setelah partisi penghilangan lemak oleh petroleum eter. Pemisahan
saponin dengan kromatografi (kromatografi kolom terbuka, HPLC, KLT, maupun
agen antiinflamasi, mengobati batuk, dermatologi, serta sebagai adaptogen (Bruneton,
1999). Uji saponin yang sederhana ialah dengan mengocok ekstrak dengan air. Bila
terbentuk busa yang tahan lama pada permukaan cairan (Harborne, 1984).
c.Karotenoid. Merupakan tetraterpenoid dengan delapan unit isoprena,
memiliki karakteristik kromofor yang menyebabkan warna kuning atau oranye yang
sangat mudah teroksidasi, serta larut didalam lipid dalam tumbuhan. Banyak terdapat
pada daun, bunga, akar (wortel), dan biji (jagung). Misalnya β-karoten yang
merupakan pro-vitamin A. Karotenoid juga dapat melawan penyakit degeneratif, serta
sebagai pewarna alami (Bruneton, 1999).
Spektrum karotenoid sangat khas antara 400-500 nm, dua puncak utama
disekitar 450 nm dan biasanya ada dua puncak tambahan pada kedua sisi puncak
utama (Harborne, 1984).
D.Kromatografi Kolom
Kromatografi merupakan proses pemisahan campuran dimana analit-analit
dalam sampel terdistribusi dalam fase diam dan fase gerak. Fase diam dapat berupa
bahan padat atau porus dalam bentuk molekul kecil, atau dalam bentuk cairan yang
dilapiskan pada pendukung padat. Fase gerak dapat berupa gas maupun cairan.
Gambar 4. Proses kromatografi kolom (Gritter, Bobbit, dan Schwarting, 1991) Menurut Székely (cit., Hostettmann, Hostettmann, dan Marston, 1995)
kombinasi proses isolasi untuk senyawa lipofil dapat dilakukan dengan; partisi
cair-cair dan kromatografi cair-cair, kromatografi cair-cair dan kromatografi padat (misalnya
kombinasi kolom terbuka dengan KLT preparatif menggunakan silika gel), ataupun
kombinasi kromatografi cair. Kromatografi kolom terbuka biasa dipakai secara luas
karena sederhana.
Kromatografi cair yang dilakukan di dalam kolom besar merupakan metode
terbaik untuk pemisahan campuran dalam jumlah besar (lebih dari 1 g). Pada
kromatografi kolom, campuran yang akan dipisahkan diletakkan berupa pita pada
bagian atas kolom penjerap yang berada dalam tabung kaca, tabung logam, atau
bahkan tabung plastik. Fase gerak dibiarkan mengalir melalui kolom karena aliran
yang disebabkan oleh gaya berat atau didorong dengan tekanan. Pita senyawa akan
bergerak melalui kolom dengan laju yang berbeda, memisah, dan dikumpulkan
Ukuran partikel fase diam untuk kolom biasanya lebih besar daripada untuk
KLT. Untuk kolom yang dijalankan dengan gaya tarik bumi biasanya 63-250 µm.
sedangkan kolom yang dijalankan dengan tekanan mengandung partikel fase diam
dengan ukuran 40-63 µm. Silika gel (SiO2) atau asam silikat merupakan fase diam
yang paling banyak digunakan karena dapat dipakai dengan semua pelarut (Gritter,
Bobbit, dan Schwarting, 1991).
Fase diam dapat dikemas ke dalam tabung dengan cara basah maupun
kering. Umumnya cara basah lebih mudah dan lebih sering dipakai untuk silika gel.
Sedangkan cara kering lebih baik untuk alumina. Pada cara basah, fase diam
dimasukkan ke dalam kolom, dan tabung diisi sepertiganya dengan pelarut. Pelarut
yang dipakai pada proses pengemasan ini mungkin sama dengan fase gerak atau
pelarut lain yang kepolarannya lebih rendah. Fase diam dibuat suspensi dengan
pelarut, dan suspensi ini dituangkan ke dalam pelarut yang ada di tabung. Selama
proses pengendapan, tabung dapat diketuk-ketuk pada semua sisi secara perlahan agar
dapat diperoleh lapisan yang seragam (Gritter, Bobbit, dan Schwarting, 1991)
Pendekatan untuk memilih fase gerak ada tiga. Pertama dengan penelusuran
pustaka, karena sebagian besar senyawa pada kimia analitik, biokimia, dan kimia obat
diketahui dan pernah dikromatografi. Ketika senyawa belum diketahui atau senyawa
yang tidak biasa, maka dapat dicari informasi mengenai senyawa yang ukuran serupa
dan memiliki gugus fungsi yang sama. Kedua adalah hubungan dengan KLT. Karena
KLT membutuhkan waktu yang singkat dengan menggunakan pelarut (fase gerak)
pemisahan memakai kolom. Ketiga adalah dengan pemakai elusi landaian umum
mulai dari pelarut yang tidak menggerakan sampel sampai pelarut yang lebih polar
yang menggerakan sampel (Gritter, Bobbit, dan Schwarting, 1991).
Sampel dilarutkan dalam sedikit pelarut, ditambahkan ke bagian atas kolom
dan dibiarkan mengalir ke bagian atas fase diam. Kemudian kromatogram
dikembangkan. Pada pengembangan ini, sampel yang berupa campuran akan terpisah.
(Gritter, Bobbit, dan Schwarting, 1991)
Kecepatan migrasi tiap senyawa melalui fase diam ditentukan oleh
perbandingan distribusinya (D) yang ditentukan oleh afinitas relatif senyawa itu pada
kedua fase. Nilai D (koefisien distribusi) didefinisikan sebagai perbandingan
konsentrasi senyawa dalam fase diam dibanding dengan konsentrasi senyawa tersebut
dalam fase gerak. Semakin besar nilai D, maka migrasi senyawa semakin lambat, dan
semakin kecil nilai D, migrasinya akan semakin cepat. Semakin besar perbedaan
distribusi antar senyawa, maka campuran akan semakin mudah terpisah. (Rohman,
2009).
Secara umum pemantauan senyawa yang telah dipisahkan dilakukan dengan
membagi eluat menjadi beberapa fraksi. Fraksi dianalisis dengan menggunakan KLT
maupun KCKT sehingga hasilnya dapat digunakan sebagai petunjuk fraksi mana
yang harus digabung untuk mengisolasi produk. Sedangkan untuk isolasi produk,
fraksi kolom yang telah digabungkan atau mengandung senyawa yang sama, fase
E.Kromatografi Lapis Tipis (KLT)
Kromatografi lapis tipis merupakan metode pemisahan fisikokimia. Dimana
campuran yang akan dipisahkan ditotolkan berupa bercak atau pita. Pemisahan terjadi
dalam bejana tertutup rapat yang berisi fase gerak, dan pemisahan terjadi selama
perambatan kapiler (Stahl, 1985). KLT merupakan salah satu metode kromatografi
yang paling sederhana yang dapat memisahkan senyawa yang amat berbeda seperti
senyawa organik alam dan senyawa organik sintetik, kompleks anorganik, dan
bahkan ion anorganik, dapat dilakukan dalam waktu yang singkat dengan biaya yang
cukup rendah (Gritter, Bobbit, dan Schwarting, 1991).
Bila KLT dibandingkan dengan kromatografi kertas, KLT memiliki
kelebihan yaitu keserbagunaan, kecepatan, dan kepekaannya. Keserbagunaan
disebabkan banyaknya jenis fase diam yang dapat digunakan (selulosa atau silika gel,
dan sebagainya). Kecepatan KLT yang lebih besar karena sifat penyerap yang lebih
padat dan merupakan keuntungan untuk menelaah senyawa yang kurang stabil.
Kepekaan KLT karena jumlah yang diperlukan hanya berjumlah dalam µg (Harborne,
1984).
KLT dapat dipakai dengan dua tujuan. Pertama, dipakai selayaknya sebagai
metode untuk mencapai hasil kualitatif, kuantitatif atau preparatif. Kedua, dipakai
untuk menjajaki sistem pelarut dan sistem penyangga yang akan dipakai dalam
kromatografi kolom atau kromatografi cair kinerja tinggi (Gritter, Bobbit, dan
Schwarting, 1991).
Lapisan buatan sendiri mempunyai beberapa kekurangan dan biasanya
memerlukan peralatan tertentu untuk membuatnya (Gritter, Bobbit, dan Schwarting,
1991). Untuk membuat pelat KLT, terlebih dahulu pelat kaca dibersihkan dengan
aseton untuk membersihkan lemak. Kemudian bubur silika harus di kocok kuat dalam
waktu yang cukup (90 detik) sebelum penyaputan. Setelah itu, pelat dikeringkan pada
suhu kamar, lalu dikeringkan dalam oven pada suhu 100-110°C selama 30 menit
(Harborne, 1984)
Umumnya jumlah sampel yang ditotolkan sekitar 50-100 µg setiap bercak
untuk kromatografi adsorbsi. Untuk meningkatkan konsentrasi sampel pada bercak,
dapat dilakukan penotolan berulang (Gritter, Bobbit, dan Schwarting, 1991).
Pada pengembangan lapisan KLT, terdapat 3 gerakan pelarut. Pertama
pelarut bergerak ke atas melalui lapisan. Kedua, uap pelarut akan terjerap oleh lapisan
di atas garis depan gerakan pertama pelarut. Ketiga, penguapan pelarut dibawah garis
depan pada lapisan. Sehingga untuk meminimalkan banyaknya gerakan pelarut, maka
dibutuhkan penjenuhan bejana. Penjenuhan bejana dapat dilakukan dengan melapisi
dinding bejana dengan kertas saring. Kertas harus dibasahkan dengan pelarut, dan
dalam bejana (Gritter, Bobbit, dan Schwarting, 1991). Biasanya KLT dilakukan
dengan pengembangan naik dalam suatu bejana yang dindingnya dilapisi dengan
kertas saring sehingga bejana jenuh dengan pengembang yang digunakan (Harborne,
1984)
Pemisahan pada kromatografi planar (misalnya kromatografi lapis tipis)
pada umumnya akan dihentikan sebelum semua fase gerak melewati seluruh
permukaan fase diam. Analit dicirikan dengan faktor retardasi (Rf) atau jarak migrasi
analit terhadap jarak ujung fase geraknya. (Rohman, 2009)
Rf = (Rohman, 2009) ………..(1)
Cara penampakan bercak yang tidak merusak dapat digunakan untuk KLT
preparatif dan kuantitatif. Cara khas merupakan cara yang umumnya digunakan
dengan menyemprot pelat dengan pereaksi yang akan menimbulkan warna jika
bereaksi dengan bercak cuplikan. Ada dua segi penting mengenai penggunaan
pereaksi semprot. Segi pertama ialah mengenai informasi gugus fungsi yang dapat
diperoleh. Serta segi kedua yaitu mengenai derajat warna yang kecil yang terjadi jika
pereaksi semprot ini dipakai (Gritter, Bobbit, dan Schwarting, 1991).
F.Kromatografi Lapis Tipis Preparatif (KLTP)
Salah satu metode pemisahan yang memerlukan biaya paling murah dan
menggunakan peralatan yang paling sederhana adalah kromatografi lapis tipis
cara yang ideal untuk pemisahan cuplikan kecil (50 mg sampai 1 g) dari senyawa
yang kurang atsiri. Pada KLTP, cuplikan yang akan dipisahkan ditotolkan berupa
garis pada salah satu sisi pelat lapisan besar dan dikembangkan secara tegak lurus
pada garis cuplikan sehingga campuran akan terpisah menjadi beberapa pita. Pita
ditampakkan dengan cara yang tidak merusak jika senyawa itu tidak berwarna, dan
fase diam, yang mengandung pita dikerok dari pelat kaca. Kemudian cuplikan
diekstraksi dari fase diam dengan pelarut polar (Gritter, Bobbit, dan Schwarting,
1991).
Fase diam yang paling umum digunakan adalah silika gel dan dipakai untuk
pemisahan campuran senyawa lipofil maupun hidrofil. Seperti biasa, silika gel lebih
banyak digunakan daripada fase diam lain. Ketebalan optimum untuk lapisan
preparatif sekitar 1-1,5 mm. Pembatasan ketebalan lapisan dan ukuran pelat akan
mengurangi jumlah bahan yang dapat dipisahkan dengan KLTP. Pada umumnya,
suspensi yang dipakai untuk mencetak lapisan preparatif agak lebih kental daripada
yang dipakai untuk lapisan tipis. Lapisan harus dibiarkan mengering selama beberapa
jam pada suhu kamar sebelum diaktifkan. Ini akan mencegah peretakan dan
pengerasan pada bagian luar. Pengaktifan dilakukan pada suhu 100°C,
sekurang-kurangnya selama 1 jam (Gritter, Bobbit, dan Schwarting, 1991).
Cuplikan dilarutkan dalam sedikit pelarut sebelum ditotolkan pada pelat
KLTP. Pelarut yang baik adalah pelarut yang mudah menguap, karena jika pelarut
kurang mudah menguap maka dapat terjadi pelebaran pita. Pemilihan pelarut
ukuran partikel penyerap sama, maka pelarut yang dipakai pada KLT analitik dapat
dipakai langsung pada KLTP (Hostettmann, Hostettmann, dan Marston, 1995).
Pelarut yang memiliki titik didih di antara 50-90°C cocok untuk pelarut cuplikan.
Pada penotolan dilakukan penyebaran larutan cuplikan yang volumenya agak besar
(sampai 2 ml) berbentuk pita seragam tipis (lebar 1 sampai 5 mm) tanpa mengganggu
permukaan lapisan secara berlebihan (Gritter, Bobbit, dan Schwarting, 1991).
Pengembangan pelat KLTP biasanya dilakukan dalam bejana kaca yang
dapat menampung beberapa pelat sekaligus. Bejana dijaga tetap jenuh dengan pelarut
pengembang dengan bantuan sehelai kertas saring yang tercelup di dalam
pengembang. Keefisienan pemisahan dapat ditingkatkan dengan cara pengembangan
berulang. Jika pemisahan secara KLTP telah dicapai, pelat dikeringkan kemudian
dimasukkan lagi ke dalam bejana (Hostettmann, Hostettmann, dan Marston, 1995).
Pita yang kedudukannya telah diketahui dikerok dari pelat dengan spatula
atau pengerok berbentuk tabung yang disambungkan dengan pengumpul vakum.
Senyawa harus diekstraksi dari penyerap dengan pelarut yang paling kurang polar
yang mungkin (sekitar 5 ml untuk 1 g penyerap). Semakin lama senyawa kontak
dengan penyerap, semakin besar kemungkinana penguraian. Ekstrak disaring melalui
kaca berpori 4 dan kemudian melalui membrane 0,2-0,45 µm. Kemudian pelarut
G.Elusidasi Struktur
Setelah suatu senyawa tanaman terisolasi, struktur senyawa kemudian
dielusidasi struktur dan dikarakterisasi. Identitas struktural senyawa ditetapkan
dengan berbagai metode fisikokimia termasuk inframerah (IR), ultraviolet-Vis, 1H dan 13C resonansi magnetik inti (NMR), dan spektrometri massa (MS), serta berbagai sifat fisika dan data kromatografis seperti titik leleh, analisis element, data kelarutan,
parameter kromatografi lapis tipis dan kromatografi cair kinerja tinggi, analisis
thermogravimetri, serta analisis DSC (differential scanning calorimetry) (Ho,
Chi-Tang, Shahidi, dan Fereidoon, 2000).
1. Kromatografi gas-spektrometri massa
Penggunaan spektrometer massa berkembang karena banyak senyawa
organic dapat diionisasi pada keadaan uap dan dicatat berat molekul senyawa dengan
mengukur perbandingan massa terhadap muatan (m/e). Kedua ion molekul dapat
diputus-putus lagi atau difragmentasi dalam fragmentasi yang lebih kecil yang dapat
berguna untuk penentuan struktur molekul (Kosela, 2010).
Peralatan terdiri dari sebuah ruangan pemboman yang diisi sampel dalam
bentuk uap. Ruangan dihampakan agar tekanan uapnya rendah sehingga sampel padat
dan cairan mudah menguap. Selanjutnya ion molekuler (M) dan ion-ion anak
(pecahan) yang bermuatan positif yang terbentuk akan dipercepat oleh akselerator
oleh suatu muatan negatif yang terdapat pada ujung lainnya. Selanjutnya ion yang
melalui celah (slits) dilewatkan melalui medan magnet dan dibelokkan sesuai dengan
kecepatan yang tergantung pada perbandungan massa dan muatan menuju detektor.
Selanjutnya rekorder akan mencatat hasil berupa gambar antara limpahan relatif (LR)
atau relative abundance (RA) lawan m/e yang dikenal sebagai spektra massa (Sitorus,
2009)
Dalam spektrometer ini, sampel diubah dalam bentuk gas dan dengan
elektron berenergi cukup untuk mengalahkan potensial ionisasi pertama senyawa
tersebut. Tabrakan antara sebuah molekul organik dan salah satu elektron berenergi
tinggi menyebabkan lepasnya sebuah elektron dari molekul tersebut dan terbentuknya
suatu ion organik. Ion organik yang dihasilkan oleh penembakan berenergi tinggi
tersebut tidak stabil dan pecah menjadi fragmen yang lebih kecil, baik berbentuk
radikal bebas maupun ion-ion lain (Supratman, 2010).
Sampel dimasukkan, diuapkan dan diumpankan dalam suatu aliran yang
berkesinambungan dengan kamar pengionan yang dijaga tetap dalam keadaan tetap
vakum untuk meminimalkan tabrakan dan reaksi antara radikal, molekul udara, dan
ionisasi beberapa molekul sampel menjadi ion-ion molekul, yang dapat mengalami
fragmentasi dan penataan ulang (Supratman, 2010).
Radikal ion dan partikel yang terbentuk diumpankan melewati dua elektroda,
lempeng pemercepat ion, yang memercepat partikel bermuatan positif. Dari sini,
partikel bermuatan positif menuju ke tabung analisator, dimana partikel ini dibelokan
oleh medan magnet sehingga lintasannya melengkung (Supratman, 2010).
Pada kuat medan dan tegangan listrik (voltase) yang sama, partikel dengan
m/e tinggi akan memiliki jari-jari yang besar. Sehingga, ketika voltase pemercepat
dikurangi perlahan dan kontinyu, maka kecepatan semua partikel akan berkurang, dan
jari-jari lintasan pun berkurang. Maka, partikel akan mengenai detektor dimulai
dengan m/e yang rendah (Supratman, 2010).
Elektron dalam orbital berenergi tertinggi (elektron yang paling longgar)
adalah elektron yang pertama kali akan lepas. Jika molekul memiliki elektron n (lone
pair electrons), maka salah satunya akan dilepaskan, jika tidak ada maka akan
dilepaskan sebuah elektron phi (π), jika tidak ada keduanya, maka ion molekul akan
terbentuk dengan lepasnya sebuah elektron sigma (σ) (Supratman, 2010).
Setelah ionisasi awal, ion molekul akan mengalami fragmentasi, suatu proses
dimana radikal bebas atau molekul netral kecil dilepaskan dari ion molekul. Ion
molekul tidak pecah secara acak, tetapi cenderung membentuk fragmen-fragmen
sestabil mungkin (Supratman, 2010).
Spektrum massa adalah alur kelimpahan (abundance) jumlah relatif fragmen
fragmen-fragmen tersebut. Muatan ion dari kebanyakan partikel yang dideteksi adalah +1;
maka nilai m/e sama dengan massa molekulnya (M). bagaimana suatu molekul atau
ion pecah menjadi fragmen-fragmen kecil tergantung dari kerangka karbon dan gugus
fungsional yang ada. Oleh karena itu, struktur dari massa fragmen dapat memberikan
petunjuk mengenai struktur molekul induknya serta menentukan bobot molekulnya
(Supratman, 2010).
Spektrum massa dipaparkan sebagai grafik batangan. Setiap puncak dalam
spektrum menyatakan suatu fragmen molekul sehingga puncak ditata menurut
kenaikan m/e dari kiri ke kanan. Intensitas puncak sebanding dengan kelimpahan
relatif fragmen-fragmen bergantung pada stabilitas relatifnya. Puncak tertinggi dalam
spektrum disebut puncak dasar (base peak), diberi intensitas sebesar 100 %
(Supratman, 2010).
Ion limpahan yang paling tinggi yang disebut dengan puncak dasar (based
peak) menggambarkan fragmen yang paling stabil untuk molekul tersebut. Intensitas
fragmen yang lain relatif terhadap puncak dasar yang berarti stabilitasnya juga adalah
relatif (Sitorus, 2009).
Pada saat ini banyak alat spektrometer massa digabungkan dengan
kromatografi gas, sehingga setiap peak dari kromatogram dapat diukur berat molekul
serta bentuk framentasinya. Selain itu ratusan ribu senyawa organik sudah didata
dalam komputer, dan hasil pengukurannya dapat dibandingkan derajat kemiripannya.
Bila derajat kemiripannya lebih dari 90 % maka senyawa tersebut dapat dikatakan
Kromatografi gas adalah suatu cara untuk memisahkan senyawa atsiri
dengan meneruskan arus gas melalui fase diam. Pada kromatografi gas, komponen
yang akan dipisahkan dibawa oleh gas melalui kolom. Campuran akan terbagi di
antara gas pembawa dan fase diam. Fase diam akan menahan komponen secara
selektif berdasarkan koefisien distribusinya sehingga terbentuk sejumlah pita yang
berlainan pada gas pembawa. Pita komponen ini keluar dari kolom bersama aliran gas
pembawa dan dicatat sebagai fungsi waktu. Detektor menunjukan adanya komponen
dalam eluen dan mengukur kuantitasnya (McNair dan Bonelli, 1988).
Gambar 7. Skema peralatan kromatografi gas-spektrofotometer massa (Sitorus, 2009)
2. Spektrometri ultraviolet-sinar tampak (UV-VIS)
Spekstroskopi adalah alat analisis yang menggunakan radiasi sebagai sumber
energi. Sinar atau radiasi adalah merupakan gelombang yang mempunyai energi
berbanding terbalik dengan panjang gelombang. Selain sinar atau radiasi, elektron
Elusidasi struktur sangat penting untuk senyawa organik Karena adanya
fenomena isomeri yaitu senyawa yang memiliki rumus molekul sama tetapi memiliki
struktur yang berbeda (Sitorus, 2009).
Bila energi atau sinar berinteraksi dengan molekul organik maka yang
dipengaruhi adalah ikatannya. Pada hakekatnya terdapat 3 jenis ikatan yaitu, ikatan
sigma (σ), ikatan pi (π), dan pasangan elektron bebas (n), dimana kekuatan ketiga
ikatan tersebut adalah sebagai berikut (Sitorus, 2009).
σ > π > n (Sitorus, 2009)………..(2)
Tabel II. Klasifikasi sinar tampak dengan warna komplementernya (Sitorus, 2009)
Panjang gelombang
(nm) Warna Warna Komplementer 400-435 Violet /ungu /lembayung Hijau kekuningan
435-480 Biru Kuning
480-490 Biru kehijauan Jingga
490-500 Hijau kebiruan Merah
500-560 Hijau Ungu kebiruan
560-580 Hijau kekuningan Ungu
580-610 Jingga Biru kehijauan
610-680 Merah Hijau kebiruan
680-800 Ungu kemerah-merahan Hijau
Molekul menyerap energi dalam ultraviolet dan spektrum sinar tampak
tergantung pada daerah elektronik dari molekul. Energi serapan menghasilkan elevasi
elektron dari orbital dasar ke orbital lebih energi lebih tinggi di kedudukan tereksitasi.
Spektrofotometer ultraviolet akan memberikan informasi yang berguna pada sistem
Energi yang diserap dalam daerah UV menghasilkan transisi elektron valensi
dalam molekul. Transisi ini terjadi karena elektron tereksitasi dari orbital molekul ke
energi orbital yang lebih tinggi (antibonding). Perpindahan dari ikatan orbital π ke
antibonding orbital π* dinyatakan sebagai π → π* (Kosela, 2010).
Baik radiasi UV maupun tampak berenergi lebih tinggi daripada radiasi
inframerah. Absorpsi cahaya ultraviolet dan tampak mengakibatkan transisi
elektronik, yaitu promosi elektron-elektron dari orbital keadaan dasar, highest
occupied molecular orbital (HOMO) berenergi rendah ke orbital keadaan tereksitasi berenergi lebih tinggi lowest unoccupied molecular orbital (LUMO). Transisi ini menyerap energi yang selanjutnya terbuang sebagai kalor, cahaya, atau tersalurkan
dalam reaksi kimia (Supratman, 2010).
Gambar 8.Transisi elektronik oleh sinar UV-Vis (Sitorus, 2009)
Kromofor adalah gugus tak jenuh kovalen (σ) yang menyebabkan serapan
elektronik. Auksokrom adalah gugus jenuh yang bila terikat pada suatu kromofor
akan mempengaruhi panjang gelombang (λ) dan intensitas serapan maksimum
Auksokrom adalah suatu gugus jenuh dengan elektron sunyi yang tidak
menyerap pada daerah ultraviolet-tampak tetapi jika terikat pada kromofor akan
mengubah panjang gelombang dan intensitas serapan kromofor (gugus fungsi yang
mengalami transisi n→σ*) (Supratman, 2010).
Spektrum UV-Vis terdiri dari pita absorpsi lebar pada daerah panjang
gelombang yang lebar. Ini disebabkan oleh terbaginya keadaan dasar dan keadaan
eksistensi sebuah molekul dalam subtingkat-subtingkat rotasi dan vibrasi. Transisi
elektronik dapat terjadi dari subtingkat apa saja dari keadaan dasar ke subtingkat
keadaan apa saja dari keadaan eksitasi. Karena berbagai transisi ini berbeda energi
lebih sedikit dan menimbulkan pita lebar yang muncul dalam spektrum itu
(Supratman, 2010).
Spektrum ultraviolet dan visibel biasanya sangat encer, dan pelarut yang
digunakan harus tidak memberikan serapan pada panjang gelombang dimana
dilakukan pengukuran dan transparan terhadap sel silika (Supratman, 2010).
Panjang gelombang untuk transisi elektronik adalah spesifik yang dikenal
sebagai λmaks yaitu panjang gelombang yang memberikan absorbansi maksimum dan
merupakan dasar dari analisa kualitatif yang dapat ditentukan secara eksperimen
dengan membuat kurva antara A lawan λ (Sitorus, 2009).
Spektroskopi UV-Vis diperuntukkan untuk analisis senyawa dengan gugus
kromofor diena dan poliena serta enon terkonjugasi. Bila konjugasi ikatan rangkap
makin panjang maka akan menuju senyawa berwarna sehingga sinar yang digunakan
a.Sistem butadien aturan Woodward. Panjang gelombang maksimum (λ)
sistem butadien (C=C-C=C) dimana butadien dibagi dalam dua katagori yaitu s-trans
butadien dan s-cis butadien. Dalam perhitungan Woodward harga induk (parent
value) di singkat HI untuk system s-trans butadien (heteroanular) sebesar 214 nm,
tapi harga induk s-cis-butadien (homoanular) sebesar 253 nm. Pengertian eksosiklik
yang disingkat dengan ES adalah ikatan rangkap diluar cincin dan setiap eksosiklik,
penambahannya 5 nm (Kosela, 2010).
b.Sistem butadien aturan Fieser-Kuhn. Aturan Woodward hanya berlaku
untuk sistem butadien dan perpanjangan paling banyak dua ikatan rangkap
terkonjugasi. Untuk ikatan rangkat lebih dari empat digunakan aturan Fieser Kuhn
dengan rumus sebagai berikut:
max( ) = 114 + 5 + (48,0−1,7 )−16,5 −10 …….(3)
max( ) = (1,74 × 10 ) ...(4)
Dimana:
M = jumlah substituent alkil atau yang menyerupai alkil pada sistem
konjugasi
N = jumlah dari ikatan rangkap terkonjugasi
Rendo = jumlah ikatan rangkap dalam cincin pada sistem konjugasi
Rexo = jumlah ikatan rangkap di luar cincin pada sistem konjugasi
Gambar 9. Skema peralatan spektrofotometer UV-Vis (Sitorus, 2009) a.Sumber radiasi. Secara umum radiasi yang dihasilkan oleh material
bersumber listrik. Tegangan listrik akan menyebabkan eksitasi elektron pada benda
dan waktu elektron kembali ke tingkat energi yang lebih rendah akan menghasilkan
radiasi berupa emisi sejumlah energi tertentu yang merupakan sumber radiasi.
Sumber radiasi UV digunakan lampu hidrogen ataupun deuterium, sedangkan sumber
radiasi sinar tampak menggunakan lampu filamen tungsten (Sitorus, 2009)
b.Monokromator. Radiasi dari sumber radiasi adalah sinar polikromatis
(banyak panjang gelombang). Monokromator yang berupa bahan optik berbentuk
prisma ini, berfungsi untuk menguraikan sinar tersebut menjadi monokromatis sesuai
yang diinginkan (Sitorus, 2009)
c.Sel (tempat) sampel. Biasanya tempat sampel dikenal dengan istilah
dilewatkan sebagai sumber radiasi dan tidak bereaksi dengan sampel maupun pelarut
(Sitorus, 2009).
d. Detektor. Detektor berfungsi untuk mengubah tenaga radiasi menjadi
arus listrik atau peubah panas lainnya dan biasanya terintegrasi dengan pencatat
(Sitorus, 2009).
H.Kandungan Binahong
Daun binahong menurut hasil penelitian sebelumnya secara kultur in vitro
mengandung flavonoid, alkaloid, terpenoid, dan saponin (Manoi, 2009). Penelitian
Rachmawati (2007) mendapatkan bahwa terdapat saponin triterpenoid, flavonoid, dan
minyak atsiri dalam ekstrak n-heksana daun binahong, sedangkan Khunaifi (2010)
mendapatkan bahwa daun binahong mengandung flavonoid, alkaloid, polifenol.
Selain itu, daun binahong mengandung saponin treterpenoid dan saponin steroidal
(Astuti, 2011). Sedangkan Barboza, Cantero, Nunez, Pacciaroni, dan Espinar (2010)
menyatakan bahwa keseluruhan bagian tanaman binahong kering mengandung
steroid.
Muhammad (2011) mendapatkan senyawa yang mirip dengan
boussingosida, Saroh, Winarti, dan Djamil (2012) memperkirakan terdapat senyawa
adenine, Facrhiyah dan Kusrini (2012) menemukan senyawa stigmasterol, serta Titis,
Facriyah, dan Kusrini (2013) menemukan senyawa alkaloid betanidin pada daun
Yang, Lin, dan Kuo (2008) menyebutkan bahwa terdapat flavonoid yaitu
kuersetin dalam daun binahong sebesar 0,6 mg/100gram daun. Tsai, Huang, Wu, dan
Lee (2005) mendapatkan kandungan oksalat dengan kadar 231,3 mg/100g daun segar
binahong. Djamil, Wahyudi, Wahono, dan Hanafi (2012), berhasil mengisolasi dan
mengidentifikasi 8-glucopyranosyl-4’,5,7,-trihydroxyflavone dari ekstrak methanol
daun binahong. Li (2006) menyatakan bahwa daun Boussingaultia gracilis Miers var
pseudobaselloides yang merupakan nama lain dari tanaman binahong, mengandung
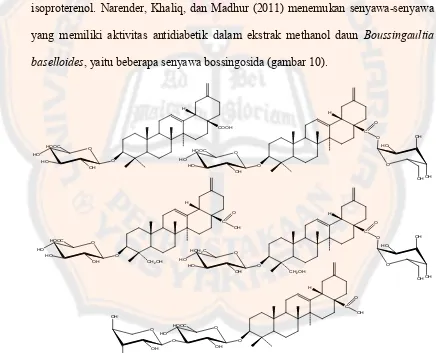
isoproterenol. Narender, Khaliq, dan Madhur (2011) menemukan senyawa-senyawa
yang memiliki aktivitas antidiabetik dalam ekstrak methanol daun Boussingaultia
baselloides, yaitu beberapa senyawa bossingosida (gambar 10).
O
I. Landasan Teori
Tanaman Binahong merupakan tanaman yang digunakan masyarakat untuk
mengobati atau mencegah berbagai penyakit. Karena itu, perlu dilakukan identifikasi
kandungan kimia dalam tanaman binahong sehingga dapat mengembangkan tanaman
binahong menjadi suatu bahan obat dengan bentuk sediaan tertentu.
Untuk mengidentifikasi senyawa dalam daun binahong, dapat dilakukan
dengan metode metabolomika. Pertama, dilakukan pengumpulan sampel daun, yang
diteruskan dengan ekstraksi. Pada ekstrak dilakukan pemisahan dan pemurnian,
sebelum dideteksi, identifikasi, dan dikuantifikasi dengan kromatografi
gas-spektrometri massa atau kromatografi cair kinerja tinggi (KCKT)-gas-spektrometri massa
(SM), serta dengan metode spektrometri lain, seperti spektrometri UV-Vis,
spektrometri inframerah, dan sebagainya. Data yang dapatkan dikombinasikan untuk
didapatkan struktur senyawa-senyawa metabolitnya (Vinayavekhin dan Saghatelian,
2010).
Langkah lain dalam identifikasi kimia adalah proses isolasi senyawa, dimana
dilakukan proses ekstraksi, yaitu penyarian senyawa dari bahan, lalu dilakukan
pemisahan senyawa atau proses isolasi dengan proses kromatografi. Proses ini lebih
sederhana dan lebih mudah dilakukan, karena pada proses metabolomika harus
diperhatikan adanya kandungan senyawa dalan tanaman yang bisa mengganggu.
Misalnya, harus dilakukan terlebih dahulu pigmen (klorofil dan karotenoid) agar