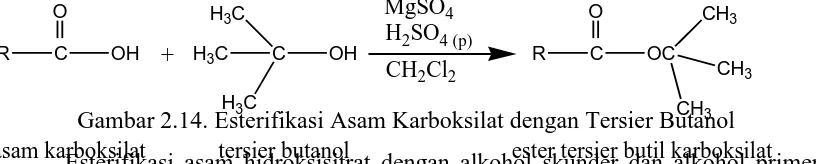Garam magnesium hidroksisitrat diperoleh putih dan dikarakterisasi. Analisa FT-IR dilakukan untuk melihat gugus fungsi pada garam magnesium hidroksisitrat, analisa AAS untuk mengetahui kadar Mg dalam garam magnesium hidroksisitrat.
2. Esterifikasi Asam Hidroksisitrat dengan Metanol
Metanol kering di campurkan dengan asam sulfat, magnesium hidroksi sitrat dan katalis DMTPS, campuran tersebut di panaskan pada suhu 120 0C selama 10 jam sambil di aduk. Kemudian dari campuran reaksi diisolasi esternya menggunakan pelarut diklorometana dan dimurnikan dengan mengekstraksi menggunakan n-heksan/etanol. Ester yang diperoleh dianalisa. Analisa FT-IR untuk mengetahui terbentuknya ester. Analisa 1H-NMR dan 13C-NMR dilakukan untuk mengetahui proton dan karbon pada ester yang diperoleh.
BAB 2
TINJAUAN PUSTAKA
2.1 Asam Hidroksi Sitrat
Asam hidroksi sitrat sering di sebut asam garcinia karena salah satu kandungan utama pada tumbuhan genus Garcinia adalah asam hidroksi sitrat (Mackeen, 2012). Pada kulit tumbuhan spesis Garcinia selain mengandung asam hidroksi sitrat sebagai kandungan utama nya (23-54%) terdapat juga asam hidroksi sitrat lakton (6-20%) (Moffet,1997) dan asam-asam lain nya yang pada umumnya adalah asam sitrat (~30%) (Jena,2002).
dipekatkan dengan alkohol kemudian dinetralkan dengan basa alkali ( Lewis dkk, 1965), selain itu dengan mengekstraksi tanaman Rosella ( Hibiscus Sabdariffa L) menggunakan pelarut aseton dan methanol dan diikuti dengan rekristalisasi (Baitii, 2009) dan dapat juga dilakukan dengan menggunakan mikroorganisme Bacilus Megaterium dan Steptomyces (Hida, 2005).
Beberapa sifat fisik asam hidroksi sitrat yaitu memiliki titik lebur 178 0C , larut dalam air, alkohol dan sedikit larut dalam eter, memiliki sifat hidroskopis yang sangat tinggi. Selain itu asam hidroksi sitrat memiliki sifat yang kurang stabil dalam bentuk yang bebas, sehingga dapat berubah bentuk menjadi lakton selama adanya pemekatan dan penguapan. Asam hidroksi sitrat stabil dalam bentuk lakton, garam dan dalam bentuk ester (Jena,2002).
2.1.1 Turunan Asam Hidroksi Sitrat
Asam hidroksi sitrat yang dalam bentuk bebas tidak stabil maka di buat kebentuk garam-garam nya atau pun dalam bentuk ester nya.
2.1.1.1 Garam – garam Hidroksi Sitrat
Garam-garam hidroksi sitrat sudah banyak di sintesis, dalam bentuk garam tunggal, garam rangkap dan garam, garam tripel, tetra dan peta logam yang berbeda.
2.1.1.1.1 Garam Tunggal
larutan MgCl2 0.5M dalam pelarut etanol dan dengan penambahan polyvinyl polypyrrolidone (Shrivastava, 2001).
2.1.1.1.2 Garam Rangkap (Memiliki Dua Logam Berbeda)
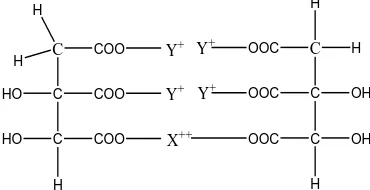
Garam rangkap hidroksisitrat memiliki dua logam yang berbeda. Logam– logam tersebut dapat dibentuk dari logam golongan IA dan IIA. Logam golongan IA seperti Li atau Na atau K atau Rb atau Cs atau Fr. Dan logam golongan IIA seperti Be, Mg, Ca, Sr, Ba atau Ra. Dengan formula yang di bentuk X (logam golongan IA) memiliki konsentrasi 1.5-51% dan Y (logam golongan IIA) memiliki konsentrasi 2.0-50.9% dan konsentrasi dari asam hidroksi sitrat dalam jenis garam nya 31.0-93.0%.
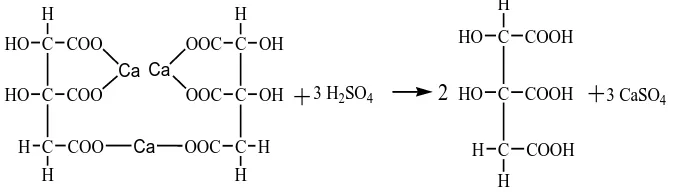
Pembuatan garam rangkap dengan logam X dan Y dimana logam X yang di tambahkan adalah dalam bentuk garam hidroksi dan logam Y yang di tambahkan adalah dalam bentuk garam klorida nya, dan pengendapan yang di lakukan dengan menggunakan pelarut yang bersifat polar dan akan menghasilkan garam rangkap yang bentuk serbuk yang larut dalam air. Bentuk umum yang di temukan (Balasubramanyam,2002) dapat dilihat pada Gambar 2.1 sebagai berikut :
C COO -C
C
COO -COO -H
HO HO
X+
Y++
H H
Gambar 2.1 Formula Garam Rangkap
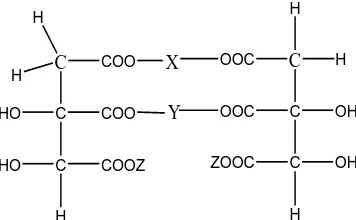
Dan formula yang lain di temukan oleh Moffet (2013) sebagai brikut:
C COO C C
COO COO H HO HO
H
H OOC C
H H C C
OH OOC
OH OOC
H
X++ Y+ Y+ Y+ Y+
Dan formula II (Moffet,2013) dapat dilihat pada Gambar dibawah ini:
Gambar 2.3 Formula II garam rangkap Asam Hidroksisitrat Dan dapat juga dibuat pada formula III seperti Gambar dibawah ini:
C COO
Gambar 2.4 Formula III garam rangkap Asam Hidroksisitrat
2.1.1.1.3 Tri-tetra-penta Salt Hidroksisitrat
Garam ini (tripel salt hidroksisitrat) dibentuk pada formula sebagai berikut:
C COO
Gambar 2.5 Stuktur tripel salt Hidroksi Sitrat (Gokarju,2007)
larutan magnesium karbonat kemudian kalsium hidroksida dan kalium hidroksida dengan proses pemanasan dan akhir reaksi diperoeh pH = 7. Pembuatan tetra-penta salt hidroksi sitrat juga dapat dilakukan dengan metode yang sama seperti pebuatan tripel salt hidroksi sitrat (Gokarju, 2007).
2.1.1.2 Ester -Ester Hidroksi Sitrat
Sudah ada beberapa macam ester dari asam hidroksi sitrat yang disintesis, seperti: dimetil hidroksi sitrat, tribenzil hidroksi sitrat, dikalium niasin hidroksisitrat, dan dibutil-metil hidroksi sitrat dan trietil hidroksi sitrat.
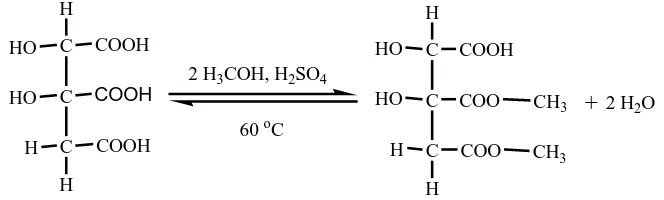
Esterifikasi pembuatan dimetil hidroksi sitrat telah dilakukan dengan cara mereaksikan asam hidroksi sitrat dengan metanol pada suhu 60 0C selama 2 jam (Hida, 2005). Pada penelitian itu hanya ada dua gugus asam karboksilat yang teresterikasi. Reaksi yang terjadi dapat dilihat pada Gambar 2.6 seperti dibawah ini.:
C
C
C HO
HO
H
H H
COOH
COOH
COOH
C
C
C HO
HO
H
H H
COOH
COO
COO 2 H3COH, H2SO4
60 oC
CH3
CH3
+ 2 H2O
Gambar 2.6. Reaksi Esterifikasi Asam hidroksisitrat dengan Metanol.
C
Gambar 2.7. Reaksi Esterifikasi Kalsium Hidroksisitrat dengan Benzil Alkohol.
Dikalium niasin hidroksi sitrat diperoleh dengan cara mereaksikan kalium hidroksi sitrat dengan niacin dan HCl pada Gambar 2.8 dibawah ini (Gupta, 2007).
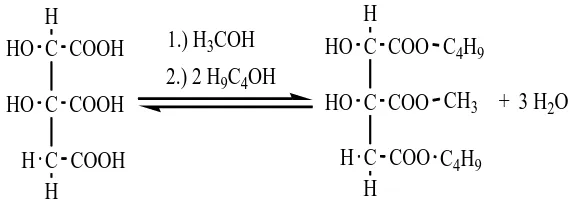
Gambar 2.8 Reaksi Pembentukan Ester Dikalium Niasin Hidroksi Sitrat Dibutil-metil hidroksi sitrat diperoleh dengan mereaksikan ekstrak metanol buah kering G. atroviridis dengan n-butanol pada Gambar 2.9 dibawah ini (Mackeen, 2002).
cairan kental kuning bening dengan yield 17,56% dan beberapa campuran asam organik lain nya (Fantoso, 2014). Reaksi pertama terjadi pembentukan etil sulfat pada Gambar 2.10 dibawah ini.
+
+
H2SO4 (p) C2H5-O-SO3HC2H5OH H2O
Gambar 2.10. Reaksi Pembentukan Etil Sulfat
Kemudian pembentukan asam hidroksi sitrat dengan asam sulfat yang terjadi secara in situ, sepert Gambar 2.11 dibawah ini.
C
Gambar 2.11. Reaksi pembentukan asam hidroksi sitrat
Dan reaksi esterifikasi asam hidroksi sitrat dengan etil sulfat dapat dilihat pada Gambar 2.12 berikut:
3 C2H5-O-SO3H
Gambar 2.12. Reaksi Esterifikasi Asam Hidroksi Sitrat dengan etil sulfat
2.1.2 Kegunaan Asam Hidroksi Sitrat dan Turunan nya
mengubah sitrat dan koenzim A kebentuk oksalaasetat dan asetil koenzim A (Gokarju, 2010), mengontrol berat badan, meningkatkan oksidasi lemak menjadi energi, menurunkan indeks massa tubuh, menurunkan nafsu makan, meningkatkan kolesterol HDL(Bagchi,2008), dan penurun kolesterol LDL yang potensial (Kim,2011).
Garam – garam turunan asam hidroksisitrat berfungsi untuk mengontrol dan mencegah peradangan (Clouatre, 2013), sebagai suplemen gizi dalam minuman, mengkontrol obesitas (Balasubramanyam,2000), antistres, antilelah, regenarasi sel, mengurangi sintesis kolesterol dan menghambat penimbunan lemak di dalam sel otot polos vascular (Shrivastava, 2001). Sedangkan ester hidroksisitrat memiliki banyak kegunaan yaitu sebagai campuran kosmetik dan pembersih kulit (Kamachi 2007), anti tumor, anti oksidan, anti keracunan sel (Mackeen, 2012), mengurangi bau badan (Gupta, 2007), anti mikroba, anti bakteri, anti jamur (Mackeen, 2000).
2.2 Ester
Ester adalah senyawa organik yang memiliki karakteristik gugus fungsi sebagai berikut (Stoker, 1991):
C
RII O
O RI
Gambar 2.11 Struktur gugus fungsi Ester
2.2.1 Esterifikasi
Esterifikasi adalah proses pembuatan ester. Esterifikasi dapat dilakukan dengan berbagai cara dan menggunakan bermacam – macam katalis.
Esterifikasi dapat dilakukan dengan mereaksikan asam karboksilat dengan alkohol dan menggunakan asam sebagai katalis, dapat berupa asam sulfat maupun asam klorida (Fessenden, 1986) atau pun RSO3H, dan H3PO4 sebagai katalis homogen (Nowicki, 2013). Reaksi esterifikasi yang sederhana di buat yaiitu dengan mereaksikan asam asetat dengan etanol menghasilkan etil asetat dengan air (Gambar 2.12).
CH3
O
OH
C HO
CH2 CH
3
CH3 C
O CH2 CH3
+
O
+ H2O
asam asetat etanol etil asetat
Gambar 2.12. Reaksi Asam asetat dengan Alkohol menghasilkan etil asetat. Karena reaksi esterifikasi bersifat reversible, maka untuk memperoleh rendemen tinggi dari ester, kesetimbangan harus di geser kearah sisi ester. Salah satu teknik yang di gunakan adalah menggunakan salah satu zat pereaksi yang berlebih dan teknik lain nya yaitu membuang salah satu produk dari dalam campuran pereaksi. Misalnya, dengan menghilangkan air (Fessenden, 1989). Pada umumnya, zat pereaksi yang di gunakan berlebih adalah alkohol. Hal ini di karenakan alkohol dengan air dapat membentuk campuran heteroazeotrop, sehingga air tersebut dapat di hilangkan (Nowocki,2013). Untuk menghilangkan air yang terbentuk dapat juga di gunakan asam sulfat pekat, hal ini di sebabkan karena asam sulfat pekat bersifat hidroskopis (Austin, 1966).
Reaksi antara alkohol dengan asam karboksilat dapat berlangsung tergantung struktur kedua nya.
Kereaktifan alkohol berikut membentuk ester:
O
R C OH
O
R C OC
+ C OH
H2SO4 (p)
asam karboksilat tersier butanol ester tersier butil karboksilat
H3C
MgSO4
CH2Cl2
CH3
CH3 CH3 H3C
H3C
HCOOH > CH3CO2H > RCH2CO2H > R2CHCO2H > R3CCO2H (Nowicki,2013).
Sebagai contoh esterifikasi asam hidroksi sitrat dengan alkohol primer misalnya dengan mereaksikan asam asetat dengan etanol menghasilkan etil asetat (Stoker, S.2008). Dimana diketahui bahwa etil asetat dapat dipergunakan sebagai pelarut (Reaksi 2.8).
Esterifikasi asam karboksilat dengan alkohol skunder sebagai contoh reaksi antara asam butirat dengan 2-heksanol menghasilkan 2-heksil butirat dapat dilihat pada Gambar 2.13 dibawah ini (Romero, 2011).
O
C3H7 C OH
O
C3H7 C OC6H13 +
Novozym 435
+ H20
asam butirat 2-heksanol 2-heksil butirat OH
C4H9 C CH3 H
Gambar 2.13. Reaksi Asam Karboksilat dengan Alkohol Skunder.
Reaksi asam karboksilat dengan alkohol tersier sebagi contoh yaitu reaksi antara asam karboksilat dengan tersier butanol. Cara yang dilakukan yaitu dahulu diawali dengan dehidrasi tersier butanol menjadi isobutilena yang diikuti dengan adisi asam karboksilat menghasilkan ester tersier butil karboksilat. Reaksi dapat dilihat pada Gambar 2.14 dibawah ini.seperti (Otera,2003) .
Gambar 2.14. Esterifikasi Asam Karboksilat dengan Tersier Butanol
Esterifikasi asam hidroksisitrat dengan alkohol skunder dan alkohol primer pada umumnya lebih sulit dilakukan karena adanya halangan sterik yang lebih besar dari alkohol primer (Nowicki, 2013).
Katalis merupakan suatu senyawa yang dapat meningkatkan laju reaksi tetapi tidak ikut terkonsumsi oleh reaksi. Katalis digunakan secara luas baik di laboratorium dan industri (Shriver & Atkins, 1999 ).
Suatu katalis biasanya bekerja dengan membentuk ikatan kimia ke satu atau lebih pereaksi yang kemudian dapat membantu konversi dari pereaksi menjadi produk. Katalis tidak mempengaruhi kesetimbangan reaksi. Penjelasan kimia dari proses katalisis secara kualitatif diberikan melalui mekanisme reaksi (Gates, 1991).
Katalis pada dasarnya dapat dibagi menjadi tiga bagian, yaitu: katalisis homogen, katalisis heterogen, dan katalisis enzim.
2.3.1. Katalis Homogen
Pada sistem katalisis homogen, katalis mempunyai fasa yang sama dengan reaktan dan produk reaksi (Istadi,2011), katalis homogeny juga dapat dibagi menjadi katalis asam dan katalis basa. Katalis asam homogen umumnya digunakan adalah H2SO4, HCl, dan H3PO4. Akan tetapi penggunaan katalis ini memerlukan waktu reaksi yang lama, dapat menyebabkan korosi pada reaktor yang digunakan, rasio molar alkohol dengan minyak harus besar serta memerlukan suhu yang tinggi (Helwani, 2009).
Cara kerja katalis homogen umumnya melibatkan pembentukan senyawa kompleks antara yang bersifat tidak stabil dalam tahap – tahap reaksi. Katalis dengan reaktan membentuk kompleks antara yang mengakibatkan reaktan dalam kompleks menjadi aktif membentuk produk baru dan disertai dengan pelepasan katalisatornya (Sugiyarto,2003). Kerugian katalis homogen adalah sulit untuk dipisahkan dari produk dan biayanya mahal. Katalis homogen juga dapat menyebabkan korosi dan pencemaran lingkungan (Gates, dkk.,1979).
2.3.2. Katalis Heterogen
pendopingan oksida logam untuk meningkatkan kebasaannya seperti oksida logam Na, Li, dan K yang didoping pada CaO, MgO dan BaO (D’Cruz, 2007) dan oksida campuran antara oksida logam Na, Li, dan La2O3 (Singh dan Fernando 2009).
Selain katalis heterogen basa, banyak juga katalis heterogen asam yang dapat digunakan untuk reaksi esterifikasi. Katalis senyawa karbon berbasis sulfonat menjadi katalis yang paling diminati saat ini karena memiliki gugus –SO3H dengan kerangka karbon yang stabil dan memiliki aktifitas katalitik yang ( Voort,dkk, 2013). Kiss, dkk (2006) telah meneliti penggunaan resin penukar ion sebagai katalis reaksi esterifikasiyaitu Amberlyst-15 dan Nafion-NR50. Dari hasil yang diperoleh, diketahui bahwa kedua katalis ini meskipun memiliki banyak gugus sulfonat, namun kedua resin tersebut menunjukkan ketidakstabilan selama proses reaksi. Kedua katalis ini menunjukkan aktivitas awal yang cukup tinggi, tapi katalis Amberlyst-15 setelah 2 jam reaksi menjadi tidak aktif, sedangkan katalis Nafion-NR50 setelah 4,5 jam reaksi. Hal ini membuat kedua katalis resin tersebut tidak dapat digunakan secara terus-menerus dalam proses industri. Disamping itu, harga kedua katalis tersebut sangat mahal.
Sidabutar (2011) telah menggunakan katalis padat polistirena sulfonat dengan derajat sulfonasi 6,24% pada reaksi transesterifikasi minyak jarak berkadar asam lemak bebas tinggi menghasilkan metil ester sebesar 93%. Namun katalis ini tidak tahan terhadap suhu tinggi dan mudah terdegradasi.
Bangun,dkk (2015) baru-baru ini telah mensintesis katalis berfase padat turunan dari silana yang tersubsitusi dengan gugus fenil sulfonat yaitu 1,1,2,2-tetrafenilsulfonatodisilana (DMTPS) dengan cara mensulfonasi 1,2-dimetil-1,1,2,2-tetrafenildisilana. Katalis ini memiliki kestabilan termal sangat baik, dapat digunakan pada suhu tinggi yang bersifat reusable dan mampu mengkatalisis reaksi esterifikasi asam karboksilat rantai panjang dengan alkohol primer dan skunder.
antara alkohol dengan minyak atau lemak akan semakin besar sehingga tidak perlu menggunakan co-solvent seperti dietil eter dan benzen.
2.3.3. Katalis Enzim
Enzim adalah molekul-molekul protein dengan ukuran koloid yang berada diantara ranah homogen molekular dan heterogen makroskopik. Enzim merupakan gaya penggerak di dalam reaksi-reaksi biokimia. Biasanya enzim merupakan katalis yang sangat efisien dan selektif. Sebagai contoh, reaksi dekomposisi H2O2 yang dikatalisasi oleh enzim catalase adalah lebih cepat 109 kali daripada dikatalisasi oleh katalis anorganik (Istadi,2011).
Banyak reaksi yang dikatalisis enzim berlangsung di dalam sel biologis. Di dalam sitoplasma terkandung larutan biologis dengan banyak molekul, termasuk reaktan, produk, dan enzim di dalam larutan. Karakteristik khusus Enzim memiliki struktur yang fleksibel. Sifat fleksibel ini sangat penting dalam mengkatalisis reaksi. Sebagai contoh, ikatan reaktan dengan enzim dapat dibuat menjadi kecil tetapi perubahan signifikan dalam geometri bagian katalitik, seperti hasil dari pembatasan pembelahan, pemutusan antara enzim dan intermediet katalitik lebih baik daripada pemutusan antara enzim dan reaktan.
BAB 3
METODE PENELITIAN
3.1 Alat-alat − Thermo Control
− Indikator Universal Macherey Nagel
− Lemari Pendingin UHF-200T Uchida
− Neraca Digital AS 220/C/2 Radwag