UJI AKTIVITAS PENGHAMBATAN ENZIM ALFA AMILASE DENGAN EKSTRAK ETANOL BATANG BROTOWALI
(Tinospora crispa L.) Hook. f. & Thomson SECARA IN VITRO
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh:
Fetiana Chrismaurin NIM : 168114168
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
UJI AKTIVITAS PENGHAMBATAN ENZIM ALFA AMILASE DENGAN EKSTRAK ETANOL BATANG BROTOWALI
(Tinospora crispa L.) Hook. f. & Thomson SECARA IN VITRO
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh:
Fetiana Chrismaurin NIM : 168114168
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
“I may fall down and get hurt. But, I still run endlessly towards my dreams” -Epilogue: Young Forever by 방탄소년단, 2016-
Skripsi ini saya persembahkan kepada:
Tuhan Yesus Kristus sebagai sumber kekuatan, harapan dan kebijaksanaan. Bapak, Ibu dan Gamaliel yang selalu mendukung dan mendoakan saya.
vii
PRAKATA
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala berkat dan kasih-Nya penulis dapat menyelesaikan skripsi yang berjudul ”Uji Aktivitas Penghambatan Enzim Alfa Amilase dengan Ekstrak Etanol Batang Brotowali (Tinospora crispa L.) Hook. f. & Thomson secara In Vitro” dengan baik dan lancar. Skripsi ini disusun sebagai salah satu pemenuhan syarat untuk mendapatkan gelar sarjana farmasi (S. Farm) di Fakultas Farmasi Universitas Sanata Dharma.
Keberhasilan penulis dalam menyusun naskah skripsi ini juga tidak terlepas dari bantuan, arahan dan bimbingan dari berbagai pihak, baik secara langsung maupun tidak langsung. Oleh karena hal tersebut penulis ingin mengucapkan terima kasih kepada:
1. Ibu Dr. Yustina Sri Hartini, Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma dan dosen pembimbing yang senantiasa memberikan bantuan, arahan, saran dan pendampingan dengan sabar dari awal penyusunan naskah proposal, penelitian hingga penyusunan naskah skripsi. 2. Bapak Maywan Hariono, Ph.D., Apt. selaku dosen penguji yang sudah memberikan arahan dan saran yang sangat berguna dalam penyusunan skripsi ini menjadi lebih baik lagi.
3. Ibu Dr. Erna Tri Wulandari, Apt. selaku dosen penguji yang sudah memberikan arahan dan saran yang sangat berguna dalam penyusunan skripsi ini menjadi lebih baik lagi.
4. Ibu Dina Christin Ayuning Putri, M.Sc., Apt. selaku Dosen Pembimbing Akademik yang sudah memberikan bantuan dan pendampingan sejak awal memasuki dunia perkuliahan di Fakultas Farmasi Sanata Dharma.
5. Pak Dwi Priyana dan Pak Sarwanto selaku sekretariat S1 Fakultas Farmasi Universitas Sanata Dharma yang selalu membantu dan memberikan informasi selama pelaksanaan perkuliahan dari awal hingga akhir.
6. Pak Wagiran, Pak Kayat dan Mas Bimo selaku laboran yang selalu membantu dan memberikan kemudahan selama pelaksanaan penelitian.
viii
7. Bapak, Ibu dan Gamaliel yang selalu mendoakan, mendukung dan menyemangati sepanjang jalan kehidupan penulis.
8. Teman-teman penelitian dalam kelompok ‘Alfa Amilase” yang selalu membantu, mendukung, berbagi ilmu dan memberikan saran selama proses penelitian.
9. Teman-teman tempat penulis berkeluh kesah dan berbagi cerita Monica Tiara Dewi, Yasinta Tri Astuti, Stephanus Adven dan lainnya yang selalu mendukung, menemani dan menyemangati penulis dari awal mengikuti “TITRASI” hingga saat ini.
10. Tim “98 Liners” Natasya Safetyani, Saffana Iliyuna dan Yuana Dysa yang selalu saling mendukung dan mendoakan dalam proses penyusunan skripsi. 11. Tim Expo FACTION #2 Tommy Aditya, Maria Yessica, Edward Subastian, Agista Bangalino dan Eka Yuliana yang selalu memberikan kebahagiaan dan dukungan selama perkuliahan.
12. 방탄소년단 yang selalu memberikan motivasi, inspirasi dan harapan lewat lagu dan kata-kata lain selama penulis berada dalam “the most struggle
phase” dalam proses penyusunan skripsi.
13. Teman-teman angkatan 2016 yang saling mendukung selama perkuliahan. 14. Seluruh pihak yang terlibat dalam penyusunan skripsi ini yang tidak dapat
disebutkan satu persatu.
Penulis menyadari bahwa masih banyak kekurangan dalam penyusunan skripsi ini mengingat terbatasnya pengetahuan dan kemampuan penulis dalam menyusun naskah. Oleh karena itu, penulis ingin meminta maaf apabila terdapat kesalahan baik dalam penulisan maupun pemilihan kata. Penulis berharap adanya kritik serta saran yang membangun agar naskah ini menjadi lebih baik. Akhir kata, semoga skripsi ini dapat bermanfaat bagi pihak yang membutuhkan, terutama dalam perkembangan ilmu pengetahuan khususnya pada bidang kefarmasian.
Yogyakarta, 17 Juli 2020
ix
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN SKRIPSI ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI... vi
PRAKATA ... vii
DAFTAR ISI ... ix
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
ABSTRAK ... xiv
ABSTRACT ... xv
PENDAHULUAN ... 1
METODE PENELITIAN ... 3
HASIL DAN PEMBAHASAN ... 11
KESIMPULAN ... 26
SARAN ... 26
DAFTAR PUSTAKA ... 27
LAMPIRAN ... 32
x
DAFTAR TABEL
Tabel I. Identifikasi metabolit sekunder serbuk simplisia... 15
Tabel II. Identifikasi metabolit sekunder ekstrak batang brotowali... 15
Tabel III. Identifikasi metabolit sekunder serbuk simplisia ... 17
Tabel IV. Identifikasi metabolit sekunder ekstrak batang brotowali ... 18
Tabel V. Nilai persentase penghambatan acarbose ... 20
Tabel VI. Nilai persentase penghambatan ekstrak etanol batang brotowali ... 21
xi
DAFTAR GAMBAR
Gambar 1. Hasil elusi KLT di bawah lampu UV 254 nm (a) Hasil uji KLT serbuk
simplisia daun sambiloto (b) Hasil uji KLT ekstrak batang brotowali ... 14
Gambar 2. Hasil elusi KLT di bawah lampu UV 366 nm (a) Hasil uji KLT serbuk simplisia daun sambiloto (b) Hasil uji KLT ekstrak batang brotowali ... 17
Gambar 3. Struktur Acarbose ... 25
Gambar 4. (a) Struktur Borapetosida A; (b) Struktur Borapetosida C ... 25
Gambar 5. Struktur Amilum ... 25
Gambar 6. Serbuk Simplisia Batang Brotowali ... 34
Gambar 7. Ekstrak Etanol Batang Brotowali ... 34
Gambar 8. Penentuan Kadar Air... 35
Gambar 9. Perolehan Panjang Gelombang Maksimum ... 37
xii
DAFTAR LAMPIRAN
Lampiran 1. Surat Determinasi Serbuk Simplisia Batang Brotowali (Tinospora
crispa L.) Hook. f. & Thomson ... 32
Lampiran 2. Certificate of Alpha Amylase Enzyme ... 33
Lampiran 3. Serbuk Simplisia Batang Brotowali dan Ekstrak Etanol Batang Brotowali ... 34
Lampiran 4. Penentuan Kadar Air Serbuk Simplisia Batang Brotowali .... 35
Lampiran 5. Perhitungan Uji Kadar Air Serbuk Simplisia ... 35
Lampiran 6. Perhitungan Rendemen Simplisia ... 35
Lampiran 7. Identifikasi Senyawa Metabolit Sekunder Serbuk Simplisia Batang Brotowali dan Ekstrak Batang Brotowali dengan Metode KLT ... 36
Lampiran 8. Penentuan Panjang Gelombang Maksimum ... 37
Lampiran 9. Penentuan Operating Time (OT) ... 38
Lampiran 10. Perhitungan Larutan Buffer Phosphate pH 6,9 ... 38
Lampiran 11. Data dan Perhitungan Nilai Absorbansi ... 38
Lampiran 12. Uji Shapiro Wilk Nilai Persentase Penghambatan Ekstrak Etanol Batang Brotowali ... 40
Lampiran 13. Uji Levene Nilai Persentase Penghambatan Ekstrak Etanol Batang Brotowali ... 41
Lampiran 14. Uji ANOVA Satu Arah Nilai Persentase Penghambatan Ekstrak Etanol Batang Brotowali ... 41
Lampiran 15. Uji Post-Hoc Tukey Nilai Persentase Penghambatan Ekstrak Etanol Batang Brotowali dalam Tiap Konsentrasi ... 41
Lampiran 16. Uji Shapiro Wilk Nilai Persentase Penghambatan Acarbose42 Lampiran 17. Uji Levene Nilai Persentase Penghambatan Acarbose ... 43
Lampiran 18. Uji ANOVA Satu Arah Nilai Persentase Penghambatan Acarbose ... 43
Lampiran 19. Uji Post-Hoc Tukey Nilai Persentase Penghambatan Acarbose dalam Tiap Konsentrasi ... 43
xiii
Lampiran 20. Uji T Perbandingan Nilai IC50 Ekstrak Etanol Batang Brotowali dan Acarbose ... 44
xiv
ABSTRAK
Diabetes melitus merupakan kelompok penyakit metabolik yang dikarakterisasi dengan kondisi hiperglikemia kronis yang muncul dari kerusakan pada sekresi insulin, kerja insulin atau keduanya. Komplikasi jangka panjang dari diabetes melitus meliputi retinopati, nefropati, neuropati, mikroangiopati dan peningkatan risiko penyakit kardiovaskular. Salah satu cara untuk mengatasi kondisi hiperglikemia pada individu dengan diabetes melitus adalah dengan menggunakan bahan obat alternatif atau bahan alam. Salah satu tanaman yang memiliki efek antihiperglikemia adalah brotowali (Tinospora crispa L.) Hook. f. & Thomson. Penelitian ini bertujuan untuk mengetahui potensi dari ekstrak etanol batang brotowali dalam menghambat enzim alfa amilase secara in-vitro. Hasil pengujian yang dilakukan diperoleh nilai persentase penghambatan berturut-turut pada konsentrasi 4; 8; 15 dan 20 mg/ml sebesar 41.87%; 60.47%; 77.90% dan 87.16% dengan nilai r berturut-turut dari replikasi pertama hingga replikasi ketiga sebesar 0.981; 0.990 dan 0.980. Sementara itu untuk nilai IC50 ekstrak etanol batang brotowali yang diperoleh berturut-turut dari replikasi pertama hingga replikasi ketiga sebesar 11.84; 11.83 dan 11.30 mg/ml dengan rata-rata nilai IC50 sebesar 11.66 mg/ml ± 0.31 dan nilai CV sebesar 2.66%. Berdasarkan analisis statistika yang membandingkan nilai IC50 acarbose dengan ekstrak etanol batang brotowali diperoleh nilai p<0.05 bahwa terdapat perbedaan yang signifikan pada aktivitas penghambatan terhadap enzim alfa amilase antara acarbose dengan ekstrak etanol batang brotowali.
Kata Kunci: Diabetes melitus, hiperglikemia, batang brotowali, ekstrak etanol, enzim alfa amilase, borapetosida, spektrofotometer uv-vis
xv
ABSTRACT
Diabetes mellitus is a metabolic disease characterized by the condition of a chronic hyperglycemia resulting from a deficiency in insulin secretion, insulin action or both. Long terms complications of diabetes mellitus include retinopathy, nephropathy, neuropathy, microangiopathy and risk factor of cardiovascular disease. One of the ways to overcome the condition of hyperglycemia in individuals with diabetes mellitus is by using alternative medicine ingredients or natural ingredients. One of the herbals that has an antihyperglycemic effect is brotowali (Tinospora crispa L.) Hook. f. & Thomson. The aim of this study was to find out whether the potential of ethanolic extract of brotowali stem is capable to inhibit alpha amylase enzyme as in vitro. The result shows the inhibition percentage at the concentration 4; 8; 15 and 20 mg/ml is 41.87%; 60.47%; 77.90% and 87.16% consecutively with the r value from the first replication to the third replication consecutively is 0.981; 0.990 and 0.980. Meanwhile, for the IC50 value of ethanolic extract of brotowali stem, we obtained from the first replication to the third replication consecutively is 11.84; 11.83 dan 11.30 mg/ml with the average of IC50 value is 11.66 mg/ml ± 0.31 and CV value is 2.66%. Based on statistical analysis comparing the IC50 value of acarbose with ethanolic extract of brotowali stem, we obtained that p<0.05 showed a significant difference in the inhibitory activity of the alpha amylase enzyme in between acarbose and ethanolic extract of brotowali stem.
Keyword: diabetes mellitus, hyperglycemia, brotowali stem, ethanolic extract, alpha amylase enzyme, borapetoside, spectrophotometer uv-vis
1
PENDAHULUAN
Diabetes melitus merupakan kelompok penyakit metabolik yang dicirikan dengan kondisi hiperglikemia kronis yang muncul dari kerusakan pada sekresi insulin, kerja insulin atau keduanya. Abnormalitas metabolik pada karbohidrat, lemak, dan protein merupakan hasil dari pentingnya insulin sebagai hormon anabolik (Kharroubi, 2015). Diabetes melitus dapat menyebabkan komplikasi jangka panjang yang meliputi retinopati, nefropati, neuropati, mikroangiopati dan peningkatan risiko penyakit kardiovaskular (de Sales et al., 2012).
Salah satu cara untuk mengatasi kondisi hiperglikemia pada pasien diabetes melitus khususnya diabetes melitus tipe dua adalah menurunkan kadar gula darah
post-prandial dengan mekanisme memperlambat absorbsi glukosa dengan
menghambat enzim yang menghidrolisis karbohidrat yaitu alfa glukosidase dan alfa amilase yang bertanggung jawab terhadap pemecahan oligosakarida dan disakarida menjadi monosakarida yang cocok untuk diabsorbsi (de Sales et al., 2012). Enzim pankreatik alfa amilase berperan sebagai katalis pada reaksi hidrolisis dengan memutus ikatan alfa-1,4 glikosidik yang berhubungan dengan pati, amilose, glikogen dan beberapa maltodekstrin serta bertanggung jawab terhadap pencernaan pati (Agarwal and Gupta, 2016; de Sales et al., 2012). Penghambatan dari kedua enzim tersebut secara signifikan dapat menurunkan peningkatan kadar glukosa darah post-prandial dengan mekanisme menunda pencernaan karbohidrat dan memperpanjang waktu pencernaan karbohidrat sehingga menyebabkan reduksi absorbsi glukosa. Lebih lanjut hal tersebut dapat digunakan sebagai salah satu strategi penting dalam manajemen terapi pada pasien diabetes melitus tipe dua (Tundis, Loizzo and Menichini, 2010; Elya et al., 2015).
Senyawa yang diketahui dan digunakan secara luas untuk terapi antihiperglikemia pada pasien diabetes melitus tipe dua adalah acarbose. Acarbose dikenal sebagai agen antidiabetik oral noninsulintropik dan merupakan inhibitor enzim alfa amilase dan alfa glukosidase yang memiliki mekanisme mereduksi dan memperlambat absorpsi glukosa pada intestinal (Rosak and Mertes, 2012; Oboh et
2
Brotowali (Tinospora crispa L.) Hook. f. & Thomson merupakan tanaman herbal yang sering dijumpai di Indonesia. Banyak yang meggunakan akar, batang dan daun untuk dibuat jamu yang diyakini dapat menyembuhkan berbagai penyakit. Brotowali diketahui mengandung senyawa metabolit sekunder seperti flavonoid, terpenoid, alkaloid, lignan, nukleosida, dan sterol (Ahmad, Jantan and Bukhari, 2016). Lebih lanjut pada skrining fitokimia yang dilakukan oleh Elya et al., (2015) menurut prosedur Materia Medika Indonesia dan Harborne (MoH., 1995; Harborne, 1987) ekstrak etanol batang brotowali mengandung alkaloid, flavonoid, glikosida dan terpenoid. Sejumlah terpenoid diklasifikasikan sebagai triterpenoid dan diterpenoid (Ahmad, Jantan and Bukhari, 2016).
Menurut penelitian yang dilakukan oleh Lam et al., (2012) telah diisolasi tiga diterpenoid yang baru yaitu 2-O-lactoylborapetoside B, 6’-O-lactoylborapetoside dan tinocrispol A bersamaan dengan sembilan diterpenoid yang sudah diketahui dan diidentifikasi sebagai borapetosida A-F, borapetol A dan B dan columbin dari ekstrak etanol tanaman brotowali. Diterpenoid dan glikosida merupakan terpenoid utama dalam tanaman brotowali dan yang paling umum adalah clerodane-type furanoditerpenoids (Koay and Amir, 2013). Clerodane-type furanoditerpenoids terdiri atas borapetosida A, B dan C (Ruan et al., 2013).
Lebih lanjut dikemukakan bahwa menurut penelitian yang dilakukan oleh Lam et al., (2012) ekstrak etanol batang brotowali yang dibuat dengan metode pengadukan dan dilanjutkan dengan sentrifugasi diketahui mengandung senyawa borapetosida A dan C dapat menurunkan kadar plasma glukosa pada tikus keadaan normal dan pada tikus yang diinduksi streptozocin dengan diabetes melitus tipe satu di bawah pemeriksaan aktivitas antihiperglikemia secara in vivo. Senyawa borapetosida C dikatakan mampu menstimulasi sekresi insulin pada tikus normal dan tikus dengan diabetes melitus tipe 2. Hal ini sesuai dengan yang dilaporkan oleh Ruan et al., (2013) yang menunjukkan bahwa borapetosida C dan senyawa analognya merupakan inhibitor enzim dengan efek antihiperglikemia. Pada penelitian yang dilakukan oleh Lokman et al., (2013) ketika sel-sel pulau Langerhans pankreas dari tikus Wistar and Goto-Kakizaki diisolasi dengan diberi borapetol B yang diisolasi dari ekstrak heksan batang brotowali yang dibuat dengan
3
metode sonifikasi menyatakan bahwa terjadi peningkatan sekresi insulin dari sel-sel pulau Langerhans. Hal tersebut terjadi tanpa menyebabkan kebocoran insulin dari rusaknya sel beta pulau Langerhans.
Terkait dengan adanya kandungan senyawa diterpenoid khususnya borapetosida A dan C pada batang brotowali yang mampu menurunkan kadar glukosa darah, maka diharapkan dengan adanya sediaan ekstrak etanol batang brotowali dapat digunakan sebagai terapi antihiperglikemia. Berdasarkan hal tersebut peneliti ingin mengetahui pengaruh efek antihiperglikemia dengan uji aktivitas penghambatan enzim alfa amilase oleh ekstrak etanol batang brotowali yang dilakukan secara in vitro.
Pada penelitian ini dilakukan ekstraksi dengan metode maserasi dengan pelarut etanol 70%. Menurut Farmakope Herbal Indonesia (2008) pembuatan ekstrak dari serbuk simplisia kering dibuat dengan menggunakan metode maserasi dengan pelarut yang sesuai. Alasan digunakan metode maserasi dalam proses ekstraksi adalah karena borapetosida A dan C yang termasuk dalam golongan terpenoid memiliki karakteristik tidak tahan panas atau thermolabile. Pemilihan pelarut yang digunakan yaitu etanol 70% karena terpenoid larut dalam pelarut organik dan biasanya sukar larut dalam air (Yadav, Yadav and Goyal, 2014).
METODE PENELITIAN
Alat dan Bahan Penelitian
Alat-alat yang digunakan dalam penelitian ini antara lain oven, timbangan analitik (Mettler Toledo®), rotary evaporator (BUCHI®), seperangkat alat penyulingan untuk penetapan kadar air (MTOPS®), alat-alat gelas (gelas beaker, gelas ukur, tabung reaksi, batang pengaduk, erlenmeyer, labu tentukur, pipet volume, pipet ukur, pipet tetes, corong, kaca arloji), cawan porselen, sendok, penangas air, hot plate, vortex, lemari asam, corong buchner, shaker (Innova® 2100), kertas saring Whatman nomor satu, mikropipet (SOCOREX), yellow tips,
4
plat silika gel untuk kromatografi lapis tipis (KLT) GF254, bejana, lampu UV (CAGMA®), glass firn, mortir dan stamper.
Bahan-bahan yang digunakan meliputi serbuk batang brotowali yang diperoleh dari PT. HRL Internasional di Kabupaten Gresik, Jawa Timur, enzim alfa amilase (SIGMA Aldrich), reagen iodin, dimetil sulfoksida (E. Merck), tablet acarbose, etanol 70%, potato starch, HCL 1M, aquabidest, toluena pro-analisis (E. Merck), baku kuersetin, kloroform pro-analisis (E. Merck), metanol pro-analisis (E. Merck).
Tata Cara Penelitian
Pengumpulan Bahan Uji dan Identifikasi Serbuk Simplisia Batang Brotowali Bahan uji berupa serbuk simplisia diperoleh dari PT. HRL Internasional di Kabupaten Gresik, Jawa Timur dan dilakukan identifikasi di Departemen Biologi Farmasi Fakultas Farmasi Universitas Gadjah Mada Yogyakarta.
Penetapan Kadar Air pada Serbuk Simplisia Batang Brotowali
Penetapan kadar air dilakukan dengan metode distilasi toluena. Dimasukkan 10 gram simplisia kering batang brotowali dan 200 ml toluena jenuh air yang sudah dibuat tadi ke dalam labu. Toluena jenuh air dimasukkan ke tabung penerima melalui pendingin sampai batas leher alat penampung dan dipanaskan selama 15 menit. Setelah toluena mulai mendidih, penyulingan diatur dengan kecepatan lebih kurang dua tetes per detik hingga sebagian besar air tersuling, kemudian kecepatan penyulingan dinaikkan hingga empat tetes tiap detik selama lima menit. Setelah selesai, tabung penerima didinginkan hingga suhu ruang dan kemudian volume air dibaca setelah air dan toluena terpisah (Direktorat Jendral Bina Kefarmasian dan Alat Kesehatan RI, 2013). Kadar air dihitung dengan rumus:
% Kadar air = 𝑣𝑜𝑙𝑢𝑚𝑒 𝑎𝑖𝑟 (𝑚𝑙)
𝑏𝑒𝑟𝑎𝑡 𝑠𝑖𝑚𝑝𝑙𝑖𝑠𝑖𝑎 𝑦𝑎𝑛𝑔 𝑑𝑖𝑡𝑖𝑚𝑏𝑎𝑛𝑔 (𝑔) x 100%
5
Pembuatan Ekstrak Etanol Batang Brotowali
Pembuatan ekstrak dilakukan secara maserasi dengan cara ditimbang secara saksama lebih kurang 10 gram serbuk simplisia kering dan dilarutkan ke dalam 100 ml etanol 70%, ditutup terlindung dari cahaya matahari, lalu dibiarkan selama 24 jam sambil diaduk menggunakan shaker pada suhu ruang dan kecepatan pengadukan 200 rpm. Hasil maserat disaring menggunakan corong buchner yang dilapisi kertas saring whatman nomor satu sambil dilakukan vakum. Residu hasil penyarian dimaserasi kembali dengan pelarut yang baru selama 24 jam. Proses maserasi dilakukan sebanyak tiga kali. Hasil filtrat diuapkan menggunakan rotary
evaporator pada suhu 60̊ C untuk menguapkan pelarut yang terdapat dalam ekstrak
dan dipekatkan di atas penangas air hingga ekstrak benar-benar pekat untuk menghilangkan pelarut yang masih tersisa di dalam ekstrak (Atmajani et al., 2018; Harwoko and Choironi, 2016; Mun’im et al., 2013; Parimelazhagan, 2016). Hasil ekstrak kemudian dihitung nilai rendemennya dengan rumus:
% Rendemen = (𝐵𝑒𝑟𝑎𝑡 𝑒𝑘𝑠𝑡𝑟𝑎𝑘 𝑦𝑎𝑛𝑔 𝑑𝑖𝑑𝑎𝑝𝑎𝑡)
𝐵𝑒𝑟𝑎𝑡 𝑏𝑎ℎ𝑎𝑛 𝑏𝑎𝑘𝑢 𝑎𝑤𝑎𝑙 x 100%
(Rezki, Anggoro and MZ, 2015)
Uji Kandungan Metabolit Sekunder dengan Metode Kromatografi Lapis Tipis (KLT)
Dilakukan uji kandungan terpenoid pada serbuk simplisia dan ekstrak etanol batang brotowali. Untuk serbuk simplisia dengan membuat larutan uji dengan cara timbang saksama lebih kurang 1 gram sebuk simplisia rendam sambil diaduk di atas penangas air dengan 10 ml pelarut metanol P selama 10 menit. Masukkan filtrat ke dalam labu tentukur 10 ml tambahkan pelarut hingga batas tanda. Sementara itu untuk ekstrak dilakukan dengan cara timbang saksama lebih kurang 20 mg ekstrak, dilarutkan dengan 5 ml metanol P dan diaduk di atas penangas air selama 10 menit. Masukkan filtrat ke dalam labu tentukur 5 ml tambahkan pelarut hingga batas tanda. Dibuat larutan pembanding yaitu kuersetin 1% dengan cara timbang saksama lebih kurang 0,05 mg senyawa pembanding kuersetin kemudian dilarutkan dalam 5 ml metanol P. Lempeng silika yang akan digunakan dilakukan aktivasi terlebih dahulu dengan memanaskan lempeng silika dalam oven pada suhu 100̊C selama 5-10 menit
6
untuk mengurangi kadar air dalam lempeng. Totolkan larutan uji dan larutan pembanding pada plat KLT menggunakan pipa kapiler dengan jarak 1,5 – 2 cm dari tepi bawah lempeng dan biarkan mengering. Keluarkan plat KLT dan keringkan di udara. Amati bercak dengan sinar tampak UV gelombang pendek (254 nm) dan UV gelombang panjang (366 nm). Ukur dan catat jarak tiap bercak dari titik penotolan serta catat panjang gelombang untuk tiap bercak diamati (Direktorat Jendral Bina Kefarmasian dan Alat Kesehatan RI, 2013). Harga Rf (faktor retensi) dapat
ditentukan dengan rumus:
Rf = 𝑗𝑎𝑟𝑎𝑘 𝑦𝑎𝑛𝑔 𝑑𝑖𝑡𝑒𝑚𝑝𝑢ℎ 𝑜𝑙𝑒ℎ 𝑘𝑜𝑚𝑝𝑜𝑛𝑒𝑛
𝑗𝑎𝑟𝑎𝑘 𝑦𝑎𝑛𝑔 𝑑𝑖𝑡𝑒𝑚𝑝𝑢ℎ 𝑜𝑙𝑒ℎ 𝑝𝑒𝑙𝑎𝑟𝑢𝑡
(Kumar, Jyotirmayee and Sarangi, 2013)
Uji Aktivitas Penghambatan Enzim Alfa Amilase
Uji aktivitas penghambatan enzim alfa amilase dilakukan berdasar pada penelitian Hamid et al., 2015; Ononamadu et al., 2020; dan Pramitasari, Pujiyanto and Suprihadi, 2017 dengan dilakukan modifikasi.
Pembuatan Larutan Uji
Pembuatan larutan uji meliputi pembuatan larutan soluble starch (0,5%) dengan cara melarutkan 0,25 gram amilum ke dalam 50 ml aquabidest. Dibuat larutan DMSO 1% dengan cara melarutkan 1 ml DMSO dalam 100 ml aquabidest. Dibuat larutan seri konsentrasi ekstrak etanol batang brotowali dengan konsentrasi 4; 8; 15 dan 20 mg/ml. Sebanyak 200 mg ekstrak etanol batang brotowali dilarutkan dengan DMSO 1% dalam labu tentukur 10 ml dan ditambahkan DMSO 1% hingga batas tanda sehingga diperoleh konsentrasi 20 mg/ml (labu 1). Diambil sebanyak 7,5 ml dari labu 1 dimasukkan dalam labu tentukur 10 ml dan ditambah DMSO 1% hingga batas tanda sehingga diperoleh konsentrasi 15 mg/ml (labu 2). Diambil sebanyak 5.34 ml dari labu 2 dimasukkan dalam labu tentukur 10 ml dan ditambah DMSO 1% hingga batas tanda sehingga diperoleh konsentrasi 8 mg/ml (labu 3). Diambil sebanyak 5 ml dari labu 3 dimasukkan dalam labu tentukur 10 ml dan ditambahkan DMSO 1% hingga batas tanda sehingga diperoleh 4 mg/ml (labu 4). Dibuat larutan buffer phosphate pH 6,9 dengan melarutkan 3280 mg natrium fosfat (Na3PO4) dengan aquabidest dan 391,95 mg natrium klorida (NaCl) dengan
7
aquabidest dimasukkan dalam labu tentukur 100 ml dan ditambahkan aquabidest hingga batas tanda. Dibuat larutan enzim alfa amilase dengan cara diambil sebanyak 0,15 ml dan ditambahkan dalam 100 ml larutan buffer phosphate pH 6,9. Dibuat larutan seri konsentrasi acarbose sebagai kontrol positif dengan konsentrasi 4; 8; 15 dan 20 mg/ml. Sebanyak empat tablet acarbose dengan kandungan 50 mg per tablet digerus dilarutkan dengan aquabidest dalam labu tentukur 10 ml dan ditambahkan aquabidest hingga batas tanda sehingga diperoleh konsentrasi 20 mg/ml (labu 1). Diambil sebanyak 7,5 ml dari labu 1 dimasukkan dalam labu tentukur 10 ml dan ditambah aquabidest hingga batas tanda sehingga diperoleh konsentrasi 15 mg/ml (labu 2). Diambil sebanyak 5.34 ml dari labu 2 dimasukkan dalam labu tentukur 10 ml dan ditambah aquabidest hingga batas tanda sehingga diperoleh konsentrasi 8 mg/ml (labu 3). Diambil sebanyak 5 ml dari labu 3 dimasukkan dalam labu tentukur 10 ml dan ditambahkan aquabidest hingga batas tanda sehingga diperoleh 4 mg/ml (labu 4).
Penentuan Panjang Gelombang Maksimum
Penentuan panjang gelombang maksimum dilakukan sebelum dilakukan uji aktivitas penghambatan enzim alfa amilase. Diambil larutan potato starch 0,5% sebanyak 1 ml dimasukkan ke dalam tabung reaksi dan ditambahkan 1 ml ekstrak etanol batang brotowali konsentrasi terkecil yang dipakai dalam uji aktivitas penghambatan enzim alfa amilase yaitu 4 mg/ml. Kemudian ditambahkan 1 ml enzim alfa amilase dalam buffer phosphate pH 6,9, 1 ml buffer phosphate pH 6,9 dan 1 ml DMSO 1%. Larutan dikocok menggunakan vortex hingga homogen kemudian diinkubasi selama 10 menit. Reaksi dihentikan dengan penambahan HCl 1M sebanyak 1 ml dan reagen iodin sebanyak 0,01 ml kemudian dikocok menggunakan vortex lagi hingga homogen. Serapan diukur dengan menggunakan spektrofotometer UV-Vis pada rentang panjang gelombang 400-800 nm.
Penentuan Operating Time (OT)
Penentuan operating time (OT) dilakukan sebelum dilakukan uji aktivitas penghambatan enzim alfa amilase. Diambil larutan potato starch 0,5% sebanyak 1 ml dimasukkan ke dalam tabung reaksi dan ditambahkan 1 ml ekstrak etanol batang brotowali konsentrasi terkecil yang dipakai dalam uji aktivitas penghambatan
8
enzim alfa amilase yaitu 4 mg/ml. Kemudian ditambahkan 1 ml enzim alfa amilase dalam buffer phosphate pH 6,9, 1 ml buffer phosphate pH 6,9 dan 1 ml DMSO 1%. Larutan dikocok menggunakan vortex hingga homogen kemudian diinkubasi selama 5; 10; 15 dan 30 menit untuk menentukan waktu optimum enzim tersebut dapat bereaksi. Reaksi dihentikan dengan penambahan HCl 1M sebanyak 1 ml dan reagen iodin sebanyak 0,01 ml kemudian dikocok menggunakan vortex lagi hingga homogen. Serapan diukur dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang yang sudah diperoleh sebelumnya.
Pengujian Efek Penghambatan Larutan Blanko Acarbose dan Kontrol Blanko Acarbose
Pengukuran efek penghambatan larutan blanko acarbose dilakukan dengan cara diambil larutan potato starch 0,5% sebanyak 1 ml dimasukkan ke dalam tabung reaksi, ditambahkan 1 ml aquabidest kemudian ditambahkan 1 ml enzim alfa amilase dalam buffer phosphate pH 6,9 dan 2 ml buffer phosphate pH 6,9. Larutan dikocok menggunakan vortex hingga homogen dan diinkubasi selama 5 menit. Reaksi dihentikan dengan penambahan HCl 1M sebanyak 1 ml dan reagen iodin sebanyak 0,01 ml kemudian dikocok menggunakan vortex lagi hingga homogen. Serapan diukur dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang 536 nm. Sementara itu pengukuran efek penghambatan larutan kontrol blanko acarbose memiliki langkah yang sama hanya saja tidak menggunakan enzim alfa amilase dan menggunakan buffer phosphate pH 6,9 sebanyak 3 ml.
Pengujian Efek Penghambatan Larutan Acarbose dan Kontrol Acarbose
Pengukuran efek penghambatan larutan blanko acarbose dilakukan dengan cara diambil larutan potato starch 0,5% sebanyak 1 ml dimasukkan ke dalam tabung reaksi, ditambahkan 1 ml larutan acarbose dalam masing-masing tabung reaksi dengan konsentrasi 4; 8; 15 dan 20 ml dan 1 ml aquabidest kemudian ditambahkan 1 ml enzim alfa amilase dalam buffer phosphate pH 6,9 dan 2 ml
buffer phosphate pH 6,9. Larutan dikocok menggunakan vortex hingga homogen
dan diinkubasi selama 5 menit. Reaksi dihentikan dengan penambahan HCl 1M sebanyak 1 ml dan reagen iodin sebanyak 0,01 ml kemudian dikocok menggunakan
9
vortex lagi hingga homogen. Serapan diukur dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang 536 nm. Sementara itu pengukuran efek penghambatan larutan kontrol acarbose memiliki langkah yang sama hanya saja tidak menggunakan enzim alfa amilase dan menggunakan buffer
phosphate pH 6,9 sebanyak 3 ml. Pembuatan larutan acarbose dan kontrol acarbose
dilakukan sebanyak tiga kali replikasi.
Pengujian Efek Penghambatan Larutan Blanko Sampel dan Kontrol Blanko Sampel Pengukuran efek penghambatan larutan blanko sampel dilakukan dengan cara diambil larutan potato starch 0,5% sebanyak 1 ml dimasukkan ke dalam tabung reaksi, ditambahkan 1 ml DMSO 1% kemudian ditambahkan 1 ml enzim alfa amilase dalam buffer phosphate pH 6,9 dan 2 ml buffer phosphate pH 6,9. Larutan dikocok menggunakan vortex hingga homogen dan diinkubasi selama 5 menit. Reaksi dihentikan dengan penambahan HCl 1M sebanyak 1 ml dan reagen iodin sebanyak 0,01 ml kemudian dikocok menggunakan vortex lagi hingga homogen. Serapan diukur dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang 536 nm. Sementara itu pengukuran efek penghambatan larutan kontrol blanko sampel memiliki langkah yang sama hanya saja tidak menggunakan enzim alfa amilase dan menggunakan buffer phosphate pH 6,9 sebanyak 3 ml.
Pengujian Efek Penghambatan Larutan Sampel dan Kontrol Sampel
Pengukuran efek penghambatan larutan blanko sampel dilakukan dengan cara diambil larutan potato starch 0,5% sebanyak 1 ml dimasukkan ke dalam tabung reaksi, ditambahkan 1 ml larutan acarbose dalam masing-masing tabung reaksi dengan konsentrasi 4; 8; 15 dan 20 ml dan ditambahkan 1 ml DMSO 1% kemudian ditambahkan 1 ml enzim alfa amilase dalam buffer phosphate pH 6,9 dan 2 ml
buffer phosphate pH 6,9. Larutan dikocok menggunakan vortex hingga homogen
dan diinkubasi selama 5 menit. Reaksi dihentikan dengan penambahan HCl 1M sebanyak 1 ml dan reagen iodin sebanyak 0,01 ml kemudian dikocok menggunakan
vortex lagi hingga homogen. Serapan diukur dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang 536 nm. Sementara itu pengukuran efek penghambatan larutan kontrol blanko sampel memiliki langkah yang sama hanya saja tidak menggunakan enzim alfa amilase dan menggunakan
10
buffer phosphate pH 6,9 sebanyak 3 ml. Pembuatan larutan acarbose dan kontrol
acarbose dilakukan sebanyak tiga kali replikasi.
Perhitungan Nilai Persentase Penghambatan dan Nilai IC50
Hasil absorbansi seluruh larutan uji yang sudah diukur dihitung dengan mengggunakan rumus:
% Penghambatan = (𝐴1−𝐴2)
𝐴1 x 100% Keterangan:
A1 : Absorbansi blanko(B*) – absorbansi kontrol dari blanko(KB**) A2 : Absorbansi sampel(S) – absorbansi kontrol dari sampel(KS***)
B* : Blanko berisi potato starch, DMSO 1%, enzim alfa amilase, buffer
phosphate, HCl 1M dan reagen iodin
KB** : Kontrol dari blanko berisi potato starch, DMSO 1%, buffer phosphate, HCl 1M dan reagen iodin
S : Sampel berisi potato starch, ekstrak, DMSO 1%, enzim alfa amilase, buffer
phosphate, HCl 1M dan reagen iodin
KS*** : Kontrol dari sampel berisi potato starch, ekstrak, DMSO 1%, buffer
phosphate, HCl 1M dan reagen iodin
(Elya et al., 2015) Sementara itu perhitungan nilai IC50 dilakukan dengan menggunakan regresi linear dengan ketentuan konsentrasi sampel ekstrak batang brotowali pada sumbu x dan persen penghambatan yang diperoleh pada sumbu y. Dengan menggunakan persamaan y = a+bx maka nilai IC50 dapat dihitungan menggunakan rumus:
IC50 = 50−𝑎 𝑏
(Elya et al., 2015)
Analisis Statistik
Pengukuran efek antihiperglikemia ekstrak etanol batang brotowali dilakukan sebanyak tiga kali replikasi dan dihitung rerata dan standar deviasi (SD).
11
Data yang diperoleh yaitu persentase penghambatan enzim alfa amilase oleh ekstrak etanol batang brotowali.
Analisis data pengukuran efek antihiperglikemia ekstrak etanol batang brotowali diukur secara statistik yang diawali dengan menguji distribusi normalitas dengan uji Shapiro-Wilk dan menguji homogenitas dengan uji Levene. Apabila didapatkan data terdistribusi normal (nilai P >0,05), maka dilanjutkan dengan uji ANOVA satu arah, dan apabila ditemukan perbedaan, maka dilanjutkan dengan uji
Post-Hoc Tukey pada taraf kepercayaan 95%; namun apabila didapatkan data
terdistribusi tidak normal (nilai P <0,05), maka dilanjutkan dengan uji
Kurskal-Wallis, dan apabila ditemukan perbedaan, maka dilanjutkan dengan uji Mann-Whitney dengan taraf kepercayaan 95%.
HASIL DAN PEMBAHASAN
Penelitian ini bertujuan untuk mengetahui aktivitas ekstrak etanol batang brotowali yang dibuat dengan metode maserasi dalam menghambat enzim alfa amilase secara in vitro. Hasil dari penelitian ini dilihat dari nilai persentase penghambatan dan nilai IC50. Senyawa yang dituju dalam penelitian ini adalah borapetosida A dan C yang termasuk dalam golongan terpenoid. Senyawa tersebut diduga dapat menghambat enzim alfa amilase sehingga tidak terjadi hidrolisis pati. Penelitian ini menggunakan batang brotowali yang diperoleh sudah dalam bentuk serbuk simplisia dari PT. HRL Internasional yang terletak di Kabupaten Gresik, Jawa Timur. Serbuk simplisia yang digunakan telah diidentifikasi dan dilakukan determinasi di Departemen Biologi Farmasi, Fakultas Farmasi, Universitas Gadjah Mada Yogyakarta dengan nomor referensi No. 32.16.12/UN1/FFA/BF/PT/2019 (Lampiran 1). Hasil identifikasi menunjukkan bahwa serbuk simplisia yang digunakan berasal dari batang brotowali dengan nama latin (Tinospora crispa L.) Hook. f. & Thomson.
Dilakukan penetapan kadar air pada serbuk simplisia dengan metode distilasi toluena dan diperoleh hasil 8.99% (Lampiran 4 dan 5). Menurut Kementerian Kesehatan Republik Indonesia (2014), tentang persyaratan obat
12
tradisional mengatakan bahwa kadar air pada serbuk simplisia tidak boleh lebih dari 10% maka dalam hal ini kadar air pada serbuk simplisia batang brotowali telah sesuai dengan persyaratan yang ada. Penetapan kadar air bertujuan untuk memberi batasan minimal besarnya kandungan air dalam bahan uji yaitu serbuk simplisia. Semakin tinggi kadar air maka bahan uji akan semakin mudah untuk ditumbuhi jamur dan kapang sehingga dapat menurunkan aktivitas biologi simplisia dalam masa penyimpanan (Salim et al., 2017).
Pembuatan ekstrak etanol dilakukan dengan metode maserasi yaitu metode yang dilakukan dengan merendam bahan tanaman baik dalam bentuk simplisia kasar atau serbuk simplisia pada suatu wadah tertutup dengan pelarut didalamnya. Dibiarkan pada suhu kamar selama suatu periode tertentu sambil terus dikocok. Proses tersebut bertujuan untuk melunakkan dan menghancurkan dinding sel tanaman agar dapat melepas zat fitokimia yang dapat terlarut (Nn, 2015). Prinsip metode maserasi adalah cairan penyari akan menembus dinding sel maka zat aktif akan terlarut karena ada perbedaan konsentrasi antara larutan zat aktif di dalam sel dan di luar sel, sehingga larutan dengan konsentrasi tinggi akan terdesak ke luar sel (Salamah, M.Sc, Apt., Rozak and Al Abror, 2017). Maserasi dilakukan selama 24 jam karena semakin lama waktu maserasi maka kuantitas bahan yang terekstrak juga akan semakin meningkat karena waktu kontak antara bahan dengan pelarut makin lama sehingga hasil akan bertambah sampai titik jenuh larutan (Pujiyanto dkk., 2019).
Penelitian ini melakukan tiga kali proses maserasi dengan pelarut dan jumlah pelarut yang sama agar penyarian senyawa yang dituju yaitu borapetosida A dan C dapat memberikan hasil yang optimal. Maserat yang diperoleh kemudian diuapkan menggunakan alat rotary evaporator pada suhu 60̊C setelah itu dipekatkan lagi di atas penangas air pada suhu 60̊C. Pembuatan ekstrak etanol batang brotowali dilakukan sebanyak tiga kali replikasi. Dihitung bobot tetap ekstrak yang diperoleh. Bobot tetap diperoleh apabila dalam dua kali penimbangan secara berturut-turut setelah dipijarkan selama satu jam tidak lebih dari 0.25% atau perbedaan dalam penimbangan tidak lebih dari 0.5 mg (Departemen Kesehatan Republik Indonesia, 2008). Setelah diperoleh bobot tetap lalu dilanjutkan dengan
13
menghitung rendemen ekstrak. Rendemen ekstrak adalah perbandingan antara ekstrak yang diperoleh dengan simplisia awal. Rendemen menggunakan satuan persen (%), semakin tinggi nilai rendemen yang dihasilkan menandakan nilai ekstrak yang dihasilkan semakin banyak (Wijaya, Novitasari and Jubaidah, 2018). Pada replikasi pertama diperoleh bobot ekstrak sebanyak 1.4352 g dari 10.0013 g serbuk simplisia sehingga diperoleh rendemen ekstrak sebesar 14.35%. Pada replikasi kedua diperoleh bobot ekstrak sebanyak 2.9281 g dari 10.0005 g serbuk simplisia sehingga diperoleh rendemen ekstrak sebesar 29.28%. Pada replikasi ketiga diperoleh bobot ekstrak sebanyak 2.3419 g dari 10.0080 g serbuk simplisia sehingga diperoleh rendemen ekstrak sebesar 23.40% (Lampiran 6).
Pada skrining fitokimia yang dilakukan oleh Elya et al., (2015) ekstrak etanol batang brotowali mengandung alkaloid, flavonoid, glikosida dan terpenoid. Senyawa metabolit sekunder yang diduga memiliki efek antihiperglikemia pada brotowali adalah borapetosida A dan C yang termasuk dalam golongan terpenoid. Pada penelitian ini juga dilakukan uji yang bertujuan untuk mengetahui kandungan metabolit sekunder dalam serbuk simplisia dan ekstrak etanol batang brotowali dengan metode kromatografi lapis tipis (KLT). Uji tersebut dilakukan membandingkan nilai Rf larutan uji dengan senyawa baku standar. Metode KLT merupakan metode yang relatif mudah dilakukan, pemisahan senyawa berlangsung cepat, banyak digunakan serta dapat memisahkan sampel uji dalam jumlah kecil. Bejana yang digunakan terlebih dahulu dijenuhkan dengan fase gerak yaitu kloroform-P dan metanol-P dengan perbandingan volume 9:1. Bejana yang sudah jenuh ditandai dengan kertas saring yang terbasahi oleh fase gerak. Penjenuhan bejana bertujuan agar elusi dapat berjalan dengan baik sementara itu penggunaan kertas saring bertujuan agar penjenuhan uap oleh fase gerak merata dalam bejana. Selama proses elusi, bejana harus ditutup dengan rapat agar proses pemisahan senyawa dalam ekstrak berjalan dengan baik (Gandjar dan Rohman, 2007).
Fase diam yang digunakan adalah plat silika gel GF254. Plat silika dipotong menjadi berukuran 5 cm x 15 cm. Pada plat diberi jarak 2 cm dari tepi bawah, 3 cm dari tepi atas dan masing-masing 1,5 cm dari tepi kanan dan kiri serta jarak antar totolan sebesar 1 cm. Dari penandaan plat silika tersebut diperoleh jarak elusi
14
sebesar 10 cm. Sebelum dilakukan penotolan plat silika harus diaktivasi terlebih dahulu. Aktivasi plat silika bertujuan untuk menghilangkan kelembaban air atmosfer yang teradsorbsi dalam plat silika. Aktivasi plat silika dapat dilakukan dalam oven pada suhu 120̊C selama kurang lebih 30 menit (Wulandari, 2011).
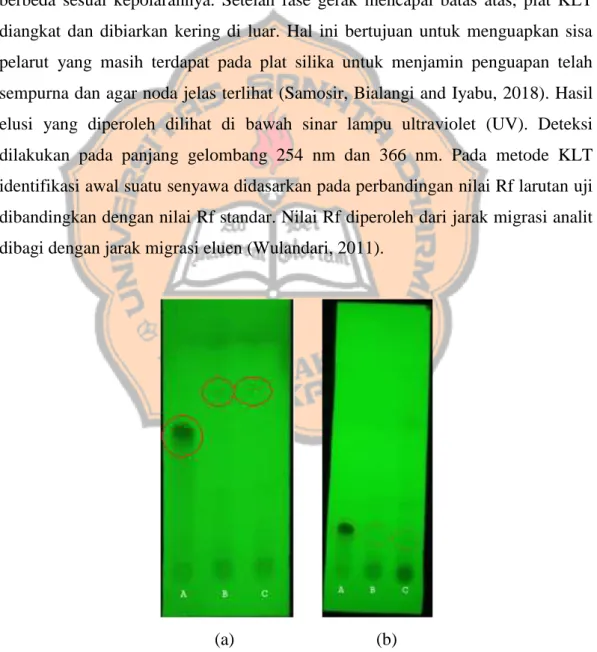
Ketika plat silika sudah dimasukkan ke dalam bejana yang berisi fase gerak dan sudah terjenuhkan, fase gerak akan naik secara perlahan. Dalam proses naiknya fase gerak, komponen-komponen berbeda dari campuran berjalan pada tingkat yang berbeda sesuai kepolarannya. Setelah fase gerak mencapai batas atas, plat KLT diangkat dan dibiarkan kering di luar. Hal ini bertujuan untuk menguapkan sisa pelarut yang masih terdapat pada plat silika untuk menjamin penguapan telah sempurna dan agar noda jelas terlihat (Samosir, Bialangi and Iyabu, 2018). Hasil elusi yang diperoleh dilihat di bawah sinar lampu ultraviolet (UV). Deteksi dilakukan pada panjang gelombang 254 nm dan 366 nm. Pada metode KLT identifikasi awal suatu senyawa didasarkan pada perbandingan nilai Rf larutan uji dibandingkan dengan nilai Rf standar. Nilai Rf diperoleh dari jarak migrasi analit dibagi dengan jarak migrasi eluen (Wulandari, 2011).
(a) (b)
Gambar 1. Hasil elusi KLT di bawah lampu UV 254 nm (a) Hasil uji KLT serbuk simplisia batang brotowali (b) Hasil uji KLT ekstrak batang brotowali
15
Keterangan:
(a): A= Baku kuersetin; B = Serbuk simplisia batang brotowali (replikasi I); C = Serbuk simplisia batang brotowali (replikasi II)
(b): A= Baku kuersetin; B = Ekstrak air batang brotowali; C = Ekstrak etanol batang brotowali
Tabel I. Identifikasi metabolit sekunder serbuk simplisia Sampel Nilai Rf Warna Bercak Selisih Rf Kuersetin (baku pembanding) 0.57 Kuning - Sampel serbuk I 0.62 Kuning-kecoklatan 0.05 Sampel serbuk II 0.65 Kuning-kecoklatan 0.08
Tabel II. Identifikasi metabolit sekunder ekstrak batang brotowali Sampel Nilai Rf Warna Bercak Selisih Rf Kuersetin (baku pembanding) 0.22 Kuning - Ekstrak air batang brotowali 0.18 Kuning-kecoklatan 0.04 Ekstrak etanol batang brotowali 0.16 Kuning-kecoklatan 0.06
Hasil pengujian flavonoid yang diperoleh menggunakan metode KLT dengan pembanding kuersetin dan dideteksi dengan lampu UV 254 nm (Gambar 1). Kuersetin termasuk dalam kelas flavonol yang tidak dapat diproduksi dalam tubuh manusia. Berwarna kuning dan sukar larut dalam air panas, agak mudah larut
16
dalam alkohol dan lipid dan tidak larut dalam air dingin (Anand David, Arulmoli and Parasuraman, 2016). Volume penotolan untuk baku kuersetin sebesar 5 µL dan untuk sampel masing-masing 10 µL. Pada pengujian kandungan metabolit sekunder serbuk simplisia batang brotowali yang dilihat di bawah lampu UV 254 nm dengan senyawa pembanding kuersetin diperoleh nilai Rf 0.57 untuk baku pembanding kuersetin, 0.62 untuk nilai Rf serbuk simplisia batang brotowali replikasi pertama dan 0.65 untuk replikasi kedua (Tabel I). Menurut Direktorat Jenderal Bina Kefarmasian dan Alat Kesehatan Republik Indonesia (2013) tentang deteksi metabolit sekunder pada serbuk simplisia batang brotowali nilai Rf baku pembanding kuersetin adalah 0.72. Selisih nilai Rf berturut-turut pada sampel serbuk simplisia replikasi pertama dan kedua adalah 0.05 dan 0.08. Hasil pengujian menunjukkan bahwa warna bercak antara sampel dan baku sama. Nilai Rf antara sampel dan baku saling mendekati dengan selisih ≤0.2 (Samosir, Bialangi and Iyabu, 2018). Pada pengujian kandungan metabolit sekunder pada ekstrak etanol batang brotowali diperoleh nilai Rf 0.22 untuk baku pembanding kuersetin dan 0.16 untuk nilai Rf ekstrak etanol batang brotowali. Selisih nilai Rf berturut-turut pada sampel ekstrak air dan ekstrak etanol batang brotowali adalah 0.04 dan 0.06. Nilai Rf antara sampel dan baku saling mendekati dengan selisih ≤0.2 (Samosir, Bialangi and Iyabu, 2018). Maka dapat dikatakan bahwa sampel baik serbuk simplisia, ekstrak air maupun ekstrak etanol batang brotowali mengandung senyawa metabolit sekunder flavonoid.
Pada penelitian ini senyawa metabolit sekunder yang ditargetkan sebenarnya adalah terpenoid. Berdasarkan hasil yang diperoleh setelah dilihat di bawah lampu UV 366 nm (Gambar 2), terdapat bercak berwarna biru-kehijauan yang menandakan bahwa terdapat senyawa metabolit sekunder terpenoid (Jiang, Kempinski and Chappell, 2017).
17
(a) (b)
Gambar 2. Hasil elusi KLT di bawah lampu UV 366 nm (a) Hasil uji KLT serbuk simplisia daun sambiloto (b) Hasil uji KLT ekstrak batang brotowali
Keterangan:
(a): A= Baku kuersetin; B = Serbuk simplisia batang brotowali (replikasi I); C = Serbuk simplisia batang brotowali (replikasi II)
(b): A= Baku kuersetin; B = Ekstrak air batang brotowali; C = Ekstrak etanol batang brotowali
Tabel III. Identifikasi metabolit sekunder serbuk simplisia Sampel Nilai Rf Warna Bercak Selisih Rf Kuersetin (baku pembanding) 0.57 Kuning - Sampel serbuk I 0.73 Biru-kehijauan 0.16 Sampel serbuk II 0.74 Biru-kehijauan 0.17
18
Tabel IV. Identifikasi metabolit sekunder ekstrak batang brotowali Sampel Nilai Rf Warna Bercak Selisih Rf Kuersetin (baku pembanding) 0.22 Kuning - Ekstrak air batang brotowali 0.57 Biru-kehijauan 0.35 Ekstrak etanol batang brotowali 0.55 Biru-kehijauan 0.33
Pada pengujian kandungan metabolit sekunder serbuk simplisia batang brotowali yang dilihat di bawah lampu UV 366 nm dengan senyawa pembanding kuersetin diperoleh nilai Rf 0.57 untuk baku pembanding kuersetin, 0.73 untuk nilai Rf serbuk simplisia batang brotowali replikasi pertama dan 0.74 untuk replikasi kedua (Tabel III). Selisih nilai Rf berturut-turut pada sampel serbuk simplisia replikasi pertama dan kedua adalah 0.16 dan 0.17. Pada pengujian kandungan metabolit sekunder pada ekstrak etanol batang brotowali diperoleh nilai Rf 0.22 untuk baku pembanding kuersetin dan 0.55 untuk nilai Rf ekstrak etanol batang brotowali (Tabel IV). Selisih nilai Rf ekstrak etanol batang brotowali dengan baku pembanding kuersetin adalah adalah 0.33. Selisih nilai Rf yang diperoleh antara baku pembanding dengan sampel >0.2 sehingga dapat dikatakan bahwa terdapat senyawa lain ekstrak etanol senyawa batang brotowali mengandung senyawa metabolit sekunder lain selain kuersetin.
Hasil pengujian kandungan metabolit sekunder menunjukkan bahwa ketika plat diletakkan di bawah lampu UV dengan panjang gelombang yang berbeda terdapat perbedaan dan variasi kandungan senyawa metabolit sekunder. Hal tersebut dilihat dari perbedaan letak bercak, warna bercak dan perbedaan nilai Rf yang diperoleh.
Pengujian aktivitas penghambatan enzim alfa amilase dilihat berdasarkan penurunan intensitas warna biru pada kompleks iodin-pati karena berkurangnya
19
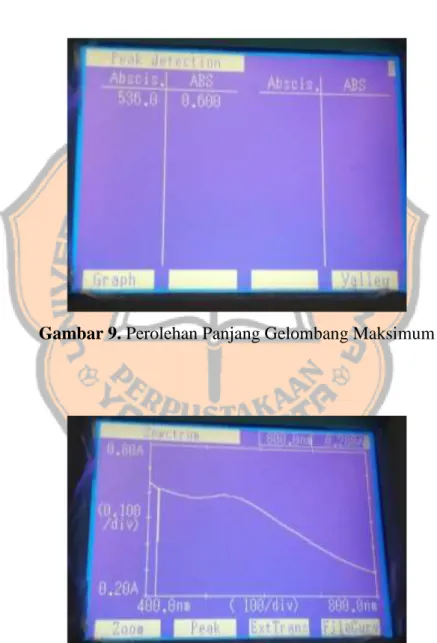
substrat pati akibat hidrolisis yag dilakukan oleh enzim (Ononamadu et al., 2020). Sebelum dilakukan pengujian perlu dilakukan optimasi panjang gelombang maksimum dan optimasi operating time (OT). Tujuan penentuan panjang gelombang maksimum agar mengetahui daerah serapan dalam kondisi optimum yang dihasilkan dari nilai absorbansi yang diukur menggunakan alat spektrofotometer UV-Vis (Sudewi and Pontoh, 2018). Optimasi dilakukan pada rentang panjang gelombang 400-800 nm dan diperoleh panjang gelombang maksimum 536 nm (Lampiran 8).
Penentuan OT ditentukan dengan mengukur absorbansi pada panjang gelombang maksimum yang sudah ditentukan sebelumnya yaitu 536 nm dengan konsentrasi yang digunakan adalah 4 mg/ml dan dalam rentang waktu 5; 10; 20; dan 30 menit. Diperoleh OT selama 5 menit (Lampiran 9). OT yang diperoleh digunakan sebagai waktu inkubasi dari larutan yang akan diuji.
Pengujian aktivitas penghambatan enzim alfa amilase dilakukan pada larutan blanko acarbose, kontrol blanko acarbose, sampel berisi acarbose, kontrol sampel acarbose, blanko sampel uji, kontrol blanko sampel uji, sampel uji berisi ekstrak etanol batang brotowali dan kontrol sampel uji. Pengujian larutan blanko dan kontrol blanko bertujuan untuk mengetahui aktivitas enzim alfa amilase sehingga larutan uji yang digunakan tanpa adanya penambahan larutan acarbose dan larutan sampel uji berupa ekstrak etanol batang brotowali. Sementara itu pengujian larutan sampel berisi acarbose digunakan sebagai pembanding dengan pengujian larutan sampel berisi ekstrak etanol batang brotowali. Keduanya dilakukan untuk melihat aktivitas penghambatan terhadap enzim alfa amilase.
Penggunaan potato-starch dalam penelitian ini bertujuan sebagai substrat dari enzim alfa amilase. Penggunaan DMSO dipilih sebagai pelarut karena bersifat tidak mudah menguap (non-volatile solvents). Selain itu DMSO merupakan pelarut organik paling kuat yang dapat melarutkan berbagai macam bahan organik secara efektif (Jacob and de la Torre, 2015). HCl dipilih dan digunakan untuk menghentika reaksi enzimatik hal ini karena pH merupakan suatu faktor yang mempengaruhi aktivitas dan stabilitas enzim. Pada suatu reaksi enzimatik yang melibatkan pelepasan atau penyerapan proton hal tersebut penting untuk memantau pH untuk
20
memastikan efisiensi kontrol proses dan untuk meminimalkan perubahan pada proses dan kualitas produk akhir (Gruber et al., 2017). Berdasarkan penjelasan tersebut maka HCl dapat digunakan untuk menghentikan reaksi karena HCl merupakan golongan asam kuat sehingga ketika ditambahkan pada larutan uji maka pH larutan uji yang berisi enzim alfa amilase akan berubah dan dapat terjadi denaturasi enzim. Enzim alfa amilase sendiri bekerja optimal pada pH 7.0 (Sundarram and Murthy, 2014). Larutan buffer phosphate pH 6.9 (Lampiran 10) digunakan untuk mempertahankan pH enzim alfa amilase sehingga selama proses berlangsungnya reaksi, enzim alfa amilase tetap bekerja secara optimal. Reagen iodin digunakan sebagai indikator warna karena pati bereaksi dengan reagen iodin membentuk warna biru (Louis and Gabriel, 2014). Warna biru yang terbentuk akan dibaca serapannya menggunakan metode spektrofotometri.
Sampel berisi acarbose maupun ekstrak etanol batang brotowali masing-masing dibagi menjadi empat tingkat konsentrasi yaitu 4; 8; 15 dan 20 mg/ml. Pengujian sampel dilakukan dengan berbagai varian konsentrasi yang bertujuan untuk melihat pengaruh konsentrasi sampel terhadap peningkatan daya hambat. Seluruh larutan uji akan diukur serapannya menggunakan metode spektrofotometri hingga diperoleh nilai absorbansi (Lampiran 11). Nilai absorbansi yang diperoleh pada setiap larutan uji akan digunakan untuk menghitung nilai persentase penghambatan dan nilai IC50. Nilai persentase penghambatan digunakan untuk menentukan persentase hambatan dari suatu bahan yang dilakukan terhadap aktivitas enzim alfa amilase.
Tabel V. Nilai persentase penghambatan acarbose Konsentrasi (mg/ml) Replikasi I (%) Replikasi II (%) Replikasi III (%) 4 42.89 40.48 42.23 8 61.93 60.18 59.30 15 77.68 77.90 78.12 20 87.31 89.50 84.68
21
Tabel VI. Nilai persentase penghambatan ekstrak etanol batang brotowali Konsentrasi (mg/ml) Replikasi I (%) Replikasi II (%) Replikasi III (%) 4 23.16 27.89 21.84 8 38.68 38.95 37.37 15 53.16 54.21 69.47 20 83.42 78.16 77.89
Berdasarkan nilai persentase penghambatan aktivitas enzim alfa amilase oleh acarbose (Tabel V) diperoleh nilai r berturut-turut dari replikasi pertama hingga replikasi ketiga sebesar 0.981; 0.990 dan 0.980 dengan rata-rata nilai persentase penghambatan berturut-turut dari konsentrasi terkecil hingga terbesar sebagai berikut 41.87% ± 1.25; 60.47% ± 1.34; 77.90% ± 0.22 dan 87.16% ± 2.41. Sementara itu untuk nilai persentase penghambatan aktivitas enzim alfa amilase oleh ekstrak etanol batang brotowali (Tabel VI) diperoleh nilai r berturut-turut dari replikasi pertama hingga replikasi ketiga sebesar 0.977; 0.985 dan 0.987 dengan rata-rata nilai persentase penghambatan berturut-turut dari konsentrasi terkecil hingga terbesar sebagai berikut 24.30% ± 3.18; 38.33% ± 0.85; 58.95% ± 9.13 dan 79.82% ± 3.12. Selisih nilai persentase penghambatan antar replikasi pada konsentrasi yang sama khususnya pada konsentrasi 4; 15 dan 20 mg/ml cukup besar karena tiap replikasi konsentrasi tersebut menggunakan replikasi ekstrak yang sama dari awal. Maka dari itu dapat dikatakan bahwa kandungan senyawa metabolit sekunder pada ekstrak khususnya senyawa borapetosida A dan C pada replikasi I, II dan III terdapat perbedaan dilihat dari hasil rendemen ekstrak yang bervariasi sehingga dapat berpengaruh pada hasil nilai persentase penghambatan uji aktivitas penghambatan enzim alfa amilase.
Pada penelitian yang dilakukan oleh Pujiyanto dkk., (2019) uji aktivitas penghambatan enzim alfa amilase oleh ekstrak etanol batang brotowali diperoleh nilai persentase penghambatan berturut-turut dari konsentrasi 125; 250; 500; dan 1000 μg/ml sebesar 47.08%; 92.84%; 94.41% dan 95.06%. Ekstrak etanol dibuat dengan metode maserasi dengan pelarut etanol 96% dan penghentian reaksi
22
dilakukan dengan menambah reagen dinitrosalisilat (DNS). Hasil yang diperoleh lebih baik apabila dibandingkan denga hasil penelitian milik penulis. Hal tersebut dapat dipengaruhi oleh beberapa hal diantaranya perbedaan pelarut dan reagen yang digunakan dalam pengujian aktivitas penghambatan enzim alfa amilase. Namun kedua hasil penelitian menyatakan bahwa seiring dengan meningkatnya konsentrasi ekstrak maka nilai persentase penghambatan juga akan semakin meningkat.
Nilai r merupakan nilai yang menggambarkan hubungan antara peningkatan konsentrasi dengan nilai peningkatan persentase penghambatan. Apabila nilai r mendekati 1 maka semakin menggambarkan korelasi yang sempurna (Gandjar dan Rohman, 2017). Pada ketiga replikasi diperoleh nilai r yang hampir mendekati 1 hal ini berarti dapat dikatakan bahwa terdapat hubungan antara peningkatan konsentrasi dengan peningkatan nilai persentase penghambatan ekstrak etanol batang brotowali.
Setelah dilakukan perhitungan persentase penghambatan sampel uji maka selanjutnya dilakukan perhitungan nilai IC50. Nilai IC50 merupakan parameter aktivitas penghambatan pada suatu senyawa atau ekstrak. Nilai IC50 merupakan konsentrasi sampel uji berupa ekstrak etanol batang brotowali yang memiliki aktivitas penghambatan enzim alfa amilase sebesar 50%. Perhitungan nilai IC50 dilakukan dengan menggunakan regresi linear dengan ketentuan konsentrasi sampel ekstrak etanol batang brotowali sebagai sumbu x dan persentase penghambatan sebagai sumbu y (Elya et al., 2015).
Nilai IC50 ekstrak etanol batang brotowali yang diperoleh berturut-turut dari replikasi pertama hingga replikasi ketiga sebesar 11.84; 11.83 dan 11.30 mg/ml dengan rata-rata nilai IC50 sebesar 11.66 mg/ml ± 0.31 dan CV = 2.66%. Sementara itu nilai IC50 acarbose diperoleh berturut-turut dari replikasi pertama hingga replikasi ketiga sebesar 5.22; 6.00 dan 5.65 mg/ml dengan rata-rata nilai IC50 sebesar 5.62 mg/ml ± 0.39 dan CV = 6.94%. Nilai IC50 ekstrak etanol batang brotowali lebih besar dari nilai IC50 acarbose. Berdasarkan hal tersebut dapat dikatakan bahwa kemampuan ekstrak etanol batang brotowali dalam menghambat enzim alfa amilase tidak sebaik acarbose, hal ini disebabkan karena dalam ekstrak etanol batang brotowali banyak terdapat senyawa lain yang kemungkinan dapat
23
menurunkan aktivitas dalam menghambat enzim alfa amilase. Selain itu nilai IC50 acarbose sebagai pembanding terlalu tinggi karena acarbose yang digunakan merupakan sediaan tablet dengan kekuatan 50 mg bukan senyawa acarbose murni. Pada sediaan tablet acarbose sudah terdapat bahan tambahan lain seperti bahan pengisi, bahan pengikat dan lain-lain. Bahan-bahan tersebut dapat memengaruhi hasil pengujian aktivitas penghambatan enzim alfa amilase.
Dilakukan uji statistik untuk melihat kebermaknaan nilai persentase penghambatan antar konsentrasi. Uji statistik yang dilakukan pertama kali adalah uji normalitas dengan menggunakan uji Shapiro-Wilk. Uji normalitas digunakan untuk melihat apakah data yang diperoleh terdistribusi normal atau tidak. Berdasarkan hasil uji tersebut diperoleh nilai p>0.05 (Lampiran 12), hal ini menunjukkan bahwa data nilai persentase antar konsentrasi terdistribusi secara normal. Lalu dilanjutkan dengan uji homogenitas dengan menggunakan uji Levene. Uji homogenitas dilakukan dengan tujuan melihat homogenitas atau kesamaan beberapa bagian sampel atau seragam tidaknya variansi sampel (Naibaho, 2018). Berdasarkan hasil uji tersebut diperoleh nilai p<0.05 (Lampiran 13), hal ini menunjukkan bahwa data nilai persentase antar konsentrasi tidak homogen. Hasil uji normalitas menunjukkan bahwa data terdistribusi dengan normal maka dilanjutkan dengan uji ANOVA satu arah. Berdasarkan hasil uji tersebut diperoleh nilai p<0.05 (Lampiran 14), hal ini menunjukkan bahwa data nilai persentase dari keempat kelompok konsentrasi memiliki perbedaan. Kemudian dilanjutkan dengan uji Post-Hoc Tukey pada taraf kepercayaan 95%. Berdasarkan hasil uji tersebut diperoleh nilai p<0.05 (Lampiran 15), hal ini menunjukkan bahwa setiap konsentrasi yang diujikan terdapat perbedaan yang bermakna. Sehingga dapat dikatakan bahwa peningkatan konsentrasi mempengaruhi peningkatan aktivitas penghambatan enzim alfa amilase oleh ekstrak etanol batang brotowali.
Uji statistik juga dilakukan pada nilai persentase penghambatan acarbose. Berdasarkan uji normalitas diperoleh nilai p>0.05 (Lampiran 16), hal ini menunjukkan bahwa data nilai persentase antar konsentrasi terdistribusi secara normal. Sementara itu untuk uji homogenitas diperoleh nilai p>0.05 (Lampiran 17), hal ini menunjukkan bahwa data nilai persentase antar konsentrasi homogen. Hasil
24
uji normalitas menunjukkan bahwa data terdistribusi dengan normal maka dilanjutkan dengan uji ANOVA satu arah. Berdasarkan hasil uji tersebut diperoleh nilai p<0.05 (Lampiran 18), hal ini menunjukkan bahwa data nilai persentase dari keempat kelompok konsentrasi memiliki perbedaan. Kemudian dilanjutkan dengan uji Post-Hoc Tukey pada taraf kepercayaan 95%. Berdasarkan hasil uji tersebut diperoleh nilai p<0.05 (Lampiran 19), hal ini menunjukkan bahwa setiap konsentrasi yang diujikan terdapat perbedaan yang bermakna. Menurut penelitian yang dilakukan Ibrahim et al., (2017) diperoleh nilai IC50 acarbose sebesar 200.19 mg/ml ± 7.29 sedangkan pada penelitian ini diperoleh sebesar 5.62 mg/ml ± 0.39. Perbedaan nilai IC50 yang sangat jauh tersebut dapat disebabkan oleh beberapa hal seperti perbedaan acarbose yang digunakan dan perbedaan substrat enzim yang digunakan. Pada penelitian ini menggunakan potato starch sedangkan pada penelitian Ibrahim et al., (2017) yang sudah mengalami modifikasi menggunakan maltopentoglikosida. Selain itu dapat disebabkan oleh perbedaan pelarut dan konsentrasi pelarut yang digunakan serta yang paling utama perbedaan metode penelitian yang digunakan.
Kemudian dilakukan juga analisis statistik berupa uji T antara nilai IC50 acarbose dengan ekstrak etanol batang brotowali. Uji T digunakan karena hanya terdapat dua kelompok yang dibandingkan. Berdasarkan uji tersebut diperoleh nilai p<0.05 (Lampiran 20), hal tersebut menyatakan bahwa terdapat perbedaan yang signifikan sehingga dapat disimpulkan bahwa terdapat perbedaan aktivitas penghambatan terhadap enzim alfa amilase antara acarbose dengan ekstrak etanol batang brotowali.
Menurut penelitian yang dilakukan Hamid et al., (2015) menyatakan bahwa senyawa borapetosida C merupakan senyawa yang paling banyak ditemukan dalam tanaman brotowali dan dapat menghambat enzim alfa amilase secara in vitro dengan nilai IC50 sebesar 0.775 ± 0.005 mg/ml. Senyawa borapetosida diperoleh dari ekstrak heksan batang brotowali yang dibuat dengan metode perkolasi. Maka dapat dikatakan bahwa hasil dari penelitian ini ekstrak etanol batang brotowali dengan metode maserasi memiliki aktivitas menghambat enzim alfa amilase.
25
Gambar 3. Struktur Acarbose (PubChem, 2019)
(a) (b)
Gambar 4. (a) Struktur Borapetosida A; (b) Struktur Borapetosida C (PubChem, 2019)
Gambar 5. Struktur Amilum (PubChem, 2019)
26
KESIMPULAN
Berdasarkan pengujian ekstrak etanol batang brotowali memiliki aktivitas penghambatan enzim alfa amilase. Hasil analisis statistik yang membandingkan nilai persentase penghambatan diperoleh nilai p<0.05 yang menyatakan bahwa terdapat perbedaan yang bermakna antar konsentrasi ekstrak etanol batang brotowali yang digunakan. Selain itu analisis statistik yang membandingkan nilai IC50 acarbose dengan ekstrak etanol batang brotowali diperoleh nilai p<0.05 bahwa terdapat perbedaan yang signifikan pada aktivitas penghambatan terhadap enzim alfa amilase antara acarbose dengan ekstrak etanol batang brotowali dengan nilai IC50 berturut-turut 5.62 mg/ml ± 0.39 dan 11.66 mg/ml ± 0.31.
SARAN
Perlu dilakukan penelitian lebih lanjut terhadap aktivitas ekstrak etanol brotowali terutama dalam uji kualitatif dengan menggunakan senyawa borapetosida A dan C murni untuk mengetahui kandungan senyawa borapetosida A dan C pada sampel. Selain itu perlu dilakukan pula uji lanjutan secara in-vivo untuk membuktikan bahwa ekstrak etanol batang brotowali mampu menurunkan kadar gula darah pada hewan uji.
27
DAFTAR PUSTAKA
Agarwal, P. and Gupta, R. 2016 Alpha-amylase inhibition can treat diabetes mellitus. Research & Reviews: Journal of Medical and Health Sciences, 5(4), pp. 1–8.
Ahmad, W., Jantan, I. and Bukhari, S. N. A. 2016. Tinospora crispa (L.) Hook. f. & Thomson: A review of its ethnobotanical, phytochemical, and pharmacological aspects. Frontiers in Pharmacology, 7(MAR), pp. 1–19. Anand David, A. V., Arulmoli, R. and Parasuraman, S. 2016. Overviews of
biological importance of quercetin: A bioactive flavonoid. Pharmacognosy
Reviews, 10(20), pp. 84–89.
Atmajani, W. et al. 2018. α-Glucosidase Inhibitory Activity of In Vitro Combination of 96% Ethanolic Extract of Brotowali Stem (Tinospora cordifolia) and Cashew Apple (Anacardium occidentale L.). Journal of
Tropical Pharmacy and Chemistry, pp. 175–181.
de Sales, P. M. et al. 2012. α-amylase inhibitors: A review of raw material and isolated compounds from plant source. Journal of Pharmacy and
Pharmaceutical Sciences, pp. 141–183.
Direktorat Jendral Bina Kefarmasian Kefarmasian dan Alat Kesehatan RI, 2008. Farmakope Herbal. Suplemen II. Edisi I, Jakarta: Kementerian Kesehatan RI, 100-111.
Direktorat Jendral Bina Kefarmasian Kefarmasian dan Alat Kesehatan RI, 2013. Farmakope Herbal. Suplemen II. Edisi I, Jakarta: Kementerian Kesehatan RI, 100-111.
Elya, B. et al. 2015. Antidiabetic activity and phytochemical screening of extracts from indonesian plants by inhibition of alpha amylase, alpha glucosidase and dipeptidyl peptidase IV. Pakistan Journal of Biological Sciences, 18(6), pp. 273-278.
Gandjar, I. G., dan Rohman, A., 2017. Kimia Farmasi Analisis. Pustaka Pelajar,Yogyakarta, pp.253-254, 466-467.
28
reactions in a microfluidic side-entry reactor (μSER) shows potential for pH control. Biotechnology Journal, 12(6), pp. 1–28.
Hamid, H.A., et al., 2015. α-Glucosidase and α-amylase inhibitory constituents of
Tinospora crispa: Isolation and chemical profile confirmation by ultra-high
performance liquid chromatography-quadrupole t ime-of-flight/mass spectrometry. Journal of Functional Foods I6, 74-80.
Ibrahim, A. et al. 2017. HPLC profile, in vitro alpha-amylase, alpha-glucosidase inhibitory and antioxidant activities of Gymnema sylvestre ethyl acetate leaf extract. Bayero Journal of Pure and Applied Sciences, 10(1), p. 72.
Jacob, S. W. dan de la Torre J.C. 2015. Dimethyl Sulfoxide in Trauma and Disease. CRC Press, Florida.
Jiang, Z., Kempinski, C. and Chappell, J. 2017. Extraction and analysis of terpenes/terpenoids. Curr Protoc Plant Biol. 2016(1), p. 345-358.
Kementerian Kesehatan Republik Indonesia, 2014. Farmakope Indonesia V. Kharroubi, A. T. 2015. Diabetes mellitus: The epidemic of the century. World
Journal of Diabetes, 6(6), p. 850.
Koay, Y. C. Y. C. and Amir, F. 2013. A review of the secondary metabolites and biological activities of Tinospora crispa (Menispermaceae). Tropical Journal
of Pharmaceutical Research, 12(4), pp. 641–649.
Kumar, S., Jyotirmayee, K. and Sarangi, M. 2013. Thin layer chromatography: A tool of biotechnology for isolation of bioactive compounds from medicinal plants. International Journal of Pharmaceutical Sciences Review and
Research, 18(1), pp. 126–132.
Lam, S. H. et al. 2012. Hypoglycemic diterpenoids from Tinospora crispa. Journal
of Natural Products, 75(2), pp. 153–159.
Lokman, F. E. et al. 2013. Antidiabetic effect of oral borapetol B compound, isolated from the plant tinospora crispa, by stimulating insulin release.
Evidence-based Complementary and Alternative Medicine, 2013.
Louis, M. N. and Gabriel, B. O. 2014. Colour of starch-iodine complex as index of retrogradability of starch pastes. African Journal of Pure and Applied
29
Mun’im, A. et al. 2013. Screening of α- Glucosidase Inhibitory Activity of Some Indonesian Medicinal Plants. International J. Med. Arom. Plants, pp. 144– 150.
Naibaho, Agus Junsion, 2018. Perbedaan Peningkatan Kemampuan Pemecahan Masalah Matematika dengan Pendekatan Contextual Teaching and Learning di Kelas X. Jurnal EduMatSains, 3(1), pp. 69-86.
Nn, A. 2015. A Review on the Extraction Methods Use in Medicinal Plants, Principle, Strength and Limitation. Medicinal & Aromatic Plants, 04(03), pp. 3–8.
Oboh, G. et al. 2016. Influence of gallic acid on α-amylase and α-glucosidase inhibitory properties of acarbose. Journal of Food and Drug Analysis, 24(3), pp. 627–634.
Ononamadu, C. J. et al. 2020. Starch-iodine assay method underestimates α-amylase inhibitory potential of antioxidative compounds and extracts.
Biotechnologia, pp. 45–54.
Parimelazhagan, T. 2016. Pharmacological Assays of Plant-Based Natural
Products, Internasional Publishing, Switzerland.
Pramitasari, M. D., Pujiyanto, S. and Suprihadi, A. 2017. AKTIVITAS INHIBITOR Α-AMILASE ISOLAT KHAMIR ENDOFIT DARI TUMBUHAN BROTOWALI (Tinospora crispa L.). Jurnal Biologi, pp. 76– 84.
PubChem, 2019. Compound Summary: Acarbose. https://pubchem.ncbi.nlm.nih.gov/compound/Acarbose, diakses tanggal 18 Mei 2020.
PubChem, 2019. Compound Summary: Borapetoside A. https://pubchem.ncbi.nlm.nih.gov/compound/Borapetoside, diakses tanggal 7 Juni 2020.
PubChem, 2019. Compound Summary: Borapetoside C. https://pubchem.ncbi.nlm.nih.gov/compound/Tinocrisposide, diakses tanggal 7 Juni 2020.