i
UJI TOKSISITAS SUBKRONIS INFUSA DAUN SIRSAK (Annona muricata L.) TERHADAP GAMBARAN HISTOLOGIS
TESTIS DAN OVARIUM TIKUS
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Niken Ambar Sayekti NIM : 098114117
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
“Marilah kepada-Ku, semua yang letih lesu dan berbeban berat, Aku akan memberi kelegaan kepadamu.”
(Mat 11:28)
HIDUP adalah bagaimana kita BERJUANG,
mewujudkan MIMPI-MIMPI yang telah tertanam dalam angan …
Dengan penuh syukur dan sukacita, Kupersembahkan karya ini untuk: Tuhan Yesus Kristus, sahabat sejati yang selalu ada untukku, Bapak, Ibu, Mbak Galuh, Dhek Puput, dan seluruh keluarga besarku yang selalu mendukung dan mendoakanku,
vii PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Kuasa atas berkat, kasih, dan rahmat-Nya, sehingga penulis dapat menyelesaikan skripsi yang
berjudul “Uji Toksisitas Subkronis Infusa Daun Sirsak (Annona muricata L.)
terhadap Gambaran Histologis Testis dan Ovarium Tikus”, sebagai salah satu syarat memperoleh gelar Sarjana Farmasi (S.Farm.) Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Dalam penelitian hingga selesainya penyusunan skripsi ini penulis telah banyak memperoleh bantuan dari berbagai pihak, baik secara langsung maupun tidak langsung. Oleh karena itu, penulis hendak mengucapkan terimakasih kepada:
1. Ibu Phebe Hendra, M.Si., Ph.D., Apt. selaku Dosen Pembimbing dan Dosen Penguji skripsi, atas kesabaran, bimbingan, pengarahan, saran, dan motivasi yang diberikan kepada penulis selama proses penelitian dan penyusunan skripsi ini.
2. Bapak Ipang Djunarko, M.Sc., Apt. selaku Dosen Penguji skripsi yang telah memberikan arahan dan masukan kepada penulis.
3. Bapak Prof. Dr. C. J. Soegiharjo M. Si., Apt. selaku Dosen Penguji skripsi yang telah memberikan arahan dan masukan kepada penulis.
viii
5. Ibu Rini Dwiastuti, M.Si., Apt. selaku Kepala Laboratorium Fakultas Farmasi yang telah memberikan izin dalam penggunaan semua fasilitas laboratorium untuk kepentingan penelitian skripsi ini.
6. Dokter Ari, Bapak Ratijo, Bapak Parjiman, Bapak Heru, Bapak Kayat, Bapak Wagiran, Mas Andri selaku laboran Laboratorium Fakultas Farmasi yang telah banyak memberikan bantuan selama proses pelaksanaan penelitian. 7. Bapak Bambang, Ibu Sitarina, Ibu Asih, Bapak Yon yang telah banyak
membantu dalam pemeriksaan dan menentukan diagnosis histologis organ. Serta Bapak Lilik dan Bapak Dwi selaku laboran Laboratorium Patologi Fakultas Kedokteran Hewan UGM yang telah banyak membantu dalam pembuatan preparat histologis.
8. Bapak Antonius Slamet, Ibu Sulistiyani, Mbak Galuh Ambar Sasi, dan Adik Catarina Kartikawati yang tak henti mendoakan, memberi semangat, dan memberikan kasih sayang selama hidupku.
9. Partner dan sahabatku “Tim Annona”, Apriliawati Galuh Ajeng, Christiana Lambang Kristanti, E. Raras Pramudita, Meita Eryanti, Suster Imelda Korbafo, Veronika Dita Ayuningtyas atas kerjasama, bantuan, dukungan, dan kesabaran selama penelitian dan pengerjaan skripsi.
ix
11.Seluruh dosen dan staf Fakultas Farmasi Universitas Sanata Dharma Yogyakarta yang telah banyak memberikan ilmu, pengalaman, dan bantuan kepada penulis.
12.Teman-teman angkatan 2009 Fakultas Farmasi Universitas Sanata Dharma atas bantuan dan kebersamaan dalam suka maupun duka selama melewati tahun-tahun penuh perjuangan.
13.Semua pihak yang tidak dapat penulis sebutkan satu-persatu yang telah banyak berperan selama penyusunan skripsi ini.
14. Tuhan Yesus Kristus yang kusebut terakhir, karena Dia-lah tujuan akhir dari hidup ini. Bersyukur atas berkat, kasih karunia, kekuatan, kesehatan, dan pendampingan-Nya, sehingga penulis dapat menyelesaikan skripsi ini.
Penulis menyadari bahwa tak ada manusia yang sempurna. Oleh karena itu, penulis menerima kritik dan saran yang bersifat membangun demi kemajuan penelitian-penelitian dimasa mendatang.
Harapan penulis, semoga skripsi ini dapat bermanfaat bagi semua pihak, baik mahasiswa, lingkungan akademis, maupun masyarakat, serta memberikan sumbangan bagi perkembangan ilmu pengetahuan khususnya di bidang kefarmasian.
Yogyakarta,
x DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI ... vi
PRAKATA ... vii
DAFTAR ISI ... x
DAFTAR TABEL ... xv
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN ... xix
INTISARI ... xx
ABSTRACT ... xxi
BAB I. PENGANTAR ... 1
A. Latar Belakang ... 1
1. Perumusan masalah ... 3
2. Keaslian penelitian ... 4
3. Manfaat penelitian ... 5
B. Tujuan Penelitian ... 5
1. Tujuan umum ... 5
xi
BAB II. PENELAAHAN PUSTAKA ... 6
A. Tanaman Sirsak (Annona muricata L.) ... 6
1. Sinonim ... 6
2. Nama umum ... 6
3. Penyebaran ... 6
4. Klasifikasi ……... 7
5. Morfologi ... 7
6. Kandungan ... 8
7. Khasiat dan kegunaan ... 9
B. Infusa ... 10
C. Toksikologi ... 10
1. Definisi toksikologi ... 10
2. Asas toksikologi ... 11
3. Jenis uji toksikologi ... 14
D. Uji Toksisitas Subkronis. ... 16
E. Testis ... 19
1. Anatomi dan fisiologi testis ... 19
2. Spermatogenesis ... 21
3. Pengaturan hormonal ... 23
4. Gangguan fungsi testis ... 24
F. Ovarium ... 26
1. Anatomi dan fisiologi ovarium ... 26
xii
3. Pengaturan hormonal siklus ovarium ... 30
4. Gangguan fungsi ovarium ... 33
G. Keterangan Empiris... 34
BAB III. METODE PENELITIAN ... 35
A. Jenis dan Rancangan Penelitian ... 35
B. Variabel Penelitian ... 35
1. Variabel bebas ... 35
2. Variabel tergantung ... 35
3. Variabel pengacau ... 35
C. Definisi Operasional ... 36
1. Infusa daun sirsak ... 36
2. Daun sirsak yang digunakan ... 36
3. Pengaruh efek toksik ... 36
4. Sifat efek toksik ... 36
D. Alat dan Bahan Penelitian ... 36
1. Alat penelitian ... 36
2. Bahan penelitian ... 37
E. Tata Cara Penelitian ... 38
1. Determinasi daun sirsak ... 38
2. Pengumpulan bahan ... 38
3. Pembuatan serbuk ... 38
4. Penetapan kadar air ... 38
xiii
6. Penentuan peringkat dosis ... 39
7. Penyiapan hewan uji ... 41
8. Pengelompokan hewan uji ... 41
9. Prosedur pelaksanaan ... 42
10.Pengamatan ... 42
11. pembuatan preparat dan pemeriksaan histologis ... 43
F. Analisis dan Evaluasi Hasil ... 44
1. Pemeriksaan histologis organ ... 44
2. Uji reversibilitas ... 45
3. Penimbangan berat badan hewan uji ... 45
4. Pengukuran asupan pakan dan minum hewan uji ... 45
BAB IV. HASIL DAN PEMBAHASAN ... 46
A. Determinasi Tanaman Sirsak ... 47
B. Pembuatan Serbuk dan Penetapan Kadar Air ... 47
C. Gambaran Histologis Testis Akibat Pemberian Infusa Daun Sirsak ... 49
D. Gambaran Histologis Ovarium Akibat Pemberian Infusa Daun Sirsak ... 51
E. Reversibilitas ... 55
F. Pengaruh Pemberian Infusa Daun Sirsak Terhadap Perubahan Berat Badan Tikus Jantan dan Betina ... 60
xiv
H. Asupan Minuman Tikus Jantan dan Betina Akibat Pemberian
Infusa Daun Sirsak ... 65
I. Rangkuman Pembahasan ... 67
BAB V. KESIMPULAN DAN SARAN ... 69
A. Kesimpulan ... 69
B. Saran ... 69
DAFTAR PUSTAKA ... 70
LAMPIRAN ... 73
xv
DAFTAR TABEL
Halaman Tabel I. Hasil pemeriksaan histologis testis tikus kelompok kontrol
dan kelompok perlakuan infusa daun sirsak selama 30 hari ... 49 Tabel II. Hasil pemeriksaan histologis ovarium tikus kelompok
kontrol dan kelompok perlakuan infusa daun sirsak selama
30 hari ... 53 Tabel III. Hasil pemeriksaan histologis testis dan ovarium tikus
kelompok kontrol dan kelompok perlakuan uji reversibilitas ... 57 Tabel IV. Purata berat badan ± SEM tikus jantan pada kelompok
kontrol dan kelompok perlakuan infusa daun sirsak ... 60 Tabel V. Purata berat badan ± SEM tikus betina pada kelompok
xvi
DAFTAR GAMBAR
Halaman
Gambar 1. Morfologi daun sirsak (Annona muricata L.) ... 7
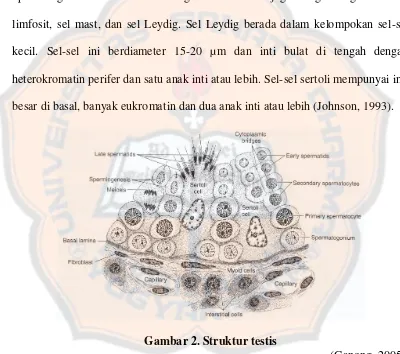
Gambar 2. Struktur testis ... 20
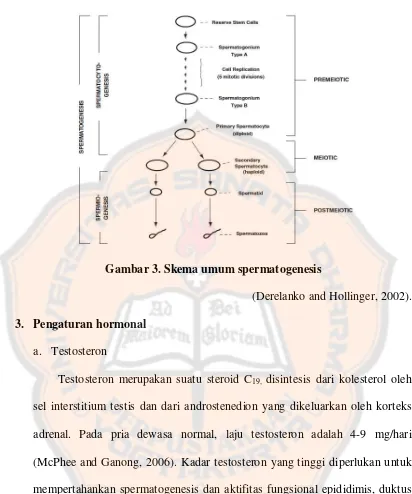
Gambar 3. Skema umum spermatogenesis ... 23
Gambar 4. Kerusakan sel penyusun testis ... 26
Gambar 5. Diagram ovarium ... 29
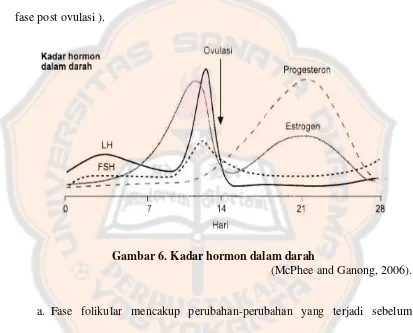
Gambar 6. Kadar hormon dalam darah ... 31
Gambar 7. Fibrosis pada stroma ovarium ... 34
Gambar 8. Gambaran histologis testis tikus akibat pemberian aquadest 8333 mg/kg dengan pewarnaan hematoksilin eosin, perbesaran 100X ... 50
Gambar 9. Gambaran histologis testis tikus akibat pemberian aquadest 8333 mg/kg dengan pewarnaan hematoksilin eosin, perbesaran 400X ... 51
Gambar 10. Gambaran histologis ovarium tikus akibat pemberian infusa daun sirsak dosis 180 mg/kg selama 30 hari dengan pewarnaan hematoksilin eosin, perbesaran 100X ... 54
Gambar 11. Gambaran histologis ovarium tikus akibat pemberian infusa daun sirsak 180 mg/kg selama 30 hari dengan pewarnaan hematoksilin eosin, perbesaran 400X ... 54 Gambar 12. Gambaran histologis testis tikus 14 hari setelah
xvii
mg/kg selama 30 hari dengan pewarnaan hematoksilin
eosin, perbesaran 100X ... 56 Gambar 13. Gambaran histologis testis tikus 14 hari setelah
diberhentikan dari pemberian infusa daun sirsak dosis 108 mg/kg selama 30 hari dengan pewarnaan hematoksilin
eosin, perbesaran 400X ... 56 Gambar 14. Gambaran histologis ovarium tikus 14 hari setelah
diberhentikan dari pemberian infusa daun sirsak dosis 180 mg/kg selama 30 hari dengan pewarnaan hematoksilin
eosin, perbesaran 100X ... 58 Gambar 15. Gambaran histologis ovarium tikus 14 hari setelah
diberhentikan dari pemberian infusa daun sirsak dosis 180 mg/kg selama 30 hari dengan pewarnaan hematoksilin
eosin, perbesaran 400X ... 59 Gambar 16. Grafik perubahan berat badan tikus jantan akibat pemberian
infusa daun sirsak ... 62 Gambar 17. Grafik perubahan berat badan tikus betina akibat pemberian
infusa daun sirsak ... 62 Gambar 18. Grafik asupan pakan tikus jantan akibat pemberian infusa
daun sirsak ... 64 Gambar 19. Grafik asupan pakan tikus betina akibat pemberian infusa
xviii
Gambar 20. Grafik asupan minuman tikus jantan akibat pemberian
infusa daun sirsak ... 65 Gambar 21. Grafik asupan minuman tikus betina akibat pemberian
xix DAFTAR LAMPIRAN
Halaman
Lampiran 1. Foto Daun Sirsak. ... . 74
Lampiran 2. Foto Infusa Daun Sirsak ... 74
Lampiran 3. Penetapan Peringkat Dosis Infusa Daun Sirsak dan Dosis Kontrol Aquadest. ... . 75
Lampiran 4. Perhitungan Konversi Dosis untuk Manusia ... . 76
Lampiran 5. Perhitungan Penetapan Kadar Air. ... . 77
Lampiran 6. Foto Penetapan kadar air ... 78
Lampiran 7. Surat Pengesahan Determinasi... . 79
Lampiran 8. Surat Ethics Committee Approval ... . 80
Lampiran 9. Hasil Diagnosis Histologis. ... . 81
Lampiran 10. Hasil Pemeriksaan Histologis Testis Tikus. ... . 83
Lampiran 11. Hasil Pemeriksaan Histologis Ovarium Tikus. ... . 84
Lampiran 12. Analisis Statistik Perubahan Berat Badan Tikus Jantan ... 86
Lampiran 13. Analisis Statistik Perubahan Berat Badan Tikus Betina ... . 88
xx INTISARI
Penelitian ini bertujuan untuk mengungkapkan spektrum efek toksik infusa daun sirsak terhadap testis dan ovarium berdasarkan gambaran histologisnya. Selain itu juga untuk menganalisis kekerabatan antara dosis infusa daun sirsak dengan spektrum efek toksik, serta mengevaluasi sifat efek toksik yang terjadi.
Penelitian ini bersifat eksperimental murni dengan rancangan acak lengkap pola searah. Hewan uji yang digunakan sebanyak 50 tikus: 25 jantan dan 25 betina, galur Sprague-Dalwey, umur 2-3 bulan. Kemudian dibagi secara acak menjadi 5 kelompok yaitu kelompok kontrol yang diberi aquadest 8333 mg/kg dan 4 kelompok perlakuan yang diberi infusa daun sirsak dengan dosis berturut-turut 108, 180, 301, dan 503 mg/kg BB. Pada hari ke-31, sebanyak lima tikus dari tiap dosis dikorbankan dan dilakukan pemeriksaan histologis. Selanjutnya dilakukan uji reversibilitas selama 14 hari tanpa pemberian perlakuan. Pada hari ke-15, hewan uji yang tersisa dikorbankan dan dilakukan pemeriksaan histologis.
Hasil pemeriksaan histologis menunjukkan testis dan ovarium dalam keadaan normal. Maka dapat disimpulkan bahwa pemberian infusa daun sirsak selama 30 hari tidak menimbulkan efek toksik terhadap testis dan ovarium. Selanjutnya, tidak ada hubungan antara dosis dengan spektrum efek toksik yang terjadi. Sifat efek toksik tidak dapat ditentukan karena gambaran histologis pada perlakuan maupun uji reversibilitas menunjukkan testis dan ovarium dalam keadaan normal.
xxi
ABSTRACT
This research aims to examine the aqueous extract Annona muricata L.’s spectrum toxic on testes and ovaries based on histologic. Also to analizes
correlation between doses examine and toxic effects’s spectrum, and to evaluate
the toxic effect’s reversibility.
This research is purely experimental with one way pattern of completely randomized design. Animals testing are used by 50 rats: 25 males and 25 females, strain Sprague-Dalwey, age 2-3 month. Then devide randomly into 5 groups, control group were given distilled water 8333 mg/kg and 4 treatment groups were given a dose of extract aqueous Annona muricata L. 108, 180, 301, and 503 mg/kg, respectively. On 31st days, 5 rats from each dose were sacrificed and examined histologically. Furthermore, the reversibility test performed for 14 days without giving treatment. On 15th days, the remaining test animals were sacrificed and examined histologically.
The result of histologic examination indicate that the testes and ovaries in normal state. So, can be concluded that the administration of aqueous extract of Annona muricata L. for 30 days didn’t cause toxic effects on the testes and ovaries. Futhermore, there are no relations between the amount of doses with
toxic’s effect determines. The characteristic of toxic’s effect can’t determined
because the treatment and reversibility histological test showed testes and ovaries in normal state.
1 BAB I PENGANTAR
A. Latar Belakang
Salah satu tanaman yang banyak digunakan dalam pengobatan tradisional adalah tanaman sirsak (Annona muricata L.). Daun sirsak mempunyai banyak khasiat untuk mengatasi berbagai penyakit sehingga banyak digunakan dalam masyarakat diberbagai negara, diantaranya digunakan dalam sistem pengobatan herbal di Afrika sebagai sedatif dan antispasmodik, di Nigeria biasanya digunakan sebagai antiparasit, antispasmodik, adstringen, antikanker, sedatif, insektisida, analgetik, dan mengobati penyakit kulit (Adewole and Ojewole, 2009). Penggunaan daun sirsak di Indonesia antara lain untuk mengobati penyakit hipertensi, demam, kecacingan, diare, luka bisul, jerawat, antikolesterol dan sebagai antikanker (Trubus, 2011). Berdasarkan penelitian Adewole dan Ojewole (2009) dilaporkan bahwa ekstrak air daun sirsak mempunyai efek sebagai antidiabetes, sedangkan ekstrak etanolnya mempunyai efek antioksidan (Baskar, Rajeswari, and Kumar, 2007).
yang diberikan dengan dosis berulang pada hewan uji tertentu selama kurang dari tiga bulan (Donatus, 2001).
Pada penelitian ini, daun sirsak yang diberikan dalam perlakuan dibuat dalam bentuk sediaan infusa. Infusa merupakan sediaan cair yang dibuat dengan cara mengekstraksi simplisia nabati dengan air pada suhu 900C selama 15 menit (Direktorat Obat Asli Indonesia, 2010). Bentuk sediaan infusa lebih mudah dibuat oleh masyarakat daripada dalam bentuk ekstrak karena infusa lebih mendekati rebusan. Selain itu bentuk sediaan infusa sudah termasuk dalam kategori bentuk sediaan herbal Badan POM Republik Indonesia (Direktorat Obat Asli Indonesia, 2010).
Pengamatan yang dilakukan meliputi pengamatan dan pemeriksaan terhadap asupan pakan dan minum untuk masing-masing hewan, perubahan berat badan, dan pemeriksaan histologis organ testis dan ovarium. Pengamatan patologi dilakukan terhadap gambaran histologis testis dan ovarium (Lu, 1995). Organ testis dan ovarium termasuk organ yang penting yaitu sebagai organ reproduksi yang berfungsi menghasilkan individu baru dan menghasilkan hormon-hormon tertentu. Fungsi reproduksi ini sangat penting bagi kelangsungan hidup suatu spesies sehingga muncul gagasan untuk mengetahui ketoksikan dan sifat efek toksik infusa daun sirsak jika dikonsumsi secara subkronis.
2500 mg/kg tidak menimbulkan efek toksik terhadap testis. Namun penelitian tersebut hanya dilakukan selama 14 hari dan tidak dilakukan uji keterbalikkan. Arthur et al. (2011) juga tidak meneliti tentang efek toksik daun sirsak terhadap organ reproduksi pada hewan betina (ovarium). Hal ini mendorong penulis untuk melakukan penelitian mengenai ketoksikan dan sifat efek toksik daun sirsak terhadap ovarium dan testis dengan jangka waktu yang lebih lama. Dalam penelitian ini dilakukan uji toksisitas subkronis infusa daun sirsak selama 30 hari dengan uji keterbalikkan selama 14 hari terhadap tikus putih galur Sprague-Dalwey untuk mengetahui apakah infusa daun sirsak yang diberikan selama
perlakuan memberikan pengaruh atau efek toksik terhadap testis dan ovarium dan apakah efek toksik yang ditimbulkan dapat kembali normal jika pemejanan dihentikan, dilihat dari gambaran histologisnya. Hasil penelitian ini diharapkan dapat diaplikasikan untuk mengetahui ketoksikan dan sifat efek toksik daun sirsak pada organ reproduksi manusia.
1. Perumusan masalah
Berdasarkan latar belakang diatas, dapat dirumuskan permasalahan sebagai berikut:
a. Apakah pemberian infusa daun sirsak secara subkronis mempunyai efek toksik terhadap testis dan ovarium tikus?
b. Apakah ada hubungan antara dosis dengan spektrum efek toksik yang terjadi?
2. Keaslian penelitian
Penelitian yang pernah dilakukan antara lain sebagai berikut:
a. Evaluasi toksisitas akut dan subkronis ekstrak air Annona muricata L. pada hewan. Hasil penelitian menunjukkan bahwa A. muricata pada dosis rendah bersifat hipoglikemik dan hipolipidemia. Namun pada dosis tinggi menyebabkan kerusakan ginjal dan menimbulkan efek negatif pada fungsi rahim (Arthur, et al., 2011).
b. Efek perlindungan ekstrak daun Annona muricata L. (Annonaceae) terhadap profil serum lipid dan kerja oksidatif hepatosit pada tikus diabetes terinduksi Streptozotocin menunjukkan hasil bahwa pemberian streptozotocin berkaitan dengan stress oksidatif pada jaringan hati dan ekstrak air daun A. muricata menunjukkan aktivitas antioksidan yang dapat menghambat/mencegah kerusakan oksidatif yang disebabkan oleh pemberian streptozocin (Adewole and Ojewole, 2009).
c. Aktivitas antimikroba secara in vitro dan analisis fitokimia daun Annona muricata. Hasil menunjukkan bahwa A. muricata dapat digunakan pada penyakit yang disebabkan oleh organisme uji yang digunakan pada penelitian ini yaitu Staphylococcus aureus, Streptococcus pyogenes, Bacillus subtilis, Enterobacter aerogenes, Escherichia coli, Klebsiella
Sepengetahuan penulis, penelitian tentang uji toksisitas subkronis infusa daun sirsak terhadap gambaran histologis organ testis dan ovarium tikus belum pernah dilakukan.
3. Manfaat penelitian a. Manfaat teoritis
Hasil penelitian ini diharapkan dapat bermanfaat bagi pengembangan ilmu kefarmasian dan pengobatan tradisional khususnya tentang daun sirsak
b. Manfaat praktis
Hasil penelitian ini diharapkan dapat dijadikan sebagai bahan informasi mengenai toksisitas infusa daun sirsak terhadap organ testis dan ovarium pada pemakaian berturut-turut
B. Tujuan Penelitian 1. Tujuan umum
Penelitian ini bertujuan untuk membuktikan ada tidaknya potensi efek toksik dari infusa daun sirsak terhadap testis dan ovarium tikus
2. Tujuan khusus
a. Dari penelitian ini dapat diketahui spektrum efek toksik dari infusa daun sirsak terhadap testis dan ovarium tikus
b. Mengungkapkan hubungan antara dosis yang diberikan dengan spektrum efek toksik yang terjadi
6 BAB II
PENELAAHAN PUSTAKA
A. Tanaman Sirsak (Annona muricata L.) 1. Sinonim
Annona bonplandiana Kunth, Annona cearensis Bard. Rodr., Annona
macrocarpa Werckle, Annona muricata var borinquensis Morales, guanabanus
muricatus Gomez (Pinto et al., 2005).
2. Nama umum
Annona muricata L. merupakan tanaman buah tropis yang banyak
dikenal dengan nama guanabana (Spanish), Graviola (Brazil), pawpaw, corossolier (Perancis), guanavana, toge-banreisi, nangka blanda, dan nangka londa, zuurzak (Jerman), munolla (India), mullu ramaphala (Kanada), durian belanda (Malaysia) (Romero, Beristain, Gabas, and Tellis, 2007; Pinto et al., 2005). Indonesia: Sirsak, nangka sabrang, nangka walanda. Inggris: Soursop. Melayu: Durian Belanda, Durian Benggala. Vietnam: Mang Cau Xiem. Thailand: Thurian Thet, Thurian Khaek. Pilipina: Guyabano, Atti, Illabanos (Plantamor, 2008).
3. Penyebaran
4. Klasifikasi
Kingdom : Plantae (Tumbuhan)
Subkingdom : Tracheobionta (Tumbuhan berpembuluh) Super Divisi : Spermatophyta (Menghasilkan biji) Divisi : Magnoliophyta (Tumbuhan berbunga) Kelas : Magnoliopsida (berkeping dua / dikotil) Sub Kelas : Magnolidae
Ordo : Magnoliales Famili : Annonaceae
Genus : Annona
Spesies : Annona muricata L.
(Plantamor, 2008). 5. Morfologi
Daun sirsak berbentuk elips memanjang atau bulat menyempit dengan bagian ujung yang meruncing. Daun ini memiliki panjang ±6-20 cm dan lebar ±2-6 cm. Permukaan daun halus dan mengkilat, dengan warna hijau yang lebih tua dari bagian permukaan atas dibandingkan dengan permukaan bawah, seperti ditunjukkan pada gambar 1 (Orwa, Mutua, Kindt, Jamnadass, and Simons, 2009).
Gambar 1. Morfologi daun sirsak (Annona muricata L.)
Buahnya berbentuk oval, kadang-kadang bentuknya bulat tidak beraturan, panjangnya 10-30 cm dan lebarnya 15 cm dengan berat 4,5-6,8 kg. Buah ini dilapisi dengan kulit berduri yang tampak tajam namun halus jika disentuh. Buah yang belum matang berwarna hijau tua dan lama-kelamaan semakin menguning (Enweani, Obroku, Enahoro, and Omoifo, 2004). Daging buah berwarna putih, sangat lembut, agak masam, dan beraroma segar, cocok untuk dibuat minuman seperti jus atau dimakan langsung. Daging buah soursop banyak digunakan untuk membuat jus, sirup, nastar, jelly, es krim dan selai (Romero et al., 2007).
6. Kandungan
Beberapa komponen kimia telah diisolasi dari bagian-bagian tanaman (akar, batang, daun, buah, dan biji). Sirsak mengandung karbohidrat, protein, asam folat, kalsium, fosfor, besi, vitamin C, dan banyak mengandung vitamin B1 dan B2 (Enweani et al., 2004). Pathak et al. pada tahun 2010 melaporkan bahwa ekstrak air dan ekstrak methanol dari daun sirsak mengandung steroid, glikosida jantung, tannin, dan gula.
7. Khasiat dan kegunaan
Dalam pengobatan tradisional, tanaman ini digunakan pada pengobatan disentri, kardiovaskuler, konstipasi, hemoragi, infeksi bakteri, antivirus, demam, antiinflamasi, dan gangguan lambung. Juga digunakan untuk antitumor, antifertilitas, sedatif, antispasmodik, dan hipotensi (Rajeswari, Gajalakshmi, and Vijayalakshmi, 2012; Yuan et al., 2003).
Bioaktivitas fraksinasi dari daun sirsak yang telah diisolasi menunjukkan adanya kandungan acetogenin, yaitu muricoreacin, dan murihexocin yang menunjukkan efek sitotoksik yang signifikan terhadap sel tumor manusia (Watson and Preedy, 2009). Berdasarkan hasil penelitian Baskar et al. (2007), ekstrak etanol daun Annona muricata menunjukkan aktivitas antioksidan yang paling poten secara in vitro dengan persen penghambatan yang paling besar dibandingkan dengan daun Annona squamosa dan Annona reticulata. Hal ini mungkin dikarenakan adanya kandungan acetogenin yang memegang peran sebagai penghalau radikal bebas yang efektif dan juga sebagai agen antitumor.
B. Infusa
Infusa adalah sediaan cair yang dibuat dengan cara mengekstraksi simplisia nabati dengan air pada suhu 900C selama 15 menit. Pembuatan infuas merupakan cara yang paling sederhana untuk membuat sediaan herbal dari bahan lunak seperti daun dan bunga (Direktorat Obat asli Indonesia, 2010).
Pembuatan sediaan infusa adalah dengan mencampur simplisia yang telah diayak dengan derajat halus yang sesuai dalam panci dengan air secukupnya, panaskan di atas tangas air selama 15 menit terhitung mulai suhu mencapai 900C sambil sekali-sekali diaduk-aduk. Diserkai selagi masih panas dengan kain flanel, jika volume belum memenuhi dapat ditambahkan air panas pada ampas sampai didapat volume yang dikehendaki (Direktorat Obat asli Indonesia, 2010).
C. Toksikologi 1. Definisi toksikologi
2. Asas toksikologi
Peristiwa timbulnya efek toksik racun atas makhluk hidup terjadi melalui beberapa proses, diawali dengan terjadinya pemejanan racun atas makhluk hidup. Setelah mengalami absorpsi dari tempat pemejanannya, racun atau metabolitnya didistribusikan ketempat aksi (sel sasaran atau reseptor) tertentu yang ada di dalam makhluk hidup. Ditempat aksi ini terjadi antaraksi antara racun atau metabolitnya dengan komponen penyusun sel sasaran atau reseptor, yang menyebabkan terjadinya serangkaian peristiwa biokimia dan biofisika yang menimbulkan efek toksik dengan wujud dan sifat tertentu (Donatus, 2001).
Berdasarkan alur peristiwa timbulnya efek toksik suatu racun, maka ada empat asas utama yang perlu dipahami dalam toksikologi yaitu kondisi efek toksik, mekanisme aksi, wujud, dan sifat efek toksik.
a. Kondisi efek toksik
Kondisi efek toksik adalah keadaan atau faktor yang mempengaruhi keefektifan absorpsi, distribusi, dan eliminasi zat beracun didalam tubuh sehingga menentukan keberadaan (kadar dan lama tinggal) senyawa atau metabolitnya ditempat aksi dan keefektifan antaraksinya (mekanisme aksi). Keadaan ini bergantung pada kondisi pemejanan dan kondisi makhluk hidup (Donatus, 2001).
b. Mekanisme efek toksik
antara racun dan tempat aksinya, dan berdasarkan risiko penumpukan racun dalam gudang penyimpanan tubuh (Donatus, 2001).
Mekanisme aksi berdasarkan sifat dan tempat kejadian dibedakan menjadi mekanisme luka intrasel dan ekstrasel. Mekanisme luka intrasel disebut juga mekanisme langsung atau primer, yaitu luka sel yang diawali oleh aksi racun pada tempat aksinya didalam sel. Sedangkan mekanisme aksi ekstrasel terjadi secara tidak langsung atau mekanisme sekunder, dimana tempat kejadian awalnya di lingkungan ekstrasel (Donatus, 2001).
Mekanisme aksi berdasarkan sifat antaraksi digolongkan menjadi dua, yaitu aksi toksik yang didasarkan atas antaraksi yang terbalikkan dan yang tak terbalikkan antara racun dan tempat aksinya. Antaraksi yang terbalikkan artinya bila kadar racun yang ada di reseptor habis, maka reseptor akan kembali kekedudukan semula, sehingga efek toksik yang ditimbulkan oleh racun akan hilang bila pemejanan racun dihentikan. Antaraksi tak terbalikkan memungkinkan penumpukan efek. Artinya, kerusakan yang terjadi sifatnya sama, sehingga akan terjadi penumpukan efek toksik. Maka pemejanan dengan takaran yang sangat kecil dalam jangka panjang akan menimbulkan efek toksik yang seefektif dengan yang ditimbulkan oleh pemejanan racun takaran besar dalam jangka pendek (Donatus, 2001).
senyawa tersebut akhirnya terlepas ke sirkulasi darah dan meningkatkan kadar senyawa yang ada dicairan tubuh. Bila kadar tersebut melebihi harga kadar toksik minimum (KTM) senyawa tersebut, maka akan menimbulkan efek toksik yang tidak diinginkan (Donatus, 2001).
c. Wujud efek toksik
Wujud efek toksik adalah hasil akhir dari aksi dan respon toksik. Respon toksik merupakan suatu proses di mana sel, jaringan, atau organ menanggapi adanya luka dalam komponen-komponen tubuhnya. Respon yang terjadi merupakan hasil dari (1) perubahan biokimia terhadap luka sel akibat antaraksi racun dan tempat aksinya. Termasuk efek toksik jenis ini diantaranya penghambatan respirasi selular, perubahan keseimbangan cairan dan elektrolit, dan gangguan pasok energi. Perubahan biokimia pada umumnya bersifat terbalikkan. (2) perubahan fisiologi (fungsional) yang berkaitan dengan antaraksi racun dengan reseptor atau tempat aktif enzim sehingga mempengaruhi fungsi homeostasis tertentu. Perubahan ini bersifat terbalikkan. Termasuk efek toksik jenis ini diantaranya anoksia, gangguan pernapasan, perubahan kontraksi dan relaksasi otot, dan gangguan sistem saraf pusat. (3) perubahan structural, yang biasanya diawali oleh perubahan biokimia atau fungsional. Termasuk dalam jenis ini diantaranya perlemakan, nekrosis, karsinogenesis, dan teratogenesis (Donatus, 2001).
d. Sifat efek toksik
kembali seperti keadaan normal atau seperti sebelum terjadi efek toksik. Keterbalikkan ini tergantung dari sejumlah faktor, termasuk tingkat paparan (waktu dan jumlah racun) dan kemampuan jaringan yang terkena untuk memperbaiki diri atau beregenerasi. Sifat tak terbalikkan adalah jika efek toksik yang terjadi menetap atau tidak dapat kembali seperti keadaan normal (Williams, James, and Roberts, 2000).
3. Jenis uji toksikologi
Jenis uji toksikologi dapat dibagi menjadi dua golongan yaitu uji ketoksikan tak khas dan uji ketoksikan khas.
a. Uji ketoksikan tak khas
Uji ketoksikan tak khas adalah uji toksikologi yang dirancang untuk mengevaluasi keseluruhan atau spektrum efek toksik suatu senyawa pada aneka ragam jenis hewan uji. Termasuk dalam uji ketoksikan tak khas adalah: 1) Uji ketoksikan akut, yaitu uji yang dirancang untuk menentukan efek
toksik suatu senyawa yang terjadi dalam waktu yang singkat setelah pemejanan atau pemberian dalam jumlah tertentu. Biasanya pengamatan dilakukan selama 24 jam. Data kuantitatif yang diperoleh adalah nilai LD50
sedangkan data kualitatif berupa penampakan klinis dan morfologis efek toksik senyawa uji (Klaassen, 2001).
memperlihatkan apakah spektrum efek toksik tersebut berkaitan dengan takaran dosis. Hasil uji memberikan informasi tentang efek toksik utama senyawa uji dan organ-organ yang dipengaruhi, efek toksik lambat yang tidak diamati pada uji ketoksikan akut, kekerabatan antara dosis dan efek toksik, dan reversibilitas (Donatus, 2001).
3) Uji ketoksikan kronis merupakan uji ketoksikan suatu senyawa yang diberikan dengan dosis berulang pada hewan uji selama lebih dari tiga bulan (selama sebagian besar masa hidup hewan uji) (Klaassen, 2001). b. Uji ketoksikan khas
Uji ketoksikan khas adalah uji toksikologi yang dirancang untuk mengevaluasi secara rinci efek khas suatu senyawa pada aneka ragam jenis hewan uji. Termasuk dalam uji ketoksikan khas adalah:
1) Uji potensiasi adalah uji untuk menentukan efek suatu senyawa dengan adanya senyawa lain yang kemungkinan meningkatkan ketoksikan salah satu senyawa tersebut. Uji potensiasi dilakukan mengikuti tata cara uji ketoksikan akut dengan melibatkan dua atau lebih senyawa uji.
2) Uji kekarsinogenikan adalah uji yang ditujukan untuk menentukan kemampuan senyawa dalam menimbulkan efek pertumbuhan sel yang lebih cepat dari keadaan normal, yang biasa disebut dengan kanker.
4) Uji keteratogenikan adalah uji yang ditujukan untuk menentukan pengaruh suatu senyawa terhadap janin dalam hewan bunting.
5) Uji reproduksi adalah uji yang ditujukan untuk menentukan pengaruh senyawa atas kapasitas reproduksi hewan uji.
6) Uji kulit dan mata adalah uji yang ditujukan untuk menentukan berbagai efek lokal senyawa bila bersentuhan langsung pada kulit dan mata.
7) Uji perilaku adalah uji yang ditujukan untuk mengevaluasi aktivitas lokomotor hewan uji atas pengaruh suatu senyawa
(Donatus, 2001; Hodgson, 2004).
D. Uji Toksisitas Subkronis
Uji ketoksikan subkronis biasanya disebut juga subakut merupakan uji ketoksikan suatu senyawa yang diberikan dengan dosis berulang pada hewan uji tertentu, selama kurang dari tiga bulan. Uji ini ditujukan untuk mengungkapkan spektrum efek toksik senyawa uji, serta untuk memperlihatkan apakah spektrum efek toksik itu berkaitan dengan takaran dosis (Donatus, 2001).
Hewan uji yang disarankan paling tidak satu jenis hewan dewasa sehat, baik jantan maupun betina yang peka, memiliki profil farmakokinetika dan pola metabolisme terhadap senyawa uji yang semirip mungkin dengan manusia. Dalam prakteknya, kebanyakan roden yang digunakan adalah tikus dan untuk nonroden adalah anjing (Hodgson, 2004). Menurut Derelanko anda Hollinger (2002), jumlah hewan uji yang digunakan untuk uji ketoksikan subkronis adalah lima ekor untuk masing-masing jenis kelamin dalam tiap kelompok perlakuan. Hewan uji harus diadaptasikan dahulu selama beberapa hari sebelum dilakukan percobaan agar kondisi hasil percobaan yang diperoleh benar-benar merupakan pengaruh pemberian perlakuan, bukan karena lingkungan yang baru bagi hewan uji.
Takaran dosis yang diberikan untuk hewan uji paling tidak merupakan peringkat dosis. Penelitian subkronis biasanya menggunakan sedikitnya tiga (lebih sering empat) peringkat dosis. Dosis tertinggi harus memperlihatkan gejala-gejala toksik yang nyata, dosis terendah sama sekali tidak menimbulkan efek atau gejala toksik, dan dosis tengah harus memberikan efek diantara kedua efek tersebut (Hodgson, 2004). Takaran dosis senyawa uji diberikan sekali sehari selama kurun waktu uji ketoksikan subkronis, melalui jalur pemberian sesuai dengan yang akan digunakan oleh manusia (Donatus, 2001).
Pengamatan dan pemeriksaan yang dilakukan dalam uji ketoksikan subkronis meliputi:
a. Perubahan berat badan yang diperiksa paling tidak 7 hari sekali
c. Gejala-gejala klinis umum yang diamati setiap hari
d. Pemeriksaan hematologi yang paling tidak diperiksa dua kali, pada awal dan akhir uji coba
e. Pemeriksaan kimia darah yang diperiksa dua kali pada awal dan akhir uji coba f. Analisi urin paling tidak sekali
g. Pemeriksaan histopatologi organ pada akhir uji coba
(Loomis, 1978 cit Donatus, 2001). Hasil uji ketoksikan subkronis memberikan informasi tentang efek toksik utama senyawa uji dan organ-organ sasaran yang dipengaruhinya, informasi tentang perkembangan efek toksik yang lambat berkaitan dengan takaran dosis yang tidak teramati pada uji ketoksikan akut, kekerabatan antara kadar senyawa dalam darah dan jaringan terhadap perkembangan luka toksik, dan keterbalikan (reversibilitas) efek toksik. Hasil ini digunakan untuk merancang uji ketoksikan kronis di mana hewan uji akan dipejani dengan senyawa uji dalam jangka waktu yang lebih lama (Donatus, 2001).
Efek toksik yang terjadi akibat pemberian senyawa uji, dapat dilihat dari besarnya kerusakan organ yang terjadi akibat pemberian senyawa uji. Kerusakan organ dapat dilihat dari gambaran histologis dari organ tersebut. Organ-organ yang dapat dijadikan sebagai obyek pemeriksaan histologis diantaranya adalah testis, ovarium, hati, ginjal, lambung, dan usus (Hodgson, 2004).
kandang. Sehingga kandang didesain secara khusus agar mudah dibersihkan, aman bagi hewan uji, dan dalam satu kandang hanya diisi satu hewan uji (Hodgson, 2004).
E. Testis 1. Anatomi dan fisiologi testis
Saluran reproduksi pria terdiri atas dua testis, duktus genital, kelenjar aksesorius, dan penis. Saluran reproduksi memiliki dua fungsi utama, yang pertama membentuk hormon androgenik, perkembangan karekteristik seks sekunder saat pubertas, serta pemeliharaan libido dan potensi selama masa dewasa. Fungsi kedua adalah membentuk sekitar 30 juta spermatozoa perhari selama masa subur pria. Kedua fungsi ini saling berkaitan, dan keduanya membutuhkan keutuhan aksis hipotalamus-hipofisis-testis. Oleh karena itu, penyakit hipotalamus, hipofisis, testis, atau kelenjar aksesorius dapat menyebabkan gangguan produksi androgen (menyebabkan hipogonadisme) atau produksi sperma (menyebabkan infertilitas) (McPhee and Ganong, 2006).
sel sertoli, yaitu sel yang menyokong sel-sel penghasil gamet. Sel-sel ini dihubungkan oleh sejumlah barier seluler, termasuk beberapa lapisan sel mioid. Sel mioid mempunyai banyak sifat-sifat otot polos (McPhee and Ganong, 2006).
Diantara tubulus-tubulus, terdapat sarang-sarang sel intersisial yang mengandung fibroblast jaringan ikat dan fibrol kolagen yang memegang jaringan apermatogenik bersama-sama. Jaringan intersisial ini juga mengandung makrofag, limfosit, sel mast, dan sel Leydig. Sel Leydig berada dalam kelompokan sel-sel kecil. Sel-sel ini berdiameter 15-20 µ m dan inti bulat di tengah dengan heterokromatin perifer dan satu anak inti atau lebih. Sel-sel sertoli mempunyai inti besar di basal, banyak eukromatin dan dua anak inti atau lebih (Johnson, 1993).
Gambar 2. Struktur testis
zat kimia kedalam testis ditentukan oleh bobot molekul, koefisien partisi, dan ciri– ciri ionnya (Lu, 1995).
Testis mempunyai dua fungsi, yaitu sebagai tempat spermatogenesis dan produksi androgen. Spermatogenesis terjadi dalam tubulus seminiferus testis. (Heffner and Schust, 2006). Dalam tubulus ini terdapat sel sertoli yang menjulur dari membran dasar sampai ke lumen tubulus dan berisi protein pengikat-androgen (pengikat-androgen-binding protein=ABP). Androgen-binding protein (ABP) memudahkan pergerakan androgen kespermatosid untuk pengembangannya. Sel sertoli membantu menghancurkan sel-sel selama spermatogenesis dan badan sisa yang dilepaskan spermatid selama spermiogenesis. Sel sertoli mensekresi cairan yang menimbulkan suasana lingkungan yang cocok untuk spermatozoa dalam tubulus seminiferus. Selain itu, sel sertoli juga mensekresi protein inhibin yang memberikan umpan balik membantu menghambat produksi FSH oleh gonadotrop andenohipofiis maupun secara langsung mempengaruhi sekresi gonadotropin releasing hormone (GnRH) (Johnson, 1993).
Selain itu ada sel Leydig, yang terletak dalam jaringan intersisial disekeliling tubulus seminiferus (Lu, 1995). Sel-sel ini yang menghasilkan testosteron dan dihidrotestosteron serta menyekresikan hormon-hormon tersebut ke dalam darah (McPhee and Ganong, 2006).
2. Spermatogenesis
berkembangbiak membentuk spermatogonium lain sementara lainnya mengalami pematangan menjadi spermatozoa. Ada tiga tahap antara, spermatogonium membelah dengan mitosis untuk membentuk spermatosid primer, yang kemudian membelah dengan meiosis untuk membentuk spermatosid sekunder. Kemudian spermatosid sekunder membelah diri membentuk spermatid. Melalui metamorfosis, spermatid berubah menjadi spermatozoa. Seluruh proses terjadi secara berkesinambungan. Waktu yang dibutuhkan spermatogonium untuk menjadi spermatozoa adalah sekitar 60 hari (Lu, 1995).
Skema umum spermatogenesis mamalia (gambar 3) menunjukkan tahap premeiotic dan meiosis dari spermatositogenesis (dari sel batang cadangan melalui
Gambar 3. Skema umum spermatogenesis
(Derelanko and Hollinger, 2002). 3. Pengaturan hormonal
a. Testosteron
Testosteron merupakan suatu steroid C19, disintesis dari kolesterol oleh
b. Dihidrotestosteron (DHT)
Dihidrotestosteron berasal baik dari sekresi langsung oleh testis (sekitar 20%) maupun dari perubahan perifer testosteron dan prekursor androgen lainnya yang berasal dari testis dan adrenal (sekitar 80%). DHT beredar dalam darah, dengan kadar DHT plasma normal untuk pria dewasa adalah 27-75 ng/dL (McPhee and Ganong, 2006).
c. Luteinizing hormone (LH)
Luteinizing hormone dihasilkan oleh gonadotrop basofilik di
adenohipofisis. GnRH hipotalamus merangsang gonadotrop untuk mensekresi LH (Johnson, 1993). LH merangsang sel intersisial Leydig untuk menghasilkan testosteron (McPhee and Ganong, 2006).
d. Follicle-stimulating hormone (FSH)
Follicle-stimulating hormone dihasilkan oleh gonadotrop adenohipofisis
basofilik. Hormon ini bekerja pada sel sertoli untuk mempermudah spermatogenesis (McPhee and Ganong, 2006).
e. Hormon lain
Sel sertoli melepaskan protein pengikat androgen, yang menimbunnya dalam tubulus seminiferus dan membantu menciptakan kadar testosteron setempat yang tinggi yang diperlukan untuk spermatogenesis (Johnson, 1993).
4. Gangguan fungsi testis
(kriptorkismus) merupakan kelainan genitelia yang paling sering dijumpai pada 2% anak laki-laki usia 1 tahun dan 0,3% setelah pubertas (Ganong, 2005). Kriptorkismus dapat disebabkan oleh salah satu dari hal berikut: (i) kegagalan hipotalamus janin untuk merangsang sekresi gonadotropin pada trimester ketiga; (ii) kegagalan testis mensekresi androgen; (iii) kegagalan konversi testosteron menjadi dihidrotestosteron pada jaringan target; (iv) tidak adanya reseptor androgen yang berfungsi (Heffner and Schust, 2006).
Kelainan lain adalah hernia inguinalis yang merupakan keadaan yang menyerupai kriptorkripmus. Pada keadaan ini terjadi penurunan testis, namun cincin inguinal tidak menutup dengan sempurna setelah penurunan. Anak laki-laki yang didiagnosis mengalami hernia inguinalis sebelum usia 15 tahun memiliki resiko dua kali lipat untuk mengalami kanker testis dibandingkan anak laki-laki pada populasi umum (Heffner and Schust, 2006).
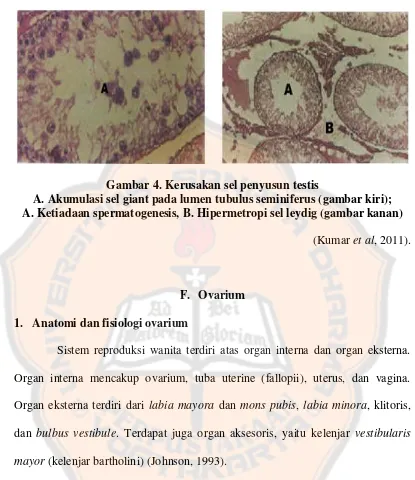
Kerusakan testis dapat dilihat dari gambaran histologis, seperti misalnya intertubular edema, perubahan degeneratif pada epitelium gonad dengan akumulasi sel giant pada lumen tubulus seminiferus, hipermetropi sel leydig, dan ketiadaan spermatogenesis yang ditunjukkan pada gambar 4 (Kumar, Kanniappan, and Mathuram, 2011).
Gambar 4. Kerusakan sel penyusun testis
A. Akumulasi sel giant pada lumen tubulus seminiferus (gambar kiri); A. Ketiadaan spermatogenesis, B. Hipermetropi sel leydig (gambar kanan)
(Kumar et al, 2011).
F. Ovarium 1. Anatomi dan fisiologi ovarium
Sistem reproduksi wanita terdiri atas organ interna dan organ eksterna. Organ interna mencakup ovarium, tuba uterine (fallopii), uterus, dan vagina. Organ eksterna terdiri dari labia mayora dan mons pubis, labia minora, klitoris, dan bulbus vestibule. Terdapat juga organ aksesoris, yaitu kelenjar vestibularis mayor (kelenjar bartholini) (Johnson, 1993).
polos, dan sejumlah arteri dan vena yang berkelok-kelok dari cabang kecil beradiasi ke korteks. Korteks dan medulla tersusun tanpa garis pemisah yang jelas (Bloom and Fawcett, 1994). Kedua ovarium mengandung ribuan folikel, masing-masing dengan satu oosit yang dikelilingi oleh sel granulosa, yang terbenam dalam suatu matriks sel-sel teka. Sel-sel penunjang ini menghasilkan steroid dan produk-produk parakrin yang penting dalam pematangan folikel dan koordinasi proses-proses reproduksi (McPhee and Ganong, 2006).
2. Siklus ovarium
Setiap bulan sistem reproduksi wanita mengalami perubahan siklus teratur yang dapat dikatakan sebagai persiapan untuk kehamilan. Pada mamalia, siklus ini merupakan siklus menstruasi dengan gambaran yang paling menyolok adalah adanya pendarahan vagina priodik yang timbul dengan pelepasan mukosa uterus. Lama siklus ini bervariasi pada tiap wanita, tetapi gambaran rata-rata 28 hari dari mulai satu masa menstruasi ke masa berikutnya (Ganong, 2005). Siklus menstruasi memiliki tiga fase yaitu:
a. Fase folikular
Gambar 5. Diagram ovarium (Ganong, 2005).
1) Folikel primordial dan folikel primer
Sel epitel folikel di folikel primordial membentuk lapisan gepeng disekeliling oosit. Folikel primordial menjadi folikel primer yang mempunyai banyak lapisan karena sel epitel berproliferasi membentuk beberapa lapisan. Sel-sel stroma yang berdekatan pada tiap folikel yang sedang bertumbuh membentuk lapisan konsentris disebut teka interna 2) Folikel sekunder (antral)
3) Pematangan folikel
Sel-sel granulosa mengalami proliferasi akhir, produksi likuor folikuli meningkat dan sel-sel granulosa sekeliling oosit saling lepas dari sel-sel granulosa didekatnya. Folikel menonjol ke permukaan ovarium. Karena ada rangsangan LH sebelum ovulasi, folikel yang menonjol memecah epitel germinal dan oosit sekunder masuk ke rongga peritoneum (Johnson, 1993).
b. Fase Ovulasi
Ovulasi merupakan proses dimana folikel dominan mengeluarkan oosit matangnya untuk diangkut melalui tuba uterine dan dibuahi serta tertanam di uterus yang sudah siap. Konseptus tertanam dalam rongga uterus dan terbentuk hubungan yang erat dengan jaringan maternal
c. Fase luteal
Fase luteal biasanya berlangsung rata-rata 14 hari dan ditandai oleh luteinisasi folikel yang pecah untuk menghasilkan corpus luteum (McPhee and Ganong, 2006). Jika timbul kehamilan, maka corpus luteum menetap dan biasanya tak ada haid lagi sampai persalinan. Jika tak ada kehamilan, maka corpus luteum mulai berdegenerasi sekitar 4 hari sebelum haid berikutnya dan kemudian digantikan oleh jaringan parut yang membentuk corpus albicans (Ganong, 2005).
3. Pengaturan hormonal siklus ovarium
FSH dan LH disekresi oleh gonadotrop adenohipofisialis. Estrogen dan progesteron disintesa di ovarium terutama di dalam dan di sekitar folikel (Johnson, 1993). Hormon-hormon ini berubah kadarnya sesuai fase yang terjadi (Gambar 6). Menurut Johnson (1993), siklus reproduksi wanita dibagi menjadi beberapa fase, yaitu fase folikular (fase preovulasi) dan fase luteal (ovulasi dan fase post ovulasi ).
Gambar 6. Kadar hormon dalam darah
(McPhee and Ganong, 2006).
a. Fase folikular mencakup perubahan-perubahan yang terjadi sebelum ovulasi, berupa rangsangan FSH pada folikel yang sedang tumbuh untuk menghasilkan estrogen dan progesteron. Estrogen kemudian merangsang pertumbuhan kelenjar endometrium.
1) Luteinisasi
a) Selama luteinisasi folikel, membran basalis epitel pecah-pecah, sel-sel garnulosa kolaps dan sejumlah pembuluh darah dan sel-sel-sel-sel teka interna pindah ke dalam korpus luteum yang sedang tumbuh
b) Korpus luteum terdiri dari sel-sel lutein teka dan sel-sel lutein granulosa, dan banyak pembuluh darah (Johnson, 1993). Korpus luteum mensekresi sejumlah besar steroid, hormon utama adalah progesteron, tetapi androgen dan estrogen juga dihasilkan. Kelanjutan sekresi korpus luteum membutuhkan stimulasi LH, tanpa rangsangan LH, corpus luteum mengalami degenerasi (McPhee and Ganong, 2006).
2) Progesteron merangsang kelenjar endometrium untuk mensekresi bahan pertumbuhan yang mendukung perkembangan awal suatu embrio, yang terdapat setelah fertilisasi.
4) Perkembangan folikel adalah proses yang terus menerus pada wanita yang dapat bereproduksi dan fase awalnya tidak bergantung pada rangsangan gonadotropin (Johnson, 1993).
4. Gangguan fungsi ovarium
Dalam sistem reproduksi wanita, telur dan ovarium dapat dipengaruhi oleh toksikan. Namun biasanya telur yang telah dibuahilah yang dipengaruhi secara langsung atau tidak langsung melalui perusakan terhadap rahim (Lu, 1995). Kanker sel epitel ovarium biasanya terdeteksi setelah terjadi penyebaran intraperitonial luas dan pada saat itu penyembuhan hampir tidak dapat terjadi (Heffner and Schust, 2006). Agar ovarium berfungsi dengan benar, diperlukan responsivitas terhadap gonadotropin, viabilitas instrinsik folikel, dan sejumlah interaksi parakrin di dalam dan di antara folikel. Sindrom ovarium polikistik (SOPK) adalah salah satu contoh disfungsi ovarium akibat gangguan mekanisme umpan-balik yang terus-menerus (McPhee and Ganong, 2006). Merupakan keadaan yang ditandai oleh penebalan capsula ovarium dan pembentukan beberapa kista folikular, biasanya dalam kedua ovarium (Ganong, 2005). Sindrom ovarium polikistik bermanifestasi sebagai anovulasi, infertilitas, dislipidemia, dan pendarahan uterus abnormal (McPhee and Ganong, 2006).
hewan roden dapat disebabkan karena pemberian terapi antikanker seperti agen alkilasi, antimetabolit, antibiotik, dan alkaloid vinca dengan atau tanpa radiasi ionik. Ovarium yang mengalami atropi biasanya ditandai dengan ukuran organ yang kecil dan tidak adanya perkembangan folikel atau corpus luteum. sel ovarium dan corpora albicans mungkin masih berbentuk tetapi stroma ovarium mengalami fibrosis (gambar 7). Akumulasi pigmen seroid (lipofuscin) umumnya terkait dengan usia yang menyebabkan perubahan sel stroma pada ovarium roden seperti pada strain Sprague-Dalwey (SD). Agen penghambat sintesis steroid seperti imidazol (antijamur) juga berpotensi menyebabkan pigmentasi pada ovarium roden (Greaves, 2000).
Gambar 7. Fibrosis pada stroma ovarium
(Greaves, 2000).
G. Keterangan Empiris
35 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian toksisitas subkronis infusa daun sirsak terhadap gambaran histologis testis dan ovarium tikus termasuk penelitian eksperimental murni dengan menggunakan rancangan penelitian acak lengkap pola searah.
B. Variabel Penelitian
1. Variabel bebas : dosis infusa daun sirsak.
2. Variabel tergantung : histologis testis dan ovarium tikus. 3. Variabel pengacau
a. Variabel pengacau terkendali
1) Subjek uji berupa tikus putih galur Sprague Dawley (SD), jenis kelamin jantan dan betina, umur 2 – 3 bulan, berat badan 160 – 280 g, keadaan fisik berstatus sehat, diperoleh dari Laboratorium Hayati Imono, Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta. 2) Bahan uji berupa daun sirsak, diperoleh dari wilayah Jetis, Ngaglik,
Sleman, Yogyakarta.
b. Variabel pengacau tak terkendali
C. Definisi Operasional
1. Infusa daun sirsak adalah sediaan cair yang dibuat dengan cara menginfundasi 6 g serbuk daun sirsak dengan 100 ml aquadest pada suhu 900C selama 15 menit.
2. Daun sirsak yang digunakan adalah daun dewasa segar yang berada antara ujung dan pangkal dari ranting, berwarna hijau, bersih, tidak berlubang/sobek, dan bentuk daunnya masih utuh.
3. Pengaruh efek toksik terhadap testis dan ovarium ditunjukkan dengan adanya perbedaan pada organ tersebut antara perlakuan dan kontrol berdasarkan gambaran histologis organ.
4. Sifat efek toksik adalah terbalikkan dan tak terbalikkan. Sifat terbalikkan, berarti kerusakan pada suatu organ bisa pulih kembali pada kondisi normal karena adanya proses perbaikan sel-sel dan jaringan-jaringan pada organ tersebut sehingga dapat berfungsi kembali sebagaimana mestinya. Sifat tak terbalikkan, yaitu jika kerusakan struktural hewan uji tidak kembali menjadi kondisi normal. Sifat efek toksik dilihat dengan membandingkan hasil pemeriksaan histologis uji reversibilitas dengan masa perlakuan.
D. Alat dan Bahan Penelitian 1. Alat penelitian
a. Alat-alat untuk pembuatan simplisia, yaitu timbangan digital, oven, blender, ayakan no. 40, wadah untuk menyimpan serbuk daun sirsak
c. Alat-alat untuk pembuatan infusa daun sirsak, yaitu timbangan, sendok, panci infusa, thermometer, heater, stopwatch, alat-alat gelas seperti bekker glass, pengaduk, gelas ukur
d. Alat-alat untuk perlakuan dan pemeriksaan histologis, yaitu kandang tikus (metabolic cage), jarum suntik per oral, spuit injeksi, timbangan, seperangkat alat bedah, alat-alat gelas dan pot-pot untuk menyimpan organ 2. Bahan penelitian
a. Subjek uji yang digunakan yaitu tikus putih galur Sprague Dawley (SD) jantan dan betina; umur 2-3 bulan; berat badan 160-280 g yang diperoleh dari Laboratorium Hayati Imono, Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
b. Bahan uji yang hendak diujikan adalah daun sirsak dalam kondisi segar, utuh, dan tidak bercacat, diperoleh dari wilayah Jetis, Ngaglik, Sleman, Provinsi Daerah Istimewa Yogyakarta pada bulan Mei-Juni 2012.
c. Bahan untuk penetapan kadar air, yaitu toluena yang diperoleh dari Laboratorium Farmakologi dan Toksikologi, Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
d. Bahan untuk kontrol negatif adalah aquadest yang diperoleh dari Laboratorium Farmakologi dan Toksikologi, Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
Laboratorium Hayati Imono, Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
f. Bahan untuk pemeriksaan histologis adalah formalin 10% yang dibuat dengan mengencerkan formalin 37% dengan aquadest sesuai volume yang dikehendaki.
E. Tata Cara Penelitian 1. Determinasi daun sirsak
Determinasi daun sirsak dilakukan dengan mencocokkan ciri-ciri daun dengan buku acuan (van Steenis, 1975).
2. Pengumpulan bahan
Bahan uji yang digunakan adalah daun sirsak kondisi segar, utuh, dan tidak bercacat, diperoleh dari wilayah Jetis, Ngaglik, Sleman, Provinsi Daerah Istimewa Yogyakarta pada bulan Mei-Juni 2012.
3. Pembuatan serbuk
Daun sirsak segar ditimbang, dibersihkan, dicuci dengan air mengalir, kemudian dikeringkan dalam oven dengan suhu ±500C selama ±72 jam. Daun sirsak yang telah kering dimasukkan ke dalam blender untuk dijadikan serbuk kemudian diayak dengan ayakan No.40. Selanjutnya dihitung persen (%) rendemen yang diperoleh.
4. Penetapan kadar air
alat. Tuang toluena kedalam tabung penerima melalui alat pendingin. Panaskan labu hati-hati selama 15 menit.
Setelah toluena mulai mendidih, suling dengan kecepatan lebih kurang 2 tetes tiap detik, hingga sebagian besar air tersuling, kemudian naikkan kecepatan penyulingan hingga 4 tetes tiap detik. Setelah semua air tersuling, cuci bagian dalam pendingin dengan toluena. Lanjutkan penyulingan selama 5 menit. Biarkan tabung penerima dan pendingin hingga suhu kamar. Setelah air dan toluena memisah sempurna, baca volume air. Hitung kadar air dalam %. 5. Pembuatan infusa
Serbuk dibuat sediaan infusa dengan cara menginfundasi 6 g serbuk daun sirsak dengan 100 ml aquadest pada suhu 900C selama 15 menit. Hasilnya diserkai selagi masih panas dengan kain flanel, jika volume belum memenuhi dapat ditambahkan air panas pada ampas sampai didapat volume yang dikehendaki.
6. Penentuan peringkat dosis
Penentuan peringkat dosis infusa daun sirsak dilakukan dengan mengambil dosis terapi yang digunakan oleh masyarakat sehari-hari, yaitu 2 g/70 kg BB manusia.
Dosis IV : 𝐷𝑥𝐵𝐵 =𝐶𝑥𝑉
Peringkat dosis ditetapkan dengan mengalikan dosis terapi dengan faktor pengali yaitu 1,67. Sehingga didapatkan peringkat dosis untuk tiap g tikus sebagai berikut:
Dosis I: 108 mg/kg BB tikus Dosis II: 180 mg/kg BB tikus Dosis III: 301 mg/kg BB tikus Dosis IV: 503 mg/kg BB tikus
7. Penyiapan hewan uji
Hewan uji yang digunakan terdiri dari satu jenis hewan uji tikus putih jantan dan betina, galur Sprague-Dawley (SD), sehat, dewasa, umur 2-3 bulan, berat badan 160-280 g, berjumlah 50 ekor (25 jantan dan 25 betina), ditempatkan dalam kandang (metabolic cage) dimana dalam satu kandang hanya berisi satu tikus. Hewan uji diadaptasikan dahulu selama tiga hari sebelum dilakukan percobaan.
8. Pengelompokan hewan uji
Pada penelitian ini, digunakan lima kelompok perlakuan. Lima puluh ekor tikus dibagi menjadi lima kelompok secara acak, masing-masing kelompok uji terdiri dari sepuluh ekor tikus (lima jantan dan lima betina). Pembagian peringkat dosis dengan faktor pengalian tetap dengan rincian pengelompokan sebagai berikut:
Kelompok I : diberi sediaan uji infusa daun sirsak dengan dosis 108 mg/kg BB tikus
Kelompok II : diberi sediaan uji infusa daun sirsak dengan dosis 180 mg/kg BB tikus
Kelompok III : diberi sediaan uji infusa daun sirsak dengan dosis 301 mg/kg BB tikus
Kelompok IV : diberi sediaan uji infusa daun sirsak dengan dosis 503 mg/kg BB tikus
9. Prosedur pelaksanaan
Sediaan uji berupa infusa daun sirsak diberikan pada hewan uji sesuai dengan dosis pemberian dengan kekerapan pemberian sekali sehari selama 30 hari pada tikus jantan dan betina dengan tetap diberi makan dan minum. Pada hari ke-31, lima ekor tikus dari masing-masing kelompok diambil secara acak untuk dikorbankan. Organ testis dan ovarium diambil dan dimasukkan dalam larutan formalin 10% untuk dibuat preparat histologis. Sementara hewan uji dari masing-masing kelompok yang masih tersisa tetap dipelihara dengan diberi makan dan minum tanpa perlakuan infusa daun sirsak maupun kontrol selama 14 hari. Masa ini disebut dengan masa keterbalikan, untuk melihat apakah pengaruh pemberian infusa daun sirsak selama 30 hari terhadap testis dan ovarium bersifat terbalikkan atau tak terbalikkan. Uji keterbalikkan dilakukan pada hari ke-15, semua hewan yang tersisa dikorbankan, diambil organ testis dan ovariumnya untuk dibuat preparat histologis. Pengamatan histologis dilakukan di Laboratorium Patologi Fakultas Kedokteran Hewan UGM dibawah bimbingan drh. Sitarina Widyarini, MP., Ph. D., untuk melihat apakah ada gangguan atau kelainan pada testis dan ovarium. Hasil pemeriksaan dibuat fotomikroskopi sebagai data kualitatif.
10. Pengamatan
a. Pengamatan berat badan hewan uji
melihat purata perubahan berat badan tiap kelompok hewan uji pada hari ke-0, 7, 14, 21, dan 28.
b. Pengukuran asupan pakan hewan uji
Hewan uji diberikan asupan pakan berupa pellet AD2 setiap hari sebanyak 20 g dan dilakukan penggantian pakan setiap harinya selama 30 hari masa pemejanan dan 14 hari masa reversibilitas. Cara mengukur besarnya asupan makan tikus yaitu dengan menimbang pakan yang diberikan pada hari pertama dan pakan yang masih tertinggal di wadah pada hari kedua. Selisih penimbangan antara berat pakan hari pertama dengan berat pakan hari kedua, dihitung sebagai asupan makanan yang dihabiskan pada hari pertama.
c. Pengukuran asupan minum hewan uji
Hewan uji diberikan minum berupa air reverse osmosis (RO) setiap hari sebanyak 120 ml selama 30 hari masa pemejanan dan 14 hari masa reversibilitas. Minuman diberikan dalam wadah botol berskala dengan pipa yang diberi lubang pada ujungnya. Air minum yang dihabiskan tikus pada hari pertama dihitung dengan cara mengurangkan jumlah air minum yang diberikan pada hari pertama dengan jumlah air minum sisa pada hari kedua.
11. Pembuatan preparat dan pemeriksaan histologis
direndam dengan larutan formalin 10%. Preparat dimasukkan ke dalam larutan etanol secara bertingkat berturut-turut etanol 70% selama 20 menit, etanol 80% selama 20 menit, etanol 95% selama 20 menit, etanol absolute 20 menit sebanyak 2 kali perlakuan. Selanjutnya, dimasukkan kedalam larutan propanol selama 20 menit sebanyak 3 kali perlakuan.
Preparat kemudian dimasukkan ke dalam xilol paraffin, dipanaskan selama satu jam. Perlakuan ini dilakukan sebanyak 2 kali. Pindahkan preparat ke dalam paraffin cair selama 30 menit dalam blok preparat, kemudian didinginkan. Setelah dicetak, preparat dipotong dengan mikrotom setebal 5 mikron, masukkan inkubator untuk memanaskan preparat. Preparat diletakkan diatas kaca preparat yang telah diolesi albumin agar preparat dapat menempel dengan baik di kaca. Cuci preparat dengan air, kemudian masukkan kedalam hematoksilin-eosin. Selanjutnya, preparat dikeringkan pada suhu kamar dan ditutup dengan obyek glass.
Diagnosis gambaran histologis testis dan ovarium dilakukan oleh pihak Laboratorium Patologi Klinik Fakultas Kedokteran Hewan, Universitas Gadjah Mada, Yogyakarta.
F. Analisis dan Evaluasi Hasil 1. Pemeriksaan histologis organ
negatif. Data ini digunakan untuk melihat hubungan antara dosis dan spektrum efek toksik.
2. Uji reversibilitas
Data uji reversibilitas dianalisis secara kualitatif berdasarkan perubahan morfologi yang terjadi pada kelompok tikus yang diberhentikan dari pemberian infusa daun sirsak dibandingkan dengan kelompok tanpa berhenti. 3. Penimbangan berat badan hewan uji
Data penimbangan berat badan hewan uji dihitung purata perubahan berat badan tiap kelompok hewan uji pada hari ke-0, 7, 14, 21, dan 28. Data perubahan berat badan hewan uji antar minggu dan kelompok perlakuan dianalisis secara statistik dengan analisis General Linier Model (dengan metode Multivariate).
4. Pengukuran asupan pakan dan minum hewan uji
35 BAB IV
HASIL DAN PEMBAHASAN
Penelitian ini bertujuan untuk mengungkapkan spektrum efek toksik infusa daun sirsak terhadap testis dan ovarium tikus dilihat dari gambaran histologis testis dan ovarium. Selain itu juga untuk mengungkapkan hubungan kekerabatan antara dosis infusa daun sirsak yang diberikan dengan spektrum efek toksik yang terjadi, apakah dengan dosis yang semakin meningkat, efek toksik yang ditimbulkan juga akan semakin meningkat, atau semakin meningkatnya dosis tidak mempengaruhi derajat efek toksik yang timbul. Serta untuk mengevaluasi reversibilitas spektrum efek toksik yang terjadi. Tolok ukur yang dipakai adalah tolok ukur kualitatif berdasarkan analisis histologis testis dan ovarium tikus.
Diagnosis gambaran histologis organ dilakukan berdasarkan derajat kerusakan sel testis dan ovarium pada masing-masing kelompok. Data uji reversibilitas di analisis secara kualitatif berdasarkan perubahan morfologi yang terjadi pada kelompok tikus yang diberhentikan dari pemberian infusa daun sirsak dibandingkan dengan kelompok tanpa berhenti.
A. Hasil Determinasi Tanaman Sirsak
Determinasi tanaman yang akan digunakan dalam penelitian memegang peranan penting untuk identifikasi tanaman. Tanaman sirsak (Annona muricata L.) yang digunakan dalam penelitian ini diperiksa melalui determinasi dengan cara mencocokkan ciri-cirinya dengan buku acuan Flora untuk Sekolah di Indonesia (Steenis, 1975). Hasil determinasi tanaman sirsak sampai spesies adalah sebagai berikut:
1b-2b-3b-4b-6b-7b-9b-10b-11b-12b-13b-14a-15a-109b-119b-120b-128b-129b-
135b-136b-139b-140b-142b-143b-146b-154b-155b-156b-162b-163a-164b-165b-166a………..….…50.Annonaceae
1b………..……….…….2.Annona
1a………..………..Annona muricata L.
Hasil determinasi menunjukkan bahwa daun sirsak yang digunakan dalam penelitian ini adalah benar daun sirsak yang berasal dari tanaman sirsak dengan nama ilmiah (Annona muricata L.).
B. Pembuatan Serbuk dan Penetapan Kadar Air
sejumlah daun sirsak basah yang telah mengalami pengolahan. Dari proses pembuatan serbuk, sejumlah 184,0 g daun sirsak segar yang mengalami proses pengeringan dan pengayakan menghasilkan 41,4 g serbuk kering. Rendemen yang diperoleh adalah 22,5%.
Penetapan kadar air bertujuan untuk mengetahui banyaknya air yang terkandung dalam serbuk yang digunakan dalam pembuatan infusa. Menurut Keputusan Menteri Kesehatan Republik Indonesia (1994), kadar air yang diperbolehkan dalam suatu serbuk adalah tidak lebih dari 10%. Penetapan kadar air ini penting untuk dilakukan karena air merupakan habitat yang disukai mikroorganisme untuk dapat berkembangbiak dan melangsungkan hidupnya. Jadi jika kadar air dalam serbuk lebih dari 10%, hal ini memungkinkan mikroorganisme untuk tinggal di dalamnya dan mencemari serbuk tersebut sehingga tidak layak digunakan sebagai bahan uji percobaan.
C. Gambaran Histologis Testis Akibat Pemberian Infusa Daun Sirsak Pemeriksaan histologis digunakan untuk mengevaluasi adanya perubahan struktural dari testis sebagai wujud efek toksik bahan uji. Semua data histologis organ testis kelompok perlakuan dibandingkan dengan kelompok kontrol untuk mengetahui spektrum efek toksik yang terjadi. Jika terdapat perbedaan gambaran histologis antara kelompok perlakuan dan kelompok kontrol, dapat diduga testis mengalami kerusakan.
Dari data yang diperoleh mengenai gambaran histologis pada tabel I, semua kelompok baik kelompok kontrol maupun kelompok perlakuan menunjukkan tidak ada perubahan spesifik, bahwa ukuran, bentuk, dan struktur sel serta jaringan penyusun organ yaitu tubulus seminiferus dan spermatogenesis dalam batas normal.
Tabel I. Hasil pemeriksaan histologis testis tikus kelompok kontrol dan kelompok perlakuan infusa daun sirsak selama 30 hari
Kelompok
Jumlah hewan uji
(ekor)
Gambaran histologis
I 3 Tubulus seminiferus dan spermatogenesis
dalam batas normal
II 3 Tubulus seminiferus dan spermatogenesis dalam batas normal
III 3 Tubulus seminiferus dan spermatogenesis dalam batas normal
IV 3 Tubulus seminiferus dan spermatogenesis dalam batas normal
V 3 Tubulus seminiferus dan spermatogenesis
dalam batas normal
Keterangan: I = kelompok dosis 108 mg/kg BB infusa daun sirsak II = kelompok dosis 180 mg/kg BB infusa daun sirsak III= kelompok dosis 301 mg/kg BB infusa daun sirsak IV= kelompok dosis 503 mg/kg BB infusa daun sirsak