1
1.1.Latar Belakang
Karsinoma payudara merupakan keganasan yang paling sering terjadi pada perempuan. Diperkirakan jutaan perempuan di seluruh dunia terkena karsinoma payudara tiap tahunnya. Karsinoma ini merupakan salah satu masalah kesehatan yang penting dan menjadi penyebab kematian terbanyak pada perempuan. Angka kematian dapat diturunkan apabila deteksi dini, diagnosis, dan penatalaksanaan karsinoma ini dilakukan secara tepat dan cepat.
Karsinoma payudara merupakan karsinoma terbanyak kedua di dunia, dengan perkiraan 1,67 juta kasus karsinoma baru yang didiagnosis pada tahun (Globocan, 2012). Angka kejadian pada negara berkembang mencapai 6%, di mana angka kejadiannya mencapai dua kali lipat pada daerah lain (Muhammad et al., 2012).
Sekitar 100.000 kasus baru terdiagnosis dan sekitar 30.000 pasien meninggal akibat karsinoma ini di Amerika Serikat setiap tahunnya. Sedangkan di Inggris sekitar 26.000 kasus baru dan 15.000 kematian terjadi setiap tahunnya (Tanwani and Majeed, 2009).
Di Indonesia berdasarkan data dari Badan Registrasi Kanker Ikatan Dokter Ahli Patologi Indonesia (IAPI) pada tahun 2011, karsinoma payudara di Indonesia mengalami peningkatan menjadi 28,99%. Sementara itu di Bali pada tahun 2011 merupakan kejadian karsinoma peringkat pertama sebesar 23,33% dari
keseluruhan karsinoma primer pada wanita, di mana terjadi peningkatan dibandingkan tahun 2006 sebesar 21,45% (DitYanMed, 2006, 2011).
Karsinoma payudara di dunia lebih sering terjadi pada wanita dengan usia yang lebih tua dengan puncak insiden pada usia 75-80 tahun. Karsinoma payudara sangat jarang terjadi sebelum usia 25 tahun (Lester, 2015). Di Indonesia dan Bali, sebagian besar kasus karsinoma payudara terdiagnosis pada rentang usia 35-44 tahun (DitYanMed, 2006, 2011).
Perjalanan akhir dari karsinoma payudara ini tergantung dari gambaran biologis karsinoma yaitu tipe histologis atau molekular serta perluasan dan penyebaran karsinoma tersebut. Faktor prognosis dari karsinoma ini dibagi menjadi dua kelompok yaitu faktor prognosis yang berhubungan dengan perluasan karsinoma (stadium) dan yang berhubungan dengan biologis karsinoma. Faktor prognosis yang berhubungan dengan perluasan karsinoma adalah adanya ukuran tumor, invasi limfovaskular, metastasis kelenjar getah bening, dan metastasis jauh.
Tipe histologis khusus, derajat histologis, tingkat proliferasi, reseptor estrogen, reseptor progesteron, reseptor HER-2, dan subtipe molekular merupakan faktor prognosis yang berhubungan dengan biologis karsinoma (Lester, 2015).
Derajat histologis pada karsinoma invasif tipe tidak spesifik dinilai berdasarkan penggabungan skor penilaian tiga karakteristik yaitu formasi tubular (kelenjar), pleomorfia inti sel, dan hitung mitosis per 10 lapang pandang besar.
Penilaian derajat histologis ini mengacu pada Nottingham Grading System atau disebut juga Nottingham Combined Histologic Grade/Patey & Scarff and Bloom
& Richardson modified by Elston & Ellis (Colditz dan Chia, 2012).
Pada dekade terakhir, penelitian tentang tumor microenvironment (TME) berkembang dengan pesat dan mulai turut dipertimbangkan sebagai salah satu faktor prognosis (Scully et al., 2012). Tumor microenvironment terdiri dari sel stromal, sel sistem imun dan inflamasi, faktor pertumbuhan, pembuluh darah dan limfe, serta matriks ekstraseluler (ECM). Pada keadaan normal jaringan stroma memiliki kemampuan sebagai pertahanan terhadap keganasan melalui mekanisme supresi respon imun dan menekan proses karsinogenesis. Akan tetapi sel karsinoma dapat merubah dan memodulasi lingkungan mikro di sekitar tumor untuk mendukung pertumbuhan dan sifat progresivitas tumor (Li et al., 2007;
Rohan et al., 2014). Sel-sel epitelial dapat juga berkonversi menjadi sel-sel mesenkimal melalui proses yang dikenal sebagai epithelial-mesenchymal transition (EMT). Hal ini akan meningkatkan kapasitas migrasinya (Lee and Nelson, 2012).
Perubahan karakteristik morfologi sel pada EMT berhubungan dengan beberapa perubahan ekspresi molekul. Molekul ini sering digunakan sebagai penanda untuk mendeteksi EMT. Salah satunya adalah peningkatan ekspresi protein matrix metalloproteinases yaitu MMP-2, MMP-3, dan MMP-9 (Lee dan Nelson, 2012).
Matriks metalloproteinase merupakan suatu kelompok endopeptidase yang tergantung pada zinc dan terlibat dalam degradasi matriks ekstraselular baik pada proses fisiologis maupun patologis. Pada keadaan fisiologis MMP ini membantu proses morfogenesis, angiogenesis, dan perbaikan jaringan. Sementara pada
proses patologis, MMP terlibat pada terjadinya sirosis, artritis, dan kanker (Farina and Mackay, 2014).
MMP-9 atau gelatinase B lebih banyak mendapat perhatian oleh karena aktivitas dan regulasinya lebih kompleks dibandingkan semua kelompok MMP yang lain (Loffek et al., 2011).
Pada karsinoma payudara invasif tipe tidak spesifik MMP-9 mengalami regulasi melalui interaksi antara sel tumor dengan lingkungan mikro di sekitarnya, yaitu sel stroma, sel endotel, dan sel radang. Sudah sangat diakui peranan sel radang seperti makrofag, neutrofil, sel mast sel dendritik, dan sel T pada inisiasi dan progresi tumor. Sel tumor ini mampu menghasilkan faktor-faktor pro- inflamasi dan MMP berperan pada progresivitas tumor (Deryugina dan Quigley, 2006).
Matriks metalloproteinase-9 pada karsinoma payudara invasif tipe tidak spesifik terlibat pada semua tahap progresivitas sel kanker mulai dari proliferasi, angiogenesis, apoptosis, epithelial-mesenchymal transition (EMT), dan metastasis. Proses metastasis dimudahkan oleh kemampuan sel tumor untuk berubah dari bentuk sel epitel yang tidak mampu bergerak menjadi sel mesenkimal yang mampu bergerak (Farina dan Mackay, 2014). MMP-9 ini dikatakan berpartisipasi dalam invasi tumor dan metastasis dengan menurunkan matriks ekstraselular pada karsinoma payudara invasif tipe tidak spesifik (Mahmood et al., 2015) (Benson et al., 2013).
Beberapa penelitian yang menghubungkan ekspresi MMP-9 dengan derajat histologis pada karsinoma payudara sudah pernah dilakukan. Pada penelitian yang
dilakukan oleh Irianiwati et al. terhadap 50 kasus karsinoma payudara, dilakukan pulasan MMP-9 untuk menilai perburukan derajat histologisnya. Hasil penelitian menunjukkan bahwa ekspresi MMP-9 berbeda bermakna pada derajat tinggi dibandingkan derajat rendah (Irianiwati et al, 2012).
Penelitian oleh Yousef et al. ekspresi tinggi MMP-9 ditemukan pada karsinoma payudara dengan derajat keganasan yang tinggi. Sedangkan pada jaringan payudara normal tidak ditemukan adanya ekspresi dari MMP-9 (Yousef et al., 2014).
Penelitian oleh Mahmood dan kawan-kawan di Irak menghubungkan antara ekspresi MMP-2 dan MMP-9 dengan berbagai variabel klinikopatologis pada karsinoma payudara stadium II dan III. Didapatkan korelasi yang signifikan antara ekspresi MMP-9 dengan beberapa variabel klinikopatologis, yaitu: stadium tumor, derajat histologis, tipe histologis, dan status metastasis limfonodi (Mahmood et al., 2015).
Vasaturo et al. di Italia melakukan penelitian ekspresi MMP-2 dan MMP-9 pada pasien karsinoma payudara. Dengan hasil penelitian menunjukkan tampak perbedaan yang bermakna pada pasien-pasien karsinoma payudara bila ditinjau dari sudut pandang variabel derajat histologis (Vasaturo et al., 2012).
Penelitian yang dilakukan oleh Benson et al. di India terhadap 39 sampel kanker payudara dan 16 jaringan payudara yang normal, menunjukkan adanya peningkatan MMP-9 secara berbeda pada jaringan kanker payudara (Benson et al., 2013).
Di Finlandia ekspresi MMP-2 dan MMP-9 dianalisis oleh Pellikainen et al.
secara imunohistokimia dalam prospektif seri besar dari 421 pasien kanker payudara. MMP-9 terekspresi dalam sitoplasma sel-sel ganas dan stroma. Ekspresi tinggi MMP-9 dalam sel karsinoma terkait stadium tumor, sedangkan ekspresi positif pada stroma dikaitkan dengan faktor-faktor agresif. Evaluasi ekspresi MMP-9 juga memberikan informasi tentang prognosis kanker payudara (Pellikainen et al., 2014).
Hasil kontradiktif didapatkan oleh Wu dan kawan-kawan melalui penelitiannya di Cina berusaha mencari signifikansi antara ekspresi MMP-9 dengan berbagai variabel klinikopatologis. Hasil penelitian menunjukkan bahwa tidak ada korelasi yang signifikan antara ekspresi MMP-9 dengan semua variabel penelitian yang dievaluasi termasuk derajat histologis (Wu et al., 2014).
Meskipun penelitian yang menghubungkan ekspresi MMP-9 dengan derajat histologis pada karsinoma payudara sudah pernah dilakukan akan tetapi masih terdapat hasil yang kontradiktif. Di samping itu, penelitian yang menunjukkan adanya pengaruh antara ekspresi MMP-9 dengan karakteristik derajat histologis pada karsinoma payudara invasif tipe tidak spesifik sampai saat ini belum pernah dilakukan di Bali, sehingga sangat menarik untuk dilakukan penelitian tersebut agar dapat memahami keterlibatan MMP-9 pada progresivitas karsinoma tersebut.
Pada penelitian ini dilakukan pulasan imunohistokimia MMP-9 untuk melihat apakah ada hubungan antara ekspresi MMP-9 dengan derajat histologis pada karsinoma payudara invasif tipe tidak spesifik.
1.2.Rumusan Masalah
Berdasarkan latar belakang tersebut di atas yaitu masih ditemukannya ketidaksesuaian pendapat di antara para peneliti mengenai hubungan antara ekspresi MMP-9 dengan derajat histologis pada karsinoma payudara invasif tipe tidak spesifik, maka rumusan masalah pada penelitian ini adalah :
1. Apakah terdapat hubungan antara ekspresi MMP-9 dengan derajat histologis pada karsinoma payudara invasif tipe tidak spesifik?
2. Apakah ekspresi MMP-9 mempengaruhi faktor karakteristik derajat histologis yang paling dominan pada karsinoma payudara invasif tipe tidak spesifik?
1.3.Tujuan Penelitian
Berdasarkan latar belakang dan rumusan masalah di atas maka tujuan penelitian adalah sebagai berikut:
1. Membuktikan adanya hubungan antara ekspresi MMP-9 dengan derajat histologis pada karsinoma payudara invasif tipe tidak spesifik.
2. Membuktikan bahwa ekspresi MMP-9 mempengaruhi faktor karakteristik derajat histologis yang paling dominan.
1.4.Manfaat Penelitian 1.4.1.Manfaat Akademik
1. Memberikan informasi data molekular tentang ekspresi MMP-9 yang dihubungkan dengan derajat histologis karsinoma payudara invasif tipe tidak spesifik.
2. Memberikan tambahan pengetahuan mengenai ekspresi MMP-9 yang dapat mempengaruhi faktor karakteristik derajat histologis yang paling dominan, serta pengetahuan yang mendukung MMP-9 dan derajat histologis sebagai faktor prognostik dalam diagnosis karsinoma payudara invasif tipe tidak spesifik.
1.4.2.Manfaat Praktis
Memberikan informasi tambahan kepada klinisi bahwa ekspresi MMP-9 yang tinggi berkaitan dengan derajat histologis yang lebih tinggi pula dan memiliki prognosis yang lebih buruk, sehingga penanganan karsinoma payudara invasif tipe tidak spesifik dapat dilakukan lebih baik.
9
2.1 Karsinoma Payudara
2.1.1 Klasifikasi Karsinoma Payudara
Karsinoma payudara merupakan kelompok lesi yang heterogen. Pada tahap pertumbuhannya dibagi menjadi karsinoma in situ dan karsinoma invasif.
Karsinoma duktal dan lobular merupakan tumor yang paling sering didapat meliputi 70-80% dari keseluruhan karsinoma invasif pada payudara (Ellis et al., 2012). Karsinoma insitu merupakan proliferasi sel-sel neoplastik yang belum menembus membran basal duktus maupun lobulus, sedangkan apabila sel-sel neoplastik tersebut telah menembus membran basal dan menginfiltrasi stroma disebut sebagai karsinoma invasif. Sel-sel tersebut kemudian mampu menginvasi pembuluh limfe maupun pembuluh darah sehingga dapat menyebabkan metastasis pada kelenjar getah bening maupun dapat bermetastasis jauh (Lester, 2010).
Berikut ini adalah klasifikasi karsinoma payudara invasif menurut klasifikasi World Health Organization (WHO) (Ellis et al., 2012):
1. Invasive carcinoma of no special type (NST) 2. Invasive lobular carcinoma
3. Tubular carcinoma 4. Cribriform carcinoma 5. Mucinous carcinoma
6. Carcinoma with medullary features
10
10. Adenoid cystic carcinoma 11. Mucoepidermoid carcinoma 12. Polymorphous carcinoma
13. Carcinoma with signet-ring cell differentiation 14. Carcinoma with neuroendocrine features 15. Invasive papillary carcinoma
16. Invasive micropapillary carcinoma 17. Inflammatory carcinoma
Karsinoma payudara invasif tipe tidak spesifik yang sebelumnya disebut juga karsinoma duktal invasif tipe tidak spesifik adalah keganasan yang terjadi pada sel-sel epitel duktuli payudara, terutama sel-sel dari terminal duct lobular unit (TDLU) yang ditandai adanya invasi ke stroma jaringan dan tumor ini tidak membentuk suatu pola tipe histologis tertentu (Ellis et al., 2012).
Diklasifikasikan sebagai karsinoma invasif tipe tidak spesifik apabila komponen gambaran tidak spesifiknya lebih dari 50% massa tumor dengan pemeriksaan dari potongan yang representatif. Jika gambaran tidak spesifik kurang dari 50% atau sekitar 10% - 49% dari massa tumor dan sisanya adalah tipe spesifik maka disebut kelompok campuran yaitu campuran karsinoma invasif tipe tidak spesifik dan tipe spesifik (Ellis et al., 2012).
2.1.2 Epidemiologi Karsinoma Payudara
Karsinoma payudara merupakan karsinoma terbanyak kedua di dunia, dengan perkiraan 1,67 juta kasus karsinoma baru yang didiagnosis pada tahun 2012 (25%
dari semua jenis karsinoma) (Globocan, 2012). Di mana merupakan keganasan yang paling sering dan penyebab kematian terbanyak pada wanita baik di negara maju maupun negara berkembang. Angka kejadian pada negara berkembang mencapai 6%, di mana angka kejadiannya mencapai dua kali lipat pada daerah lain (Muhammad et al., 2012). Setiap tahun di Amerika Serikat sekitar 100.000 kasus baru terdiagnosis dan sekitar 30.000 pasien meninggal akibat karsinoma ini.
Sedangkan di Inggris sekitar 26.000 kasus baru dan 15.000 kematian terjadi setiap tahunnya (Tanwani and Majeed, 2009).
Di Indonesia berdasarkan data dari Badan Registrasi Kanker Ikatan Dokter Ahli Patologi Indonesia (IAPI) pada tahun 2006 karsinoma payudara menempati peringkat kedua dari seluruh kasus karsinoma sebesar 22,8%. Karsinoma payudara merupakan karsinoma ke-2 tersering pada wanita setelah karsinoma leher rahim. Pada tahun 2011, karsinoma payudara di Indonesia mengalami peningkatan menjadi 28,99%. Sementara itu di Bali pada tahun 2006, karsinoma payudara merupakan karsinoma kedua yaitu sebesar 21,45%. Pada tahun 2011 kejadian karsinoma payudara di Bali menempati peringkat pertama sebesar 23,33% dari keseluruhan karsinoma primer pada wanita (DitYanMed, 2006, 2011).
Karsinoma payudara lebih sering terjadi pada wanita dengan usia yang lebih tua dengan puncak insiden pada usia 75-80 tahun. Usia rata-rata saat diagnosis
adalah 61 tahun pada wanita kulit putih, 56 tahun pada Hispanik, dan 46 tahun pada wanita Afrika-Amerika. Karsinoma payudara sangat jarang terjadi sebelum usia 25 tahun (Lester et al., 2015). Di Indonesia dan Bali, sebagian besar kasus karsinoma payudara terdiagnosis pada rentang usia 35-44 tahun (DitYanMed, 2006; DitYanMed, 2011).
2.1.3 Derajat Histologis Karsinoma Payudara
Diagnosis pada karsinoma payudara berdasarkan tipe histologis saja tidak cukup untuk menentukan terapi akhir. Oleh karena itu, dibuatlah sistem derajat histologis, oleh karena baik dalam menentukan diagnostik dan terapeutik.
Karsinoma payudara dengan derajat histologis baik umumnya memiliki prognosis yang baik, sedangkan tumor-tumor derajat histologis buruk akan berkembang cepat dan memiliki prognosis yang kurang baik.
Derajat histologis karsinoma payudara ini dinilai berdasarkan sistem Nottingham Combined Histologic Grade (Elston-Ellis Modification of Scarff- Bloom-Richardson Grading System) atau biasa disebut dengan Nottingham Grading System. Sistem ini menilai karsinoma payudara berdasarkan tiga karakteristik tumor yaitu formasi tubular (kelenjar), pleomorfisme inti sel, dan hitung mitosis. Sistem ini menggunakan skor 1 sampai skor 3 yang dinilai secara individual pada tiap faktor (Tabel 2.1) (Ellis et al., 2012).
Formasi tubular dinilai dari jumlah persentase struktur gambaran glanduler atau kelenjar yang jelas menunjukkan adanya lumen di tengahnya. (Ellis et al., 2012). Seluruh bagian tumor ditinjau dengan lapangan pandang kecil. Ambang
batas yang dipakai adalah 10% dan 75%. Skor 1 apabila mayoritas tumor memiliki struktur tubular dan kelenjar sebanyak > 75%, skor 2 bila tumor mengandung struktur tubular dan kelenjar sebanyak 10-75%, sedangkan skor 3 bila tumor mengandung struktur tubular sebanyak < 10% disajikan dalam gambar 2.1 (Anonim, 2005; Hoda et al., 2014).
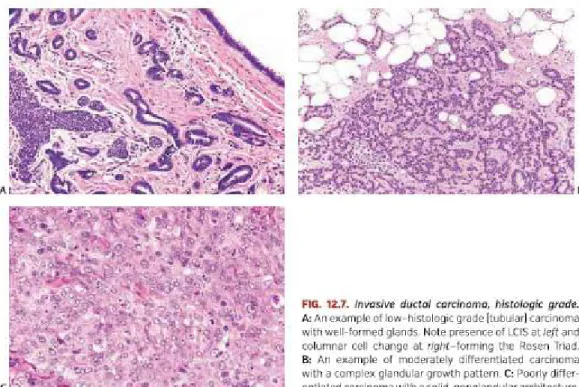
Gambar 2.1 Gambaran derajat histologis dari karsinoma payudara invasif. A.
Derajat histologis rendah dengan bentukan kelenjar yang terbentuk dengan baik.
B. Derajat histologis sedang dengan pola pertumbuhan kelenjar yang kompleks.
C.Derajat histologis buruk dengan pola pertumbuhan solid, arsitektur nonglanduler. (Hoda et al., 2014).
Pleomorfisme inti sel dinilai dari regularitas ukuran inti dan bentuk sel epitel, dimana peningkatan iregularitas membran inti dan rasio inti/sitoplasma menjadi tanda bertambahnya skor pleomorfisme inti sel (Ellis et al., 2012). Dimulai dari nilai skor 1 sampai 3. Skor 1 bila inti hampir serupa ukurannya (<1,5 kali dari sel-
sel epitelial payudara normal), batasnya regular, kromatin inti uniform, beberapa kasar, sedikit variasi bentuk dan ukurannya (pleomorfia inti yang minimal), dan anak inti tidak tampak jelas. Dikatakan skor 2 apabila sel lebih besar daripada sel normal, inti membesar (1,5-2 kali ukuran inti sel-sel epitelial normal) terdapat variasi yang sedang dalam ukuran dan bentuknya (pleomorfia inti ringan sampai sedang), inti open vesikular, dan anak inti terlihat namun kecil dan tidak nyata.
Dan skor 3 bila inti semakin membesar (>2 kali ukuran inti sel epitel normal), ukuran dan bentuknya sangat bervariasi (pleomorfia inti berat), biasanya dengan bentuk bizarre dan sangat besar, kromatin inti vesikular, sering dengan anak inti yang sangat jelas terlihat disajikan dalam gambar 2.2 (Anonim, 2005; Hoda et al., 2014).
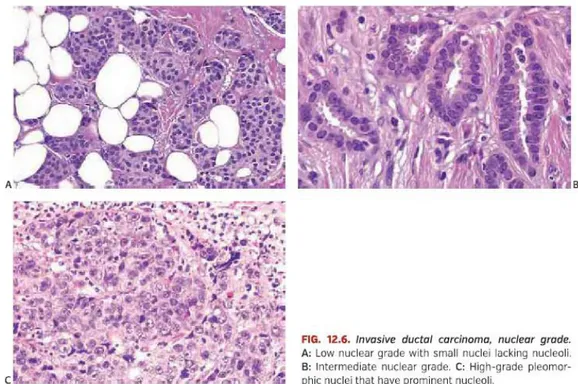
Gambar 2.2 Gambaran inti dari karsinoma payudara invasif. A. Derajat rendah dengan inti kecil. B. Derajat sedang. C. Derajat tinggi dengan pleomorfik inti
yang memiliki nukleolus yang prominen. (Hoda et al., 2014).
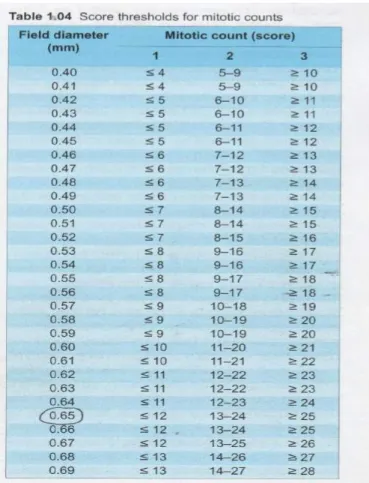
Hitung mitosis dilakukan dimulai dari bagian tepi tumor dan bila terdapat heterogenesitas maka daerah yang dihitung adalah yang paling banyak mengandung mitosis (Ellis et al., 2012). Penghitungan mitosis dinilai dengan menghitung jumlah mitosis per 10 lapang pandang besar mikroskop atau High Power Field (HPF) dengan pembesaran 400x. Cut-off point untuk skor mitosis tergantung dari besarnya area lapang pandang objektif masing-masing mikroskop, sehingga perlu mengkalibrasi mikroskop dengan ukuran diameter dari lapang pandang besar (objektif 40x) disajikan dalam gambar 2.3 (Colditz and Chia, 2012).
Gambar 2.3 Hitung skor mitosis berdasarkan luas lapang pandang besar mikroskop (Colditz and Chia, 2012).
Skor dari ketiga penilaian tersebut dijumlahkan menghasilkan total skor dengan rentang 3-9, kemudian dikatakan derajat histologis 1 atau baik bila skor yang didapat adalah 3-5, derajat histologis 2 atau sedang bila total skor yang didapat adalah 6-7 sedangkan derajat histologis 3 atau buruk bila total skor yang didapat 8-9 (disajikan dalam tabel 2.1 dan gambar 2.4) (Lester et al., 2015;
Colditz and Chia, 2012; Hoda et al., 2014).
Tabel 2.1 Metode semi-kuantitatif penilaian derajat histologis karsinoma payudara invasif (Ellis et al., 2012).
Gambaran Skor
Bentukan tubular dan kelenjar Pada mayoritas tumor (> 75%) Derajat sedang (10-75%) Sedikit atau tidak ada (<10%)
1 2 3 Pleomorfia inti
Sel-sel uniform, kecil, pleomorfia inti ringan
Peningkatan sedang dalam bentuk dan ukuran (pleomorfia sedang)
Bentuk sangat bervariasi (pleomorfia berat)
1 2 3
Hitung mitosis
Tergantung dari luas lapang pandang besar mikroskop Lihat nilai pada gambar 2.3 Derajat akhir
Dijumlah semua skor dari bentukan kelenjar, pleomorfia inti sel, dan hitung mitosis per 10 lapang pandang besar
Derajat histologis I : total skor 3 – 5 Derajat histologis II : total skor 6 – 7 Derajat histologis III : total skor 8 – 9
Gambar 2.4 Derajat histologis karsinoma payudara invasif Modified Bloom- Richardson Histologic Grading (Hoda et al., 2014).
Gambar 2.5 Gambaran karsinoma payudara invasif tipe tidak spesifik derajat histologis I, II, dan III (Lester, 2010)
2.1.4 Stadium Karsinoma Payudara
Sistem stadium karsinoma payudara yang dipergunakan adalah sistem TNM dari American Joint Committee on Cancer (AJCC) berdasarkan evaluasi terhadap tumor (T), keterlibatan kelenjar getah bening (N), dan metastasis jauh (M) (Ellis et al.,2012). Kategori T, N, dan M dikombinasikan untuk membuat 5 stadium yaitu stadium 0, I, II, III, dan IV yang memberikan informasi tentang keadaan penyakit ( ukuran tumor, invasi kulit atau dinding dada, dan keterlibatan kelenjar getah bening) serta metastasis jauh. Gambaran ini digunakan untuk mengklasifikasikan penderita karsinoma payudara kedalam kelompok prognosis demi kepentingan pengobatan, konseling, dan uji klinis (Ellis et al.,2012; Moelans and Diest, 2012).
Stadium karsinoma payudara berdasarkan AJCC yaitu :
Stadium 0 : Ductal carcinoma in situ (DCIS) atau Lobular carcinoma in situ (LCIS); harapan hidup 5 tahun adalah 93%.
Stadium I : Karsinoma invasif dengan ukuran 2 cm atau kurang tanpa terkenanya kelenjar getah bening dan tanpa metastasis jauh;
harapan hidup 5 tahun adalah 88%.
Stadium II : Karsinoma invasif dengan ukuran 5 cm atau kurang disertai metastasis ke kelenjar getah bening aksila yang tidak terfiksasi dan tanpa metastasis jauh atau karsinoma invasif dengan ukuran lebih dari 5 cm tanpa metastasis ke kelenjar getah bening atau tanpa metastasis jauh; harapan hidup 5 tahun adalah 74-81%.
Stadium III : Karsinoma invasif dengan ukuran lebih dari 5 cm dengan metastasis ke kelenjar getah bening atau karsinoma invasif ukuran berapapun dengan metastasis ke kelenjar getah bening yang terfiksir; atau karsinoma yang menginvasi dinding dada, kulit, edema, serta beradang, jika tidak ditemukan metastasis jauh;
harapan hidup 5 tahun adalah 41-67%.
Stadium IV : Karsinoma invasif ukuran berapapun dengan metastasis ke tempat jauh (termasuk kelenjar getah bening supraklavikula ipsilateral);
harapan hidup 5 tahun adalah 15% (Moelans and Diest, 2013).
2.1.5 Karsinogenesis
Penyebab karsinoma payudara berhubungan erat dengan faktor genetik dan pengaruh hormonal (Lester et al., 2015). Pada literatur lain dikatakan faktor diet, faktor hormonal dan reproduksi, serta faktor terpapar radiasi juga ikut berpengaruh (Colditz and Chia, 2012). Sebagian besar perubahan genetik berperan dalam pertumbuhan karsinoma payudara di mana riwayat keluarga dengan karsinoma payudara akan lebih berisiko. Faktor hormonal dan reproduksi yang mempengaruhi antara lain meliputi usia pertama kali menstruasi, nulliparitas, usia saat kelahiran anak pertama, tidak menyusui, usia menopause, dan penggunaan kontrasepsi oral. Sedangkan faktor diet berupa peningkatan berat badan pada wanita postmenopause, westernized diet, kurangnya olahraga, kurangnya asupan buah dan sayuran, merokok serta alkohol (Colditz and Chia, 2012).
Adanya mutasi gen BRCA 1 pada kromosom 17q21.3 dan mutasi gen BRCA 2 pada kromosom 13q12-13 pada beberapa kasus menunjukkan bahwa mutasi ini sangat berpengaruh. Kedua gen ini berperan dalam repair DNA sebagai gen supresor karena inaktif atau defek keduanya germ line mutation dan somatic mutation. Mutasi yang mempengaruhi proto-onkogen dan gen penekan tumor di epitel payudara ikut serta dalam proses transformasi onkogenik. Di antara berbagai mutasi tersebut ekspresi berlebihan proto-onkogen ERBB2 atau HER- 2/neu mengalami amplifikasi pada 30% kanker payudara. Ketidakseimbangan hormon sangat berperan terhadap pertumbuhan karsinoma payudara. Banyak faktor risiko yang telah disebutkan nuliparitas, usia subur yang lama, usia lanjut saat memiliki anak pertama menunjukkan peranan kadar estrogen terhadap risiko karsinoma payudara. Reseptor estrogen dan progesteron secara normal terdapat di epitel payudara berinteraksi dengan promotor pertumbuhan yang dikeluarkan oleh sel kanker payudara untuk menciptakan mekanisme autokrin perkembangan tumor (Lester et al., 2015).
Beberapa gen yang terlibat dalam karsinogenesis payudara adalah gen penekan tumor yaitu BRCA1, BRCA2, dan gen P53 serta onkogen yang terdiri dari gen HER2, gen apoptosis, gen reseptor steroid (Estrogen Receptor dan Progesteron Receptor), gen adhesi sel dan invasif, serta gen angiogenesis.
Apoptosis diperlukan untuk menghancurkan sel-sel dengan kerusakan DNA atau sel-sel yang telah menjadi sel kanker. Beberapa onkogen seperti Bax dan Bcl2, c- myc dan P53 terlibat dalam pengaturan sinyal proapoptosis dan anti apoptosis yang dikontrol oleh beberapa gen. Bcl2 mengatur pelepasan protein mitokondria
seperti sitokrom. Sitokrom c berikatan dengan faktor lainnya untuk membentuk kompleks aktivasi disebut apoptosom. Apoptosom yang aktif akan mengaktifkan caspase yang akhirnya akan menyebabkan apoptosis. Hormon-hormon steroid juga dikenal dapat menyebabkan up-regulation atau down-regulation apoptosis dengan jalan mengontrol kematian sel yang dimediasi P53 (Boder, 2013).
Perubahan genetik dan epigenetik yang diperlukan untuk karsinogenesis menimbulkan perubahan morfologi yang dikenali sebagai lesi payudara, yang berhubungan dengan meningkatnya risiko perkembangan kanker. Perubahan awal tersebut adalah perubahan proliferatif, yang berasal dari hilangnya sinyal menghambat pertumbuhan, menyimpangan kenaikan sinyal pro-pertumbuhan, atau penurunan apoptosis. Selama perkembangan tumor, klonal ganas menjadi abadi dan memperoleh kemampuan pembentukan neo-angiogenesis. Gambaran morfologi dan biologis karsinoma biasanya terbentuk pada tahap insitu, karena di sebagian besar kasus lesi insitu mirip karsinoma invasif yang menyertai. Langkah akhir dari karsinogenesis adalah perubahan lesi insitu menjadi karsinoma invasif (Lester et al., 2015).
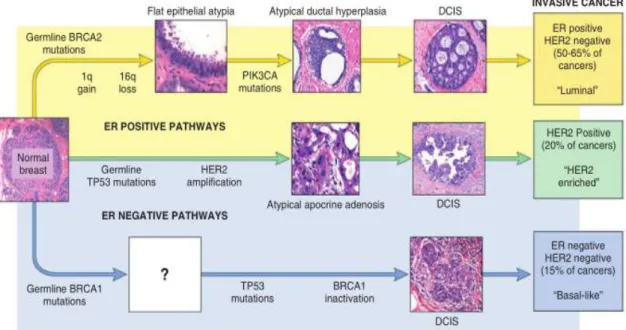
Berdasarkan jalur molekular terdapat tiga jalur utama dalam perkembangan kanker payudara (Gambar 2.6). Jalur yang terbanyak adalah terjadinya karsinoma ER positif, HER2 negatif. Terjadi pada penderita dengan mutasi germline BRCA2. Jalur ini berhubungan dengan delesi kromosom 16q dan penambahan kromosom 1q serta aktivasi mutasi PIK3CA. Lesi prekursor yang sering ditemukan adalah flat epithelial atypia dan atypical hyperplasia. Jalur kedua yaitu karsinoma HER2 positif. Ditemukan pada penderita dengan mutasi germline TP53
dan terjadi amplifikasi gen HER2. Lesi prekursor yang ditemukan adalah atypical apocrine adenosis. Jalur yang paling jarang adalah karsinoma ER dan HER2 negatif. Pada karsinoma ini lesi prekursor tidak jelas, kemungkinan karena perkembangan lesi yang sangat cepat menjadi karsinoma. Sering ditemukan pada penderita dengan mutasi germline BRCA1, sedangkan pada tumor sporadic terjadi mutasi pada TP53 (Tamaki et al., 2013; Lester et al., 2015).
Gambar 2.6 Jalur utama perkembangan kanker payudara (Lester, 2015).
2.2 Tumor microenvironment
Solid tumor merupakan “organ like structure” terdiri atas sel tumor dan stromal.
Pada dekade terakhir, penelitian tentang tumor microenvironment (TME) berkembang dengan pesat (Scully et al., 2012). Tumor microenvironment terdiri dari sel stromal, sel sistem imun dan inflamasi, faktor pertumbuhan, jaringan pembuluh darah dan limfe, serta matriks ekstraseluler (ECM). Pada keadaan normal jaringan stroma memiliki kemampuan sebagai pertahanan terhadap
keganasan melalui mekanisme supresi respon imun dan menekan proses karsinogenesis. Akan tetapi sel karsinoma dapat merubah dan memodulasi lingkungan mikro di sekitar tumor untuk mendukung pertumbuhan dan sifat progresivitas tumor melalui sekresi berbagai sitokin, kemokin, dan faktor pertumbuhan serta enzim-enzim proteinase. Stroma akan menjadi reaktif terhadap stimulus dari sel-sel karsinoma (Li et al., 2007; Rohan et al., 2014).
Sel-sel epitelial dapat juga berkonversi menjadi sel-sel mesenkimal melalui proses yang dikenal sebagai epithelial-mesenchymal transition (EMT). EMT dan proses sebaliknya, mesenchymal-epithelial transition (MET), meregulasi stadium awal pertumbuhan dan perkembangan makhluk hidup. Reaktivasi EMT pada masa lanjut dianggap sebagai upaya fisiologis untuk mengontrol inflamasi dan memulihkan jaringan yang rusak. EMT juga terlibat dalam proses patologis seperti fibrosis dan karsinoma. Perkembangan dan patologikal EMT dilambangkan oleh berbagai spektrum perubahan morfologi, ekspresi gen, dan jalur-jalur sinyal (Lee and Nelson, 2012).
2.2.1 Sel Epitelial dan Mesenkimal
Sel-sel epitelial dan mesenkimal dikarakteristikkan oleh keunikan fenotip dan morfologi masing-masing. Gambaran perbedaan antara keduanya disajikan dalam gambar 2.7. Sel epitelium yang tipikal adalah lembaran sel yang dihubungkan dengan kompleks junctional yang spesifik antar selnya, meliputi tight junctions, adherens junctions, desmosomes, dan gap junctions. Lembaran epitelial menunjukkan karakteristik terpolarisasi dengan pola apical-basal dan normalnya
berhubungan erat dengan sel tetangganya, sehingga menghambat potensi pergerakan dan disosiasinya dari lembaran sel (Lee and Nelson, 2012).
Sebaliknya, sel-sel mesenkimal tidak membentuk lembaran sel yang reguler dan tidak memiliki kompleks adesi interseluler spesifik. Sel ini memiliki bentuk yang relatif elongated dibandingkan sel epitelial dan menunjukkan polaritas end- to-end dan adesi fokal. Hal ini meningkatkan kapasitas migrasinya. Sel-sel mesenkimal bermigrasi dengan mudah di dalam jaringan secara individual ataupun bersama-sama membentuk untaian (Lee and Nelson, 2012).
Gambar 2.7
Gambaran umum sel-sel epitelial dan mesenkimal (Lee and Nelson, 2012).
2.2.2 Epithelial-Mesenchymal Transition (EMT)
Epithelial-mesenchymal transition dideskripsikan sebagai perubahan cepat serial pada fenotip seluler. Selama EMT, sel-sel epitelial mengubah struktur perlekatan
sel dan polaritasnya sehingga menjadi terisolir, motil, dan resisten terhadap kematian sel. Istilah EMT sering diaplikasikan pada peristiwa-peristiwa biologis bagaikan sebuah proses yang terlindung, akan tetapi kenyataannya, proses yang berhubungan dengan EMT dapat bervariasi dalam intensitas mulai dari kehilangan polaritas sel yang tersamar sampai pemrograman ulang sel secara total (Klymkowsky and Savagner, 2009).
Epithelial-mesenchymal transition dapat diklasifikasikan dalam tiga subtipe (Gambar 2.8). Tipe 1 EMT melibatkan transisi dari sel epitel primordial ke sel motil mesenkimal dan berhubungan dengan generasi bermacam-macam jenis sel selama perkembangan embrio dan organogenesis. Jenis ini tidak menyebabkan fibrosis atau menginduksi invasi, dan dalam banyak kasus, sel-sel mesenkimal yang dihasilkan kemudian menjalani MET yang selanjutnya menimbulkan epitel sekunder. Tipe 2 EMT melibatkan transisi dari sel epitel sekunder untuk jaringan fibroblas dan berhubungan dengan penyembuhan luka, regenerasi jaringan, dan fibrosis organ (Lee and Nelson, 2012).
Berbeda dengan tipe 1, tipe 2 EMT diinduksi dalam menanggapi peradangan, tetapi berhenti setelah peradangan dilemahkan, terutama selama penyembuhan luka dan regenerasi jaringan. Selama jaringan fibrosis, tipe 2 EMT terus merespon peradangan secara persisten, yang mengakibatkan kerusakan jaringan (Lee and Nelson, 2012).
Tipe 3 EMT terjadi pada sel-sel karsinoma yang telah terbentuk sebagai tumor padat dan berhubungan dengan transisi ke sel-sel tumor metastatik yang memiliki potensi untuk bermigrasi melalui aliran darah, dan dalam beberapa kasus
membentuk tumor sekunder di tempat lain melalui MET. Selama tipe 3 EMT, beberapa sel tetap mempertahankan sifat epitel sementara memperoleh karakteristik mesenkimal dan sel-sel lainnya melepaskan karakteristik epitelnya dan menjadi sepenuhnya mesenkimal (Lee and Nelson, 2012).
Gambar 2.8
Berbagai jenis tipe EMT (Lee and Nelson, 2012).
Konversi epitelial menjadi mesenkimal memerlukan perubahan dalam hal morfologi seluler, adesi, dan kapasitas migrasi. Berbagai marka biologis telah dikemukakan untuk mengenali ketiga subtipe EMT (Tabel 2.2). Spektrum perubahan yang terjadi selama EMT tidak selalu identik dan mungkin ditentukan oleh integasi sinyal-sinyal ekstraseluler (Lee and Nelson, 2012).
Tabel 2.2 Kriteria mayor untuk mendeteksi EMT, termasuk marka-marka yang sudah ditegakkan, fenotip ((Lee and Nelson, 2012).
Marka Fenotip EMT
- Berbentuk spindel, fenotip fibroblast-like - Peningkatan motilitas dan kapasitas migrasi
- Peningkatan resistensi terhadap kematian sel dan apoptosis - Mempertahankan fenotip ini setelah stimuls dihentikan EMT Proteome
Protein yang menurun selama EMT
- E-cadherin, ZO-1, mucin1, cytokeratin, occludin, desmoplakin, collagen IV, laminin 1, MiR-200 family
Protein yang meningkat selama EMT
- Faktor transkripsi: Snail (Snai1/Snail1), Slug (Snai2/Snail2), ZEB1 (TCF8/δEF1), ZEB2 (SIP1), E47 (TCF3), E2-2 (TCF4, Twist1, FOXC2
- Matrix metalloproteinases: MMP2, MMP3, MMP9
- Protein permukaan sel: N-cadherin, OB-cadherin, α5β1 integrin, αVβ6 integrin, DDR2
- Marka cytoskeletal: vimentin, fibronectin, αSMA, FSP1
- Faktor transkripsi yang bertranslokasi dalam inti: β-catenin, NF-ƙB, Smad 2/3
- miRNA: miR 10b, miR-21x - HSP-47
Perubahan Minor
- Filamen intermediate dan mikrofilamen yang banyak
- Hilangnya kondensasi kromatin berhubungan dengan adanya multipel nukleoli
- Granul lisosom yang berlimpah Sinyal-sinyal yang Memicu EMT
- Faktor pertumbuhan dan sitokin: TGFβ, EGF, HGF, FGF - Komponen ECM melalui integrin
- Protein Wnt, Notch - Hipoksia
- ROS
- Stres mekanik
2.3 Matriks Metalloproteinase (MMP)
2.3.1 Struktur, Jenis, dan Fungsi Umum MMP
Matriks metalloproteinase adalah kelompok endopeptidase yang tergantung pada zinc. Protein ini terlibat dalam degradasi matriks ekstraselular, serta berperan penting pada proses fisiologis maupun patologis. Pada keadaan fisiologis MMP membantu proses morfogenesis, angiogenesis, dan perbaikan jaringan. Sementara pada proses patologis, MMP terlibat pada terjadinya sirosis, arthritis dan karsinoma (Yabluchanskiy et al., 2013; Gong et al., 2014). Jerome Gross dan Charles Lapiere adalah orang yang pertama kali menemukan MMP pada metamorfosis ekor kecebong di tahun 1962. Triple helix kolagen didegradasi jika ekor kecebong ditempatkan pada matriks kolagen kecebong yang bermetamorfosis (Loffek et al., 2011; Ansari et al., 2013).
Matriks metalloproteinase mengandung beberapa komponen dengan fungsi yang berbeda-beda berupa :
1) Pro-peptida yang berperan menjaga enzim dalam bentuk tidak aktif.
Domain ini mengandung “Cystein switch” yakni residu cystein unik dan selalu terjaga, yang berinteraksi dengan zinc pada bagian aktif. Saat aktivasi enzim, bagian ini akan dipecah secara proteolitik oleh furin secara intraseluler atau MMP lainnya dan protease serin secara ekstraseluler.
2) Domain katalitik yang menjadi penanda struktural corak pengikat zinc. Ion Zn2+, diikat oleh tiga residu histidin membentuk area aktif. Area aktif ini berjalan secara horizontal melewati molekul sebagai celah dangkal dan berikatan dengan substrat.
3) Bagian penghubung (hinge region) merupakan sebuah jembatan lentur atau bagian penghubung yang terbuat dari 75 rantai asam amino berfungsi untuk menghubungkan domain katalitik dengan domain terminal-C.
Bagian ini sangat penting untuk menjaga stabilitas enzim.
4) Domain terminal-C yang menyerupai hemopexin
(hemopexin like - domain) merupakan domain yang rangkaiannya menyerupai protein serum hemopexin. Rantai polipeptida domain ini tersusun dalam empat lembaran β yang simetris. Permukaan datar yang disediakan oleh struktur ini dipercaya terlibat dalam interaksi antar protein dan merupakan penentu spesifisitas substrat, contohnya: TIMP berinteraksi pada area ini (Nagase et al., 2005; Ansari et al., 2013).
Berdasarkan struktur tersebut, MMP diklasifikasikan menjadi empat kelompok yaitu archetypal MMPs, matrilysins, gelatinases dan furin-activatable MMPs. Archetypal MMPs terbagi lagi menjadi tiga kelompok kecil sesuai dengan kandungan subsrat spesifiknya yaitu kolagenase, stromelysin, dan kelompok lainnya. Matrilysins merupakan kelompok MMP yang tidak memiliki hemopexin domain. Sementara gelatinases mengandung struktur fibronectin berulang di dalam catalytic domain-nya dimana MMP-2 (Gelatinase A) dan MMP-9 (Gelatinase B) termasuk didalamnya. Kelompok furin-activatable mengandung furin recognition motif termasuk diantaranya secreted, membrane type dan type II transmembrane (Nagase et al., 2005; Gong et al., 2014).
Aktivitas MMP megalami regulasi ketat pada berbagai tingkat sebelum menjadi bentuk aktif. Regulasi ini terjadi baik pada tingkat mRNA maupun
aktivasi protein melalui aktivator dan inhibitornya serta berbagai sel di lingkunagn sekitar tumor. Seperti misalnya MMP-9 pada karsinoma payudara invasif tipe tidak spesifik mengalami regulasi melalui interaksi antara sel tumor dengan lingkungan mikro di sekitarnya seperti sel stroma, sel endotel, makrofag, maupun sel radang neutrofil. Sudah sangat diakui peranan sel radang seperti makrofag, neutrofil, sel mast sel dendritik, dan sel T pada inisiasi dan progresi tumor. Sel tumor ini mampu menghasilkan faktor-faktor pro-inflamasi dan MMP berperan pada progresivitas tumor (Deryugina dan Quigley, 2006). Co-culture sel tumor dengan sel stroma secara in vitro mampu meningkatkan ekspresi pro-MMP-9 di sel tumor dan menekan regulasi inhibitornya (TIMPs) di sel stroma. Co-culture sel tumor dengan sel endotel juga mampu meningkatkan ekspresi MMP-9 serta meningkatkan kemampuan invasi sel tumor melalui peningkatan sekresi IL-6 oleh sel endotel. Sitokin dan faktor pertumbuhan yang dikeluarkan oleh sel tumor, endotel dan sel radang di lingkungan mikro tumor bersama-sama meregulasi ekspresi MMP-9, baik melalui jalur autokrin maupun parakrin (Gong et al., 2014).
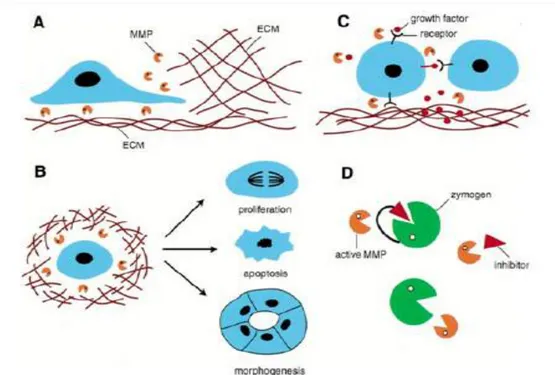
Fungsi fisiologis MMP tampak signifikan selama perkembangan embriogenik di mana MMP memegang peranan penting pada proses remodeling ECM yang merupakan bagian penting dalam pertumbuhan dan morfogenesis jaringan. Secara sistematis, beberapa fungsi seluler MMP selama perkembangan dan fisiologis normal (Gambar 2.9), yaitu:
1) Membantu migrasi sel melalui degradasi molekul ECM
2) Mengubah perangai seluler dengan mengubah lingkungan mikro ECM
3) Membantu aktivitas molekul aktif secara biologis dengan pemecahan langsung, pelepasan dari simpanan, atau memodulasi aktivitas penghambatnya.
Gambar 2.9 Fungsi seluler MMP selama perkembangan dan fisiologis normal
(Ansari et al., 2013).
Seperti yang telah dijelaskan sebelumnya, ketidakseimbangan antara aktivasi dan inhibisi mengarahkan MMP pada kondisi patologis seperti misalnya keganasan. Pada kondisi ini MMP dihasilkan langsung oleh sel tumor maupun sel fibroblast pada stroma dan sel makrofag melalui rangsangan sel tumor (Gialeli et al., 2010; Kumar et al., 2015). Selanjutnya MMP akan menyebabkan degradasi komponen ECM pada membran basalis dan jaringan ikat interstisial yang tersusun atas kolagen, glikoprotein, dan proteoglikan. Proses metastasis suatu karsinoma
diawali oleh interaksi antara sel tumor dengan ECM. Pertama-tama sel tumor harus menembus membran basalis dibawahnya, kemudian melintasi jaringan ikat, dan secara cepat mencapai sirkulasi dengan cara menembus membran basalis pembuluh darah. Proses ini berulang lagi jika emboli sel tumor mengalami ekstravasasi ke tempat jauh. Invasi melalui ECM mengawali kaskade metastasis dan merupakan proses aktif yang melibatkan beberapa tahap, diantaranya perubahan interaksi sel tumor , degradasi ECM, perlekatan ke komponen ECM, dan migrasi sel tumor (Kumar et al., 2015).
Tahap pertama proses invasi yaitu disosiasi sel terjadi karena kelainan molekul adhesi interseluler seperti E-cadherins yang menyebabkan perlekatan antar sel berkurang sehingga sel mudah terlepas dari tumor primer dan meluas ke jaringan sekitarnya. Tahap kedua berupa proses degradasi lokal membran basalis dan jaringan ikat interstisial. Proses ini melibatkan enzim proteolitik seperti MMP yang dapat disekresikan langsung dari sel tumor atau dari induksi terhadap sel stroma seperti fibroblast dan sel inflamasi. Protease lain yang juga disekresikan yaitu cathepsin D dan urokinase plasminogen activator. Untuk mengatur invasi tumor, MMP bukan hanya mengubah komponen yang tidak larut pada membran basalis dan matriks interstisial, tetapi juga melepaskan growth factor yang disimpan ECM seperti misalnya VEGF (Deryugina and Quigley, 2006; Bouchet et al., 2014; Kumar et al., 2015).
2.3.2 Matriks Metalloproteinase-9 (MMP-9)
Matriks metalloproteinase-9 dikenal sebagai enzim metallo-multidomain yang mampu mendegradasi matriks ekstraselular selama proses invasi dan metastasis.
Secara struktural MMP-9 termasuk dalam kelompok gelatinase B dengan catalytic site tersusun atas domain pengikat logam yang dipisahkan dari active site oleh ulangan tiga fibronektin yang memfasilitasi degradasi substrat besar seperti elastin dan penghancuran kolagen (Gambar 2.10) (Patil and Kundu, 2006). Dalam regio ini, asam amino Asp309, Asn319, Asp232, Tyr320 dan Arg3076 penting untuk pengikat gelatin. Catalytic site tetap dipertahankan dalam bentuk tidak aktif oleh amino-terminal pro-peptide PRCGXPD, dengan koordinasi cysteine bersama katalitik Zn2+. Ujung terminal COOH dari MMP-9 mengandung domain hemopexin yang mengatur ikatan dengan substrat, berinteraksi dengan inhibitor dan membantu ikatan ke permukaan sel. Domain O-glycosylated sentral memberikan fleksibilitas molekuler, mengatur spesifisitas substrat MMP-9 invasi yang bergantung MMP-9, interaksi dengan TIMP dan lokalisasi permukaan sel.
Domain ini membantu pergerakan MMP-9 sepanjang substrat makromolekuler dan melepaskan ikatan kolagen sebelum dipecahkan oleh enzim lainnya (Loffek et al., 2011; Farina and Mackay, 2014).
Gambar 2.10 Struktur MMP-9 (Gelatinase B) (Loffek et al., 2011)
Matriks metalloproteinase-9 dihasilkan baik oleh sel tumor maupun sel di sekitar lingkungan tumor seperti sel fibroblast di stroma, sel endotelial, sel
polimorfonuklear (PMN), keratinosit, makrofag dan beberapa sel epitel (Verma and Hansch, 2006; Loffek et al., 2011). Akibatnya aktivasi dan produksi MMP-9 atau gelatinase B sangat dipengaruhi oleh interaksi komponen tersebut di atas.
Selain fungsinya dalam proses metastasis, MMP 9 juga memainkan peran penting pada proses fisiologis seperti penyembuhan luka. Inhibisi terhadap aktivitas enzimatik MMP-9 dilakukan oleh inhibitor protease sistemik α2-makroglobulin, anggota famili TIMP dan antagonis terhadap domain hemopexinnya sendiri (Vempati et al., 2007; Farina and Mackay, 2014; Gong et al, 2014). Mekanisme yang menyebabkan ketidakseimbangan antara MMP-9 dan TIMP terutama TIMP- 1 mengarahkan MMP-9 untuk terlibat dalam proses patologis tumor (Gialeli et al., 2010; Farina and Mackay, 2014).
Saat ini diketahui MMP-9 bukan hanya memiliki kemampuan dalam mendegradasi kolagen tipe IV, komponen utama dari membran basalis epitel dan vaskuler; fibronektin dan gelatin yang memegang peranan penting dalam proses invasi dan metastasis, namun juga memiliki potensi pro-onkogenik antara lain transformasi neoplastik, inisiasi tumor dan instabilitas genetik. MMP-9 dapat menempati inti sel, meskipun memiliki sinyal lokalisasi inti klasik yang rendah dan aktivitas gelatinase inti menyatu dengan peningkatan fragmentasi DNA.
Gelatinase inti ini mendegradasi matriks protein inti yaitu PARP (poly-ADP- ribose-polymerase) dan menghindarkannya dari proses perbaikan DNA (Gialeli et al., 2010; Farina and Mackay, 2014).
Matriks metalloproteinase-9 dan TIMP-1 terekspresi dalam jumlah besar di dalam berbagai tipe sel dan disekresikan dalam bentuk komplek pro-MMP-
9/TIMP-1. Lingkungan tumor yang mengandung sel tumor, stroma, dan elemen radang memberikan kontribusi dalam menjaga stabilitas kompleks tersebut.
Infiltrasi neutrofil pada tumor menyebabkan keluarnya MMP-9 yang tidak terikat TIMP dan memfasilitasi perubahan sifat sel tumor (Gambar 2.11) (Gialeli et al., 2010; Farina and Mackay, 2014; Vandooren et al., 2013).
Gambar 2.11 Peranan MMP-9 yang tidak terikat TIMP yang berasal dari sel radang PMN sel
tumor dalam inisiasi tumor dan promosi instabilitas genetik. melalui degradasi ECM, pelepasan dan aktivasi kemokin, sitokin, dan growth factor (Farina and
Mackay, 2014)
Peranan MMP-9 yang berasal dari sel radang neutrofil juga tampak pada inisiasi adenoma intestinal. Ini dibuktikan oleh penurunan lesi adenoma sebanyak 40% pada heterozygous APC (APC-min) knockout mice yang mengalami defisiensi MMP-9. Pada tumor hepar MMP-9 dilaporkan menginisiasi sel tumor melalui pelepasan proteolitik dan aktivasi TGFβ dan VEGF. Sementara pada epitel payudara manusia, MMP-9 meningkatkan ekspresi onkoprotein HER2/Neu,
menghambat apoptosis, dan menyebabkan transformasi fenotip sel normal di mana ekspansi klonal sel ini merupakan langkah penting proses progresivitas tumor (Farina and Mackay, 2014).
Stem cell niche merupakan lokasi spesifik dan unik yang mengatur jumlah, self-renewal dan pembelahan stem cell baik pada sel normal maupun sel tumor.
Pada sel tumor stem cell niche ini mempengaruhi heterogenitas tumor, metastasis dan resistensi terapi yang diregulasi oleh kondisi-kondisi di dalam tumor dan didukung oleh stress yang berhubungan dengan tumor seperti misalnya hipoksia.
MMP-9 dikatakan berimplikasi terhadap perubahan perilaku stem cell niche dan sumsum tulang. MMP-9 mendegradasi matriks ekstraselular stem cell niche sehingga menyebabkan aktivasi dan mobilisasi stem cell hemopoetik. Hal ini difasilitasi oleh perubahan bentuk stem cell terikat membran menjadi stem cell bebas yang mampu meningkatkan promosi c-KIT terkait proliferasi sel. MMP-9 juga melepaskan stem cell prekursor sel endothelial dari sumsum tulang yang berkontribusi dalam angiogenesis. Interaksi antara stroma-derived factor (SDF)-1 dan reseptor kemokin CXCR4 penting dalam fungsi sel progenitor dan induksi ekspresi MMP-9 (Gong et al., 2014 ).
Matriks metalloproteinase-9 juga dikenal sebagai gen penting yang berhubungan dengan proses transisi EMT dan sekaligus menjadi penyebab EMT (Gambar 2.12) (Gialeli et al., 2010). Ini merupakan proses perubahan sel epitel yang tidak dapat bergerak menjadi sel mesenkimal yang mampu bergerak. Proses ini penting pada pertumbuhan (tipe 1), penyembuhan luka normal atau fibrosis patologis (tipe 2) dan proses metastasis sel karsinoma (tipe 3). Sel EMT tipe 3
fundamental untuk progresi tumor menjadi metastasis, dan baik reaktivasinya dalam dehistologis sel karsinoma maupun aktivasi dalam stem cell, mampu menginduksi fenotip dan motilitas sel karsinoma menjadi invasif (Farina and Mackay, 2014).
Gambar 2.12 Transisi epitelial menjadi mesenkimal (EMT) yang dipicu MMP-9
(Farina and Mackay, 2014)
2.3.3 Matriks Metalloproteinase-9 (MMP-9 / Gelatinase) dan Peranannya pada Karsinoma Payudara
Matriks metalloproteinase-9 pada karsinoma payudara invasif tipe tidak spesifik terlibat pada semua tahap progresivitas sel kanker mulai dari proliferasi, angiogenesis, apoptosis, epithelial-mesenchymal transition (EMT), dan metastasis (Gong et al., 2014). Matriks metalloproteinase-9 ini juga mampu mendegradasi matriks ekstraselular dari stem cell niche yang mengakibatkan terjadinya
perubahan bentuk stem cell niche menjadi bentuk bebas, dan selanjutnya meningkatkan promosi c-KIT yang terkait dengan proliferasi sel. Proses angiogenesis pada karsinoma payudara invasif tipe tidak spesifik dipicu melalui mobilisasi dan aktivasi mitogen angiogenik dari matriks penyimpanannya. Proses ini difasilitasi oleh MMP-9 yang tidak terikat TIMP-1 yang sekaligus mampu melepaskan faktor pertumbuhan FGF dan VEGF dari matriks. Proses metastasis dimudahkan oleh kemampuan sel tumor untuk berubah dari bentuk sel epitel yang tidak mampu bergerak menjadi sel mesenkimal yang mampu bergerak (EMT).
Matriks metalloproteinase-9 dikatakan juga terlibat pada proses ini (Farina dan Mackay, 2014).
Terdapat beberapa penelitian yang telah dilakukan untuk meneliti hubungan dan peranan MMP-9 pada karsinoma payudara. Pada penelitian yang dilakukan oleh Irianiwati et al. (2012) terhadap 50 kasus karsinoma payudara, dilakukan pulasan MMP-9 untuk menilai perburukan derajat histologisnya. Hasil penelitian menunjukkan bahwa ekspresi MMP-9 berbeda bermakna pada derajat tinggi dibandingkan derajat rendah, di mana ekspresi tinggi MMP-9 ditemukan pada karsinoma payudara derajat tinggi (Irianiwati et al., 2012).
Penelitian serupa dilakukan oleh Yousef et al. terhadap 200 kasus karsinoma payudara yang dibagi menjadi tiga derajat histologis. Penghitungan ekspresi MMP-9 dilakukan secara semi kuantitatif berdasarkan presentase jumlah sel yang terpulas positif dengan intensitas pewarnaan. Sel yang mengekspresikan MMP-9 akan tampak berwarna coklat pada sitoplasma sel epitel ganas maupun stroma (Gambar 2.12). Pada penelitian ini, sampel dibagi menjadi dua yaitu ekspresi
MMP-9 dengan tingkat rendah dan tingkat tinggi. Hasil dari penelitian ini didapatkan ekspresi MMP-9 tingkat tinggi pada karsinoma payudara derajat tinggi (Gambar 2.13) (Yousef et al., 2014).
Gambar 2.13
Ekspresi MMP-9 pada jaringan payudara normal A. Pulasan positif lemah MMP-9 pada kelenjar payudara
normal yang terpulas pada sel epitel luminal dan myoepitel. Sel stromal di sekitarnya tidak terpulas (pada 75% pasien) B. Pulasan positif lemah MMP-9
pada sitoplasma sel epitel luminal, myoepitel, dan sel stroma di antara asinus jaringan payudara normal (Yousef et al.,2014).
Penelitian karsinoma payudara di negara Irak tahun 2015 yang dilakukan oleh Mahmood dan kawan-kawan, menghubungkan antara ekspresi MMP-2 dan MMP- 9 dengan berbagai variabel klinikopatologis pada karsinoma payudara stadium II dan III. Penelitian dilakukan dengan jumlah pasien sebanyak 64 orang. Hal ini serupa dengan metode penelitian-penelitian sebelumnya. Didapatkan korelasi yang signifikan antara ekspresi MMP-9 dengan beberapa variabel klinikopatologis, yaitu: stadium tumor, derajat histologis, tipe histologis, dan status metastasis limfonodi (Mahmood et al., 2015).
Di Italia, penelitian ekspresi MMP-2 dan MMP-9 pada pasien-pasien dengan karsinoma payudara, dilakukan dengan mengambil level plasmadari MMP
tersebut. Jadi, penilaian tidak didasarkan pada pewarnaan IHK. Penelitian dilakukan terhadap 50 pasien karsinoma payudara dan 30 pasien fibroadenoma.
Hasil penelitian menunjukkan tidak ada perbedaan yang bermakna ekspresi MMP- 9 plasma antara pasien-pasien dengan karsinoma dan fibroadenoma. Perbedaan yang bermakna ekspresi MMP-9 plasma didapatkan pada pasien-pasien karsinoma payudara bila ditinjau dari sudut pandang variabel derajat histologis (Vasaturo et al., 2012).
Penelitian di India dengan 39 sampel kanker payudara dan 16 jaringan payudara yang normal menunjukkan adanya peningkatan MMP-9 secara berbeda pada jaringan kanker payudara dengan jaringan payudara yang normal. Dimana tampak peningkatan ekspresi MMP-9 pada karsinoma payudara (Benson et al., 2013).
Di Finlandia ekspresi MMP-2 dan MMP-9 dianalisis secara imunohistokimia dalam prospektif seri besar dari 421 pasien kanker payudara. MMP-9 terekspresi dalam sitoplasma sel-sel ganas dan stroma. Ekspresi tinggi MMP dalam sel karsinoma terkait stadium tumor, sedangkan ekspresi positif pada stroma dikaitkan dengan faktor-faktor agresif. Evaluasi ekspresi MMP-9 menambahkan informasi tentang prognosis kanker payudara (Pellikainen et al., 2014).
Hasil kontradiktif didapatkan oleh Wu dan kawan-kawan melalui penelitiannya di Cina pada tahun 2014, mereka berusaha mencari signifikansi antara ekspresi MMP-9 dengan berbagai variabel klinikopatologis pada 41 spesimen operasi mastektomi tanpa riwayat terapi sebelumnya (radioterapi dan kemoterapi). Kasus-kasus dievaluasi dengan variabel tipe histologis, derajat
histologis, metastasis limfonodi. Hasil penelitian menunjukkan bahwa tidak ada korelasi yang signifikan antara ekspresi MMP-9 dengan semua variabel penelitian yang dievaluasi (Wu et al., 2014).
Sebagai kesimpulan, data-data yang dikumpulkan mendukung hipotesis bahwa ekspresi MMP-9 berhubungan dengan derajat histologis. Namun tidak dijelaskan apakah ada perbedaan bermakna antara tiap variabel klinikopatologisnya.
42
3.1 Kerangka Berpikir
Progresivitas sel karsinoma erat kaitannya dengan kemampuan proliferasi, invasi, serta metastasis. Pada karsinoma payudara tipe tidak spesifik, progresivitas sel kanker secara histopatologis ditentukan berdasarkan sistem Nottingham Combined Histologic Grade (Elston-Ellis Modification of Scarff-Bloom-Richardson Grading System). Sistem ini menilai karsinoma payudara berdasarkan tiga karakteristik tumor yaitu formasi tubular (kelenjar), pleomorfisme inti sel, dan jumlah mitosis.
Diagnosis pada karsinoma payudara berdasarkan tipe histologis saja tidak cukup untuk menentukan terapi akhir dan memprediksi prognosis pasien. Oleh karena itu, dibuatlah dengan sistem derajat histologis. Karsinoma payudara dengan histologis baik umumnya memiliki prognosis yang baik, sedangkan tumor-tumor derajat histologis buruk akan berkembang cepat dan memiliki prognosis yang kurang baik.
Proses invasi serta metastasis melibatkan beberapa tahap salah satunya adalah degradasi komponen matriks ekstraselular (ECM). Proses ini melibatkan suatu protease utama yaitu matriks metalloproteinase (MMP), salah satunya adalah MMP-9. Secara struktural MMP-9 termasuk dalam kelompok gelatinase B dengan catalytic site tersusun atas domain pengikat logam yang dipisahkan dari active site oleh ulangan tiga fibronektin yang memfasilitasi degradasi kolagen tipe IV.
Matriks metalloproteinase-9 dihasilkan baik oleh sel tumor maupun sel di sekitar lingkungan tumor seperti sel fibroblas di stroma, sel endotel pembuluh darah, sel polimorfonuklear, keratinosit, makrofag, dan beberapa sel epitel sehingga aktivasi dan produksinya sangat dipengaruhi oleh interaksi komponen tersebut. Faktor pertumbuhan dan sitokin yang disekresikan oleh sel tumor, stroma, dan sel radang di lingkungan mikro tumor bersama-sama dapat meningkatkan ekspresi MMP-9 melalui jalur autokrin dan parakrin.
Selanjutnya MMP-9 yang berasal dari neutrofil meregulasi penarikan perisit, apoptosis, pengambilan dan mobilisasi sumsum tulang yang mengandung prekursor angiogenik ke stroma tumor sehingga meningkatkan proses angiogenik dan vaskulargenik. Pada saat proses angiogenik oleh sel tumor terjadi, MMP-9 juga memicu tombol angiogenik melalui mobilisasi dan aktivasi mitogen angiogenik dari matriks penyimpanannya. Selain itu MMP-9 mampu melepaskan faktor pertumbuhan FGF dan VEGF, urokinase plasminogen activator (uPA), serpin protease nexin-1 (PN-1) yang penting pada proses invasi dan angiogenesis.
Progresi tumor primer hingga menjadi tumor metastasis merupakan suatu proses yang kompleks. MMP-9 memegang peranan penting pada hampir setiap tahap proses progresivitas tersebut sehingga dapat dijadikan sebagai penanda penting progresivitas karsinoma payudara invasif tipe tidak spesifik. Ekspresi MMP-9 diduga berkaitan dengan derajat karsinoma payudara invasif tipe tidak spesifik berdasarkan sistem Nottingham Grading System yang ditelusuri pada penelitian ini.
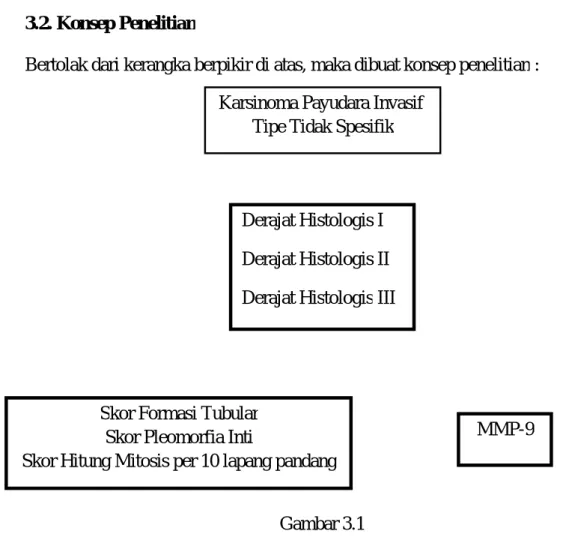
3.2. Konsep Penelitian
Bertolak dari kerangka berpikir di atas, maka dibuat konsep penelitian :
Gambar 3.1 Bagan Konsep Penelitian
Keterangan: : Variabel yang diteliti
3.3 Hipotesis Penelitian
1. Terdapat hubungan antara ekspresi MMP-9 dengan derajat histologis pada karsinoma payudara invasif tipe tidak spesifik.
2. Terdapat pengaruh ekspresi MMP-9 dalam menentukan faktor karakteristik derajat histologis yang paling dominan.
MMP-9 Karsinoma Payudara Invasif
Tipe Tidak Spesifik
Derajat Histologis I Derajat Histologis II Derajat Histologis III
Skor Formasi Tubular Skor Pleomorfia Inti
Skor Hitung Mitosis per 10 lapang pandang
45
4.1 Rancangan Penelitian
Penelitian ini merupakan penelitian observasional dengan menggunakan rancangan potong lintang (cross-sectional analytic study). Bagan rancangan penelitian dapat dilihat pada Gambar 4.1.
Gambar 4.1
Bagan Rancangan Penelitian
4.2 Tempat dan Waktu Penelitian
Penelitian dilakukan di Bagian/SMF Patologi Anatomi FK UNUD/RSUP Sanglah Denpasar dari 31 Agustus 2016 – 30 November 2016.
4.3 Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah gambaran mikroskopis dari bahan biopsi dan operasi mastektomi penderita karsinoma payudara invasif tipe tidak spesifik derajat histologis I, II, dan III yang diperiksa secara histopatologi di Bagian/SMF
Patologi Anatomi FK UNUD/RSUP Sanglah Denpasar dan mikroskopis dari bahan biopsi dan operasi mastektomi penderita karsinoma payudara invasif tipe tidak spesifik derajat histologis I, II, dan III yang diperiksa imunohistokimia MMP-9 di Bagian Patologi Anatomi Fakultas Kedokteran Universitas Gadjah Mada/RSUP Dr. Sardjito Yogyakarta.
4.4 Penentuan Sumber Data 4.4.1 Populasi
4.4.1.1. Populasi target
Populasi penelitian ini adalah semua sediaan blok parafin dari penderita karsinoma payudara invasif tipe tidak spesifik derajat histologis I, II, dan III yang diperiksa secara histopatologi dari hasil biopsi dan operasi mastektomi di Bali.
4.4.1.2. Populasi terjangkau
Populasi penelitian ini adalah sediaan blok parafin dari penderita karsinoma payudara invasif tipe tidak spesifik derajat histologis I, II, dan III yang diperiksa secara histopatologi dari hasil biopsi dan operasi di Bagian/SMF Patologi Anatomi FK UNUD/RSUP Sanglah Denpasar.
4.4.2 Sampel Penelitian
Sampel penelitian ini adalah sediaan blok parafin penderita karsinoma payudara invasif tipe tidak spesifik derajat histologis I, II, dan III yang diperiksa secara histopatologi dari hasil biopsi dan operasi di Bagian/SMF Patologi Anatomi FK
UNUD/RSUP Denpasar dari tanggal 1 Januari 2013 sampai dengan 31 Juli 2016 yang memenuhi kriteria inklusi dan eksklusi.
4.4.3 Kriteria Inklusi
1. Sediaan blok parafin yang berasal dari bahan biopsi atau operasi payudara yang mengandung cukup jaringan tumor karsinoma payudara invasif tipe tidak spesifik karsinoma payudara invasif tipe tidak spesifik dan memenuhi kriteria karakteristik bentukan tubular, pleomorfia inti, dan hitung mitosis per 10 lapang pandang besar mikroskop.
2. Sediaan blok parafin yang berasal dari bahan biopsi atau operasi karsinoma payudara invasif tipe tidak spesifik yang belum mendapat radioterapi, kemoterapi, dan terapi hormonal.
4.4.4 Kriteria Eksklusi
1. Sediaan dari sisa frozen section karsinoma payudara invasif tipe tidak spesifik.
2. Sediaan yang mengandung infiltrasi padat sel radang PMN neutrofil dan makrofag.
3. Sediaan dari bahan biopsi dengan ukuran yang tidak mencukupi untuk menentukan derajat histologisnya.
4. Blok parafin yang berjamur.
4.4.5 Besar Sampel
Pada penelitian ini besar sampel dihitung dengan rumus (Araoye, 2003):
n = Z α2PQ d2 Keterangan:
n = besar sampel
P = prevalensi karsinoma payudara invasif tipe tidak spesifik pada penelitian terdahulu
Q = 1-P
d = deviasi di populasi (15%)
α = tingkat kemaknaan 95% (Zα = 1,96)
Jumlah sampel (n) dihitung dengan rumus di atas. Di mana Zα2 yaitu 1,96 x 1,96 dikalikan dengan P sebesar 0,545, kemudian dikalikan oleh Q yaitu 1-P = 0,455.
Lalu dibagi dengan d2 yaitu 0,0225. Dan didapatkan hasil yang paling besar yaitu 42,34. Oleh karena adanya kemungkinan drop out/data blank, maka ditambahkan 10% sehingga sampel menjadi 42,34 + 4,234 = 46,57 dan dibulatkan menjadi 47 sampel. Jadi besar sampel keseluruhan dalam penelitian ini adalah 47 sampel.
4.4.6 Teknik Pengambilan Sampel
Teknik penentuan sampel dilakukan dengan cara berikut :
a. Dari populasi sediaan blok parafin diadakan pemilihan sampel berdasarkan kriteria inklusi dan eksklusi.
b. Populasi terjangkau yang telah memenuhi syarat diambil secara random untuk mendapatkan jumlah sampel yang dibutuhkan, yaitu sebanyak 47 sediaan.
4.5 Variabel Penelitian 4.5.1 Klasifikasi Variabel
1. Variabel tergantung : - Ekspresi MMP-9.
- Karakteristik derajat histologis.
2. Variabel bebas : Karsinoma payudara invasif tipe tidak spesifik derajat histologis I, II, dan III.
4.5.2 Definisi Operasional Variabel
1. Karsinoma payudara invasif tipe tidak spesifik adalah keganasan yang terjadi pada sel-sel epitel duktuli payudara, terutama sel-sel dari terminal duct lobular unit (TDLU) yang ditandai adanya invasi ke stroma jaringan dan tumor ini tidak membentuk suatu pola tipe histologis tertentu.
Diklasifikasikan sebagai karsinoma invasif tipe tidak spesifik apabila komponen gambaran tidak spesifiknya lebih dari 50% massa tumor dengan pemeriksaan dari potongan yang representatif. Jika gambaran tidak spesifik kurang dari 50% atau sekitar 10-49% dari massa tumor dan sisanya adalah tipe spesifik maka disebut kelompok campuran yaitu campuran karsinoma invasif tipe tidak spesifik dan tipe spesifik.
2. Karakteristik derajat histologis : karakteristik derajat histologis terdiri dari formasi tubular, pleomorfia inti, dan hitung mitosis. Masing-masing
karakteristik memiliki skor 1 sampai 3. Formasi tubular diamati dengan mikroskop cahaya binokuler merk Olympus CX21 dengan pembesaran lemah 40 kali, dilihat seluruh lapang pandang. Skor 1 bila bentukan tubular lebih dari 75%, skor 2 bentukan tubular 10%-75%, skor 3 bila bentukan tubular kurang dari 10%. Penghitungan pleomorfia inti diamati dengan mikroskop cahaya binokuler merk Olympus CX21 dengan pembesaran lemah 40 kali sampai pembesaran kuat 400x dilihat seluruh lapang pandang. Skor 1 bila sel- sel uniform, kecil, pleomorfia inti ringan, skor 2 bila peningkatan inti sedang dalam bentuk dan ukuran dikatakan pleomorfia inti sedang, skor 3 bila bentuk sangat bervariasi dikatakan sebagai pleomorfia inti berat. Penghitungan mitosis diamati dengan mikroskop cahaya binokuler merk Olympus CX21 dinilai dengan menghitung jumlah mitosis per 10 lapang pandang besar mikroskop atau High Power Field (HPF) dengan pembesaran 400x.
Penghitungan dengan cara mencari massa tumor yang padat dan dinilai secara random meaner. Skor 1 bila hitung mitosis ≤ 12 per 10 lapang pandang besar mikroskop, skor 2 bila hitung mitosis 13-24 per 10 lapang pandang besar mikroskop dan skor 3 bila hitung mitosis ≥ 25 per 10 lapang pandang besar mikroskop (Colditz dan Chia, 2012).
3. Karsinoma payudara invasif tipe tidak spesifik derajat histologis I : kelompok keganasan payudara yang terjadi pada sel-sel epitel duktuli payudara yang ditandai adanya invasi ke stroma jaringan dan tumor tidak membentuk suatu pola tipe histologik tertentu sesuai kriteria WHO tahun 2012 dengan skor total derajat histologis bernilai 3, 4, atau 5 poin berdasarkan Nottingham
Combined Histologic Grade (Elston-Ellis Modification of Scarff-Bloom- Richardson Grading System) atau biasa disebut dengan Nottingham Grading System (Colditz dan Chia, 2012).
4. Karsinoma payudara invasif tipe tidak spesifik derajat histologis II : kelompok keganasan payudara yang terjadi pada sel-sel epitel duktuli payudara yang ditandai adanya invasi ke stroma jaringan dan tumor tidak membentuk suatu pola tipe histologik tertentu sesuai kriteria WHO tahun 2012 dengan skor total derajat histologis bernilai 6 atau 7 poin berdasarkan Nottingham Combined Histologic Grade (Elston-Ellis Modification of Scarff- Bloom-Richardson Grading System) atau biasa disebut dengan Nottingham Grading System (Colditz dan Chia, 2012).
5. Karsinoma payudara invasif tipe tidak spesifik derajat histologis III : kelompok keganasan payudara yang terjadi pada sel-sel epitel duktuli payudara yang ditandai adanya invasi ke stroma jaringan dan tumor tidak membentuk suatu pola tipe histologik tertentu sesuai kriteria WHO tahun 2012 dengan skor total derajat histologis bernilai 8 atau 9 poin berdasarkan Nottingham Combined Histologic Grade (Elston-Ellis Modification of Scarff- Bloom-Richardson Grading System) atau biasa disebut dengan Nottingham Grading System (Colditz dan Chia, 2012).
6. Ekspresi MMP-9 adalah penilaian protein MMP-9 secara imunohistokimia menggunakan Monoclonal Rabbit Anti-Human MMP-9 Antigen, Abcam kemudian secara semikuantitatif diamati dengan mikroskop cahaya binokuler merk Olympus CX21 dimulai dari pembesaran lemah 40 kali untuk melihat