Anaerobic Bacteria for Biogas Production through an Organic Waste
Bioremediation
Maya SHOVITRI1), N.D. KUSWYTASARI1), Rachmasari2) 1)
Staf Pengajar Jurusan Biologi-FMIPA-ITS 2)
Mahasiswa S1 Jurusan Biologi-FMIPA-ITS
Abstract
Keywords: anaerobic bacteria; septic tank; organic waste water; bioremediation; biogas; chromatography gas;
1. Pendahuluan
Bahan bakar minyak (BBM) merupakan salah satu sumber daya alam yang tidak dapat diperbaharui. Peraturan Presiden Republik Indonesia No. 5 Tahun 2006 menuntut dilakukannya berbagai usaha untuk mencari sumber energi alternatif pengganti BBM. Salah satu sumber energi alternatif tersebut adalah biogas metan (CH4) dan hidrogen (H2) (Pambudi, 2008). Biogas
dapat dihasilkan dari limbah organik oleh metabolisme suatu mikroorganisme. Proses ini juga disebut dengan bioremediasi. Salah satu mikroorganisme yang dapat digunakan sebagai agen bioremediasi limbah organik adalah bakteri dalam tinja. Bakteri tinja ini didominasi golongan Coliform, salah satunya adalah Escherichia coli yang mampu menghasilkan H2 (William, 2005).
H2 merupakan gas yang paling ringan, tidak berwarna, dan tidak berbau. H2 merupakan energi
masa depan karena dapat diperbaharui dan juga tidak menimbulkan polusi dimana pembakarannya hanya menghasilkan uap air (Hansel, 1998). H2 melepaskan energi yang besar
dalam satuan unitnya dan mudah dikonversikan menjadi listrik melalui fuel cell sebagai bahan bakar (Miyamoto, 1997). Penelitian ini bertujuan untuk mendapatkan isolat bakteri anaerob dari tangki septik dan mengetahui kemampuan isolat bakteri anaerob menghasilkan biogas dari proses bioremediasi limbah organik.
2. Tinjauan Pustaka
Mikroorganisme anaerob merupakan mikroorganisme yang tidak menggunakan oksigen (O2) sebagai elektron aseptor terakhir pada respirasinya (Nelson et al., 2004), seperti
bakteri anaerob. Bakteri anaerob memiliki kemampuan memanfaatkan bahan organik sebagai sumber energi, sumber karbon dan elektron aseptor terakhir pada respirasinya. Kemampuan bakteri anaerob tersebut dapat dimanfaatkan sebagai agen bioremediasi di alam. Bioremediasi merupakan bagian dari bioteknologi lingkungan yang memanfaatkan proses alami biodegradasi dengan menggunakan aktivitas mikroba yang dapat memulihkan lahan tanah, air dan sedimen dari kontaminasi terutama senyawa organik (Cookson, 1995).
Salah satu sumber bakteri anaerob adalah tangki septik. Tangki septik merupakan tempat penampungan sementara limbah organik berupa tinja yang secara alami akan mengalami proses biodegradasi dalam kondisi anaerob oleh mikroorganisme dalam tangki septik (Anonim1, 2011). Diantara bakteri anaerob yang mampu menghasilkan biogas H2 adalah
Entrobacter, Baccillus, dan Clostridium melalui proses fermentasi gelap (Mahyudin, 2006). Selain itu CH4 dihasilkan pada tahapan akhir dari proses anaerobic digestion dihasilkan oleh
beberapa bakteri methanogen seperti Methanobacterium formicum dan M. mobilis. Sedangkan M. propionicum selain mampu menghasilkan CH4 juga mampu menghasilkan Acetate, CO2 dan
H (Kalia, 2007).
One potential future energy is biogas. It is mainly from a bacterial bioremediation. This study explored the potency of anaerobic septic tank bacteria in producing biogas through an organic waste biorem ediation. The anaerobic isolation was done by adapting a Hungate method with a thioglycolate medium without bacterial characterization. The produced biogas under anoxic condition was identified and measured with a gas chromatograph. This study was able to isolate 7 anaerobic isolates even they were not in a pure culture and coded as BT 1, BT 2, BT 3, BG 1, BG 2, BG 3 and BG 4. Their ability to produce biogas was detected by inoculating and incubating them in an organic waste containing bioreactor for 18 days, each in dark and light condition. The gas chromatographic peaks indicated that produced gasses were only O2 and N2 which were unexpected biogas under anoxic condition. Even biogas was not detected it didn’t mean that the isolate was not biogas producer. Several factors may interfere the results; abiotic factor for optimum bacterial growth and gas production or available standard gas and gas carrier for example.
Medium thioglycollate merupakan medium anaerob yang dilaporkan mampu mendukung pertumbuhan beberapa spesies bakteri anaerob diantaranya Clostridium sporogenes, Clostridium perfingens, Bacillus subtilis dan Staphylococcus aureus (Anonim2,
2010). Menurut Moodie (1973) bakteri anaerob dari tangki septik pada umumnya terdiri dari golongan Coliform diantaranya beberapa spesies bakteri anaerob yang ditemukan dalam feses adalah bifido, proprionobacteria, Bacteroides, Clostridia, dan lainnya. Gram-negatif non-sporing spesies, terutama Bacteroides fragilis ditemukan dengan jumlah dari 1010 sampai 1011 per gram feses.
3. Metodologi Penelitian Medium limbah organikcair
Sampel berupa sampah organik padat pasar yang kaya protein dan lemak seperti organ buangan ikan, ayam dan sapi serta limbah cair pasar sisa perendaman ikan. Sampah padat organik sebanyak 1500 gr dicampur dengan 3000 ml limbah cair kemudian diblender hingga didapatkan filtrat. Selanjutnya filtrate disaring hingga didapatkan 3000 ml cairan ekstrak medium limbah organik. Pupuk NPK dan Urea masing-masing sebanyak 3 gr dimasukkan ke dalam Erlenmeyer dan ditambahkan dengan cairan ekstrak medium limbah organik hingga 3000 ml (Suyasa, 2007). Medium limbah organik ditambahkan dengan agen pereduksi oksigen berupa Na2S (sodium sulfide) (Arnosti, 1993). Medium limbah organik kemudian diautoclave
selama 15 menit pada suhu 121oC dengan tekanan 1,5 atm (Wirda, 2009).
Isolasi dan pemurnian bakteri anaerob tangki septik
Isolasi dan pemurnian bakteri anaerob dari sampel inokulum tangki septik dilakukan dengan menggunakan medium thioglycollate. Isolasi bakteri anaerob dilakukan menggunakan pengenceran bertingkat dengan cara mengambil 1 ml sampel cairan tangki septik dan dimasukkan ke dalam 9 ml medium thioglycollate dengan menggunakan pipet mikro 1000 µl dan dihomogenkan sehingga didapatkan pengenceran 10-1. Pengenceran bertingkat dilakukan hingga pengenceran 10-15. Udara di bagian head space tabung reaksi kemudian diganti dengan gas N2 selama 3 menit dan ditutup dengan rubber stopper. Tabung reaksi kemudian diinkubasi
pada kondisi terang dan gelap serta diamati pertumbuhan bakteri anaerob. Sedangkan untuk proses pemurnian isolat bakteri anaerob dilakukan dengan memilih satu koloni bakteri yang terpisah. Koloni bakteri anaerob yang terpisah diambil sebanyak 10 µl dengan menggunakan pipet mikro 10 µl dan dimasukkan ke dalam 10 ml medium thioglycollate. Kemudian udara dibagian head space diganti dengan gas N2 selama 3 menit dan ditutup dengan rubber stopper.
Tabung reaksi kemudian diinkubasi pada kondisi terang dan gelap serta diamati pertumbuhan bakteri anaerob.
Produksi biogas
Isolat bakteri anaerob yang didapatkan kemudian diuji kemampuannya dalam menghasilkan biogas dari medium limbah organik cair. Isolat yang berbeda secara morfologi kemudian diuji dengan memasukkan 10 µl isolat bakteri anaerob ke dalam 10 ml medium limbah organik dalam tabung reaksi, kemudian udara dibagian head space diganti dengan gas N2
selama 3 menit dan ditutup dengan rubber stopper. Tabung reaksi selanjutnya diinkubasi dalam keadaan gelap dan terang selama 18 hari pada suhu ruang. Setelah masa inkubasi biogas diukur dengan kromatografi gas.
4. Hasil dan Pembahasan
Isolasi dan Pemurnian Bakteri Anaerob dari Tangki Septik
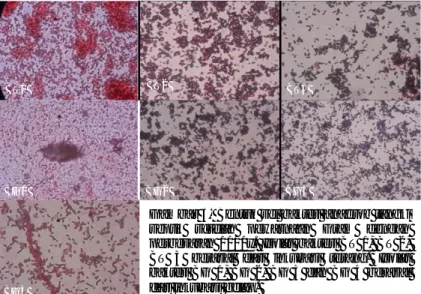
Gambar 1 menunjukkan isolat bakteri anaerob tangki septik yang berhasil tumbuh setelah pengenceran bertingkat. Selanjutnya satu koloni tunggal diambil dan dimurnikan, hingga diperoleh 7 isolat bakteri anaerob isolat BT 1, BT 2 dan BT 3 yang berasal dari inkubasi terang, serta isolat BG 1, BG 2, BG 3 dan BG 4 yang berasal dari inkubasi gelap. Pola pertumbuhan koloni bakteri yang telah dimurnikan berbeda dengan bakteri hasil pengenceran. Koloni bakteri anaerob hasil pemurnian cenderung tumbuh lebih merata ke seluruh bagian medium dengan ukuran koloni yang relative sama. Ini dapat menjadi indikator bahwa koloni bakteri yang tumbuh adalah bakteri sejenis karena memiliki kebuhan nutrisi yang sama (Gambar 2 panah hitam).
(a) (b) (c) (d) (e) (f)
Gambar 1. Isolat bakteri anaerob tangki septik dari proses pengenceran bertingkat (a) Isolat BG 1 dari
pengenceran 10-4 (b) Isolat BG 2 dari pengenceran 10-15 (c) Isolat BG 3 dan BG 4 dari pengenceran 10-6, (d) Isolat BT 1 dari pengenceran 10-6 dan (e) Isolat BT 2 dan 3 dari pengenceran 10-9 dan (f) kontrol negatif. Panah merah menunjukkan koloni bakteri yang tumbuh terpisah. Panah hitam menunjukkan koloni bakteri yang menghasilkan biogas yang berdifusi ke atas permukaan medium thioglycollate.
(a) (b) (c) (d) (e) (f)
Gambar 2. Isolat bakteri anaerob tangki septik dari proses pemurnian I (a) kontrol negatif, (b) Isolat BG 1,
(c) Isolat BG 2, (d) Isolat BG 3 dan BG 4, (e) Isolat BT 1 dan (f) Isolat BT 2 dan BT 3. Panah merah menunjukkan koloni terpisah yang tumbuh. Panah hitam menunjukkan koloni bakteri yang tumbuh merata.
Dari pengamatan mikroskopis setelah pewarnaan Gram (Gambar 3) terlihat bahwa ke-7 isolat bakteri anaerob belum berhasil dimurnikan. Ada 2 bentuk sel bakteri yaitu basil dan kokus dari satu biakan dalam satu tabung reaksi, dimana bentuk basil lebih dominan terhadap kokus. Tabel 1 menunjukkan karakter mikroskopis sel bakteri anaerob setelah pewarnaan Gram dan Endospora. Belum berhasilnya proses pemurnian ini dapat disebabkan oleh beberapa factor, diantaranya kebutuhan sumber energi dan nutrisi yang berbeda untuk setiap spesies bakteri anaerob. Sehingga pada proses purifikasi bakteri anaerob diperlukan medium yang spesifik (Henk, 1986).
BT1 BT2 BT3
BG1 BG2 BG3
BG4
Gambar 3. Bentuk sel bakteri anaerob tangki
septik setelah pewarnaan Gram dengan perbesaran 1000x. Isolat bakteri BT 1, BT 2, BT 3 berasal dari inkubasi terang. Isolat bakteri BG 1, BG 2, BG 3 dan BG 4 berasal dari inkubasi gelap.
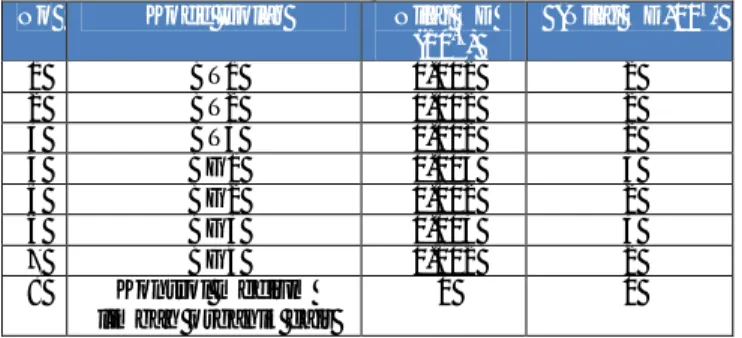
Tabel 1. Data isolat bakteri anaerob tangki septik
Inkubasi Terang
No Kode Isolat Bentuk Sel Pewarnaan
Gram Endospora
1 BT1 Dominan Basil, kokus - -
2 BT2 Dominan Basil, kokus + -
3 BT3 Dominan Basil, kokus + -
Inkubasi Gelap
No Kode Isolat Bentuk Sel Pewarnaan
Gram Endospora
1 BG1 Dominan Basil, kokus - -
2 BG2 Dominan Basil, kokus + -
3 BG3 Dominan Basil, kokus + -
4 BG4 Dominan Basil, kokus - -
Produksi Biogas
Pertumbuhan ke-7 isolat bakteri anaerob dalam medium limbah organik cair diukur berdasarkan kerapatan selnya setelah masa inkubasi 18 dan 19 hari. Dari Tabel 2 terlihat bahwa ke-7 isolat bakteri anaerob mampu tumbuh di dalam medium limbah organik cair, walaupun nilai OD relatif rendah. Kalia (2007) menyebutkan bahwa beberapa jenis bakteri anaerob memiliki waktu pembelahan yang berbeda-beda. Bakteri yang mampu menghasilkan biogas dalam kondisi anaerob misalnya bakteri bakteri asetogenis memiliki waktu pertumbuhan yang sangat lambat yaitu dengan waktu pembelahan sel sekitar 14 hari dan bakteri metanogen asetolastik dengan waktu pembelahan sel 2 hingga 6 hari (Kalia, 2007).
Tabel 2. Pertumbuhan isolat bakteri anaerob dalam medium limbah organik cair berdasarkan nilai optical
density (OD) pada panjang gelombang 600 nm
No Kode Isolat Nilai OD
(10-3) (Nilai OD*103) 1 BT1 0.002 2 2 BT2 0.002 2 3 BT3 0.002 2 4 BG1 0.003 3 5 BG2 0.002 2 6 BG3 0.003 3 7 BG4 0.002 2 8 Kontrol medium
limbah organik cair
0 0
Selanjut dari Gambar 4 terlihat bahwa komponen biogas yang terdeteksi dari ke-7 isolat bakteri hanyalah gas O2 dan N2. Kedua gas tersebut bukan merupakan biogas yang diharapkan
dalam penelitian ini. Hal ini dapat terjadi karena beberapa factor, diantaranya : 1. Isolat bakteri anaerob bukan bakteri yang mampu menghasilkan biogas.
2. Nutrisi dan sumber energi dalam medium kurang mendukung bakteri untuk memproduksi gas. Karena pada beberapa bakteri penghasil biogas memerlukan ketersediaan nutrisi dan sumber energi tertentu (Mahyudin, 2006).
3. Alat gas kromatografi kurang sensitive mendeteksi biogas. Hal ini berkaitan dengan jenis detektor, penggunaan gas standar dan gas pembawa. Berdasarkan persentase gas N2 di
Gambar 4 terlihat ketidakstabilan deteksi gas antara isolat bakteri. Pada tabung reaksi isolate bakteri anaerob BT 1, BT 3 dan BG 4, persentase N2 relatif sama dengan kontrol
negative. Ini menunjukkan bahwa N2 berasal dari proses pergantian udara dengan N2 pada
head space tabung reaksi. Sedangkan pada isolat BT 2, BG 1 dan BG 2 terlihat relatif lebih rendah, walau tabung reaksi dalam keadaan rapat tertutup dan anaerob. Di sisi lain, belum pernah dilaporkan bahwa bakteri anaerob ada yang mampu memfiksasi secara langsung gas N2.
Gambar 4. Biogas pada medium limbah organik cair
5. Kesimpulan
Penelitian ini berhasil mengisolasi 7 isolat bakteri anaerob yang berasal dari tangki septik. Ke-7 isolat bakteri anaerob dikode sebagai BT 1, BT 2 dan BT 3 yang merupakan bakteri anaerob dari inkubasi terang serta isolat BG 1, BG 2, BG 3 dan BG 4 yang berasal dari inkubasi gelap. Tidak satupun dari isolat tersebut yang dapat menghasilkan biogas, kecuali hanya gas O2
dan N2. Kedua gas tersebut bukan merupakan biogas yang diharapkan dalam penelitian ini.
Daftar Pustaka
[1] Anonim1, Pengelolaan Limbah Industri Pangan, Direktorat Jenderal Industri Kecil
Menengah Departemen Perindustrian,
www.kemenperin.go.id/asp/pelatihan_ikm/.../cleaner-production.pdf (12 Juni 2011). [2] Anonim2, Thioglycollate Medium with Resazurin, Biokar diagnostics, 2010, France
[3] Arnosti, C dan D. J. Repeta., Extracellular Enzyme Activity in Anaerobic Bacterial Cultures: Evidence of Pullulanase Activity among Mesophilic Marine Bacteria, Applied And Environmental Microbiology, p. 840-846, 1994
[4] Cookson J.T., Bioremediation engineering: Design and application, McGraw-Hill Inc., Toronto. 1995
[5] Hansel, A dan P. Lindblad., Toward Optimization Of Cyanobacteria As Biotechnologically Relevant Producers Of Molecular Hydrogen, A Clean And Renewable Energy Source. Appl Microbiol Biotechnol 50:153–160, 1998
[6] Henk, J. Nanninga dan Jan C. Gottschal., Properties of Desulfovibrio carbinolicus sp. nov. and Other Sulfate-Reducing Bacteria Isolated from an Anaerobic-Purification Plant. Department of Microbiology, University of Groningen, Kerklaan 30, 9751 NN Haren, 1986 [7] Kalia, V.C., Applied Microbiology : Microbial Treatment of Domestic and Industrial Wastes
for Bioenergy Production. Microbial Biotechnology and Genomics, Institute of Genomics and Integrative Biology, 2007
[8] Madigan, M. T dan J. M. Martinko., Brock; Biology Of Microorganism, 8th edition., Pearson Prentice Hall, USA, 1997
[9] Mahyudin, A. R dan Koesnandar., Biohydrogen Production: Prospects And Limitations To Practical Application, Pusat Pengkajian dan Penerapan Teknologi Bioindustri BPPT, 2006 [10] Miyamoto, K., Renewable Biological Systems For Alternative Sustainable Energy
Production. FAO - Food and Agriculture Organization of the United Nations, 1997
[11] Moodie, H. L dan D. R. Woods, Isolation of Obligate Anaerobic Faecal Bacteria Using an Anaerobic Glove Cabinet. Department of Botany and Microbiology, Rhodes University, Grahamstown, GP, 1973 0 20 40 60 80 100 120 BT 1 BT 2 BT 3 BG 1 BG 2 BG 3 BG 4 kontrol P e rs e n ta se B io ga s Kode Isolat
Biogas pada Medium Limbah
Organik Cair
oksigen nitrogen
[12] Nelson, D. L. dan Michael M. C., Lehninger: Principles Of Biochemistry. 4th edition., Worth Publishers. Inc, New York, 2004
[13] Suyasa, I. W. B dan W. Dwijani., Pengaruh Penambahan Urea, Kompos Cair, Dan Campuran Kompos Dengan Gula Terhadap Kandungan Bod Dan Cod Pada Pengolahan Air Limbah Pencelupan, Lab. Kimia Lingkungan Fmipa, Universitas Udayana, Ecotrophic 4 (1) : 62-65, 2007
[14] William, T. S., Genetic Engineering of Escherichia coli to Enhance Biological Hydrogen Productionfrom Biomass-derived sugars. Department of Molecular Biology and Microbiology, Burnett College of Biomedical Sciences, UCF, 2005
[15] Wirda, F. R dan Handajani, M., Degradation Of Organic Compound In Liquid Phase Of Biowaste With Wash Water Variation At Ratio 1:2 In Reaktor Batch, Program Studi Teknik Lingkungan Fakultas Teknik Sipil dan Lingkungan, Institut Teknologi Bandung, 2009