i Puslitbang tekMIRA Jl. Jend. Sudirman No. 623 Bandung 40211
Telp : 022-6030483 Fax : 022-6003373
E-mail : Info@tekmira.esdm.go.id
LAPORAN Kelompok Teknologi Pengolahan dan Pemanfaatan Mineral
PENELITIAN PENGOLAHAN DAN KAJIAN PENGUSAHAAN
LOGAM TANAH JARANG DARI MONASIT
Oleh :
Isyatun Rodliyah, dkk.
PUSLITBANG TEKNOLOGI MINERAL DAN BATUBARA 2013
i
SARI
Logam tanah jarang (LTJ) memegang peranan yang penting dalam kebutuhan material produksi modern seperti dalam dunia superkonduktor, laser, optik elektronik, aplikasi LED dan iPAD, glass dan keramik. Di Indonesia terdapat 2 jenis mineral yang mengandung LTJ yaitu monasit dan senotim. Mineral –mineral tersebut belum diolah lebih lanjut untuk memperoleh logam-logam tanah jarang murni atau dalam bentuk oksidanya, karena keterbatasan penguasaan kita tentang teknologi pengolahannya, sehingga masih perlu ditingkatkan dan dimantapkan.
Penelitian ini bertujuan mendapatkan hasil yang optimal pada proses reduksi CeO2 dan Y2O3 menjadi logam Ce dan Y, menghitung keekonomian proses pengolahan LTJ dari monasit hingga didapatkan oksida logam tanah jarang dan mengetahui dampak lingkungan pengolahan monasit dengan metode asam ataupun basa. Hasil-hasil percobaan untuk mengekstraksi LTJ dari monasit dengan metode asam diperoleh persen ekstraksi Ce tertinggi yaitu 99,08% yang dicapai pada konsentrasi asam sulfat (v/v) 1:1, suhu proses 220oC dan waktu ekstraksi120 menit. Larutan hasil ekstraksi selanjutnya diendapkan dengan menambahkan natriun hidroksida untuk menghasilkan LTJ-hidroksida yang selanjutnya dilakukan kalsinasi pada suhu 900oC selama 3 jam untuk menghasilkan LTJ-oksida. Karakterisasi LTJ-oksida yang dihasilkan adalah: Ce 29,10%; Gd 1,54%; Y 1,53%; Nd 11,53%, La 14,02%, Dy 0,489%; dan Sm 1,85%. Reduksi serium oksida menjadi logam Ce dengan kadar 50% Ce dan perolehan 91% diperoleh pada kondisi perbandingan umpan dan reduktornya 1:1, penambahan fluks 1%, dan suhu proses mencapai 1200 oC selama 3 jam.
Dampak lingkungan dari metode ekstraksi LTJ (asam dan basa) dari monasit menunjukkan bahwa metode asam menimbulkan kerusakan lingkungan yang lebih kecil dibandingkan dengan metode basa. Kajian keekonomian menunjukkan bahwa proses dengan asam dihitung dari neraca bahan dan produk yang dihasilkan layak untuk dikembangkan ke skala yang lebih besar.
ii DAFTAR ISI
BAB I PENDAHULUAN ... 1
1.1.
Latar Belakang ... 1
1.2.
Ruang Lingkup Kegiatan ... 3
1.3.
Tujuan... 4
1.4.
Sasaran ... 4
1.5.
Lokasi/ Tempat Pelaksanaan Kegiatan ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1.
Ekstraksi LTJ dari Monasit ... 5
2.2.
Reduksi Oksida LTJ menjadi Logam ... 8
2.3.
Kajian lingkungan dengan MIPS ... 11
BAB III PROGRAM KEGIATAN ... 14
3.1.
Persiapan ... 14
3.2.
Pengolahan Monasit ... 15
3.3.
Kajian Lingkungan Proses ... 16
3.4.
Kajian Keekonomian Proses ... 16
3.5.
Pembuatan Laporan Akhir ... 16
BAB IV METODOLOGI ... 17
4.1.
Peralatan ... 17
4.2.
Bahan ... 17
4.3.
Metode ... 17
BAB V HASIL DAN PEMBAHASAN ... 20
5.1.
Proses Ekstraksi LTJ dengan Metode Asam ... 20
5.2.
Reduksi CeO2 menjadi logam Ce ... 26
5.3.
Reduksi Y2O3 menjadi Y ... 33
5.4.
Kajian Lingkungan Proses ... 36
5.5.
Data masukan metode asam ... 37
5.6.
Kajian Keekonomian Proses ... 38
iii
DAFTAR TABEL
Tabel 5. 1 Komposisi unsur tanah jarang pasir monasit PT. MPS ... 20
Tabel 5. 2 Komposisi kimia konsentrat monasit ... 22
Tabel 5. 3 Komposisi kimia produk LTJ-oksida ... 23
Tabel 5. 4 Komposisi unsur LTJ pada LTJ-hidroksida... 26
Tabel 5. 5 Komposisi unsur LTJ pada LTJ-Oksida ... 26
Tabel 5. 6 Komposisi unsur LTJ pada Serium oksida ... 26
Tabel 5. 7 Komposisi unsur LTJ pada itrium oksida ... 33
Tabel 5. 8 Data cadangan mineral ikutan pencucian bijih timah 31 Oktober 2008 (Suprapto,
2008) ... 39
Tabel 5. 9 Neraca bahan untuk pembuatan LTJ-oksida ... 40
iv
DAFTAR GAMBAR
Gambar 1. 1 unsur LTJ (warna kuning) dalam sistem periodik unsur... 1
Gambar 1. 2 Diagram alir penelitian... 3
Gambar 2. 1 Jalur proses produksi LTJ dari bijih (Gupta dan Krishnamurthy, 2005) ... 5
Gambar 2. 2 Diagram alir proses ekstraksi LTJ metode asam ... 6
Gambar 2. 3 Diagram alir proses ekstraksi LTJ metode asam dengan pengendapan
LTJ-oksalat ... 7
Gambar 2. 4 Grafik titik leleh-didih logam tanah jarang (Riedemann, 2011) ... 9
Gambar 2. 5 Grafik titik didih- leleh LTJ berdasarkan kenaikan berat atomnya (Riedemann,
2011) ... 10
Gambar 4. 1 Diagram alir reduksi CeO2 dari monasit ... 18
Gambar 4. 2 Diagram alir proses reduksi Ce- dan Y-oksida menjadi logam Ce dan Y ... 18
Gambar 5. 1 Foto pasir monasit ... 20
Gambar 5. 2 Diagram alir pengolahan monasit menjadi LTJ-oksida dengan metode asam
(Bintari, 2003) ... 21
Gambar 5. 3 Pengaruh jenis asam dan konsentrasi terhadap % ekstraksi Ce ... 23
Gambar 5. 4 Pengaruh oksidator terhadap %ekstraksi Ce ... 24
Gambar 5. 5 Endapan LTJ pirofosfat dan hidroksida yang terbentuk ... 25
Gambar 5. 6 Foto Serium oksida PTAPB Batan... 27
Gambar 5. 7 Analisis SEM X-Ray Mapping untuk lelehan dengan fluks ... 28
Gambar 5. 8 Analisis SEM X-Ray Mapping untuk terak dengan fluks ... 28
Gambar 5. 9 Hasil Analisis SEM X-Ray Mapping untuk lelehan dengan tanpa fluks ... 28
Gambar 5. 10 Hasil Analisis SEM X-Ray Mapping untuk terak dengan tanpa fluks ... 29
Gambar 5. 11 Hasil analisis XRD untuk fasa logam ... 29
Gambar 5. 12 analisis XRD untuk fasa terak ... 29
Gambar 5. 13 Foto penampakan logam serium ... 30
Gambar 5. 14 Hasil analisis SEM X-Ray Mapping pada fasa logam... 30
Gambar 5. 15 Hasil analisis SEM X-Ray Mapping pada fasa terak... 31
Gambar 5. 16 Pengaruh komposisi umpan/reduktor terhadap kadar logam pada fasa logam . 31
Gambar 5. 17 analisis SEM fasa logam untuk komposisi 1:2 ... 32
Gambar 5. 18 Hasil analisis SEM fasa terak untuk komposisi 1:1 ... 32
Gambar 5. 19 Pengaruh suhu terhadap kadar logam pada fasa logam ... 33
Gambar 5. 20 Foto itrium oksida ... 34
Gambar 5. 21 Grafik energi bebas LTJ- dan logam- oksida terhadap suhu ... 34
Gambar 5. 22 Grafik energi bebas LTJ- dan logam- klorida terhadap suhu... 35
Gambar 5. 23 Grafik energi bebas LTJ- dan logam- fluorida terhadap suhu ... 35
Gambar 5. 24 Metode asam ... 36
Gambar 5. 25 Metode basa ... 37
Gambar 5. 26 Dampak lingkungan akibat kedua metode ekstraksi ... 37
Gambar 5. 27 Cadangan dan perbandingan mineral ikutan di berbagai daerah
(Suprapto, 2008) ... 40
1
BAB I
PENDAHULUAN
1.1. Latar Belakang
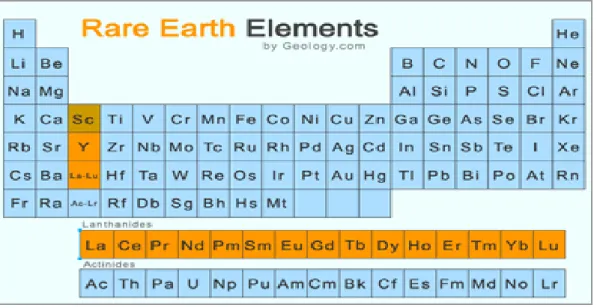
Logam tanah jarang (LTJ) merupakan kelompok logam yang keberadaannya sangat jarang atau berasosiasi dengan unsur logam lain dalam jumlah yang kecil. Kelompok logam tanah jarang merupakan kelompok lantanida dalam periodik unsur yang memiliki anggota 14 unsur yaitu: Ce-Pr-Nd-Pm-Sm-Eu-Gd-Tb-Dy-Ho-Tr-Tm-Yb-Lu. Logam grup lain yang sering berasosiasi dalam mineral yang sama adalah Sc-Y-La (Castor dan Hendrick, 2011). Keberadaan unsur logam tanah jarang dalam sistem tabel periodik unsur seperti terlihat pada Gambar 1.1. Logam tanah jarang diklasifikasikan menjadi dua, yaitu logam tanah jarang ringan atau grup serium (Ce, Pr, Nd, Pm, Sm, Eu) dan logam tanah jarang berat (Gd, Tb, Dy, Ho, Tr, Tm, Yb, Lu). Logam tanah jarang ringan keberadaannya lebih banyak dibandingkan dengan logam tanah jarang berat. Pada kenyataannya keberadaan LTJ di lapisan bumi tidaklah jarang. Serium, lantanum, neodimium, dan itrium sebenarnya lebih umum kelimpahannya dibandingkan timbal dan perak (Atmawinata, 2011).
Gambar 1. 1 unsur LTJ (warna kuning) dalam sistem periodik unsur
Oksida logam tanah jarang memegang peranan yang sangat penting dalam kebutuhan material produksi modern seperti dalam dunia superkonduktor, laser, optik elektronik, aplikasi LED dan iPAD, glass dan keramik. Kebutuhan industri oksida LTJ dunia lebih dari 90% disediakan oleh Cina. Sejak tahun 2004 Cina mengurangi ekspor LTJ untuk memasok kebutuhan dalam negerinya, sedangkan kebutuhan terhadap oksida LTJ dunia dari tahun ke tahun semakin meningkat, sehingga penyediaan LTJ dari sumber-sumber negara lain sangat dibutuhkan termasuk Indonesia karena memiliki potensi LTJ yang sangat besar.
2 Di Indonesia terdapat 2 jenis mineral yang mengandung LTJ, yaitu monasit dan senotim. Hasil studi BATAN di daerah produksi timah menunjukkan ada beberapa daerah potensi monasit, yaitu Bangka-Belitung, Karimata/Ketapang, Rirang-Tanah Merah (Atmawinata, 2011). Potensi monasit ini telah diketahui oleh Cina sehingga berminat untuk membelinya bahkan dengan harga puluhan juta per kilogramnya (Atmawinata, 2011).
Monasit tersebut belum diolah lebih lanjut untuk memperoleh logam-logam tanah jarang murni atau dalam bentuk oksidanya, karena penguasaan kita tentang teknologi pengolahannya masih perlu ditingkatkan dan dimantapkan. Sesuai dengan amanat Undang-Undang No. 4 Tahun 2009 tentang Pertambangan Mineral dan Batubara yang bertujuan memaksimalkan pengolahan mineral dan batubara di dalam negeri maka pengolahan monasit di dalam negeri merupakan amanat Undang-undang yang harus ditaati. Hal ini juga diperkuat dengan dikeluarkan Peraturan Menteri ESDM No. 7 Tahun 2012 yang sudah direvisi menjadi Permen ESDM No. 20 Tahun 2013 tentang peningkatan nilai tambah mineral melalui kegiatan pengolahan dan pemurnian mineral khususnya pada Bab II pasal 5 ayat (2) yang menyatakan bahwa produk samping/sisa hasil pengolahan dan/atau pemurnian komoditas tambang mineral logam timah berupa zirkon, ilmenit, rutil, monasit, senotim, dan terak wajib dilakukan pengolahan dan/atau pemurnian di dalam negeri.
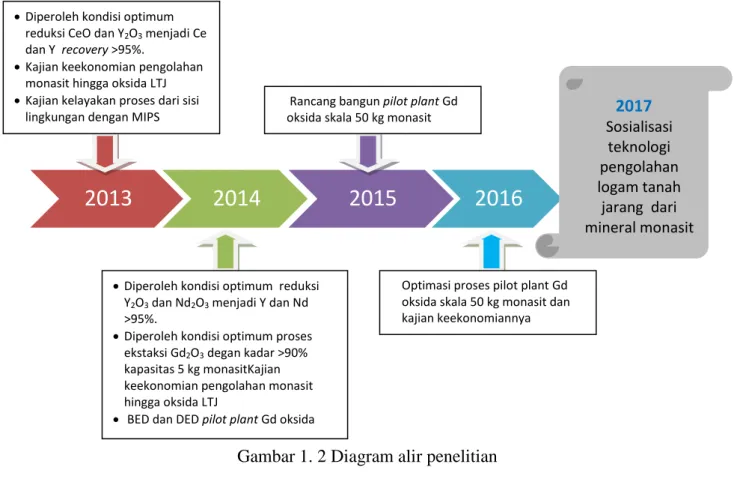
Sejalan dengan kondisi tersebut perlu dilakukan penelitian tentang ekstraksi logam tanah jarang dari monasit untuk mendorong pengolahan dan pemurnian LTJ dalam negeri. Penelitian yang dilakukan adalah penelitian multi years (5 tahun). Tahun anggaran 2013 difokuskan pada proses reduksi serium oksida dan itrium oksida menjadi logam Ce dan Y, kajian keekonomian mengenai proses pengolahan LTJ dari monasit hingga oksida logam tanah jarang dan
kajian lingkungan dengan metode MIPS
untuk proses asam dan basa
. Tahun anggaran 2014 penelitian difokuskan pada proses reduksi neodimium oksida menjadi logam Nd dan ekstraksi gadolinium oksida dari monasit skala 5 kg. Untuk tahun anggaran 2015 penelitian difokuskan pada rancang bangun pembuatan pilot plant gadolinium oksida dengan kapasitas 50 kg/monasit. Tahun anggaran 2016 pengolahan gadolinium oksida kapasitas 50 kg/monasit serta kajian keekonomiannya. Pada 2017 diharapkan sudah dapat dilakukan ke pemangku kepentingan tentang pengolahan logam tanah jarang. Roadmap penelitian ini dapat dilihat pada Gambar 1.2.3
1.2. Ruang Lingkup Kegiatan
Ruang lingkup kegiatan penelitian tahun anggaran 2013 adalah sebagai berikut : 1) Pembuatan rencana operasional kegiatan penelitian;
2) Karakterisasi sampel/monasit yang digunakan dalam penelitian;
3) Melakukan proses ekstraksi logam tanah jarang dari mineral monasit hingga mendapatkan oksida logam tanah jarang dengan metode asam;
4) Karakterisasi sampel yang akan digunakan untuk proses reduksi (serium oksida dan itrium oksida);
5) Melakukan proses reduksi serium oksida dan itrium menjadi logam serium dan itrium;
6) Melakukan kajian keekonomian pengolahan monasit hingga diperoleh oksida logam tanah jarang;
7) Melakukan kajian lingkungan terhadap proses ekstraksi logam tanah jarang baik dengan metode asam ataupun basa melalui menggunakan MIPS;
8) Pembuatan laporan akhir.
2013
2014
2015
2016
Diperolehnya kondisi optimumproses ekstraksi Sm dan Gd recoveri >95%
kelayakan dan kebijakan pembangunan smelter (custom plant) sesuai dengan PP no.11/2012, PP no.23/2010, dan Perpres 32/27 MP3EI
Kajian upaya pengelolaan lingkungan
2017
Sosialisasi teknologi pengolahan logam tanah jarang dari mineral monasit Diperoleh kondisi optimumreduksi CeO dan Y2O3 menjadi Ce
dan Y recovery >95%.
Kajian keekonomian pengolahan monasit hingga oksida LTJ
Kajian kelayakan proses dari sisi lingkungan dengan MIPS
Diperoleh kondisi optimum reduksi Y2O3 dan Nd2O3 menjadi Y dan Nd
>95%.
Diperoleh kondisi optimum proses ekstaksi Gd2O3 degan kadar >90%
kapasitas 5 kg monasitKajian keekonomian pengolahan monasit hingga oksida LTJ
BED dan DED pilot plant Gd oksida
Rancang bangun pilot plant Gd oksida skala 50 kg monasit
Optimasi proses pilot plant Gd oksida skala 50 kg monasit dan kajian keekonomiannya
4
1.3. Tujuan
Tujuan penelitian adalah:
1) Penguasaan teknologi proses ekstraksi dan reduksi LTJ khususnya Ce dan Y;
2) Tersedianya data keekonomian proses pengolahan LTJ dari monasit hingga didapatkan oksida logam tanah jarang;
3) Tersedianya data dampak lingkungan proses pengolahan monasit dengan metode asam dan basa.
1.4. Sasaran
Sasaran yang hendak dicapai adalah:
a) mendapatkan hasil yang optimal pada proses reduksi CeO2 dan Y2O3 menjadi logam Ce dan Y. Hasil yang diharapkan adalah recoveri logam Ce dan Y >90%;
b) Menghitung keekonomian proses pengolahan LTJ dari monasit hingga didapatkan oksida logam tanah jarang;
c) Mengetahui dampak lingkungan proses pengolahan monasit dengan metode asam ataupun basa.
1.5. Lokasi/ Tempat Pelaksanaan Kegiatan
Lokasi pengambilan sampel monasit dan pengumpulan data keekonomian dilakukan di Propinsi Bangka-Belitung, Ketapang di Propinsi Kalimantan Barat, serta di PTAPB dan PPGN Batan. Percobaan penelitian dilakukan di laboratorium Teknologi Pengolahan Mineral, Puslitbang Teknologi Mineral dan Batubara (tekMIRA) Bandung.
5
BAB II
TINJAUAN PUSTAKA
Monasit merupakan sumber utama logam tanah jarang ringan yang diperoleh sebagai produk samping penambangan dan pengolahan mineral berat seperti ilmenit, rutil, zirkon (Australia, Brazilia, Cina dan India), serta kasiterit, ilmenit dan zirkon (Malaysia, Thailand dan Indonesia). Di Indonesia terdapat beberapa daerah potensi deposit monasit, yaitu Bangka-Belitung, Karimata/Ketapang, dan Rirang-Tanah Merah (Atmawinata, 2011). LTJ tidak ditemukan sebagai unsur bebas dalam lapisan kerak bumi, tetapi berbentuk senyawa kompleks. Untuk mendapatkan unsurnya, perlu dilakukan proses pemisahan terlebih dahulu dari senyawa kompleks tersebut. Jalur proses produksi logam tanah jarang dari bijih dapat dilihat pada Gambar 2.1.
Gambar 2. 1 Jalur proses produksi LTJ dari bijih (Gupta dan Krishnamurthy, 2005)
2.1. Ekstraksi LTJ dari Monasit
Ekstraksi LTJ dari monasit dapat dilakukan dengan 2 cara, yaitu: metode basa (melarutkan konsentrat monasit dalam larutan alkali) dan metode asam (melarutkan dalam larutan asam).
6
2.1.1 Metode Asam
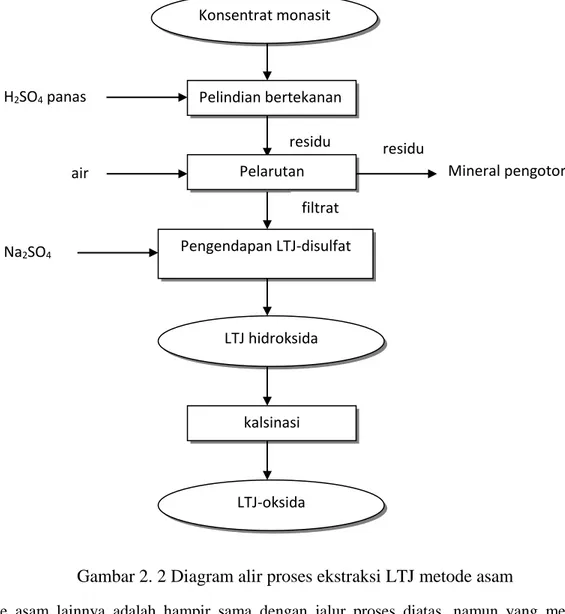
Metode asam dilakukan dengan cara pelindian bertekanan dalam autoclave menggunakan asam sulfat pada suhu 200 – 220oC dan dilanjutkan dengan pelarutan menggunakan air untuk membentuk larutan stabil dari sulfat- LTJ, Th, dan U. Residu yang dihasilkan mengandung silika dan mineral pengotor lainnya. Penambahan natrium sulfat akan menyebabkan LTJ mengendap sebagai endapan disulfat (RE2(SO4)3.Na2SO4.3H2O) yang merupakan LTJ-ringan. Th, beberapa LTJ-berat dan pengotor lainnya seperti besi dan uranium tetap tinggal sebagai larutan. Akan tetapi, torium dalam jumlah signifikan juga ikut mengendap dengan LTJ-disulfat, sehingga membutuhkan proses pemurnian yang kompleks. Alasan tersebut menyebabkan metode asam ini tidak digunakan karena tidak menghasilkan produk yang murni. Diagram alir proses ekstraksi LTJ dengan metode asam dapat dilihat pada Gambar 2.2.
Gambar 2. 2 Diagram alir proses ekstraksi LTJ metode asam
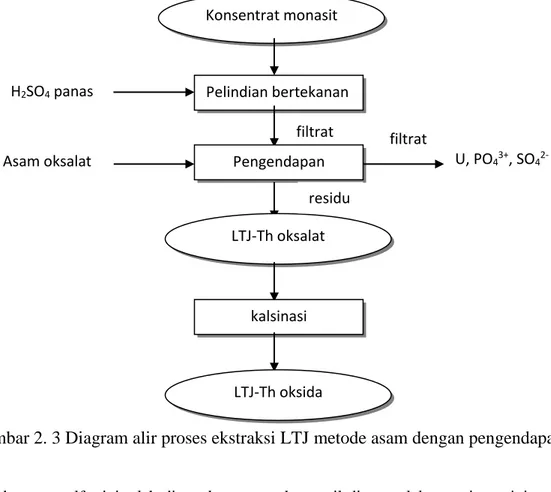
Metode asam lainnya adalah hampir sama dengan jalur proses diatas, namun yang membedakan adalah dengan mengendapkan LTJ dan Th dalam bentuk endapan LTJ, Th-oksalat menggunakan asam oksalat serta pelindian dengan asam nitrat sehingga LTJ akan larut dan Th akan tetap mengendap. Diagram alir proses ekstraksi LTJ metode asam dengan pengendapan LTJ-oksalat ditunjukkan pada Gambar 2.3. Konsentrat monasit Pelindian bertekanan H2SO4 panas residu Pelarutan air LTJ hidroksida kalsinasi LTJ-oksida residu Mineral pengotor filtrat Pengendapan LTJ-disulfat Na2SO4
7 Metode asam sulfat ini telah digunakan secara komersil di masa lalu tetapi saat ini metode tersebut sudah tidak digunakan karena tidak menghasilkan produk yang murni.
2.1.2 Metode Basa
Metode basa meliputi pelindian bertekanan menggunakan larutan natrium hidroksida pada suhu 140 – 150 oC selama 3 -9 jam dalam 60 -70% larutan natrium hidroksida. Dibutuhkan natrium hidroksida sebanyak 0,75 kg/1kg monasit untuk kesempurnaan reaksi. Reaksi ini mengubah LTJ dan torium dalam bentuk hidroksida. Senyawa fosfat dipisahkan dengan melarutkan LTJ dan torium hidroksida dalam air panas sehingga akan membentuk larutan trisodium fosfat (Na3PO4), sedangkan LTJ dan torium-hidroksida dalam bentuk padatan . Reaksi yang terjadi dalam proses ini adalah (Shwe dkk., 2008):
RE(PO4) (s) + 3NaOH (aq) ⟶ RE(OH)2 (s) + Na3PO4 (aq) Th3(PO4)4 (s) + 12NaOH (aq) ⟶ 3Th(OH)4 (s) + 4Na3PO4 (aq)
Larutan trisodium fosfat yang dihasilkan dari reaksi ini mengandung campuran fosfat 99,7% dan natrium hidoksida dengan konsentrasi 47%. Larutan selanjutnya diproses dalam evaporator vakum untuk membentuk kristal Na3PO4. Kristal selanjutnya dipisahkan dari larutan NaOH dengan sentrifugal dan dikeringkan dengan hot air pneumatic conveyor sampai menghasilkan produk yang
Konsentrat monasit Pelindian bertekanan H2SO4 panas filtrat Pengendapan Asam oksalat LTJ-Th oksalat kalsinasi LTJ-Th oksida filtrat U, PO43+, SO42- residu
8 mengandung P2O5 dengan kadar 17,5-19%. Padatan yang mengandung campuran hidroksida dari LTJ, Th bersama-sama dengan uranium, besi, dan titanium ditambahkan larutan HCl 30% dengan mengatur pH luluhan pada 3-4 dan suhu 70-80oC. Dengan perbedaan kebasaan masing-masing senyawa, sebagian besar LTJ (97,7%) larut sebagai klorida dan sebagian besar senyawa-senyawa lainnya akan menjadi padatan hidroksida. Reaksi yang terjadi dalam proses ini adalah (Shwe dkk., 2008):
RE(OH)3 (s) + 3HCl (aq) ⟶ RECl3 (aq) + H2O (aq)
Larutan LTJ-klorida masih mengandung pengotor seperti torium, uranium, besi dan radium. Pengotor tersebut dapat dihilangkan dengan menambahkan natrium hidroksida dan mengatur pH pada 5,8, sehingga torium, uranium dan besi mengendap. Diagram alir proses ekstraksi LTJ dengan metode basa ditunjukkan pada Gambar 2.4. Metode basa ini lebih disukai dan paling banyak digunakan di dunia karena lebih ekonomis, mudah dalam penanganannya dan dapat menghasilkan produk samping yang dapat dijual yaitu fosfat, sedangkan pada metode asam fosfat akan hilang.
2.2. Reduksi Oksida LTJ menjadi Logam
Logam-logam tanah jarang dapat dipisahkan dengan mereduksi oksidanya menjadi logam dengan kemurnian hampir 95% tergantung pada pengotornya. Metode untuk mereduksi oksida-LTJ dapat dilakukan melalui:
- proses elektrolisis; - proses metalotermik 1. Proses elektrolisis
Proses ini dibagi menjadi dua :
dekomposisi dari RE-Cl3 dengan melarutkannya dalam lelehan garam alkali atau alkali tanah;
dekomposisi RE-oksida dengan melarutkannya dalam garam fluorida.
Metode elektrolisis ini memiliki beberapa kelemahan, yaitu: penggunaan elektroda yang mahal dan cukup konsumtif, penggunaan garam klorida atau fluorida untuk mencegah pembentukan garam REOCl yang tidak diinginkan, membutuhkan suhu tinggi (>1000oC), perolehan logam rendah (<40%) serta proses reduksi RE-Cl3 akan menghasilkan gas klorin yang sangat korosif. Kelebihannya adalah proses ini dapat dilakukan secara kontinu.
2. Proses Metalotermik
Proses ini dibagi menjadi dua, yaitu:
reduksi RE-F3 dengan logam Ca (calciothermic process);
9 Proses metalotermik ini memiliki kerugian yaitu: suasana proses non-oksidasi dan membutuhkan energi yang tinggi. Kelebihannya perolehan logam yang dihasilkan >90%. Proses metalotermik yang sedang dikembangkan saat ini adalah Ames Process di Amerika. Ames Process ditujukan untuk membuat logam tanah jarang dengan kemurnian tinggi dan mendapatkan uranium untuk proyek Manhattan melalui reduksi metalotermik dari garam-logam menggunakan logam alkali tanah.
2RF3 + 3Ca -> 2R + 3CaF2
Dalam proses ini, tanah jarang fluorida (RF3) direduksi dengan logam Ca menghasilkan logam tanah jarang dan terak kalsium fluorida. RF3 dihasilkan dengan mereaksikan tanah jarang oksida (R2O3) dengan asam fluorida (HF) sesuai dengan reaksi di bawah ini:
R2O3 + 6HF -> 2RF3 + 3H2O
Selain itu, Proses Ames juga mencakup reduksi langsung dari oksida tanah jarang dengan lantanum untuk empat logam tanah jarang yang memiliki tekanan uap sangat tinggi yaitu Sm, Eu, Tm, dan Yb.
R2O3 + 2La -> La2O3 + 2R(g)
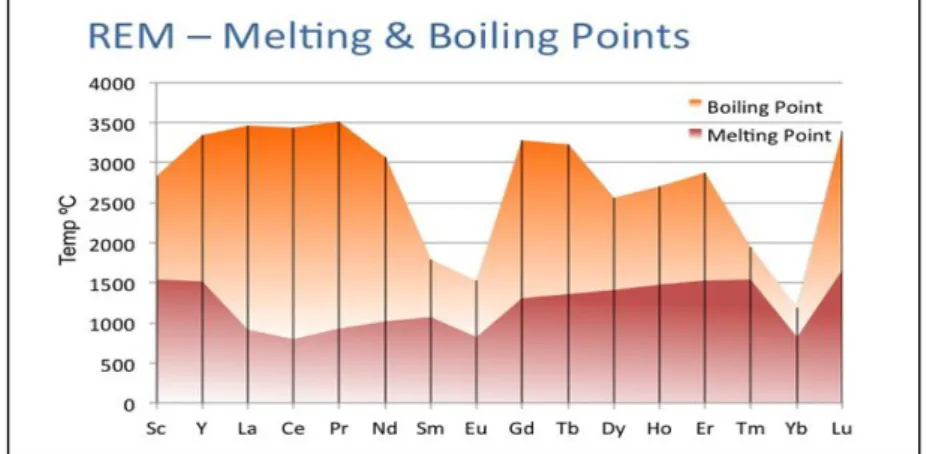
Penggunaaan logam lantanum untuk mereduksi langsung oksida tanah jarang, spesies yang memiliki tekanan uap tinggi dipisahkan dengan cara sublimasi, sehingga keluar sebagai gas yang terkondensasi kemudian dipadatkan dalam kondensor. Pemilihan metode untuk mereduksi oksida tanah jarang dapat ditentukan berdasarkan titik leleh-didih logam tanah jarang yang dapat dilihat pada grafik di Gambar 2.4.
Gambar 2. 4 Grafik titik leleh-didih logam tanah jarang (Riedemann, 2011)
Dari grafik terlihat jelas titik didih dan leleh tiap-tiap logam tanah jarang. Titik didih merupakan indikator tekanan uap relatif terhadap masing-masing logam. Jika grafik tersebut disusun ulang berdasarkan kenaikan berat atom terhadap kenaikan titik didih maka akan diperoleh grafik seperti pada Gambar 2.5.
10
Gambar 2. 5 Grafik titik didih- leleh LTJ berdasarkan kenaikan berat atomnya (Riedemann,
2011)
Jalur proses untuk membuat logam tanah jarang dapat ditentukan berdasarkan 4 (empat) jalur proses seperti pada grafik diatas. Keempat jalur proses tersebut:
( 1 ) Titik leleh rendah ke leleh tinggi, sangat tinggi tekanan uap logam • reduksi langsung oksidanya/sublimasi
• pemurnian dilakukan dengan sublimasi
( 2 ) Titik leleh tinggi, cukup tinggi tekanan uap logam • reduksi dengan logam kalsium dari bentuk fluoridanya
• vacuum casting untuk menghilangkan pengotor yang mudah menguap • sublimasi untuk menghilangkan spesies yang tidak menguap
( 3 ) Titik leleh sedang ke titik leleh tinggi, tekanan uap logam sedang • reduksi dengan logam kalsium dari bentuk fluoridanya
• vacuum casting untuk menghilangkan pengotor yang mudah menguap • distilasi untuk menghilangkan spesi yang tidak mudah menguap
( 4 ) Titik leleh rendah, tekanan uap logam rendah • reduksi dengan logam kalsium dari fluoridanya
• vacuum casting untuk menghilangkan pengotor yang mudah menguap • pengendapan tantalum ( Ta )
Pada proses ke-4, tekanan uap menurun ke tingkat yang rendah sehingga tidak dapat dilakukan proses sublimasi atau distilasi. Neodimium ( Nd ) memiliki tekanan uap yang mendekati skandium ( Sc ), namun Nd memiliki kelarutan yang jauh lebih rendah dari Ta, sehingga kemurnian Nd tinggi untuk proses ke-4 ini.
11
2.3. Kajian lingkungan dengan MIPS
Ekstraksi (LTJ) dapat dilakukan menggunakan dua metode berbeda, yaitu asam dan basa (Suprapto,
2008
). Kedua metode tersebut memiliki pengaruh terhadap lingkungan. Faktor lingkungan menjadi salah satu pertimbangan bagi pemilihan metode yang akan diterapkan pada skala yang lebih besar nantinya. Hal ini terkait dengan pembangunan berkelanjutan yang bersendikan tiga pilar utama yaitu lingkungan, sosial dan ekonomi.Faktor lingkungan sangat berpengaruh dalam suatu ekosistem. Faktor lingkungan akan mempengaruhi sumber kehidupan mahluk hidup di dalamnya. Lingkungan yang baik membuat komponen fisik dan non fisik dalam suatu ekosistem berfungsi dengan sempurna. Demikian pula sebaliknya.
Setiap proses produksi ditekankan untuk mengurangi kerusakan lingkungan yang ditimbulkannya. Untuk mewujudkan hal tersebut diterapkan suatu sistem pengelolaan lingkungan (environmental management system). Sistem pengelolaan lingkungan sebenarnya dapat menggambarkan kondisi lingkungan dan keuntungan ekonominya. Pengelolaan lingkungan sendiri, saat ini telah diatur secara internasional melalui ISO 14001 sebagai acuannya. Akan tetapi, hal ini belumlah cukup karena standar tersebut tidak dapat mengukur tingkat kerusakan lingkungan. Lingkungan tidak dapat dikelola dengan baik tanpa adanya sebuah ukuran mengenai tingkat kerusakannya.
Metode yang digunakan untuk mengukur tingkat kerusakan lingkungan adalah metode material input per unit of service (MIPS) (Bintari dkk., 2003). Metode ini mengarah pada pengelolaan sumber daya alam sebagai indikator untuk mengukur tekanan lingkungan. Konsep MIPS dapat digunakan untuk mengukur eko-efisiensi dari suatu produk atau jasa dan dapat diaplikasikan pada semua skala mulai dari produk tunggal hingga system yang komplek.
Konsep MIPS dicetuskan pertama kali oleh Prof. Dr. Friedrich Schimdt Blek pada 1989. Penekanannya terletak pada dematerialisasi dan pengelolan sumber daya dalam pembangunan keberlanjutan (Messner, 2010). Pada 1992 konsep ini dikembangkan oleh Divisi Material Flow and Structural Change di Wuppertal Institute Germany dibawah bimbingan Prof. Dr. Friedrich Schimdt Blek sebagai vice presiden. Pada 1993 dikembangkan teori dan penghitungan MIPS yang dimulai dengan menganalisis intensitas bahan (material intensity) dalam bahan-bahan tertentu. Kemudian pada 1994 diterbitkan buku berjudul Wiefel Umweit braucht der Mensh yang menceritakan kebutuhan sumber daya alam untuk memenuhi kebutuhan manusia oleh Prof. Dr. Friedrich Schimdt Blek. Pada 1995 dilakukan persiapan dasar sistem pengelolaan lingkungan berdasarkan konsep MIPS dengan membandingkan intensitas bahan dari proses yang berbeda pada produksi bahan sintetis. Pada 1996 buku Okologiesche Wirtschaftspolitik oleh Prof. Dr. Friedrich Schimdt Blek diterbitkan dengan menggabungkan aspek ekonomi dan politik yang dikonversi dalam tujuan dari faktor 10. Pada tahun
12 itu juga konsep MIPS diaplikasikan di Eropa oleh European Research Network “CompETE (Competitieveness, Employment, Technology, Environment).
Pada prinsipnya hasil eksploitasi sumber daya alam harus dikelola secara bijaksana. Seperti ungkapan siapa yang menanam akan memetik buahnya. Siapa yang memulai dengan memberikan yang terbaik pada akhirnya dia yang akan mendapatkan yang lebih banyak. Bahan-bahan dan energi tidak hanya dibutuhkan pada saat proses produksi. Namun selama proses transportasi, utilisasi, penyimpanan, daur ulang dan pembuangan.
MIPS adalah suatu metode penghitungan sumberdaya alam yang digunakan selama siklus hidup (life cycle) sebuah produk atau jasa dan mengestimasi dampak lingkungan. MIPS menghitung semua bahan yang berpindah dari tempat asalnya selama siklus hidup. Oleh karenanya hal ini disebut “ecological rucksack”. MIPS secara langsung berhubungan dengan kajian siklus hidup (life cycle assessment). Terdapat 5 (lima) jenis bahan masukan yang dipertimbangkan, yaitu sumberdaya biotik dan abiotik, pemakaian air, udara dan perpindahan tanah (padatan).
Tujuan utama konsep MIPS adalah:
- membuat kebijakan terkait konsumsi bahan; - membuat formula terkait efisiensi sumberdaya;
- indikator keberlanjutan suatu proses produksi dan konsumsi;
- evaluasi dampak lingkungan sebuah produk atau jasa selama daur hidupnya.
Unit servis pada masukan bahan (dalam penghitungan MIPS) adalah sebuah ukuran efisiensi sumberdaya. MIPS dapat pula digunakan untuk mengetahui peningkatan efisiensi dan lebih merupakan suatu metode keberlanjutan dari proses produksi dan konsumsi. Terdapat dua pilihan untuk mengurangi konsumsi bahan per unit servis yaitu mengurangi masukan bahan, misalnya dengan mengurangi pemakaian energi atau bahan baku pada proses produksi, atau dengan meningkatkan turunan jumlah servis unit dari bahan tertentu. Efisiensi sumberdaya dapat ditingkatkan selain dengan mengurangi bahan yang digunakan selama proses produksi atau dengan cara meningkatkan jumlah servisnya.
MIPS mempunyai beberapa kelebihan, di antaranya adalah sebagai berikut: 1. Menjadi sebuah indikator kuantitatif dari potensi dampak lingkungan; 2. Dapat membandingkan dampak lingkungan dari produk, proses dan servis; 3. Dapat mengidentifikasi konservasi sumberdaya;
4. Inovasi proses produksi;
5. Dapat digunakan untuk analisis daur hidup pada tahap prosedur pemilihan sehingga dapat mereduksi pemakaian sumberdaya secara drastis. Keberhasilan analisisnya akan mempermudah tahap perencanaan;
13 6. Sebagai instrument pengukur keberlanjutan secara ekonomi;
7. Dapat merancang proses produksi menjadi ramah lingkungan;
8. Merupakan strategi pengelolaan lingkungan dan konseling pelanggan;
9. Dapat berguna untuk menetukan tarif, isu, asuransi, pajak dan membuat kebijakan terkait subsidi;
10. Berguna untuk menilai karakteristik lingkungan;
11. Menunjukkan harmonisasi global karena keterkaitan antara beberapa sumberdaya dan produk yang dihasilkan.
14
BAB III
PROGRAM KEGIATAN
Kegiatan tahun 2013 terdiri atas 5 (lima) tahap yaitu persiapan, ekstraksi logam tanah jarang dari monasit, kajian lingkungan, keekonomian proses serta pembuatan laporan akhir. Rincian masing-masing tahap sebagai berikut:
3.1.
Persiapan
a. Studi literatur/koordinasi ke instansi terkait
Studi literatur dilakukan untuk memperoleh data sekunder tentang teknologi proses yang sudah ada serta penelitian yang sudah pernah dilakukan yang berkaitan dengan kegiatan. Sumber literatur diperoleh dari perpustakaan-perpustakaan instansi terkait, jurnal elektronik dan laman-laman jaringan elektronik. Koordinasi ke instansi terkait terutama PTAPB dan PPGN dilakukan karena instansi tersebut telah berpengalaman dalam melakukan pengolahan monasit hingga memperoleh oksida logam tanah jarang.
b. Pembuatan Rencana Operasional
Pembuatan rencana operasional dilakukan dari hasil studi literatur dan koordinasi ke instansi terkait dengan bantuan alat-alat tulis kantor.
c. Persiapan peralatan
Peralatan yang tersedia di laboratorium pengolahan mineral Puslitbang tekMIRA yang hendak digunakan yaitu tube furnace, resistance furnace dan muffle furnace disiapkan sehingga dalam kondisi siap pakai. Persiapan peralatan dilakukan oleh para anggota pelaksana kegiatan.
d. Kegiatan lapangan
Kegiatan lapangan bertujuan untuk memperoleh data primer maupun sekunder. Data primer meliputi informasi langsung dari perusahaan–perusahaan penghasil/sumber LTJ, pengambilan dan sampling contoh monasit. Pengambilan contoh dilakukan di lokasi Bangka dan Ketapang. Untuk seluruh kegiatan lapangan dikoordinasi langsung oleh Wakil Ketua Tim, surat menyurat dan admisnistrasi dilakukan oleh Sekretaris Tim.
Hasil dari tahap persiapan adalah tersusunnya Rencana Operasional yang berasal dari penelusuran literatur berupa buku teknis dan ekonomi, dan jurnal elekronik. Selain itu peralatan laboratorium siap pakai serta bahan baku berupa monasit.
15
3.2.
Pengolahan Monasit
Tahapan kegiatan ini terdiri atas pengolahan sampel, karakterisasi sampel dan produk serta koordinasi kegiatan untuk memperoleh metode pendukung selama proses pengolahan sampel berlangsung. Pengolahan sampel dilakukan melalui beberapa kegiatan, yaitu:
Preparasi monasit dan karakterisasi.
Monasit yang digunakan berasal dari PT. Mutiara Prima Sejahtera sebanyak 50 kg. Mineral tersebut terlebih dahulu dipreparasi melalui proses kominusi (pengecilan ukuran) hingga diperoleh ukuran butir -150 mesh dan -200 mesh untuk keperluan karakterisasi. Sampel yang sudah dipreparasi dilakukan karakterisasi dengan metode XRF (X-Ray Flourence) yang dilakukan di Laboratorium Pusat Survey Geologi (PSG) untuk mengetahui jenis dan kandungan logam/unsur yang terdapat dalam monasit, ICP yang dilakukan di Laboratorium Pusat Sumber Daya Geologi (PSDG) untuk menentukan kandungan logam tanah jarangnya dan XRD serta SEM yang dilakukan di Laboratorium Puslitbang tekMIRA untuk melihat jenis mineral dan gambaran morfologinya;
Ekstraksi monasit dengan metode asam.
Ekstraksi monasit dengan metode asam dilakukan di PTAPB-Batan Yogyakarta menggunakan pelarut asam sulfat sehingga diperoleh oksida-logam tanah jarang. Oksida-logam tanah jarang yang didapatkan dari PTAPB sebanyak ±1 kg dengan kemurnian 97%; namun untuk mendapatkan gambaran proses ekstraksi monasit, Puslitbang tekMIRA juga telah melakukan proses ekstraksi monasit dengan metode yang sama juga. Parameter-parameter yang dipelajari adalah jenis pelarut/asam, konsentrasi pelarut dan penambahan oksidator. Filtrat dihasilkan proses pelindian selanjutnya ditambahi air es untuk mengendapkan torium. Filtrat dari proses pengendapan torium selanjutnya ditambahi amonia untuk menghasilkan endapan yang mengandung LTJ. Endapan tersebut selanjutnya dilindi dengan NaOH sehingga diperoleh hidroksida-logam tanah jarang. Setelah diperoleh hidroksida-LTJ dilakukan kalsinasi sehingga didapatkan oksida-LTJ. Endapan terakhir yang dihasilkan dianalisis dengan ICP untuk mengetahui kandungan masing-masing unsur tanah jarangnya;
Reduksi serium oksida (CeO2) menjadi logam Ce.
Proses reduksi dilakukan dengan metode metalotermik menggunakan reduktor logam Mg serta penambahan fluks CaCl2. Parameter-parameter yang dipelajari dalam proses ini adalah jumlah reduktor, komposisi fluks dan suhu proses. Fasa logam/lelehan dan terak yang dihasilkan selanjutnya dipisahkan. Fasa logam dan terak dianalisis dengan ICP untuk mengetahui kandungan masing-masing unsur tanah jarangnya, sedangkan analisis XRD serta SEM untuk lebih memperjelas jenis unsur yang terdapat dalam logam dan terak.
16 Hasil tahap ini adalah didapatkannya kondisi proses untuk menghasilkan oksida logam tanah jarang dan logam serium dengan perolehan tertinggi.
3.3.
Kajian Lingkungan Proses
Metode yang digunakan untuk kajian lingkungan proses ekstraksi logam tanah jarang adalah metode material input per unit of service (MIPS). Proses yang dikaji dengan metode tersebut adalah ekstraksi LTJ dengan asam (asam sulfat)yang telah dilakukan oleh PTAPB-Batan dan ekstraksi dengan basa (natrium hidroksida) oleh PPGN-Batan. Metode ini memperhitungkan jumlah atau konsumsi bahan kimia yang dipakai untuk kedua metode tersebut sehingga dapat diprediksikan dampak proses pengolahannya terhadap lingkungan. Hasil tahap ini adalah diperoleh rekomendasi proses yang memberikan dampak yang lebih kecil terhadap lingkungan.
3.4.
Kajian Keekonomian Proses
Proses yang dikaji keekonomiannya adalah ekstraksi LTJ dengan asam (H2SO4) yang telah dilakukan oleh PTAPB-Batan dan dengan basa (NaOH) oleh PPGN-Batan. Data yang diperlukan dalam kajian ini adalah jumlah atau konsumsi bahan kimia yang dipakai, peralatan, perolehan dan kadar yang diperoleh dari proses tersebut, harga-harga bahan dan produk. Hasil tahap ini adalah diperoleh rekomendasi proses yang lebih ekonomis.
3.5.
Pembuatan Laporan Akhir
Seluruh pelaksanaan dan hasil kegiatan penelitian dituangkan dalam satu laporan akhir yang disertai ringkasan eksekutif. Hasil tahap ini adalah laporan akhir, karya tulis ilmiah.
17
BAB IV
METODOLOGI
4.1. Peralatan
Penggunaan peralatan disesuaikan dengan tahapan kegiatan proses ekstraksi LTJ dari monasit. Tahap kegiatan terdiri atas preparasi sampel, pemisahan LTJ untuk mendapatkan oksida LTJ dan reduksi oksida LTJ menjadi logam. Peralatan yang dipakai untuk setiap tahap adalah sebagai berikut:
1) Preparasi sampel. Monasit yang digunakan digerus dengan ball mill dan ring mill hingga diperoleh ukuran -325 mesh. Peralatan pendukung lain yang diperlukan adalah kuas, splitter, timbangan dan plastik untuk wadah sampel;
2) Proses ekstraksi LTJ dengan metode asam dilakukan dengan alat-alat pelindian yang terdiri atas alat-alat gelas beserta hotplate stirrer yang dapat diatur suhu dan kecepatan pengaduknya. Selain itu diperlukan masker dan sarung tangan sebagai alat bantu keamanan kerja;
3) Proses reduksi menggunakan crucible, resistance furnace, muffle furnace dan tube furnace. Selain itu diperlukan masker, sarung tangan sebagai alat bantu keamanan kerja.
4.2. Bahan
Bahan-bahan yang diperlukan untuk kegiatan penelitian adalah sebagai berikut: 1) Kertas saring Whatman untuk penyaringan dalam proses ekstraksi LTJ; 2) Natrium hidroksida (NaOH) untuk proses ekstraksi LTJ;
3) Asam sulfat (H2SO4) untuk proses ekstraksi LTJ; 4) Asam nitrat (HNO3) untuk proses ekstraksi LTJ; 5) Asam flourosilika (H2SiF6) untuk proses ekstraksi LTJ; 6) Hidrogen peroksida (H2O2) untuk oksidator;
7) Amonia (NH3) untuk proses pengendapan oksida-LTJ; 8) KBrO3 untuk proses ekstraksi LTJ;
9) Sodium sulfat untuk proses ekstraksi LTJ; 10) Kertas pH, untuk mengukur pH;
11) Magnesium butir (Mg) untuk reduktor dalam proses reduksi; 12) Kalsium klorida (CaCl2) untuk fluks dalam proses reduksi
13) Gas argon untuk dialirkan ke proses pada saat reduksi sehingga tidak ada udara luar yang masuk.
4.3. Metode
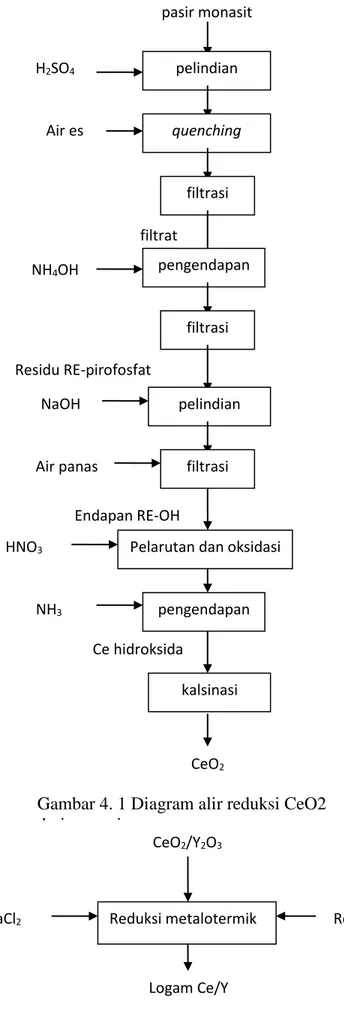
Metode yang dilakukan untuk proses ekstraksi dengan metode asam dan proses reduksi dapat dilihat Gambar 4.1. dan Gambar 4.2.
18 pasir monasit pelindian H2SO4 quenching Air es filtrasi filtrat pengendapan NH4OH filtrasi Residu RE-pirofosfat pelindian NaOH filtrasi Air panas Endapan RE-OH
Pelarutan dan oksidasi
Ce hidroksida HNO3 pengendapan NH3 kalsinasi CeO2 CeO2/Y2O3 Reduksi metalotermik CaCl2 Reduktor Mg Logam Ce/Y
Gambar 4. 2 Diagram alir proses reduksi Ce- dan Y-oksida menjadi logam Ce dan Y
Gambar 4. 1 Diagram alir reduksi CeO2
19 Kajian keekonomian dilakukan dengan menghitung material balance yaitu dengan memperhatikan kebutuhan bahan-bahan kimia yang digunakan dan produk yang dihasilkan dari percobaan yang telah dilakukan.
20
BAB V
HASIL DAN PEMBAHASAN
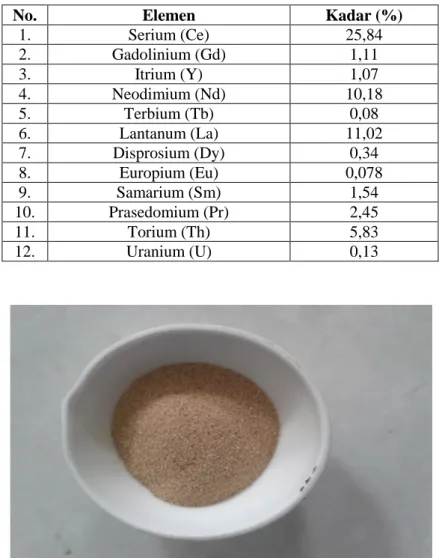
Karakterisasi pasir monasit dari PT. MPS (Mutiara Prima Sejahtera) yang berlokasi di Bangka dilakukan dengan analisa XRF yang dilakukan di Laboratorium Pusat Survey Geologi. Hasil analisis XRF dapat dilihat pada Tabel 5.1. di bawah ini. Gambar pasir monasit dapat dilihat pada Gambar 5.1.
Tabel 5. 1 Komposisi unsur tanah jarang pasir monasit PT. MPS
No. Elemen Kadar (%)
1. Serium (Ce) 25,84 2. Gadolinium (Gd) 1,11 3. Itrium (Y) 1,07 4. Neodimium (Nd) 10,18 5. Terbium (Tb) 0,08 6. Lantanum (La) 11,02 7. Disprosium (Dy) 0,34 8. Europium (Eu) 0,078 9. Samarium (Sm) 1,54 10. Prasedomium (Pr) 2,45 11. Torium (Th) 5,83 12. Uranium (U) 0,13
Gambar 5. 1 Foto pasir monasit
5.1.
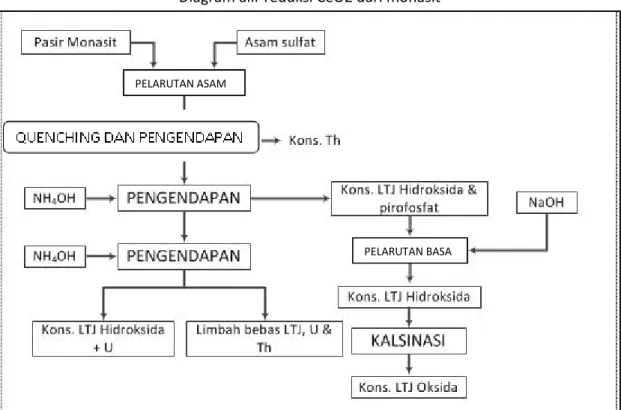
Proses Ekstraksi LTJ dengan Metode Asam
Tahapan proses pengolahan dengan metode asam dapat dilihat pada Gambar 5.2. Proses tersebut sudah dipatenkan oleh PTAPB-BATAN Yogyakarta.
21 Diagram alir reduksi CeO2 dari monasit
Gambar 5. 2 Diagram alir pengolahan monasit menjadi LTJ-oksida dengan metode asam
(Bintari, 2003)
Tahapan proses pengolahan monasit menjadi LTJ-oksida meliputi:
Pelarutan memakai asam sulfat;
Quenching dan pengendapan Th Reaksi yang terjadi :
2 LTJ2(SO4)3 + 6 H3PO4 LTJ4(P2O7)3 + 6 H2SO4 + 3 H2O Th(SO4)2 + 2 H3PO4 Th(P2O7) + 2 H2SO4 + H2O
Torium pirofosfat akan mengendap, sedang LTJ pirofosfat belum mengendap. Pemisahan dengan cara pengendapan dapat terjadi karena perbedaan konstante hasil kali kelarutan ( Ksp ) antara Th dalam bentuk pirofosfat dengan LTJ pirofosfat
Pengendapan LTJ bebas uranium
Filtrat hasil pengendapan Th ditambah amonia sampai terbentuk endapan konsentrat LTJ dengan kandungan Th dan U kecil (ppm). endapan yang terbentuk merupakan campuran antara senyawa pirofosfat dan hidroksida
Reaksi yang terjadi :
2 LTJ2(SO4)3 + 6 H3PO4 LTJ4(P2O7)3 + 6 H2SO4 + 3 H2O LTJ2(SO4)3 + 6 NH4OH 2 LTJ(OH)3 + 3 (NH4)2SO4
Pengendapan LTJ bebas uranium juga terjadi karena perbedaan konstante hasil kali kelarutan antara LTJ hidroksida dengan U hidroksida.
PELARUTAN ASAM
22
Pelarutan basa
Merubah bentuk LTJ pirofosfat menjadi LTJ Hidroksida Na4P2O7 + Na2O ─→ 2Na3PO4
2NaOH ─→ Na2O + H2O
--- + Na4P2O7 + 2NaOH ─→ 2Na3PO4 + H2O
LTJ4(P2O7)3 + 12NaOH ─→ 4LTJ(OH)3 + 3Na4(P2O7) 3Na4P2O7 + 6NaOH ─→ 6Na3PO4 + 3H2O
--- + LTJ4(P2O7)3 + 18NaOH ─→ 4LTJ(OH)3 + 6Na3PO4
Pengendapan LTJ mengandung uranium
filtrat hasil pengendapan LTJ ditambah amonia sampai terbentuk endapan LTJ yang tersisa dengan kandungan Th kecil dan uranium besar. endapan yang terbentuk merupakan senyawa hidroksida
Reaksi yang terjadi :
LTJ2(SO4)3+6 NH4OH2 LTJ(OH)3 + 3 (NH4)2SO4
Kalsinasi konsentrat LTJ Hidroksida menjadi LTJ Oksida
Konsentrat LTJ hidroksida kering dikalsinasi menjadi konsentrat LTJ oksida (sebagai produk utama).
Komposisi kimia konsentrat monasit yang digunakan dalam proses dapat dilihat pada Tabel 5.2, sedangkan karakterisasi produk LTJ-oksida yang dihasilkan dari hasil pengolahan konsentrat monasit dapat dilihat pada Tabel 5.3.
Tabel 5. 2 Komposisi kimia konsentrat monasit
Unsur kadar unsur, % Kadar senyawa fosfat, %
La 11,34 19,10 Ce 18,27 30,67 Nd 8,64 14,33 Pr 0,54 0,91 Th 6,47 10,00 lain-lain (Si, Zr,Sn, Y, Gd, Dy, U) 24,99
23
Tabel 5. 3 Komposisi kimia produk LTJ-oksida
No Senyawa Kadar oksida,% Kadar unsur,%
1 La2O3 29,14 21,35
2 Ce2O3 48,23 35,37
3 Nd2O3 21,07 15,52
4 Pr2O3 1,56 1,14
Jumlah 100,00
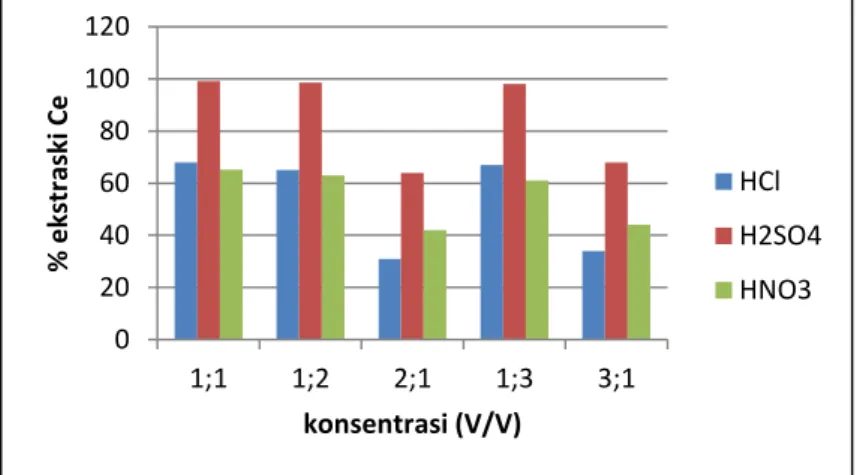
Pasir monasit yang sudah digerus sampai -325 mesh kemudian dilakukan pelindian menggunakan pelarut asam. Parameter yang digunakan dalam percobaan ini adalah jenis pelarut/asam, konsentrasi, dan pengaruh penambahan oksidator. Parameter tetap dalam percobaan ini adalah waktu pelindian (2 jam) , suhu proses (220 oC) dan persen solid (30%). Parameter tetap ditentukan dari percobaan atau penelitian sebelumnya yang dilakukan oleh PTAPB yang menghasilkan persen ekstraksi tertinggi (Purwani, 2013). Pada percobaan parameter asam dan konsentrasi, pelarut yang digunakan adalah asam sulfat, nitrat, dan klorida. Konsentrasi dari masing-masing pelarut adalah 1:1, 1:2; 2:1, 1:3, 3:1. Hasil-hasil percobaan untuk pengaruh jenis pelarut dan konsentrasi terhadap % ekstraksi Ce dapat dilihat pada Gambar 5.3.
Gambar 5. 3 Pengaruh jenis asam dan konsentrasi terhadap % ekstraksi Ce
Gambar 5.3. menunjukkan bahwa pelarut asam yang memberikan persen ekstraksi serium tertinggi adalah asam sulfat. Penambahan asam sulfat akan membentuk larutan LTJ-disulfat yang stabil. Penambahan asam nitrat akan membentuk LTJ-nitrat sedangkan penambahan asam klorida akan menghasilkan LTJ-klorida. Pada percobaan ini pembentukan LTJ-sulfat lebih stabil dibandingkan pembentukan LTJ-nitrat dan LTJ-klorida. Reaksi pembentukan LTJ-sulfat yang terjadi adalah:
2(LTJ)(PO
4) + 3 H
2SO
4 (LTJ)
2(SO
4)
3+ 2 H
3PO
4ThSiO
4+ 2 H
2SO
4 Th(SO
4)
2+ SiO
2+ H
2O
Th
3(PO
4)
4+ 6 H
2SO
4 3Th(SO
4)
2+ 4 H
3PO
4 0 20 40 60 80 100 120 1;1 1;2 2;1 1;3 3;1 % e kstr aski C e konsentrasi (V/V) HCl H2SO4 HNO324
SiO
2.
XH
2O + H
2SO
4 SiO
2+ H
2SO
4.
xH
2O
Persen ekstraksi Ce yang tertinggi yaitu 99,08% dicapai pada konsentrasi asam sulfat (v/v) 1:1, sedangkan ketika konsentrasi diencerkan menjadi 1:2 persen ekstraksi Ce menurun menjadi 98,56%. Hal ini disebabkan karena jumlah asam yang kurang mencukupi untuk bereaksi dengan LTJ membentuk LTJ-sulfat. Sedangkan saat konsentrasi dibuat lebih pekat yaitu 2:1, persen ekstraksi Ce cenderung menurun drastis yaitu 68% Ce. Hal ini disebabkan viskositas larutan yang terlalu kental sehingga asam tidak dapat bereaksi dengan sempurna.
Setelah mendapatkan kondisi proses yang optimum untuk jenis pelarut dan konsentrasi, selanjutnya dilakukan percobaan untuk mengetahui pengaruh oksidator terhadap % ekstraksi Ce. Oksidator yang digunakan dalan percobaan ini adalah hidrogen peroksida (H2O2). Parameter tetap dalam percobaan ini adalah konsentrasi asam 1:1, waktu pelindian 120 menit dan suhu pelindian 220 oC. Hasil-hasil percobaan dapat dilihat pada Gambar 5.4.
Gambar 5. 4 Pengaruh oksidator terhadap %ekstraksi Ce
Gambar 5.4 menunjukkan bahwa penambahan oksidator hidrogen peroksida tidak terlalu mempengaruhi persen ekstraksi Ce. Hal ini disebabkan karena LTJ yang bereaksi dengan asam sulfat membentuk LTJ-sulfat masih berupa campuran semua LTJ, belum terpisah secara individu unsurnya. Setiap unsur LTJ memiliki valensi rangkap II dan III, sedangkan Ce mempunyai valensi rangkap III dan IV. Penambahan oksidator lebih efektif apabila dilakukan pada tahap proses pemisahan unsur-unsur LTJ, khususnya untuk pemisahan Ce. Setelah terbentuk LTJ-hidroksida yang kemudian dilarutkan dengan asam nitrat untuk membentuk larutan LTJ-nitrat yang selanjutnya dilakukan pemisahan unsur-unsur LTJ. Penambahkan oksidator ke dalam larutan LTJ nitrat akan merubah menjadi Ce ( III ) atau cero menjadi Ce atau ceri ( IV ). Hasil kali kelarutan Ce ( Ceri ) Hidroksida jauh berbeda dengan LTJ (La, Nd dll ) hidroksida lain yang bervalensi III. Sehingga Ce dapat terpisah dan mengendap lebih awal jika ke dalam larutan nitrat setelah dioksidasi ditambahkan ammonium hidroksida. 0 20 40 60 80 100 120 HCl H2SO4 HNO3 % e kstr aksi C e jenis asam non oksidator oksidator
25 Dari serangkaian percobaan diperoleh kondisi proses untuk menghasilkan persen ekstraksi Ce tertinggi (99,08%) yaitu asam sulfat dengan konsentrasi 1:1, suhu pelindian 220oC dan waktu pelindian 120 menit tanpa penambahan oksidator hidrogen peroksida. Proses selanjutnya setelah diperoleh LTJ-sulfat adalah proses quenching untuk mengendapkan torium yang ikut terlarut saat pelindian dengan sulfat. Reaksi yang terjadi adalah:
2 LTJ
2(SO
4)
3+ 6 H
3PO
4 LTJ
4(P
2O
7)
3+ 6 H
2SO
4+ 3 H
2O
Th(SO
4)
2+ 2 H
3PO
4 Th(P
2O
7) + 2 H
2SO
4+ H
2O
Torium pirofosfat akan mengendap, sedangkan LTJ pirofosfat belum mengendap (masih ada dalam larutan). Larutan LTJ yang dihasilkan dari proses ini sudah bebas radioaktif. Proses selanjutnya adalah pengendapan LTJ dengan amonium hidroksida sehingga akan terbentuk endapan konsentrat LTJ. Reaksi yang terjadi adalah:
2 LTJ
2(SO
4)
3+ 6 H
3PO
4 LTJ
4(P
2O
7)
3+ 6 H
2SO
4+ 3 H
2O
LTJ
2(SO
4)
3+ 6 NH
4OH 2 LTJ(OH)
3+ 3 (NH
4)
2SO
4Endapan yang dihasilkan masih berupa LTJ-pirofosfat dan hidroksida, yang sudah bebas
radioaktif dengan kadar Th-nya sekitar 0,076% seperti yang ditunjukkan pada Gambar 5.4.
Gambar 5. 5 Endapan LTJ pirofosfat dan hidroksida yang terbentuk
Endapan LTJ pirofosfat dan hidroksida kemudian direaksikan dengan NaOH untuk membentuk konsentrat LTJ-hidroksida yang kemudian di kalsinasi pada suhu 900oC selama 3 jam untuk membentuk LTJ-oksida. Pengujian LTJ-hidroksida dan oksida nonlogam dapat dilihat pada Tabel 5.4 dan 5.5.
26
Tabel 5. 4 Komposisi unsur LTJ pada LTJ-hidroksida
No. elemen Kadar (%)
1. Serium (Ce) 12,22 2. Gadolinium (Gd) 0,57 3. Itrium (Y) 0,559 4. Neodimium (Nd) 4,93 5. Terbium (Tb) 0,0558 6. Lantanum (La) 6,04 7. Disprosium (Dy) 0,201 8. Europium (Eu) 0,0327 9. Samarium (Sm) 0,771 10. Prasedomium (Pr) 1,17 11. Torium (Th) 0,0762 12. Uranium (U) 0,04
Tabel 5. 5 Komposisi unsur LTJ pada LTJ-Oksida
No. elemen Kadar (%)
1. Serium (Ce) 29,10 2. Gadolinium (Gd) 1,54 3. Itrium (Y) 1,53 4. Neodimium (Nd) 11,53 5. Terbium (Tb) 0,124 6. Lantanum (La) 14,02 7. Disprosium (Dy) 0,489 8. Europium (Eu) 0,095 9. Samarium (Sm) 1,85 10. Prasedomium (Pr) 2,69 11. Torium (Th) 0,165 12. Uranium (U) 0,088
5.2.
Reduksi CeO
2menjadi logam Ce
Serium oksida(CeO2) yang digunakan dalam proses reduksi ini diperoleh dari PTAPB-Batan. Karakterisasi serium oksida tersebut dapat dilihat pada Tabel 5.6. Foto serium oksida dapat dilihat pada Gambar 5.6.
Tabel 5. 6 Komposisi unsur LTJ pada Serium oksida
No. elemen Kadar (%)
1. Serium (Ce) 79,44 3. Itrium (Y) 0,06 4. Neodimium (Nd) 0,53 6. Lantanum (La) 0,435 9. Samarium (Sm) 0,097 10. Prasedomium (Pr) 0,173
27
Gambar 5. 6 Foto Serium oksida PTAPB Batan
Semua LTJ-oksida atau LTJ-fluorida dapat direduksi menjadi logamnya melalui proses metalotermik. Pemilihan logam yang digunakan sebagai reduktor dalam proses metalotermik sangat terbatas karena stabilitas termodinamik senyawa LTJ sangat tinggi. Reaksi secara umum untuk proses metalotermik adalah:
RE-O + M →RE + MO
Dimana M adalah logam yang digunakan untuk proses reduksi. Logam yang digunakan sebagai reduktor harus lebih reaktif dibandingkan serium seperti Ca, Al, Si, dan Mg. Pada percobaan reduksi ini digunakan reduktor Mg dan fluks CaCl2. Proses reduksi ini dilakukan tanpa menggunakan udara, sehingga harus dialirkan gas argon. Reaksi yang terjadi dalam proses reduksi serium oksida adalah:
CeOx(s) + Mg(s) => Ce(l) + MgO (tidak dalam kesetimbangan) CeO2 + 2CaCl2 + 2Mg → Ce + 2CaO + 2MgCl2
Parameter yang digunakan dalam proses ini adalah komposisi CeO2 dengan Mg, suhu proses, dan jumlah fluks. Sejumlah percobaan pendahuluan dilakukan untuk mengetahui kondisi proses hingga terbentuk logam Ce. Percobaan awal dilakukan pada suhu 900oC dengan komposisi CeO2 dan Mg sesuai stokiometri; baik tanpa penambahan fluks, maupun dengan penambahan fluks. Percobaan dilakukan pada tube furnace. Hasil-hasil yang diperoleh adalah belum terbentuk logam Ce dan terbentuk dua lapisan, powder berubah menjadi hijau (kemungkinan masih seria) dan powder berwarna coklat seperti CeO2. Hasil SEM dan XRD belum menunjukkan terbentuknya logam Ce. Powder berwarna hijau merupakan serium yang masih berasosiasi dengan magnesium dan terinklusi dalam material pengikat yang dapat dilihat pada Gambar 5.7 dan 5.9, sedangkan untuk powder yang berwarna coklat merupakan serium berasosiasi dengan magnesium seperti yang terlihat pada Gambar 5.8 dan 5.10. Hasil analisis untuk kedua proses tersebut menunjukkan bahwa baik logam ataupun terak masih didominasi oleh serium oksida.
28
Gambar 5. 7 Analisis SEM X-Ray Mapping untuk lelehan dengan fluks
Gambar 5. 8 Analisis SEM X-Ray Mapping untuk terak dengan fluks
29
Gambar 5. 10 Hasil Analisis SEM X-Ray Mapping untuk terak dengan tanpa fluks
Percobaan pendahuluan selanjutnya adalah dengan menaikkan suhu proses menjadi 1000 oC dengan komposisi bahan sama seperti pada percobaan sebelumnya (sesuai stokiometri). Dari hasil analisis XRD belum terlihat adanya logam serium. Fasa logam yang dihasilkan masih berupa serium oksida dan fasa terak yang terbentuk juga masih serium oksida. Didalam fasa logam terbentuk juga magnesium silikat. Hal ini dapat ditunjukkan pada Gambar 5.11 dan 5.12.
Gambar 5. 11 Hasil analisis XRD untuk fasa logam
30 Percobaan pendahuluan selanjutnya adalah dengan menambahkan komposisi berat CeO2 dengan Mg yaitu 1:1, suhu 1200oC dan kondisi lainnya sama seperti pada percobaan awal sebelumnya. Dari hasil percobaan sudah terlihat terbentuknya fasa logam serium berupa perak-abu seperti pada Gambar 5.13.
Gambar 5. 13 Foto penampakan logam serium
Hasil analisis SEM X-Ray mapping yang diperlihatkan pada Gambar 5.14 menunjukkan bahwa pada fasa logam, logam serium (Ce) sudah terbentuk yang ditunjukkan oleh struktur menjarum (pada bagian kiri sampai kanan atas foto, warna putih). Mg, Cl dan Ca masih terdapat pada fasa logam. Monasit juga masih terlihat dalam bentuk chunk (kanan bawah foto). Kemungkinan tidak semua monasit terubah menjadi logam Ce pada saat proses reduksi.
Gambar 5. 14 Hasil analisis SEM X-Ray Mapping pada fasa logam
Pada fasa terak terdapat logam Ce yang lolos masuk ke dalam terak (di bagian kiri sampai tengah foto). Material Mg yang berada dalam terak berbentuk lempengan (kanan bawah foto). Hasil analisis SEM X-Ray Mapping pada fasa terak dapat dilihat pada Gambar 5.15.
31
Gambar 5. 15 Hasil analisis SEM X-Ray Mapping pada fasa terak
Setelah diperoleh logam serium pada percobaan pendahuluan maka dilakukan percobaan dengan kapasitas yang lebih besar yaitu umpan 100 gram CeO2 menggunakan alat resistance furnace. Parameter yang dilakukan adalah komposisi CeO2/reduktor Mg dan suhu proses. Parameter komposisi umpan/reduktor dilakukan dengan perbandingan umpan dan reduktornya 1:1, 1:2 dan 2:1. Parameter tetapnya adalah penambahan fluks 1%, suhu proses 1200 oC dan ditahan selama 3 jam. Hasil-hasil percobaan untuk komposisi umpan/reduktor pada fasa logam dapat dilihat pada Gambar 5.16.
Gambar 5. 16 Pengaruh komposisi umpan/reduktor terhadap kadar logam pada fasa logam
Gambar 5.16 menunjukkan bahwa pada komposisi umpan/reduktor 1:2 hanya logam Ce yang dominan pada fasa logamnya, walaupun masih terdapat kandungan lainnya seperti La, Nd, Pr, Sm dalam jumlah yang kecil. Hal ini disebabkan karena dari umpan yang dipakai masih mengandung logam-logam tersebut. Hal ini dapat dilihat dari warna serium oksida yang agak kemerah-merahan, sedangkan untuk warna serium oksida murni sendiri memiliki warna putih. Dalam fasa logam pada komposisi 1:2 logam Mg dan Ca sudah tidak terdeteksi. Hal ini menunjukkan bahwa reduktor Mg dan CaCl2 sudah bereaksi sempurna dengan serium. Hal tersebut diperkuat dengan hasil analisis SEM seperti yang terlihat pada Gambar 5.17.0 10 20 30 40 50 60 1;1 2;1 1;2 kad ar , % umpan/reduktor Ca Mg Ce
32
Gambar 5. 17 analisis SEM fasa logam untuk komposisi 1:2
Fasa terak yang dihasilkan dalam percobaan ini menunjukkan bahwa logam serium masih terlihat, khususnya terak 1:1 yang menunjukkan serium masih terlihat dominan. Hal ini disebabkan karena serium yang tereduksi pada fasa logam lolos masuk ke dalam terak. Hasil analisis SEM pada terak 1:1 dapat ditunjukkan pada Gambar 5.18.
Gambar 5. 18 Hasil analisis SEM fasa terak untuk komposisi 1:1
Percobaan selanjutnya adalah dengan mempelajari parameter suhu reduksi yaitu pada 1000, 1300, dan 1500oC. Hasil-hasil percobaan untuk parameter suhu pada fasa logamnya dapat dilihat pada Gambar 5.19.
33
Gambar 5. 19 Pengaruh suhu terhadap kadar logam pada fasa logam
Gambar 5.19. terlihat bahwa pada suhu 1200oC dihasilkan logam Ce paling banyak. Ketika suhu dinaikkan, Ce yang terbentuk turun menjadi 25%. Pada kondisi dengan kadar Ce yang paling tinggi, perolehannya mencapai 91%.
5.3.
Reduksi Y
2O
3menjadi Y
Itrium oksida yang digunakan dalam proses reduksi ini juga diperoleh dari PTAPB-Batan. Karakterisasi itrium oksida yang diperoleh dapat dilihat pada Tabel 5.7, sedangkan foto serium oksida dapat dilihat pada Gambar 5.20.
Tabel 5. 7 Komposisi unsur LTJ pada itrium oksida
No. elemen Kadar (%)
1. Serium (Ce) 1 2. Itrium (Y) 49,09 3. Neodimium (Nd) 0,63 4. Lantanum (La) 0,77 5. Samarium (Sm) 0,38 6. Disprosium (Dy) 3,87 7. Gadolinium (Gd) 1,79 0 10 20 30 40 50 60 1000 1200 1300 kad ar , % suhu, celcius Ca Mg Ce
34
Gambar 5. 20 Foto itrium oksida
Itrium oksida juga dapat direduksi menjadi logam melalui proses metalotermik. Proses pemisahan logam dari senyawanya atau yang lebih dikenal dengan istilah reduksi mengikuti reaksi:
MXn + iR = M + iRX(n/i)
M adalah logam yang dihasilkan. X adalah oksigen, klorin, atau fluorin; dan R adalah pereduksi yang biasanya hidrogen, karbon atau logam lain seperti Li, Ca, Al, K, Na dan Mg. Pemilihan pereduksi yang tepat dapat ditentukan dengan melihat pembentukan energi bebas standarnya (∆G0). Reaksi reduksi dapat terjadi apabila perbedaan ∆G0 MXn dengan ∆G0 RX(n/i) adalah <0 (negatif). Persamaan tersebut dapat ditulis (Gupta dan Krishnamurthy, 2005):
i∆G0 RX(n/i) - MXn < 0
Proses reduksi untuk melepaskan logam dan senyawanya serta pembentukan senyawa RX bergantung juga terhadap suhu proses reduksi. Berikut disajikan grafik ∆G0 untuk beberapa logam tanah jarang- dan logam - oksida, -fluorida, -klorida terhadap suhu yang dapat dilihat pada Gambar 5.21, 5.22 dan 5.23.
35
Gambar 5. 22 Grafik energi bebas LTJ- dan logam- klorida terhadap suhu
Gambar 5. 23 Grafik energi bebas LTJ- dan logam- fluorida terhadap suhu
Dari grafik di atas terlihat bahwa itrium oksida memiliki ∆G0 yang lebih negatif dibandingkan dengan ∆G0 dari pereduksi seperti CaO, MgO, Na2O, Al2O3 dan Na2O, sehingga reduksi logam itrium (Y) dalam bentuk oksida akan sulit diperoleh. Ketika dalam bentuk itrium klorida (YCl3) akan mudah untuk menjadi logam Y dengan reduktor K, Ca, dan Li. Dalam hal ini, itrium oksida yang sudah diperoleh dari PTAPB-Batan harus diubah bentuknya ke dalam itrium klorida dengan menambahkan asam klorida.
Penelitian reduksi itrium oksida menjadi logam Y belum dapat dilakukan karena bahan baku baru didapatkan pada akhir tahun anggaran 2013 (bulan November), sehingga baru bisa dilakukan karakterisasi bahan baku. Hasil karakterisasi menunjukkan bahwa kadar itrium oksida baru sekitar 50% sehingga belum memenuhi persyaratan untuk dilakukan peleburan. Kadar itrium oksida agar dapat dilebur harus sekitar 70%. Di samping itu, pembuatan itrium oksida membutuhkan waktu yang
36 sangat lama, karena tidak ada sampel yang murni senotim. Pada proses ini digunakan sampel senotim bercampur monasit. Yang mengakibatkan proses menjadi lama dan tidak efisien. Diharapkan percobaan reduksi logam Y dapat dilakukan pada Tahun Anggaran 2014.
5.4.
Kajian Lingkungan Proses
Kajian lingkungan proses didasarkan pada dua metode ekstraksi LTJ, yaitu asam dan basa. Diagram alir proses untuk metode asam dapat dilihat pada Gambar 5.24., sedangkan untuk yang metode basa dapat dilihat pada Gambar 5.25.
H2SO4 Pasir monasit
Dijesti
Air es Quenching/leburan encer
Filtrasi NH4OH (15%)
Gel Th (kadar 90%, Efisiensi 90%) Pengendapan
Filtrasi NaOH (50%)
Air panas Larutan Endapan REOH (kadar 90%
U << efisiensi RE 80%)
Pengendapan
Limbah H3PO4, air, NH4SO4
Padatan REOH U>>
Gambar 5. 24 Metode asam
37
Gambar 5. 25 Metode basa
5.5.
Data masukan metode asam
Hasil penghitungan seperti yang ditampilkan pada Lampiran 3, menunjukkan bahwa metode basa mempunyai nilai 667,768, sedangkan metode asam bernilai 432,896. Hal ini berarti metode basa menimbulkan kerusakan lingkungan yang lebih buruk dibandingkan dengan metode asam. Dampak yang ditimbulkan tersaji pada Gambar 5.26.
Gambar 5. 26 dampak lingkungan akibat kedua metode ekstraksi
Monasit
penggerusan
Dekomposisi
Pelarutan parsial
Pengendapan U & Th
Pengendapan RE
RE(OH)
3 0 10.000 20.000 30.000 40.000 50.000 60.000 70.000abiotik air udara
Dampak Metode Basa Metode Asam NaOH Air Na3PO4 HCl Air U, Th NH4OH U, Th NH4OH
38 Penyebab besarnya nilai metode basa disebabkan banyaknya penggunaan sodium hidroksida (NaOH) dan ammonium hidroksida (NH4OH). Oleh karena itu, bila metode basa diterapkan pada skala yang lebih besar maka perlu dipertimbangkan untuk mengganti atau mengurangi pemakaian kedua jenis basa yang digunakan atau mengolah limbah basa yang dihasilkan melalui proses daur ulang (recycling) atau pemanfaatan di tempat lain (reuse).
Dari Gambar 5.26. diketahui bahwa metode basa akan berdampak besar pada faktor abiotik dan udara. Pengelolaan lingkungan pada metode basa harus difokuskan pada kedua hal tersebut. Misalnya dengan mendesain instalasi pengolahan air limbah dan memasang alat pereduksi cemaran udara. Instalasi pengolahan air limbah utamanya bertujuan untuk menetralkan cairan basa. Biasanya dilakukan penambahan asam sulfat hingga pH menjadi netral dan melakukan stripping aerasi sampai batasan baku limbah sesuai ketentuan Undang-undang Lingkungan Hidup. Sementara alat pereduksi cemaran udara berupa scruber yang didesain menangkap amonia dengan cara menyemprotkan air secara otomatis jika terjadi paparan amonia lepas ke udara saat pabrik memulai atau menghentikan proses produksinya. Pemantauan kualitas lingkungan terutama pada lingkungan abiotik dan udara dilakukan guna mengontrol paparan bahan berbahaya.
Proses ekstraksi logam tanah jarang menggunakan kedua metode tersebut menghasilkan limbah radioaktif uranium dan torium. Kedua zat tersebut perlu ditangani agar tidak membahayakan lingkungan. Di antara pemanfaatan yang dapat dilakukan adalah dengan memanfaatkannya sebagai sumber energi. Sampai saat ini instansi yang berwenang menangani hal ini (BATAN) masih terus melakukan penelitiannya.
Pada proses ekstraksi dengan metode asam dihasilkan pula limbah H3PO4 dan NH4SO4. Kedua jenis zat ini dapat diteliti untuk dimanfaatkan kembali sebagai bahan baku pupuk, baik pupuk fosfat maupun ZA. Bila dapat dimanfaatkan kembali tentunya proses ekstraksi akan menjadi ramah lingkungan dan bernilai ekonomis.
Terlepas dari analisis konsep MIPS, prakiraan dampak lingkungan yang terjadi akibat proses ekstraksi LTJ adalah tersebarnya zat toksik dari pelarut yang digunakan. Pada umumnya proses ekstraksi menggunakan beberapa bahan organik sebagai pelarut misalnya tributil fosfat (TBP), heksamin dan lain-lain. Untuk itu perlu dilakukan uji toksisitas seperti LD50 terhadap mahluk hidup di perairan di sekitar pabrik ekstraksi.
5.6.
Kajian Keekonomian Proses
Di Bangka Belitung, monasit merupakan hasil samping penambangan dan pengolahan timah. Mineral monasit Bangka didapat sebanyak 7.290 - 8.505 ton per tahun(Castor dan Hendrick, 2011).
39 Pada Tabel 5.8 berikut disajikan data cadangan Pusat Pencucian Bijih Timah (PPBT) PT Timah, TBk yang diambil pada akhir Oktober 2008.
Tabel 5. 8 Data cadangan mineral ikutan pencucian bijih timah 31 Oktober 2008 (Suprapto,
2008)
I.
N
o
Mineral
Stok awal
Jumlah
produksi
Jumlah
Dikeluarkan
Stok akhir
II.
Monasit high
1
grade
III.
IV.
V.
VI.
VII.
VIII.
Jumlah (drum) IX.
0 X.
0 XI.
0 XII.
0 XIII.
0
XIV.
Berat ore (ton) 408.820 XV.
0
408.820
XVI.
0
408.820
XVII.
Kadar min
(%)
88,31 XVIII.
0
78,31
XIX.
0
78,31
XX.
Berat min
(ton)
320.163 XXI.
0
320.163 XXII.
0
320.163
XXIII.
Monasit low
grade
XXIV.
XXV.
XXVI.
XXVII.
XXVIII.
XXIX.
Berat ore (ton) 549.683 XXX.
0
549.683 XXXI.
0
549.683
XXXII.
Kadar min
(%)
35,09
XXXIII.
0
35,09 XXXIV.
0
35,09
XXXV.
Berat min
(ton)
192.894
XXXVI.
0
192.894
XXXVII.
0
192.894
XXXVIII.
Senotim XXXIX.
2
XL.
XLI.
XLII.
XLIII.
XLIV.
Berat ore (ton)
88.389 XLV.
0
88.389 XLVI.
0
88.389
XLVII.
Kadar min
(%)
65,04
XLVIII.
0
65,04
XLIX.
0
65,04
L.
Berat min
(ton)
40
Gambar 5. 27 Cadangan dan perbandingan mineral ikutan di berbagai daerah
(Suprapto,
2008)
Kajian keekonomian dilakukan untuk menentukan kelayakan proses pengolahan dapat diterapkan dalam skala industri. Kajian keekonomian yang dilakukan difokuskan pada perhitungan keekonomian proses pengolahan konsentrat monasit sampai diperoleh logam tanah jarang oksida dengan metode asam.
Neraca bahan kimia dan produk untuk proses pembuatan LTJ-oksida dengan metode asam dapat dilihat pada Tabel 5.9.
Tabel 5. 9 Neraca bahan untuk pembuatan LTJ-oksida
Masuk Keluar
bahan Kg/jam Ton/tahun bahan Kg/jam Ton/tahun
Pasir monasit 5 40 gas 5,05 40
H2SO4 teknis 9,17 72,63 Uap air 15,34 121,5
air 174,232 1379,9 residu 1,39 11
NH4OH teknis 14 110,94 Padatan konsentrat Th 0,54 4,26
NaOH 1,05 8,35 Padatan konsentrat
LTJ oksida 1,875 14,85 Padatan konsentrat LTJOH U> 0,38 3 limbah 21,877 173,266 Jumlah 46,452 367,9 Jumlah 46,452 367,9
Harga bahan baku monasit dan bahan-bahan kimia yang digunakan dalam proses dapat dilihat pada Tabel 5.10.