i
PENGARUH PEMBERIAN EKSTRAK METANOL-AIR DAUN Macaranga tanarius L. TERHADAP PENURUNAN KADAR GLUKOSA DARAH
PADA TIKUS YANG TERBEBANI GLUKOSA
SKRIPSI
Diajukan Untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Martina Tri Handayani
NIM: 088114124
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
iv
PERSEMBAHAN
Ku persembahkan karyaku ini untuk :
Tuhan Yesus yang senantiasa memberikan kekuatan dan harapan
Bapak, Ibu, kakak, dan adikku yang selalu memberikan doa dan
dukungan untukku
Alexander adji penyemangatku
Sahabat-sahabatku tersayang
Almamaterku tercinta
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
vi
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
vii PRAKATA
Puji syukur kepada Tuhan Yang Maha Kasih atas berkatnya yang
melimpah, sehingga penulis dapat menyelesaikan skripsi berjudul “Pengaruh
Pemberian Ekstrak Metanol-Air Daun Macaranga tanarius L. Terhadap Penurunan Kadar Gukosa Darah Pada Tikus yang Terbebani glukosa”
dengan baik.
Skripsi ini dibuat untuk memenuhi salah satu syarat memperoleh gelar
Sarjana Farmasi (S.Farm.) program studi Farmasi Universitas Sanata Dharma.
Penulis menyadari sepenuhnya bahwa dalam pelaksanaan dan penyusunan
skripsi, tidak terlepas dari bantuan dan campur tangan dari berbagai pihak. Oleh
karena itu, pada kesempatan ini penulis mengucapkan terima kasih kepada :
1. Tuhan Yang Maha Kasih atas berkat, rahmat dan penyertaan-Nya selama ini.
2. Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
3. Ibu Phebe Hendra, M.Si., Ph.D., Apt. sebagai Dosen Pembimbing Utama
skripsi ini atas segala kesabarannya telah memberikan bimbingan,
pengarahan, tuntunan, dukungan dan motivasi selama penelitian dan
penyusunan skripsi.
4. Bapak Prof. Dr. C.J. Soegihardjo, Apt. sebagai Dosen Penguji skripsi atas
bantuan, masukkan dan perhatian kepada penulis demi kemajuan skripsi ini.
5. Ibu dr. Fenty, M.Kes, Sp.PK. sebagai Dosen Penguji skripsi yang telah
viii
6. Ibu Rini Dwiastuti, M.Si., Apt. selaku Pimpinan Laboratorium Farmasi yang
telah memberikan ijin penggunaan semua fasilitas laboratorium guna
penelitian skripsi ini.
7. Bapak Yohanes Dwiatmaka, M.Si. yang telah membimbing dalam
determinasi tanaman Macaranga tanarius L.
8. Dokter Ari, Pak Heru, Pak Parjiman, Pak Kayat, Mas Yohanes, Mas Yuwono
dan Pak Timbul yang telah banyak membantu menyediakan fasilitas yang
dibutuhkan untuk melakukan penelitian ini.
9. Almarhumah ibu Lusia yang selalu menjadi semangatku
10. Bapak Sunardi, Ibu Ch.Rully, kakak dan adikku yang telah membantu dari
awal sampai akhir penelitian ini, atas doa, dukungan semangat dan
perhatiannya.
11. Alexander Adji Trionaldi sebagai sahabat seperjalanan yang tak pernah
selesai, atas doa, kasih sayang, perhatian, bantuan, motivasi dan waktunya.
12. Marsillus Marsell Wibowo sebagai teman yang selalu memberikan waktu,
motivasi dan semangat kepadaku
13. Teman-teman “Tim Macaranga 2” Stephanie Irena Nugrahesti, Triana
Oktavia, Rio Bagus Permadi, Ivan Pradipta, Viviane Theresia, Ana Puspita
Dewi, atas kerja sama, bantuan, suka duka, dan perjuangan dalam
menyelesaikan penelitian ini sampai akhir.
14. Seluruh warga FKK angkatan 2008 kelas B dan semua teman Fakultas
Farmasi USD atas kebersamaannya selama kuliah S1 di Fakultas Farmasi
Universitas Sanata Dharma.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
x DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ... vi
PRAKATA ... vii
DAFTAR ISI ... x
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
DAFTAR SINGKATAN DAN ISTILAH ... xvi
INTISARI ... xvii ABSTRACT ... xviii BAB I. PENGANTAR ... 1 A. Latar Belakang ... 1 1. Perumusan masalah ... 3 2. Keaslian penelitian ... 4 3. Manfaat penelitian ... 4 B. Tujuan Penelitian ... 5
BAB II. PENELAHAAN PUSTAKA ... 6
A. Diabetes Melitus... 6 1. Definisi ... 6 2. Gejala ... 6 3. Klasifikasi ... 7 4. Diagnosis ... 8 B. Metabolisme Karbohidrat ... 9
C. Teknik Uji Diabetik dan Metode Penetapan Kadar Glukosa Darah ... 11
1. Teknik uji diabetik ... 11
xi D. Glibenklamida ... 15 1. Definisi ... 15 2. Farmkodinamika ... 15 3. Farmkokinetika ... 16 4. Efek samping ... 16 E. Macaranga tanarius L. ... 17 1. Keterangan botani ... 17 2. Taksonomi ... 17 3. Kandungan ... 18
4. Khasiat dan kegunaan ... 20
5. Morfologi ... 21
6. Penyebaran ... 21
F. Metode Penyarian ... 21
G. Landasan Teori ... 22
H. Hipotesis ... 22
BAB III. METODE PENELITIAN ... 23
A. Jenis dan Rancangan Penelitian ... 23
B. Variabel dan Definisi Operasional ... 23
1. Variabel penelitian ... 23
2. Definisi operasional ... 24
C. Bahan dan Alat Penelitian ... 24
1. Bahan penelitian ... 24
2. Alat penelitian ... 26
D. Jalannya Penelitian ... 26
1. Determinasi tanaman ... 26
2. Pembuatan simplisia uji ... 27
3. Preparasi bahan ... 27
4. Percobaan pendahuluan... 29
5. Penetap kadar glukosa darah ... 30
xii
BAB IV . HASIL DAN PEMBAHASAN ... 32
A. Determinasi Tanaman ... 32
B. Hasil Ekstraksi daun M. tanarius ... 33
C. Hasil Uji Pendahuluan ... 34
1. Penetapan waktu pemberian kontrol positif ... 35
2. Penetapan dosis ekstrak metanol-air M. tanarius ... 37
3. Selang pemberian ekstrak M. tanarius... 37
D. Efek Penurunan Kadar Glukosa Darah Ekstrak M. tanarius ... 38
BAB V. KESIMPULAN DAN SARAN ... 47
A. Kesimpulan ... 47
B. Saran ... 47
DAFTAR PUSTAKA ... 48
LAMPIRAN ... 51
BIOGRAFI PENULIS ... 69
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xiii
DAFTAR TABEL
Tabel I. Nilai glukosa plasma puasa dan toleransi glukosa ... 9
Tabel II. Isi pereaksi enzim Glucose GOD-PAP ... 25
Tabel III. Keseragaman bobot tablet ... 28
Tabel IV. Volume pengukuran kadar glukosa darah ... 31
Tabel V. Hasil uji Post Hoc Scheffe LDDK 0-240 glukosa darah tikus yang terbebani glukosa ... 35
Tabel VI. Nilai LDDK0-240 larutan glibenklamida sebelum UTGO ... 35
Tabel VII. Nilai LDDK0-240 ekstrak M. tanarius sebelum UTGO ... 37
Tabel VIII. Rerata kadar glukosa darah dan LDDK 0-240 setiap kelompok perlakuan ... 40
Tabel IX. Hasil uji Post Hoc Scheffe LDDK 0-240 glukosa darah tikus yang terbebani glukosa ... 44
Tabel X. Pengaruh praperlakuan ekstrak M. tanarius terhadap LDDK 0-240 kadar glukosa darah tikus dan prosentase perbedaan terhadap kontrol positif dan kontrol negatif ... 46
xiv
DAFTAR GAMBAR
Gambar 1.Sekresi insulin akibat peningkatan kadar glukosa dalam darah ... 11
Gambar 2. Struktur aloksan ... 12
Gambar 3. Struktur glibenklamida ... 15
Gambar 4. Struktur senyawa daun M. tanarius L. ... 19
Gambar 5. Isolasi Ellagitannins dari daunM. tanarius L. ... 20
Gambar 6.Diagram penentuan selang waktu pemberian glibenklamida terhadap LDDK ... 36
Gambar 7. Diagram penentuan selang waktu pemberian ekstrak M. tanarius terhadap LDDK ... 38
Gambar 8. Reaksi enzimatik antara glukosa dan reagen GOD-PAP ... 39
Gambar 9. Kurva hubungan antara waktu sampling dan kadar rata-rata glukosa darah akibat pemberian CMC, glibenklamida, dan ekstrak M. tanarius ... 41
Gambar 10. Hasil Uji One Way ANOVA LDDK 0-240 glukosa darah tikus yang terbebani glukosa ... 43
Gambar 11. Diagram LDDK 0-240 ± SE glukosa darah masing-masing perlakuan.... 45
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xv
DAFTAR LAMPIRAN
Lampiran 1. Determinasi M. tanarius ... 51
Lampiran 2. Foto tanaman M. tanarius... 52
Lampiran 3. Foto hewan uji percobaan (tikus putih jantan) ... 53
Lampiran 4. Foto alat penelitian ... 54
Lampiran 5. Preparasi bahan ... 56
Lampiran 6. Perhitungan penetapan peringkat dosis ekstrak metanol daun M.tanarius L.pada kelompok perlakuan ... 58
Lampiran 7. Perhitungan konversi dosis untuk manusia ... 59
Lampiran 8. Hasil uji distribusi data dengan tes Kolmogorov Smirnov ... 60
Lampiran 9. Hasil uji one way ANOVA glibenklamida ... 61
Lampiran 10. Hasil uji one way ANOVA ekstrak M. tanarius L. ... 63
Lampiran 11. Hasil rendemen ekstrak metanol-air M. tanarius L. ... 65
Lampiran 12. Bobot pengeringan ekstrak metanol-air M. tanarius L. ... 66
xvi
DAFTAR SINGKATAN, ARTI LAMBANG, DAN ISTILAH
EMMT : Ekstrak metanol-air ekstrak daun M. tanarius L.
MTME : M. tanarius L. leaf methanol-water extract
CMC : Carboxy Methyl Cellulosa
GOD–PAP : Glucose Oxidase - Phenol Antipirin atau Glukosa
Oksidase Phenol p-aminophenazone
Hipoglikemi(k) : Penurunan kadar glukosa dalam darah secara abnormal
LDDK : Luas Daerah di Bawah Kurva, kadar glukosa dalam darah
vs waktu
LDDK0-240 : Luas Daerah di Bawah Kurva dari menit ke-0 sampai menit ke-240
ANOVA : Analisis o f Varian
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xvii INTISARI
Penelitian ini bertujuan untuk mengetahui ekstrak metanol-air daun M. tanarius (EMMT) dapat menurunkan kadar glukosa darah, mengetahui seberapa besar dosis EMMT dapat menurunkan kadar glukosa darah, dan seberapa besar potensi EMMT yang efektif dalam menurunkan kadar glukosa darah pada tikus yang terbebani glukosa.
Penelitian ini termasuk eksperimental murni rancangan acak lengkap pola searah menggunakan 30 ekor tikus putih jantan galur Wistar dibagi secara acak ke dalam lima kelompok. Kelompok I (kontrol negatif) diberi CMC 1%, kelompok II (kontrol positif) diberi glibenklamida dosis 0,45 mg/kg BB, dan tikus kelompok III, IV,dan V diberi EMMT berturut-turut dengan dosis 0,43; 1,28 dan 3,84 g/kgBB, semua pemberian dilakukan secara per-oral. Efek hipoglikemik M. tanarius diuji mengikuti metode uji toleransi glukosa oral (UTGO). Kadar glukosa darah ditetapkan pada menit ke-0 sebelum UTGO dan menit ke-15, 30, 60, 90, 180, dan 240 setelah UTGO dari hewan uji yang sebelumnya telah mendapat pra-perlakuan kontrol negatif, positif, dan EMMT. Data kadar glukosa darah pada tiap kelompok dianalisis secara statistik menggunakan metode ANOVA satu arah dan uji scheffe bertaraf kepercayaan 95%.
Hasil penelitian menunjukkan bahwa EMMT dapat menurunkan kadar glukosa darah pada tikus yang terbebani glukosa pada dosis 0,43; 1,28 dan 3,84 g/kg BB. Daya dalam menurunkan kadar glukosa darah EMMT yang efektif pada dosis 0,43 mg/kg BB sebesar 73,2 %
Kata kunci: penurunan kadar glukosa darah, ekstrak metanol-air, Macaranga tanarius L.
xviii
ABSTRACT
This research aimed was to find out the effect of M. tanarius leaf methanol-water extract (MTME) can lowering blood glucose levels, knowing the dose of EMMT can lowering blood glucose levels, and how much potential for EMMT as an effective on lowering blood glucose levels in rats burdened glucose.
This research was experimental study with one way-complete-random design using 30 male rats were divided into five groups. The rats in group I were given of CMC 1% (negative control). The group II rats were given 0.45 g/kg BW doses of Glibenclamida (positive control). In group III, IV and V, the rats were given 0.43; 1.28; 3.84 g/kg BW doses of MTME, all of the processes were given through the oral method. The hypoglycemic effect of MTME was tested by following the Oral Glucose Tolerance Test (OGTT) method. The blood-glucose contents were taken, at the 0 minutes before the OGTT and also taken at minutes of 15, 30, 60, 90, 180, and 240 after the OGTT, from the tested animal that had been gotten the pre-treatment of the negative control, positive control and MTME control before. The AUC 0-240 was statistically analyzed using one way ANOVA and Scheffe test with 95 % convidence level.
The result of this research showed that MTME can lowering blood glucose levels on rats in burdened glucose at dose 0.43; 1.28; and 3.84 g/kg BW. The potential of EMMT can lowering blood glucose levels at a dose of 0.43 mg / kg BW of 73.2%.
Keywords : Lowering blood glucose levels, Methanol-Water Extract , Macaranga tanarius L.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
1 BAB I
PENGANTAR
A. Latar Belakang
Seiring perkembangan zaman, banyak teknologi canggih yang
menawarkan kemudahan bagi manusia dan secara tidak langsung berpengaruh
terhadap kehidupan manusia. Sebagaian besar orang menginginkan kepraktisan
dalam melakukan pekerjaannya dengan alasan untuk menghemat waktu sehingga
manusia akan semakin dimanjakan dan menyebabkan kemalasan dalam
melakukan aktivitas yang nantinya akan menurunkan proses metabolisme tubuh.
Saat ini manusia lebih senang mengkonsumsi makanan yang cepat saji dimana
makanan tersebut kurang baik untuk tubuh.Hal-hal tersebut dapat menyebabkan
menurunnya kondisi kesehatan dan meningkatnya penyakit degeneratif. Penyakit
degeneratif merupakan suatu penyakit yang disebabkan karena fungsi atau
struktur dari jaringan atau organ tubuh yang secara progresif menurun dari waktu
ke waktu karena usia atau pilihan gaya hidup yang tidak sehat (Subroto, 2006).
Diabetes melitus merupakan kelompok penyakit metabolik dengan karakteristik
hiperglikemia yang terjadi karena kelainan sekresi insulin, kerja insulin atau
kedua-duanya (Soegondo, 2005).
Berdasar data WHO total penderita diabetes mellitus di Indonesia, saat
ini sekitar 8 juta jiwa, dan diperkirakan jumlahnya melebihi 21 jiwa pada tahun
keempat penderita diabetes terbesar setelah Cina, India, dan Amerika.Sementara
jumlah penderita diabetes di dunia, mencapai 200 juta jiwa.Diprediksi angka
tersebut terus bertambah menjadi 350 juta jiwa pada tahun 2020 (Ningharmanto,
2009).
Selama ini pengobatan yang digunakan untuk penyakit diabetes melitus
adalah dengan menggunakan obat hipoglikemik oral (OHO), suntikan insulin,
diet, ataupun gabungan ketiganya. Obat yang sering digunakan oleh penderita
diabetes khususnya diabetes tipe 2 adalah glibenklamida dari golongan gliburid
yang mempunyai mekanisme kerja menurunkan kadar gula darah yang tinggi
karena dapat merangsang sekresi insulin dari granul sel-sel ß Langerhans pankreas
(insulin secretagogues) (Gunawan, 2007).
Berbagai jenis obat antidiabetik oral banyak ditemukan di apotek, tetapi
harga obat-obat ini cukup mahal padahal harus digunakan secara terus-menerus
sehingga bagi yang tidak mampu sulit memperolehnya.Disamping itu daerah yang
tidak mempunyai apotek, obat untuk penyakit ini sulit ditemukan.Oleh karena itu,
perlu digunakan obat yang ada disekitarnya yaitu dengan memanfaatkan tanaman
obat yang telah terbukti dapat berkhasiat sebagai obat hipoglikemik (Widowati,
Dzulkarnain, Sa’roni, 1997).
M. tanarius tersebar luas dari India, Cina Selatan, Australia, di seluruh
pulau Borneo. Kebanyakan koleksi dari Sabah dan Kalimantan. Daun M.
tanarius di Indonesia digunakan untuk fermentasi kedelai dalam pembuatan
'tempe' dan juga sebagai pakan ternak. Di Filipina Kulit kayu dan daun untuk
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
minuman fermentasi disebut 'basi' yang terbuat dari tebu (Putri dan Kawabata,
2009).
Menurut Phommart, Sutthivaiyakit, Chimnoi, Ruchirawat, dan
Sutthivaiyakit (2005) dari ekstrak n-heksan dan kloroform daun M. tanarius
berupa flavonoid mempunyai aktivitas antioksidan terhadap DPPH dan
nymphaeols B sebagai agen antiinflamasi pada uji siklooksigenase-2. Putri dan
kawabata (2009) melaporkan EMMT mempunyai aktivitas penghambatan
terhadap α-glukosidase.Adanya aktivitas penghambatan α-glukosidase dari EMMT memberikan peluang untuk digunakan dalam menurunkan kadar glukosa
darah.
Pemilihan ekstrak metanol-air dalam penelitian ini dimaksudkan untuk
mendapatkan senyawa yang lebih banyak dalam penangkapan radikal bebas
(Matsunami, Takamori, Shinzato, Aramoto, Kondo, Otsuka, 2006) dan juga
karena senyawa ini termasuk dalam golongan glikosida yang mudah larut dalam
air. Oleh karena itu, dalam penelitian ini dilakukan uji efek EMMT dalam
menurunkan kadar glukosa darah pada tikus yang terbebani glukosa.
1. Permasalahan
Berdasarkan latar belakang tersebut muncul permasalahan sebagai
berikut:
a. Apakah EMMTdapat menurunkan kadar glukosa darah pada tikus
b. Pada dosis berapa EMMTdapat menurunkan kadar glukosa darah pada
tikus yang terbebani glukosa?
c. Berapa besar potensi EMMT yang efektif dalam menurunkan kadar
glukosa darah tikus yang terbebani glukosa?
2. Keaslian penelitian
Penelitian terkait pengujian daun M. tanarius melaporkan kandungan
EMMTmempunyai aktivitas potensial menghambat α-glukosidase yang dapat dimanfaatkan dalam menurunkan kadar glukosa darah (Puteri dan Kawabata,
2010). Menurut Phommart dkk, (2005) kandungan M. tanarius mempunyai
aktivitas antioksidan dansebagai agen antiinflamasi.M. tanarius juga
mempunyai aktivitas penangkapan radikal terhadap DPPH secara in vitro
(Matsunami, dkk, 2006).M. tanarius pernah dilakukan penelitian secara in vivo
diantaranya yaitu penelitian tentang efek analgesik ekstrak metanol-air daun M.
tanarius pada mecit galur Swiss (Andini dan Hendra, 2011), uji praklinik
ekstrak metanol-air daun M. tanarius.Kajian : aktivitas antiinflamasi dan
hepatoprotektif (Kurniawaty, Adrianto, dan Hendra, 2011).
Sejauh pengamatan penulis, penelitian tentang efek EMMT dalam
menurunkan kadar glukosa darah pada tikus putih belum pernah dilakukan.
3. Manfaat Penelitian
a. Manfaat teoritis. Penelitian ini diharapkan dapat memberikan
informasi yang berguna tentang obat tradisional yang dapat menurunkan kadar
glukosa darah.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
b. Manfaat praktis. Penelitian diharapakan dapat bermanfaat bagi
masyarakat karena memberikan informasi tentang khasiat daun M. tanariusyang
dapat menurunkan kadar glukosa darah.
B. Tujuan Penelitian
1. Untuk mengetahui EMMT dapat menurunkan kadar glukosa darahpada tikus
yang terbebani glukosa
2. Untuk mengetahui seberapa besar dosis EMMTdapat menurunkan kadar
glukosa darah
3. Untuk mengetahui seberapa besar potensi EMMT yang efektifdalam
6 BAB II
PENELAHAAN PUSTAKA
A. Diabetes Melitus
1. Definisi
Diabetes melitus merupakan kelompok penyakit metabolik dengan
karakteristik hiperglikemia yang terjadi karena kelainan sekresi insulin, kerja
insulin atau kedua-duanya (Soegondo, 2005). Pada diabetes, pankreas tidak
memproduksi insulin atau memproduksi insulin terlalu sedikit sehingga kadar
glukosa darah meningkat (Tjay dan Rahardja, 2002). Sesuai klasifikasi WHO,
disebut normal jika kadar glukosa plasma puasa < 110 mg/dl, glukosa plasma
terganggu jika kadar glukosa puasa antara 110-125 mg/dl, sedangkan toleransi
glukosa terganggu adalah kadar glukosa darah sesudah pembebanan 75 g antara
10-199 mg/dl. Disebut diabetes jika kadar gula darah puasa >126 mg/dl atau bila
kadar glukosa darah sesudah pembebanan glukosa 75 g >200 mg/dl (Merentek,
2006).
2. Gejala
Gejala klasik penyakit diabetes mellitus, yaitu :
a. Poliuria (banyak kencing). Banyak kencing disebabkan karena
glukosa menarik air, osmotic diureticakan terjadi mengakibatkan hilangnya
banyak air dan elektrolit lewat urine terutama natrium klorida, kalium dan fosfat.
Hilangnya air dan natrium akan mengakibatkan kurangnya asupan air (polidipsia),
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
biasanya terjadi pada waktu malam hari karena kadar gula darah relatif tinggi
pada malam hari.
b. Polidipsi (banyak minum). Merupakan akibat dari banyak kencing.
Untuk menghindari tubuh kekurangan cairan, maka akan timbul rasa haus yang
menyebabkan keinginan untuk terus minum selama kadar gula dalam darah belum
terkontrol dengan baik.
c. Polifagia (banyak makan). Terjadi karena berkurangnya cadangan
gula dalam tubuh meskipun kadar gula dalam darah tinggi sehingga tubuh
berusaha memperoleh tambahan cadangan gula dari makanan. Polifagia timbul
karena sel tubuh juga mengalami kekurangan bahan bakar (cell starvation)
(Lanywati, 2006; Baradero, Dayrit dan Siswadi, 2005).
3. Klasifikasi
a. Diabetes melitus tipe 1 (insulin-dependent diabetes mellitus) (IDDM).
IDDM umumnya timbul sebelum usia dewasa, walaupun juga terjadi pada orang
dewasa non-obese dan pasien yang sudah lanjut usia pada waktu diabetes mulai
muncul. Diabetes tipe ini disebabkan oleh gangguan katabolisme, dimana insulin
tidak ada sama sekali dalam sirkulasi, glukagon plasma meningkat, dan sel-sel ß
pankreas tidak responsif terhadap semua stimuli insulinogenik. Oleh sebab itu,
pasien ini mutlak memerlukan pengobatan insulin eksogen untuk memperbaiki
katabolisme, mencegah ketosis, menurunkan glukagon darah agar kadarnya yang
meningkat dalam darah dapat turun.
b. Diabetes melitus tipe 2 (noninsulin-dependent diabetes mellitus)
(NIDDM). NIDDM adalah tipe diabetes melitus yang umumnya muncul pada usia
insulin endogen dalam sirkulasi sebenarnya masih cukup tinggi untuk mencegah
ketoasidosis, tetapi seringkali sub-normal atau relatif tidak cukup karena
kebutuhan yang meningkat yang disebabkan oleh tidak sensitifnya jaringan.
Dengan demikian, pasien diabetes tipe ini tidak mutlak memerlukan insulin untuk
mempertahankan hidup (Wijayakusuma, 2006).
c. Diabetes melitus tipe lain. Tipe ini disebabkan oleh berbagai kelainan
genetik spesifik (kerusakan genetik sel ß pankreas dan kerja insulin), penyakit
pada pankreas, obat-obatan,bahan kimia, infeksi, dan lain- lain.
d. Diabetes melitus saat kehamilan. Diabetes mellitus saat kehamilan
merupakan istilah yang digunakan untuk wanita yang menderita diabetes selama
kehamilan dan kembali normal sesudah hamil. Banyak wanita yang mengalami
diabetes kehamilan kembali normal saat postpartum (setelah kelahiran), tetapi
pada beberapa wanita tidak demikian (Wijayakusuma, 2006).
4. Diagnosis
Diagnosis DM awalnya dipikirkan dengan dengan adanya gejala khas
berupa polifagia, poliuria, polidipsia, lemas, dan berat badan turun, kesemutan,
gatal, mata kabur, dan impotensi pada pria, serta pruritus vulva pada wanita
(Mansjoer, Kuspuji, Rakhmi, Wahyu dan Wiwiek, 2000). Keluhan dan gejala
yang khas ditambah hasil pemeriksaan glukosa darah sewaktu > 200 mg/dl atau
glukosa darah puasa ≥ 126 mg/dl sudah cukup untuk menegakkan diagnosis DM. Bila hasil pemeriksaan glukosa darah meragukan, pemeriksaan Tes Toleransi
Glukosa Oral (TTGO) diperlukan untuk memastikan diagnosis DM (Tabel I).
Untuk diagnosis DM dan gangguan toleransi glukosa lainnya diperiksa glukosa
darah 2 jam setelah beban glukosa. Sekurang-kurangnya diperlukan kadar glukosa
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
darah 2 kali abnormal untuk konfirmasi diagnosis DM pada hari yang lain atau
TTGO yang abnormal. Konfirmasi tidak diperlukan pada keadaan khas
hiperglikemia dengan dekompensasi metabolik akut, seperti ketoasidosis, berat
badan yang menurun cepat, dll (Mansjoer dkk., 2000).
Tabel I. Nilai glukosa plasma puasa dan toleransi glukosa
Glukosa plasma puasa
Normal < 100 mg/dl (5,6 mmol/L)
Glukosa plasma puasa terganggu 100 -125 mg/dl (5,6 – 6,9 mmol/L)
Diabetes melitus = 126 mg/dl (7,0 mmol/L)
Hasil tes toleransi glukosa oral, glukosa plasma 2 jam
Normal < 140 mg/dl (7,8 mmmol/L)
Toleransi glukosa terganggu 140 - 200 mg/dl (7,8 - 11,1 mmol/L)
Diabetes melitus = 200 mg/dl (11,1 mmol/L)
(Wijayakusuma, 2006).
B. Metabolisme Karbohidrat
Karbohidrat glukosa adalah karbohidrat terpenting dalam kaitannya
dengan penyediaan energi di dalam tubuh, hal ini dikarenakan semua jenis
karbohidrat baik monosakarida, disakarida, maupun polisakarida yang dikonsumsi
manusia akan terkonversi menjadi glukosa di dalam tubuh (Irawan, 2007).
Sumber energi terbesar manusia berasal dari karbohidrat.Karbohidrat dari
makanan dirombak di usus halus dan diubah menjadi glukosa, kemudian dilepas
ke aliran darah dan diangkut ke sel – sel tubuh (Tjay dan Raharja, 2002).
Glukosa yang diserap tubuh dari makanan digunakan sesuai keperluan,
senyawa lemak yang disebut glikogen. Gula yang menumpuk banyak di dalam
pembuluh darah akan membuat darah menjadi kental dan alirannya melambat,
sehingga mengakibatkan gangguan pada pasokan oksigen yang dibawa darah
(Mangoenprasodjo, 2005). Diantara beberapa penyakit kelainan metabolisme
karbohidrat, yang paling banyak diketahui adalah Diabetes Melitus (Tjay dan
Raharja, 2002).
Glukosa di dalam tubuh selain tersimpan dalam bentuk glikogen di dalam
otot dan hati, juga tersimpan pada plasma darah dalam bentuk glukosa darah
(blood glucose). Di dalam tubuh glukosa berperan sebagai bahan bakar bagi
proses metabolisme, dan sumber energi utama bagi kerja otak. Glukosa digunakan
untuk mensintesis molekul adenosine triphosphate (ATP) melalui proses oksidasi.
ATP merupakan molekul-molekul dasar penghasil energi di dalam tubuh. Dalam
kebutuhan seharian, glukosa menyediakan hampir 50-75% dari total kebutuhan
energi tubuh (Irawan, 2007).
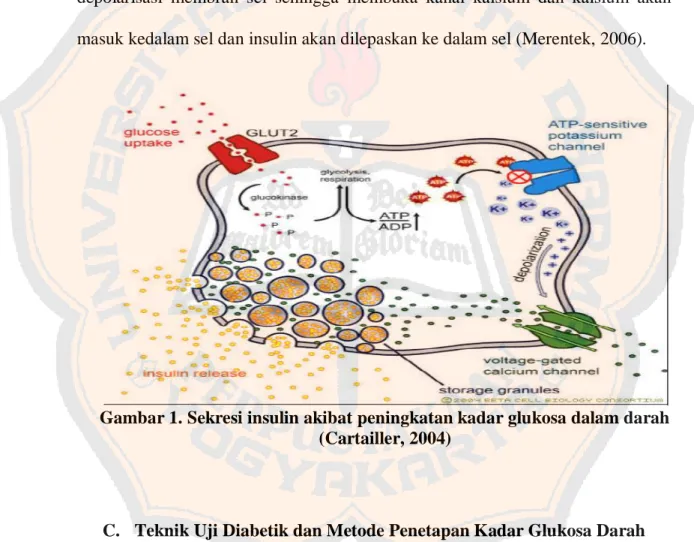
Sekresi insulin oleh sel ß (beta) tergantung oleh 3 faktor utama yaitu
kadar glukosa darah, ATP-sensitive K+ channels dan Voltage-sensitive
CalsiumChannels sel ß pancreas (Gambar 1). Mekanisme kerja faktor- faktor
tersebut adalah sebagai berikut: pada keadaan puasa, kadar glukosa darah turun,
ATP-sensitive K + channels pada membrane sel ß akan terbuka sehingga ion
kalium akan meninggalkan sel ß, dan Ca-channels tertutup, akibatnya kalsium
tidak dapat masuk ke dalam sel ß, dan perangsangan sel ß untuk mensekresi
insulin menurun (Merentek, 2006).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
Pada saat keadaan setelah makan, kadar glukosa darah akan meningkat
dan akan ditangkap oleh sel ß melalui glucose transporter 2 (GLUT2) dan dibawa
ke dalam sel ß. Di dalam sel, glukosa akan mengalami fosforilase menjadi
glukosa-6-fosfat (G6P) dengan bantuan enzim glukokinase. Glukosa-6-fosfat akan
mengalami glikolisis menjadi asam piruvat. Proses glikolisis juga menghasilkan
produk 6-8 ATP. Penambahan ATP ini akan meningkatkan rasio ATP/ADP dan
menutup kanal kalium. Penumpukan kalium dalam sel mengakibatkan
depolarisasi membran sel sehingga membuka kanal kalsium dan kalsium akan
masuk kedalam sel dan insulin akan dilepaskan ke dalam sel (Merentek, 2006).
Gambar 1. Sekresi insulin akibat peningkatan kadar glukosa dalam darah (Cartailler, 2004)
C. Teknik Uji Diabetik dan Metode Penetapan Kadar Glukosa Darah
1. Teknik uji diabetik
a. Uji toleransi glukosa oral. Kemampuan tubuh untuk mentolerir gula
(WHO, 1985), yang dilakukan sebelum dan sesudah menjalani pengobatan.
Semalam sebelum dilakukan GTT, pasien diminta berpuasa (10-16 jam).
Kemudian di pagi hari, pasien diminta untuk meminum larutan gula yang
mengandung 75 gram glukosa dalam 250-240 ml air. Sampel darah diambil sesaat
sebelum meminum glukosa, dan 2 jam setelah pemberian. Bila perlu
sampel-sampel darah juga bisa diambil setiap 0,5 jam setelah pembebanan glukosa (jam
ke 0; 0,5; 1; 1,5; 2 jam). Kemudian segera dianalisis untuk menentukan kadar
glukosa. Nilai kadar glukosa dalam plasma yang diambil untuk menunjukkan
keadaan diabetik sedikit berbeda yakni diatas 140 mg% sebelum pembeban dan
diatas 200 mg% pada 2 jam sesudah pembebanan (Direktorat Jendral Pengawasan
Obat dan Makanan RI, 1991).
b. Induksi aloksan. Aloksan (2,4,5,6-tetraoksipirimidin; 5,6-dioksiurasil)
merupakan senyawa hidrofilik dan tidak stabil (Gambar 2). Waktu paro pada suhu
37°C dan pH netral adalah 1,5 menit dan bisa lebih lama pada suhu yang lebih
rendah.
Gambar 2. Struktur aloksan (Nugroho, 2006)
Aloksan secara cepat dapat mencapai pankreas, aksinya diawali oleh
pengambilan yang cepat oleh sel β Langerhans.Pembentukan oksigen reaktif
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
merupakan faktor utama pada kerusakan sel tersebut. Faktor lain selain
pembentukan oksigen reaktif adalah gangguan pada homeostatis kalsium
intraseluler. Aloksan dapat meningkatkan konsentrasi ion kalsium bebas sitosolik
pada sel β Langerhans pankreas. Efek tersebut diikuti oleh beberapa kejadian :
influks kalsium dari cairan ekstraseluler, mobilisasi kalsium dari simpanannya
secara berlebihan, dan eliminasinya yang terbatas dari sitoplasma. Influks kalsium
akibat aloksan tersebut mengkaibatkan depolarisasi sel β Langerhans, lebih lanjut
membuka kanal kalsium tergantung voltase dan semakin menambah masuknya
ion kalsium ke sel. Pada kondisi tersebut, konsentrasi insulin meningkat sangat
cepat, dan secara signifikan mengakibatkan gangguan pada sensitivitas insulin
perifer dalam waktu singkat. Selain kedua faktor tersebut di atas, aloksan juga
diduga berperan dalam penghambatan glukokinase dalam proses metabolisme
energi (Nugroho, 2006).
c. Streptozotosin.Streptozotosin (STZ) atau
2-deoksi-2-[3-(metil-3-nitrosoureido)-D-gluko piranose] diperoleh dari Streptomyces achromogenes
dapat digunakan untuk menginduksi baik DM tipe 1 maupun tipe 2 pada hewan
uji. STZ menembus sel β Langerhans melalui tansporter glukosa GLUT 2. Aksi STZ intraseluler menghasikan perubahan DNA sel β pankreas. Alkilasi DNA oleh STZ melalui gugus nitrosourea mengakibatkan kerusakan pada sel β pancreas. Selain itu, STZ juga mampu membangkitkan oksigen reaktif yang mempunyai
peran tinggi dalam kerusakan sel β pancreas (Nugroho, 2006).
2. Metode penentuan kadar glukosa darah
Secara umum metoda penentuan glukosa darah dapat ditentukan dengan
a. Metode kondensasi gugus amin. Prinsip: aldosa dikondensasi dengan
orto toluidin dalam suasana asam dan menghasilkan larutan berwarna hijau
setelah dipanaskan. Kadar glukosa darah dapat ditentukan sesuai dengan intensitas
warna yang terjadi, diukur secara spektrofotometri.
b. Metode enzimatik. Glukosa dapat ditentukan secara enzimatik,
misalnya dengan penambahan enzim glukosa oksidase (GOD). Dengan adanya
oksigen, glukosa dioksidasi oleh enzim menjadi asam glukoronat disertai
pembentukan H2O2. Dengan adanya enzim perioksidase (POD), H2O2akan membebaskan O2 yang mengoksidasi akseptor kromogen yang sesuai serta memberikan warna yang sesuai pula. Kadar glukosa darah ditentukan berdasarkan
intensitas warna yang terjadi, diukur secara spektrofotometri.
c. Metode reduksi. Prinsip: Kadar glukosa darah ditentukan secara
reduksi dengan menggunakan suatu oksidan ferisianida yang direduksi menjadi
ferosianida oleh glukosa dalam suasana basa dengan pemanasan. Kemudian
kelebihan garam feri ditritasi secara iodometri.
d. Metode pemisahan glukosa. Glukosa dipisahkan dalam keadaan panas dengan antron atau timol dalam suasana asam sulfat pekat. Glukosa juga dapat
dipisahkan secara kromatografi, tetapi jarang dilakukan (Widowati dkk, 1997).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
D. Glibenklamida
OCH3
Cl
CO NH CH2 CH2 SO2 NH CO NH
Gambar 3. Struktur Glibenklamida (Gunawan, 2007)
1. Definisi
Glibenklamida (Gambar 3) merupakan antidiabetik oral derivat
sulfonilurea generasi kedua dimana rantai samping alifatik digantikan oleh
cyclohexyl group dan mempunyai struktur lebih kompleks dibanding generasi
pertama (Alberti, Zimmet, De Franzo,1997).
2. Farmakodinamik
Penurunan kadar glukosa darah yang terjadi setelah pemberian
sulfonilurea disebabkan oleh perangsangan sekresi insulin dari pankreas. Sifat
perangsangan ini berbeda dengan perangsangan oleh glukosa karena ternyata pada
saat hiperglikemi gagal merangsang sekresi insulin dalam jumlah yang cukup,
obat-obat tersebut masih mampu merangsang sekresi insulin pada dosis tinggi
(Tony dan Suharto, 2005).
Mekanisme kerja sulfonilurea termasuk menurunkan kadar glukagon
dalam serum, meningkatkan pengikatan insulin pada jaringan target dan reseptor,
dan menghambat penghancuran insulin oleh hati (Mycek, Harvey dan
Awal dosis pemberian yang biasa adalah 2,5 mg/hari atau kurang, dan
rata-rata dosis pemeliharaan adalah 5-10 mg/hari yang diberikan sebagai dosis
tunggal pada pagi hari. Tidak dianjurkan untuk memberikan dosis pemeliharaan
lebih dari 20 mg/hari (Nolte dan Karam, 2002).
3. Farmakokinetik
Absorpsi derivat sulfonilurea melalui usus baik sehingga dapat diberikan
per oral.Setelah absorpsi, obat ini tersebar ke seluruh cairan ekstrasel.Dalam
plasma sebagian terikat dalam protein plasma terutama albumin
(70-90%).Glibenklamida dimetabolisme dalam hati, hanya 25% metabolit diekskresi
melalui urin dan sisanya diekskresi melalui empedu dan tinja. Bila pemberian
dihentikan, obat akan bersih dari serum sesudah 36 jam (Toni dan Suharto, 2005).
4. Efek samping
Saluran cerna: mual, diare, sakit perut, hipersekresi asam lambung.
Susunan saraf pusat: vertigo, bingung, ataksia. Hematologik: lekopeni,
agranulositosis. Hipertiroidisme, ikterus obstruktif (Toni dan Suharto, 2005).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
E. Tanaman Macaranga tanarius L.
1. Keterangan botani
M. tanarius termasuk dalam famili Euphorbiaceae dengan sinonim
Ricinus tanarius L. (Wagner, Herbst, Sohmer, 1999), Macaranga molliuscula
Kurz, Macaranga tomentosa Druce, Mappa tanarius Blume (World Agroforestry
Centre, 2002). Dikenal di beberapa daerah dengan nama tutup ancur (Jawa), mapu
(Batak), mara (Sunda) (Prosea, 2010).
2. Taksonomi
Kingdom : Plantae (tumbuhan)
Subkingdom : Tracheobionta (tumbuhan berpembuluh)
Divisio : Spermatophyta (tumbuhan berbiji)
Sub-Divisi : Magnoliophyta (tumbuhan berbunga)
Classis : Magnoliopsida (tumbuhan dikotil)
Sub-classis : Rosidae
Ordo : Euphorbiales
Familia : Euphorbiaceae
Genus : Macaranga
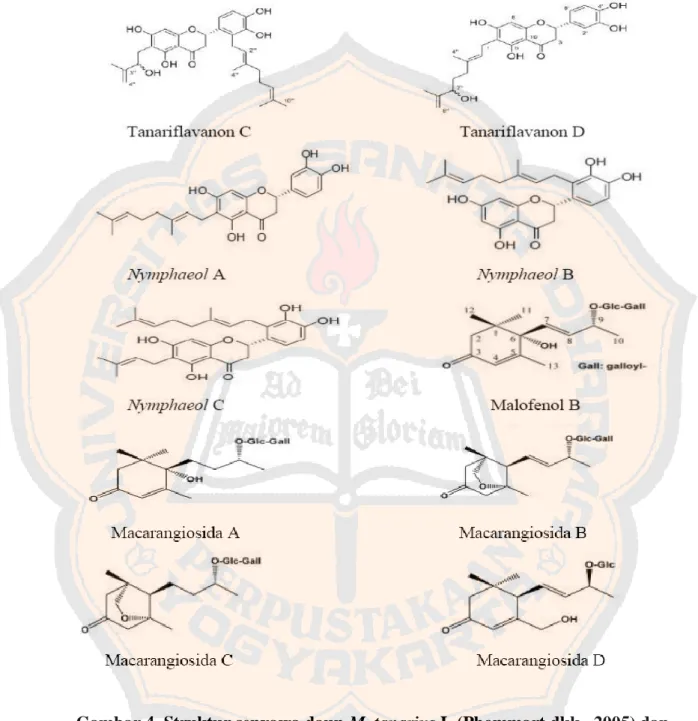
3. Kandungan
Dilaporkan empat kandungan baru dari daun M. tanarius
(Euphorbiaceae) megastigmate glukosida (Matsunami dkk., 2009). Matsunami
dkk, (2006) dan Matsunami dkk, (2009) melaporkan adanya senyawa glikosida
(Gambar 4) yaitu macarangioside A-C dan mallophenol B yang diisolasi dari
ekstrak metanol M. tanarius menunjukkan aktivitas penangkapan radikal terhadap
DPPH. Uji kimia dari tanin dalam daun M. tanarius menunjukkan tujuh
hydrolyzable tannin yang baru (22-28), bersama dengan dua puluh satu tanin yang
telah diketahui sebelumnya (Lin, Gen-ichiro dan Itsuo, 1990). Selain itu, juga
ditemukan ditemukan tiga kandungan baru yaitu tanarifuranonol,
tanariflavanonC, dan tanariflavanon D bersama dengan tujuh kandungan yang
telah diketahui yaitu nimfaeol A, nimfaeol B, nimfaeol C, tanariflavanonB,
blumenolA (vomifoliol), blumenol B (7,8 dihidrovomifoliol, dan annuionone).
Salah satu konstituen dari ekstrak n-heksan dan kloroform dari daun M. tanarius
berupa flavonoid mempunyai aktivitas antioksidan terhadap DPPH dan
nymphaeolsB sebagai agen antiinflamasi pada uji siklooksigenase-2. Adanya
kandungan senyawa antioksidan dari M. tanarius yang berpeluang sebagai agen
antiinflamasi, dapat mencegah terjadinya oksidasi parasetamol menjadi metabolit
NAPQI (Phommart dkk., 2005).
Dilaporkan 4 kandungan baru dari daun M. tanarius megastigman
glucoside, dinamai macarangiosida A-D bersama dengan campuran mallophenol
B, lauroside E, methyl brevifolin carboxylate, dan hyperin dan isoquercitrin
(Matsunami dkk., 2006), serta lignan glukosida, (+)-pinoresinol
4-O-[6n-O-galloyl]-β-D-glucopyranoside, dan 2 megastigman glukosida, dinamai
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
macarangiosida E dan F, bersama dengan 15 komponen lain yang telah diketahui
dilaporkan terdapat pada daun M. tanarius (Matsunami dkk., 2009).
Gambar 4. Struktur senyawa daun M. tanarius L.(Phommart dkk., 2005) dan (Matsunami dkk., 2006)
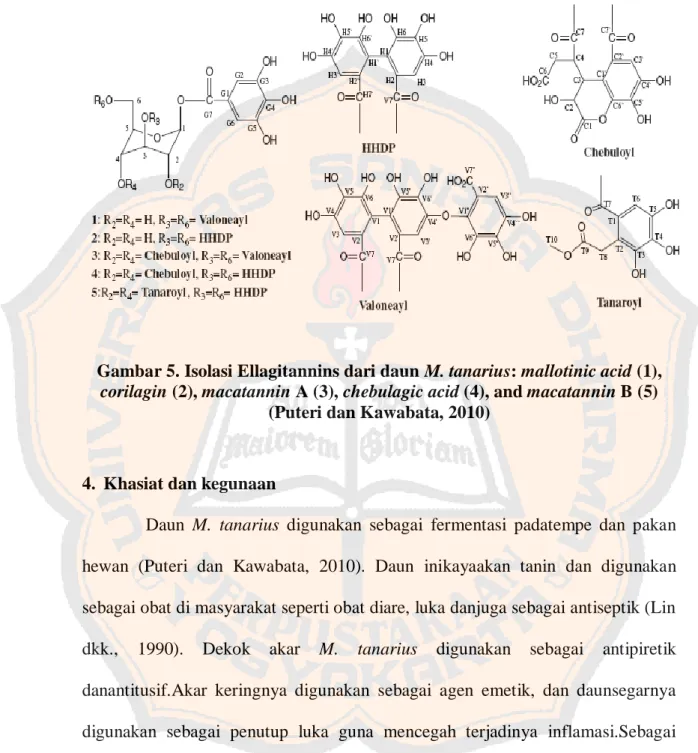
Kandungan EMMTberupa mallotinic acid, corilagin, macatannin A,
glukosidase yang dapat dimanfaatkan dalam menurunkan kadar glukosa darah
(Gambar 5) (Puteri dan Kawabata, 2010).
Gambar 5. Isolasi Ellagitannins dari daun M. tanarius: mallotinic acid (1), corilagin (2), macatannin A (3), chebulagic acid (4), and macatannin B (5)
(Puteri dan Kawabata, 2010)
4. Khasiat dan kegunaan
Daun M. tanarius digunakan sebagai fermentasi padatempe dan pakan
hewan (Puteri dan Kawabata, 2010). Daun inikayaakan tanin dan digunakan
sebagai obat di masyarakat seperti obat diare, luka danjuga sebagai antiseptik (Lin
dkk., 1990). Dekok akar M. tanarius digunakan sebagai antipiretik
danantitusif.Akar keringnya digunakan sebagai agen emetik, dan daunsegarnya
digunakan sebagai penutup luka guna mencegah terjadinya inflamasi.Sebagai
tumbuhan yang komersil, yang dijadikansebagai produk minuman kesehatan
(Lim, Lim dan Yule, 2009).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
5. Morfologi
Tanaman pohon dengan tinggi sekitar 4-20 m, daun berwarna hijau
dengan bentuk jantung dan pangkal daun berbentuk bulat, panjang petiole 6- 25
cm, kelopak bunga berwarna hijau hingga hijau kekuningan, kepala sari berbentuk
tetrahecal, tangkai putik berukuran 5-8 mm, kapsul 2-3 ruang dengan diameter
10-12 mm, ditutupi dengan kelenjar lilin yang halus (Wagner dkk., 1999).
6. Penyebaran
M. tanarius tersebar di hampir seluruh daerah tropis di dunia, antara lain:
Kepulauan Andaman dan Nicobar,Indo-Cina, Cina Selatan, Taiwan dan
Kepulauan Ryukyu, seluruh Malesia,sampai ke Australia Utara dan Timur dan
Melanesia. Jenis ini umum dijumpai didaratan Asia Tenggara (Thailand Selatan,
Semenanjung Malaya), dan padabanyak pulau di Malesia (yaitu Sumatra, Borneo,
Kepulauan Sunda kecil,Sulawesi, Nugini, seluruh Kepulauan Filipina) (Prosea,
2010). Tumbuhan inidapat ditemukan di sepanjang Asia Timur dan Selatan,
khususnya Cina Selatan,Korea dan Jepang (Matsunami dkk., 2006).
F. Metode Penyarian
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat
aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai,
kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang
tersisa diperlakukan sedemikian rupa hingga memenuhi baku yang telah
ditetapkan (Direktorat Jendral Pengawasan Obat dan Makanan RI, 1995).
Maserasi adalah cara penyarian yang sederhana. Maserasi dilakukan
akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat
aktif, zat aktif akan larut dan karena adanya perbedaan konsentrasi antara larutan
zat aktif di dalam dan di luar sel, maka larutan yang terpekat didesak keluar.
Peristiwa tersebut berulang sehingga terjadi keseimbangan konsentrasi antara
larutan di luar dan di dalam sel (Direktorat Jendral Pengawasan Obat dan
Makanan RI, 1986).
G. Landasan Teori
Diabetes melitus merupakan kelompok penyakit metabolik dengan
karakteristik hiperglikemia yang terjadi karena kelainan sekresi insulin, kerja
insulin atau kedua-duanya (Soegondo, 2005). Pada diabetes, pankreas tidak
memproduksi insulin atau memproduksi insulin terlalu sedikit sehingga kadar
glukosa darah meningkat (Tjay dan Rahardja, 2002). Berdasarkan laporan Putri
dan Kawabata (2010) dengan adanya aktivitas penghambatan terhadap
α-glukosidase maka dapat menyebabkan efek penurunan kadar glukosa darah. M.
tanarius dapat diuji mengikuti metode uji toleransi glukosa oral (UTGO) untuk
melihat kemampuan dalam menurunkan kadar glukosa darah tanaman tersebut
pada saat pemberian glukosa oral. Penelitian ini dilakukan dengan memberikan
EMMTmasing-masing 0,43; 1,28 dan 3,84 g/kg BB pada tikus yang terbebani
glukosa.
H. Hipotesis
EMMTdapat menurunkan kadar glukosa darah pada tikus yang terbebani
glukosa.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
23 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Jenis penelitian ini adalah eksperimental murni dengan rancangan
penelitian acak lengkap pola satu arah.
B. Variabel Penelitian dan Definisi Operasional
1. Variabel penelitian
a. Variabel bebas. Dosis EMMT. Dosis yang digunakan adalah jumlah
miligram EMMT tiap kilogram berat badan hewan uji.
b. Variabel tergantung. LDDK0-240kadar glukosa dalam darah. LDDK 0-240
kadar glukosa dalam darah adalah besaran yang menggambarkan jumlah kadar
glukosa dalam darah pada rentang waktu mulai menit ke-0 sampai menit ke-240
yang dihitung menggunakan metode trapezoid.
c. Variabel pengacau
1) Variabel pengacau terkendali
a) Jenis kelamin hewan uji : jantan
b) Galur hewan uji : Wistar
c) Berat badan hewan uji : 200-300 gram
d) Umur hewan uji : 2-3 bulan
e) Waktu pengamatan : 08.00-14.00
2) Variabel pengacau tak terkendali
a) Keadaan patologi subjek uji
b) Variasi biologis, yaitu kemampuan hewan uji dalam
mengabsorbsi EMMT
2. Definisi operasional
a. Daun M. tanarius adalah daun yang diambil dari tanaman M. tanarius,
memiliki daun yang berwarna hijau, tidak berlubang, segar, tidak terlalu tua dan
muda (diambil daun yang berada tidak dipangkal dan diujung batang).
b. EMMT berupa ekstrak kental yang diperoleh dengan mengekstraksi
serbuk kering daun M. tanarius seberat 10,0 gram yang dilarutkan dalam 100 ml
pelarut metanol-air 50% secara maserasi selama 72 jam, dengan putaran 140 rpm.
Kemudian disaring dengan kertas saring dan diuapkan di oven selama 24 jam
pada suhu 50oC, hingga diperoleh bobot ekstrak tetap dengan susut pengeringan sebesar 0%.
c. Efek menurunkan kadar glukosa darah adalah penurunan kadar
glukosa dalam darah yang dihitung dengan metode GOD-PAP
C. Bahan dan Alat Penelitian
1. Bahan penelitian
a. Hewan uji. Tikus putih jantan galur Wistar, umur 2 - 3 bulan, berat
badan 200-300 gram, dari Laboratorium Imono Hayati Fakultas Farmasi
Universitas Sanata Dharma.
b. Bahan uji. Daun M. tanariusyang diperoleh dari Kebun Obat
Universitas Sanata Dharma Yogyakarta.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
c. Senyawa pembanding. Senyawa pembanding berupa kaplet generik
glibenklamida produksi PT. IndoFarma.
d. Pereaksi untuk pengukuran kadar glukosa darah. Pereaksi yang
digunakan adalah enzim Glucose GOD FS*(DiaSys, Germany) yang terdiri atas:
Tabel II. Isi pereaksi enzim Glucose GOD-PAP
Reagen :
Phosphat buffer pH 7,5 250 mmol/L
Phenol 5 mmol/L
4-aminoantipyrine 0,5 mmol/L Glukosa oksidase (GOD) ≥ kU/L Phenol Amino Antipirin Peroksidase (PAP) ≤ 1 kU/L Glukosa standar 100 mg/dl (5,5 mmol/dl)
e. Lain-lain
1) Glukosa monohidrat p.a (Merck) dengan dosis 1,75 g/kg BB
sebagai larutan untuk pembuatan kurva baku dan untuk uji toleransi
glukosa oral
2) CMC 1% sebagai kontrol negatif dan pelarut (glibenklamida dan
EMMT) yang diperoleh dari Laboratorium Biofarmasetika dan
Bioanalisis Fakultas Farmasi Universitas Sanata Dharma
Yogyakarta.
3) Aquadest dan aquabidest yang diperoleh dari Laboratorium
Farmakologi Toksikologi Fakultas Farmasi Universitas Sanata
Dharma Yogyakarta.
4) Metanol (Merck) yang diperoleh dari Laboratorium
Farmakognosi-Fitokimia Fakultas Farmasi Universitas Sanata Dharma
5) Parafin cair sebagai pelancar aliran darah dalam pengambilan
sampel darah dari hewan uji, yang diperoleh dari Laboratorium
Biofarmasetika dan Bioanalisis Fakultas Farmasi Universitas
Sanata Dharma Yogyakarta.
2. Alat penelitian
a. Seperangkat alat gelas (Beaker glass, labu takar,tabung reaksi, gelas
ukur, batang pengaduk) merk pyrex
b. Jarum suntik (injeksi peroral)
c. Mortir dan stemper
d. Mesin penyerbuk, ayakan serbuk no.50, meserator dan evaporator
e. Sentrifuge (Centurion Scientific)
f. Micro vitalab (Microlab 200, Merck),mikro pipet dan blue tipe, yellow
tipe
g. Alat timbang elektrik (Mettler Toledo AB 204, Switzerland)
dantimbang analitik
h. Vortex (GENIE, merck)
i. Holder
j. Eppendorf
D. Jalannya Penelitian 1. Determinasi tanaman
Determinasi tanaman Macaranga tanarius L. bunga, daun, batang yang
dilakukan secara benar sesuai dengan buku acuan (Backer dan Van Den Brink,
1963).Determinasi dilakukan oleh Bapak Yohanes Dwiatmaka, M.Si.dilakukan di
Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
2. Pembuatan simplisia uji
a. Pengumpulan bahan. Daun M. tanarius diperoleh dari kebun obat
Fakultas Farmasi Universitas Sanata Dharma Yogyakarta yang di panen pada
bulan April 2011. Daun yang diambil adalah daun segar yang berwarna hijau dan
tidak berlubang.
b. Pembuatan simplisia. Pembuatan simplisia daun M. tanarius yang
telah dikumpulkan, dicuci dengan air mengalir, kemudian ditiriskan dengan sinar
matahari, untuk meniadakan air pada daun. Selanjutnya daun dikeringkan kembali
menggunakan oven pada suhu 40-500C selama 24 jam dan diserbuk. Kemudian serbuk simplisia diayak menggunakan ayakan nomor 50.
c. Pembuatan ekstrak metanol-air daun M. tanarius.Seberat 10,0 gram
serbuk kering daun M. tanarius dilarutkan dengan 100,0 ml metanol 50 % pada
erlenmeyer bersumbat. Kemudian diekstraksi secara maserasi selama 72 jam
dengan kecepatan 140 rpm pada suhu kamar. EMMT yang didapat kemudian
dievaporasi hingga kering dan menghasilkan EMMT pekat.
3. Preparasi bahan
a. Pembuatan larutan CMC 1% b/v. CMC ditimbang sebanyak 0,25
gram dan dilarutkan dengan aquadest dalam labu takar 25 ml sampai tanda.
b. Pembuatan larutan stok glukosa p.a. 15% b/v. Glukosa monohidrat
p.a. ditimbang sebanyak 15,0 gram dan dilarutkan dengan aquades dalam labu
takar 100 ml sampai tanda.
c. Penentuan keseragaman bobot kaplet glibenklamida. Penentuan
keseragaman bobot kaplet glibenklamida mengacu pada Depkes 1979. Timbang
tablet yang masing-masing bobotnya menyimpang dari bobot rata-ratanya lebih
besar dari harga yang ditetapkan kolom A, dan tidak satu tabletpun menyimpang
dari bobot rataratanya lebih dari harga yang ditetapkan kolom B. Nilai
penyimpangan bobot rata-rata kolom A dan B dapat dilihat pada tabel III.
Tabel III. Keseragaman bobot tablet
Bobot rata-rata Penyimpangan bobot rata-rata dalam %
A B
25 mg atau kurang 15 % 30 % 26 mg sampai dengan 150 mg 10 % 20 % 151 mg sampai dengan 300 mg 7,5 % 15 % lebih dari 300 mg 5 % 10 %
d. Penentuan dosis glibenklamida. Dosis glibenklamida yaitu 5 mg pada
manusia dengan berat badan 70,0 kg, dikonversikan ke tikus 200,0 gram dengan
faktor konversi 0,018. 5 mg glibenklamida x 0,018 = 0,09 mg glibenklamida/200
gram = 0,45 mg glibenklamida/ kg BB. Berdasarkan perhitungan maka besarnya
dosis glibenklamida pada hewan uji tikus yaitu 0,45 mg/ kg BB.
e. Pembuatan larutan glibenklamida 0,1125 mg/ml. Timbang serbuk
glibenklamida setara dengan 25,0 mg glibenklamida murni, larutkan dengan CMC
1% dalam labu takar 10,0 ml sampai tanda sebagai larutan induk glibenklamida.
Buat dengan konsentrasi 0,1125 mg/ml dalam labu ukur 10 ml dari larutan induk
glibenklamida tersebut.
f. Validasi dan realiabilitas instrument penelitian.Hasil pengukuran yang
baik dari suatu parameter kuantitas kimia, dapat dilihatberdasarkan tingkat presisi
dan akurasi yang dihasilkan. Akurasi menunjukkan kedekatan nilaihasil
pengukuran dengan nilai sebenarnya. Presisi menunjukkan tingkat reliabilitas dari
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
data yang diperoleh, hal inidapat dilihat dari standar deviasi yang diperoleh dari
pengukuran( Tahir, 2008).
Menurut Direktorat Bina Pelayanan Penunjang Medik Departemen
Kesehatan Republik Indonesia (2008), alat dikatakan memiliki presisi yang baik
apabila coefisien variasi (CV) ≤ 5% CV yang diperoleh hasil uji presisi Micro vitalab adalah 2,07 % sehingga dapat dikatakan instrument penelitian memiliki
presisi yang baik. Dapat dilihat dari hasil pengukuran kadar secara berulang
menunjukkan kedekatan nilaihasil pengukuran dengan nilai sebenarnya. Hal ini
menunjukkan bahwa alat memenuhi akurasi yang baik.
4. Percobaan pendahuluan
a. Penetapan waktu pemberian glibenklamida. Tujuan dari penetapan
pemberian glibenklamida adalah untuk melihat pengaruh waktu pemberian
terhadap efek hipoglikemik glibenklamida, agar pada saat uji toleransi glikosa oral
(UTGO) glibenklamida sudah memberikan efek penurunan kadar glukosa darah.
Orientasi ini menggunakan 9 ekor tikus yang terbagi dalam 3 kelompok dimana
masing-masing kelompok diberi perlakuan pada menit ke-15 sebelum UTGO
untuk kelompok I, menit 30 sebelum UTGO untuk kelompok II, dan menit
ke-45 sebelum UTGO untuk kelompok III. Semua pemberian dilakukan secara
peroral, selanjutnya dilakukan UTGO dengan diberikan larutan glukosa
monohidrat 1,75 g/kg BB. Pengambilan cuplikan darah dilakukan sesaat sebelum
perlakuan sebagai menit ke-0 dan pada menit ke-15, 30, 45, 60, 90, 180, dan 240.
Pengukuran kadar glukosa darah dilakukan dengan menggunakan metode
b. Penetapan waktu pemberian EMMT. Tujuannya untuk melihat
pengaruh waktu pemberian terhadap efek penurunan kadar glukosa darah, agar
pada saat dilakukan UTGO EMMT sudah memberikan efek dalam menurunkan
kadar glukosa darah. Orientasi ini menggunakan 5 ekor tikus yang masing-masing
diberi ekstrak daun M. tanarius pada menit ke-0, dan 15 sebelum UTGO. Semua
pemberian dilakukan secara peroral, selanjutnya dilakukan UTGO dengan
diberikan larutan glukosa monohidrat 15% b/v; 1,75 g/kg BB. Pengambilan
cuplikan darah dilakukan sesaat sebelum perlakuan sebagai menit ke-0 dan pada
menit ke-15, 30, 45, 60, 90, 180, dan 240. Pengukuran kadar glukosa darah
dilakukan dengan menggunakan metode GOD-PAP. Selanjutnya dibuat
perhitungan harga LDKK0-240. Penentuan waktu pemberian EMMT didasarkan pada harga LDKK0-240 terendah.
c. Pengelompokan hewan uji.Hewan percobaan yang digunakan
sebanyak 30 ekor tikus yang dibagi secara acak dalam 5 kelompok sama banyak.
Kelompok I (kontrol positif) diberi glibenklamida 0,45 mg/kg BB. Kelompok II
(kontrol negatif) diberi CMC 1 % 5 ml/ kg BB. Kelompok III-V (perlakuan)
diberi EMMT sebesar 0,43; 1,28; dan 3,84 g/kg BB secara per oral
5. Penetapan kadar glukosa darah
Kadar glukosa darah ditetapkan dengan metode GOD-PAP. Pada tiap
kelompok dilakukan pengambilan cuplikan darah sebanyak 0,5 ml melalui vena
lateralis ekor dan ditampung dalam eppendrof sesaat sebelum perlakuan sebagai
menit ke-0 dan pada menit ke-15, 30, 45, 60, 90, 180, dan 240. Setelah UTGO
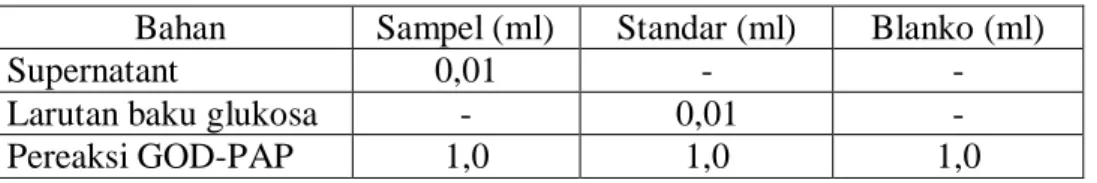
kemudian darah dipusingkan 3000 rpm selama 10 menit. Selanjutnya diambil 0,01
ml, kemudian dilakukan pengukuran seperti dalam tabel berikut:
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
Tabel IV. Volume pengukuran kadar glukosa darah
Bahan Sampel (ml) Standar (ml) Blanko (ml) Supernatant 0,01 - - Larutan baku glukosa - 0,01 - Pereaksi GOD-PAP 1,0 1,0 1,0
Alat yang digunakan untuk menganalisis kadar glukosa serum adalah
micro vitalab. Kadar glukosa dinyatakan dalam mg/dL. Pengukuran kadar glukosa
serum dilakukan di laboratorium Farmakologi-Toksikologi Fakultas Farmasi
USD, Yogyakarta.
Setelah kadar glukosa serum didapatkan, dibuat kurva dengan mem-plot
-kan nilai kadar glukosa darah lawan waktu ke-0 sampai menit ke-240 dengan
metode trapezoid (LDDK0-240) dan rumus yang digunakan adalah sebagai berikut:
LDDKt0−tn =t1−t0 2 x C0+ C1 + t2−t1 2 x C1+ C2 + tn−tn −1 2 x Cn−1 + Cn Keterangan: t = waktu (jam/menit)
C = konsentrasi zat dalam darah (mg/ml)
LDDKto-tn = luas daerah di bawah kurva dari waktu ke-0 sampai ke-n
E. Analisis Hasil
Data kadar glukosa darah pada tiap kelompok dianalisis secara statistik.
Dari harga LDDK0-240 glukosa darah dilakukan uji distribusi menggunakan uji
Kolmogorov Smirnov kemudian jika distribusinya normal dilanjutkan dengan
analisis One Way ANOVA dan Post Hoc Tests Scheffe dengan tingkat
kepercayaan 95%.
Jika nilai LDDK 0-240 glukosa darah mempunyai variansi yang berbeda maka dilakukan uji Kruskal Wallis dan dilanjutkan uji Mann Whitney dengan
32 BAB IV
HASIL DAN PEMBAHASAN
A. Hasil determinasi Tanaman
Bahan yang akan diteliti dalam penelitian ini adalah daun dari tanaman
M.tanarius. Sebelum digunakan dalam pengujian efek EMMT dalam menurunkan
kadar glukosa darah maka diperlukan determinasi tanaman untuk memastikan
bahwa tanaman yang digunakan telah sesuai sehingga tidak terjadi kesalahan
dalam pengambilan sampel yang akan digunakan sebagai tanaman uji. Bagian
tanaman yang digunakan dalam determinasi adalah bagian batang, daun, dan
bunga.Determinasi tanaman dilakukan di laboratorium Kebun Tanaman Obat
Fakultas Farmasi Universitas Sanata Dharma Yogyakarta dengan menggunakan
pustaka acuan(Backer dan Van Den Brink, 1963).
Hasil determinasi sebagai berikut :
1b, 2b, 3b, 4b, 12b, 13b, 14b, 17b, 18b, 19b, 20b, 21b, 22b, 23b, 24b,
25a...99.Euphorbiaceae
1b, 3b, 4b, 6a, 7b, 8b, 10b, 13a, 14b...34. Macaranga
1a,2a,3b,5b...Macaranga tanarius (L.) M.A
Dari hasil determinasi tersebut membuktikan bahwa yang dideterminasi adalah
benar tanaman Senu (Macaranga tanarius).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
B. Hasil ekstraksi daun M. tanarius
Metode yang digunakan dalam pembuatan EMMT adalah metode
penyarian maserasi.Metode ini digunakan karena pengerjaan dan peralatan yang
digunakan sederhana, mudah dan efisien. Selain itu, metode ini digunakan untuk
penyarian simplisia yang mengandung zat aktif yang mudah larut dalam cairan
penyari sehingga kadarnya akan menjadi lebih besar. Cairan penyari yang
digunakan yaitu metanol-air (50:50).Tujuan dilarutkan dalam pelarut metanol
adalah agar senyawa kimia yang terkandung dalam daun M. tanarius dapat larut
dalam pelarut karena metanol lebih polar dibandingkan dengan etanol sehingga
metanol menarik senyawa kimia di dalam daun lebih kuat.Selain itu metanol lebih
cepat menguap (titik didih rendah) jika dibandingkan dengan etanol, sehingga
tidak membutuhkan panas yang lebih tinggi yang dapat merusak senyawa kimia
yang ada di dalam daun.
Sebelum dilakukan ekstraksi, dilakukan penyerbukan terlebih dahulu
agar kandungan fitokimia yang terkandung dalam daun lebih mudah terekstrak
karena luas permukaan serbuk yang kontak dengan pelarut semakin besar. No
ayakan yang digunakan yaitu no. 50 yang artinya bahwa dalam 1 inchi ada 50
lubang. Serbuk daun M. tanarius seberat 25 gram direndam dengan 250 ml pelarut
metanol 50% di dalam erlenmeyer selama 72 jam (Puteri dan Kawabata, 2009)
dengan kecepatan 140 rpm pada suhu kamar. Perendaman ini ditujukan supaya
senyawa kimia yang terkandung dalam tumbuhan dapat larut dalam pelarut
tersebut. Setelah dilakukan perendaman, dilakukan penyaringan dengan kertas
saring dan kemudian di evaporasi untuk menghilangkan atau menguapkan
dimaksudkan untuk mempermudah perhitungan rendemen ekstrak kental yang
akan diperoleh. Kemudian dimasukkan dalam oven dengan suhu 40-50oC sampai mendapat EMMT yang kental.
Standarisasi yang dilakukan pada EMMTadalah penimbangan bobot
ekstrak hingga diperoleh bobot tetap dengan susut pengeringan 0%.Parameter
non-spesifik yaitu parameter susut pengeringan digunakan dengan maksud untuk
mengukur sisa zat setelah pengeringan pada temperatur 50ºC. Cawan berisi
ekstrak ditimbang setiap hari sampai diperoleh berat ekstrak konstan. Hal tersebut
dilakukan untuk memberikan batasan maksimal (rentang) tentang besarnya
senyawa yang hilang pada proses pengeringan karena hal ini dapat mempengaruhi
bobot ekstrak yang didapat sehingga akan mempengaruhi konsentrasi ekstrak dan
dosis yang akan digunakan pada hewan uji.
Dari proses pengeringan diperoleh bobot ekstrak tetap (tidak ada
perubahan bobot ekstrak) pada hari ke-4 dan ke-5 dan susut pengeringan
EMMTpada hari ke-4 dan ke-5 sebesar 0% sehingga diketahui bahwa tidak ada
pelarut penyari yang masih tersisa. Oleh karena itu, pada penelitian ini digunakan
waktu pengeringan selama 5 hari diperoleh bobot EMMT yang tetap .Rendemen
EMMT diperoleh dari pengurangan beaker glass yang berisi ekstrak kering
dengan beaker glass kosong sehingga didapatkan total berat EMMT. Dari 125 g
serbuk kering didapatkan 41,01 g EMMT kental sehingga diperoleh rendemen
sebesar 3,28 %.
C. Hasil Uji Pendahuluan
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
Uji pendahuluan dilakukan sebelum pengujian efek EMMT dalam
menurunkan kadar glukosa darah. Uji pendahuluan ini dilakukan untuk
menetapkan hal-hal yang akan dilakukan pada pengujian yang sebenarnya, agar
didapat hasil yang lebih valid dan akurat. Adapun uji pendahuluan yang dilakukan
antara lain : penetapan waktu pemberian kontrol positif (glibenklamida),
penetapan dosis EMMT, selang waktu pemberian EMMT.
1. Penetapan waktu pemberian kontrol positif (glibenklamida)
Waktu pemberian larutan glibenklamida didasarkan pada prosentase
penurunan harga luas daerah dibawah kurva dari menit ke-0 sampai menit ke-240
(LDDK0-240). Hasil dari LDDK0-240 ini kemudian di uji statistika dengan uji uji
Post Hoc Scheffe, seperti yang terlihat pada tabel V:
Tabel V. Hasil uji Post Hoc Scheffe LDDK 0-240glukosa darah tikus yang terbebani glukosa Waktu Pemberian Glibenklamida (Menit) 15 30 45 15 --- BTB BTB 30 BTB - BTB 45 BTB BTB - Keterangan :
BTB : Berbeda tidak bermakna
Hasil uji post Hoc ScheffeLDDK0-240 glukosa darah pada tabel V menunjukkan bahwa waktu pemberian pada menit ke-15, 30 dan 45 sebelum
pemberian UTGO menunjukkan perbedaan yang tidak bermakna. Dan dari hasil
UTGO dan perhitungan LDDK0-240 didapatkan dilihat di tabel VI:
Tabel VI. NilaiLDDK0-240larutan glibenklamida sebelum UTGO
Waktu pemberian larutan glibenklamida sebelum UTGO
(menit ke-)
LDDK 0-240 (mg.menit/dl)
15 17557,5 30 17232,5
45 22840
Dari tabel VI dapat dilihat bahwa pemberian larutan glibenklamida 30
menit sebelum UTGO mempunyai nilai LDDK 0-240 yang paling kecil dibandingkan dengan pemberian yang lain sehingga dapat ditetapkan pemberian
larutan glibenklamida sebagai kontrol positif untuk dibandingkan dengan EMMT
yaitu 30 menit sebelum UTGO. Pada menit ke-30 ini glibenklamida mempunyai
kemampuan untuk menurunkan kadar glukosa yang paling tinggi dibandingkan
dengan menit ke-15 dan menit ke-45. Untuk lebih jelasnya dapat dilihat pada
gambar 6:
Gambar 6. Diagram penentuan selang waktu pemberian glibenklamida terhadap LDDK
Dari gambar 6 menunjukkan bahwa pada menit ke-30 mempunyai nilai
LDDK 0-240 yang paling kecil dibandingkan dengan yang lainnya sehingga 30
0 5000 10000 15000 20000 25000 15 30 45 17557,5 17232,5 22840 LD D K p e m b e ri an gl ib e n kl am id a (m g.m e n it /d l)
selang waktu waktu (menit)
15 30 45
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
menit sebelum UTGO ditetapkan sebagai waktu pemberian kontrol positif
glibenklamida.
2. Penetapan dosis ekstrak metanol-air daun M. tanarius
Tujuan ditetapkan dosis EMMTadalah untuk menentukan tingkatan dosis
EMMTyang akan digunakan dalam penelitian ini. Penentuan dosis EMMT
didasarkan pada dosis maksimal EMMT pada tikus. Dosis maksimal EMMTpada
tikus didasarkan pada konsentrasi tertinggi EMMTyang dapat dipejankan secara
oral. Dari hasil orientasi diketahui bahwa konsentrasi tertinggi EMMTyang dapat
dipejankan secara oral pada tikus yaitu 384 mg/ml sehingga dosis maksimal yang
diperoleh sebesar 3,84 g/kgBB. Kemudian ditentukan 3 tingkatan dosis
EMMTyaitu 0,43; 1,28; dan 3,84 g/kgBB (Adrianto dkk., 2011).
3. Selang waktu pemberian ekstrak M. tanarius
Waktu pemberian EMMT didasarkan pada prosentase penurunan harga
luas daerah dibawah kurva dari menit ke-0 sampai menit ke-240 (LDDK0-240). Dari hasil UTGO dan perhitungan LDDK0-240 dapat dilihat di tabel VI :
Tabel VII. NilaiLDDK0-240 ekstrak M. tanarius sebelum UTGO
Waktu pemberian ekstrak M. tanarius
sebelum UTGO (menit ke-)
LDDK0-240 (mg.menit/dl)
0 23680
15 29947,5
Dari tabel VII dapat dilihat bahwa pemberian EMMT bersamaan (menit
ke-0) dengan UTGO mempunyai nilai LDDK 0-240 yang paling kecil dibandingkan dengan pemberian 15 menit sebelum UTGO sehingga dapat ditetapkan pemberian
kemampuan untuk menurunkan kadar glukosa yang paling tinggi dibandingkan
dengan menit ke-15. Untuk lebih jelasnya dapat dilihat pada gambar 7 :
Gambar 7. Diagram penentuan selang waktu pemberian ekstrak M. tanarius terhadap LDDK
Dari gambar 7 dapat dilihat bahwa pada menit ke-0 menunjukkan LDDK
0-240
yang kecil dibandingkan dengan menit ke-15. Jadi kemampuan larutan
ekstrak dalam menurunkan kadar glukosa darah paling efektif pada menit ke-0
sehingga ditetapkan sebagai waktu pemberiaan EMMT.
D. Efek Penurunan Kadar Glukosa Darah ekstrak M. tanarius
Penetapan kadar glukosa darah dilakukan dengan metode enzimatis, yaitu
dengan menambahkan reagen GOD-PAP dengan prinsip adanya GOD (glukosa
oxidase) yang akan mengkatalisis oksidasi glukosa menjadi asam glukonat dan
hydrogen peroksida. Reagen GOD-PAP berisi dapar fosfat 250 mmol/L, fenol 5
mmol/L, 4-amino antipirin 0,5 mmol/L, glukosa oksidase (GOD) ≥ 10 ku/L, dan
peroksidase (POD) ≥1 ku/L. Jika glukosa bereaksi dengan reagen GOD-PAP akan
0 5000 10000 15000 20000 25000 30000 0 15 23680 29947,5 LD D K p em b eri an e ks tra k (m g.m en it /d l)
selang waktu waktu (menit)
0 15