BAB II
TINJAUAN PUSTAKA
2.1 Saos
Saos merupakan bumbu penyedap makanan atau biasanya digunakan untuk menambah kelezatan pada makanan. Saos berbentuk seperti bubur kental (pasta) dan umumnya bewarna orange hingga merah. Pembuatannya saos sering ditambahkan dengan zat pewarna makanan alami maupun buatan.Warna saos biasanya terbuat dari buah berwarna menarik seperti warna merah atau ditambahkan zat pewarna, selain warna saos mempunyai aroma dan rasa yang merangsang (dengan atau tanpa rasa pedas), mempunyai daya simpan panjang karena mengandung asam, gula, garam dan seringkali ditambahkan pengawet (Putra dkk, 2014 dan Margono, 2000).
2.1.1 Fungsi Saos
Kebutuhan akan saos dari tahun ke tahun terus meningkat. Di Indonesia, saos merupakan produk olahan yang sangat populer, karena berfungsi sebagai penambah cita rasa dan selera pada makanan. Saos juga banyak digunakan pada industri pengalengan ikan. Selain sebagai campuran bumbu, saos dipakai sebagai pelengkap hidangan (Margono, 2000).
2.2 Cabai Merah
Cabai merah (Capsicum annum L.)merupakan salah satu jenis tanaman hortikultura yang dibudidayakan secara komersial, hal ini disebabkan selain cabai
memiliki kandungan gizi yang cukup lengkap juga memiliki nilai ekonomis tinggi yang banyak digunakan baik untuk konsumsi rumah tangga maupun untuk keperluan industri makanan. Cabai merah dapat ditanam dengan kisaran suhu antara 21oC–27oC (Nurlenawati dkk, 2010).
Klasifikasi tanaman cabai Kingdom : Plantae Dividi : Spermatophyta Subdivisi : Angiospermae Kelas : Dicotyledoneae Subkelas : Sympetalae Ordo : Tubiflorae Famili : Solanaceae Genus : Capsicum
Species : Capsicum annum L.
(Kusandriani, 1996).
2.3 Zat Pewarna 2.3.1 Pewarna Alami
Pewarna alami merupakan pewarna (pigmen) yang berasal dari tumbuh– tumbuhan atau hewan contohnya karotenoid, klorofil, tannin, dan kuinon. Walaupun terdapat secara alami dalam tumbuhan dan hewan, pewarna alami juga dapat timbul akibat proses pemanasan, penyimpanan atau proses-proses pengolahan pangan yang lain (Nugraheni, 2014).
Pewarna alami dalam penggunaanya perlu dalam jumlah lebih banyak agar dapat menghasilkan warna yang baik sehingga pewarna alami lebih mahal, selain itu ketersediaanya pun terbatas. Warna yang tersedia juga kurang bervariasi, sehingga hanya terbatas pada warna–warna asli dari tumbuhan atau hewan yang menghasilkan zat warna tersebut (Murdiati dan Amaliah, 2013).
Ciri–ciri zat warna alami pada produk pangan: a. konsentrasi pigmen rendah (warna agak suram)
b. seringkali memberikan rasa khas yang tidak diinginkan c. mudah larut dalam air
d. satabilitas pigmen rendah e. keseragaman warna kurang baik
f. spektrum warna tidak seluas seperti pada pewarna sintetis g. membutuhkan waktu lama untuk meresap kedalam produk
h. mudah mengalami degradasi atau pemudaran pada saat saat diolah dan disimpan
i. selain itu umumnya, pigmen-pigen ini bersifat tidak cukup stabil terhadap panas, cahaya dan pH tertentu. Walau begitu, pewarna alami umumnya aman dan tidak menimbulkan efek samping bagi tubuh (Nugraheni, 2014).
Tabel 2.1 Sifat-Sifat Bahan Pewarna Alami
Kelompok Warna Sumber Kelarutan Stabilitas
Karamel Cokelat Gula
dipanaskan
Anthosianin Jingga Merah Biru
Tanaman Air Peka
terhadap panas dan pH Flavonoid Tanpa kuning Tanaman Air Stabil
terhadap panas
Leucoanthosianin Tidak bewarna Tanaman Air Stabil terhadap
panas
Tannin Tidak bewarna Tanaman Air Stabil
terhadap panas Batalain Kuning, merah Tanaman Air Sensitif
terhadap panas Quinon Kuning-hitam Tanaman
bakteria lumut
Air Stabil terhadap
panas
Xanthon Kuning Tanaman Air Stabil
terhadap panas Karotenoid Tanpa kuning- Tanaman/ Lipida Stabil
merah hewan terhadap panas Klorofil Hijau,cokelat Tanaman Lipida dan
air
Sensitif terhadap panas
Heme Merah,cokelat Hewan Air Sensitif
terhadap panas (Cahyadi, 2006). Penggunaaan pewarna makanan alami semakin lama semakin ditinggalkan produsen makanan. Hal ini disebabkan karena kurang praktis, memberi rasa khas yang tidak diinginkan, kurang stabil dalam penyimpanan, menghasilkan warna yang kurang seragam yang bisa disebabkan oleh perubahan pH, proses oksidasi, pengaruh cahaya dan pemanasan sehingga intensitas warnanya sering berkurang selama proses pembuatan makanan. Akibatnya produsen makanan banyak yang beralih ke pewarna sintetis (Nugraheni, 2014).
2.3.2 Pewarna Sintetis
Zat pewarna sintetis merupakan zat pewarna buatan manusia. Zat pewarna sintetis harus melalui suatu pengujian secara intensif untuk menjamin keamananya. Karakteristik dari zat pewarna sintetis adalah warnanya lebih cerah, lebih homogen dan memilikiwarna yang bervariasi dibandingkan dengan zat pewarna alami. Disamping itu penggunaan zat pewarna sintetis pada makanan bila
dihitung berdasarkan harga per unit dan efisiensi produksi akan jauh lebih murah dibandingkan dengan zat pewarna alami (Pahmawati, 2011).
Beberapa keuntungan penggunaan zat pewarna sintetis adalah tersedia dalam jumlah yang memadai, stabilitas bagus, kekuatan mewarnai yang tinggi menjadikan zat pewarna sintetis menguntungkan secara ekonomi, daya larut bagus dalam air dan alkohol, tidak berasa dan tidak berbau tersedia dalam berbagai bentuk dan bebas bakteri (Nugraheni, 2014).
Pewarna sintetis juga mempunyai kekuranganyaitu dapat menimbulkan berbagai macam penyakit terutama jika digunakan dengan dosis yang berlebihan atau pemakaiannya sedikit tetapi dikonsumsi secara rutin dalam waktu yang lama (Murdiati dan Amaliah, 2013).
Ciri–ciri pewarna sintetis antara lain:
a. warna cerah meskipun sudah mengalami proses pengolahan dan pemanasan
b. tidak mudah larut dalam air
c. membutuhkan bahan pewarna lebih sedikit, karena dalam konsentrasi rendah sudah mampu mewarnai dengan baik
d. cepat meresap ke dalam produk (Nugraheni, 2014).
Proses pembuatan zat warna sintetis biasanya melaui pemberian asam sulfat atau asam nitrat yang seringkali terkontaminasi oleh arsen atau logam berat lain yang bersifat racun. Pada pembuatan zat pewarna organik sebelum mencapai produk akhir, harus memenuhi suatu senyawa dulu yang terkadang berbahaya dan sering kali tertinggal dalam hal akhir atau berbentuk senyawa–senyawa baru yang
berbahaya. Namun sering sekali terjadi penyalahgunaan pemakaian zat pewarna untuk bahan pangan, misalnya zat pewarna tekstil dan kulit untuk mewarnai bahan pangan. Zat pewarna yang berbahaya terhadap kesehatan seperti Amaran, Auramin, Methanyl Yellow dan Rhodamin B (Nugraheni, 2014).
Untuk zat pewarna yang dianggap aman, ditetapkan kandungan arsen tidak boleh lebih dari 0,0004% dan timbal tidak boleh lebih dari 0,0001, sedangkan logam berat lainnya tidak boleh ada (Cahyadi, 2006).
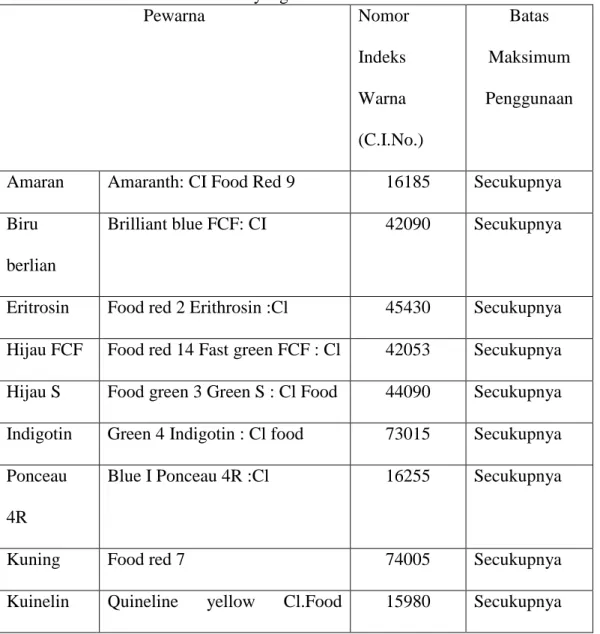
Tabel 2.2 Bahan Pewarna Sintetis yang Diizinkan di Indonesia
Pewarna Nomor Indeks Warna (C.I.No.) Batas Maksimum Penggunaan
Amaran Amaranth: CI Food Red 9 16185 Secukupnya Biru
berlian
Brilliant blue FCF: CI 42090 Secukupnya
Eritrosin Food red 2 Erithrosin :Cl 45430 Secukupnya Hijau FCF Food red 14 Fast green FCF : Cl 42053 Secukupnya Hijau S Food green 3 Green S : Cl Food 44090 Secukupnya Indigotin Green 4 Indigotin : Cl food 73015 Secukupnya Ponceau
4R
Blue I Ponceau 4R :Cl 16255 Secukupnya
Kuning Food red 7 74005 Secukupnya
yellow 13 Kuning
FCF
Sunset yellow FCF Cl. Food yellow 3
- Secukupnya
Riboflavina Riboflavin 19140 Secukupnya
Tartrazine Tartrazine - Secukupnya
(Yuliarti, 2007). Tabel 2.3 Bahan Pewarna Sintetis yang Dilarang di IndonesiaBerdasarkan Peraturan Menkes RI Nomor 239/Menkes/Per/v/85
Nama Indeks Warna
Auramine (Cl basic yellow 2) 41000
Alkanet 755250
Butter Yellow (Cl solvent yellow) 11020
Chrysoidine (Cl food yellow B) 114270
Citrous 22156
Chocolate brown FB (Food Brown) -
Methanyl yellow (ext DC yellow1) 13065 Oil orange XO (Cl solvent oranges 7) 12140 Oil orange AB (Cl solvent orange 5) 11380
Orange RN (Cl food orange 1) 15970
Ponceau 3R (Cl food red 6) 16135
Ponceau SX (Cl food red 1) 14700
Rhodamin B (Cl food red 15) 45170
Scarlet GN (Cl food red 2) 14815
(Sulami, 2009). 2.3.2.1Rhodamin B
Rhodamin B dalam dunia perdagangan sering dikenal dengan nama tetra ethyl rhodamin B, D dan Red no.19,C,I, Basic violet 10, C.I.No.45179. Zat warna sintetis ini berbentuk serbuk kristal, tidak berbau, berwarna merah keunguan, dalam larutan berwarna merah terang berpendar (berfluoresensi). Pewarna ini sebenarnya adalah pewarna untuk kertas, tekstil, dan reagensia untuk pengujian antimon, cobalt, dan bismuth (Yuliarti, 2007).
Rhodamin B tidak dapat larut dan dicerna oleh tubuh. Meskipun kadar Rhodamin B yang dikonsumsi sangat sedikit, namun pewarna ini dapat mengalami penumpukan dalam tubuh manusia. Keberadaan Rhodamin B pada makanan ditandai dengan tampilan fisik makanan yang berwarna merah mencolok dan berpendar (Sulami, 2009).
Penggunaan Rhodamin B pada makanan dalam waktu yang lama akan dapat mengakibatkan gangguan fungsi hati maupun kanker. Namun demikian, bila terpapar Rhodamin B dalam jumlah besar maka dalam waktu singkat akan terjadi gejala akut keracunan Rhodamin B. Bila Rhodamin B tersebut masuk melalui makanan maka akan mengakibatkan iritasi pada saluran pencernaan dan mengakibatkan gejala keracunan dengan air kencing yang berwarna merah ataupun merah muda. Jangankan lewat makanan, menghirup Rhodamin B dapat mengakibatkan gangguan kesehatan, yakni terjadinya iritasi pada saluran pernafasan. Demikian pula apabila zat kimia ini mengenai kulit maka kulit pun
akan mengalami iritasi. Mata yang terkena Rhodamin B juga akan mengalami iritasi yang ditandai dengan mata kemerahan dan terdapat timbunan cairan atau udem pada mata (Yuliarti, 2007).
2.3.2.2 Eritrosin
Zat pewarna ini termasuk golongan fluorescein berupa tepung coklat larutannya dalam alkohol 95% menghasilkan warna merah yang berfluoresensi, sedangkan larutannya dalam air bewarna merah cherry tanpa fluoresensi. Eritrosin arut dalam gliserol dan glikol bersifat kurang tahan terhadap cahaya dan oksidator, tetapi tahan terhadap reduktor dan NaOH 10%. Mudah diendapkan oleh asam, karena itu tidak dapat dipergunakan dalam produk minuman. Eritrosin juga dapat diendapakan oleh tawas dan FeSO4. Logam Cu hanya sedikit berpengaruh
terhadap warna larutan (Nugraheni, 2014).
Eritrosin mengakibatkan reaksi alergi pada pernapasan, hiperaktif pada anak-anak, serta menghambat perkembangan otak dan perilaku (Sulami, 2009).
2.4 Alasan Penggunaan Pewarna Tambahan
Pewarna merupakan bahan yang ditambahkan dalam makanan yang berfungsi untuk memberikan warna yang khas dan mencari ciri khusus dari suatu makanan. Kemajuan teknologi pangan memungkinkan zat pewarna dibuat secara sintetis. Dalam jumlah yang sedikit suatu zat kimia bisa memberi warna yang stabil pada produk pangan.
Beberapa alasan utama menambahkan zat pewarna pada makanan :
a. untuk menutupi perubahan warna akibat paparan cahaya, udara, atau temperatur yang ekstrim akibat proses pengolahan dan penyimpanan
b. memperbaiki variasi alami warna. Produk pangan yang salah warna akan diasosiasikan dengan kualitas rendah
c. membuat identitas produk pangan
d. menarik minat konsumen dengan pilihan warna yang menyenangkan e. menjaga rasa dan vitamin yang mungkin yang terpengaruh sinar
matahari selama produk di simpan
f. melindungi rasa dan cahaya rentan vitamin (Nugraheni, 2014).
2.5 Fungsi Warna Pada Produk Pangan
a. sebagai indikator kematangan, terutama untuk produk pangan segar seperti buah-buahan
b. sebagai indikator kesegaran misalnya pada produk sayuran dan daging. c. sebagai kesempurnaan proses pengolahan pangan misalnya pada proses
penggorengan, timbulnya warna coklat sering kali sebagai indikator akhir kematangan produk (Nugraheni, 2014).
2.6 Kromatografi Kertas
Kromatografi kertas diperkenalkan oleh Consden, Gordon, dan Martin, yang menggunakan kertas saring sebagai penunjang fase diam. Kertas merupakan selulosa murni yang mempunyai afinitas besar terhadap air atau pelarut polar lainnya. Bila air diadsorpsikan pada kertas, maka akan membentuk lapisan tipis yang dianggap analog dengan kolom. Lembaran kertas berperan sebagai
penyangga dan air bertindak sebagai fase diam yang terserap diantara struktur pori kertas (Yazid, 2005).
Meskipun zat yang tercovery tidak betul-betul murni, dia dimanfaatkan juga untuk uji kualitatif dan kuantitatif. Keterbatasan metode ini adalah waktu yang relatif lama dan resolusinya yang rendah. Susunan serat kertas membentuk medium berpori yang bertindak sebagai tempat untuk mengalirnya fase bergerak. Berbagai macam kertas secara komersial tersedia adalah Whatman 1, 2, 31 dan 3mm. Kertas asam asetil, kertas kieselguhr, kertas silikon dan kertas penukaran ion yang digunakan. Tersedia juga kertas selulosa murni, kertas selulosa yang dimodifikasi dan kertas serat kaca. Zat-zat hidrofobik dapat dipisahkan pada kedua jenis kertas terakhir ini. Kertas asam asetil atau kertas silikon dapat digunakan untuk zat-zat hidrofobik, sedangkan untuk reagen yang korosif, kertas serat kaca dapat digunakan. Untuk memilih kertas, yang menjadi pertimbangan adalah tingkat dan kesempurnaan pemisahan, difusivitas pembentukan spot, efek tailing dan pembentukan komet serta laju pergerakan pelarut terutama untuk teknik descending. Pembentukan komet adalah suatu fenomena dimana spot yangdiperoleh bukannya berbentuk bundar, melainkan bulatan berbentuk panjang. Penambahan asam dalam pelarut bisa menghindarkan pembentukan komet serta mencegah ionisasi akibat hidrolisis ion-ion anorganik yang berbentuk komet. Seringkali nilai Rf berbeda dari satu kertas- kertas lainnya. Pengotor yang terdapat pada kertas saring adalah ion-ion Ca2+, Mg2+, Fe3+, Cu2+. Kertas seharusnya penolak air (Khopkar, 1990).
Kromatografi kertas tidak memerlukan pelat pendukung dan kertas dapat dengan mudah diperoleh dalam bentuk murni sebagai kertas saring. Lapisan selulosa harus dicetak atau dibeli khusus. Panjang serabut pada kertas lebih panjang daripada serabut pada lapisan selulosa lazim, menyebabkan lebih banyak terjadi difusi ke samping dan bercak lebih besar. Akhirnya, lapisan selulosa lebih rapat dan pelarut cenderung mengalir melaluinya lebih cepat dan menghasilkan pemisahan tajam (Gritter, 1991)
Cairan fase bergerak yang biasanya berupa campuran dari pelarut organik dan air, akan mengalir membawa noda cuplikan yang didepositkan pada kertas dengan kecepatan berbeda. Pemisahan terjadi berdasarkan partisi masing-masing komponen diantara fase diam dan fase bergeraknya. Senyawa-senyawa yang dipisahkan kebanyakan bersifat sangat polar, misalnya asam-asam amino, gula-gula atau pigmen-pigmen alam (Yazid, 2005).
Ditinjau dari sistem pelarut yang dipergunakan salam kromatografi partisi, dikenal tiga kategori yaitu fase dan berair, fase diam pelarut organik hidrofilik, dan fase diam pelarut organik hidrofobik. Fase diam berair bersifat polar ataupun ionik. Fase diam tersebut diperoleh dengan cara mengekspos kertas pada atmosfer air dalam ruang tertutup. Kertas tersebut tanpa direndam dalam larutan buffer dan dapat dikeringkan sebelum digunakan. Dua metode dapat digunakan untuk memperoleh fase diam pelarut organik hidrofilik, tergantung pada volatilitas pelarutnya, jika pelarutnya mudah menguap digunakan teknik eksposur, sedangkan bila pelarutnya tidak mudah menguap digunakan teknik perendaman untuk conditioning. Fase bergerak dengan pelarut hidrofilik yang tepat adalah
formida, yang terdiri atas selulosa, karbitol, gliserol dan benzoil alkohol. Menjadikan kertas hidrofobik dapat juga dilakukan dengan impregnasi kertas dengan pelarut hidrofobik yang terlarut dalam eluen mudah menguap serta dibiarkan kering di udara (Khopkar, 1990).
2.6.1 Teknik Kromatografi Kertas
Proses pengeluaran asam mineral dari kertas disebut desalting. Larutan ditempatkan pada kertas dengan menggunakan mikropipet pada jarak 2–3 cm dari salah satu ujung kertas dalam bentuk coretan garis horizontal. Setelah kertas dikeringkan, diletakkan di dalam ruang yang sudah dijenuhkan dengan air atau dengan pelarut yang sesuai. Penjenuhan dapat dilakukan 24 jam sebelum analisis (Khopkar, 1990)
Kertas dipotong memanjang sesuai ukuran bejana yang akan digunakan. Kertas yang dipakai adalah kertas Whatman yang secara komersial tersedia dalam berbagai macam ukuran dan lembaran. Biasanya dipakai kertas Whatman no.1 dengan kecepatan sedang. Tersedia juga kertas selulosa murni, kertas selulosa yang dimodifikasi , kertas asam asetil dan kertas serat kaca. Untuk pemilihan kertas yang menjadi pertimbangan adalah tingkat kesempurnaan pemisahan, difusifitas pembentukan spot, efek tailing serta laju pergerakan pelarut. Kertas yang akan digunakan harus disimpan dalam ruang tertutup atau di temapat yang kering jauh dari sumber uap terutama yang mempunyai afinitas tinggi terhadap selulosa (Yazid, 2005).
Sejumlah cuplikan kurang lebih 1 µl diteteskan menggunakan mikropipet pada jarak 2–3 cm dari salah satu ujung kertas yang sudah diberi garis horizontal
dengan pensil. Spot atau noda yang terbentuk dikeringkan, lalu kertas dimasukkan dalam bejana tertutup yang sudah dijenuhkan dengan pelarut yang sesuai untuk dikembangkan. Penjenuhan dilakukan selama 24 jam sebelum analisis (Yazid, 2005).
Terdapat tiga metode pengembangan pada kromatografi kertas ,yaitu : a. Metode Penaikan (Ascending)
Kertas digantungkan pada penggantung berbentuk kail yang dipasang pada penutup bejana kromatografi. Pelarut berada di dasar bejana (Gritter, 1991).
Noda harus diusahakan tidak sampai tercelup karena dapat larut dalam pelarut. Pelarut akan naik memalui serat-serat kertas oleh gaya kapiler menggerakan komponen dengan jarak yang berbeda-beda (Yazid, 2005) b. Metode Penurunan (Descending)
Bejana dilengkapi dengan sejenis wadah pelarut yang di pasang pada penopang dan kertas kromatografi dicelupkan ke dalam pelarut di dalam wadah itu dan diberati dengan batang kaca supaya tetap pada tempatnya . Pelarut bergerak turun membawa komponen melaui gaya kapiler dan gaya gravitasi (Gritter, 1991).
c. Metode Mendatar (Radial)
Metode ini sangat berbeda dari sebelumnya. Biasanya kertas dibentuk bulat ditengahnya diberi sumbu dari benang atau gulungan kertas. Noda ditempatkan pada pusat kertas kemudian pelarut akan naik melalui
sumbu sehingga membasahi kertas untuk kemudian mengembang melingkar membawa komponen yang dipisahkan (Yazid, 2005)
Temperatur harus dikendalikan dalam variasi tidak boleh lebih dari 0,5oC. Kertas harus didiamkan dahulu paling tidak 24 jam dengan atmosfer pelarutnya, agar mencapai kesetimbangan sebelum pengaliran pelarutnya pada kertas. Dilakukan beberapa pengerjaan yang parallel, Rf nya tidak boleh berbeda lebih dari ± 0,02 (Khopkar, 1990).
Bila permukaan pelarut telah mengembang atau bergerak pada batas tertentu, maka kertas dikeluarkan dari bejana dan batas permukaan pelarut diberi tanda lalu kertas dikeringkan. Jika senyawa yang dipisahkan bewarna akan nampak seperti noda- noda yang terpisah. Tetapi jika komponen zat tidak bewarna umumnya zat organik), maka dapat dideteksi dengan cara fisika dan kimia (Yazid, 2005).
Setelah letak noda komponen diketahui dan diberi tanda batas, harga Rf
(Retardation factor) dapat dihitung
Rf =
jarak yang ditempuh komponenjarak yang ditempuh pelarut
Nilai Rf dapat digunakan untuk identifikasi kualitatif dari senyawa yang tidak diketahui dengan membandingkan terhadap senyawa standar. Bila harga Rf sama, berarti kedua senyawa tersebutidentik sedangkan untuk analisis kuantitatif, komponen-komponen yang terpisah dapat dipotong-potong kemudian dilarutkan secara terpisah dalam pelarut yang sesuai untuk ditetapkan kadarnya dengan metode lain, misalnya spektrofotometri (Yazid, 2005).