Optimalisasi dan Karakterisasi Elektroda Selektif Ion Ni(II) Tipe Kawat
TerlapisBerbasis D2EHPA untuk Analisis Kadar Logam Ni(II)
Nur Hasni1*, Wahid Wahab1, Maming2
Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Hasanuddin
Jln. Perintis Kemerdekaan Km.10, Makassar 90245
ABSTRAK
Elektroda Selektif Ion (ESI) Ni(II) tipe kawat terlapis dibuat menggunakan bahan
aktif D2EHPA, campuran polivinilklorida (PVC) sebagai bahan pendukung,
Dibutylphthalate (DBP) sebagai bahan pemlastis, dengan perbandingan D2EHPA : PVC : DBP = 16 : 28 : 56 dalam pelarut tetrahidrofuran (THF) (1:3 b/v). ESI Ni(II)
tipe kawat terlapis berbasis D2EHPA menunjukkan harga faktor Nernst 29,01
mV/dekade konsentrasi Ni(II) pada rentang konsentrasi 1x10-4 – 1x10-1 M, limit
deteksi 1,20x10-5 M atau setara dengan 0,704 ppm nikel dengan waktu respon 2-14
detik. Hasil penelitian menunjukkan keberadaan ion asing Co2+ dan Cu2+ tidak
mempengaruhi kinerja ESI Ni(II). Aplikasi pada penentuan kadar nikel secara
potensiometri menggunakan ESI Ni(II) tipe kawat terlapis berbasis D2EHPA hasilnya
dibandingkan dengan metode standar Spektrofotometer Serapan Atom (SSA). Berdasarkan hasil pengukuran Ni(II) menggunakan metode potensiometri dengan ESI
Ni(II)tipe kawat terlapis berbasis D2EHPA tidak berbeda jauh dengan hasil
pengukuran menggunakan metoda SSA sehingga dapat digunakan sebagai metoda
alternatif untuk pengukuran kadar Ni2+ dalam air laut.
Kata kunci: D2EHPA, Elektroda Selektif Ion, Ion Ni2+, Potensiometri.
PENDAHULUAN
Nikel adalah salah satu jenis logam berat yang dapat menyebabkan pencemaran. Apabila terdapat dalam jumlah berlebih pada tubuh, dapat menyebabkan kanker pada paru-paru,
laring dan dapat menyebabkan
kerusakan dada, ginjal serta batuk kering (Karamah dkk., 2010). Selama
ini metode untuk analisis logam berat yang sering dilakukan adalah SSA (Spektrofotometer Serapan Atom) dan
ICP (Inductively Coupled Plasma)
yang merupakan instrumen yang cukup canggih. Secara umum kedua teknik ini cukup sederhana namun memerlukan biaya yang cukup besar
2
untuk melakukannya. Melihat
kekurangan dari metode tersebut maka diperlukan upaya untuk mengatasi masalah tersebut (Wijanarko dkk., 2013).
Elektroda Selektif Ion (ESI) merupakan salah satu alat ukur dalam metode potensiometri yang dalam pelaksanaan analisisnya cepat, mudah dan tidak membutuhkan sampel dalam jumlah yang banyak terutama untuk ESI tipe kawat terlapis sehingga sangat cocok untuk analisis di lapangan (Wijanarko dkk., 2013).
Beberapa penelitian tentang ESI antara lain penelitian Taufik (2008) telah dibuat ESI-Ni(II) dengan bahan aktif DBDA18C6 menunjukkan sifat Nernstian dengan nilai slope (faktor Nernst) 29,11 mV/dekade,
kisaran konsentrasi 10-4 M-10-1 M,
sedangkan dari penelitian yang
dilakukan oleh Panggabean (2001) telah dibuat ESI-Cd(II) berbasis
kitosan sebagai ionofor dengan
komposisi optimum membran ESI- Cd(II) ini memiliki faktor Nernst sebesar 32,03 mV/dekade. Faktor Nernst dari ESI-Cd(II) tersebut masih belum ideal, hal ini disebabkan oleh sifat hidrofilik yang menyebabkan molekul air masuk ke dalam membran sehingga membran akan mengembang. Molekul air tersebut menimbulkan peluruhan senyawa aktif pada
membran. Berdasarkan masalah
tersebut telah dilakukan penelitian
menggunakan bahan aktif D2EHPA
sebagai pengganti kitosan.
Kelayakan suatu elektroda
bermembran dapat dilihat dari nilai faktor Nernst dan trayek pengukuran, limit deteksi, waktu respon, pH dan gangguan dari ion lain (selektivitas). Faktor-faktor tersebut perlu ditentukan terlebih dahulu sebelum suatu elektroda digunakan untuk keperluan analisis (Wahab dan La Nafie, 2014).
Berdasarkan uraian tersebut maka perlu dikembangkan suatu metode untuk analisis logam berat yang cukup akurat, sensitif, selektif, dan biaya operasionalnya relatif murah. Oleh karna itu dalam penelitian
telah dilakukan optimalisasi dan
karakterisasi elektroda selektif ion yang digunakan sebagai alat untuk mendeteksi atau menganalisa kadar logam-logam berat khususnya logam Ni(II).
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Mei 2015 - Desember
2015. Lokasi penelitian di
Laboratorium Analitik, Jurusan Kimia,
Fakultas MIPA Universitas
Hasanuddin, Makassar.
Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah kawat platina (Pt), kawat perak (Ag), kawat tembaga yang berlapis plastik, kawat
timah, tip, PVC (sigma), DBP (sigma),
D2EHPA (sigma), THF p.a (E-merck),
larutan KCl 0,1 M, padatan
Ni(NO3)2.6H2O, padatan Co(NO-
3)2.6H2O, padatan Cu(NO3)2.3H2O,
parafilm, kawat koaksial RG 58, elektroda pembanding Ag/AgCl,
tertentu menurut prosedur Kusrini dkk, (2013) yang terdiri atas PVC, ionofor
ligan D2EHPA, DBP dengan pelarut
THF sebanyak 3 mL diaduk
menggunakan pengaduk magnet selama kiri-kira 2 jam.
Tabel 1. Komposisi Membran
HNO3 65%, NaOH 2 M, akuades dan
akuabides.
Alat Penelitian
Membran
Komposisi % berat
PVC DBP D2EHPA
Alat-alat yang digunakan 1 30 60 10
dalam penelitian ini adalah pH meter 2 29 58 13
Orion Model 720 A, pengaduk 3 28 56 16
magnetik stirrer, neraca analitik, stopwatch, solder listrik, dan alat-alat gelas yang umum digunakan di laboratorium.
3.4 Prosedur Penelitian
3.4.1 Pembuatan Elektroda Kawat Terlapis (EKT)
Elektroda kawat terlapis dibuat dengan menggunakan kawat tembaga (panjangnya 5 cm, diameter 1,5 mm) yang disambungkan dengan kawat Pt yang ukurannya 2,5 cm, diameter 0,4 mm dengan menggunakan solder listrik (bahan pateri adalah kawat timah) (Tandiayu, 2006).
3.4.3 Pembuatan Membran berbasis PVC
Sejumlah bahan dicampurkan dengan berbagai perbandingan berat
4
4 27 54 19 Sumber : Putra dkk., 2013
3.4.4 Desain ESI Ni-(II)
Desain ESI Ni-(II) dilakukan dengan mencelupkan elektroda kawat yang telah dibuat secara hati-hati selama beberapa menit kemudian dimasukkan ke dalam tip (sebagai batang elektroda) dan
ujungnya direkatkan dengan
menggunakan parafilm. Elektroda
disimpan dalam larutan standar Ni2+ 0,1
M selama 24 jam sebelum digunakan (Taufik,
2008).
3.4.5 Pembuatan Larutan Standar Ni2+ 10-1 - 10-7 M
Larutan Ni(NO3)2.6H2O ditimbang dengan teliti sebanyak 0,5871 gram, dimasukkan ke dalam labu ukur 100 mL dan diimpitkan
dengan akuades hingga batas garis. Larutan ini kemudian diencerkan dari konsentrasi (10-2, 10-3, 10-4, 10-5, 10-6
dan 10-7) M (Taufik, 2008).
3.4.7 Pengamatan Potensial
Pengamatan potensial (E, mV) dalam sel dimulai dari konsentrasi larutan standar masing-masing Ni(II)
10-7 M sampai 10-1 M dan hubungan E
(mV) dengan -log [Ni(II)] dibuat sesuai persamaan berikut:
E = Eo + S log [Ni(II)]
Dari persamaan tersebut dapat ditunjukkan bahwa E (mV) adalah
potensial yang dihasilkan sel, EomV)
potensial-standar reduksi ion-ion Ni(II) terhadap ESI-Ni(II) dengan Ag/AgCl, konsentrasi larutan standar Ni(II) dalam -log [Ni(II)] (dekade),
dan S (slop) adalah faktor Nernst atau
kepekaan ESI-Ni(II) (Tandiayu, 2006).
3.4.8 Uji Kinerja ESI Ni(II)
a. Faktor Nernst dan kisaran konsentrasi pengukuran
Faktor Nernst diperoleh melalui pengukuran sederetan larutan standar Ni(II) dengan konsentrasi bervariasi 10-7-10-1 M. Potensial diukur berturut-turut dari larutan yang paling encer kelarutan yang lebih pekat konsentrasinya. Pengamatan
dilakukan sambil diaduk dengan
pengaduk magnetik untuk
menghilangkan gelembung udara
dipermukaan membran. Dari hasil
pengukuran, dibuat grafik antara
potensial (mV) terhadap -log Ni (II). Pada selang konsentrasi tertentu garis lurus diperoleh dengan kemiringan secara teoritis sebesar 2,303 RT/nF yang merupakan harga faktor Nernst. Untuk menghasilkan harga K, kurva linear diekstrapolasikan ke sumbu y (Kusrini dkk., 2013).
b. Limit Deteksi
Limit deteksi diperoleh dengan membuat garis singgung pada fungsi
linier, antara – log [Ni2+] dengan
potensial (mV) (Kusrini dkk., 2013).
c. Waktu Respon
Waktu respon ESI-Ni2+
ditentukan berdasarkan pada lamanya pengukuran yang diperlukan untuk menghasilkan potensial E (mV) yang konstan (Taufik, 2008).
d. Kondisi pH Pengukuran
Kondisi pH pengukuran larutan
ditentukan melalui pengamatan
potensial E (mV) berbagai larutan standar antara 10-7 M sampai 10-1 M. Pengukuran pH dilakukan dilakukan dengan penambahan larutan NaOH
dan HNO3 masing-masing dengan pH
6
e. Koefisien Selektivitas
Koefisien selektivitas ditentukan melalui pengukuran potensial E (mV) berbagai larutan standar ion- ion
utama Ni(II) antara 10-7-10-1 M dan
larutan standar ion-ion penganggu
(Mn+). Hasil pengukuran dimasukkan
dalam kurva kalibrasi (Taufik, 2008).
f. Sampling
Sampel diperoleh dengan cara
memasukkan wadah penampungan
kedalam cairan limbah pada tiga titik
di pelabuhan Paotere Makassar.
Kemudian sampel tersebut dianalisis
secara potensiometri dan
spektrofotometer serapan atom terhadap kandungan logam berat nikel (II).
HASIL DAN PEMBAHASAN
1. Kondisi Optimum
Penentuan komposisi optimum dimaksudkan untuk mencari komposisi
Perbandingan % berat komposisi
membran terhadap Nilai kemiringan (slope) dapat dilihat pada Tabel 2.
Tabel 2. Perbandingan komposisi
membran ESI-Ni(II)
terhadap nilai faktor Nernst Nomor Komposisi % berat Membran Slope PVC DBP D2EHPA 1 30 60 10 22,49 2 29 58 13 27,70 3 28 56 16 29,01 4 27 54 19 26,05
2. Uji Kualitas ESI-Ni(II)
Kualitas ESI-Ni2+ tipe kawat
terlapis dengan bahan aktif Di-2 Etil
Heksil Fosfat (D2EHPA) dapat dilihat
dari harga faktor Nernst dan trayek pengukuran, limit deteksi, waktu
respon (respon time), pengaruh pH dan
koefisien selektivitas. membran yang terdiri atas polivinil
klorida (PVC), dibuthyl phtalate 2.1 Faktor Nernst dan Trayek
(DBP), di-2-Etil heksil fosfat
(D2EHPA), dicampur dengan pelarut
THF yang menghasilkan elektroda dengan kinerja yang optimum. Kinerja membran optimum didasarkan pada
kemiringan (slope) linier pada kurva
antara potensial elektroda (E) dan (-log
[Ni2+]) yang mendekati faktor Nernst
teoritis, yaitu 29,6 mV/dekade.
Pengukuran
Faktor Nernst dan kisaran
pengukuran diperoleh melalui
pengukuran potensial sederetan
larutan standar Ni(II) dengan
konsentrasi bervariasi 10-7-10-1 M,
mulai dari larutan yang paling encer sampai larutan yang lebih pekat
y = -29.01x + 262.05 R² = 0.9538 E( m V)
konsentrasinya. Dari data hasil
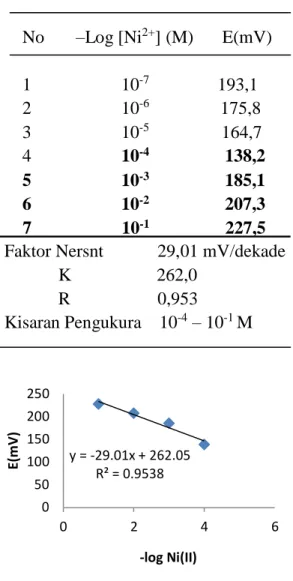
pengukuran, dibuat grafik antara potensial (mV) terhadap –log Ni(II). Untuk nilai faktor Nernst dan kisaran pengukuran dapat dilihat pada Tabel 3 dan Gambar 4.
Tabel 3. Faktor Nernst dan trayek
pengukuran ESI-Ni2+ dengan
komposisi PVC 28% : DBP 56% :
D2EHPA 16%.
No –Log [Ni2+] (M) E(mV)
1 10-7 193,1 2 10-6 175,8 3 10-5 164,7 4 10-4 138,2 5 10-3 185,1 6 10-2 207,3 7 10-1 227,5
Faktor Nersnt 29,01 mV/dekade K 262,0 R 0,953 Kisaran Pengukura 10-4 – 10-1 M 250 200 150 100 50 0 0 2 4 6 -log Ni(II)
Gambar 4. Kurva potensial E (mV)
terhadap –log Ni2+ ESI-Ni(II).
Gambar 3 menunjukkan garis linear pada rentang konsentrasi
10-4-10-1 M. ESI-Ni2+ tipe kawat
terlapis yang didesain dengan
komposisi PVC : DBP : D2EHPA = 28
: 56 : 16 mempunyai nilai faktor Nernst sebesar 29,01 mV/dekade pada
kisaran pengukuran 10-4 - 10-1 M.
Pengukuran kation Ni2+ pada kisaran
konsentrasi ini dianggap paling baik karena mempunyai nilai faktor Nernst yang mendekati nilai teoritis yaitu 29,6 mV/dekade untuk kation divalen.
Perbedaan faktor Nernst pada
setiap daerah trayek pengukuran
disebabkan oleh limit deteksi setiap ESI. Selain itu adanya perbedaan harga faktor Nernst disebabkan oleh respon kation dalam larutan.
4.2 Limit Deteksi
Limit deteksi adalah batas konsentrasi minimum dan maksimum yang dapat dideteksi oleh suatu ESI. Nilai limit deteksi menentukan kualitas suatu metode analisa semakin kecil limit deteksi suatu ESI, maka semakin baik kualitas ESI tersebut (Ni’am,
2012). Limit deteksi ESI-Ni2+ tipe
EKT ditentukan dengan membuat garis singgung pada fungsi kurva linear dan non linear yang saling memotong. Jika titik potong dari kedua garis singgung tersebut diekstrapolasikan ke sumbu x akan diperoleh limit deteksi. Hasil
penentuan limit deteksi dari ESI-Ni2+
8
Gambar 5. Kurva limit deteksi dari
ESI-Ni(II) dengan
komposisi PVC 28% :
Tabel 4. Waktu Respon ESI-Ni2+
terhadap –log Ni2+ dengan komposisi
PVC 28% : DBP 56% : D2EHPA 16%
DBP 56% : D2EHPA 16%. pada konsentrasi Ni
2+10-7-10-1M. 250 200 150 100 50 0 0 1 2 3 4 5 6 7 8
No –Log [Ni2+] (M) Waktu (detik)
1 10-7 14,00 2 10-6 13,00 3 10-5 12,66 4 10-4 11,33 5 10-3 10,33 6 10-2 7,00 7 10-1 2,00
Ekstrapolasi terhadap sumbu X (-log Ni(II)) diperoleh limit deteksi pada nilai 3,91 atau setara dengan 1,20
x 10-5 M (0,704 ppm). Nilai tersebut
menunjukkan limit deteksi terhadap ESI Ni(II) dengan komposisi membran
PVC 28% : DBP 56% : D2EHPA 16%.
4.3 Waktu Respon
Waktu respon merupakan waktu yang dibutuhkan oleh suatu
elektroda untuk mencapai
kesetimbangan yang konstan, diukur sejak elektroda mengadakan kontak dengan larutan. Semakin cepat waktu respon semakin baik kualitas suatu elektroda selektif ion (Iyabu dan Duengo, 2013). Kemampuan ESI merespon suatu analit sangat ditentukan oleh bahan aktif membran. Waktu respon ESI Ni(II) tipe kawat
terlapis berbasis D2EHPA dapat dilihat
pada Tabel 4.
Pada Tabel 4 terlihat bahwa waktu respon elektroda rata-rata 2 detik hingga 14 detik. Data tersebut menunjukkan bahwa semakin besar konsentrasi Ni(II) dalam larutan, maka
waktu yang diperlukan ion Ni2+ untuk
mencapai kesetimbangan pada
membran semakin kecil karena
mobilitas ion-ion menjadi lebih cepat
sehingga proses terjadinya
kesetimbangan pada permukaan
membran makin cepat tercapai. Waktu respon dipengaruhi oleh beberapa faktor antara lain melarutnya bahan- bahan aktif ke dalam fase air akan memperlambat waktu respon selain itu waktu respon dipengaruhi oleh struktur ESI seperti penggunaan komposisi membran.
4.2.4 Pengaruh pH
Pengukuran pH terhadap
kinerja ESI Ni2+ ditentukan dengan
pH larutan nikel. Dalam penelitian ini,
ESI- Ni2+ tipe EKT dalam larutan Ni2+
10-4 M -10-1M diatur pHnya pada pH
2 - 8 menggunakan larutan HNO3 65 %
dan NaOH 2 M. Data hasil penelitian dapat dilihat pada Tabel 5.
Tabel 5. Faktor Nernst ESI-Ni2+
terhadap –log Ni2+ dengan
komposisi PVC 28% : DBP 56% : D2EHPA 16% pada berbagai pH. pH Faktor Nernst K (mV) R 2 15 261,3 0,997 3 19,89 231,3 0,934 4 24,22 187,1 0,964 5 27,06 96,6 0,972 6 23,06 70,75 0,918 7 19,58 53,1 0,956 8 14,76 35,95 0,915
Data dalam Tabel 5
menunjukkan bahwa pH sangat
berpengaruh terhadap kinerja ESI-
Ni2+. Pada pH 2-4 memperlihatkan
nilai faktor nernst yang masih berbeda jauh dari nilai faktor nernst secara teoritis (29,6 mV/dekade), hal ini
diakibatkan karena adanya ion-ion H+
yang mempengaruhi kesetimbangan
kompleks D2EHPA dan ion Ni2+ bebas
dalam fase cairan. Kelebihan ion H+
akan mempengaruhi potensial yang
ditimbulakan oleh ion Ni2+ sehingga
keaktifannya tidak bersesuaian dalam
larutan uji. Pada pH 5 merupakan
kondisi optimun untuk elektroda
selektif ion Ni(II) karena memiliki
nilai faktor Nernst yang paling
mendekati nilai teoritis (29,6
mV/dekade) yaitu sebesar 27,06
mV/dekade dan nilai R 0,972.
Sedangkan pada pH 6-8 menunjukkan faktor Nersnt yang juga jauh berbeda dari nilai teoritis karena adanya
kelebihan ion-ion OH- yang
mengakibatkan terjadinya hidrolisis
ion nikel. ESI Ni2+ tidak dapat bekerja
dengan baik pada pH yang terlalu tinggi dan juga pH yang terlalu rendah (Wijanarko dkk., 2013).
4.2.5 Koefisien Selektivitas
Penentuan koefisien selektivitas
ESI-Ni2+ dilakukan metode MPM
(Match Potential Method). Metode MPM merupakan metode pendekatan
baru untuk penentuan tetapan
selektivitas elektroda selektif ion
dengan membandingkan aktivitas ion utama dan ion pengganggu. Metode MPM cocok untuk penentuan koefisien selektivitas yang melibatkan ion-ion dengan muatan lebih dari satu.
Besarnya tetapan selektivitas
ditentukan berdasarkan rasio dari selisih antara aktivitas ion utama dan
ion pengganggu dari dua buah
pengukuran (Suyanta, 2013).
Dalam metode ini, terlebih dahulu diukur potensial (mV) larutan
standar 10-4-10-1 M, sehingga
10
3 5,71.10-3 4,36.10-3
2 1,58.10-3 9,50.10-4
1 6,13.10-4 1,37.10-4
Kemudian nilai Y dimasukkan kedalam persamaan regresi ion, sehingga nilai X dapat dihitung. Nilai
K ����𝑜𝑡
Tabel 6 terlihat bahwa nilai secara keseluruhan kurang dari
selektivitas dihitung dengan
persamaan (Suyanta, 2013) :
��𝑡
=
Xsatu ( K ��𝑜𝑡 ��< 1 ), hal ini berarti bahwa
ion pengganggu Co2+ dan Cu2+ tidak
menganggu kinerja ESI Ni(II). ESI Ni(II) dengan kualitas yang baik
𝐾
��[Ion] adalah ESI yang tidak diganggu oleh
ion-ion pengganggu.
Dimana X = konsentrasi yang didapat dari persamaan regresi
Pengukuran potensial dilakukan
terhadap ion penganggu Co2+ dan Cu2+
pada kisaran konsentrasi 10-4-10-1 M. ��𝑡
4.3 Aplikasi ESI Ni(II) tipe Kawat
Terlapis berbasis D2EHPA
Penentuan kandungan ion nikel dalam sampel air laut Pelabuhan
Jika ���� < 1, maka ion asing Paotere kota Makassar menggunakan
dinyatakan tidak mengganggu ion
��𝑡 ESI Ni(II) tipe kawat terlapis berbasis
utama dan jika ���� > 1, maka ion D2EHPA ditentukan secara langsung
asing dinyatakan menganggu ion utama.
Tabel 5. Data hasil perhitungan koefisien selektivitas ( ����𝑡
)
��
ion penganggu untuk ESI Ni2+
dengan komposisi PVC 28% : DBP 56% : D2EHPA 16%. Kij -Log [X] Co2+ Cu2+ 4 1,21.10-2 2,13.10-2
melalui pengukuran potensial sampel. Hasil pengukuran dibandingkan
dengan metode spektrofotometer
serapan atom (SSA) sehingga
dihasilkan data seperti pada Tabel 7.
Tabel 7. Data hasil analisis kandungan
ion Ni2+ ESI-Ni(II) dan
instrument SSA
.
Sampel ESI-Ni(II)(ppm) SSA(ppm)
2 1,13 1,10
3 1,03 1,06
12
Data pada Tabel 7 menunjukkan nilai rata-rata potensial untuk pengukuran ion Ni(II) pada sampel air laut pelabuhan Paotere Makassar dengan menggunakan sensor potensiometri adalah sebesar 1,17 ppm
(1,99x10-5 M) sedangkan dengan
menggunakan metode SSA konsentrasi ion Ni(II) dalam sampel yang
diperoleh adalah 1,18 ppm (2,0x10-5
M), menunjukkan bahwa tidak terdapat selisih yang cukup besar antara kedua metode tersebut. Sehingga metode potensiometri dengan alat ukur ESI-Ni(II) tipe kawat
terlapis berbasis D2EHPA dapat
digunakan sebagai metode alternatif
untuk pengukuran kadar Ni2+ dalam
sampel air laut selain metode
spektrofotometer serapan atom (SSA).
5.1 Kesimpulan
Berdasarkan data hasil
penelitian maka dapat di simpulkan
bahwa komposisi membran yang
optimum diperoleh pada perbandingan
% berat PVC : DBP : D2EHPA = 28 :
56 : 16. Karakteristik ESI yang telah dibuat antara lain faktor nernst sebesar 29,01 mV/dekade, kisaran konsentrasi
pengukuran 10-4-10-1 M, limit deteksi
1,20 x 10-5 M atau 0,704 ppm waktu
respon rata-rata 2-14 detik, pH kerja optimum adalah 5. Kinerja ESI-Ni(II)
rata-rata tidak diganggu oleh ion Co2+
dan Cu2+ karena memiliki nilai Kij < 1.
Penerapan ESI-Ni2+ tipe kawat terlapis
berbasis D2EHPA pada analisis sampel
air laut pelabuhan Paotere dengan menggunakan ESI-Ni(II) tidak terdapat perbedaan secara signifikan
dengan hasil pengukuran
menggunakan SSA. Elektroda selektif ion Ni(II) tipe kawat terlapis berbasis
D2EHPA dapat digunakan sebagai
metode alternatif untuk pengukuran
kadar Ni2+ dalam sampel air laut selain
metode spektrofotometer serapan atom (SSA).
Saran
Perlu dilakukan penelitian
lebih lanjut mengenai pengaruh
ketebalan membran terhadap nilai
faktor Nernst dengan komposisi
membran yang sama.
Daftar Pustaka
Iyabu, H., dan Duengo, S., 2013,
Pengaruh Penambahan
KH2PO4 Pada Pembuatan
Elektroda Selektif Ion Fosfat
sebagai Pengganti Metode
Spektrofotometri Dalam
Penentuan Fosfat, Journal
Entropi, 7(1), 2-8.
Karamah, E. V., Syafrizal., dan Sari,
A. N., 2010, Pengolahan
Limbah Campuran Logam Fe,
Cu, Ni dan Amonia
Menggunakan Metode Flotasi- Filtrasi dengan Zeolit Alam
Lampung sebagai Bahan
Nasional Teknik Kimia “Kejuangan”, Yogyakarta, 26 Januari 2010.
Kusrini, E., Atikah, dan Sulistyarti, H., 2013, Karakterisasi Elektroda Selektif Ion (ESI) Kadmium
Tipe Kawat Terlapis
Bermembran D2EHPA, Kimia
Student Journal, 2(2), 560-566.
Ni’am, B.M., 2012, Aplikasi Turunan
Kaliks[4]arena (22,17- bis(sianopropiloksi)-26,28- dihidroksi-p-
nitrokaliks[4]arena) untuk Elektroda Selektif Ion Tembaga II (Cu2+) Berbasis Potensiometri, Universitas Jember, Jember.
Panggabean, A.S., 2001, Pembuatan
dan Karakterisasi Membran Elektroda Selektif Ion Cd2+ - Kitosan sebagai Sensor Kimia,
Tesis, Program Pasca sarjana, Universitas Sumatera Utara, Medan.
Putra, D.A., Atikah, dan Sulistyarti, H., 2013, Karakterisasi Elektroda Selektif Ion (ESI) Kadmium Tipe Kawat Terlapis
Bermembran D2EHPA, Kimia
Student Journal, 2(2), 553-559. Suyanti dan Aryadi, 2011, Ekstraksi
Torium dari Konsentrat Th, Ltj
(Hidroksida) Menggunakan
Solven Bis-2-Etil Heksil
Fosfat, Prosiding Seminar
Penelitian Dan Pengelolaan
Perangkat Nuklir Pusat
Teknologi Akselerator Dan
Proses Bahan Yogyakarta.
Suyanta, 2013, Potensiometri,
Yogyakarta: UNY Press.
Taufik, 2008, Optimalisasi
Komposisi Membran
Berbasis Polivinil Klorida (PVC) dengan Ionofor N,N- dibenzil-1,4,10,13- tetraoksa-7,16-diazasiklo oktadekana (DBDA18C6) dalam Pembuatan ESI-Ni(II), Universitas Hasanuddin, Makassar.
Wahab, A.W., dan Nafie, N.L., 2014,
Metode Pemisahan dan
Pengukuran 2, Universitas Hasanuddin, Makassar.
Wijanarko, A., Atikah, dan Fardiyah, Q., 2013, Pengaruh Ion Asing
terhadap Kinerja Elektroda
Selektif Ion (ESI) Cd(II) Tipe
Kawat Terlapis Berbasis
D2EHPA serta Aplikasinya
pada Penentuan Kadar
Kadmium dalam Air Sungai, Kimia Student Journal, 2(2), 546-552.