KANDUNGAN NUTRISI DAN TINGKAT KECERNAAN IN VITRO PADA TIGA VARIETAS SORGHUM HYDROPONIC FODDER (SHF)
SKRIPSI
RISTA KURNIA DEWI
PROGRAM STUDI KIMIA FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA 2018 M/1439 H
KANDUNGAN NUTRISI DAN TINGKAT KECERNAAN IN VITRO PADA TIGA VARIETAS SORGHUM HYDROPONIC FODDER (SHF)
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh :
RISTA KURNIA DEWI 1113096000014
PROGRAM STUDI KIMIA FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA 2018 M/1439 H
ABSTRAK
RISTA KURNIA DEWI. Kandungan Nutrisi dan Tingkat Kecernaan In Vitro Pada
Tiga Varietas Sorghum Hydroponic Fodder (SHF). Dibimbing oleh TEGUH
WAHYONO dan DEDE SUKANDAR.
Penelitian ini bertujuan untuk mengetahui kandungan nutrisi dan tingkat kecernaan in
vitro dari tiga varietas Sorghum Hydroponic Fodder (SHF). Analisis kandungan
nutrisi meliputi bahan kering (BK), bahan organik (BO), protein kasar (PK), ekstrak eter (EE), neutral detergent fiber (NDF) dan acid detergent fiber (ADF). Analisis kecernaan in vitro meliputi Kecernaan Bahan Kering (KcBK), Kecernaan Bahan Organik (KcBO) dan produk fermentasi rumen yaitu pH, konsentrasi NH3 dan total volatile fatty acid (TVFA). Hasil yang didapat pada penelitian menunjukkan
kandungan nutrisi dan tingkat kecernaan in vitro pada ketiga varietas Sorghum
Hydroponic Fodder (SHF) memiliki beda nyata. Kandungan nutrisi tertinggi
dihasilkan oleh SHF Samurai 1 dengan nilai PK dan EE sebesar 19,80% dan 10,97%. Kecernaan BK dan BO tertinggi pada SHF Pahat dengan nilai 65,21±5,32% dan 65,96±5,42%. Hasil tertinggi yang didapat dari produk fermentasi rumen yaitu pH, konsentrasi NH3 dan total volatile fatty acid (TVFA) terdapat pada SHF Samurai 2 dengan nilai masing-masing 7,03±0,19; 6,13±0,24 mM dan 105,62±21,7 mM. Kandungan nutrisi dari ketiga varietas SHF memiliki nilai yang cukup untuk dijadikan sebagai sumber pakan ternak. Begitu pula dengan hasil kecernaan in vitro yang didapat lebih dari 60% yang menunjukkan bahwa SHF dapat dicerna dengan baik.
Kata kunci : In vitro, kandungan nutrisi, kecernaan, Sorghum Hydroponic Fodder
ABSTRACT
RISTA KURNIA DEWI. Nutrient content and level of In vitro digestibility of three
varieties Sorghum Hydroponic Fodder (SHF). Supervised by TEGUH WAHYONO and DEDE SUKANDAR.
The aim of this research is for knowing nutrition content and in vitro level digestibility of three varieties Sorghum Hydroponic Fodder (SHF). Nutrition content analyze includes dry matter (DM), organic matter (BO), crude protein (CP), ether extract (EE), neutral detergent fiber (NDF) and acid detergent fiber (ADF). Analysis digestibility in vitro include dry material digestibility (DMD), organic materials digestibility (OMD) and rumen fermentation product include pH, concentration of NH3 and total volatile faty acid (TVFA). The result showed that no significantly different on nutrition content and in vitro digestibility level of three varieties Sorghum Hydroponic Fodder (SHF). SHF Samurai 1 has highest crude protein and EE value by 19, 80% and 10.97%. DMD and OMD of SHF Pahat has highest value is 65, 21 ± 5.32% and 65.96 ± 5.42%. The highest fermentation rumen product (pH, NH3 and TVFA) obtained by SHF Samurai 2 (7.03 ± 0.19; 6.13 ± 0.24mM and 105.62 ± 21.7 mM). The results of in vitro digestibility show that SHF has better native grass.
Keywords: In vitro, nutrion content, digestibility, Sorghum Hydroponic Fodder (SHF)
viii
KATA PENGANTAR
Bismillahirohmaanirrahiim
Puji syukur penulis panjatkan kepada Allah SWT karena berkat
rahmat, karunia dan hidayah-Nya penulis dapat menyelesaikan skripsi yang
berjudul “Kandungan Nutrisi dan Tingkat Kecernaan In Vitro Pada Tiga
Varietas Sorghum Hydroponic Fodder (SHF)” sehingga terlaksana sesuai
dengan harapan. Tak lupa shalawat serta salam penulis haturkan kepada Nabi
Muhammad SAW beserta keluarga dan sahabatnya. Penelitian ini
dilaksanakan di Laboratorium Pusat Aplikasi Isotop dan Radiasi (PAIR)
BATAN, Jalan Lebak Bulus Raya No. 49, Jakarta Selatan, Indonesia pada
bulan Februari sampai April 2017.
Skripsi ini disusun untuk memenuhi syarat kelulusan dalam
menempuh pendidikan Strata 1 (S1) di Program Studi Kimia Fakultas Sains
dan Teknologi Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
Penulis menyadari bahwa, tanpa bantuan dan bimbingan dari berbagai pihak,
sangatlah sulit untuk menyelesaikan skripsi ini. Oleh karena itu, penulis
mengucapkan terima kasih sebanyak-banyaknya terutama kepada:
1. Teguh Wahyono, M.Si, selaku pembimbing I yang senantiasa membimbing
dan memberikan segala ilmunya kepada penulis dengan penuh kesabaran
ix
2. Drs. Dede Sukandar, M.Si, selaku pembimbing II yang telah memberikan
bimbingannya kepada penulis dan selaku Ketua Program Studi Kimia
Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah
Jakarta.
3. Dr. Sandra Hermanto, M.Si, selaku penguji I yang telah memberikan
masukan dalam penulisan skripsi ini dengan penuh kesabaran dan
keikhlasan.
4. Anna Muawanah, M.Si, selaku penguji II yang telah memberikan masukan
dalam penulisan skripsi ini dengan penuh kesabaran dan keikhlasan.
5. Dr. Agus Salim, M.Si, selaku Dekan Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta.
6. Kedua orang tua tercinta yang selalu memberikan doa serta dukungan moril
maupun materil.
7. Pegawai BATAN PAIR Laboratorium Nutrisi Ternak (saudari Tia, Bapak
Edi, Bapak Dedi, Bapak Haryono, dll.) yang senantiasa membantu penulis
selama penelitian berlangsung.
8. Yulia dan Ariani sebagai patner kerja, Sinta, Syifa, Ersa, Ardhi, Dini dan
rekan seperjuangan Kimia 2013 UIN Syarif Hidayatullah Jakarta yang
x
Nasihat, kritik dan saran pada skripsi ini yang membangun dari pembaca
sangat penulis harapkan. Semoga skripsi ini dapat bermanfaat bagi perkembangan
ilmu pengetahuan.
Jakarta, Januari 2018
xi
DAFTAR ISI
KATA PENGANTAR ... viii
DAFTAR ISI ... xi
DAFTAR GAMBAR ... xiv
DAFTAR TABEL ... 1 DAFTAR LAMPIRAN ... 2 BAB I PENDAHULUAN ... 1 1.1. Latar Belakang ... 1 1.2. Rumusan Masalah ... 5 1.3. Hipotesis ... 5 1.4. Tujuan Penelitian ... 6 1.5. Manfaat pengujian ... 6
BAB II TINJAUAN PUSTAKA ... 7
2.1. Hijauan Pakan Ternak ... 7
2.2. Sorgum ... 10
2.3. Kandungan Kimia pada Sorgum ... 15
2.4. Hydroponic Fodder ... 17
2.5. Ruminansia ... 19
2.6. Pencernaan Ternak Ruminansia ... 20
2.6. Kecernaan In Vitro ... 24
2.7. Analisis Kandungan Nutrisi Pakan ... 27
2.8. Volatile Fatty Acid (VFA) ... 29
xii
BAB III METODE PENELITIAN ... 34
3.1. Tempat dan Waktu Pelaksanaan ... 34
3.2. Alat dan Bahan ... 34
3.2.1. Alat ... 34
3.2.2. Bahan ... 35
3.3. Tahapan Penelitian ... 35
3.4. Prosedur Kerja ... 36
3.4.1. Pembuatan Larutan Pupuk Cair ... 36
3.4.2. Penanaman Sorghum Hydroponic Fodder (Nugroho, 2015) ... 36
3.4.3. Pemanenan Sorghum Hydroponic Fodder (Nugroho, 2015) ... 37
3.4.4. Analisis Kandungan Nutrisi SHF ... 37
3.4.5. Analisis In Vitro Dua Tahap (Tilley and Terry, 1963) ... 41
3.4.6. Analisis statistik ... 45
3.5. Bagan Alir Penelitian ... 46
BAB IV HASIL DAN PEMBAHASAN ... 47
4.1. Profil Nutrisi ... 47
4.1.1. Bahan Kering (BK) ... 47
4.1.2. Bahan Organik (BO) ... 49
4.1.3. Protein Kasar (PK) ... 50
4.1.4. Ekstrak Eter (EE) ... 53
4.1.5. Neutral detergent fiber (NDF) dan Acid detergent fiber (ADF) ... 54
4.2. Kecernaan In Vitro ... 58
4.2.1. Nilai pH ... 58
xiii
4.2.3. Produksi Total Volatile Fatty Acid (TVFA) ... 62
4.2.4. Kecernaan BO (KcBO) ... 64
4.2.5. Kercernaan BK (KcBK) ... 64
BAB V SIMPULAN DAN SARAN ... 69
5.1. Simpulan ... 69
5.2 Saran ... 69
DAFTAR PUSTAKA ... 70
xiv
DAFTAR GAMBAR
Gambar 1. Sorgum hasil mutasi radiasi PAIR-BATAN ... 11
Gambar 2. Struktur selulosa (Gascoigne, 1960) ... 12
Gambar 3. Struktur hemiselulosa (Fangel dan Wegener, 1995) ... 16
Gambar 4. Struktur lignin (Fangel dan Wegener, 199l)... 16
Gambar 5. Sistem pencernaan ruminansia (Fariani, 2008) ... 17
Gambar 6. Skema pencernaan karbohidrat didalam rumen dan perubahan asam... 30
Gambar 7. Proses metabolisme protein pada ruminansia (Sakinah, 2005) ... 33
Gambar 8. Bagan alir penelitian... 46
Gambar 9. Proses pembentukan asam amino (Kamal, 1994) ... 51
Gambar 10. Skema pemisahan menggunakan detergent (Van Soet, 1982) ... 55
Gambar 11. Hasil analisis pH SHF setelah diinkubasi selama 48 jam ... 67
Gambar 12. Hasil konsentrasi NH3 SHF setelah diinkubasi selama 48 jam. ... 65
Gambar 13. Hasil Produksi TVFA SHF setelah diinkubasi selama 48 jam.. ... 59
Gambar 14. Hasil KcBO SHF setelah inkubasi selama 48 jam... ... 61
1
DAFTAR TABEL
Tabel 1. Komposisi nutrisi dalam sorgum sebagai pakan ternak………12
Tabel 2. Data nilai kandungan nutrisi varietas sorgum………..……….13
Tabel 3. Komposisi nutrisi limbah sorgum sebagai pakan ternak………...14
Tabel 4. Nilai daya cerna in vitro dan in vivo sorgum………...….15
Tabel 5. Jumlah bateri dan protozoa rumen pada sapi……….23
Tabel 6. Profil nutrisi SHF dengan 9 hari waktu tanam………..47
2
DAFTAR LAMPIRAN
Lampiran 1. Hasil kandungan nutrisi ... 79
Lampiran 2. Kecernaan in vitro dan produk fermentasi rumen ... 81
Lampiran 3. Uji statistik kandungan nutrisi SHF ... 83
Lampiran 4. Uji statistik kecernaan in vitro ... 86
Lampiran 5. Dokumentasi penelitian ... 89
1
BAB I PENDAHULUAN 1.1. Latar Belakang
Hewan ternak seperti ruminansia merupakan salah satu hewan yang menjadi
sumber protein hewani. Hal tersebut karena hewan ini mampu memanfaatkan bahan
makanan yang tidak dapat dimanfaatkan oleh manusia. Hijauan seperti rumput atau
limbah pertanian yang tidak dikonsumsi oleh manusia dapat dikonversikan ke dalam
makanan bernilai gizi tinggi. Makanan yang bernilai gizi tinggi tersebut adalah
sumber protein hewani berupa daging, telur dan susu. Kebutuhan masyarakat
Indonesia akan protein hewani semakin meningkat, sehingga harus diimbangi dengan
peningkatan produktivitas ternak. Sebagaimana juga dijelaskan di dalam Al-Qur’an
surah Al-Mu’minun ayat 21:
اَهيِف ْمُكَل َو اَهِنوُطُب يِف اَّمِم ْمُكيِقْسُنۖ ًة َرْبِعَل ِماَعْنَ ْلْا يِف ْمُكَل َّنِإ َو
َهْنِم َو ٌة َريِثَك ُعِفاَنَم
َنوُلُكْأَت ا
Artinya: Dan sesungguhnya pada binatang-binatang ternak, benar-benar terdapat
pelajaran yang penting bagi kamu, Kami memberi minum kamu dari air susu yang
ada dalam perutnya, dan (juga) pada binatang-binatang ternak itu terdapat faedah
yang banyak untuk kamu, dan sebagian daripadanya kamu makan (QS.
Al-Mu’minun: 21).
Dari ayat Al-qur’an pada surah Al-Mu’minun ayat 21 di atas dijelaskan bahwa
2
binatang ternak, ruminansia juga membutuhkan pakan atau hijauan dalam
melangsungkan kehidupannya. Menurut ACIAR (2008), hijauan makanan ternak
yang dipergunakan untuk ternak ruminansia sebagian besar berupa rumput-rumputan,
sehingga rumput memegang peranan penting dalam penyediaan pakan dan telah
umum digunakan oleh peternak. Pakan hijauan yang diberikan sebaiknya hijauan
yang mempunyai kandungan nutrisi yang baik, tinggi dan disukai oleh ternak, seperti
rumput lapangan yang memiliki kandungan protein kasar (PK) sebesar 8,20% (Akbar,
2007).
Berbagai teknologi dapat diaplikasikan untuk mengatasi kebutuhan akan
tanaman pakan di lahan terbatas. Salah satunya adalah budidaya tanaman pakan
secara hidroponik. Hidroponik merupakan suatu cara bertanam tanpa media tanah.
Budidaya tanaman pakan menggunakan sistem hidroponik (hydroponic system)
menawarkan solusi yang tepat dalam penyediaan hijuan pakan yang memiliki
keterbatasan lahan dan iklim dalam budidaya tanaman pakan dan juga untuk
penyediaan hijauan pakan yang cepat dan bernutrisi tinggi (Krismawati, 2012).
Keuntungan dari budidaya tanaman secara hidroponik adalah keberhasilan
tanaman untuk tumbuh dan berproduksi lebih terjamin, perawatan lebih praktis dan
gangguan hama lebih terkontrol, pemakaian pupuk lebih hemat, tanaman yang mati
lebih mudah diganti dengan tanaman yang baru, tidak membutuhkan banyak tenaga
kasar karena metode kerja lebih hemat dan memiliki standarisasi, tanaman dapat
tumbuh lebih pesat dan dengan keadaan yang tidak kotor dan rusak, hasil produksi
lebih continue dan lebih tinggi dibanding dengan penanaman ditanah, beberapa jenis
3
produk non-hydroponic, tidak ada resiko kebanjiran, erosi, kekeringan, atau
ketergantungan dengan kondisi alam dan tanaman hidroponik dapat dilakukan pada
lahan atau ruang yang terbatas, misalnya di atap, dapur atau garasi (Krismawati,
2012).
Beberapa tanaman yang di kembangkan sebagai sumber pakan ternak adalah
sorgum. Sorgum (Sorghum spp.) mempunyai kandungan gizi dan serat kasar yang
cukup memadai. Sorgum juga dapat digunakan sebagai sumber pakan ternak karena
sorgum memiliki kandungan nutrisi yang baik, bahkan kandungan proteinnya lebih
tinggi daripada beras (Sirappa, 2003). Sorgum yang digunakan pada penelitian ini
adalah sorgum Pahat, Samurai 1 dan Samurai 2. Sorgum Pahat merupakan hasil
pemuliaan varietas sorgum yang dilakukan oleh Badan Tenaga Nuklir Nasional
(BATAN) yang menggunakan teknik iradiasi sinar gamma untuk memperbaiki sifat
agronomi dan kualitas sorgum (biji dan hijauan).
Varietas sorgum Samurai 1 dan Samurai 2 merupakan varietas yang
dihasilkan melalui pemuliaan mutasi radiasi dari sorgum Pahat sebagai varietas
mutan. Beberapa kelebihan sorgum Pahat sebagai varietas mutan adalah memiliki
produktivitas biji tinggi (5 ton/ha), batang semi pendek (158 cm), rendah tanin
(0.012%) dan multifungsi. Keunggulan Samurai 1 adalah produktivitas biji lebih
tinggi daripada Pahat (7.5 ton/ha), biomasa tinggi, kadar gula batang tinggi (12-18%)
sehingga cocok untuk bahan bioetanol. Samurai 2 memiliki keunggulan produktivitas
tinggi, biomasa total tanaman tinggi 47 ton/ha, kebal terhadap penyakit karat daun
4
Penelitian ini menggunakan teknik in vitro. Teknik in vitro atau yang dikenal
dengan teknik mengukur daya degradabilitas secara laboratoris adalah suatu teknik
alternatif untuk memecahkan permasalahan yang terdapat pada teknik in vivo
(Soebarinoto et al., 1990). Kecernaan suatu bahan pakan untuk ternak ruminansia
dapat dihitung secara akurat pada skala laboratorium dengan percobaan menggunakan
cairan rumen dan pepsin (Zakariah, 2012). Pada penelitian ini, teknik in vitro yang
digunakan adalah metode dua tahap Tilley dan Terry. Dua tahap in vitro pada
percobaan ini yaitu: tahap proses pencernaan fermentatif dan tahap proses pencernaan
secara hidrolisis (Andayani, 2010). Fase pencernaan fermentatif merupakan fase yang
pertama. Bahan pakan di fermentasi secara anaerob dalam cairan rumen yang
merupakan sumber mikroba rumen dan larutan buffer yang merupakan saliva buatan.
Fase selanjutnya adalah fase pencernaan hidrolitis. Pada fase kedua ini dilakukan
proses pencernaan hidrolitis atau enzimetis yaitu pencernaan oleh larutan asam
khlorida-pepsin pada kondisi aerob.
Berdasarkan penelitian Wahyono et al (2015) tentang evaluasi fermentabilitas
ransum kerbau yang mengandung sorgum dengan pendekatan In Sacco, In Vitro dan
RUSITEC membuktikan bahwa silase jerami sorgum samurai 2 sebagai sumber serat
mampu menggantikan sumber serat dari jerami sorgum Pahat. Maka di dalam
penelitian ini akan dilihat pengaruh varietas setiap sorgum yang dipanen pada umur 9
hari terhadap kandungan nutrisi dan tingkat kecernaan in vitro. Pengaruh varietas
diamati melalui penanaman sorgum varietas Pahat, Samurai 1 dan Samurai 2
5
Pahat, Samurai 1 dan Samurai 2 yang telah dipanen kemudian diuji
fermentabilitasnya secara in vitro menggunakan metode dua tingkat Tilley and Terry
(1963). Kandungan nutrisi yang di uij meliputi kandungan bahan kering (BK), bahan
organik (BO), protein kasar (PK), ekstrak eter (EE), neutral detergent fiber (NDF)
dan acid detergent fiber (ADF). Tingkat kecernaan in vitro yang diukur meliputi
kecernaan bahan kering (KcBK) dan kecernaan bahan organik (KcBO). Produk
fermentasi rumen yang diukur meliputi konsentrasi NH3, volatile fatty acid (VFA),
pH.
1.2. Rumusan Masalah
1. Apakah sorgum Pahat, sorgum Samurai 1 dan sorgum Samurai 2 yang
ditanam secara hidroponik memiliki kandungan nutrisi yang tinggi untuk
hijauan pakan ternak ?
2. Bagaimana kecernaan in vitro dari sorgum Pahat, sorgum Samurai 1 dan
sorgum Samurai 2 yang di tanam secara hidroponik ?
1.3. Hipotesis
1. Hijauan sorgum Pahat, Samurai 1 dan Samurai 2 yang ditanam secara
hidroponik memiliki kandungan nutrisi yang tinggi.
2. Sorgum Pahat, Samurai 1 dan Samurai 2 yang ditanam secara hidroponik
6 1.4. Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui kandungan nutrisi dan tingkat
kecernaan in vitro pada tiga varietas sorgum yaitu varietas Pahat, Samurai 1 dan
Samurai 2 yang di tanam secara hidroponik sebagai pakan ternak ruminansia.
1.5. Manfaat pengujian
Penelitian ini diharapkan dapat menyelesaikan masalah akan keterbatasan
lahan untuk budidaya pakan ternak dengan alternatif budidaya secara hidroponik.
Selain itu, pada penelitian ini juga diharapkan mampu memberikan informasi
tentang kandungan nutrisi dan kecernaan secara in vitro dari sorgum yang
7
BAB II
TINJAUAN PUSTAKA
2.1. Hijauan Pakan Ternak
Pakan adalah kebutuhan mutlak yang harus selalu diperhatikan dalam
kelangsungan hidup pemeliharaan ternak, apalagi pada ternak ruminansia yang
memerlukan sumber hijauan yang proporsinya lebih besar. Pemberian pakan dengan
cara dibatasi adalah yang cukup baik, tetapi kuantitas dan kualitasnya harus
diperhitungkan agar mencukupi kebutuhan ternak. Perlu dilakukan penyusunan
ransum yang didasarkan kepada kelas, jenis kelamin, keadaan fisiologis dan prestasi
produksi ternak bersangkutan (Santosa, 2006). Pakan digunakan untuk kebutuhan
harian hidup pokok, produksi dan bereproduksi. Sapi membutuhkan pakan berupa
hijauan 10% dari berat badan dan pakan tambahan berupa konsentrat 1-2% dari berat
badan berupa dedak halus, bungkil kelapa, gaplek atau ampas tahu (Tabrany, 2004).
Hijauan diartikan sebagai pakan yang mengandung serat kasar atau bahan
yang tak tercerna relatif tinggi. Konsentrat adalah pakan yang mengandung serat
kasar atau bahan yang tak tercerna relatif rendah. Contoh pakan hijauan yaitu rumput
gajah dan contoh konsentrat yaitu bungkil inti sawit (Siregar, 1993).
Bahan pakan adalah bahan yang dapat dimakan, dicerna dan digunakan untuk
kehidupan ternak tanpa menyebabkan penyakit dan keracunan. Beberapa hal penting
yang harus diperhatikan dalam memilih bahan pakan antara lain adalah (a) bahan
pakan harus mudah diperoleh dan sedapat mungkin terdapat di daerah sekitar
9 (b) bahan pakan harus terjamin ketersediaannya sepanjang waktu dan dalam jumlah
yang mencukupi keperluan, (c) bahan pakan harus mempunyai harga yang layak dan
sedapat mungkin, mempunyai fluktuasi harga yang tidak terlalu besar, (d) bahan
pakan harus diusahakan tidak bersaing dengan kebutuhan manusia, (e) bahan pakan
harus dapat diganti oleh bahan pakan lain yang kandungan zat-zat makanannya
hampir setara, (f) bahan pakan tidak mengandung racun dan tidak dipalsukan atau
tidak menampakkan perbedaan warna, bau atau rasa dari keadaan normal
(Santosa,1995).
Kemampuan ternak ruminansia dalam mengkonsumsi pakan dipengaruhi oleh
banyak faktor, seperti faktor ternak itu sendiri, faktor pakan yang diberikan dan faktor
lainnya. Faktor ternak meliputi bobot badan, status fisiologik, potensi genetik, tingkat
produksi dan kesehatan ternak. Faktor pakan meliputi bentuk dan sifat pakan,
komposisi zat-zat gizi, toksisitas atau anti nutrisi. Sedangkan faktor lain meliputi
suhu dan kelembapan udara, curah hujan, lama siang atau malam dan keadaan ruang
kandang serta tempat pakan (Santosa, 1995).
Pakan dari tumbuh-tumbuhan dapat berupa hasil tanaman maupun hasil
sisanya misalnya jagung, dedak halus dan jerami, sedangkan pakan asal hewan lebih
banyak dari hasil produksi sisa yang sudah digunakan oleh manusia yaitu misalnya
tepung ikan, tepung tulang, daging dan lain-lainnya. Karena di dalam tubuh ternak
terdiri atas zat-zat gizi, maka ternak memerlukan zat-zat gizi dari luar yang dapat
dipakai oleh ternak untuk menjaga kehidupan dan produksi (Kusumo, 1994).
Ditambahkan Kusumo (1994) bahwa zat yang ada dalam pakan terdiri atas
10 disebut zat gizi atau nutrien. Zat gizi inilah yang diperlukan oleh ternak, sesuai
dengan umur, besarnya ukuran tubuh ternak, jenis ternak dan tingkat produktivitas
suatu ternak terhadap kebutuhan tertentu akan suatu zat gizi (nutrient requirement).
2.2. Sorgum
Sorgum (Sorghum bicolor L.(Moench)) termasuk jenis tanaman serealia yang
berasal dari Ethiopia (Somantri et al., 2007). Sorgum digunakan sebagai bahan
pangan untuk manusia, pakan ternak dan bahan baku industri karena mengandung
nilai gizi yang cukup tinggi (Soeranto, 2007). Rismunandar (1989) menyatakan
bahwa sorgum digunakan sebagai pakan ternak dan sebagai pangan manusia pada
musim kering dimana ketersediaan bahan pangan lain menurun dan OISAT (2011)
menjelaskan bahwa sorgum memiliki kandungan nutrisi yang tinggi.
Tanaman sorgum yang digunakan sebagai pakan ternak unggas berupa biji,
sedangkan untuk ternak ruminansia menggunakan daun dan batang (Somantri et al.,
2007). Sorgum digunakan sebagai sumber hijauan karena mengandung serat kasar
yang cukup tinggi pada daun yaitu sekitar 32,2% (Hartadi et al., 1997). Sorgum
mempunyai struktur akar yang kuat dan dilapisi lilin, sehingga tanaman sorgum
relatif tahan kering dan dapat digunakan sebagai cadangan makanan pada musim
kemarau. Berdasarkan keunggulan-keunggulan tersebut, penggunaan sorgum sebagai
pakan ternak mulai dilakukan. Indrawan (2002) menggunakan daun dan batang
sorgum hasil mutasi oleh Badan Tenaga Nuklir Nasional. Gambar 1 berikut ini
merupakan gambar sorgum hasil mutasi yang dilakukan oleh BATAN. Berikut ini
11
Gambar 1. Sorgum hasil mutasi radiasi PAIR-BATAN (Dokumentasi pribadi, 2017)
Kingdom : Plantae Divisi : Magnoliophyta Kelas : Liliopsida Ordo : Poales Famili : Poaceae Genus : Sorgum
Spesies : Sorgum bicolor
Limbah sorgum (daun dan batang segar) dapat dimanfaatkan sebagai hijauan
pakan ternak. Potensi daun sorgum manis sekitar 14-16% dari bobot segar batang
atau sekitar 3 t daun segar/ha dari total produksi 20 t/ha. Soebarinoto et al (1996)
melaporkan bahwa setiap hektar tanaman sorgum dapat menghasilkan jerami 2,62 +
0,53 t bahan kering. Konsumsi rata-rata setiap ekor sapi adalah 15 kg daun segar/hari
(Direktorat Jenderal Perkebunan 1996). Daun sorgum tidak dapat diberikan secara
12 sorgum setara dengan rumput gajah dan pucuk tebu. Komponen nutrisi yang terdapat
dalam tanaman sorgum disajikan dalam Tabel 1.
Tabel 1. Komponen nutrisi dalam sorgum sebagai pakan ternak
Perakitan varietas sorgum bukan hanya dilakukan oleh Badan Litbang
Pertanian tetapi juga instituti lain seperti BATAN (Badan Tenaga Nuklir) yang
menggunakan teknik iradiasi sinar gamma untuk memperbaiki sifat agronomi dan
kualitas sorgum (biji dan hijauan). Induksi mutasi untuk meningkatkan keragaman
genetik tanaman sorgum menghasilkan satu varietas pada tahun 2013 yang diberi
nama Pahat (pangan sehat) untuk dikembangkan sebagai bahan pangan dan pakan
alternatif di daerah kering (Soeranto et al. 2002).
Dari sorgum Pahat tersebut kemudian BATAN melakukan pemuliaan kembali
yang menghasilkan varietas baru yaitu sorgum Samurai 1 dan sorgum Samurai 2.
Ketiga varietas sorgum tersebut dihasilkan melalui pemuliaan mutasi radiasi yang
memanfaatkan teknologi nuklir sehingga menghasilkan varietas mutan sorgum yang
berpotensi dalam industri pangan (kadar gula tinggi) dan bioetanol serta memiliki
palatabilitas tinggi. Tujuan pemuliaan sorgum dengan teknik mutasi radiasi adalah
Nutrien (% BK) Bahan Kering Bahan Organik Protein Kasar Ekstrak Ether Serat Kasar
Ekstrak Tanpa Nitrogen Ca P 90.78 90.70 4.41 4.56 31.69 50.04 0.32 0.06 Sumber: Purwantari (2008)
13 untuk menghasilkan tanaman yang memiliki genotipe tahan terhadap kondisi lahan
sub-optimal, namun tetap memiliki produktivitas dan kualitas yang tinggi.
Beberapa kelebihan sorgum Pahat sebagai varietas mutan adalah memiliki
produktivitas biji tinggi (5 ton/ha), batang semi pendek (158 cm), rendah tanin
(0.012%) dan multifungsi. Keunggulan Samurai 1 adalah produktivitas biji lebih
tinggi daripada Pahat (7.5 ton/ha), biomasa tinggi, kadar gula batang tinggi (12-18%)
sehingga cocok untuk bahan bioetanol. Samurai 2 memiliki keunggulan produktivitas
tinggi, biomasa total tanaman tinggi 47 ton/ha, kebal terhadap penyakit karat daun
dan busuk pelepah (Sihono, et al., 2013). Ada pula data nilai kandungan nutrisi dari
sorgum pahat dan sorgum samurai 2 disajikan pada tabel 2.
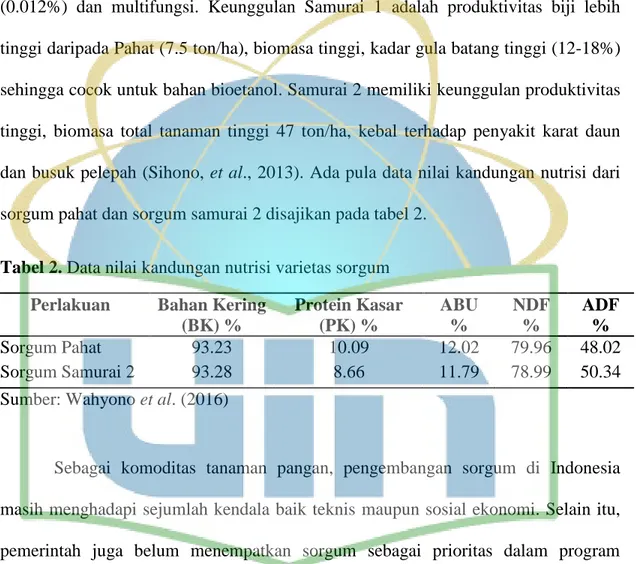
Tabel 2. Data nilai kandungan nutrisi varietas sorgum Perlakuan Bahan Kering
(BK) % Protein Kasar (PK) % ABU % NDF % ADF % Sorgum Pahat 93.23 10.09 12.02 79.96 48.02 Sorgum Samurai 2 93.28 8.66 11.79 78.99 50.34
Sumber: Wahyono et al. (2016)
Sebagai komoditas tanaman pangan, pengembangan sorgum di Indonesia
masih menghadapi sejumlah kendala baik teknis maupun sosial ekonomi. Selain itu,
pemerintah juga belum menempatkan sorgum sebagai prioritas dalam program
perluasan areal tanam dengan alasan sorgum bukan kebutuhan pokok, sehingga
perluasan sorgum tidak masuk dalam rencana strategis dan belum ada anggaran
khusus (Direktorat Serealia, 2013). Berdasarkan data Direktorat Jenderal Tanaman
14 1990 menunjukkan luas tanam sorgum di Indonesia di atas 18.000 ha dan tahun 2011
luas tanam sorgum menurun menjadi 3.607 ha (Direktorat Jenderal Tanaman Pangan,
2012).
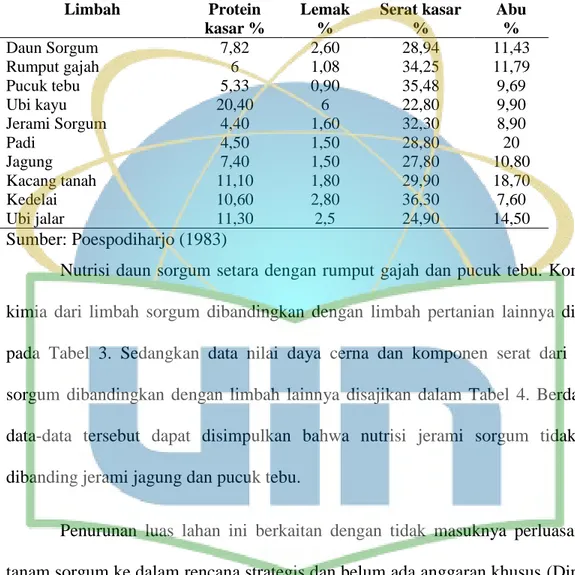
Tabel 3. Komposisi nutrisi limbah sorgum dan bahan lainnya sebagai pakan ternak
Limbah Protein kasar % Lemak % Serat kasar % Abu % Daun Sorgum 7,82 2,60 28,94 11,43 Rumput gajah 6 1,08 34,25 11,79 Pucuk tebu 5,33 0,90 35,48 9,69 Ubi kayu 20,40 6 22,80 9,90 Jerami Sorgum 4,40 1,60 32,30 8,90 Padi 4,50 1,50 28,80 20 Jagung 7,40 1,50 27,80 10,80 Kacang tanah 11,10 1,80 29,90 18,70 Kedelai 10,60 2,80 36,30 7,60 Ubi jalar 11,30 2,5 24,90 14,50 Sumber: Poespodiharjo (1983)
Nutrisi daun sorgum setara dengan rumput gajah dan pucuk tebu. Komposisi
kimia dari limbah sorgum dibandingkan dengan limbah pertanian lainnya disajikan
pada Tabel 3. Sedangkan data nilai daya cerna dan komponen serat dari limbah
sorgum dibandingkan dengan limbah lainnya disajikan dalam Tabel 4. Berdasarkan
data-data tersebut dapat disimpulkan bahwa nutrisi jerami sorgum tidak kalah
dibanding jerami jagung dan pucuk tebu.
Penurunan luas lahan ini berkaitan dengan tidak masuknya perluasan areal
tanam sorgum ke dalam rencana strategis dan belum ada anggaran khusus (Direktorat
Serealia, 2013) sehingga data perluasan areal tanam sorgum pada tahun 2014 belum
diperoleh secara konkrit. Kenyataan ini merupakan peluang sekaligus tantangan agar
produktivitas sorgum ditingkat petani dapat meningkat dengan meningkatkan
15
Tabel 4. Nilai daya cerna in vitro dan in vivo serta fraksi serat limbah sorgum
Komponen Jerami Daun ubi
kayu
Pucuk tebu
Sorgum Jagung Kacang tanah
Bobot kering (%) 39,80 39,80 29,30 23,50 37,40 Dinding sel (%) 81,80 79,50 69,40 62,40 86,50 Serat (%) 76, 73,50 62 58,50 81,50 Hemiselulosa (%) 5,80 6 7,40 3,40 5 Lignin (%) 16 12,80 6,80 14,20 9,20 Silika (%) 4,40 20,40 1,90 1,60 4,60 BKTIV (%) 39,40 32,70 67,30 54,30 39,40 BOTIV (%) 39,20 30,70 59,00 48,70 36,30
Daya cerna in vivo
TNT (%) 33 36,60 67,20 54,30 39,40
Protein tercerna (%) 1 0,60 3,90 - 1,50
ET (kkal/kg) 1.766 902 2,992 - 1.917
Sumber: Hartadi et al. (1981)
Keterangan: BKITV: Bahan Kering Tanpa In Vitro; BOITV: Bahan Organik Tanpa
In Vitro; TNT: Trinitrotoluene.
2.3. Kandungan Kimia pada Sorgum
Sorgum memiliki kandungan serat pangan yang tinggi. Serat pangan yang
terdapat pada sorgum adalah selulosa, hemiselulosa, lignin, (Laroche et al., 2006).
Selulosa adalah zat penyusun tanaman yang terdapat pada struktur sel dimana struktur
selulosa dapat dilihat pada gambar 2. Kadar selulosa dan hemiselulosa pada tanaman
pakan yang muda mencapai 40% dari bahan kering. Bila hijauan makin tua proporsi
selulosa dan hemiselulosa makin bertambah (Tillman et al., 1998). Selulosa
merupakan komponen utama penyusun dinding sel tanaman. Kandungan selulosa
pada dinding sel tanaman tingkat tinggi sekitar 35-50% dari berat kering tanaman
16
Gambar 2. Struktur selulosa (Gascoigne, 1960)
Hemiselulosa merupakan kelompok polisakarida heterogen dengan berat
molekul rendah. Jumlah hemiselulosa biasanya antara 15 dan 30 persen dari berat
kering bahan lignoselulosa (Taherzadeh, 1999). Hemiselulosa relatif lebih mudah
dihidrolisis dengan asam menjadi monomer yang mengandung glukosa, mannosa,
galaktosa, xilosa dan arabinosa. Struktur hemiselulosa dapat dilihat pada gambar 3.
Hemiselulosa mengikat lembaran serat selulosa membentuk mikrofibril yang
meningkatkan stabilitas dinding sel. Hemiselulosa juga berikatan silang dengan lignin
membentuk jaringan kompleks dan memberikan struktur yang kuat (Suparjo, 2010).
Gambar 3. Struktur hemiselulosa (Fangel dan Wegener, 1995)
Lignin adalah gabungan beberapa senyawa yang hubungannya erat satu sama
lain, mengandung karbon, hidrogen dan oksigen, namun proporsi karbonnya lebih
17 dimana lignin sangat tahan terhadap degradasi kimia, termasuk degradasi enzimatik
(Tillman et al., 1989). Lignin sering digolongkan sebagai karbohidrat karena
hubungannya dengan selulosa dan hemiselulosa dalam menyusun dinding sel, namun
lignin bukan karbohidrat. Hal ini ditunjukkan oleh proporsi karbon yang lebih tinggi
pada lignin (Suparjo, 2008). Pengerasan dinding sel kulit tanaman yang disebabkan
oleh lignin menghambat enzim untuk mencerna serat dengan normal. Hal ini
merupakan bukti bahwa adanya ikatan kimia yang kuat antara lignin, polisakarida
tanaman dan protein dinding sel yang menjadikan komponen-komponen ini tidak
dapat dicerna oleh ternak (McDonald et al., 2002).
Gambar 4. Struktur lignin (Fangel dan Wegener, 199l)
2.4. Hydroponic Fodder
Hidroponik adalah budidaya tanaman pada media tanam selain tanah dan
18 2008). Hydroponic fodder dapat dijadikan sebagai teknologi alternatif untuk
memproduksi pakan hijauan. Teknik hidroponik memiliki kemampuan untuk
menghasilkan produk berkualitas selain itu sistem hidroponik tidak tergantung
dengan musim sehingga tanaman dapat ditanam sepanjang tahun dan dapat ditanam
di lahan yang sempit dengan sistem green house. Budidaya tanaman dengan sistem
hidroponik umumnya dilakukan di dalam green house (Suhardiyanto, 2009).
Pemanfaatan teknik hidroponik untuk penanaman hijauan pakan diharapkan
dapat mengatasi keterbatasan produksi hijauan sebagai pakan sapi perah dan dapat
mengatasi kekurangan kandungan nutrisi pada pakan terutama vitamin esensial yang
sangat dibutuhkan sapi perah. Hijauan pakan yang diproduksi dengan teknik
hidroponik memiliki kandungan tinggi protein dan energi metabolisme yang sangat
mudah dicerna oleh hewan (Cader, 2002).
Budidaya sistem hidroponik fokus pada cara pemberian air dan hara yang
optimal, sesuai dengan kebutuhan tanaman, umur tanaman, dan kondisi lingkungan
sehingga tercapai hasil yang maksimum (Prihmantoro dan Indriani, 2001). Unsur hara
atau nutrisi diberikan ke tanaman dengan cara dilarutkan dalam air, kemudian
disirkulasikan ke akar tanaman secara berkala atau pun terus menerus tergantung dari
jenis sistem hidroponik yang dipakai (Lingga, 2000). Nutrisi yang digunakan dalam
budidaya dengan sistem hidroponik adalah nutrisi AB mix. Nutrisi AB Mix
mengandung 16 unsur hara esensial yang diperlukan tanaman, dari 16 unsur tersebut
6 diantaranya diperlukan dalam jumlah banyak (makro) yaitu N, P, K, Ca, Mg, S, dan
10 unsur diperlukan dalam jumlah sedikit (mikro) yaitu Fe, Mn, Bo, Cu, Zn, Mo, Cl,
19 Salah satu tantangan dalam memproduksi hijauan pakan (green fodder)
dengan sistem hidroponik yaitu tumbuhnya jamur. Keadaan lingkungan (suhu,
kelembaban dan cahaya) yang kurang mendukung dapat menyebabkan jamur
berkembang yang kemudian merusak tanaman dan menyebabkan masalah kesehatan
pada ternak yang diberi pakan berjamur. Kerusakan pada biji jagung biasanya
disebabkan oleh jamur, sehingga diperlukan disinfektan untuk mengurangi
pertumbuhan jamur. Hypocloride aman digunakan dan bersifat bakterisid.
Disinfektan ini dipakai dengan cara perendaman selama 15 menit. Larutan ini
merupakan disinfektan yang sangat aktif pada semua bakteri, virus, jamur, parasit dan
beberapa spora (Anusavice, 2004).
Sutiyoso (2004) mengungkapkan bahwa keberhasilan sistem hidroponik ini
dipengaruhi oleh faktor lingkungan diantaranya kelembaban, temperatur dan angin.
Pemberian mulsa dimaksudkan untuk mencegah hilangnya air akibat penguapan,
memperkecil perbedaan suhu antara siang dan malam hari, mencegah penyinaran
langsung dari matahari yang menyebabkan kerusakan pada tanaman terutama pada
saat perkecambahan. Disamping itu, mulsa akan dapat mempertahankan kelembaban
nisbi udara dipermukaan tetap meningkat sehingga kecepatan penguapan dapat
dibatasi dan kelembaban udara dapat dipertahankan (Doring et al. 2006 dan Djazuli,
1986).
2.5. Ruminansia
Ruminansia adalah mamalia berkuku genap seperti sapi, kerbau, domba,
20 ruminansia berasal dari bahasa Latin “ruminare” yang artinya mengunyah kembali
atau memamah biak, sehingga dalam bahasa Indonesia dikenal dengan hewan
memamah biak. Hijauan seperti rumput atau limbah pertanian yang tidak dimakan
oleh manusia dapat dikonversikan ke dalam makanan bernilai gizi tinggi yang dapat
dikonsumsi oleh manusia (Direktorat Jendral Budidaya Ternak Ruminansia, 2009).
Ternak ruminansia dapat dibagi menjadi dua kelompok, pertama kelompok
ternak ruminansia besar yaitu sapi dan kerbau dan kelompok ternak ruminansia kecil
yaitu kambing dan domba (Blakely dan Bade, 1998). Ternak ruminansia adalah
hewan ternak yang pada sistem pencernaanya mempunyai alat pencernaan yang
berbentuk rumen (perut besar). Berdasarkan susunan alat-alat pencernaanya hewan
ternak dibagi dalam 2 kelompok besar yaitu ternak berlambung tunggal dan ternak
berlambung jamak. Kelompok ternak berlambung jamak inilah yang biasa di sebut
sebagai ternak ruminansia. Dalam rumen (perut besar) ternak ruminansia terdapat
berjuta-juta mikroba yang hidup bersimbiosis dengan ternak inang dan sangat
berguna dalam proses pencernaan. Dengan mikroba-mikroba tersebut, ternak
ruminansia mampu memanfaatkan bahan makanan berkadar serat tingi seperti
rumput-rumputan dan dedaunan menjadi makanan (Fariani, 2008).
2.6. Pencernaan Ternak Ruminansia
Pencernaan merupakan serangkaian proses perubahan fisik maupun kimia
yang dialami bahan pakan ketika berada dalam saluran pencernaan. Pencernaan
mekanik ruminansia terjadi di mulut dengan tujuan memperkecil ukuran partikel
21 Proses pencernaan kimiawi dibantu oleh enzim pencernaan yang dihasilkan oleh
organ pencernaan (Van Soest, 1994).
Ruminansia memiliki perut majemuk yang terdiri dari rumen, retikulum,
omasum dan abomasum yang ditunjukkan pada gambar 5. Rumen merupakan
struktur terbesar yang tersusun dari 1/7 sampai 1/10 massa ternak. Pada bagian ini
merupakan tempat berlangsungnya proses fermentasi terbesar. Kondisi dalam rumen
adalah anaerobic dengan suhu 38-42○C. Tekanan osmosis pada rumen mirip dengan
tekanan aliran darah, pH dipertahankan oleh buffer karbonat dari saliva karena
adanya VFA dan amonia. Saliva yang masuk ke dalam rumen berfungsi sebagai
buffer dan membantu mempertahankan pH tetap pada 6,8. Selain itu saliva juga
berfungsi sebagai zat pelumas dan surfaktan yang membantu dalam proses mastikasi
dan ruminasi (Arora, 1995).
Rumen merupakan bagian saluran pencernaan vital pada ternak ruminansia.
Pada rumen terjadi pencernaan secara fermentatif dan pencernaan secara hidrolitik.
Pencernaan fermentatif membutuhkan bantuan mikroba dalam mencerna pakan
terutama pakan dengan kandungan selulase dan hemiselulase yang tinggi. Sedangkan
pencernaan hidrolisis membutuhkan bantuan enzim dalam mencerna pakan. Protein
pakan di dalam rumen akan mengalami hidrolisis menjadi asam amino dan
oligopeptida. Selanjutnya asam amino mengalami katabolisme lebih lanjut dan
menghasilkan amonia, VFA, dan CO2. Ternak ruminansia besar seperti sapi potong
dan sapi perah dapat memanfaatkan pakan dengan kandungan nutrisi yang sangat
22
Gambar 5. Sistem pencernaan ruminansia (Fariani, 2008)
Pakan berserat (hijauan) yang dimakan ditahan untuk sementara di dalam
rumen. Pada saat hewan beristirahat, pakan yang telah berada dalam rumen
dikembalikan ke mulut (proses regurgitasi), untuk dikunyah kembali (proses
remastikasi), kemudian pakan ditelan kembali (proses redeglutasi). Selanjutnya pakan
tersebut dicerna lagi oleh enzim-enzim mikroba rumen. Kontraksi retikulum rumen
yang terkoordinasi dalam rangkaian proses tersebut bermanfaat pula untuk
pengadukan digesta inokulasi dan penyerapan nutrien. Selain itu kontraksi retikulum
rumen juga bermanfaat untuk pergerakan digesta meninggalkan retikulo rumen.
Rumen dihuni tidak kurang dari empat jenis mikroba yaitu: bakteri, protozoa,
fungi dan virus (Preston dan Leng, 1987). Pada tabel 5 dapat dilihat bahwa jumlah
bakteri total kerbau (16,20 x 108 sel/ml) lebih tinggi daripada sapi (13,20 x 108
sel/ml). Persentase bakteri selulolitik dari total bakteri, pada kerbau (42,3 %) lebih
23 yang melaporkan bahwa aktivitas bakteri selulolitik dalam cairan rumen kerbau lebih
tinggi daripada cairan rumen sapi. Akibatnya laju degradasi dan kecernaan benang
kapas pada cairan rumen kerbau jauh lebih cepat daripada cairan rumen sapi sehingga
kecernaan pada cairan rumen kerbau lebih tinggi. Sama seperti populasi bakteri total,
jumlah protozoa rumen pada kerbau (2,8 x 105 sel/ml) lebih tinggi dibandingkan sapi
(1,5 x 105sel/ml) (Pradhan, 1994). Hal inilah yang membuat tingkat efisiensi
kecernaan ransum pada kerbau lebih tinggi dibandingkan sapi (Ruangprim et al.,
2007).
Tabel 5. Jumlah bakteri dan protozoa rumen pada sapi dan kerbau yang diberi pakan
berserat tinggi
Mikrobiota Sapi Kerbau
Bakteri (x 108sel/ml) Selulolitik 2,58 6,86 Proteolitik 0,41 0,54 Amilolitik 8,63 11,05 Total Bakteri 13,2 16,20 Protozoa (x 105 sel/ml) Total Protozoa 1,15 1,59 Sumber: Pradhan (1994)
Bakteri pencerna pati yaitu Streptococcus bovis, Ruminobacter amylophilus,
Prevotella ruminicola, Succinomonas amylophilus dan Selenomonas ruminantium.
Sedangkan bakteri pencerna selulosa adalah Ruminococcus flavefaciens, R. albus, F.
succinogenes dan B. fibrisolvens. Bakteri tersebut mempunyai enzim yang mampu
menghancurkan karbohidrat kompleks menjadi glukosa dan VFA (Freer dan Dove,
24 rumen sangat dipengaruhi oleh konsentrasi amonia dan VFA yang merupakan sumber
kerangka karbon untuk pertumbuhan dan pembentukan protein mikroba.
Sutardi (1979) menyatakan bahwa adanya bakteri dan protozoa yang hidup
dalam rumen menyebabkan ruminansia dapat mencerna ransum yang mengandung
serat kasar tinggi. Pernyataan ini didukung pula oleh Arora (1995) yang menyatakan
bahwa protozoa berperan dalam pola fermentasi rumen dengan cara mencerna
partikel-partikel pati sehingga dapat mempertahankan pH dan menghasilkan
konsentrasi VFA rendah, selain itu protozoa juga memangsa bakteri untuk memenuhi
kebutuhannya karena kemampuan protozoa untuk mensintesis vitamin B kompleks
dan asam amino sangat rendah. Penghuni terbesar dalam cairan rumen adalah bakteri
yaitu 1010-1012 sel/ml cairan rumen dan populasi terbesar kedua diduduki oleh
protozoa yang populasinya mencapai 105-106 sel/ml cairan rumen (Hungate, 1966).
2.6. Kecernaan In Vitro
In vitro adalah suatu kegiatan yang dilakukan di luar tubuh ternak dengan
mengikuti keadaan yang sesungguhnya pada ternak tersebut. Secara tidak langsung
kita dapat mengamati kegiatan yang terjadi di dalam rumen dengan cara in vitro
(Arora, 1989). Kondisi yang dapat dimodifikasi dalam hal ini antara lain penggunaan
larutan penyangga dan media nutrisi, tabung fermentasi, pengadukan dan fase gas,
suhu fermentasi, pH optimum, sumber inokulum, kondisi anaerob, periode waktu
fermentasi serta akhir proses fermentasi (Candra, 2013). Metode in vitro
dikembangkan untuk memperkirakan kecernaan dan tingkat degradasi rumen
25 ini biasa digunakan untuk evaluasi pakan, meneliti mekanisme fermentasi mikroba
dan untuk mempelajari aksi terhadap faktor antinurisi, aditif dan suplemen pakan
(Lopez, 2005).
Metode in vitro sering digunakan untuk mengetahui kecernaan hewan, pakan
dan hasil proses pencernaan dalam saluran pencernaan ternak. Teknik in vitro
memberikan hasil analisa yang cepat dalam proses yang murah dan jumlah yang
digunakan sangat sedikit (Tisserand, 1989). Kelebihan metode in vitro adalah hasil
penelitian dapat diperoleh dalam waktu singkat beberapa bahan makanan yang tidak
dapat diberikan secara tunggal pada hewan, kecernaannya dapat diteliti dengan
metode in vitro tidak diperlukan pengumpulan feses atau sisa makanan, sehingga
dapat menghemat waktu, tenaga dan biaya. Sedangkan kekurangannya adalah
menggunakan waktu standar, padahal waktu lamanya bahan makanan berada dalam
rumen bervariasi menurut jenis dan bentuk makanan, tidak terjadi penyerapan zat-zat
makanan seperti yang terjadi pada hewan hidup (Rusdi, 2000).
Metode in vitro yang digunakan pada penelitian ini merupakan metode
evaluasi nilai nutrisi pakan dengan melalui pengukuran kecernaan menggunakan
mikroorganisme rumen dari cairan rumen segar. Metode ini memakai dasar sistem
pencernaan dua tahap Tilley dan Terry (1963). Tahap pertama meliputi perlakuan
fermentasi bahan pakan termasuk hijauan dalam fermentasi in vitro menggunakan
mikroba cairan rumen yang merupakan sumber mikroba rumen dan larutan buffer
yang merupakan saliva buatan segar selama 48 jam pada kondisi anaerob. Pencernaan
tahap kedua adalah pencernaan hidrolisis komponen bahan kering oleh asam
26 mensimulasi pencernaan dalam rumen dan tahap kedua mensimulasi pencernaan yang
terjadi di dalam organ alat pencernaan pasca rumen. Nilai koefisien cerna yang
diperoleh dari teknik analisis in vitro tersebut mendekati hasil dengan sistem in vivo
(Tilley dan Terry, 1963).
Metode in vitro Tilley dan Terry (1963) yang dimodifikasi oleh Makkar
(2002) merupakan proses metabolisme nutrien pakan yang terjadi di dalam rumen dan
abomasum atau di luar tubuh ternak. Metode ini sering digunakan untuk menduga
kecernaan komponen bahan pakan dalam saluran pencernaan ternak. Teknik in vitro
ini memberikan hasil analisa yang cepat dan proses yang murah, serta dapat
digunakan untuk mengevaluasi bahan pakan dalam jumlah besar. Namun metode ini
sulit diterapkan pada material seperti sampel jaringan atau fraksi dinding sel (Makkar,
2002).
Inkubasi 48 jam digunakan untuk mengetahui konsentrasi produk akhir
fermentasi sebelum terjadi pencernaan hidrolitik oleh enzim pepsin. Keragaman hasil
fermentasi dapat terjadi akibat berbagai faktor termasuk kualitas cairan rumen yang
digunakan. Jumlah dan jenis mikroba dalam cairan rumen sangat bervariasi
tergantung kepada jenis dan pola pemberian pakan serta waktu pengambilan cairan
rumen setelah pemberian pakan. Dengan teknik yang sama kecernaan bahan organik
dapat ditentukan dengan mengukur kadar bahan organik bahan pakan dan residu
27
2.7. Analisis Kandungan Nutrisi Pakan
Analisis kandungan nutrisi atau bisa disebut analisis proksimat adalah
analisisis dengan hasil yang diperoleh hanya mendekati nilai yang sebenarnya, oleh
karena itu untuk menunjukkan nilai dari sistem analisis proksimat selalu dilengkapi
dengan istilah minimum atau maksimum sesuai dengan manfaat fraksi tersebut
(Kamal, 1998). Dari sistem analisis proksimat dapat diketahui adanya 5 macam fraksi
yaitu: 1). Air, 2). Abu, 3). Protein kasar, 4). Lemak kasar (ekstrak ether), 5). Serat
kasar dan 6). Khusus untuk BETN nilainya dicarihanya berdasarkan perhitungan
yaitu: 100% dikurangi jumlah dari kelima fraksi yang lain. Analisis ini didasarkan
atas komposisi susunan kimia dan kegunaannya (Tilman et al., 1998).
Air dalam analisis proksimat adalah semua cairan yang menguap pada
pemanasan dalam beberapa waktu pada suhu 105-110 ºC dengan tekanan udara bebas
hingga mempunyai bobot tetap. Penentuan kandungan kadar air dari suatu bahan
bertujuan untuk menentukan kadar bahan kering dari bahan tersebut (Kamal, 1998).
Setelah pemanasan tersebut sampel bahan pakan disebut sebagai sampel bahan kering
dan penggunaanya dengan sampel disebut kadar air (Tillman et al.,1998). Kadar air
dalam bahan pakan terdapat dalam bentuk air bebas, air terikat lemah dan air terikat
kuat. Faktor yang mempengaruhi kadar air yaitu pengeringan dan kandungan air dari
suatu bahan pakan (Sutardi, 2006).
Kadar abu adalah banyaknya sisa pembakaran sempurna dari suatu bahan.
Suatu bahan apabila dibakar sempurna pada suhu 500 – 600 ºC selama beberapa
waktu, semua senyawa organiknya akan terbakar menjadi CO2, H2O yang menguap.
28 (Fosfor), dan S (Belerang), oleh karena itu abu tidak dapat dan gas lain untuk
menunjukan adanya zat anorganik didalam pakan secara tepat baik secara kualitatif
maupun kuantitatif. Kadar abu dari pakan yang berasal dari hewan dan ikan dapat
digunakan sebagai indeks untuk kadar Ca (Kalsium) dan P (Fofsor), yang juga
merupakan tahap awal penentuan berbagai mineral yang lain (Kamal,1998).
Serat kasar merupakan residu dari bahan makanan atau hasil pertanian setelah
diperlakukan dengan asam atau alkali mendidih dan terdiri dari selulosa, dengan
sedikit lignin dan pentosa. Serat kasar juga merupakan kumpulan dari semua serat
yang tidak bisa dicerna, komponen dari serat kasar ini yaitu terdiri dari selulosa,
pentosa, lignin, dan komponen-komponen lainnya. Komponen dari serat kasar ini
serat ini tidak mempunyai nilai gizi akan tetapi serat ini sangat penting untuk proses
memudahkan dalam pencernaan didalam tubuh agar proses pencernaan tersebut
lancar (peristaltic) (Hermayati et al., 2006). Analisis kadar serat kasar adalah usaha
untuk mengetahui kadar serat kasar bahan baku pakan. Zat-zat yang tidak larut
selama pemasakan bisa diketahui karena terdiri dari serat kasar dan zat-zat mineral,
kemudian disaring, dikeringkan, ditimbang dan kemudian dipijarkan lalu didinginkan
dan ditimbang sekali lagi. Perbedaan berat yang dihasilkan dari penimbangan
menunjukkan berat serat kasar yang ada dalam makanan atau bahan baku pakan
(Murtidjo, 1987).
Protein kasar adalah nilai hasil bagi dari total nitrogen amonia dengan faktor
16% (16/100) atau hasil kali dari total nitrogen amonia dengan faktor 6,25 (100/16).
Nitrogen yang terdapat di dalam pakan tidak hanya berasal dari protein saja tetapi ada
29 (non–protein nitrogen/ NPN). Nilai yang diperoleh dari perhitungan diatas merupakan
nilai dari apa yang disebut protein kasar (Kamal,1998). Kadar protein suatu bahan
pakan secara umum dapat diperhitungkan dengan analisis kadar protein kasar.
Analisis kadar protein ini merupakan usaha untuk mengetahui kadar protein bahan
baku pakan. Analisis kadar protein digunakan untuk menguji kadar protein,
ditentukan kadar nitrogennya secara kimiawi kemudian angka yang diperoleh
dikalikan dengan faktor 6,25 = (100 : 16). Faktor tersebut digunakan sebab nitrogen
mewakili sekitar 16% dari protein (Murtidjo, 1987).
2.8. Volatile Fatty Acid (VFA)
Ransum yang diberikan kepada ternak ruminansia sebagian besar terdiri dari
karbohidrat. Di dalam rumen, polisakarida dihidrolisa menjadi monosakarida oleh
enzim-enzim mikroba rumen. Kemudian monosakarida tersebut, seperti glukosa,
difermentasi menjadi VFA (Volatile Fatty Acid) berupa asetat, propionat dan butirat,
serta gas-gas CH4 dan CO2. VFA yang terbentuk akan diserap melalui dinding rumen
dan gas CH4 serta CO2 akan hilang melalui eruktasi (McDonald et al., 2002). Proses
ini disebut juga glukoneogenesis yaitu diserapnya VFA ke dalam sistem peredaran
darah yang kemudian VFA diubah oleh hati menjadi gula darah. Gula darah inilah
yang akan mensuplai sebagian besar kebutuhan energi bagi ternak ruminansia
(Lehninger, 1982).
Menurut Arora (1995), peranan VFA sangat penting sebagai sumber energi
utama bagi ternak dan merupakan produk akhir fermentasi gula. Namun, selain itu
30 Nilai VFA sebagai sumber energi hanya berbeda sedikit, akan tetapi keefisienannya
sebagai kerangka karbon jauh berbeda (Sutardi et al., 1980). Konsentrasi VFA
tergantung pada jenis ransum yang dikonsumsi (McDonald et al., 2002), sedangkan
konsentrasi VFA yang dibutuhkan untuk pertumbuhan optimal mikroba rumen, yaitu
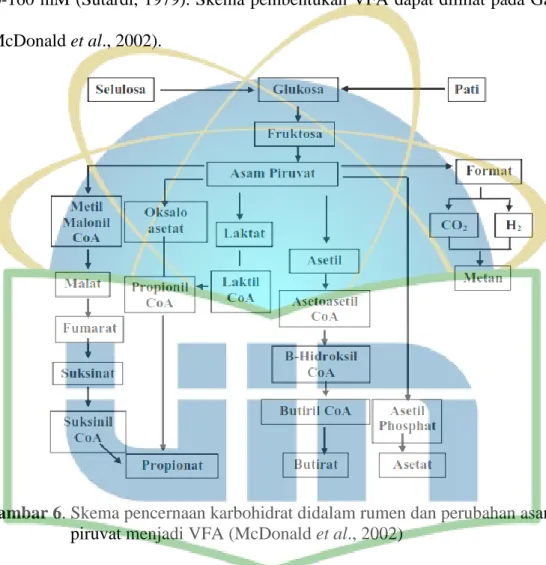
80-160 mM (Sutardi, 1979). Skema pembentukan VFA dapat dilihat pada Gambar 6
(McDonald et al., 2002).
Gambar 6. Skema pencernaan karbohidrat didalam rumen dan perubahan asam piruvat menjadi VFA (McDonald et al., 2002)
VFA dalam rumen yang dapat mendukung pertumbuhan mikroba berkisar
antara 70-150 mM (McDonald et al., 2002). Peningkatan produksi VFA dapat
mengindikasikan kemudahan suatu nutrien dalam pakan terutama karbohidrat dan
31 dapat digunakan sebagai tolak ukur fermentabilitas pakan yang berkaitan erat dengan
aktivitas dan populasi mikroba rumen (Hartati, 1998). Perubahan komposisi VFA
didalam rumen sangat berhubungan dengan bentuk fisik pakan, komposisi pakan,
tarafdan frekuensi pemberian pakan, serta pengolahan.
Konsentrasi VFA selain dipengaruhi oleh jenis ransum yang dikonsumsi
,dipengaruhi juga oleh jenis ternak ruminansia tersebut. Ulya (2007) memaparkan
bahwa konsentrasi VFA pada ternak sapi lebih kecil daripada ternak kerbau, kambing
dan domba. Hal ini disebabkan oleh mikroba ternak sapi kurang mampu
memfermentasi karbohidrat pada BBJP. Pradhan (1994) juga menyatakan bahwa
populasi bakteri total dalam cairan rumen sapi lebih rendah daripada kerbau sehingga
enzim yang dihasilkan mikroba pada cairan rumen kerbau lebih banyak dibandingkan
sapi. Enzim sangat berguna dalam memecah karbohidrat kompleks menjadi molekul
yang sederhana seperti VFA.
2.9. Amonia (NH3)
NH3 merupakan nitrogen yang paling banyak dibutuhkan mikroorganisme
rumen yang bersama dengan kerangka karbon dari sumber energi akan disintesa
menjadi protein mikroba. Hungate (1966), menjelaskan bahwa mikroorganisme
sangat penting untuk mengatur kecepatan tumbuh dan efisiensi penggunaan makanan
bagi ruminansia dan nutrisi mikroorganisme ini sangat penting untuk induk semang.
Faktor-faktor pembatas untuk pertumbuhan mikroba rumen adalah ketersediaan
ammonia, asam amino, sulfur dan mineral (Tamminga, 1982). Apabila nutrisi tidak
32 NH3 yang tidak digunakan oleh bakteri akan diserap oleh dinding rumen (Van Soest,
1982).
Kandungan protein ransum yang tinggi dan proteinnya mudah didegradasi akan
menghasilkan konsentrasi NH3 di dalam rumen (McDonald et al., 2002). Selain itu,
tingkat hidrolisis protein bergantung kepada daya larutnya yang akan mempengaruhi
kadar NH3. Pengukuran NH3 in vitro dapat digunakan untuk mengestimasi degradasi
protein dan penggunaanya oleh mikroba. Produksi amonia dipengaruhi oleh waktu
setelah makan dan umumnya produksi maksimum dicapai pada 2-4 jam setelah
pemberian pakan yang bergantung kepada sumber protein yang digunakan dan mudah
tidaknya protein tersebut didegradasi (Wohlt et al., 1976). Kadar NH3 yang
dibutuhkan untuk menunjang pertumbuhan mikroba rumen yang maksimal berkisar
antara 4-12 mM atau setara dengan 5,6-16,8 mg/100 ml (Sutardi, 1980).
NH3 merupakan sumber nitrogen utama dan penting untuk sintesis protein
mikroba (Sakinah, 2005). NH3 hasil fermentasi tidak semuanya disintesis menjadi
protein mikroba, sebagian akan diserap ke dalam darah. NH3 yang tidak terpakai
dalam rumen akan dibawa ke hati diubah menjadi urea, sebagian dikeluarkan melalui
urine dan yang lainnya dibawa ke kelenjar saliva. Proses metabolisme protein dan
pembentukan NH3 ditunjukkan pada Gambar 7. Untuk mencegah dampak yang buruk
dari pemenuhan nitrogen amonia asal urea, produksi NH3 di dalam rumen akan
diproduksi terus-menerus walaupun sudah terjadi akumulasi (Sutardi, 1977).
Konsentrasi amonia yang optimum untuk menunjang sintesis protein mikroba dalam
33
34
BAB III
METODE PENELITIAN
3.1. Tempat dan Waktu Pelaksanaan
Penelitian ini dilaksanakan di Laboratorium Nutrisi Ternak Bidang Pertanian
Pusat Aplikasi Isotop dan Radiasi, Badan Tenaga Nuklir Nasional (PAIR-BATAN),
yang beralamat di Jalan Lebak Bulus Raya No. 49, Jakarta Selatan, Indonesia.
Penelitian ini dilaksanakan pada Bulan Februari sampai April 2017.
3.2. Alat dan Bahan
3.2.1. Alat
Alat yang digunakan dalam penelitian ini adalah ember, rak penanaman,
paralon hidroponik untuk saluran pengairan, talang air untuk wadah benih sorgum
yang akan di tanam, plastik hitam besar, timbangan digital, pengaduk, timbangan
pakan, penggiling besar, timbangan analitik (Sartorius), termos, oven (Fisher),
erlenmeyer, gelas ukur, hot plate (Kika), labu takar, spatula, bulb, gegep, cawan petri,
cawan porselin, cawan masir, desikator, tabung centrifuge 100 ml dan rak tabung,
sumbat karet yang dilengkapi dengan klep gas (rubber policemen with slit),
thermometer, gelas silinder, labu penyaring, kain kasa, pipet volumetrik, pH meter,
stirrer, buret, inkubator (Polystat), waterbath, seperangkat alat destilasi TVFA
(Glascol), cawan conway, pompa vakum, sintered glass, buret, statif, tanur listrik
(Pyrolabo), High Speed Centrifuge (Vario), tabung gas CO2 dan Nitrogen Analyzer
35
3.2.2. Bahan
Bahan yang digunakan dalam penelitian ini adalah benih sorgum berbagai
varietas yaitu pahat, samurai 1 dan samurai 2 yang diperoleh dari Pusat Aplikasi
Isotop dan Radiasi (PAIR)-BATAN, pupuk cair mineral AB Mix dengan komposisi
pupuk A unsur hara makro (N, P, K, Ca, Mg, S) dan pupuk B unsur hara mikro (Fe,
Mn, Zn, B, Cu, Mo), 10% larutan pemutih (NaClO; Natrium Hipoklorit), larutan Acid
Detergent Solution (ADS) yang terdiri dari campuran (H2SO4 98%; Cetyl Trimethyl
Amonium Bromide (CTAB); Akuades), larutan Neutral Detergent Solution (NDS)
yang terdiri dari campuran (Akuades; natrium-lauryl sulfat; disodium ethylene
diaminetetraacetate (EDTA); Na2B4O7.10H2O; Na2HPO4, larutan pepsin HCl, HCl
0,1 N, petroleum ether, larutan Mc Dougall (larutan makromineral, mikromineral,
buffer, resazurin), cairan rumen dari kerbau fistula Pusat Aplikasi Isotop dan Radiasi
(PAIR)-BATAN, gas CO2, indikator pp, aquadest, rumput lapangan yang berasal dari
kawasan PAIR-BATAN dan vaselin.
3.3. Tahapan Penelitian
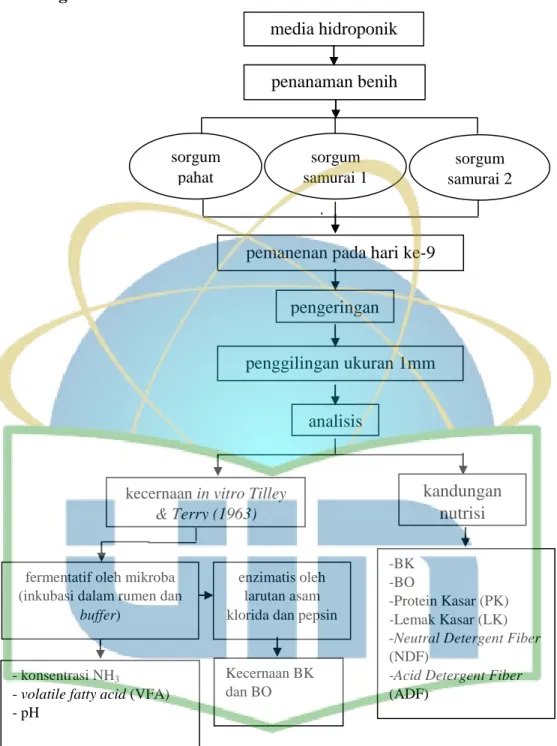
Penelitian ini meliputi beberapa tahapan yang dibagi menjadi tiga tahapan
besar, yaitu tahapan pertama merupakan tahap budidaya SHF meliputi tahap
pembuatan pupuk cair, penanaman, dan pemanenan. Tahap kedua adalah analisis
kandungan nutrisi meliputi analisis Bahan Kering (BK), Bahan Organik (BO), Protein
Kasar (PK), Ekstrak Eter (EE), Neutral Detergent Fiber (NDF) dan Acid Detergent
Fiber (ADF). Tahap terakhir adalah tahap analisis tingkat kecernaan SHF secara in
36 (KcBO) dan produk fermentasi rumen (NH3, pH dan VFA). Penelitian ini
menggunakan rancangan acak lengkap (RAL) 3 perlakuan dan 1 kontrol positif
dengan lima pengulangan. Data yang diperoleh dianalisis menggunakan analysis of
variance (ANOVA) pada IBM SPSS versi 20.0.
3.4. Prosedur Kerja
3.4.1. Pembuatan Larutan Pupuk Cair
Pupuk cair untuk hidroponik biasanya menggunakan pupuk hidroponik AB
Mix. Pembuatan larutan pupuk cair yaitu dengan mencampurkan larutan pupuk A:
larutan pupuk B 5 ml : 5 ml kedalam 1 l air.
3.4.2. Penanaman Sorghum Hydroponic Fodder (Nugroho, 2015)
Penanaman dilakukan pada biji sorgum Pahat, Samurai 1 dan Samurai 2 yang
sebelumnya direndam selama semalam di dalam air. Biji sorgum yang telah direndam
semalaman, kemudian direndam dalam larutan hipoklorit selama 20 menit lalu
dibilas. Biji sorgum lalu dipindahkan ke media hidroponik yaitu talang air yang
sebelumnya telah dialiri 10% larutan pemutih selama 15 menit untuk meminimalisir
tumbuhnya jamur pada biji sorgum, kemudian dibilas dengan air bersih dan
diangin-anginkan selama lebih kurang 10 menit untuk menghilangkan bau dari larutan
pemutih tersebut.
Penyebaran biji sorgum pada talang air disebar dengan kerapatan 0.36 g cm-2
dan ditutup dengan plastik hitam besar, kemudian dialiri larutan pupuk cair selama
dua menit setiap dua jam sekali. Lama penutupan dengan plastik hitam besar adalah 2
37 tumbuh kecambah. Selanjutnya penanaman dilakukan terbuka tanpa plastik sampai
waktu panen tiba yaitu hari ke 9.
3.4.3. Pemanenan Sorghum Hydroponic Fodder (Nugroho, 2015)
Pemanenan dilakukan pada umur 9 hari setelah penanaman. Pemanenan
dilakukan dengan memisahkan bagian tumbuhan (daun, batang, dan akar) dari
medianya kemudian ditimbang berat segarnya dan dianalisis BK dan BO (Nugroho,
2015). Hasil SHF umur panen 9 hari diangin-anginkan diudara terbuka selama dua
sampai tiga hari. Selanjutnya SHF dikeringkan pada oven bersuhu 60oC selama dua
hari dan digiling serta disaring pada ukuran 2 mm (Wahyono, 2015). SHF dengan
umur panen 9 siap digunakan untuk analisis kandungan nutrisi dan analisis kecernaan
secara in vitro.
3.4.4. Analisis Kandungan Nutrisi SHF
3.4.4.1. Analisis Bahan Kering dan Abu (AOAC, 2005)
Pada tahap pengukuran kadar air dan bahan kering, pertama-tama cawan
porselen dicuci dengan akuades. Lalu dikeringkan dalam oven pada suhu 105oC
selama 1 hari. Kemudian dimasukkan dalam desikator selama 30 menit dan
ditimbang (a). Cawan yang telah ditimbang kemudian ditambah sampel sorgum yang
berbeda varietas masing-masing sebanyak 1 gr (b). Masing-masing dilakukan
pengulangan sebanyak 5 kali. Selanjutnya dimasukkan dalam oven selama 1 hari
pada suhu 105oC. Lalu dimasukkan dalam desikator selama 30 menit dan ditimbang
(c). Kemudian masukkan ke dalam tanur selama 6 jam pada suhu 600oC, didiamkan
38 ditimbang (d). Selanjutnya dilakukan perhitungan Kadar Bahan Kering (BK), Kadar
Bahan Organik (BO), Kadar Air dan Kadar Abu dengan rumus sebagai berikut:
% Kadar BK = x 100%
% Kadar BO = x 100%
% Kadar Air = 100 - BK
% Kadar Abu = 100 – BO
Keterangan:
a = berat cawan kosong (gr)
b = berat cawan yang diisi dengan sampel (gr)
c = berat cawan berisi sampel yang sudah dikeringkan (gr) d = berat cawan berisi sampel yang sudah jadi abu (gr)
3.4.4.2. Analisis Protein Kasar (PK), Ekstrak Eter (EE), Neutral Detergent Fiber (NDF) dan Acid Detergent Fiber (ADF)
Protein Kasar ditentukan dengan menggunakan instrumen Nitrogen Analyzer.
Kras gas Helium dan Oksigen dibuka dan tombol Power PC dinyalakan. Software
pada PC dibuka dan pilihan Connection diklik lalu klik Autoconnect. Send Setting to
Analyzer dipilih untuk mengirim data agar sesuai dengan yang kita inginkan dengan
suhu combustion 1050˚C dan suhu reduction 600˚C lalu alat siap untuk analisis
dengan tanda berkedipnya lampu indikator. Menu view dipilih lalu Live Signal
Monitor dan Autozero Nitrogen diklik lalu tunggu sampai garis datar pada signal
39 lalu pilih New dan File Name. Jumlah sampel yang akan dianalisis dipilih dengan
memasukkan Berat Sampel, Position, dan Identification, serta Concentration TN
46,7% (urea) kemudian pilih OK.
Masing-masing sampel ditimbang (SHF Pahat, SHF Samurai 1 dan SHF
Samurai 2) 100 mg lalu ditempatkan ke crucible dan dimasukkan ke wadah
autosampler. Pilih analisis lalu klik New, File Name dimasukkan, dan simpan lalu
dipilih File Template yang sudah dibuat sebelumnya. Menu Start Analysis diklik.
Untuk mematikan instrumen, Setting dan Stand-by diklik. Dipilih Stand-by On dan
ditunggu hingga suhu Combustion 250˚C dan Reduction 30˚C. Saat Combustion
sudah tercapai suhu tersebut, pilih Exit. Tombol Power dimatikan dan PC dimatikan
serta tutup kran gas Oksigen dan Helium. Sampel melalui 2 tahapan, yaitu tahap
pembakaran dengan suhu tinggi 1000˚C dan tahap reduksi. Setelah itu, N2 diukur
dengan Thermal Conductivity Detection (TCD). Sinyal hasil pengukuran dari TCD
dapat dikonversikan ke total kandungan nitrogen atau dalam bentuk %.
Analisis ekstrak eter dilakukan dengan menimbang sampel 0,5 – 1 gram (X)
kemudian dibungkus dengan kertas saring bebas lemak. Kemudian sampel
dimasukkan ke dalam oven dengan suhu 105oC selama satu malam. Lalu bungkusan
sampel ditimbang tanpa didinginkan (Y). Setelah ditimbang, bungkusan dimasukkan
ke dalam sokhlet dan diekstraksi dengan menggunakan petroleum ether selama 8 jam.
Hasil sokhlet kemudian kembali di oven pada suhu 105oC selama semalam. Sampel
kembali ditimbang tanpa didinginkan (Z) (AOAC, 1990).