2. Tinjauan Pustaka
2.1 Korosi dan Inhibitor Korosi
Korosi dapat didefinisikan sebagai perusakan sifat-sifat penting dari suatu material yang disebabkan oleh interaksi kimiawi atau elektrokimia antara material tersebut dengan lingkungannya. Lingkungan yang menyebabkan logam mengalami korosi ada bermacam-macam, namun secara garis besar terdiri dari tiga bagian yaitu air (air tawar, air terdistilasi, air garam, dan air tambang), asam (asam klorida, asam sulfat, asam nitrat, dan beberapa asam organik seperti asam asetat dan asam formiat) dan gas (klor, amoniak, dan gas bahan bakar).
Hampir semua proses reaksi korosi berupa proses elektrokimia, dan melibatkan air baik dalam bentuk cairan maupun dalam bentuk fasa uapnya. Seperti hal nya proses elektrokimia yang lain, proses korosi juga melibatkan dua reaksi yaitu reaksi reduksi pada katoda dan reaksi oksidasi pada anoda. Secara umum reaksi elektrokimia tersebut dapat dituliskan sebagai berikut (Denny A. Jones, 1992):
a. Reaksi reduksi suatu logam (M) pada katoda: M → Mn+ +
ne-
b. Reaksi oksidasi pada anoda, reaksi ini ada beberapa macam yaitu: 1. O2 + 2H2O + 4e-→ 4OH- (reduksi gas oksigen)
2. O2 + 4H+ + 4e-→ 2H2O (reduksi ion hidrogen)
3. Jika reaksi-reaksi reduksi di atas tidak dijumpai, maka air akan tereduksi dengan persamaan reaksi 2H2O + 2e-→ H2 + 2OH-.
Di negara-negara industri yang sudah maju, masalah korosi ini telah mendapat perhatian yang serius sehingga banyak lembaga-lembaga yang dibentuk baik oleh pemerintah maupun swasta yang berupaya dengan sungguh-sungguh menangani permasalahan ini. Data terakhir menyebutkan bahwa di Amerika Serikat saja kerugian akiat korosi diperkirakan mencapai $276 miliar. Mengingat besarnya kerugian yang ditimbulkan oleh korosi, maka dilakukan upaya-upaya untuk menghambat proses korosi tersebut.
Upaya untuk menghambat proses korosi ada beberapa macam, diantaranya dengan pengecatan, proteksi katodik dan menggunaan inhibitor korosi. Mekanisme inhibisi korosi pada umumnya adalah proses adsorpsi inhibitor pada permukaan logam sehingga inhibitor memproteksi permukaan logam dengan cara membentuk film (lapisan tipis). Inhibitor biasanya didistribusikan ke permukaan logam dari larutan. Proses lambat dari inhibitor adalah sebagai berikut (Bundjali, 2005):
1. Meningkatkan polarisasi anodik dan katodik (Tafel slope) 2. Reduksi pergerakan atau difusi ion ke permukaan logam; dan 3. Meningkatkan resistansi listrik dari permukaan logam.
Senyawa-senyawa yang berpotensi untuk berperan sebagai inhibitor korosi biasanya mempunyai dua bagian yaitu bagian yang bersifat hidrofil dan bagian yang bersifat hidrofob. Bagian hidrofil biasanya mempunyai pasangan elektron bebas yang dapat berikatan koordinasi dengan permukaan logam yang bermuatan positif, sedangkan bagian hidrofobnya berperan untuk menghambat interaksi antara senyawa yang korosif dengan permukan logam. Dengan demikian diharapkan terjadinya pengurangan terhadap laju korosi logam.
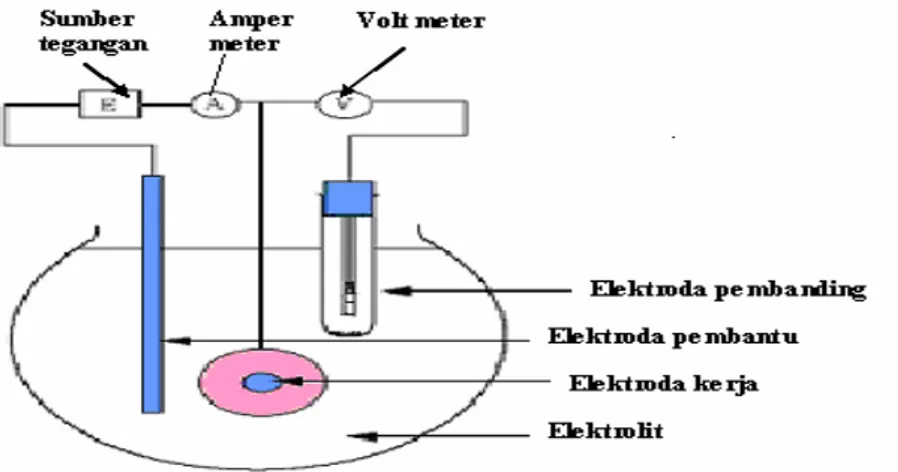
Laju korosi diukur dengan menggunakan alat VoltaLabs(R) dengan metode tahanan polarisasi atau dikenal dengan metode Tafel. Laju korosi ditentukan dengan mengukur besar arus anoda yang dihasilkan pada potensial korosi. Pada alat VoltaLabs(R) ini digunakan tiga buah elektroda, yaitu Fe sebagai elektroda kerja, Pt sebagai elektroda pembanding dan elektroda kalomel jenuh Hg/Hg2Cl2 sebagai elektroda pembantu Dasar yang digunakan pada metode
ini dituliskan dalam persamaan berikut (Brahma, 2005):
2,3( ) 2,3( )
exp
corexp
corap E E E E cor a c
dE
I
I
C
dt
β
β
− − −⎛
⎡
⎤ ⎡
⎤
⎞
⎛
⎞
=
⎜
⎜
⎢
⎥ ⎢
−
⎥
⎟
⎟
+
⎜
⎟
⎝
⎠
⎣
⎦ ⎣
⎦
⎝
⎠
dengan: Iapp = arus yang diberikan; Icor = arus korosi;
E = potensial yang diberikan; Ecor = potensial korosi; C = kapasitas antar muka;
adan c = koefisien Tafel anodik dan katodik;
dE/dt = laju perubahan waktu potensial yang diberikan (scan rate) yang secara ideal nilainya ~ 0.
Dari persamaan tersebut di atas, dapat diamati hubungan antara arus yang diberikan dengan potensial yang dihasilkan. Data yang didapat dari hasil pengukuran dapat dibuat grafik yang mengalurkan hambatan laju korosi (R) terhadap waktu (t). Sebelum terjadinya penambahan inhibitor maka tentu saja nilai hambatan akan rendah. Seiring dengan adanya penambahan inhibitor maka nilai R akan semakin besar. Besar kecilnya nilai R akan bergantung pada daya adsorpsi dari inhibitor pada material logamnya. Nilai hambatan kemudian akan mencapai nilai konstan dimana hambatan laju korosinya mencapai nilai maksimum. Gambar alat VoltaLab® adalah sebagai berikut:
Gambar 2.1 Skema alat VoltaLab
2.2 Senyawa-senyawa Organik
2.2.1 Asam Amino
Asam α-amino merupakan polimer dari protein. Secara umum terdapat tiga bagian utama dalam struktur molekul asam α-amino yaitu gugus karboksilat, amino dan rantai samping. Gugus amino terikat pada karbon α yaitu karbon yang paling dekat dengan gugus karboksil. Oleh karena itulah asam ini disebut dengan asam α-amino. Selain gugus amino, pada karbon α juga terikat sebuah atom hidrogen dan sebuah rantai samping. Satu asam α-amino dibedakan dari asam amino lain berdasarkan rantai sampingnya (R).
Gambar struktur umum dari asam α-amino adalah sebagai berikut:
+
H3N CH C
R
O -O
Asam amino termasuk ke dalam asam karboksilat yaitu suatu asam lemah. Nilai pKa dari gugus karboksil dan amino secara berturut-turut berada pada kisaran 2 dan 10. Oleh karena itu, pada pH netral gugus karboksilat pada asam amino akan kehilangan proton, sedangkan gugus amino akan mendapatkan satu proton tambahan menghasilkan suatu zwitter ion (suatu senyawa yang mengandung gugus fungsi bermuatan positif dan negatif secara sekaligus sehingga bisa bereaksi baik dengan asam maupun basa). Biasanya struktur asam amino dituliskan dengan bentuk zwitter ion ini (Matthews et al).
Asam amino tidak selalu barsifat seperti senyawa-senyawa organik. Misalnya, titik lelehnya di atas 2000C, sedangkan sebagian besar senyawa organik dengan bobot molekul yang mirip berupa cairan pada temperatur kamar. Asam amino larut dalam air dan pelarut polar lainnya, tetapi tidak larut dalam pelarut non polar seperti dietil eter atau benzena. Asam amino mempunyai momen dipol yang besar, kurang bersifat asam dibandingkan dengan sebagian besar asam karboksilat dan kurang basa dibandingkan dengan sebagian besar amina (Fessenden, 1986)
Asam amino mempunyai sifat yang tidak biasa seperti ini karena asam amino mengandung suatu gugus amino yang bersifat basa dan gugus karboksil yang bersifat asam di dalam molekul yang sama. Suatu asam amino mengalami reaksi asam-basa internal yang menghasilkan suatu ion di polar yang disebut juga dengan zwitter ion (lihat Gambar 2.2). Pada kenyataannya tidak semua asam amino bersifat netral. Dalam hal ini rantai samping suatu asam amino memegang peranan yang cukup penting apakah suatu asam amino bersifat asam, basa atau netral. Sebagian besar asam amino bersifat asam, karena keasaman gugus -NH3+ lebih kuat daripada kebasaan gugus –CO2-. Akibat perbedaan dalam keasaman dan
kebasaan ini adalah bahwa asam amino lebih banyak berada dalam bentuk anionnya daripada dalam bentuk kationnya.
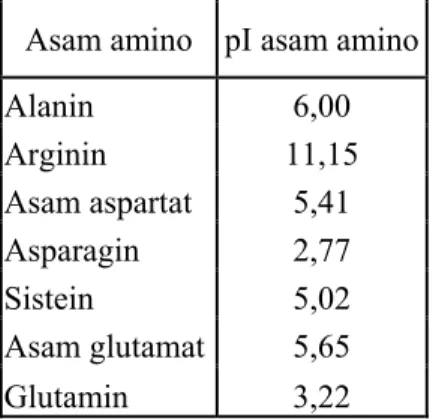
pH suatu asam amino yang tidak mengemban muatan ion netto disebut dengan titik isoelektrik dari asam amino tersebut (pI). Berikut pI dari asam amino:
Tabel 2.1 Nilai pI dari asam amino
Asam amino pI asam amino
Alanin 6,00 Arginin 11,15 Asam aspartat 5,41 Asparagin 2,77 Sistein 5,02 Asam glutamat 5,65 Glutamin 3,22
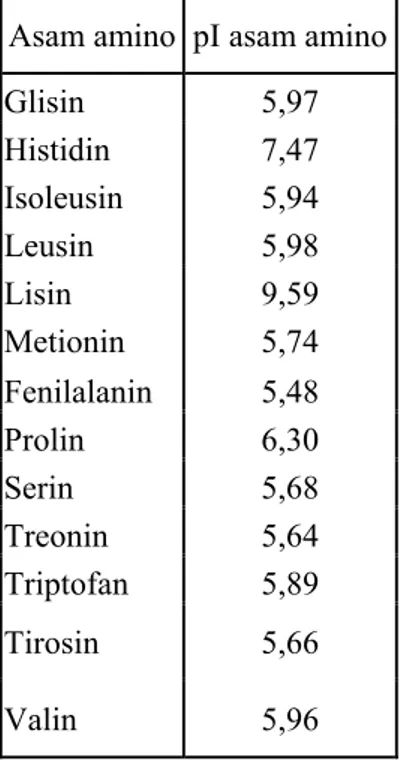
Tabel 2.1 lanjutan
Asam amino pI asam amino
Glisin 5,97 Histidin 7,47 Isoleusin 5,94 Leusin 5,98 Lisin 9,59 Metionin 5,74 Fenilalanin 5,48 Prolin 6,30 Serin 5,68 Treonin 5,64 Triptofan 5,89 Tirosin 5,66 Valin 5,96
Di alam terdapat 20 jenis asam amino. Asam amino merupakan salah satu jenis senyawa yang diduga mempunyai aktifitas inhibisi korosi karena beberapa diantaranya mempunyai pasangan elektron bebas sehingga bisa teradsorpsi pada permukaan logam dan membentuk ikatan koordinasi dengannya. Ada 6 asam amino yang diuji aktifitas inhibisi korosinya dalam penelitian ini. Keenam asam amino tersebut yaitu glisin, alanin, fenilalanin, histidin, asam aspartat dan tirosi. Berikut adalah struktur molekul keenam asam amino tersebut:
H2N CH C CH3 OH O Alanin H2N CH C H OH O Glisin H2N CH C CH2 OH O C OH O Asam Aspartat H2N CH C CH2 OH O N NH Histidin H2N CH C CH2 OH O Fenilalanin H2N CH C CH2 OH O OH Tirosin
2.2.2 Ester
Ester merupakan kelompok senyawa organik yang mengandung gugus –CO2R dengan R
dapat berbentuk alkil atau aril. Suatu ester dapat dibentuk dengan reaksi langsung antara suatau asam karboksilat dan suatu alkohol, yang dikenal sebagai reaksi esterifikasi. Esterifikasi berkataliskan asam dan merupakan reaksi yang reversibel. (Fessenden, 1982)
O C OH R
+
R'OH
H
+, kalor
O C OR' R+
H
2O
Suatu asam
karboksilat
Suatu
alkohol
Suatu ester
Laju esterifikasi suatu asam karboksilat bergantung terutama pada halangan sterik dalam alkohol dan asam karboksilatnya. Kuat asam dari asam karboksilat hanya memainkan peranan kecil dalam laju pembentukkan ester.
Salah satu mekanisme lain yang dapat digunakan untuk mensintesis ester adalah dengan membentuk suatu asil halida terlebih dahulu. Salah satu contohnya adalah dengan membentuk asil klorida sebagai berikut. (Solomon, 1976)
O C OH R O C OR' R Suatu asam karboksilat Suatu ester SOCl2 R C Cl O
Suatu asil klorida
R'OH, basa (-HCl)
Kereaktivan alkohol terhadap esterifikasi:
Kereaktivan asam karboksilat terhadap esterifikasi:
CH
3CO
2H
R
3CCO
2H
R
2CHCO
2H
RCH
2CO
2H
HCO
2H
bertambahnya kereaktivan
Reaksi-reaksi ester : Senyawa ester merupakan senyawa yang bersifat polar, senyawa ini apabila dalam keadaan murni tidak dapat membentuk ikatan hidrogen antar molekul ester, akan tetapi atom oksigen yang ada pada gugus karbonilnya dapat membentuk ikatan hidrogen dengan molekul lain yang mengandung atom hidrogen yang bersifat parsial positif,
ROH tersier
ROH sekunder
ROH primer
CH
3OH
bertambahnya kereaktivan
seperti molekul air. Akibatnya, ester memiliki titik didih yang lebih rendah apabila dibandingkan dengan asam karboksilat dan alkohol, yang mana kedua kelompok senyawa ini mampu membentuk ikatan hidrogen antar molekul.
Berbeda dengan kelompok senyawa asam karboksilat yang memiliki berat molekul rendah, dalam struktur ester umumnya memiliki aroma bau yang sedap. (Solomon, 1976)
a. Reaksi dengan ammonia. Ester bereaksi dengan ammonia berair menghasilkan amida. O C OCH2CH3 ClH2C
+
0
o+
CH
3CH
2OH
etil kloroasetat
kloroasetamida (80%)
NH
31 jam
O
C NH2
ClH2C
b. Reduksi. Ester dapat direduksi oleh hidrogenasi katalitik, suatu reaksi yang kadang-kadang disebut hidrogenolisis ester, atau oleh litium aluminium hidrida. Suatu teknik yang lebih tua ialah reaksi antara ester dan logam natrium dalam etanol. Apapun zat pereduksinya, dihasilkan sepasang alkohol (sekurangnya satu adalah alkohol primer) dari reduksi suatu ester.
O
C OR'
R
[H]
RCH
2OH + HOR'
c. Reaksi dengan reagensia Grignard. Reaksi ester dengan reagensia Grignard merupakan teknik yang sangat bagus untuk membuat alkohol tersier dengan dua gugus R yang identik. (Fessenden 1982).
O C OR' R (1) 2 R''MgX (2) H2O, H+ C OH R'' R'' R
dua gugus R''
yang sama
2.2.3 Aldehida
Aldehida merupakan kelompok senyawa karbonil yang memiliki sekurang-kurangnya satu buah atom hidrogen yang terikat pada karbon karbonil. Secara umum kelompok senyawa aldehida memiliki kerangka dasar RCHO dengan R yang dapat berupa alkil, aril atau H. Sintesis senyawa aldehida dapat dilakukan dengan beberapa cara (Solomon, 1976), yaitu:
1. Oksidasi alkohol primer
R-CH2OH [O] R C O
H
2. Reduksi asil klorida
R C O Cl + AlH[OC(CH3)3]2, H2O R C O H 3. Reduksi ester
R
C O HR
C O OR'+ AlH(
i
-Bu)
2,H
2O
4. Reduksi nitrilR
C NR
C O HAlH(
i
-Bu)
2,H
2O
Aldehida merupakan suatu molekul yang polar sehingga melakukan tarik menarik dipol-dipol antar molekul. Aldehida mendidih pada temperatur yang lebih tinggi daripada senyawa non polar yang berbobot molekul yang sama.
Aldehida mempunyai pasangan elektron bebas pada atom oksigen sehingga dapat mengadakan ikatan hidrogen (tetapi tidak dengan senyawa karbonil lain, kecuali jika senyawa itu mempunyai hidrogen asam untuk ikatan hidrogen). Akibat adanya kemampuan untuk melakukan ikatan hidrogen, aldehida dengan berat molekul yang rendah dapat larut dalam pelarut polar. Akan tetapi, karena tidak dapat membentuk ikatan hidrogen intra molekuler maka titik didihnya menjadi lebih rendah jika dibandingkan dengan alkohol padanannya. O C R H H O H
Aldehida dapat dibedakan dari senyawa-senyawa non karbonil dengan mereaksikannya terhadap senyawa turunan amonia. Semikarbazida, 2,4-dinitrofenilhidrazin dan hidroksilamin bereaksi dengan aldehida membentuk suatu endapan. Semikarbazon dan oksim biasanya tidak berwarna, sedangkan 2,4-dinitrofenilhidrazin dan hidroksilamin berwarna oranye. Identifikasi aldehida pun dapat dilakukan dengan titik leleh.
Cara identifikasi yang lain adalah dengan melakukan tes menggunakan reagen Tollens. Reagen ini mengandung ion diaminoperak(I), Ag(NH3)2+. Meskipun ion ini merupakan
oksidator yang sangat lemah namun mampu mengoksidasi aldehida menjadi ion karboksilat, sementara perak tereduksi dari ion Ag+ pada Ag(NH
3)2+ menjadi logam perak. Metode ini
dikenal dengan istilah metode cermin perak. Reaksinya adalah sebagai berikut:
R C O H Ag(NH3)2+ H2O R C O O- + Ag(s)
Aldehida
Cermin perak
2.3 Reduktor
Dalam sintesis organik, reaksi reduksi memiliki peranan yang cukup penting. Banyak molekul-molekul organik yang dapat direduksi dengan berbagai reduktor dan metode reduksi yang telah kita kenal dengan baik. Diantara senyawa-senyawa dan metode reduksi yang umum dilakukan adalah dengan menggunakan LiAlH4, NaBH4, hidrogenasi katalitik, serta
penggunaan reduktor baik logam dan non logam lainnya.
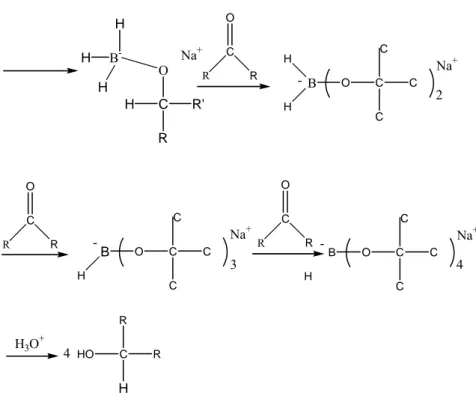
Pada penelitian ini, reduktor yang dipergunakan adalah NaBH4 dalam I2/THF. Natrium
borohidrida NaBH4 ditemukan oleh Schlesinger dan Brown pada tahun 1943. NaBH4
merupakan suatu reagen yang sangat selektif, mampu mereduksi aldehida, keton dan imin (Michael B. Smith, 1994). Contoh mekanisme reaksi reduksi dengan menggunakan NaBH4
adalah sebagai berikut:
B H H H H Na O C R R' B H H H O C R' R H Na+
B -H H H O C R' R H Na+ R C R O B H H O C C C C Na+ R C R O B H O C C C C Na+ 2 3 -R C R O B H O C C C C Na+ -4 H3O+ 4 HO C R R H
Gambar 2.4 Gambar mekanisme reaksi reduksi menggunkan NaBH4
2.4 Spektroskopi Infra Merah
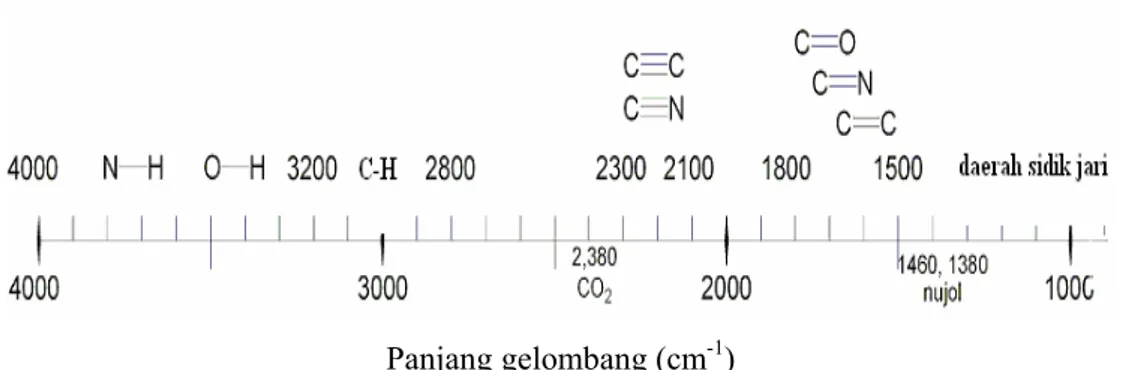
Spektrum inframerah (IR) merupakan bagian dari spektrum elektromagnetik yang terletak diantara spektrum cahaya tampak dan spektrum gelombag mikro (microawave). Inframerah merupakan suatu teknik pengukuran spektrum absorpsi molekul yang didasarkan pada transisi vibrasi gugus fungsi pada molekul tersebut. Radiasi yang berada pada batasan bilangan gelombang antara 10.000 cm-1 – 100 cm-1 ditangkap oleh suatu molekul organik lalu dikonversi menjadi energi vibrasi molekul. Absorpsi ini terkuantisasi tetapi spektrum vibrasinya akan muncul sebagai pita bukan sebagai garis karena setiap perubahan energi vibrasi selalu diikuti dengan perubahan energi rotasi molekul. Frekuensi atau panjang gelombang dari absorpsi tergantung dari massa relatif dan geometri dari atom itu sendiri. Absorpsi terkuantisasi dilakukan pada daerah inframerah yaitu pada panjang gelombang (λ) 750–2500 nm atau dinyatakan dengan nilai bilangan gelombang (υ) yang mempunyai hubungan dengan λ adalah υ = 1/ λ, dimana υ = bilangan gelombang dinyatakan dengan satuan cm-1, λ = panjang gelombang dinyatakan dengan satuan cm (Silverstein, hal 71-73)
Pada spektrum inframerah, daerah dengan bilangan belombang 4000 – 1300 cm-1 disebut
dengan daerah gugus fungsional. Dalam daerah ini gugus-gugus fungsional yang penting seperti –OH, -NH, -C=CH, -CN, dan C=O menunjukkan puncak yang khas, dan letak puncak tersebut tidak berubah karena bentuk atau ukuran molekulnya. Daerah 1300 – 400 cm-1 yang disebut sebagai daerah sidik jari(finger print region) adalah amat kompleks, tetapi spektrum daerah ini sangat berharga bila kita menggunakan ini dan disesuaikan dengan daerah lain (Wiwin, 2006).
Intensitas pita absorpsi dapat dinyatakan baik dengan transmitan (T) maupun absorbans (A). Transmitan merupakan perbandingan kekuatan radiasi yang ditransmisikan terhadap kekuatan radiasi pada sampel tersebut. Absorbans merupakan bentuk logaritma dari transmitan dengan hubungan sebagai berikut:
A = log (1/T)
Vibrasi molekul (v) terdiri dari dua jenis yaitu regangan/stretching dan belokan/bending. Vibrasi regangan merupakan pergerakan sepanjang sumbu molekul sehingga jarak antara atom dalam senyawa tersebut bertambah atau berkurang. Vibrasi belokan (δ) berkaitan dengan perubahan sudut ikatan. Vibrasi belokan terdiri dari vibrasi dengan gerakan puntiran (twisting), ayunan (rocking) dan pilinan. Penting untuk diperhatikan bahwa hanya vibrasi yang menghasilkan perubahan momen dipol yang dapat diamati oleh IR. Senyawa atau gugus yang bervibrasi tetapi vibrasinya tidak menghasilkan momen dipol disebut dengan senyawa atau gugus aktif raman dan biasanya digunakan untuk analisis kuantitatif dengan metode hamburan.
Sebuah molekul dengan n atom mempunyai derajat kebebasan sebanyak 3n. Untuk molekul yang nonlinier 3 derajat kebebasan menggambarkan rotasi molekul, sedangkan 3 derajat kebebasan yang lain menggambarkan translasi. Oleh karena itu derajat kebebasan vibrasi molekul nonlinier adalah 3n-6. Untuk molekul yang linier derajat kebebasan vibrasinya berjumlah 3n-5 karena untuk molekuk linier hanya diperlukan 2 derajat kebebasan untuk menggambarkan rotasi molekul.
Spektrum infra merah dapat digunakan untuk mengkarakterisasi gas, cairan maupun padatan. Pada penelitian ini, sampel yang digunakan merupakan sampel padatan. Sampel digerus bersama-sama dengan KBr sampai benar-benar tercampur dengan baik lalu dijadikan sebuah film yang tipis. Kualitas spektrum akan bergantung pada homogenitas campuran sampel-KBr dan reduksi partikel tersuspensi.
Panjang gelombang (cm-1)
Gambar 2.5 Gambaran umum posisi absorpsi gelombang inframerah beberapa gugus fungsi (http://en.wikipedia.org/wiki/Infrared_spectroscopy)