Akta Kimindo Vol. 3 No. 1 Oktober 2007: 11 - 16 AKTA KIMIA
INDONESIA
Karakterisasi Adenosin Kinase Dari Plasenta
Surya Rosa Putra1,*1Laboratorium Biokimia,
Jurusan Kimia, Institut Teknologi Sepuluh Nopember, Kampus ITS Keputih, Surabaya 60111
ABSTRAK
Enzim adenosin kinase yang diisolasi dari plasenta manusia adalah katalis yang membantu proses fosforilasi adenosin, atau turunan adenosin, dengan gugus fosforil dari ATP. Pada penelitian ini, adenosin kinase yang diperoleh memiliki aktifitas optimum pada pH 6.5 dan rasio konsentrasi ATP/Mg+2 0.5. Harga parameter kinetika, Km, untuk substrat-substrat, adenosin dan MgATP, masing-masing adalah 0.4 dan 75 μM. Pada konsentrasi yang tinggi, kedua substrat ini bertindak juga sebagai inhibitor internal (> 2.5 μM). Dua turunan adenosin, N-6-cyclohexiladenosine (CHA) and N-6-phenylisoprophyladenosine (L-PIA) menghambat aktifitas adenosin kinase dengan kuat. Dua hasil reaksi katalisis, AMP dan ADP, juga dapat menghambat aktifitas enzim dengan mempengaruhi konformasi sisi katalitik adenosin dan/atau MgATP. Kata kunci : biomassa bulu ayam, adsorben, metilen biru.
ABSTRACT
Adenosin kinase isolated from human placental is an enzyme that catalyze phosphorylation of adenosine by using phosphoryl group of ATP. This enzyme showed optimum activity at pH 6.5 and the ratio ATP/Mg+2 of 0.5. Km values for its substrates, adenosine and MgATP are 0.4 and 75 M respectively. Both adenosine and MgATP can act as internal inhibitors at high concentration (> 2.5 M). N-6-cyclohexiladenosine (CHA) and N-6-phenylisoprophyladenosine (L-PIA) are adenosine analogues that inhibit strongly adenosine kinase activity. Two catalytic products, AMP and ADP can also inhibit adenosine kinase activity by influencing the conformation of adenosine and/or MgATP catalytic sites.
Keyword : chicken feather biomass, adsorbent, methylene blue. PENDAHULUAN
Adenosin kinase adalah enzim yang mengkatalisis reaksi fosforilasi alkohol primer pada C-5’ adenosin, atau turunan adenosin seperti deoksiadenosin, dengan gugus γ-fosforil dari ATP (atau GTP). Keberadaannya terdistribusi luas dalam organisme hidup. Khusus dalam tubuh manusia, enzim ini ditemukan pada jaringan hati, plasenta dan otak (Palella dkk., 1980).
Enzim ini sangat krusial dalam pengaturan metabolisme purin, dalam replikasi DNA, dalam sintesis protein dan dalam pengaturan respon selular. Defisiensi atau hambatan terhadap adenosin kinase akan mengakibatkan akumulasi adenosin, atau turunan adenosin, dan kekurangan adenosin fosfat. Akumulasi adenosin yang sangat toksik akan menghambat beberapa aktifitas biologis seperti sistem kekebalan tubuh,
transmisi sinyal pada jaringan sel syaraf dan ketidaknormalan aktifitas otot jantung. Sementara, kekurangan adenosin fosfat akan menghambat respon selular, terhentinya metabolisme selular, dan terhentinya proses pergantian sel.
Akhir-akhir ini adenosin kinase dikaitkan dengan kemampuannya dalam menghambat proses perkembanganbiakan virus dan bakteri. Virus yang dimaksudkan adalah HIV (Human Immunodeficience Virus). Mekanisme penghambatan yang disarankan berhubungan dengan tahapan krusial pada perbanyakan virus HIV : transkripsi terbalik (reverse transcription) RNA virus menjadi DNA (Clercq dkk., 1992). Proses ini memerlukan deoksiadenosin fosfat dalam jumlah banyak. Adenosin kinase diduga sangat berperan dalam menjamin ketersediaan senyawa ini. Caranya adalah dengan mengkatalisis fosforilasi deoksiadenosin yang didatangkan dari luar sel terinfeksi. * Corresponding author : Phone : + 62 31-5943353;
Deoksiadenosin fosfat sendiri tidak mungkin melintasi membran karena sifatnya yang cukup polar. Senyawa turunan adenosin, atau deoksiadenosin dapat dijadikan sebagai substrat alternatif substrat adenosin kinase (Baba dkk., 1988). Senyawa-senyawa ini akan memberikan turunan adenosin, atau deoksiadenosin, fosfat yang tidak dapat dimanfaatkan untuk polimerisasi DNA dalam proses transkripsi terbalik. Akibatnya, proses perbanyakan virus akan terhenti (Jhonson
et al, 1988)
Peran adenosin kinase dalam menghambat perkembangan bakteri diujikan terhadap
Mycobacterium tuberculosis, bakteri yang
bertanggungjawab pada turberkulosis (TBC) (Long
et al, 2006). Sama seperti pada penghambatan
virus, disini juga digunakan senyawa turunan adenosin, 3-deaza-adenosin, yang bertindak sebagai substrat alternatif bagi adenosin kinase. Produk fosforilasi, 3-deaza-adenosin fosfat, akan menghambat proses transkripsi DNA menjadi RNA dalam sintesis protein bakteri.
Mengingat perannya yang begitu besar, karakteristik adenosin kinase yang lebih rinci sangat diperlukan sebelum ditemukan cara-cara mengendalikannya. Penelitian ini dimaksudkan untuk mengungkap karakter adenosin kinase yang diisolasi dari plasenta bayi dari sisi kinetika. Hasil penelitian ini diharapkan dapat dijadikan acuan untuk mendisain aktifator yang cocok untuk adenosin kinase.
Prosedur Kerja
Isolasi dan pemurnian adenosin kinase
Sebanyak 500 g plasenta manusia dihomogenisasi dalam 500 ml larutan penyangga Hepes (Hepes/KOH 10 mM, pH = 6; MgCl2 1 mM; dithiotritol 0.1 mM; PhMeSO2F 0.1 mM; NaNO3 1.5 mM). Homogenat yang terbentuk diendapkan dengan sentrifugasi pada 11000 g selama 20 menit. Supernatan diasamkan dengan asam asetat glasial sampai pH = 5.2, sedangkan endapannya dibuang.
Protein yang terdapat dalam supernatan diendapkan dengan ammonium sulfat 50 % jenuh pada temperatur 4 oC. Endapan yang terjadi dipisahkan dengan sentrifugasi pada 12000 g selama 30 menit, lalu dibuang. Protein sisa yang terdapat dalam supernatan diendapkan kembali dengan ammonium sulfat 70 % jenuh pada temperatur 4 oC. Endapan protein yang terjadi kembali dipisahkan dengan sentrifugasi pada 12000 g selama 30 menit.
Enzim yang terdapat pada endapan dilarutkan dalam larutan penyangga Hepes tanpa PhMeSO2F 0.1 mM. Pada bagian lain, kolom khromatografi afinitas 5’-AMP-sepharosa distabilkan dengan NaOAc 10 mM pH = 6. Selanjutnya campuran enzim adenosin kinase diikatkan pada kolom dan dielusi pertama kali dengan 200 ml NaOAc pada laju alir 90 ml/jam.
Campuran protein non-adenosin kinase dielusi berturut-turut dengan 50 ml campuran NaOAc 10 mM dan KCl 1 M pH 6, lalu dengan campuran 50 ml Tris-HCl 10 mM, KCl 1 M, dan ATP 5 mM pH 7.4. Adenosin kinase yang terikat dalam kolom dielusi dengan larutan Tris-HCl 0.1 M, ATP mM:Mg2+ dan adenosin 5 mM.
Adenosin kinase yang diperoleh kemudian dipisahkan lebih lanjut dengan filtrasi gel G-75 (2 x 70 cm) yang disetimbangkan dengan Tris-HCl 0.1 mM, ATP:Mg+2 1.6 mM. Laju alir kolom adalah 4 ml/jam. Protein standar yang digunakan dalam penentuan Berat Molekul adalah Bovine Serum Albumin (BSA), ovalbumin, cytochrom-c, chymotrypsinogen A, dengan konsentrasi masing-masing adalah 5 mg/ml. Fraksi protein diamati pada 280 nm atau 410 untuk cytochro-c. Volume yang tidak terpakai diukur dengan dextran-biru pada 280 nm, sedangkan volume total kolom ditentukan dengan absorbansi dinitrofenilalanin pada 360 nm. Enzim yang diperoleh disimpan pada temperatur -80 oC.
Penentuan aktifitas adenosin kinase
Aktifitas adenosin kinase ditentukan dengan melihat reaksi pembentukan adenin nukleotida dari [8-14C]adenosin 0.25 mM yang berlangsung selama 40 menit pada 37 oC dalam 0.1 ml media yang mengandung ATP: MgCl2 0.8 mM, NaOAc 2.5 mM pH 5.5. Enzim yang digunakan < 0.2 mg/ml. Reaksi dihentikan dengan pemanasan pada 85 oC selama 2 menit. Duapuluh mikroliter dari campuran reaksi diteteskan pada cakram DEAE-selulosa, kemudian dicuci 5 menit dalam ammonium format 1 mM untuk menghilangkan sisa adenosin. Cakram kemudian dikeringkan dan dihitung cacahan radioaktifnya. Aktifitas adenosin kinase dihitung dari perbandingan cacahan yang diperoleh dengan cacahan adenosin awal.
Kinetika inhibisi
Aktifitas adenosin kinase dihambat dengan 6 adenosin analog, masing-masing NECA
(5’-N-etilkarboksiamidoadenosin), MTA (metilthioadenosin), CHA (sikloheksiladenosin),
L-PIA (fenilisopropiladenosin), CIAdo (khloroadenosin), dan 6-MMPR
(6-metilmerkaptopurin ribosida). Disamping itu, aktifitas enzim juga dihambat dengan MgATP-2. Inhibisi dilakukan pada konsentrasi adenosin dan inhibitor < 5 M.
HASIL DAN PEMBAHASAN Purifikasi adenosin kinase
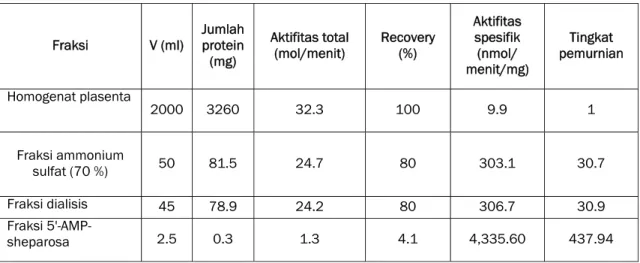
Tabel 1 memperlihatkan perubahan aktifitas total dan aktifitas spesifik selama proses pemurnian. Dengan menganggap adenosin kinase pada ekstrak plasenta sebagai kontrol, terlihat bahwa pemurnian dengan ammonium sulfat (70 %) memberikan peningkatan aktifitas sebesar
spesifik, atau kemurnian, sebesar 30.7 kali. Pemurnian ini menghilangkan sekitar 20 & protein total. Peningkatan yang sama diberikan oleh fraksi dialisis. Namun, jumlah protein yang diperoleh relatif tidak berubah dari hasil pemurnian ammonium sulfat.
Pemurnian dengan kolom 5’-AMP-sepharosa menghasilkan peningkatan aktifitas spesifik sebesar 438 kali. Artinya, tingkat kemurnian enzim juga meningkat sebesar nilai yang sama. Meskipun demikian, proses ini sekaligus menunjukkan bahwa sebagian besar homogenat plasenta dan fraksi protein ammonium sulfat hanya mengandung sekitar 4 % adenosin kinase.
Adenosin kinase, sebelumnya, telah dimurnikan dari berbagai tissue, termasuk dari ragi roti (38). Aktifitas dan tingkat kemurnian yang diperoleh sangat beraneka ragam karena sangat tergantung pada sumber enzim serta metoda yang digunakan. Namun sejauh yang menyangkut adenosin kinase dari plasenta manusia, hasil eksperimen ini memberikan aktifitas dan tingkat kemurnian lebih baik. Satu hal yang belum dapat dibandingkan adalah kestabilan adenosin kinase. Faktor ini perlu diteliti lebih lanjut dengan rangkaian eksperimen yang lain.
Penentuan berat molekul adenosin kinase
Berat molekul protein dapat ditentukan dengan berbagai cara. Eksperimen ini menggunakan metoda gel filtrasi yang memakai matriks Sephadex G-75. Berat molekul ditentukan dengan dengan mengukur perbandingan antara volume elusi (Ve) dengan volume total cairan yang tidak terpakai oleh matriks (Vo) dari adenosin kinase. Hasil perbandingan ini diekstrapolasikan pada kurva standar antara Ve/Vo dan berat molekul berbagai standar (BSA (75 kDa), cytochrom c (11 kDa), chymotrypsin (22 kDa) dan ovalbumin (42 kDa) yang berbentuk garis lurus, dengan lereng positif. Dari sini diketahui bahwa adenosin kinase memiliki berat molekul sekitar 43 kDa.
Berat molekul adenosin kinase yang diperoleh hampir sama dengan berat molekul adenosin kinase plasenta manusia yang diukur dengan SDS-page (Andres dan Fox, 1979), adenosin kinase tikus (de Jong dkk., 1977), adenosin kinase ragi (Leibach dkk., 1971) dan adenosin kinase dari eritrosit tikus (Schmidt dkk., 1974). Namun, berat molekul ini lebih besar dari
berat molekul adenosin kinase hati kelinci yang hanya 23 kDa (Lindberg dkk., 1967).
Karakter kinetika adenosin kinase
Karakter kinetika berhubungan dengan laju maksimum (Vm), Konstanta Michelis-Menten (Km), dan tetapan inhibisi (Ki). Untuk mempelajari karakter kinetika dari adenosine kinase, beberapa substrat (adenosine, beberapa turunan adenosine yang lain, dan MgATP serta beberapa kofaktor ) diinkubasi dengan adenosine kinase.
Hasil percobaan menunjukkan bahwa, pada konsentrasi yang rendah, substrat adenosin terikat secara sempurna pada bagian katalitik dari adenosin kinase dan terfosforilasi menjadi AMP mengikuti kinetika Michaelis-Menten. Sebaliknya, pada konsentrasi diatas 2.5 M, aktifitas enzimatik menurun. Ini menunjukkan bahwa pada konsentrasi tersebut, adenosin bertindak sebagai inhibitor kompetitif.
Aktifitas enzim mencapai nilai maksimum pada pH 6.5 untuk rasio ATP/Mg+2 = 0.5 sampai 1. Hasil ini sesuai dengan nilai yang pernah diberikan oleh adenosine kinase dari hati tikus (Lindberg dkk., 1967).
Harga Km untuk adenosin adalah 0.4 M, sedangkan untuk substrat kedua, MgATP, nilainya adalah 75 M. Nilai ini memperlihatkan bahwa adenosin terikat lebih kuat pada adenosine kinase dibandingkan dengan MgATP.
Substrat-substrat yang lain memberikan derajad inhbisi dan perubahan harga Km seperti pada Tabel 1. NECA dan MTA memberikan inhibisi dan respon simulasi yang tinggi dengan harga Km yang sangat kecil sekali. Ini berarti bahwa, NECA dan MTA merupakan inhibitor yang kurang efektif dibandingkan dengan inhibitor lain, terutama CHA dan L-PIA yang menghasilkan perubahan Km sampai, masing-masing 330 dan 205 M. Fenomena yang sama pernah ditunjukkan oleh adenosine kinase dari ragi dan tikus Pallela dkk., 1980).
Karakter kinetika lain dapat diukur dengan derajad inhibisi produk fosforilasi, ADP dan AMP, terutama pada saan konsentrasi keduanya sangat tinggi. Tabel 2 memperlihatkan hasil eksperimen inbisi AMP dan ADP pada adenosine dan MgATP. Untuk melihat inhibisi pada adenosine, MgATP dibuat tetap, sedangkan untuk melihat inhibisi pada Mg ATP, adenosine dibuat tetap.
Tabel 1 . Hasil pemurnian adenosin kinase.
Fraksi V (ml) Jumlah protein (mg) Aktifitas total (mol/menit) Recovery (%) Aktifitas spesifik (nmol/ menit/mg) Tingkat pemurnian Homogenat plasenta 2000 3260 32.3 100 9.9 1 Fraksi ammonium sulfat (70 %) 50 81.5 24.7 80 303.1 30.7 Fraksi dialisis 45 78.9 24.2 80 306.7 30.9 Fraksi 5'-AMP-sheparosa 2.5 0.3 1.3 4.1 4,335.60 437.94
Tabel 2. Inhibisi dan simulasi beberapa substrat terhadap adenosin
Substrat analog Derajat inhibisi (adenosin 0.5 M Km (M) Derajat simulasi (adenosin 0.5 M)
NECA ++ tu ++ MTA ++ tu ++ CHA ++ 330 ++ L-PIA ++ 205 ++ CIAdo + 1 + 6-MMPR +++ 4 -
Tabel 3. Efek adenosin dan MgATP pada aktifitas adenosin kinase.
Produk reaksi Substrat varibel Substrat tetap Tipe inhibisi Ki (M)
AMP Adenosin MgATP Kompetitif 140
AMP MgATP Adenosin Non-kompetitif 500
ADP Adenosin MgATP Non-kompetitif 50
ADP MgATP Adenosin Non-kompetitif 50 dan 150
Dari tabel tampak bahwa, AMP merupakan inhibitor kompetitif (Ki = 140 M) bagi adenosin dan inhibitor non-kompetitif bagi MgATP (Ki =500 M). Sementara, ADP merupakan inhibitor non-kompetitif bagi kedua substrat tersebut (adenosin, Ki = 50 M; MgATP, Ki = 50 dan 150 M).
Dari kedua tipe inhibisi produk tersebut dapat diusulkan bahwa mekanisme katalisis reaksi fosforilasi adenosin mengikuti pola Bi-Bi. Pada tahap pertama, adenosin diikat oleh enzim membentuk kompleks enzim-adenosin dengan konformasi yang labil sehingga memungkinkan untuk menyerap substrat kedua, MgATP, pada sisi katalitik yang lain. Kompleks adenosin kinase-adenosin-MgATP, selanjutnya, memungkinkan
fosforilasi adenosin membentuk kompleks adenosin kinase-AMP-MgADP. Kompleks yang terakhir sangat rapuh dan segera terurai menjadi AMP dan MgATP.
UCAPAN TERIMA KASIH
Terima kasih kepada Prof. Helene Picalino dari Laboratorium Biokimia Kedokteran, Universitas Montpellier II, Montpellier, Perancis, yang telah membiayai dan membimbing penelitian ini.
DAFTAR PUSTAKA
Baba, M dkk. (1988), Biochem. Pharm., 37, 7, hal. 1317-1325
Clercq, E.(1992), Aids Research and Human
Retrovirus, 8,2, hal. 1919-1921
De Jong (1977), Arch. Int. Physiol. Biochim., 85, hal. 557-589
Elallaoui, A. (1994). Eur. J. Biochem., 711, hal 1-8 Hurley, CH. (1985). J. Biol. Chem., 260, 29, hal.
15675-15681
Jhonson, MA, dkk. (1988). J. Biol. Chem., 263, 30, hal. 15354-15357
Long, MC, dkk. (2006), J. Antimicrob Chemotherapy, 3, hal. 1-4
Lindberg, B., dkk. (1967). J. Biol. Chem., 242, hal. 350-356
Leibach, TK. (1971), Hoppe-Seyler’s Z. Physiol. Chem., 352, 328-344\
Palella, TD dkk. (1980). J. Biol. Chem., 255, 11, hal. 5264-5269
Schmidt, G., dkk. (1974) Tropenmed. Parasit, 25, hal. 301-308