i
UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL BUAH CABAI RAWIT HIJAU (Capsicum frutescens L.) DENGAN METODE DPPH (1,1-difenil-2-pikrilhidrazil) DAN PENETAPAN KADAR KAPSAISIN SECARA
KROMATOGRAFI LAPIS TIPIS (KLT) – DENSITOMETRI
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh: Yenny NIM : 098114063
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2013
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
ii
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
iii
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
iv
HALAMAN PERSEMBAHAN
Kupersembahkan karya ini untuk : Papa, Mama, Kakak dan Adik ku terkasih, Sahabat-sahabat ku dan Almamaterku
Sebab Aku ini mengetahui rancangan-rancangan apa yang
ada pada-Ku mengenai kamu, demikianlah firman TUHAN,
yaitu rancangan damai sejahtera dan bukan rancangan
kecelakaan, untuk memberikan kepadamu hari depan yang
penuh harapan. (Yeremia 29:11)
Masa depan adalah milik mereka yang
percaya tentang keindahan mimpi-mimpi
mereka. (Eleanor Roosevelt)
Karena itu Aku berkata kepadamu : apa saja yang kamu minta dan doakan, percayalah bahwa kamu telah menerimanya, maka hal itu akan diberikan kepadamu. (Markus 11:24)
Sebab Aku ini mengetahui rancangan-rancangan apa yang ada pada-Ku mengenai kamu, demikianlah firman TUHAN, yaitu rancangan damai sejahtera dan bukan rancangan kecelakaan, untuk memberikan kepadamu hari depan yang penuh harapan. (Yeremia 29:11)
Masa depan adalah milik mereka yang
percaya tentang keindahan mimpi-mimpi
mereka. (Eleanor Roosevelt)
Karena itu Aku berkata kepadamu : apa saja yang kamu minta dan doakan, percayalah bahwa kamu telah menerimanya, maka hal itu akan diberikan kepadamu. (Markus 11:24)
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
v
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
vi
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
vii PRAKATA
Puji Syukur kepada Tuhan atas semua berkat dan penyertaan-Nya kepada
penulis sehingga penulis dapat menyelesaikan skripsi yang berjudul “UJI
AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL BUAH CABAI RAWIT HIJAU (Capsicum frutescens L.) DENGAN METODE DPPH (1,1-difenil-2-pikrilhidrazil) DAN PENETAPAN KADAR KAPSAISIN SECARA KROMATOGRAFI LAPIS TIPIS (KLT) – DENSITOMETRI” ini dengan baik. Laporan akhir ini disusun untuk memenuhi salah satu persyaratan untuk memperoleh gelar Sarjana Strata 1 Program Studi Ilmu Farmasi (S.Farm).
Dalam proses penyelesaian skripsi ini, penulis tidak lepas dari bimbingan serta bantuan yang diberikan oleh semua pihak. Maka pada kesempatan ini dengan segala kerendahan hati penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Ipang Djunarko, M.Sc., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta yang telah memberikan kesempatan kepada penulis untuk melakukan penelitian ini.
2. Prof.Dr.C.J. Soegihardjo, Apt., selaku Dosen Pembimbing yang telah memberikan bantuan dan bimbingan selama rancangan, pengusulan skripsi, saat dilakukan penelitian dan selama penulisan naskah skripsi dengan kesabaran dan penuh perhatian.
3. Yohanes Dwiatmaka, M.Si., selaku Dosen Penguji yang telah memberikan bimbingan dan saran sehingga skripsi ini dapat terselesaikan.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
viii
4. Dra. M.M. Yetty Tjandrawati, M.Si., selaku Dosen Penguji yang telah memberikan bimbingan dan saran sehingga skripsi ini dapat terselesaikan. 5. Agustina Setiawati, M.Sc., Apt., selaku Dosen Pembimbing Akademik yang
telah memberikan bimbingan dan saran.
6. Rini Dwiastuti, M.Sc., Apt. selaku Kepala Laboratorium Fakultas Farmasi Universitas Sanata Dharma.
7. Seluruh staff laboratorium Universitas Sanata Dharma Yogyakarta terutama Mas Bimo, Mas Wagiran, Mas Parlan dan Mas Kayat atas segala bantuan selama penelitian skripsi.
8. Teman seperjuangan, Vanny Christy Silviani dan Christina atas semua dukungan, semangat, persahabatan, doa dan kerjasamanya selama pengerjaan skripsi.
9. Edy Trilaksono yang selalu memberi semangat, dukungan, dan doa selama proses pengerjaan skripsi dari awal hingga selesai.
10.Sahabat terkasih, Agustina Erni Purnamasari, Marsela Lotjita, Christina Yessy Jessica, Evy Fenny Veronica, Fitri Apriliyani Tiran dan Melisa Silvia yang selalu memberikan dukungan, semangat dan doa yang tak terlupakan.
11.Teman-teman terkasih, Adel, Riza, Wisnu, Oni, dan Prita yang selalu memberikan dukungan dan semangat.
12.Komsel Spirit of Angel, Yusita Halim, Lulu Margathe, Hana Eirene Tawe, Rini Novianti, Rina Novianti, Cynthia Chrisdiananda Happy Anastasia Putri, Ratna Puspita Adiyasa yang selalu memberikan semangat dan doa.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
ix
13.Teman-teman FST 2009 dan FSM B 2009, atas kerjasama, doa, semangat, canda tawa, saran dan kritik.
14.Semua pihak yang tidak dapat penulis sebutkan satu per satu dalam proses kuliah dan pengerjakan skripsi ini.
Akhir kata penulis menyadari bahwa skripsi ini masih banyak memiliki kekurangan. Oleh karena itu, penulis mengharapkan saran dan kritik yang membangun demi kesempurnaan skripsi ini. Penulis juga berharap semoga laporan ini dapat bermanfaat bagi teman-teman dan orang lain yang membutuhkannya.
Yogyakarta,12 Maret 2013 Penulis
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
x DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ... vi
PRAKATA ... vii
DAFTAR ISI ... x
DAFTAR TABEL ... xv
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN ... xvii
INTISARI ... xviii
ABSTRACT ... xix
BAB I PENGANTAR ... 1
A. Latar Belakang ... 1
1. Permasalahan ... 3
2. Keaslian Penelitian ... 3
3. Manfaat Penelitian ... 4
a. Manfaat teoritis ... 4
b. Manfaat praktis ... 4
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xi
B. Tujuan Penelitian ... 4
1. Tujuan umum ... 4
2. Tujuan khusus ... 4
BAB II PENELAAHAN PUSTAKA ... 5
A. Cabai ... 5
1. Klasifikasi Tanaman ... 5
2. Gambaran Umum ... 5
3. Kandungan Kimia dan Manfaat Tanaman Cabai Rawit Hijau ... 6
B. Kapsaisin ... 6
C. Radikal Bebas ... 7
D. Antioksidan ... 8
E. Metode DPPH (1,1-difenil-2-pikrilhidrazil) ... 9
F. Ekstraksi ... 9
G. Validasi Metode Analisis ... 10
H. Spektrofotometri Visibel ... 13
I. Metode Kromatografi Lapis Tipis (KLT) – Densitometri ... 14
J. Landasan Teori ... 15
K. Hipotesis ... 16
BAB III METODOLOGI PENELITIAN ... 17
A. Jenis dan Rancangan Penelitian ... 17
B. Variabel ... 17
1. Variabel Bebas ... 17
2. Variabel Tergantung ... 17
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xii
3. Variabel pengacau ... 17
a. Terkendali ... 17
b. Tak terkendali ... 17
C. Definisi Operasional ... 17
D. Alat dan Bahan Penelitian ... 18
1. Alat penelitian ... 18
2. Bahan penelitian ... 18
E. Tatacara Penelitian ... 18
1. Determinasi tanaman ... 18
2. Pengumpulan bahan ... 19
3. Pembuatan ekstrak etanol buah cabai rawit hijau ... 19
4. Penentuan aktivitas antioksidan ekstrak etanol buah cabai rawit hijau dengan metode DPPH ... 19
a. Pembuatan larutan DPPH ... 19
b. Pembuatan larutan stok kapsaisin ... 19
c. Pembuatan larutan seri baku kapsaisin ... 20
d. Pembuatan larutan uji ... 20
e. Uji pendahuluan aktivitas antioksidan ... 20
f. Penentuan operating time (OT) ... 20
g. Penentuan panjang gelombang maksimum ( maks) ... 21
h. Penentuan aktivitas antioksidan ... 21
i. Validasi metode uji aktivitas antioksidan ... 22
j. Estimasi aktivitas antioksidan ... 22
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xiii
5. Penetapan kadar kapsaisin ... 22
a. Pembuatan fase gerak ... 22
b. Pembuatan larutan stok kapsaisin ... 22
c. Pembuatan larutan seri baku kapsaisin ... 22
d. Pembuatan larutan uji ... 23
e. Penetapan kadar kapsaisin ekstrak etanol buah cabai rawit hijau ... 23
F. Analisis Hasil ... 24
1. Penentuan aktivitas antioksidan ekstrak etanol buah cabai rawit hijau dengan metode DPPH ... 24
2. Penetapan kadar kapsaisin ... 24
BAB IV HASIL DAN PEMBAHASAN ... 25
A. Hasil Determinasi Tanaman ... 25
B. Hasil Pengumpulan Bahan ... 25
C. Hasil Preparasi Sampel ... 26
D. Hasil Uji Pendahuluan ... 27
E. Hasil Optimasi Metode Uji Aktivitas Antioksidan ... 28
1. Penentuan operating time (OT) ... 28
2. Penentuan panjang gelombang maksimum ( maks) ... 29
F. Hasil Validasi Metode Uji Aktivitas Antioksidan ... 30
1. Linieritas ... 33
2. Akurasi ... 33
3. Presisi ... 36
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xiv
4. Spesifisitas ... 36
G. Hasil Estimasi Aktivitas Antioksidan dengan Radikal DPPH ... 36
H. Penetapan Kadar Kapsaisin ... 39
I. Analsis Statistik ... 43
BAB V KESIMPULAN DAN SARAN ... 44
A. Kesimpulan ... 44
B. Saran ... 44
DAFTAR PUSTAKA ... 45
LAMPIRAN ... 48
BIOGRAFI PENULIS ... 66
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xv
DAFTAR TABEL
Tabel I. Kriteria Akurasi yang Dapat Diterima Menurut
Harmita (2004) ... 12 Tabel II. Kriteria Presisi yang Dapat Diterima Menurut APVMA
(cit., Angela, 2012) ... 12 Tabel III. Hasil Scanning Panjang Gelombang Maksimum
DPPH ... 30 Tabel IV. Hasil Pengukuran % IC Seri Baku Kapsaisin ... 31 Tabel V. Hasil Pengukuran % IC Seri Ekstrak Etanol Buah Cabai
Rawit Hijau ... 31 Tabel VI. Hasil % recovery dan % CV Uji Aktivitas Antioksidan
Baku Kapsaisin ... 34 Tabel VII. Hasil % recovery dan % CV Uji Aktivitas Antioksidan
Ekstrak Etanol Buah Cabai Rawit Hijau ... 35 Tabel VIII. Hasil IC50 Baku Kapsaisin dan Ekstrak Etanol Buah Cabai
Rawit Hijau ... 38 Tabel IX. Nilai Rf Baku Kapsaisin dan Ekstrak Etanol Buah Cabai
Rawit Hijau ... 40 Tabel X. Penetapan Kadar Kapsaisin dalam Ekstrak Etanol Buah
Cabai Rawit Hijau ... 42
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xvi
DAFTAR GAMBAR
Gambar 1. Struktur Senyawa Kapsaisin (Bickler, J.R., 2000) ... 7 Gambar 2. Soxhlet (Burge, D.M., James M. Reilly, and Douglas
W. Nishimura, 2002) ... 10 Gambar 3. Hasil Uji Pendahuluan ... 27 Gambar 4. Operating Time (OT) Baku Kapsaisin ... 29 Gambar 5. Kurva Persamaan Regresi Linier Aktivitas Antioksidan
Baku Kapsaisin ... 32 Gambar 6. Kurva Persamaan Regresi Linier Aktivitas Antioksidan
Ekstrak Etanol Buah Cabai Rawit Hijau ... 32 Gambar 7. Penangkapan DPPH oleh Senyawa Antioksidan (Windono,
Soediman, Yudawati, Ermawati, Srielita dan
Erowati, 2001) ... 37 Gambar 8. Mekanisme Penghambatan Radikal Bebas oleh Senyawa
Kapsaisin ... 38 Gambar 9. Interaksi Kapsaisin dengan Fase Diam Silika Gel 60
F254 ... 40 Gambar 10. Kurva Persamaan Regresi Linier Baku Kapsaisin ... 41
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xvii
DAFTAR LAMPIRAN
Lampiran 1. Sertifikat Kapsisin ... 48
Lampiran 2. Gambar Buah Cabai Rawit Hijau ... 49
Lampiran 3. Perhitungan Rendemen Ekstrak Etanol Buah Cabai Rawit Hijau ... 50
Lampiran 4. Data Penimbangan Pengujian Aktivitas Antioksidan ... 50
Lampiran 5. Perhitungan Konsentrasi Bahan Pengujian Aktivitas Antiokidan ... 51
Lampiran 6. Optimasi Metode Uji Aktivitas Antioksidan ... 52
Lampiran 7. Uji Aktivitas Antioksidan Menggunakan DDPH ... 55
Lampiran 8. Perhitungan % recovery, CV Uji Aktivitas Antioksidan Menggunakan DPPH ... 57
Lampiran 9. Perhitungan IC50 Kapsaisin dan Ekstrak Etanol Buah Cabai Rawit Hijau ... 59
Lampiran 10. Data Persamaan Kurva Baku Kapsaisin ... 59
Lampiran 11. Data dan Perhitungan Kadar Kapsaisin dalam Ekstrak Etanol Buah Cabai Rawit Hijau ... 60
Lampiran 12. Kromatogram Baku Kapsaisin ... 61
Lampiran 13. Kromatogram Ekstrak Etanol Buah Cabai Rawit Hijau ... 62
Lampiran 14. Uji Statistik Aktivitas Antioksidan dengan SPSS 16.0 ... 65
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xviii INTISARI
Buah cabai rawit hijau (Capsicum frutescens L.) mengandung senyawa kimia yaitu kapsaisin. Kapsaisin memiliki atom hidrogen yang bertanggungjawab terhadap aktivitas antioksidan. Penelitian ini bertujuan untuk menetapkan aktivitas antioksidan yang terdapat pada ekstrak etanol buah cabai rawit hijau dan menetapkan kadar kapsaisin dalam ekstrak etanol buah cabai rawit hijau.
Penelitian ini merupakan penelitian eksperimental. Penetapan aktivitas antioksidan dilakukan dengan metode DPPH. Pengukuran absorbansi
menggunakan spektrofotometer visibel pada maks 517,5 nm. Penetapan kadar
kapsaisin digunakan metode KLT – densitometri dengan fase diam silika gel 60 F254 dan fase gerak toluen : kloroform: aseton (45:25:30).
Hasil penelitian menunjukkan aktivitas antioksidan (IC50) kapsaisin
sebesar 15,9961±4,2 µg/mL dan ekstrak etanol buah cabai rawit hijau sebesar 115,2074±5,8 µg/mL. Hasil penetapan kadar kapsaisin ekstrak etanol buah cabai rawit hijau sebesar (0,066±0,003) % (b/b).
Kata kunci: buah cabai rawit hijau (Capsicum frutescens L.), kapsaisin, DPPH, aktivitas antioksidan, KLT-densitometri
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xix ABSTRACT
Fruit green chili pepper (Capsicum frutescens L.) contains a chemical compound called capsaicin. Capsaicin has a hydrogen atom are responsible for antioxidant activity. This research aims to assign antioxidant activity which is found in extract ethanol fruit green chili and set levels capsaisin in extract ethanol fruit green chili.
This is an experimental research study. The determination of antioxidant activity performed with a method of DPPH. The measurement of absorbansi use of the spectrophotometer visible in max 517,5 nm. The determination of the level of capsaisin used method of TLC – densitometry with silica gel 60 F254 as stasionary phase and toluene : chloroform : acetone (45:25:30) as mobile phase.
The result of examination showed that antioxidant activity (IC50) in
capsaisin is 15,9961±4,2 µg/mL and extract ethanol fruit green chili is 115,2074±5,8 µg/mL. The level of capsaisin in extract ethanol fruit green chili is (0,066±0,003) % (b/b).
Keyword : Fruit green chili (Capsicum frutescens L.), capsaicin, DPPH, antioxidant activity, TLC - densitometry
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
1
BAB I PENGANTAR
A. Latar Belakang
Radikal bebas adalah suatu atom atau molekul yang memiliki satu atau lebih elektron bebas yang memilki sifat reaktif di dalam tubuh. Di dalam tubuh, apabila jumlah elektron bebas sedikit maka dapat distabilkan oleh sistem enzim yang ada di dalam tubuh namun jika berada dalam jumlah banyak maka dapat bermasalah bagi kesehatan. Radikal bebas adalah suatu agen pengoksidasi yang dapat menyebabkan beberapa penyakit seperti kerusakan protein dan DNA, kanker, penuaan dini, dan penyakit degeneratif lainnya (Metris, 2012). Oleh karena itu, tubuh memerlukan suatu senyawa antioksidan yang dapat berikatan dengan radikal bebas supaya tidak menyebabkan munculnya penyakit di dalam tubuh. Senyawa antioksidan biasanya terdapat pada tumbuh-tumbuhan dan buah-buahan.
Antioksidan adalah suatu senyawa yang mampu memberikan satu atau lebih elektron pada radikal bebas sehingga efek radikal bebas dapat dihindari (Suhartono, 2002). Dalam tubuh manusia memiliki cadangan antioksidan yang terbatas, sehingga ketika jumlah radikal bebas berlebih maka tubuh kita memerlukan tambahan antioksidan eksogen. Antioksidan eksogen dapat berasal dari makanan atau minuman yang mengandung vitamin C, vitamin E, beta karoten dan asam amino. Antioksidan terdiri dari dua macam, yaitu antioksidan alami dan antioksidan sintetik (Sunarni, 2005).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
2
Cabai merupakan salah satu tanaman yang sangat penting dalam industri makanan dan industri farmasi karena biasa digunakan untuk bumbu masak dan mulai banyak peneliti yang menganalisis kandungan dari cabai. Khasiat ekstrak cabai adalah sebagai obat sariawan, tonik, stimulan kuat untuk jantung dan aliran darah, antireumatik, antikoagulan, stomakik, karminatif, diaforetik dan diuretik (Sentra Informasi Ilmu Pengetahuan dan Teknologi, 2005).
Pada cabai terkandung senyawa kimia yaitu kapsaisin (8-methyl-N -vanillyl-6-nonenamide) yang dapat menimbulkan rasa pedas (Wellyan, 2000). Menurut Henderson dan Slickman (1999), kapsaisin memiliki aktivitas antioksidan dengan cara mendonorkan atom hidrogen sehingga radikal bebas dapat bersifat netral. Oleh karena itu, perlu ditetapkan daya antioksidan pada cabai.
Pengujian aktivitas antioksidan dapat dilakukan dengan beberapa metode. Pada penelitian ini digunakan metode DPPH (1,1-difenil-2-pikrilhidrazil) untuk mengetahui aktivitas antioksidan pada cabai rawit hijau. Metode DPPH (1,1-difenil-2-pikrilhidrazil) dapat memberikan informasi mengenai penangkapan radikal bebas yang menyebabkan elektron menjadi berpasangan. Nilai aktivitas antioksidan dinyatakan dengan IC50 yang merupakan konsentrasi antioksidan yang
mampu menghambat 50% radikal. (Sunarni, 2005). Dalam penetapan kadar kapsaisin digunakan metode kromatografi lapis tipis (KLT) – densitometri karena dapat menganalisis secara kualitatif dan kuantitatif.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
3
1. Permasalahan
a. Berapa nilai aktivitas antioksidan ekstrak etanol buah cabai rawit hijau dengan metode DPPH yang dinyatakan dengan IC50?
b. Berapa kadar kapsaisin yanag terkandung di dalam ekatrak etanol buah cabai rawit hijau dengan metode kromatografi lapis tipis (KLT) – densitometri?
2. Keaslian penelitian
Sejauh penelusuran penulis, uji aktivitas antioksidan pada buah cabai rawit hijau dan penetapan kadar kapsaisin pernah dilakukan:
a. Penelitian Henderson dan Slickman (1999) tentang Quantitative HPLC Determination of the Antioxidant Activity of Capsaicin on the Formation of Lipid Hydroperoxides of Linoleic Acid: A Comparative Study against BHT and Melatonin
b. Penelitian yang dilakukan Talcott, Brenes, dan Villalon (2000) mengenai aktivitas antioksidan pada berbagai spesies Capsicum dengan metode β -karoten – linoleat.
c. Penelitian dari Sukrasno dan Kusmardiyani (1997) meneliti kandungan kapsaisin pada berbagai buah Capsicum menggunakan metode KCKT.
Perbedaan dengan penelitian ini adalah pengujian antioksidan dengan metode DPPH pada ekstrak etanol buah cabai rawit hijau dan penetapan kadar kapsaisin menggunakan metode KLT – densitometri.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
4
3. Manfaat penelitian
a. Manfaat teoritis. Penelitian ini diharapkan dapat memberikan pengetahuan mengenai aktivitas antioksidan ekstrak etanol buah cabai rawit hijau dengan metode DPPH yang dinyatakan dengan IC50.
b. Manfaat praktis. Penelitian ini diharapkan dapat memberikan informasi mengenai aktivitas antioksidan ekstrak etanol buah cabai rawit hijau supaya dapat bermanfaat bagi kesehatan masyarakat dan perkembangan pada sediaan farmasi.
B. Tujuan Penelitian 1. Tujuan umum
Menguji aktivitas antioksidan ekstrak etanol buah cabai rawit hijau dengan metode DPPH.
2. Tujuan khusus
a. Mengetahui nilai aktivitas antioksidan ekstrak etanol buah cabai rawit hijau dengan metode DPPH yang dinyatakan dengan IC50.
b. Mengetahui kadar kapsaisin yang terkandung di dalam ekstrak etanol buah cabai rawit hijau dengan metode kromatografi lapis tipis (KLT) –
densitometri.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
5
BAB II
PENELAAHAN PUSTAKA A. Cabai
1. Klasifikasi tanaman
Klasifikasi tanaman cabai rawit hijau menurut Plantmor, 2008 seperti berikut:
Kingdom : Plantae
Subkingdom : Tracheobionta Super Divisi : Spermatophyta Divisi : Magnoliophyta Kelas : Magnoliopsida Sub Kelas : Asteridae
Ordo : Solanales
Famili : Solanaceae
Genus : Capsicum
Spesies : Capsicum frutescens L.
2. Gambaran umum
Secara morfologi, cabai rawit memiliki bagian-bagian penting yang dapat dideskripsikan sebagai berikut: buah cabai rawit akan terbentuk setelah penyerbukan. Buah cabai rawit memiliki bentuk bulat pendek dengan ujung runcing atau kerucut. Warna buah cabai rawit bermacam-macam yaitu putih, hijau dan merah. Biji cabai rawit berwarna putih kekuningan dan berbentuk
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
6
bulat pipih. Akar cabai rawit terdiri dari akar tunggang yang tumbuh lurus ke pusat bumi dan akar serabut yang menyebar ke samping (Cahyono, 2003).
3. Kandungan kimia dan manfaat tanaman cabai rawit hijau
Kandungan kimia cabai rawit antara lain kapsaisin, kapsantin, kapsarubin, karoten, karotenoid, minyak lemak, vitamin A, B dan C (Guntur, 2010). Manfaat cabai rawit hijau antara lain dapat menjaga kesehatan mata, menambah nafsu makan, menormalkan kembali kaki dan tangan yang lemas, batuk berdahak, melegakan hidung tersumbat pada sinusitis, migrain. Cabai rawit yang memiliki rasa pedas apabila masuk ke dalam meridian jantung dan pankreas dapat menimbulkan sensasi panas. Ekstrak buah cabai rawit mempunyai daya hambat terhadap pertumbuhan Candida albicans. Daya hambat ekstrak cabal rawit 1 mg/mL setara dengan 6,20 mcg/mL nistatin dalam formamid (Sentra Informasi Ilmu Pengetahuan dan Teknologi, 2005).
B. Kapsaisin
Kapsaisin (8-metil-N-vanilil-6-nonenamida) merupakan suatu zat aktif cabai yang dapat memberikan efek panas dalam cabai. Kapsaisin dapat menimbulkan iritasi pada mammalian termasuk manusia dan menimbulkan rasa terbakar dan panas pada jaringan yang tersentuh. Kapsaisin disebut juga kapsaisinoid dan merupakan suatu metabolit sekunder dari cabai. Kapsaisin memiliki sifat hidrofobik, tidak berwarna, tidak berbau, dan bentuk kristalnya dapat digunakan sebagai bahan campuran lilin (Sanatombik, 2008).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
7
Kapsaisin mempunyai aktivitas antioksidan dengan menangkap radikal bebas. Gugus fenol pada kapsaisin yang akan bertanggungjawab atas aktivitas antioksidan dalam mendonorkan elektron kepada radikal bebas (Henderson and Slickman, 1999).
Gambar 1. Struktur Senyawa Kapsaisin (Bickler, 2000)
C. Radikal Bebas
Radikal bebas adalah atom atau kelompok atom dengan nomor (berpasangan) elektron ganjil dan dapat terbentuk ketika oksigen berinteraksi dengan molekul tertentu (Sportmedweb, 2005).
Radikal bebas merupakan suatu atom atau gugus atom yang memiliki satu elektron tidak berpasangan. Radikal bebas bersifat sangat reaktif dan memiliki energi yang tinggi karena memiliki elektron tidak berpasangan (Fessenden dan Fessenden, 1982).
Penangkap radikal bebas menyebabkan elektron menjadi berpasangan yang kemudian menyebabkan penghilangan warna yang sebanding dengan jumlah elektron yang diambil (Sunarni, 2005).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
8
D. Antioksidan
Antioksidan merupakan senyawa yang dapat menghambat oksidasi yang diperantarai oleh oksigen. Oksidasi memegang peranan penting dalam pertahanan tubuh terhadap penyakit. Hal tersebut disebabkan senyawa antioksidan dapat mencegah pengaruh buruk yang disebabkan oleh senyawa-senyawa radikal bebas. Radikal bebas tersebut beberapa di antaranya toksik (beracun) dan sangat reaktif sehingga dapat mempercepat proses penuaan dan kematian (Niki, 1987; Goodman, 1999).
Menurut Halliwel (2000), antioksidan memiliki aktivitas sebagai berikut: 1. Menurunkan konsentrasi oksigen.
2. Mencegah inisiasi rantai pertama dengan menangkap radikal penginisiasi seperti radikal hidroksil.
3. Mengikat ion logam dalam bentuk yang tidak akan menurunkan spesies penginisiasi seperti radikal hidroksil dan tidak mendekomposisi peroksida lipid menjadi radikal peroksi atau alkoksi.
4. Mendekomposisi peroksida dengan mengubah menjadi produk non radikal seperti alkohol.
5. Memecah rantai pada radikal intermediet seperti radikal peroksi dan alkoksi yang ditangkap untuk mencegah abstraksi hidrogen selanjutnya.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
9
E. Metode DPPH (1,1-difenil-2-pikrilhidrazil)
Salah satu uji untuk menentukan aktivitas antioksidan penangkap radikal adalah metode DPPH (1,1 Diphenyl-2-picrylhidrazyl). Metode DPPH memberikan informasi reaktivitas senyawa yang diuji dengan suatu radikal stabil. DPPH memberikan serapan kuat pada panjang gelombang 517 nm dengan warna violet gelap. Penangkap radikal bebas menyebabkan elektron menjadi berpasangan yang kemudian menyebabkan penghilangan warna yang sebanding dengan jumlah elektron yang diambil (Sunarni, 2005).
F. Ekstraksi
Ekstraksi adalah kegiatan penarikan zat aktif dari simplisia nabati dan hewani menggunakan pelarut yang sesuai kemudian pelarut diuapkan. Simplisia yang diekstrak mengandung senyawa aktif yang dapat larut dan senyawa yang tidak dapat larut dalam cairan penyari. Ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi senyawa aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa yang tersisa diperlakukan sedemikian sehingga memenuhi baku yang telah ditetapkan. Ekstrak cair adalah sediaan dari simplisia nabati yang mengandung etanol sebagai pelarut atau sebagai pengawet. Faktor yang mempengaruhi kecepatan penyarian adalah kecepatan difusi zat yang larut melalui lapisan-lapisan batas antara cairan penyari dengan bahan yang mengandung zat tersebut (Dirjen POM, 1986).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
10
Soxhletasi merupakan metode ekstraksi dengan cara mengalirkan bahan yang akan diekstraksi dengan pelarut yang sesuai dan selalu baru. Bahan yang akan diekstrak dibungkus dengan menggunakan kantung ekstraksi, kemudian dimasukkan ke dalam alat soxhlet. Soxhlet diletakkan di antara labu penampung hasil ekstraksi dan suatu pendingin balik yang terhubung dengan pipa-pipa. Dalam labu penampung hasil ekstraksi, pelarut akan diuapkan. Pelarut tersebut akan bertambah sampai batas maksimal dan akan masuk ke dalam labu penampung sehingga zat yang terekstraksi akan selalu terendam oleh pelarut yang selalu baru (Voigt, 1994).
Gambar 2. Soxhlet (Burge, Jame and Douglas, 2002)
G. Validasi Metode Analisis
Validasi adalah suatu cara untuk mengetahui bahwa metode yang akan digunakan sesuai dengan tujuan yang diinginkan (Rohman, 2009). Validasi metode adalah suatu tindakan terhadap parameter tertentu yang didasarkan oleh
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
11
penelitian laboratorium untuk membuktikan bahwa parameter tersebut memenuhi syarat untuk digunakan (Harmita, 2004).
Suatu metode analisis harus divalidasi untuk melakukan verifikasi bahwa parameter-parameter kinerjanya cukup mampu mengatasi problem analisis, karenanya suatu metode harus divalidasi ketika:
a. Metode baru dikembangkan untuk mengatasi problem analisis tertentu.
b. Metode yang sudah baku direvisi untuk menyesuaikan perkembangan, atau karena munculnya suatu masalah yang mengarahkan bahwa metode baku tersebut harus direvisi.
c. Penjaminan mutu yang mengindikasikan bahwa metode baku telah berubah seiring dengan berjalannya waktu.
d. Metode baku digunakan di laboratorium yang berbeda dikerjakan oleh analis berbeda, atau dikerjakan dengan alat yang berbeda. (Rohman, 2009).
Parameter validasi metode analisis antara lain adalah akurasi, presisi, dan linieritas. Akurasi merupakan keterdekatan nilai pengukuran dengan nilai sebenarnya dari analit dalam sampel (Mulja dan Suharman, 1995).
Akurasi merupakan ketelitian suatu metode analisis atau kedekatan antara nilai terukur dengan nilai yang diterima baik nilai konvensi, nilai sebenarnya atau nilai rujukan. Akurasi diukur sebagai banyaknya analit yang diperoleh kembali pada suatu pengukuran (Gandjar dan Rohman, 2007). Akurasi dinyatakan dalam persen perolehan kembali (recovery) analit yang ditambahkan (Harmita, 2004).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
12
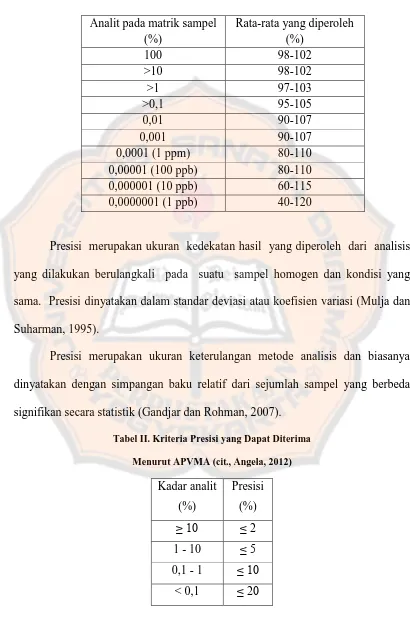
Tabel I. Kriteria Akurasi yang Dapat Diterima Menurut Harmita (2004)
Analit pada matrik sampel (%)
Rata-rata yang diperoleh (%)
100 98-102
>10 98-102
>1 97-103
>0,1 95-105
0,01 90-107
0,001 90-107
0,0001 (1 ppm) 80-110
0,00001 (100 ppb) 80-110 0,000001 (10 ppb) 60-115 0,0000001 (1 ppb) 40-120
Presisi merupakan ukuran kedekatan hasil yang diperoleh dari analisis yang dilakukan berulangkali pada suatu sampel homogen dan kondisi yang sama. Presisi dinyatakan dalam standar deviasi atau koefisien variasi (Mulja dan Suharman, 1995).
Presisi merupakan ukuran keterulangan metode analisis dan biasanya dinyatakan dengan simpangan baku relatif dari sejumlah sampel yang berbeda signifikan secara statistik (Gandjar dan Rohman, 2007).
Tabel II. Kriteria Presisi yang Dapat Diterima
Menurut APVMA (cit., Angela, 2012)
Kadar analit (%)
Presisi (%)
≥ 10 ≤ 2
1 - 10 ≤ 5 0,1 - 1 ≤ 10
< 0,1 ≤ 20
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
13
Spesifisitas adalah kemampuan untuk mengukur analit yang dituju secara tepat dan spesifik dengan adanya komponen-komponen lain dalam matriks sampel seperti ketidakmurnian, produk degradasi dan komponen matriks (Gandjar dan Rohman, 2007).
Linieritas merupakan kemampuan suatu metode untuk memperoleh hasil-hasil uji yang secara langsung proposional dengan konsentrasi analit pada kisaran yang diberikan. Linieritas suatu metode merupakan ukuran seberapa baik kurva kalibrasi yang menghubungkan antara respon (y) dengan konsentrasi (x). Linieritas dapat diukur dengan melakukan pengukuran tunggal pada konsentrasi yang berbeda-beda. Data yang diperoleh selanjutnya diproses dengan metode kuadrat terkecil, untuk selanjutnya dapat ditentukan nilai kemiringan (slope), intersep dan koefisien korelasinya (Gandjar, dan Rohman, 2007).
H. Spektrofotometri Visibel
Spektrofotometri UV-VIS adalah salah satu teknik analisis fisika kimia yang mengamati tentang interaksi atom/molekul dengan radiasi elektromagnetik pada panjang gelombang 190-380 nm (UV) dan 380-780 nm (VIS) dengan memakai instrumen spektrofotometer (Mulja dan Suharman, 1995).
Prinsip kerja spektrofotometri adalah berdasarkan atas interaksi antara radiasi elektromagnetik (salah satu jenis energi yang ditransmisikan dalam ruang dengan kecepatan tinggi) dengan materi (atom, ion/molekul) (Khopkar, 1990). Absorbsi cahaya UV/VIS mengakibatkan transmisi elektronik yaitu promosi
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
14
elektron-elektron dari orbital keadaan dasar berenergi rendah ke orbital tereksitasi bernergi lebih besar (Fessenden dan Fessenden, 1982).
I. Metode Kromatografi Lapis Tipis (KLT) – Densitometri
Kromatografi lapis tipis (KLT) dan kromatografi kertas (KKt) adalah metode kromatografi cair yang paling sederhana dalam penyajian data. Dengan memakai KLT, pemisahan senyawa yang berbeda seperti senyawa organik alam dan senyawa sintetik, kompleks organik-nonorganik, dan bahkan ion anorganik, dapat dilakukan dalam beberapa menit dengan alat yang harganya tidak terlalu mahal. Jumlah cuplikan serendah beberapa mikrogram atau setinggi 5 gram dapat ditangani, bergantung pada alat dan gejala kromaografi yang terlibat. Kelebihan KLT yang lain adalah pemakaian pelarut dan cuplikan yang jumlahnya sedikit, kemungkinan penotolan cuplikan berganda (Gritter, 1991).
Kromatografi dapat dibedakan atas berbagai macam tergantung pada pengelompokannya. Berdasarkan pada mekanisme pemisahannya, kromatografi dibedakan menjadi kromatografi adsorbsi, kromatografi partisi, kromatografi pasangan ion, kromatografi penukar ion, kromatografi eksklusi ukuran, dan kromatografi afinitas (Gandjar dan Rohman, 2007).
KLT biasanya merupakan metode pilihan pertama dalam memisahkan suatu campuran. Pada kromatografi lapis tipis, fase diam berada pada pelat gelas, plastik atau logam dan sampel akan ditotolkan di atas pelat fase diam. Sampel melewati pelat fase diam bersama dengan fase gerak dengan daya kapilaritas.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
15
Volume sampel yang dapat digunakan pada kromatografi lapis tipis adalah 1
sampai 5 L (Dean, 1λλ5).
Densitometri merupakan suatu analisis kuantitatif yang berdasarkan pada interaksi radiasi elektromagnetik dengan analit yang merupakan bercak KLT. (Gandjar dan Rohman, 2007).
J. Landasan Teori
Radikal bebas merupakan suatu senyawa yang memiliki satu atau lebih elektron tidak berpasangan, hal ini yang menyebabkan radikal bebas bersifat tidak stabil dan reaktif di dalam tubuh. Di dalam tubuh, radikal bebas akan menjadi stabil dengan cara menyerang elektron disekitarnya sehingga dapat menimbulkan kerusakan sel dan dapat menimbulkan penyakit degeneratif.
Cabai rawit hijau mengandung senyawa aktif, yaitu kapsaisin. Kapsaisin memiliki gugus fenol yang dapat mendonorkan atom hidrogen pada radikal bebas sehingga radikal dapat bersifat stabil.
Pengujian aktivitas antioksidan dapat dilakukan dengan metode DPPH. DPPH merupakan suatu metode yang mampu menunjukkan terjadinya perubahan warna larutan karena radikal bebas berikatan atom hidrogen dari senyawa antioksidan.
Kadar kapsaisin ditetapkan dengan metode KLT – densitometri karena dapat memisahkan senyawa-senyawa alam, sintetik, organik maupun nonorganik dan dapat menganalisis secara kuantitatif dengan adanya interaksi radiasi elektromagnetik dengan analit (bercak hasil KLT).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
16
K. Hipotesis
1. Ekstrak etanol buah cabai rawit hijau memiliki daya aktivitas antioksidan yang dinyatakan dengan IC50 menggunakan metode DPPH.
2. Ekstrak etanol buah cabai rawit hijau mengandung kapsaisin yang dapat ditetapkan secara KLT – densitometri.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
17
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian yang berjudul uji aktivitas antioksidan ekstrak etanol buah cabai rawit hijau (Capsicum frutescens L.) dengan metode DPPH dan penetapan kadar kapsaisin secara kromatografi lapis tipis (KLT) – densitometri merupakan jenis penelitian eksperimental.
B. Variabel
1. Variabel bebas : konsentrasi ekstrak etanol buah cabai rawit hijau. 2. Variabel tergantung : persen inhibition concentration (%IC).
3. Variabel pengacau
a. Terkendali : lokasi pengambilan sampel, umur tanaman, cara pemanenan, waktu pemanenan dan bobot sampel.
b. Tak terkendali : cuaca, curah hujan dan kelembaban ruangan.
C. Definisi Operasional
1. Buah cabai rawit hijau adalah buah yang diperoleh dari pasar Beringharjo, Yogyakarta, tidak dilakukan pemilihan ukuran.
2. Ekstrak etanol buah cabai rawit hijau adalah ekstrak yang diperoleh dari hasil soxhletasi dengan etanol.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
18
3. Inhibition concentration 50 (IC50) adalah nilai konsentrasi ekstrak etanol buah
cabai rawit hijau yang mampu menangkap 50% radikal DPPH.
D. Alat dan Bahan Penelitian 1. Alat penetitian
Alat-alat yang digunakan dalam penelitian ini adalah vortex, spektrofotometer UV-VIS, alat soxhlet, densitometer, blender, corong Buchner, oven, mikropipet 10-1000 µl; 1-10 mL, neraca analitik, vaccum rotary evaporator, waterbath, tabung reaksi tertutup, bejana kromatografi dan alat-alat gelas yang lazim digunakan di laboratorium analisis.
2. Bahan penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah buah cabai rawit hijau (Capsicum frutescens L.) yang tidak ditentukan ukurannya dan di dapat dari pasar Beringharjo, Yogyakarta. Bahan kimia kualitas farmasetis berupa akuades. Bahan kimia kualitas pro analitik meliputi etanol 96%, silika gel 60 F254 DPPH dan aluminium foil.
E. Tatacara Penelitian 1. Determinasi tanaman
Determinasi sampel buah cabai rawit hijau yang digunakan berdasarkan ciri morfologinya dilakukan dengan membandingkan literatur dari Bosland, Bailey, Iglesias-Olivas (1996).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
19
2. Pengumpulan bahan
Buah cabai rawit hijau diperoleh dari seorang pedagang di Pasar Beringharjo, Yogyakarta.
3. Pembuatan ekstrak etanol buah cabai rawit hijau
Buah cabai rawit hijau sebanyak 1 kg yang masih segar dibersihkan dan dicuci kemudian dibuang tangkainya, buah cabai rawit hijau dikeringkan pada oven dengan suhu 50°C kemudian dihaluskan menggunakan blender. Serbuk yang diperoleh ditimbang sebanyak 25 g dan dibungkus dengan kertas saring. Simplisia yang telah dibungkus, dimasukkan ke dalam labu alas bulat berisi 350 mL etanol p.a. Soxhletasi dilakukan pada suhu 70°C selama 8 jam sampai diperoleh hasil ekstrasi jernih. Filtrat hasil ekstraksi diuapkan dengan menggunakan vacuum rotary evaporator.
4. Penentuan aktivitas antioksidan ekstrak etanol buah cabai rawit hijau dengan metode DPPH
a. Pembuatan larutan DPPH, sebanyak 15,8 mg DPPH dilarutkan ke dalam etanol p.a 100,0 mL sehingga diperoleh larutan DPPH dengan konsentrasi 0,4 mM. Larutan tersebut ditutup dengan aluminium foil dan harus selalu dibuat baru.
b. Pembuatan larutan stok kapsaisin, sebanyak 2,5 mg kapsaisin dimasukkan dalam labu takar 10,0 mL dan dilarutkan dengan etanol p.a sampai batas.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
20
c. Pembuatan larutan seri baku kapsaisin, diambil sebanyak 1,0; 2,0; 3,0; 4,0 dan 5,0 mL larutan stok kapsaisin, kemudian ditambahkan etanol p.a sampai 10,0 mL, sehingga diperoleh konsentrasi larutan baku kapsaisin sebesar 25,0; 50,0; 75,0; 100,0 dan 125,0 µg/mL.
d. Pembuatan larutan uji, ditimbang sebanyak 25 mg ekstrak etanol buah cabai rawit hijau dan ditambahkan etanol p.a sampai 25,0 mL. Diambil sebanyak 1,0; 2,0; 3,0; 4,0 dan 5,0 mL larutan tersebut, kemudian ditambahkan etanol p.a sampai 10,0 mL, sehingga diperoleh konsentrasi larutan uji sebesar 100,0; 200,0; 300,0; 400,0 dan 500,0 µg/mL.
e. Uji pendahuluan aktivitas antioksidan, sebanyak 1 mL larutan DPPH dimasukkan ke dalam tiga tabung reaksi. Ditambahkan masing-masing dengan 1 mL etanol p.a, larutan baku kapsaisin 75,0 µg/mL, dan larutan uji 300 µg/mL. selanjutnya, larutan tersebut ditambahkan dengan 3,0 mL etanol p.a. Larutan tersebut kemudian divortex selama 30 detik. Setelah itu di diamkan selama 30 menit dan amati warna pada larutan tersebut.
f. Penentuan operating time (OT), sebanyak 1,0 mL larutan DPPH dimasukkan ke dalam tiga labu ukur 5,0 mL, ditambahkan masing-masing dengan 1 mL larutan baku kapsaisin 25,0; 75,0 dan 125,0 µg/mL. Selanjutnya, larutan tersebut ditambahkan dengan etanol p.a hingga tanda batas. Larutan tersebut kemudian divortex selama 30 detik. Setelah itu dibaca absorbansinya dengan spektrofotometer visibel pada panjang gelombang 517 nm setiap 5 menit selama 1 jam.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
21
g. Penentuan panjang gelombang maksimum (λmaks), pada tiga labu ukur 10 mL, dimasukkan masing-masing 0,5; 1,0 dan 1,5 mL larutan DPPH. Ditambahkan ke dalam larutan tersebut dengan etanol p.a hingga tanda batas sehingga konsentrasi DPPH menjadi 0,020; 0,040 dan 0,080 mM. Larutan tersebut kemudian divortex selama 30 detik. Didiamkan selama OT. Lalu dilakukan scanning panjang gelombang serapan maksimum dengan spektrofotometer visibel pada panjang gelombang 400-600 nm. h. Penentuan aktivitas antioksidan
1) Pengukuran absorbansi larutan DPPH (kontrol), pada labu ukur 5 mL, dimasukkan sebanyak 1,0 mL larutan DPPH. Ditambahkan larutan tersebut dengan etanol p.a hingga tanda batas. Kemudian larutan tersebut dibaca absorbansinya pada saat OT dan panjang gelombang maksimum. Pengerjaan dilakukan sebanyak tiga kali. Larutan ini digunakan sebagai kontrol untuk menguji larutan baku dan uji.
2) Pengukuran absorbansi larutan baku dan uji, sebanyak 1 mL larutan DPPH dimasukkan ke dalam labu ukur 5 mL kemudian ditambah dengan 1 mL larutan baku dan uji pada berbagai seri konsentrasi telah dibuat. Selanjutnya, larutan tersebut ditambah dengan etanol p.a hingga tanda batas. Larutan tersebut kemudian divortex selama 30 detik dan didiamkan selama OT. Larutan dibaca absorbansinya dengan spektrofotometer visibel pada panjang gelombang maksimum. Pengujian dilakukan sebanyak tiga kali.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
22
i. Validasi metode uji aktivitas antioksidan, hasil dari prosedur 4h 1) dan 2) divalidasi akurasi (% recovery), presisi (% CV), spesifisitas (spectra kontrol) dan linieritas (nilai r).
% recovery = jumlah analit terukur
jumlah analit teoritis x 100% (1) (Harmita, 2004).
% CV = s
rata-ratax 100% (2) (Harmita, 2004).
j. Estimasi aktivitas antioksidan, hasil dari prosedur 4h 1) dan 2) dihitung nilai % IC dan IC50 untuk kapsaisin dan ekstrak etanol buah cabai rawit
hijau.
5. Penetapan kadar kapsaisin
a. Pembuatan fase gerak, fase gerak yang digunakan pada penelitian ini yaitu campuran toluen - kloroform - aseton (45:25:30) v/v . Fase gerak dituang dalam bejana kromatografi kemudian kertas saring dimasukkan dalam bejana yang berisi fase gerak. Bejana ditutup rapat dan dibiarkan hingga seluruh kertas saring terbasahi oleh fase gerak.
b. Pembuatan larutan stok kapsaisin, baku kapsaisin ditimbang seksama sebanyak 1,0 mg dan dimasukkan dalam labu takar 10 mL, kemudian dilarutkan dengan metanol sampai tanda batas sehingga diperoleh larutan stok kapsaisin 0,1 mg/mL.
c. Pembuatan larutan seri baku kapsaisin, larutan stok kapsaisin ditotolkan dengan volume 1,25; 2,5; 5; dan 10 µl pada lempeng silika gel 60 F254 sehingga diperoleh seri baku kapsaisin 0,125; 0,25; 0,5; dan 1,0 µg.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
23
d. Pembuatan larutan uji, sejumlah 50,0 mg ekstrak etanol buah cabai rawit hijau ditimbang seksama kemudian dilarutkan dengan metanol sebanyak 500 µl. Larutan tersebut divortex selama 10 menit dengan pemanasan diatas waterbath pada suhu 60ºC. kemudian larutan disentrifugasi selama 2 menit dan disaring dengan ayakan mesh 60. Larutan uji dibuat replikasi sebanyak 3 kali.
e. Penetapan kadar kapsaisin ekstrak etanol buah cabai rawit hijau, sebanyak 10 L larutan uji ditotolkan pada lempeng silika gel F254, kemudian dikembangkan dalam bejana kromatografi yang telah dijenuhkan dengan fase gerak toluene - kloroform - aseton (45:25:30) v/v. Pengembangan dilakukan setinggi 10 cm, lempeng silika kemudian dikeluarkan dan ditunggu hingga kering. Bercak diamati di bawah lampu UV 254 nm kemudian dianalisis dengan densitometer pada panjang gelombang maksimum. Bercak seri baku kapsaisin diukur AUC-nya dengan densitometer pada panjang gelombang yang telah diperoleh. Puncak kromatogram dan nilai AUC yang muncul diamati. Dengan metode regresi linier, nilai seri kadar (µg/mL) diplotkan terhadap nilai AUC masing-masing seri larutan baku sehingga diperoleh persamaan y = bx + a dimana y merupakan nilai respon (AUC), x merupakan konsentrasi senyawa baku, a adalah intersep dan b adalah slope. Kadar kapsaisin dalam sampel ditentukan berdasarkan persamaan kurva baku yang paling baik.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
24
F. Analisis hasil
1. Penentuan aktivitas antioksidan ekstrak etanol buah cabai rawit hijau
dengan metode DPPH
Aktivitas penangkapan radikal DPPH (%) dihitung dengan rumus:
bsorbansilarutan kontrol – bsorbansilarutan baku uji
bsorbansilarutan kontrol
x 100%
Data aktivitas tersebut dianalisis dan dihitung nilai IC50
menggunakan persamaan regresi linier dengan sumbu x adalah konsentrasi larutan uji maupun baku sedangkan sumbu y adalah % IC. Lalu dianalisis secara statistik Mann-Whitney.
2. Penetapan kadar kapsaisin
Uji kadar kapsaisin dilakukan secara kromatografi lapis tipis. Nilai kadar tersebut diperoleh dari analisis data kromatogram dengan menggunakan densitometer. Analisis kualitatif dilakukan dengan membandingkan nilai Rf sampel dengan nilai Rf baku. Analisis kuantitatif dilakukan berdasarkan data AUC dari baku sehingga diperoleh persamaan regresi linier y = bx + a yang merupakan hubungan antara kadar dengan luas area yang dihasilkan. Data AUC sampel kemudian dimasukkan dalam persamaan regresi masing-masing baku sebagai y sehingga diperoleh kadar kapsaisin dalam sampel.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
25
BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi Tanaman
Determinasi tanaman bertujuan untuk memastikan kebenaran identitas tanaman yang akan digunakan serta menghindari terjadinya kesalahan dalam pengambilan sampel. Determinasi buah cabai rawit hijau dilakukan dengan membandingkan beberapa spesies dari Capsicum yang mengacu pada Bosland, Bailey, Iglesias-Olivas (1996).
Pembuktian determinasi buah cabai rawit hijau dilakukan dengan membandingkan pengamatan morfologi dari buah dengan karakteristik spesies Capsicum sesuai dengan literatur, yaitu panjang buah 3 – 4 cm, lebar buah kurang dari 1 cm, tegak lurus dan warna buah hijau. Dari hasil determinasi buah cabai rawit hijau, telah dibuktikan bahwa buah yang digunakan pada penelitian ini adalah buah cabai rawit hijau (Capsicum frutescens L.)
B. Hasil Pengumpulan Bahan
Buah cabai rawit hijau diperoleh dari Pasar Beringharjo, Yogyakarta pada bulan September 2012. Pengumpulan bahan diambil dari seorang pedagang, hal ini bertujuan untuk mengurangi variasi waktu panen yang dapat berpengaruh terhadap variasi kandungan senyawa aktif pada buah cabai rawit hijau.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
26
C. Hasil Preparasi Sampel
Tujuan dari ekstraksi adalah untuk menarik kandungan kimia/zat aktif yang dapat larut sehingga terpisah dari bahan yang tidak larut dalam pelarut cair yang sesuai. Dalam ekstraksi ini yang diharapkan adalah menarik senyawa kapsaisin yang ada dalam serbuk cabai rawit hijau. Hasil dari ekstraksi berupa ekstrak cair.
Dalam penelitian ini metode ekstraksi yang digunakan adalah metode soxhletasi. Prinsip dari soxhletasi adalah ekstraksi menggunakan pelarut yang selalu baru secara kontinyu dengan adanya pendingin balik menghasilkan jumlah pelarut yang konstan. Digunakan metode soxhletasi karena menurut Kristanti (cit., Kurniawan, 2008), metode yang digunakan untuk mengekstraksi kapsaisin adalah menggunakan metode ekstraksi berulang secara otomatis selama delapan jam pada suhu 60ºC. Pelarut yang digunakan dalam proses ekstraksi adalah etanol 96% karena kapsaisin memiliki kelarutan yang baik dalam etanol. Sebelum diekstraksi, sampel dikeringkan menggunakan oven pada suhu 50ºC, setelah kering, sampel dihaluskan menggunakan blender dan diayak untuk memperkecil ukuran partikel dan memperoleh derajat kehalusan yang sama. Proses ekstraksi dilakukan dengan memasukkan serbuk yang telah dibungkus ke dalam alat soxhlet, kemudian pelarut etanol dituang ke dalamnya, kemudian dipanaskan. Tujuan adanya pemanasan ini adalah untuk menguapkan pelarut dan dengan adanya pendingin balik maka akan terbentuk embun, sehingga proses ekstraksi dilakukan dengan menggunakan pelarut yang selalu baru.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
27
Hasil dari ekstraksi adalah larutan berwarna hijau lumut. Larutan tersebut kemudian dipekatkan menggunakan vacuum rotary evaporator pada suhu 60ºC supaya didapatkan ekstrak kental. Prinsip dari alat vacuum rotary evaporator adalah dengan adanya penurunan tekanan udara maka titik didih larutan akan semakin menurun. Penurunan titik didih akan mempercepat penguapan pelarut etanol. Bobot ekstrak kental yang diperoleh sebanyak 2,43 g, sehingga diperoleh rendemen sebesar 8,1%.
D. Hasil Uji Pendahuluan
Uji pendahuluan bertujuan untuk mengetahui aktivitas antioksidan secara kualitatif. Uji pendahuluan ini dilakukan dengan mereaksikan radikal bebas berupa senyawa DPPH dengan senyawa kapsaisin. Adanya perubahan warna ungu, yang merupakan warna senyawa DPPH menunjukkan bahwa senyawa kapsaisin memiliki aktivitas antioksidan.
[image:46.595.97.514.276.722.2]Uji pendahuluan dilakukan dengan menggunakan 3 larutan, yaitu larutan A yang berisi baku kapsaisin dan DPPH, larutan B yang berisi larutan DPPH dan larutan C yang berisi ekstrak etanol buah cabai rawit hijau dan DPPH.
Gambar 3. Hasil Uji Pendahuluan
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
28
Hasil pengujian menunjukkan hasil positif karena terjadi perubahan warna ungu jika dibandingkan dengan larutan DPPH, sehingga ekstrak etanol buah cabai rawit hijau memiliki aktivitas antioksidan.
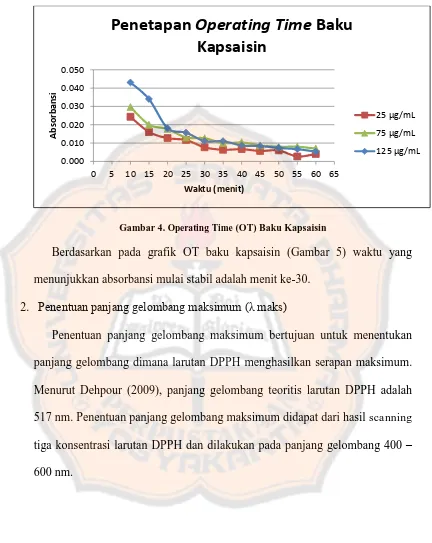
E. Hasil Optimasi Metode Uji Aktivitas Antioksidan 1. Penentuan Operating Time (OT)
Operating Time (OT) adalah waktu dimana reaksi antara senyawa yang memiliki aktivitas antioksidan dan larutan DPPH sudah berjalan sempurna yang ditunjukkan dengan absorbansi yang stabil. Pengukuran OT dilakukan dengan mengukur absorbansi larutan DPPH yang sudah direaksikan dengan larutan baku kapsaisin konsentrasi 25, 75 dan 125 µg/mL. Pengukuran dilakukan setiap 5 menit selama 60 menit dengan menggunakan spektrofotometer visibel dan dilakukan pada panjang gelombang maksimal yang telah ditentukan, yaitu 517,5 nm. Karena absorbansi terus mengalami penurunan, maka penentuan OT dilakukan dengan menghitung selisih penurunan absorbansi yang mendekati stabil setiap 5 menit sampai 60 menit dan kemudian dibuat grafik supaya dapat diketahui waktu dimana absorabansi stabil.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
29
Gambar 4. Operating Time (OT) Baku Kapsaisin
Berdasarkan pada grafik OT baku kapsaisin (Gambar 5) waktu yang menunjukkan absorbansi mulai stabil adalah menit ke-30.
2. Penentuan panjang gelombang maksimum ( maks)
Penentuan panjang gelombang maksimum bertujuan untuk menentukan panjang gelombang dimana larutan DPPH menghasilkan serapan maksimum. Menurut Dehpour (2009), panjang gelombang teoritis larutan DPPH adalah 517 nm. Penentuan panjang gelombang maksimum didapat dari hasil scanning tiga konsentrasi larutan DPPH dan dilakukan pada panjang gelombang 400 – 600 nm.
0.000 0.010 0.020 0.030 0.040 0.050
0 5 10 15 20 25 30 35 40 45 50 55 60 65
A
b
so
rb
a
n
si
Waktu (menit)
Penetapan
Operating Time
Baku
Kapsaisin
25 µg/mL
75 µg/mL
125 µg/mL
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
30
Tabel III. Hasil Scanning Panjang Gelombang Maksimum DPPH
Konsentrasi DPPH (mM)
maksimum hasil scanning
(nm) Rata-rata maksimum
0,02 517,5
517,5 nm
0,04 517,0
0,08 518,0
Hasil scanning tiga konsentrasi larutan DPPH didapatkan hasil panjang gelombang maksimum rata-rata adalah 517,5 nm (Tabel III). Panjang gelombang ini berbeda dengan panjang gelombang maksimum teoritis DPPH, yaitu 517 nm. Hal ini diperbolehkan sesuai dengan ketentuan yang tercantum dalam Farmakope Indonesia IV (1995), dimana batas pergeseran yang diperkenankan adalah maksimum sebesar 2 nm. Oleh karena itu, panjang gelombang maksimum yang digunakan pada penelitian ini adalah 517,5 nm.
F. Hasil Validasi Metode Uji Aktivitas Antioksidan
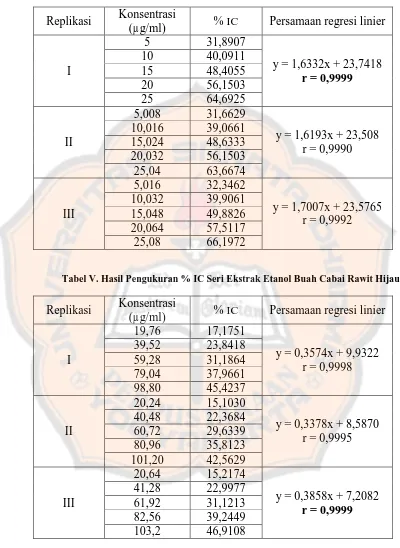
Pengujian validasi metode dilakukan dengan menggunakan baku kapsaisin dan ekstrak etanol buah cabai rawit hijau masing-masing sebanyak 3 replikasi. Hasil pengujian akan diperoleh 3 persamaan regresi linier antara konsentrasi larutan baku kapsaisin dan larutan uji dengan % IC.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
31
Tabel IV. Hasil Pengukuran % IC Seri Baku Kapsaisin
Replikasi Konsentrasi
(µg/ml) % IC Persamaan regresi linier
I
5 31,8907
y = 1,6332x + 23,7418 r = 0,9999
10 40,0911
15 48,4055
20 56,1503
25 64,6925
II
5,008 31,6629
y = 1,6193x + 23,508 r = 0,9990 10,016 39,0661
15,024 48,6333 20,032 56,1503 25,04 63,6674
III
5,016 32,3462
y = 1,7007x + 23,5765 r = 0,9992 10,032 39,9061
[image:50.595.99.499.132.680.2]15,048 49,8826 20,064 57,5117 25,08 66,1972
Tabel V. Hasil Pengukuran % IC Seri Ekstrak Etanol Buah Cabai Rawit Hijau
Replikasi Konsentrasi
(µg/ml) % IC Persamaan regresi linier
I
19,76 17,1751
y = 0,3574x + 9,9322 r = 0,9998 39,52 23,8418
59,28 31,1864 79,04 37,9661 98,80 45,4237
II
20,24 15,1030
y = 0,3378x + 8,5870 r = 0,9995 40,48 22,3684
60,72 29,6339 80,96 35,8123 101,20 42,5629
III
20,64 15,2174
y = 0,3858x + 7,2082 r = 0,9999 41,28 22,9977
61,92 31,1213 82,56 39,2449 103,2 46,9108
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
32
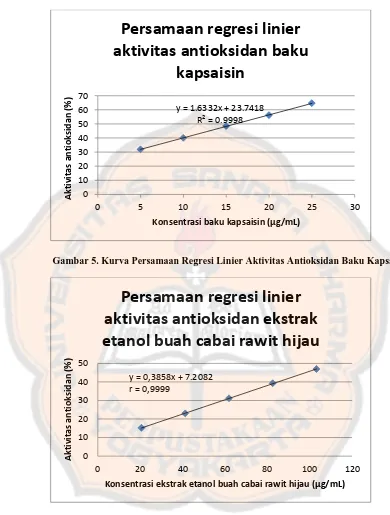
[image:51.595.99.489.106.621.2]Gambar 5. Kurva Persamaan Regresi Linier Aktivitas Antioksidan Baku Kapsaisin
Gambar 6. Kurva Persamaan Regresi Linier Aktivitas Antioksidan Ekstrak Etanol Buah Cabai Rawit Hijau
Gambar 5 dan 6 menunjukkan korelasi yang baik antara konsentrasi baku kapsaisin dan ekstrak etanol buah cabai rawit hijau dengan %IC. Hal ini ditunjukkan dengan nilai r mendekati 1 yang berarti semakin besar konsentrasi
y = 1.6332x + 23.7418 R² = 0.9998
0 10 20 30 40 50 60 70
0 5 10 15 20 25 30
A kt iv it a s a n ti o k si d a n ( % )
Konsentrasi baku kapsaisin (µg/mL)
Persamaan regresi linier
aktivitas antioksidan baku
kapsaisin
0 10 20 30 40 500 20 40 60 80 100 120
A kt iv it a s a n ti o k si d a n ( % )
Konsentrasi ekstrak etanol buah cabai rawit hijau (µg/mL)
Persamaan regresi linier
aktivitas antioksidan ekstrak
etanol buah cabai rawit hijau
y = 0,3858x + 7.2082 r = 0,9999
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
33
baku kapsaisin maupun ekstrak etanol buah cabai rawit hijau maka semakin besar pula % IC yang dihasilkan.
Analisis presisi (nilai Coefficient of Variation) dan akurasi (nilai Recovery) seri baku kapsaisin menggunakan persamaan regresi linier dari replikasi I, yaitu y = 1,6332x + 23,7418 (Tabel IV) sedangkan untuk ekstrak etanol buah cabai rawit hijau menggunakan persamaan regresi linier dari replikasi III, yaitu y = 0,3858x + 7,2082 (Tabel V) karena nilai r yang dihasilkan merupakan yang paling baik (1 atau -1) dari ketiga replikasi yang telah dilakukan. 1. Linieritas
Hasil dari tiga replikasi yang dilakukan pada baku kapsaisin dan ekstrak etanol buah cabai rawit hijau menunjukkan bahwa koefisien korelasi yang paling baik pada baku kapsaisin sebesar r = 0,9999 (replikasi I), sedangkan pada ekstrak etanol buah cabai rawit hijau sebesar r = 0,9999 (replikasi III). Nilai r yang memenuhi persyaratan linieritas yang baik menurut Mulja dan Hanwar (2003) adalah lebih besar 0,999, sehingga nilai r yang diperoleh dalam penelitian ini masih dapat diterima karena masih berada diatas nilai r yang dipersyaratkan. Hal ini menunjukkan bahwa metode yang digunakan dalam penelitian ini mempunyai linieritas yang baik untuk analisis baku kapsaisin dan ekstrak etanol buah cabai rawit hijau.
2. Akurasi
Akurasi dinyatakan dengan nilai % recovery. Nilai % recovery diperoleh dari data hubungan antara seri konsentrasi baku kapsaisin dan ekstrak etanol buah cabai rawit hijau dengan aktivitas antioksidan yang dihasilkan. Tabel
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
34
[image:53.595.100.536.191.617.2]berikut menunjukkan % recovery baku kapsaisin dan ekstrak etanol buah cabai rawit hijau.
Tabel VI. Hasil % recovery dan % CV Uji Aktivitas Antioksidan Baku Kapsaisin
Konsentrasi Teoritis (µg/ml)
% IC (%)
Konsentrasi Terukur (µg/ml)
Rata – rata Konsentrasi
Terukur (µg/ml)
SD % CV (%)
% recovery
(%) Larutan Baku 1
5 31.8907 4.9895
5,0360 0,2131 4,2313
99,7901
5,008 31,6629 4,8500 96,8457
5,016 32,3462 5,2685 105,0330
Larutan Baku 2 10 40,0911 10,0106
9,7639 0,3345 3,4257
100,1060
10,016 39,0661 9,3820 93,6798
10,032 39,9061 9,8973 98,6575
Larutan Baku 3 15 48,4055 15,1014
15,4494 0,4870 3,1520
100,6762
15,024 48,6333 15,2409 101,4438
15,048 49,8826 16,0059 106,3656
Larutan Baku 4 20 56,1503 19,8436
20,1215 0,4813 2,3919
99,2179
20,032 56,1503 19,8436 99,0594
20,064 57,5117 20,6772 103,0560
Larutan Baku 5 25 64,6925 25,0739
25,1718 0,7791 3,0950
100,2956
25,04 63,6674 24,4463 97,6288
25,08 66,1972 25,9952 103,6492
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
35
Tabel VII. Hasil % recovery dan % CV Uji Aktivitas Antioksidan Ekstrak Etanol Buah Cabai Rawit Hijau
Konsentrasi Teoritis (µg/ml)
% IC (%)
Konsentrasi Terukur (µg/ml)
Rata – rata Konsentrasi
Terukur (µg/ml)
SD % CV (%)
% recovery
(%) Larutan Uji 1
19,76 17,1751 25,8345
22,3526 3,0190 13,5063
130,7413
20,24 15,1030 20,4634 101,1037
20,64 15,2174 20,7600 100,5812
Larutan Uji 2 39,52 23,8418 43,1146
41,1123 1,9163 4,6611
109,0956
40,48 22,3684 39,2955 97,0740
41,28 22,9977 40,9267 99,1441
Larutan Uji 3 59,28 31,1864 62,1520
60,7543 2,2762 3,7466
104,8448
60,72 29,6339 58,1277 95,7307
61,92 31,1213 61,9831 100,1019
Larutan Uji 4 79,04 37,9661 79,7250
78,9690 4,4965 5,6940
100,8666
80,96 35,8123 74,1424 91,5791
82,56 39,2449 83,0395 100,5808
Larutan Uji 5 98,80 45,4237 99,0553
97,8683 5,7278 5,8526
100,2584
101,2 42,5629 91,6400 90,5534
103,2 46,9108 102,9097 99,7187
Persyaratan rentang % recovery yang baik menurut Harmita (2004) untuk analit dengan kadar 0,01% sebesar 90% - 107%. Dari data yang ditunjukkan pada Tabel VI rentang % recovery baku kapsaisin adalah 93,68% - 106,37% yang telah memenuhi syarat % recovery yang dapat diterima. Hal ini menunjukkan bahwa metode yang digunakan telah memberikan akurasi yang baik.
Persyaratan rentang % recovery yang baik menurut APVMA (cit., Angela, 2012) untuk analit sebesar 0,1% - 1% yaitu 80% - 120%. Dari data yang ditunjukkan pada Tabel VII semua data memenuhi syarat % recovery yang
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
36
dapat diterima, walaupun pada konsentrasi 19,76 µg/ml tidak memenuhi % recovery, namun pada konsentrasi lainnya memenuhi syarat % recovery, sehingga dapat disimpulkan bahwa metode yang digunakan memiliki akurasi yang baik.
3. Presisi
Presisi dinyatakan dengan nilai CV (Coevicient of Variation). Semakin kecil nilai CV maka presisi suatu metode tersebut akan semakin baik.
Persyaratan rentang CV yang baik menurut APVMA (cit., Angela, 2012) untuk analit dengan kadar < 0,01% sebesar ≤ 20%. Dari data yang ditunjukkan pada Tabel VI dan VII menunjukkan nilai CV memenuhi syarat. Hal ini menunjukkan bahwa metode yang digunakan memiliki presisi yang baik. 4. Spesifisitas
Uji spesifisitas dilakukan dengan mengukur absorbansi larutan etanol yang digunakan sebagai pelarut, kapsaisin, larutan ekstrak etanol buah cabai rawit hijau pada panjang gelombang 517,5 nm yang merupakan panjang gelombang maksimum DPPH. Hasil pengukuran dari ketiga larutan tersebut tidak terdapat serapan. Hal ini menunjukkan bahwa metode yang digunakan spesifik terhadap DPPH.
G. Hasil Estimasi Aktivitas Antioksidan dengan Radikal DPPH Pengujian terhadap daya antioksidan ekstrak etanol buah cabai rawit hijau dilakukan dengan metode DPPH (1,1-difenil-2-pikrilhidrazil). DPPH merupakan suatu senyawa yang tidak stabil yang akan tereduksi oleh adanya proses donor
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
37
hidrogen yang akan mengubah warna ungu menjadi kuning. Senyawa yang mampu memberikan efek ini dipertimbangkan memiliki daya antioksidan (Halliwell and Gutteridge, 2000).
[image:56.595.105.509.210.561.2]Reaksi umum yang terjadi saat penangkapan DPPH oleh senyawa antioksidan, yaitu sebagai berikut
Gambar 7. Penangkapan DPPH oleh Senyawa Antioksidan (Windono, Soediman, Yudawati, Ermawati, Srielita dan Erowati, 2001)
Salah satu senyawa yang terkandung di dalam buah cabai rawit hijau adalah kapsaisin. Senyawa kapsaisin memiliki gugus OH yang dapat mendonorkan atom hidrogennya untuk radikal bebas DPPH sehingga dapat diketahui daya antioksidannya. Mekanisme penghambatan radikal bebas oleh
kapsaisin ditunjukkan Gambar 8, DPPH dilambangkan sebagai R•. danya
senyawa kapsaisin yang memiliki gugus OH akan mendonorkan atom hidrogen pada elektron bebas DPPH sehingga senyawa radikal DPPH dapat bersifat netral. Penangkapan atom H ini akan menimbulkan perubahan warna pada DPPH yang semula berwarna ungu akan berubah menjadi kuning.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
38 O CH3 O H N H O CH3 CH3 R + O CH3 O N H O CH3 CH3 + RH
Gambar 8. Mekanisme Penghambatan Radikal Bebas DPPH oleh Senyawa Kapsaisin
Untuk mengetahui aktivitas antioksidan suatu senyawa dengan metode DPPH, parameter yang digunakan adalah IC50. Parameter yang dipakai untuk
menunjukan aktivitas antioksidan adalah harga konsentrasi efisien atau efficient concentration (EC50) atau Inhibition Concentration (IC50) yaitu konsentrasi suatu
zat antioksidan yang memberikan penghambatan 50%. Zat yang mempunyai aktivitas antioksidan tinggi, akan mempunyai harga EC50 atau IC50 yang rendah
(Brand-Williams, 1995).
Hasil pengukuran IC50 untuk baku kapsaisin dan ekstrak etanol buah cabai
rawit hijau adalah sebagai berikut
Tabel VIII. Hasil IC50 Baku Kapsaisin dan Ekstrak Etanol Buah Cabai Rawit Hijau
Larutan
IC50 (µg/mL)
SD CV
(%) Replikasi
Rata-rata
I II III
Baku
Kapsaisin 16,0778 16,3601 15,5368 15,9961 4,1837 2,6162 Ekstrak
etanol buah cabai rawit
hijau
112,1091 122,5962 110,9168 115,2074 6,4266 5,5783
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
[image:57.595.127.496.114.322.2]39
Dari Tabel VIII, CV yang dihasilkan untuk baku kapsaisin adalah 2,6162% dan ekstrak etanol buah cabai rawit hijau adalah 5,5783% sehingga CV memenuhi
persyaratan yaitu ≤ 20%. Hasil IC50 untuk baku kapsaisin 15,9916±4,1827 µg/mL
dan ekstrak etanol buah cabai rawit hijau 115,2074±5,5783 µg/mL. Penggolongan kekuatan aktivitas antioksidan berdasarkan nilai IC50, yaitu lemah (151 – 200
µg/mL), sedang (100 – 150 µg/mL), kuat (50 – 100 µg/mL) dan sangat kuat (< 50 µg/mL) (Ariyanto cit Angela, 2012). Berdasarkan penggolongan tersebut, aktivitas antioksidan baku kapsaisin termasuk golongan sangat kuat dan aktivitas antioksidan ekstrak etanol buah cabai rawit hijau termasuk golongan sedang.
H. Penetapan Kadar Kapsaisin
Penetapan kadar kapsaisin dilakukan dengan metode kromatografi lapis tipis (KLT) – densitometri. Prinsip metode KLT adalah berdasarkan adanya perbedaan interaksi senyawa yang diuji dengan fase diam dan fase gerak. Sedangkan prinsip densitometri adalah suatu analisis kuantitatif yang berdasarkan pada interaksi radiasi elektromagnetik dengan analit yang merupakan bercak KLT (Rohman, 2009). Digunakan metode KLT – densitometri karena mudah dilakukan dan dapat dilakukan analisis kualitatif dan kuantitatif secara bersamaan.
Sistem kromatografi yang digunakan adalah sistem dengan fase normal dimana fase diam yang digunakan bersifat polar sedangkan fase geraknya bersifat non polar. Fase diam yang digunakan adalah silika gel 60 F254 dan fase gerak yang digunakan adalah campuran antara toluen - kloroform - aseton (45:25:30) v/v yang diperoleh dari Laboratorium Hayati Universitas Gajah Mada. Pemisahan kapsaisin
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
40
[image:59.595.98.523.221.527.2]dengan senyawa lain yan terkandung dalam ekstrak etanol cabai rawit hijau dapat terjadi karena adanya perbedaan interaksi masing-masing senyawa dengan fase diam maupun fase gerak. Kapsaisin yang bersifar non polar akan lebih berinteraksi dengan fase gerak yang juga bersifat non polar sehingga kapsaisin akan terelusi. Interaksi antara kapsaisin dengan fase diam adalah interaksi hidrogen (Gambar 9).
Gambar 9. Interaksi Kapsaisin dengan Fase Diam Silika Gel 60 F254
Pertama-tama dilakukan analisis kualitatif dengan membandingkan nilai Rf baku dan Rf sampel. Nilai Rf baku dan sampel adalah sebagai berikut
Tabel IX. Nilai Rf Baku Kapsaisin dan Ekstrak Etanol Buah Cabai Rawit Hijau
Sampel Rf
Baku kapsaisin 0,61
Ekstrak etanol buah cabai rawit
hijau 0,61
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
[image:59.595.164.437.584.646.2]41
Dari Tabel IX, didapatkan bahwa nilai Rf baku kapsaisin dan Rf ekstrak etanol buah cabai rawit hijau sama, yaitu 0,61 maka dapat dikatakan bahwa kedua senyawa tersebut me