UJI AKTIVITAS ANTIOKSIDAN DAN PENETAPAN KADAR FENOLIK TOTAL EKSTRAK ETANOL BUAH BUNI (Antidesma bunius (L.) Spreng) DENGAN METODE 2,2-diphenyl-1-picrylhydrazyl (DPPH) DAN METODE
FOLIN-CIOCALTEU Margareta Novi Wijayanti
128114117 INTISARI
Radikal bebas merupakan suatu atom atau molekul yang memiliki satu atau lebih elektron yang tidak berpasangan, sehingga relatif tidak stabil yang dapat menimbulkan berbagai macam penyakit. Antioksidan adalah senyawa yang dapat menghambat reaksi oksidasi dengan mengikat radikal bebas dan molekul yang sangat reaktif, akibatnya kerusakan sel dapat dihambat.
Belakangan ini banyak penelitian yang menunjukkan bahwa antioksidan sintetik seperti butylated hydroxyanisole (BHA) dan butylated hydroxytoluene (BHT) dalam dosis besar dapat menyebabkan penyakit seperti gangguan fungsi ginjal dan hati, kanker, dan reaksi alergi. Oleh karena itu penelitian terkait bahan alam yang efektif, tidak toksik, dan memiliki aktivitas sebagai antioksidan semakin gencar dilakukan.
Buah buni (Antidesma bunius (L.) Spreng) dilaporkan mempunyai kandungan senyawa fenolik yang mempunyai aktivitas antioksidan. Senyawa- senyawa yang berperan sebagai antioksidan yaitu asam fenolik, antosianin dan flavonoid. Etanol dapat menyari berbagai macam senyawa fenolik seperti polifenol, flavonoid, antosianin dan tanin. Sehingga tujuan dari penelitian ini adalah untuk menetapkan kandungan fenolik total dan menguji aktivitas antioksidan ekstrak etanol buah buni.
Hasil penelitian menunjukkan bahwa ekstrak etanol buah buni mempunyai kandungan fenolik total sebesar 0,2794 ± 0,0048 mg GAE/g ekstrak etanol buah buni yang diukur dengan metode Folin-Ciocalteu. Sedangkan ekstrak etanol buah buni mempunyai aktivitas antioksidan dengan IC50 sebesar 2049,7099 ± 91,2742 μg/mL yang diukur dengan metode DPPH.
ANTIOXIDANT ACTIVITY ASSAY AND DETERMINATION OF TOTAL PHENOLIC CONTENT OF ETHANOLIC EXTRACT BUNI FRUITS (Antidesma bunius (L.) Spreng) USING 2,2-diphenyl-1-picrylhydrazyl (DPPH)
AND FOLIN-CIOCALTEU Margareta Novi Wijayanti
128114117 ABSTRACT
A free radical is an atom or molecule having one or more unpaired electrons. It is relatively unstable which cause various diseases. Antioxidants are compounds that can inhibit oxidation reactions by binding free radicals and highly reactive molecules, resulting in inhibited of cell damage.
Lately, many studies show that synthetic antioxidants such as butylated hydroxyanisole (BHA) and butylated hydroxytoluene (BHT) in large doses can cause diseases such as kidney and liver function disorders, cancer, and allergic reactions. Therefore, the research related to the natural ingredients that are effective, non-toxic, and have antioxidant activity more intensively conducted.
Berry (Antidesma bunius (L.) Spreng) has been reported to have phenolic compounds. Phenolic compounds are potent sources of natural antioxidants. Compounds that act as antioxidants are phenolic acids, anthocyanins and flavonoids. Ethanol can extract wide range of phenolic compounds such as polyphenols, flavonoids, antocyanin and tanin. Therefore, the purpose of this study was to specify a total phenolic content and antioxidant activity of ethanol extract test of buni fruits.
The results showed that the ethanolic extract of berry fruits obtained total phenolic content of 0.2794 ± 0.0048 mg GAE/g of ethanol extract of berry fruit as measured by the Folin-Ciocalteu method. While the berry fruit ethanol extract has antioxidant activity with IC50 2049.7099 ± 91.2742 mg/mL as measured by DPPH method.
UJI AKTIVITAS ANTIOKSIDAN DAN PENETAPAN KADAR FENOLIK
TOTAL EKSTRAK ETANOL BUAH BUNI (Antidesma bunius (L.) Spreng)
DENGAN METODE 2,2-diphenyl-1-picrylhydrazyl (DPPH) DAN METODE
FOLIN-CIOCALTEU
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Margareta Novi Wijayanti NIM : 128114117
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
UJI AKTIVITAS ANTIOKSIDAN DAN PENETAPAN KADAR FENOLIK
TOTAL EKSTRAK ETANOL BUAH BUNI (Antidesma bunius (L.) Spreng)
DENGAN METODE 2,2-diphenyl-1-picrylhydrazyl (DPPH) DAN METODE
FOLIN-CIOCALTEU
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Margareta Novi Wijayanti NIM : 128114117
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
I can do all this through Him who gives me strength.
- Philippians
4:13-“When you look closely to the path you have travel on, you will realise that God was always with you, directing every step you took.”
-Lailah Gifty
Akita-“Life will always have a different plan for you. If you don’t give up, you will eventually get to your destination. But towards the end of your life, you may look back and realize that it was never really about the destination; it was the journey that counted.”
-King Samuel Benson-
Kupersembahkan skripsi ini untuk :
- Tuhan Yesus yang selalu membimbing dan memudahkan dalam setiap langkahku
- Kedua orang tua dan kakak yang selalu mendukung dan mendoakan
- Teman – teman yang selalu memberi semangat
vii
PRAKATA
Puji syukur penulis panjatkan kepada Tuhan atas berkat dan
bimbingan-Nya penulis dapat menyelesaikan Skripsi yang berjudul “Uji Aktivitas Antioksidan Dan Penetapan Kadar Fenolik Total Ekstrak Etanol Buah Buni (Antidesma bunius (L.) Spreng) Dengan Metode 2,2-diphenyl-1-picrylhydrazyl
(DPPH) Dan Metode Folin Ciocalteu” ini dengan baik. Skripsi ini disusun untuk memenuhi salah satu syarat memperoleh gelar Sarjana Strata Satu Program Studi Farmasi, Fakultas Farmasi, Universitas Sanata Dharma.
Penulis mengalami berbagai macam kesulitan dan masalah dalam proses pengerjaan Skripsi ini. Kesulitan dan masalah ini dapat diatasi penulis dengan bantuan dari segala pihak. Oleh karena itu penulis hendak mengucapkan terima kasih kepada :
1. Aris Widayati, M.Si., Ph.D., Apt., selaku Dekan Fakultas Farmasi Universitas
Sanata Dharma.
2. Prof. Dr. C.J. Soegihardjo, Apt., selaku Dosen Pembimbing Utama dan
Dosen Penguji Skripsi atas segala kesabaran dan masukan sehingga Skripsi ini dapat diselesaikan dengan baik.
3. Dr. Erna Tri Wulandari, M.Si., Apt.,selaku Dosen Pembimbing Pendamping
dan Dosen Penguji Skripsi atas segala kesabaran dan masukan sehingga Skripsi ini dapat diselesaikan dengan baik.
4. Dr. Yustina Sri Hartini, M.Si., selaku Dosen Penguji Skripsi atas masukkan,
kritik, dan saran kepada penulis dalam penyusunan Skripsi ini.
5. Florentinus Dika Octa Riswanto, M.Sc selaku Dosen Penguji Skripsi atas
masukkan, kritik, dan saran kepada penulis dalam penyusunan Skripsi ini.
6. Agustina Setiawati, M.Sc., Apt., selaku Kepala Laboratorium Fakultas
Farmasi yang telah memberikan izin dalam penggunaan laboratorium.
7. Pak Wagiran selaku Laboran Laboratorium Farmakognosi - Fitokimia, Pak
viii
Tanaman Obat atas segala bantuan dan kerja samanya selama proses penelitian.
8. Ayah, Ibu dan Kakak yang selalu memotivasi dan mendukung penulis dalam
menyelesaikan skripsi ini.
9. Astrid Pangestuty, selaku teman seperjuangan dalam menyelesaikan Skripsi
ini.
10. Grace Shelia P.P, Veronika Novaliana S.D., Monika M.W., dan Agnes Serlyta
sebagai sahabat yang selalu memberikan semangat dalam penyusunan skripsi ini.
11. Bertha, Ossa, Kristi, Noven, dan Astrid sebagai sahabat yang selalu
mendukung dalam penyusunan skripsi ini.
12. Teman – teman satu kelompok praktikum Meda, Berto, Desion, Rosa, Agata,
Tika, dan teman – teman lain yang selalu mendukung dalam menyusun skripsi ini.
13. Kelurga besar kos Griya Kanna Putri, Cindya, Macho, Gery, Edward,
Andrew, Tasya, Mala, Bertha, Nanda, David, Yosef, dan teman – teman yang selalu mendukung dan memberikan semangat.
14. Teman-teman FST B 2012, FSM C 2012 dan teman-teman Fakultas Farmasi
Sanata Dharma angkatan 2012 yang selalu memberikan dukungan dan semangat dalam penyusunan Skripsi ini.
15. Semua pihak yang telah membantu dan memberikan dukungan yang tidak
dapat disebutkan satu per satu.
Penulis menyadari bahwa Skripsi ini masih memiliki kekurangan dalam berbagai macam hal. Untuk itu penulis mengharapkan kritik dan saran yang membangun dari segala pihak. Semoga Skripsi ini dapat berguna bagi seluruh pembaca.
Yogyakarta, 19 Agustus 2016
ix
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... vi
PRAKATA... ... vii
5. Aktivitas farmakologis ... 10
B. Ekstraksi ... 10
x
D. Radikal Bebas... 13
E. Senyawa Antioksidan ... 14
F. Metode Folin-Ciocalteu ... 15
G. Metode DPPH ... 16
H. Spektrofotometri Visibel ... 17
I. Landasan Teori ... 18
J. Hipotesis ... 20
BAB III METODOLOGI PENELITIAN... 21
A. Jenis dan Rancangan Penelitian ... 21
B. Variabel dan Definisi Operasional ... 21
1. Klasifikasi variabel ... 21
5. Skrining fitokimia ekstrak etanol 96% buah buni ... 25
xi
6. Penentuan kandungan fenolat total ... 28
7. Penentuan aktivitas antioksidan ... 30
F. Analisis Data ... 32
BAB IV HASIL DAN PEMBAHASAN ... 33
A. Hasil Determinasi Tanaman ... 33
B. Hasil Pengumpulan Bahan ... 33
C. Hasil Preparasi Sampel ... 34
D. Uji Pendahuluan Ekstrak Etanol Buah Buni ... 35
1. Uji pendahuluan keberadaan senyawa fenolik ... 35
2. Uji pendahuluan keberadaan senyawa antioksidan ... 37
E. Hasil Uji Skrining Fitokimia Ekstrak Etanol 96% Buah Buni ... 38
a. Uji saponin ... 40
F. Hasil Optimasi Metode Uji Fenolik Total ... 45
1. Penentuan operating time ... 45
2. Penentuan panjang gelombang maksimum ... 47
G. Penetapan Kandungan Fenolik Total ... 48
H. Hasil Uji Aktivitas Antioksidan ... 53
1. Penentuan Operating Time (OT) ... 53
2. Penentuan panjang gelombang serapan maksimum ... 55
I. Hasil Uji Aktivitas Antioksidan ... 56
BAB V KESIMPULAN ... 64
A. Kesimpulan ... 64
B. Saran ... 64
xii
LAMPIRAN ... 72
BIOGRAFI PENULIS ... 103
DAFTAR PUSTAKA ... 65
LAMPIRAN ... 72
xiii DAFTAR TABEL
Halaman Tabel I. Hasil pengamatan uji tabung terhadap ekstrak etanol buah
buni ………....…... 39
Tabel II. Hasil scanning panjang gelombang maksimumasam
galat yang direaksikan dengan pereaksi Folin-Ciocalteu... 48 Tabel III. Hasil pengukuran absorbansi asam galat yang telah
direaksikan dengan reagen Folin-Ciocalteu pada 745 nm... 51 Tabel IV. Hasil penentuan jumlah fenolik total ekstrak etanol buah
Buni. ... 52 Tabel V. Hasil scanning panjang gelombang serapan maksimum
DPPH ... 56 Tabel VI. Hasil pengukuran aktivitas antioksidan dengan metode
DPPH ... 58 Tabel VII. Hasil pengukuran aktivitas antioksidan ekstrak etanol
xiv
Gambar 4. Reaksi penangkapan radikal DPPH oleh antioksidan ... 17
Gambar 5. Buah buni ... 34
Gambar 6. Hasil uji kualitatif senyawa fenolik pada ekstrak etanol buah buni ... 37
Gambar 7. Hasil uji kualitatif aktivitas antioksidan pada ekstrak etanol buah buni ... 38
Gambar 8. Reaksi flavonoid pada ekstrak etanol buah buni berdasarkan uji Shinoda ... 41
Gambar 9. Mekanisme umum reaksi Liebermann-Burchard ... 42
Gambar 10. Reaksi antara flavonoid dengan FeCl3 ... 44
Gambar 11. Perubahan struktur antosianin pada pH yang berberda ... 45
Gambar 12. Grafik penentuan Operating Time asam galat ... 47
Gambar 13. Reaksi asam galat dengan senyawa molybdenum dari reagen Folin-Ciocalteu ... 50
Gambar 14. Kurva baku asam galat dalam penetapan fenolik total (Replikasi 3) ... 51
Gambar 15. Grafik penentuan Operating Time rutin ... 55
Gambar 16. Kurva persamaan regresi linier aktivitas antioksidan rutin replikasi 3 ... 58
xv
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat determinasi tanaman ... 73
Lampiran 2. Gambar tanaman buah buni di taman Kampus III Universitas Sanata Dharma, Yogyakarta ... 74
Lampiran 3. Ekstrak etanol buah buni ... 74
Lampiran 4. Foto hasil uji saponin ... 75
Lampiran 5. Foto hasil uji flavonoid ... 75
Lampiran 6. Foto hasil uji triterpenoid dan steroid ... 76
Lampiran 7. Foto hasil uji minyak atsiri ... 76
Lampiran 8. Foto hasil uji alkaloid ... 77
Lampiran 9. Foto hasil uji tanin dan polifenol ... 77
Lampiran 10. Foto hasil uji antosianin... 78
Lampiran 11. Foto hasil uji antrakuinon ... 78
Lampiran 12. Perhitungan rendemen ekstrak etanol buah buni ... 79
Lampiran 13. Data penimbangan untuk penetapan kadar fenolik total ... 80
Lampiran 14. Data optimasi penetapan kandungan fenolik total... 81
Lampiran 15. Data penetapan kandungan fenolik total ... 85
aktivitas antioksidan Lampiran 16. Data penimbangan untuk pengujian aktivitas antioksidan ... 89
Lampiran 17. Data perhitungan konsentrasi DPPH, larutan pembanding dan larutan uji ... 90
Lampiran 18. Optimasi metode uji aktivitas antioksidan... 93
Lampiran 19. Uji aktivitas antioksidan menggunakan radikal DPPH ... 97
Lampiran 20. Perhitungan nilai IC50 rutin dan ekstrak etanol buah buni ... 100
xvi
INTISARI
Radikal bebas merupakan suatu atom atau molekul yang memiliki satu atau lebih elektron yang tidak berpasangan, sehingga relatif tidak stabil yang dapat menimbulkan berbagai macam penyakit. Antioksidan adalah senyawa yang dapat menghambat reaksi oksidasi dengan mengikat radikal bebas dan molekul yang sangat reaktif, akibatnya kerusakan sel dapat dihambat.
Belakangan ini banyak penelitian yang menunjukkan bahwa antioksidan sintetik seperti butylated hydroxyanisole (BHA) dan butylated hydroxytoluene (BHT)dalam dosis besar dapat menyebabkan penyakit seperti gangguan fungsi ginjal dan hati, kanker, dan reaksi alergi. Oleh karena itu penelitian terkait bahan alam yang efektif, tidak toksik, dan memiliki aktivitas sebagai antioksidan semakin gencar dilakukan.
Buah buni (Antidesma bunius(L.)Spreng) dilaporkan mempunyai kandungan senyawa fenolik yang mempunyai aktivitas antioksidan. Senyawa- senyawa yang berperan sebagai antioksidan yaitu asam fenolik, antosianin dan flavonoid. Etanol dapat menyari berbagai macam senyawa fenolik seperti polifenol, flavonoid, antosianin dan tanin. Sehingga tujuan dari penelitian ini adalah untuk menetapkan kandungan fenolik total dan menguji aktivitas antioksidan ekstrak etanol buah buni.
Hasil penelitian menunjukkan bahwa ekstrak etanol buah buni mempunyai kandungan fenolik total sebesar 0,2794 ± 0,0048 mg GAE/g ekstrak etanol buah buni yang diukur dengan metode Folin-Ciocalteu. Sedangkan ekstrak etanol buah buni mempunyai aktivitas antioksidan dengan IC50 sebesar 2049,7099 ±
91,2742μg/mL yang diukur dengan metode DPPH.
xvii
ABSTRACT
A free radical is an atom or molecule having one or more unpaired electrons.It is relatively unstable which cause various diseases. Antioxidants are compounds that can inhibit oxidation reactions by binding free radicals and highly reactive molecules, resulting in inhibited of cell damage.
Lately, many studies show that synthetic antioxidants such as butylated hydroxyanisole (BHA) and butylated hydroxytoluene (BHT) in large doses can cause diseases such as kidney and liver function disorders, cancer, and allergic reactions. Therefore, the research related to the natural ingredients that are effective, non-toxic, and have antioxidant activity more intensively conducted.
Berry (Antidesma bunius (L.) Spreng) has been reported to have phenolic compounds. Phenolic compounds are potent sources of natural antioxidants. Compounds that act as antioxidants are phenolic acids, anthocyanins and flavonoids.Ethanol can extract wide range of phenolic compounds such as polyphenols, flavonoids, antocyanin and tanin.Therefore, the purpose of this study was to specify a total phenolic content and antioxidant activity of ethanol extract test of buni fruits.
The results showed that the ethanolic extract of berry fruits obtained total phenolic content of 0.2794 ± 0.0048 mg GAE/g of ethanol extract of berry fruit as measured by the Folin-Ciocalteu method. While the berry fruit ethanol extract has antioxidant activity with IC50 2049.7099 ± 91.2742 mg/mL as measured by DPPH method.
1
BAB I
PENGANTAR
A. Latar Belakang
Di dalam tubuh kita setiap saat terjadi reaksi oksidasi sehingga memicu terbentuknya radikal bebas yang sangat aktif yang dapat merusak struktur dan fungsi sel. Tetapi reaktivitas radikal bebas tersebut dapat dihambat oleh sistem antioksidan yang melengkapi sistem kekebalan tubuh (Damayanthi et al., 2010). Oksidasi merupakan proses alami yang dapat terjadi ketika suatu zat berikatan dengan oksigen (Chawda, 2011).
Radikal bebas merupakan suatu molekul yang kehilangan elektron terluarnya yang dengan cepat dapat bereaksi dengan atom – atom atau senyawa – senyawa di lingkungannya (Droge, 2002). Radikal bebas terbentuk melalui suatu reaksi oksidasi. Kerusakan oksidatif yang ditimbulkan karena terpapar radikal bebas dapat menyebabkan penuaan dan beragam penyakit seperti arterosklerosis, diabetes, sirosis, dan kanker (Doss dan Thangavel, 2011).
bahan alam yang efektif, tidak toksik, dan memiliki aktivitas sebagai antioksidan semakin gencar dilakukan (Gupta dan Sharma, 2006).
Metode uji yang sering digunakan untuk penentuan kandungan fenolik total adalah metode Folin – Cioucalteu. Metode ini merupakan metode yang umum digunakan sebagai standar penentuan kandungan fenolik total karena merupakan metode yang cepat dan sederhana yang dinyatakan sebagai masa ekuivalen asam galat tiap mg sampel (Fu et al., 2011). Asam galat digunakan sebagai pembanding karena telah diketahui sebagai salah satu senyawa fenolik yang terdapat dalam tanaman, selain itu asam galat merupakan standar yang direkomendasikan untuk mendapatkan hasil yang reliabel karena mempunyai reaktivitas yang cukup tinggi terhadap reagen Folin-Ciocalteu (Prior et al., 2005). Prinsip metode ini adalah reaksi oksidasi senyawa fenol dalam suasana basa oleh pereaksi Folin – Ciocalteu menghasilkan kompleks berwarna biru yang memberikan serapan kuat pada panjang gelombang 760 nm. Peningkatan intensitas warna biru akan sebanding dengan jumlah senyawa fenolik yang ada dalam sampel (Blainski et al., 2013).
yang merupakan konsentrasi ekuivalen yang memberikan 50% efek aktivitas antioksidan (Dehpour et al., 2009).
Radikal DPPH memberikan serapan kuat pada panjang gelombang 517 nm dengan warna violet gelap. DPPH dapat memberikan serapan karena memiliki gugus kromofor dan auksokrom pada struktur kimianya dan dengan adanya delokalisasi elektron pada DPPH akan memberikan warna violet (Dehpour et al., 2009). Perubahan absorbansi akibat dari reaksi ini telah digunakan secara luas untuk menguji kemampuan beberapa molekul sebagai penangkap radikal bebas. Metode DPPH merupakan metode yang mudah, cepat, dan sensitif untuk pengujian aktivitas antioksidan senyawa tertentu atau ekstrak tumbuhan (Koleva et al., 2002).
Pelarut yang sering digunakan untuk mengekstraksi senyawa fenolik antara lain metanol, etanol, aseton dan etil asetat (Taroreh et al., 2015). Etanol tergolong pelarut yang memiliki sifat polar sehingga diharapkan mampu melarutkan sebagian besar senyawa fenolik dalam buah buni yang bersifat polar. Oleh karena itu peneliti menggunakan etanol sebagai pelarut dalam pembuatan ekstrak. Penggunaan etanol sebagai pelarut juga merupakan pengembangan penelitian yang pernah dilakukan Butkhup dan Samappito 2008 dan 2011.
di Thailand sedangkan penelitian ini menggunakan tanaman buni yang tumbuh di Indonesia.
B. Permasalahan
a. Berapakah kandungan fenolik total ekstrak etanol buah buni dalam massa ekivalen asam galat yang diukur dengan metode Folin - Ciocalteu?
b. Berapakah nilai aktivitas antioksidan ekstrak etanol buah buni dalam nilai IC50 yang diukur dengan metode DPPH?
C. Keaslian Penelitian
Penelitian menggunakan tanaman Antidesma bunius (L.)Sprengpernah dilakukan oleh :
a. Butkhup dan Samappito (2008) mengenai analisis total antosianin menggunakan spectrophotometric pH differential protocol dan komponen fenolik berupa (flavonoid, prosianidin, dan asam fenolik) menggunakan metode RP-HPLC-DAD (Reverse Phase High-Performance Liquid Chromatrography-Photodiode Detector), fenolik total dengan metode Folin-Ciocalteu dan aktivitas antioksidan menggunakan metode DPPH pada ekstrak metanol 50 % buah buni.
ditetapkan menggunakan metode DPPH. Hasil yang didapatkan adalah pada ekstrak metanol 60% buah buni matang mempunyai aktivitas antioksidan yang tinggi.
c. Butkhup dan Samappito (2011) melakukan penelitian mengenai penetapan total flavonoid, jumlah antosianin, total fenolik, aktivitas antibakteri dan aktivitas antioksidan menggunakan metode DPPH. Hasil yang diperoleh yaitu pada ekstrak metanol 60 % kulit buah buni mempunyai kandungan antosianin yang tinggi, sedangkan pada ektrak metanol 60 % biji buah buni mempunyai kandungan fenolik yang tinggi.
Perbedaan penelitian ini dengan penelitian – penelitian sebelumnya adalah pada tempat pengambilan sampel, pelarut etanol 96 % yang digunakan, dan cara ekstraksi buah buni.
D. Manfaat Penelitian
1. Manfaat teoritis. Hasil penelitian ini diharapkan dapat memberikan tambahan pengetahuan mengenai aktivitas antioksidan yang dinyatakan dengan IC50 dalam ekstrak etanol 96 % buah buni yang diukur dengan metode DPPH, sehingga hasil penelitian dapat menjadi acuan untuk penelitian selanjutnya. 2. Manfaat praktis. Penelitian ini diharapkan dapat memberi informasi bagi
E. Tujuan Penelitian
1. Tujuan umum : menguji aktivitas antioksidan menggunakan metode DPPH dan menetapkan kandungan fenolik total menggunakan metode Folin-Ciocalteu dari ekstrak etanol buah buni.
2. Tujuan khusus
a. Mengetahui nilai kandungan fenolik total pada ekstrak etanol buah buni yang dinyatakan dengan massa ekuivalen asam galat menggunakan metode Folin-Ciocalteu.
8
BAB II
PENELAAHAN PUSTAKA
A. Tanaman Buni
1. Klasifikasi buah buni
Menurut United States Departement of Agriculture (USDA), tanaman buni diklasifikasikan sebagai berikut :
Kerajaan : Plantae
Sub-kerajaan : Tracheobionta Superdivisi : Spermatophyta Divisi : Magnoliophyta Kelas : Magnoliopsido Sub-kelas : Rosidae
Bangsa : Euphorbiales Suku : Euphorbiaceae Marga : Antidesma L.
Jenis : Antidesma bunius (L.) Spreng 2. Nama umum
3. Deskripsi tanaman
Tanaman ini berbentuk pohon, dengan tinggi 15 – 30 m. Daun bertangkai pendek, bentuk lanset sampai eliptis dengan panjang 9 – 25 cm. Tanaman ini berumah dua; bunga di ujung dan dalam ketiak tandan, tandan jantan bentuk mulai mengecil. Bunga jantan duduk atau bertangkai pendek, bau tidak enak; kelopak berbentuk bola cawan, pendek berlekuk 3 – 4, panjang 1 – 2 mm. Benang sari 3 – 4; tonjolan penebalan dasar bunga dengan taju yang tidak sama, gundul, dan berseling dengan kelopak; putik yang rudimenter besar. Bunga betina bertangkai; kelopak bentuk cekungan, bertaju 3 – 4 pendek, panjang 1 mm, bakal buah gundul, bentuk telur – botol; kepala putik 3 – 4, pendek dan tebal, melengkung keluar. Buah eliptis lebar, hijau kemudian merah, akhirnya ungu kehitaman, gundul, bentuk telur; kepala putik 3 – 4, pendek dan tebal, melengkung keluar. Buah eliptis lebar, hijau kemudian merah, akhirnya dapat dimakan dan biji berbentuk pipih dengan rusuk yang berbentuk jala. Pohon yang tumbuh di hutan tingginya mencapai 1.300 m (Van Steenis, 1992).
4. Kandungan kimia buah buni
5. Aktivitas farmakologis
Tanaman buni dapat digunakan untuk mengobati flu dan kanker (Micor, 2005). Tanaman buni juga dapat digunakan untuk mengobati kurang darah, darah kotor, hipertensi, jantung berdebar, batuk, sifilis dan kencing nanah (Haryanto, 2009). Buah yang sudah matang dapat digunakan untuk mengatasi masalah pada saluran cerna seperti disentri, diabetes, indigesti, dan konstipasi (Kassem et al., 2013).
B. Ekstraksi
Ekstraksi merupakan proses pemisahan bahan dari campurannya dengan menggunakan pelarut. Sedangkan ekstrak adalah sediaan yang diperoleh dengan cara ekstraksi tanaman obat dengan ukuran partikel tertentu menggunakan cairan penyari yang sesuai. Maserasi adalah metode penyarian simplisia sederhana yang dilakukan dengan menggunakan berbagai macam pelarut pada suhu kamar selama beberapa waktu (Agoes, 2009). Remaserasi adalah pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama, dan seterusnya (Depkes RI, 2000).
Pada proses ekstraksi, pelarut berdifusi kedalam sel dan selanjutnya zat aktif akan larut kedalam pelarut. Sehingga, akan dicapai kesetimbangan antara solut dan solven (Agoes, 2009). Keuntungan metode ekstraksi yaitu dapat diaplikasikan dalam sampel dengan jumlah yang sedikit, prosesnya mudah, dan alat yang digunakan sederhana (List dan Schmidt, 2000).
tersebut dapat terpisah dari bahan atau kandungan lainnya. Pelarut yang dipilih adalah pelarut yang bisa melarutkan hampir semua metabolit sekunder yang terkandung. Pelarut yang sering digunakan untuk mengekstraksi senyawa fenolik antara lain metanol, etanol, aseton dan etil asetat (Tarorehet al., 2015).
C. Senyawa Fenolik
Senyawa fenolik merupakan kelompok terbesar metabolit sekunder pada tanaman. Senyawa ini termasuk dalam alkohol aromatik karena gugus hidroksilnya selalu melekat pada cincin benzen. Senyawa fenolik secara umum memiliki potensi sebagai bakterisidal, antiseptik, antioksidan, dan sebagainya (Pengelly, 2006).
Beberapa senyawa yang termasuk dalam kelompok fenolik adalah fenol sederhana, kumarin, tannin, saponin, dan flavonoid. Senyawa tersebut biasanya berada dalam bentuk glikosida atau ester pada tanaman (Proestos, 2006).
Flavonoid merupakan senyawa fenolik yang paling umum, karena tersebar luas di jaringan tanaman, dan bersama karotenoid dan klorofil bertanggung jawab memberikan warna seperti biru, ungu, kuning, oranye dan merah pada tanaman. Flavonoid meliputi flavon, flavonol, iso-flavonol, anthocyanin, anthocyanidin, proanthocyanidin dan katekin (Khoddami et al., 2013).
Flavonoid merupakan senyawa polar karena memiliki sejumlah gugus hidroksil. Umumnya flavonoid larut dalam pelarut polar seperti air, etanol, metanol, aseton, dimetilsulfoksida, dan dimetilformamida. Gula yang terikat pada flavonoid dapat membantu meningkatkan kelarutan flavonoid dalam air, sehingga dengan menggunakan campuran pelarut air dengan beberapa contoh pelarut polar lain dapat menjadi pelarut yang baik untuk flavonoid khususnya glikosida. Sebaliknya aglikon bersifat kurang polar, contohnya adalah isoflavon, flavon, dan flavonol yang termetoksilasi. Mereka akan cenderung lebih mudah larut dalam pelarut seperti eter dan kloroform (Markham, 1988).
Rutin (3’,4’,5,7-tetrahidroksiflavon-3β-D-rutinosida) adalah glukosida flavonoid yang sangat umum dikenal dengan vitamin P. Dalam keseharian, rutin biasa digunakan untuk mengobati tekanan darah tinggi serta penyakit lain yang berkaitan dengan vaskuler (dos Santos, 2008).
Golongan senyawa fenolik lainnya antara lain, asam fenolik, kumarin, dan flavonol. Asam fenolik yang sering ditemukan antara lain asam hydroxylbenzoic, dan yang tergolong didalamnya antara lain asam galat, asam salisilat, dan asam vanillic (Vermerris dan Nicholson, 2008).
Asam galat (asam 3,4,5-trihidroksibenzoat) merupakan senyawa fenolik yang bukan tergolong dalam flavonoid. Asam galat termasuk dalam golongan antioksidan alami yang sering digunakan sebagai pengawet makanan (Lopez, 2003).
Gambar 2. Struktur asam galat (Lopez, 2003)
D. Radikal Bebas
Efek berbahaya dari radikal bebas menyebabkan potensi kerusakan biologis yang disebut dengan oxidative stress dan nitrosative stress. Efek tersebut terjadi dalam sistem biologi bila ada produksi lebih dari ROS/RNS. Oxidative Stress dapat merusak jaringan lipid, protein, atau DNA seluler sehingga menghambat fungsi normal mereka. Maka oxidative stressdapat disimpulkan terlibat dalam menimbulkan sejumlah penyakit pada manusia serta dalam proses penuaan (Valko et al., 2006).
E. Senyawa Antioksidan
Menurut Pham-Huy (2008) antioksidan adalah senyawa yang bertindak sebagai penangkal radikal bebas dan mencegah terjadinya kerusakan yang diakibatkan oleh senyawa radikal. Radikal bebas dapat mengoksidasi asam nukleat, protein, lipid, serta DNA, sehingga menyebabkan penyakit degeneratif. Senyawa antioksidan seperti asam fenolik, polifenol, dan flavonoid dapat meredam radikal bebas peroksida, hidroperoksida atau lipid peroksil dan menghambat mekanisme oksidatif yang menimbulkan penyakit degeneratif (Prakash et al., 2001).
di fase lipid, karotenoid (β karoten), glutation, bilirubin, abumin, transferin/laktoferin/serulo-plasmin, feritin, sistein, dan flavonoid (Ardhie, 2011).
Berdasarkan sumbernya, antioksidan dapat digolongkan menjadi dua jenis, yaitu antioksidan alami dan antioksidan sintetis. Antioksidan sintetis adalah antioksidan yang dibuat dengan melakukan sintetis kimia seperti TBHQ, BHT, dan propil galat (Gulcin et al., 2004). Antioksidan alami terdapat pada makanan sehari – hari, seperti buah dan sayuran yang mengandung berbagai senyawa fenolik atau nitrogen dan karotenoid. Antioksidan alami dapat melindungi tubuh manusia dari radikal bebas dan menurunkan terjadinya perkembangan penyakit kronis (Sing, 2007).
F. Metode Folin-Ciocalteu
Metode ini didasarkan pada reduksi asam fosfotungstat dalam larutan alkali menjadi fosfotungstat biru. Absorbansi yang terbentuk akibat fosfotungstat biru sebanding dengan jumlah senyawa fenolik yang terdapat dalam sampel, sehingga dapat diketahui seberapa besar jumlah kandungan senyawa dengan gugus fenol dalam suatu sampel tanaman yang dinyatakan dengan ekuivalen asam galat (Cindrić et al., 2011).
cepat terurai dalam larutan alkali, sehingga perlu untuk menggunakan reagen secara berlebih untuk mendapatkan reaksi yang lengkap. Tetapi penggunaan reagen berlebih dapat menimbulkan endapan dan kekeruhan yang tinggi, sehingga membuat analisis spektrofotometri tidak bisa dilakukan. Untuk mengatasi masalah ini, didalam reagen Folin Ciocalteu terdapat garam lithium, yang dapat mencegah kekeruhan. Reaksi ini pada umumnya memberikan data yang akurat dan spesifik pada beberapa kelompok senyawa fenolik (Blainski et al., 2013).
G. Metode DPPH
Metode uji ini menggunakan radikal bebas DPPH (2,2-difenil-1-pikrilhidrazil). Radikal bebas DPPH dapat bereaksi dengan senyawa yang dapat mendonorkan atom hidrogen. Tujuan metode ini adalah untuk mengetahui parameter konsentrasi yang ekuivalen memberikan 50% efek aktivitas antioksidan (IC50) yaitu dengan cara menginterpretasikan data eksperimental dari metode DPPH tersebut (Dehpour et al., 2009).
Metode DPPH dapat digunakan untuk sampel yang berupa padatan maupun cairan. DPPH sering digunakan untuk menguji senyawa yang berperan sebagai free radical scavengers atau donor hidrogen, mengevaluasi aktivitas antioksidannya dan mengkuatifikasi jumlah kompleks radikal antioksidan yang terbentuk (Prakash et al., 2001).
Metode DPPH merupakan metode yang sederhana, cepat, sensitif, dan reprodusibel untuk pengujian aktivitas antioksidan (Savatovic et al., 2012). DPPH memberikan serapan kuat pada 517 nm dikarenakan adanya elektron yang tidak berpasangan. Ketika elektronnya menjadi berpasangan oleh keberadaan penangkap radikal bebas, maka absorbansinya akan menurun. Keberadaan senyawa antioksidan dapat mengubah warna larutan DPPH dari ungu menjadi kuning. Perubahan absorbansi akibat dari reaksi ini telah digunakan secara luas untuk menguji kemampuan beberapa molekul sebagai penangkap radikal bebas (Dehpour et al., 2009).
Gambar 4. Reaksi penangkapan radikal DPPH oleh antioksidan (Prakash et al., 2001)
Warna DPPH yang berubah dari warna ungu menjadi kuning dikarenakan adanya penambahan antioksidan yaitu saat elektron tunggal pada DPPH berpasangan dengan hidrogen dari antioksidan. Hasil dekolorisasi oleh antioksidan setara dengan jumlah elektron yang tertangkap (Prakash et al., 2001).
H. Spektofotometri Visibel
yang lebih tinggi dalam proses menyerap sejumlah energi yang melewati larutan tersebut (Watson, 2010). Absorpsi cahaya ultraviolet atau cahaya tampak mengakibatkan adanya transisi elektronik, yaitu perpindahan elektron dari orbital dasar yang energinya rendah menuju keadaan tereksitasi yang energinya lebih tinggi (Fessenden dan Fessenden, 1982).
Hal - hal yang perlu diperhatikan dalam analisis spektrofotometri antara lain waktu operasional dan panjang gelombang maksimum. Waktu operasional ditentukan dengan mengukur hubungan antara waktu pengukuran dengan absorbansi larutan. Tujuan dari waktu operasional untuk mengetahui waktu pengukuran yang stabil. Pada awal terjadi reaksi absorbansi akan terus meningkat hingga pada waktu tertentu absorbansi yang dihasilkan stabil. Terdapat kemungkinan senyawa mengalami kerusakan atau terurai sehingga menyebabkan intensitas warna dan absorbansinya menurun seiring bertambahnya waktu. Oleh karena hal tersebut perlu dilakukan pengukuran pada saat waktu operasional yang tepat (Gandjar dan Rohman, 2007).
Panjang gelombang yang digunakan dalam pengukuran adalah panjang gelombang yang memiliki absorbansi maksimal. Pada panjang gelombang maksimal kepekaan yang dihasilkan tinggi. Oleh karena itu perubahan absorbansi untuk setiap satuan konsentrasi adalah yang paling besar (Gandjar dan Rohman, 2007).
I. Landasan Teori
Antioksidan seperti asam fenolik, polifenol, dan flavonoid merupakan senyawa pemberi elektron yang dapat memerangi aktivitas oksidan dalam tubuh yang dapat mencegah timbulnya penyakit degeneratif.
Buah buni merupakan sumber antioksidan yang memiliki kandungan senyawa fenolik, flavonoid dan antosianin yang tinggi. Ekstrak metanol buah buni mengandung antosianin (prosianidin B1, prosianidin B2), flavonoid (katekin, epikatekin, rutin, mirisetin, resveratrol, luteolin, kuersetin, naringenin, dan kaempferol) dan asam fenolik (asam galat, asam kafeat, asam elagat, dan asam ferulat) yang tinggi.
Maserasi dipilih karena metodenya tidak menggunakan panas dan tidak merusak kandungan senyawa dalam buah buni. Etanol 96 % dipilih sebagai pelarut karena bersifat polar sehingga diharapkan senyawa – senyawa flavonoid dan fenolik yang bersifat polar dapat tersari ke dalam etanol. Etanol dapat menyari berbagai macam senyawa fenolik seperti polifenol, flavonoid, antosianindan tanin. Metode yang sering digunakan untuk mengukur aktivitas antioksidan adalah metode DPPH. Metode ini menggunakan rutin sebagai kontrol positif karena rutin merupakan salah satu senyawa flavonoid dalam tanaman yang telah diketahu mempunyai aktivitas antioksidan. Tujuan metode ini adalah untuk mengetahui parameter konsentrasi yang ekuivalen memberikan 50% efek aktivitas antioksidan (IC50), yaitu dengan cara menginterpretasikan data eksperimental dari metode DPPH tersebut.
Folin-Ciocalteu didasarkan pada reduksi asam fosfotungstat dalam larutan alkali menjadi fosfotungstat biru. Kandungan fenolik total dinyatakan dengan ekuivalen asam galat sebagai pembanding karena asam galat merupakan salah satu senyawa asam fenolik yang banyak terdapat dalam tanamanyang mempunyai aktivitas antioksidan.
J. Hipotesis
1. Ekstrak etanol buah buni memiliki kandungan senyawa fenolik yang dapat diukur dengan metode Folin-Cioucalteu dan dinyatakan dengan ekuivalen asam galat.
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian eksperimental murni dengan rancangan acak sederhana.
B. Variabel dan Definisi Operasional
1. Klasifikasi variabel
a. Variabel utama
1) Variabel bebas : konsentrasi ekstrak etanol buah buni
2) Variabel tergantung : aktivitas antioksidan dan kandungan fenolik total ekstrak etanol buah buni.
b. Variabel pengacau
1) Variabel pengacau terkendali : waktu pemanenan, umur tanaman yang dipanen, dan metode ekstraksi.
2) Variabel pengacau tak terkendali : kondisi cuaca dan lingkungan pada tempat tumbuh tanaman.
2. Definisi operasional
b. Metode DPPH adalah salah satu metode pengujian aktivitas antioksidan menggunakan radikal bebas DPPH (2,2-diphenyl-1-picrylhydrazyl). Prinsip metode ini adalah penangkapan radikal bebas yang menyebabkan elektron bebas menjadi berpasangan dan mengakibatkan pemudaran warna ungu.
c. Persen inhibitory concentration (%IC) adalah persen yang menyatakan kemampuan ekstrak etanol buah buni dalam menghambat radikal bebas dalam hal ini DPPH.
d. Inhibitory concentration 50 (IC50) adalah konsentrasi ekstrak etanol buah buni yang dapat menghambat 50 % radikal bebas (DPPH).
C. Bahan Penelitian
D. Alat Penelitian
Alat yang digunakan dalam penelitian ini adalah : spektrofotometer UV-Vis (Shimadzu), vacuum rotary evaporator (buchi rotavapor), maserator/orbital shaker, corong Buchner, pompa vaccum, waterbath (Labo-tech, Haraeus), neraca analitik (Scaltec SBC 22, BP 160p), oven, vortex (Junke & Kunkel), micropipet 50 – 200 μl, micropipet 200 – 1000 μl, dan alat – alat gelas (Pyrex-Germany dan Iwaki).
E. Tata Cara Penelitian
1. Determinasi tanaman
Buah buni yang diteliti dideterminasi menurut pustaka acuan. Determinasi dilakukan di Laboratorium Kebun Tanaman Obat, Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta. Proses determinasi dilakukan dengan menggunakan bagian tanaman buni seperti daun, buah, dan bunga.
2. Pengambilan bahan buah buni
Buah buni diperoleh dari taman Kampus III Universitas Sanata Dharma, Yogyakarta. Cara pemanenan buah buni yang digunakan pada penelitian ini yaitu, diambil buah yang berwarna ungu kehitaman berbentuk bulat telur dengan permukaan kulit licin halus dan buah tidak jatuh ke tanah. Pemanenan buah buni dilakukan bulan Februari 2015 pada pagi hari pukul 09.00 WIB.
3. Pembuatan ekstrak
gelap selama 5 bulan, kemudian dilakukan maserasi selama 24 jam dengan etanol 96% dan diremaserasi sebanyak dua kali selama 24 jam dengan pelarut yang sama. Hasil maserasi dan remaserasi disaring kemudian filtrat yang diperoleh dipekatkan menggunakan vaccum rotary evaporator pada suhu 600C sehingga diperoleh ekstrak kental etanol buah buni. Hasil penguapan dari rotary evaporator diuapkan kembali di waterbath untuk menghilangkan seluruh pelarut yang masih terdapat di dalam ekstrak. Ekstrak kental ditimbang dan dihitung rendemen ekstrak kemudian disimpan dalam desikator.
4. Uji pendahuluan
a. Uji fenolik
Sebanyak 0,5 mL larutan uji dengan konsentrasi 11 mg/mL dan larutan pembanding asam galat dengan konsentrasi 150,0 µg/mL masing – masing dimasukkan ke dalam tabung reaksi, kemudian ditambah dengan 2,5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan akuades dengan perbandingan 1:10 v/v dalam tabung reaksi. Campuran didiamkan selama 10 menit, lalu ditambah dengan 7,5 mL larutan natrium karbonat 1 M. Warna larutan diamati secara visual dengan mata.
b. Uji aktivitas antioksidan
lalu divortex selama 30 detik. Selama 30 menit, warna larutan tersebut diamati secara visual dengan mata.
5. Skrining fitokimia ekstrak etanol 96% buah buni
a. Pembuatan larutan uji
Pembuatan larutan uji untuk uji fitokimia dilakukan dengan cara melarutkan sebanyak 500 mg ekstrak etanol 96% buah buni dilarutkan dengan 50 mL etanol 96%, kemudian didapat larutan uji yang digunakan untuk skrining fitokimia.
b. Uji saponin
Sebanyak 0,05 g sampel dilarutkan dalam 10 mL akuades, kemudian dimasukkan ke dalam tabung reaksi. Dikocok vertikal selama 30 detik kemudian dibiarkan selama 30 detik, diamati perubahan yang terjadi. Apabila terbentuk busa yang tetap maka identifikasi menunjukkan adanya saponin (Marliana et al., 2005).
c. Uji flavonoid
Sebanyak 3 mL larutan dimasukkan ke dalam tabung reaksi. Kemudian ditambahkan serbuk Mg dan 5 tetes HCl pekat. Jika menghasilkan warna kuning, oranye, dan merah menandakan adanya flavonoid (Nafisah et al., 2014).
d. Uji triterpenoid dan steroid
pekat melalui dinding tabung. Adanya triterpenoid ditandai dengan terbentuknya cincin kecoklatan atau violet pada perbatasan larutan, sedangkan adanya steroid ditandai dengan terbentuknya cincin biru kehijauan (Hayati dan Halimah, 2010).
e. Uji minyak atsiri
Larutan uji dipipet sebanyak 1 mL kemudian diuapkan diatas cawan porselen hingga diperoleh residu. Hasil positif minyak atsiri ditandai dengan bau khas yang dihasilkan oleh residu tersebut (Padmasari et al., 2013).
f. Uji alkaloid
Sebanyak 2 mL larutan uji diuapkan diatas cawan porselen. Residu yang terbentuk dilarutkan dengan 5 mL HCl 2 N. Larutan yang dihasilkan dibagi ke dalam 3 tabung reaksi. Tabung pertama berfungsi sebagai blanko yang ditambahkan dengan HCl, tabung kedua ditambahkan 3 tetes pereaksi Dragendorff dan tabung ketiga ditambahkan 3 tetes pereaksi Mayer. Hasil positif adanya alkaloid ditandai dengan terbentuknya endapan jingga pada tabung kedua dan endapan kuning pada tabung ketiga (Puspitasari et al., 2013).
g. Uji tanin dan polifenol
pada tabung C maka larutan ekstrak positif mengandung tannin (Marliana et al., 2005).
h. Uji antosianin
Sebanyak 10 mL larutan uji ditambahkan HCl 2 M kemudian dipanaskan 1000C selama 5 menit. Hasil positif bila timbul warna merah. Juga ditambahkan NaOH 2M tetes demi tetes sambil diamati perubahan warna yang terjadi. Hasil positif bila timbul warna hijau biru yang memudar perlahan – lahan (Putri dan Gunawan, 2015).
i. Uji antrakuinon
6. Penentuan kandungan fenolat total
a. Pembuatan larutan asam galat
Asam galat ditimbang sebanyak 25 mg, kemudian dimasukkan ke dalam gelas Beker dan dilarutkan dengan aquades : metanol p.a (1:1). Larutan dimasukkan ke dalam labu takar 50 mL, tambahkan akuades : metanol p.a (1:1) sampai batas tanda. Larutan tersebut diambil sebanyak 0,5; 0,75 ; 1 ; 1,25 dan 1,5 mL, masukkan ke dalam labu takar 10 mL dan tambahkan aquades : metanol p.a (1:1) sampai batas tanda, sehingga diperoleh konsentrasi larutan baku asam galat sebesar 50; 75; 100; 125; dan
150 g / mL.
b. Pembuatan larutan uji untuk penentuan kandungan fenolik total
Ekstrak etanol buah buni ditimbang sebanyak 250 mg, larutkan menggunakan metanol p.a dalam gelas beker. Kemudian masukkan ke dalam labu takar 10 mL dan ditambahkan metanol p.a hingga batas tanda. Larutan intermediet dibuat dengan mengambil 3,6 mL dari larutan stok, masukkan ke dalam labu takar 10 mL dan ditambahkan metanol p.a hingga batas tanda. Sejumlah 2,5 mL larutan intermediet diambil, masukkan ke dalam labu takar 10 mL dan ditambahkan metanol p.a hingga batas tanda.
Konsentrasi larutan uji sebesar 4500,0 g / mL.
c. Penentuan operating time
2,0 mL pada masing – masing larutan. Selanjutnya, ditambahkan dengan 4,0 mL natrium karbonat 1 M. Baca absorbansi larutan setiap 5 menit dengan spektrofotometer visibel pada panjang gelombang 760 nm selama 60 menit. d. Penentuan panjang gelombang maksimum
Larutan asam galat dengan konsentrasi 50; 100; dan 150 g/mL diambil sebanyak 0,5 mL. Reagen Folin-Ciocalteu ditambahkan sebanyak 2 mL pada masing – masing larutan. Selanjutnya, ditambahkan dengan 4,0 mL natrium karbonat 1 M. Diamkan selama operating time yang telah didapat, kemudian dilakukan scanning panjang gelombang maksimum dengan spektrofotometer visibel dengan panjang gelombang 600-800 nm. e. Pembuatan kurva baku asam galat
Larutan asam galat dengan konsentrasi 50; 75; 100; 125; dan 150
g/mL diambil sebanyak 0,5 mL. Reagen Folin-Ciocalteu ditambahkan sebanyak 2 mL.Selanjutnya, ditambahkan dengan 4,0 mL natrium karbonat 1 M, diamkan selama operating time yang telah didapat. Baca absorbansinya pada panjang gelombang maksimum yang telah diperoleh. Lakukan replikasi sebanyak 3 kali.
f. Estimasi kandungan fenolik total larutan uji
Larutan uji dengan konsentrasi 4500,0 g/mL diambil sebanyak 0,5
7. Penentuan aktivitas antioksidan
a. Pembuatan larutan DPPH
Sejumlah DPPH ditimbang sebanyak 5 mg dan dilarutkan dengan metanol p.a. di dalam labu ukur 50 mL sehingga diperoleh larutan stok dengan konsentrasi 100 . Diambil sebanyak 5 mL larutan stok DPPH kemudian ditambahkan metanol p.a sampai 25,0 mL. Larutan ditutup dengan alumunium foil dan harus selalu dibuat baru.
b. Pembuatan larutan stok rutin
Sejumlah 5 mg rutin dilarutkan dalam metanol p.a sampai 50,0 mL.
c. Pembuatan larutan standar rutin
Kemudian diambil sebanyak 3,0 ; 4,0 ; 5,0; 6,0; dan 7,0 mL larutan stok, lalu ditambahkan metanol p.a sampai 10,0 mL, sehingga diperoleh konsentrasi larutan standar rutin sebesar 30; 40; 50; 60; dan 70 µg/mL. d. Pembuatan larutan uji
e. Pembuatan larutan kontrol
Larutan yang digunakan adalah 0,2 mL metanol p.a dimasukkan ke dalam tabung reaksi dan ditambahkan 3,8 mL DPPH, divortex selama 30 detik. Didiamkan selama 30 menit (Reaction Time).
f. Penentuan operating time (OT)
Digunakan 3 konsentrasi rutin (5, 15, 25 µg/mL). Sebanyak 3,8 mL larutan DPPH dimasukkan ke dalam tabung reaksi tertutup kemudian ditambah dengan 0,2 mL larutan standar rutin. Campuran larutan tadi kemudian divortex selama 30 detik. Larutan dibaca absorbansinya dengan spektrofotometer visible pada panjang gelombang maksimal 517 nm setiap 5 menit selama 60 menit sampai diketahui terjadi penurunan absorbansi secara nyata.
g. Penentuan panjang gelombang serapan maksimum
Larutan DPPH yang telah dibuat dengan konsentrasi 20, 30, 40 µg/mL ditentukan spektrum serapannya menggunakan spektrofotometer UV pada panjang gelombang 400 nm hingga 700 nm. Dan ditentukan panjang gelombang optimumnya.
h. Penentuan aktivitas antioksidan
pengujian yang sama untuk pembanding rutin. Replikasi dilakukan sebanyak 3 kali.
i. Estimasi aktivitas antioksidan
Hasil dari prosedur, dihitung nilai %IC dan IC50 untuk rutin dan ekstrak etanol buah buni.
F. Analisis Data
Kandungan fenolik total ekstrak etanol buah buni dinyatakan sebagai mg ekivalen asam galat (GAE) per g ekstrak etanol buah buni. Nilai absorbansi larutan uji yang telah didapatkan dimasukkan ke dalam persamaan kurva persamaan regresi linear asam galat, sehingga diperoleh nilai ekivalensi larutanuji terhadap asam galat. Kandungan fenolik total diperoleh berdasarkan rumus :
Konsentrasi ekstrak etanol buah buni x
Aktivitas penghambatan radikal bebas DPPH (%IC) dihitung dengan menggunakan rumus :
%IC=
x
100 %BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi Tanaman
Determinasi tanaman dilakukan di Laboratorium Kebun Tanaman Obat, Fakultas Farmasi Universitas Sanata Dharma yang diidentifikasi menurut acuan Flora untuk Sekolah di Indonesia (1992). Determinasi tumbuhan ini bertujuan untuk memastikan bahwa tanaman yang digunakan benar Antidesma bunius (L.) Spreng. Bagian tanaman yang digunakan untuk determinasi adalah daun, batang, bunga dan buah. Determinasi dilakukan sampai kategori spesies, hasil determinasi menunjukkan bahwa buah buni yang digunakan dalam penelitian ini memiliki nama ilmiah Antidesma bunius (L.) Spreng (Lampiran 1) dengan warna kulit buah ketika masih muda hijau, ketika hampir matang berwarna merah, dan ketika matang berwarna ungu kehitaman dengan permukaan kulit yang licin dan halus.
B. Hasil Pengumpulan Bahan
Gambar 5. Buah buni (Dokumentasi pribadi, 2015).
Buah buni yang digunakan berwarna ungu kehitaman karena diharapkan mengandung sejumlah senyawa kimia fenolik dengan jumlah maksimal. Pemanenan dilakukan di pagi hari agar metabolit sekunder yang terkandung dalam buah buni belum mengalami fotosintesis sehingga kadar metabolit sekundernya tidak berkurang karena menurut Pallipane dan Rolle (2008) pemanenan paling baik dilakukan pada kondisi tersejuk, yaitu pagi hari atau malam hari ketika aktivitas fisiologi tanaman rendah.
C. Hasil Preparasi Sampel
digunakan untuk merendam bahan segar selama 1 bulan. Metode ekstraksi yang dipilih adalah maserasi dengan bantuan shaker. Maserasi dipilih karena menurut Williamson et al., (1996) maserasi tidak menggunakan pemanasan sehingga tidak terjadi dekomposisi senyawa kimia yang terkandung didalamnya. Dekomposisi senyawa kimia terjadi karena oksidasi senyawa fenolik, sehingga dapat menyebabkan penurunan senyawa fenolik (Dai dan Mumper 2010).
Pada penelitian ini etanol dipilih karena merupakan pelarut polar, sehingga diharapkan dapat menarik senyawa yang bersifat polar. Dasar pemilihan pelarut yang lain yaitu, kemudahan penggunaan, efisiensi, selektivitas dan penerapan yang luas (Dai dan Mumper, 2010). Menurut Schirmer (1990), etanol memiliki indeks polaritas 5,2, sehingga dapat menarik senyawa senyawa fenolik yang cenderung polar, seperti teori like dissolve like menurut Wagner (2013), dimana senyawa yang bersifat polar cenderung akan menarik senyawa yang bersifat polar juga, dan sebaliknya. Selain itu kelebihan dari etanol adalah tidak berbahaya bagi lingkungan, dan dapat mencegah pertumbuhan kapang pada konsentrasi lebih dari 20%. Hasil ekstrak kental yang didapat memiliki bobot 138,41 gram dari 1000 gram buah segar yang digunakan. Dari hasil perhitungan rendemen yang diperoleh adalah 13,841 %.
D. Uji Pendahuluan Ekstrak Etanol Buah Buni
1. Uji pendahuluan keberadaan senyawa fenolik
fosfotungstad (Nunes, et al., 2012). Prinsip uji kualitatif ini adalah reaksi oksidasi-reduksi dalam suasana basa menggunakan reagen Folin-ciocalteu dan natrium karbonat. Senyawa fenolik akan berubah menjadi ion fenolat dalam suasana basa. Ion fenolat yang terbentuk akan mereduksi asam fosfomolibdat-fosfotungstat dalam reagen Folin-Ciocalteu selama proses oksidasi fenol menjadi senyawa kompleks molybdenum-tungsten berwarna biru (Haciet al., 2009). Perubahan menjadi warna biru inilah yang digunakan sebagai indikator keberadaan senyawa fenolik dalam sampel.
Uji pendahuluan senyawa fenolik menggunakan kontrol positif dan kontrol negatif. Kontrol positif yang digunakan yaitu reagen Folin-Ciocalteu yang direaksikan dengan asam galat dan natrium karbonat untuk menunjukkan warna larutan jika hasilnya positif (Gambar 6). Kontrol negatif yang digunakan yaitu reagen Folin-Ciocalteu, metanol : air (1:1) dan natrium karbonat untuk menunjukkan jika hasilnya negatif.
Gambar 6. Hasil uji kualitatif senyawa fenolik pada ekstrak etanol buah buni [A = kontrol positif (asam galat + reagen Folin-Cioucalteu + natrium karbonat)] ;
B = sampel [larutan uji ekstrak etanol buah buni + reagen Folin-Ciocalteu + natrium karbonat] ; C = kontrol negatif [air : metanol (1:1) + reagen
Hasil dari uji kualitatif ekstrak etanol buah buni (Gambar 6) menunjukkan perubahan warna menjadi biru, sama seperti kontrol positif. Hal ini berarti dalam ekstrak etanol buah buni mengandung senyawa – senyawa fenolik. Warna yang dihasilkan oleh sampel yang direaksikan dengan pereaksi Folin dan natrium karbonat tidak sepekat pada kontrol positif karena kandungan fenolik dalam sampel rendah. Semakin tinggi kandungan fenolik dalam sampel maka intensitas warna biru juga semakin meningkat. Asam galat digunakan sebagai senyawa pembanding karena merupakan salah satu asam fenolik yang banyak terdapat dalam tanaman, dan sering digunakan untuk mendeterminasi kandungan fenol dalam tanaman melalui uji Folin-Ciocalteu (Fiuza et al., 2004)
2. Uji pendahuluan keberadaan senyawa antioksidan
Tujuan dilakukannya uji pendahuluan antioksidan pada ekstrak etanol buah buni adalah untuk mengetahui aktivitas antioksidan secara kualitatif. Prinsip uji ini adalah reaksi antara ekstrak etanol buah buni dengan DPPH (2,2-difenil-1-pikirihidrazil). Senyawa antioksidan yang terdapat dalam ekstrak etanol buah buni akan bereaksi dengan radikal bebas DPPH. Senyawa antioksidan akan mengikat elektron bebas dari senyawa radikal. Keberadaan senyawa antioksidan inilah yang dapat mengubah warna larutan DPPH dari warna ungu menjadi kuning (Dehpour et al., 2009).
banyak terdapat dalam tumbuhan dan tersebar luas dalam pigmen tanaman. Rutin juga telah terbukti mempunyai aktivitas antioksidan terhadap radikal bebas
(Mu’awwanah dan Ulfah, 2015). Kontrol negatif yang digunakan adalah DPPH.
Gambar 7. Hasil uji kualitatif aktivitas antioksidan pada ekstrak etanol buah buni [A = kontrol negatif (larutan DPPH) ; B = kontrol positif (larutan DPPH +
rutin) ; C = sampel (larutan DPPH + larutan uji ekstrak etanol buah buni) Hasil dari uji kualitatif ekstrak etanol buah buni (Gambar 7) menunjukkan perubahan warna menjadi ungu menjadi kuning, sama seperti kontrol positif. Hal ini berarti dalam ekstrak etanol buah buni mengandung senyawa – senyawa yang mempunyai aktivitas antioksidan.
E. Hasil Uji Skrining Fitokimia Ekstrak Etanol 96% Buah Buni
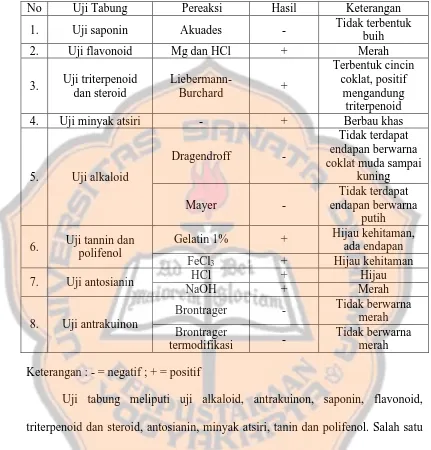
Tabel I. Hasil pengamatan uji tabung terhadap ekstrak etanol buah buni
No Uji Tabung Pereaksi Hasil Keterangan
1. Uji saponin Akuades - Tidak terbentuk
Brontrager - Tidak berwarna
merah
a. Uji saponin
Uji saponin dilakukan dengan menggojog kuat ekstrak dengan akuades selama 30 detik hingga terbentuk buih setinggi 10 cm. Buih yang terbentuk ini akan tahan dalam jangka waktu yang lama, tidak akan hilang selama 30 detik. Saponin pada umumnya berada dalam bentuk glikosida, sehingga mempunyai kemampuan membentuk buih dalam air (Marliana et al., 2005). Saponin merupakan senyawa aktif permukaan yang dapat menimbulkan busa jika dikocok dengan air. Hal ini karena saponin memiliki gugus polar dan non polar yang akan membentuk misel. Apabila misel terbentuk maka gugus polar akan menghadap keluar yang akan berikatan dengan air dan gugus non polar akan menghadap kedalam menjauhi air yang tampak seperti busa (Padmasari et al., 2013), akibatnya terjadi penurunan tegangan permukaan air yang dapat menimbulkan buih. Hasil penelitian sesuai dengan penelitian sebelumnya yang dilakukan oleh Rakasiwi dan Soegihardjo (2014), yaitu ekstrak etanol buah buni tidak mengandung saponin karena tidak terbentuk buih pada saat pengocokan.
b. Uji flavonoid
Untuk mengetahui kandungan flavonoid pada ekstrak uji digunakan uji Shinoda test, yaitu menggunakan larutan HCl pekat dan serbuk Mg yang menghasilkan warna kuning, oranye, atau merah jika dinyatakan positif.
Mg(s) + 2HCl(l) MgCl2(aq) + H2(g)
MgCl2(aq) + 6ArOH(s) [Mg(OAr)6]-4(aq) + 6H+ + 2Cl -Gambar 8. Reaksi flavonoid pada ekstrak etanol buah buni
Menurut Rakasiwi dan Soegihardjo (2014), ekstrak etanol buah buni mengandung senyawa flavonoid. Hasil penelitian yang dilakukan sesuai dengan penelitian sebelumnya yaitu timbul warna merah pada ekstrak etanol buah buni yang direaksikan dengan HCl dan Mg, hal ini menunjukkan bahwa ekstrak positif mengandung flavonoid.
c. Uji triterpenoid dan steroid
Pada pengujian steroid dan triterpenoid, analisis senyawa didasarkan pada kemampuan senyawa tersebut membentuk warna dengan H2SO4 pekat dalam pelarut asam asetat anhidrat (Sangi et al., 2008). Pereaksi Lieberman-Burchard yang terdiri dari campuran asam asetat anhidrat, asam sulfat pekat dan kloroform. Hasil positif ditunjukkan dengan adanya cincin coklat atau violet untuk triterpenoid, sedangkan untuk hasil positif steroid ditunjukkan dengan adanya cincin biru kehijauan.
Menurut Rakasiwi dan Soegihardjo (2014), ekstrak etanol buah buni mengandung senyawa triterpenoid. Hasil penelitian sesuai dengan penelitian sebelumnya yaitu ekstrak etanol buah buni positif mengandung triterpenoid ditandai dengan terbentuknya cicin berwarna coklat.
d. Uji minyak atsiri
Minyak atsiri dapat dihasilkan dari berbagai tanaman (Kardinan, 2005). Telah diketahui bahwa bunga, buah batang, dan akar rempah – rempah mengandung bahan yang mudah menguap serta berbau khas yang dikenal dengan minyak atsiri (Fachriyah dan Sumardi, 2007). Minyak atsiri didefinisikan sebagai sebagai campuran kimiawi yang terdapat pada berbagai tumbuhan dan mempunyai sifat mudah menguap. Hasil penelitian menunjukkan bahwa ekstrak etanol buah buni mengandung minyak atsiri karena menimbulkan bau khas setelah larutan ekstrak uji diuapkan. Hasil positif ini diperkuat dengan penelitian sebelumnya yang dilakukan oleh Rakasiwi dan Soegihardjo (2014) bahwa ekstrak etanol buah buni mengandung senyawa triterpenoid, sedangkan triterpenoid merupakan komponen penyusun minyak atsiri.
e. Uji alkaloid
direaksikan dengan pereaksi Dragendroff dan Mayer masing – masing sebanyak 3 tetes. Reaksi positif jika terbentuk endapan berwarna coklat muda sampai kuning pada penambahan Dragendroff dan endapan berwarna putih pada penambahan Mayer (Marliana et al., 2005). Menurut Rakasiwi dan Soegihardjo (2014), ekstrak etanol buah buni tidak mengandung alkaloid. Hasil penelitian yang didapatkan sesuai dengan penelitian sebelumnya yaitu negatif dengan ditandai tidak adanya endapan dari kedua tabung sampel.
f. Uji tanin dan polifenol
Pada uji tanin diperoleh hasil positif yaitu berwarna hijau dan terbentuk endapan, adanya tanin akan mengendapkan protein pada gelatin. Tanin akan bereaksi dengan gelatin membentuk kopolimer mantap yang tidak larut dalam air (Marliana et al., 2005).
Uji tanin juga dilakukan dengan menggunakan pereaksi besi (III) klorida untuk menentukan apakah sampel mengandung gugus polifenol atau tidak. Salah satu senyawa polifenol adalah tanin. Adanya gugus fenol ditunjukkan dengan perubahan warna sampel menjadi hijau kehitaman atau biru tua setelah penambahan besi (III) klorida. Terjadinya pembentukan warna ini karena terbentuknya senyawa kompleks antara logam Fe dan tanin.
FeCl3(aq) + 6ArOH(s) 6H+ + 3Cl- + [Fe(OAr)6]3-(aq)
Gambar 10. Reaksi antara flavonoid dengan FeCl3 (Nafisah et al., 2014).
penelitian sebelumnya bahwa ekstrak etanol buah buni mengandung senyawa tanin yang tergolong sebagai tanin kondensasi (Sangi et al., 2008).
g. Uji antosianin
Salah satu faktor yang mempengaruhi warna dari antosianin adalah perubahan pH. Sifat asam akan menyebabkan warna antosinin menjadi merah, sedangkan sifat basa menyebabkan antosianin menjadi biru.
Dalam penelitian ini digunakan asam kuat (HCl) dan basa kuat (NaOH). Penambahan asam kuat akan mengubah pH antosinin menjadi lebih asam, sedangkan penambahan basa akan mengubah pH antosinin menjadi basa (Putri et al., 2015). Menurut Maulida dan Guntarti (2015), pada pH asam antosianin akan berada pada bentuk ion flavilium yang berwarna merah dan berganti warna biru-hijau pada keadaan basa. Warna biru-biru-hijau disebabkan karena antosianin banyak berada dalam bentuk ion anhidro basa.
Gambar 11. Perubahan struktur antosianin pada pH yang berbeda (Maulida dan Guntarti 2015).
h. Uji antrakuinon
Uji Brontrager dan uji Brontrager termodifikasi bisa mendeteksi adanya antrakuinon, antrakuinon akan memberikan karakteristik warna merah, violet, hijau atau ungu dengan basa (Marliana et al., 2005). Uji Brontrager bisa mendeteksi senyawa antrakuinon, namun uji ini akan menunjukkan negatif untuk glikosida antrakuinon yang sangat stabil atau turunan tereduksi dari tipe antranol. Oleh karena itu uji Brontrager dimodifikasi dengan melakukan uji Brontrager sebelumnya untuk menghidrolisis dan mengoksidasi senyawa antrakuinon. Tidak terjadinya perubahan warna pada uji Brontrager menunjukkan tidak adanya antrakuinon pada ekstrak antrakuinon karena antrakuinon yang terdapat dalam ekstrak kemungkinan sangat stabil atau turunan tereduksi dari tipe antranol sehingga menyebabkan hasil negatif.
F. Hasil Optimasi Metode Uji Fenolik Total
1. Penentuan operating time
Penentuan operating time bertujuan untuk mendapatkan waktu dimana reaksi antara sampel dan pereaksi berada pada kondisi optimum. Reaksi yang optimum ditunjukkan dengan nilai absorbansi yang relatif stabil. Pada awal reaksi, absorbansi senyawa yang berwarna akan terus meningkat hingga pada waktu tertentu akan diperoleh absorbansi yang stabil. Tetapi, semakin lama waktu pengukuran, ada kemungkinan senyawa berwarna tersebut akan mengalami kerusakan sehingga menyebabkan intensitas warnanya menurun dan absorbansinya juga menurun (Gandjar dan Rohman, 2007).
salah satu senyawa fenolik dan memiliki aktivitas antioksidan (Fiuza et al., 2004). Penentuan OT ini dilakukan dengan mereaksikan senyawa baku asam galat dan reagen Folin-Ciocalteu. Hasil reaksi antara senyawa fenolik dengan pereaksi Folin-Ciocalteu akan membentuk kompleks berwarna biru sehingga warna larutan menjadi biru yang selanjutnya diukur dengan spektrofotometer visibel. Reaksi dianggap optimal apabila absorbansi dari tiap selang waktu yang diukur telah stabil. Absorbansi yang stabil terlihat dari makin kecilnya selisih absorbansi antar selang waktu. Pengukuran OT dilakukan selama satu jam dengan waktu pengamatan setiap 5 menit sekali.
Penentuan OT dilakukan pada 3 konsentrasi yang berbeda. Setiap konsentrasi memberikan nilai absorbansi yang berbeda pada panjang gelombang maksimum teoritis, sehingga ketiga konsentrasi tersebut akan mempresentasikan OT pada masing – masing konsentrasinya. Konsentrasi yang digunakan yaitu 50 μg/mL, 100 μg/mL, dan 150 μg/mL.
Gambar 12. Grafik penentuan operating time asam galat
Dari grafik (Gambar 12) terlihat pada menit ke 30 nilai absorbansi yang didapat telah stabil, berarti reaksi sudah berjalan sempurna. Sehingga dapat disimpulkan OT untuk pengukuran asam galat adalah 30 menit.
2. Penentuan panjang gelombang maksimum
Penentuan panjang gelombang maksimum dilakukan untuk mendapatkan panjang gelombang serapan maksimum dari hasil reaksi antara asam galat dengan reagen Folin-Cioucalteu yang akan digunakan untuk pengukuran absorbansi pengujian kandungan fenolik total sampel. Pembacaan panjang gelombang dilakukan dengan mereaksikan asam galat dan pereaksi Folin-Ciocalteu dan didiamkan selama 30 menit.
Penentuan panjang gelombang maksimum dilakukan pada 3 konsentrasi yang berbeda, yaitu konsentrasi tinggi, tengah, dan rendah. Setiap konsentrasi akan memberikan nilai absorbansi yang berbeda pada panjang gelombang maksimum, sehingga ketiga konsentrasi larutan asam galat, yaitu yaitu 50 μg/mL, 100 μg/mL, dan 150 μg/mL.
Penggunaan tiga konsentrasi tersebut diharapkan akan mempresentasikan panjang gelombang maksimum pada masing – masing konsentrasinya. Scanning panjang gelombang maksimum dilakukan pada rentang panjang gelombang 600 nm – 800 nm, dimana menurut Blainskiet al. (2013) panjang gelombang serapan maksimum untuk pereaksi Folin-Ciocalteu yang direaksikan dengan senyawa fenolik adalah 760 nm.
Tabel II. Hasil scanning panjang gelombang serapan maksimum asam
galat yang direaksikan dengan pereaksi Folin-Ciocalteu
Konsentrasi gelombang tersebut yang digunakan untuk pengukuran absorbansi kurva baku asam galat dan pengujian kandungan fenolik total sampel.
G. Penetapan Kandungan Fenolik Total
sebagai penyumbang atom hidrogen ketika bereaksi dengan senyawa radikal melalui mekanisme transfer elektron sehingga proses oksidasi dapat terhambat.
Menurut Haci et al., (2009), prinsip reaksi pada metode Folin Ciocalteu adalah ion fenolat akan mereduksi asam fosfomolibdat-fosfotungstat dalam reagen Folin-Ciocalteu dalam suasana basa selama proses oksidasi fenol menjadi senyawa kompleks molybdenum-tungsten berwarna biru.Ion fenolat dibentuk melalui disosiasi proton dalam suasana basa yang didapatkan dari suatu senyawa alkali. Senyawa alkali yang digunakan adalah natrium karbonat.
Semakin besar konsentrasi senyawa fenolik maka ion fenolat yang terbentuk pun semakin banyak, sehingga semakin banyak ion fenolat yang mereduksi fosfomolibdat dan fosfotungstat yang menyebabkan warna biru yang terbentuk semakin pekat, hal ini menyebabkan absorbansi yang terukur pun akan semakin besar.
Gambar 13. Reaksi asam galat dengan senyawa molybdenum dari reagen Folin-Ciocalteu (Nunes, et al., 2012)



![Gambar 6. Hasil uji kualitatif senyawa fenolik pada ekstrak etanol buah buni [A = kontrol positif (asam galat + reagen Folin-Cioucalteu + natrium karbonat)] ; B = sampel [larutan uji ekstrak etanol buah buni + reagen Folin-Ciocalteu + natrium karbonat] ; C = kontrol negatif [air : metanol (1:1) + reagen Folin-Ciocalteu + natrium karbonat]](https://thumb-ap.123doks.com/thumbv2/123dok/793706.602274/56.595.84.513.230.674/gambar-kualitatif-cioucalteu-karbonat-ciocalteu-karbonat-ciocalteu-karbonat.webp)