KEMDIKBUD
PPPPTK IPA PPPPTK IPA
LARUTAN ELEKTROLIT, LARUTAN NON ELEKTROLIT, DAN ASAM BASA
(Larutan Elektrolit dan Non Elektrolit)
Masmiani
mia_madhan@yahoo.com
Pada bagian ini akan dipelajari tentang sifat larutan terhadap kemampuan menghantarkan listrik
Larutan termasuk ke dalam campuran homogen yang komponennya terdiri atas zat terlarut dan pelarut. Pelarut yang biasa digunakan adalah air, sedangkan zat terlarut terdiri dari berbagai senyawa baik senyawa ion maupun senyawa kovalen. Contoh senyawa ion yaitu KCl, NaOH, NaCl.
Contoh senyawa kovalen yaitu C6H12O6, NH3, HCl, dan C2H5OH.
Pada pembahasan ini, Kompetensi Dasar yang akan di ajarkan adalah sebagai berikut:
Mendeskripsikan sifat larutan elekrolit dan larutan non elektrolit.
A. DAYA HANTAR LISTRIK LARUTAN
Dalam kimia, larutan adalah campuran homogen yang terdiri dari dua atau lebih zat. Zat yang jumlahnya lebih sedikit di dalam larutan disebut zat terlarut atau solut, sedangkan zat yang jumlahnya lebih banyak daripada zat-zat lain dalam larutan disebut pelarut atau solven.
Pelarut yang biasa digunakan adalah air,Contoh larutan adalah larutan garam dapur atau larutan gula.
Bila kita memegang kabel berarus listrik yang terkelupas isolatornya maka dapat tersengat aliran listrik. Mengapa? Hal ini terjadi karena di dalam tubuh kita terdapat larutan yang dapat menghantarkan arus listrik. Apakah semua larutan menghantarkan listrik?
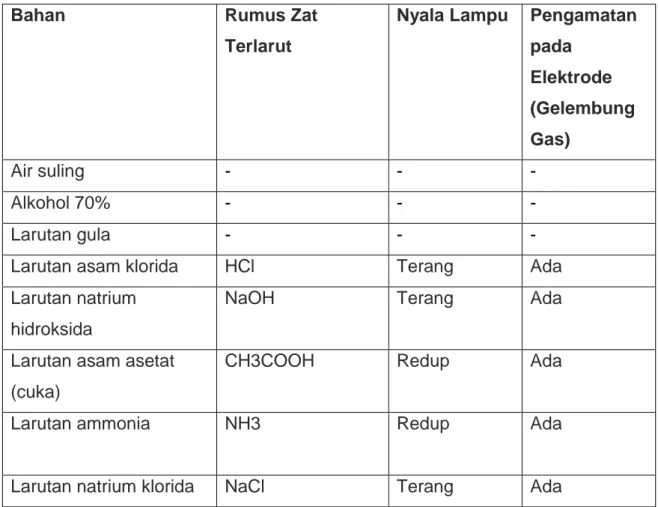
Dari beberapa larutan yang diuji dengan alat uji larutan elektrolit di dapat hasil sebagai berikut:
KEMDIKBUD
PPPPTK IPA PPPPTK IPA
Tabel 1. Pengujian daya hantar listrik beberapa larutan
Bahan Rumus Zat
Terlarut
Nyala Lampu Pengamatan pada
Elektrode (Gelembung Gas)
Air suling - - -
Alkohol 70% - - -
Larutan gula - - -
Larutan asam klorida HCl Terang Ada
Larutan natrium hidroksida
NaOH Terang Ada
Larutan asam asetat (cuka)
CH3COOH Redup Ada
Larutan ammonia NH3 Redup Ada
Larutan natrium klorida NaCl Terang Ada
Sumber: Ebbing, General Chemistry
Berdasarkan tabel diatas dapat disimpulkan bahwa:
Larutan ada yang dapat menghantarkan arus listrik ( larutan elektrolit ) yaitu Larutan asam klorida, larutan natrium hidroksida, Larutan asam asetat (cuka), Larutan amonia, Larutan natrium klorida.
Larutan yang tidak dapat menghantarkan arus listrik ( larutan non elektrolit ) yaitu alkohol 70%, Larutan gula.
I. Larutan Nonelektrolit
Larutan non elektrolit adalah larutan yang tidak dapat menyalakan lampu dan atau gelembung gas di sekitar elektrodanya pada alat uji elektrolit., bila diperhatikan lebih lanjut ternyata larutan ini merupakan campuran homogen
KEMDIKBUD
PPPPTK IPA PPPPTK IPA
antara senyawa kovalen non polar dengan air,, senyawa tersebut bila dilarutkan dalam air tidak terionisasi, sehingga tidak dapat menghantarkan arus listrik.
contoh larutan non elektrolit adalah : a. Alkohol 70%
b. Larutan gula c. Larutan urea d. Larutan glukosa
II. Larutan Elektrolit
Larutan elektrolit adalah larutan yang dapat menyebabkan lampu menyala dan atau gelembung gas di sekitar electrode.
Larutan yang dapat menghantarkan arus listrik disebut larutan elektrolit. Larutan ini memberikan gejala berupa menyalanya lampu atau timbulnya gelembung gas dalam larutan.
Larutan elektrolit mengandung partikel-partikel yang bermuatan (kation dan anion). Berdasarkan percobaan yang dilakukan oleh Michael Faraday, diketahui bahwa jika arus listrik dialirkan ke dalam larutan elektrolit akan terjadi proses elektrolisis yang menghasilkan gas. Gelembung gas ini terbentuk karena ion positif mengalami reaksi reduksi dan ion negatif mengalami oksidasi.
Contoh, pada larutan HCl terjadi reaksi elektrolisis yang menghasilkan gas hidrogen sebagai berikut.
HCl(aq)→ H+(aq) + Cl-(aq)
Reaksi reduksi : 2H+(aq) + 2e- → H2(g) Reaksi oksidasi : 2Cl-(aq) → Cl2(g) + 2e-
(http://kimia.upi.edu/utama/bahanajar/kuliah_web/2008/METI%20MARAYANTI_0606809/laruta n_nonelektrolit.html )
Berdasarkan tabel diatas contoh larutan elektrolit adalah : a. Larutan asam klorida
b. Larutan natrium hidroksida c. Larutan asam asetat (cuka)
KEMDIKBUD
PPPPTK IPA PPPPTK IPA
d. Larutan amonia
e. Larutan natrium klorida
B. KEKUATAN LARUTAN ELEKTOLIT
Untuk menentukan kekuatan larutan elektrolit dapat diuji dengan alat uji larutan elektrolit.
Dengan membandingkan cahaya lampu pijar dan atau gelembung gas yang terbentuk dari larutan-larutan dengan molaritas yang sama dapat membantu kita untuk membedakan antara larutan elektrolit kuat dan larutan elektrolit lemah, misalnya larutan HCl dapat menyalakan lampu dengan terang dan menghasilkan gelembung gas yang banyak , sedangkan larutan asam asetat menghasilkan nyala lampu redup dan gelembung gas sedikit, sehingga larutan HCl merupakan larutan elektrolit kuat dan larutan asam asetat merupakan larutan elektrolit lemah.
I. Larutan elektrolit kuat
Larutan elektrolit kuat adalah larutan yang dapat menyalakan lampu dengan terang dan pada elektroda menghasilkan gelembung gas, misalnya larutan HCl menghasilkan nyala lampu terang dan gelembung gas hal ini disebabkan Jika HCl dilarutkan dalam air, hampir seluruh molekul HCl akan terurai membentuk ion H+ dan ion Cl–. HCl terionisasi sempurna, artinya, jika 1 mol HCl
dilarutkan akan dihasilkan 1 mol ion H+ dan 1 mol ion Cl–. +(aq) + Cl–(aq)
1 mol 1 mol 1 mol
Pada data percobaan di atas yang merupakan larutan elektrolit kuat adalah : a. Larutan Larutan asam klorida
b. Larutan natrium hidroksida c. Larutan natrium klorida
II. Larutan elektrolit lemah
Larutan elektrolit lemah adalah larutan yang menghasilkan nyala lampu redup dan atau gelembung gas pada elektrodanya, Larutan CH3COOH tidak terionisasi sempurna tetapi hanya sebagian.
KEMDIKBUD
PPPPTK IPA PPPPTK IPA
CH3COOH jika dilarutkan dalam air hanya sekitar 0,4% molekul yang terionisasi, artinya jika 1 mol CH3COOH dilarutkan dalam air, jumlah ion H+ dan ion CH3COO– masing-masing hanya 0,004 mol.
CH3 H+(aq) + CH3COO–(aq) 1 mol 0,004 mol 0,004 mol.
Pada data di atas larutan yang merupakan larutan elektrolit lemah adalah : a. Larutan asam asetat (cuka)
b. Larutan amonia
Berdasarkan uraian di atas maka kekuatan daya hantar listrik dari larutan elektrolit bergantung dari jumlah ion-ion yang ada dalam larutan.
Secara garis besar, perbedaan larutan elektrolit kuat dan elektrolit lemah dapat dilihat pada Tabel 6.2.
Tabel 6.2 Perbedaan elektrolit kuat dan lemah
(Dari buku : KIMIA 1 UNTUK SMA DAN MA dikarang oleh Poppy K. Devi, Siti Kalsum,Masmiani dam Hasmiati Syahrul.)
KEMDIKBUD
PPPPTK IPA PPPPTK IPA
C. SENYAWA - SENYAWA PEMBENTUK LARUTAN ELEKTROLIT
Ikatan kimia adalah sebuah proses fisika yang bertanggung jawab dalam interaksi gaya tarik menarik antara dua atom atau molekul yang menyebabkan suatu senyawa diatomik atau poliatomik menjadi stabil.
(http://id.wikipedia.org/wiki/Ikatan_kimia)
Ikatan yang terbentuk dari penggabungan unsur-unsur bergantung pada bagaimana cara unsur-unsur tersebut mencapai konfigurasi elektron yang stabil, yaitu dengan cara :
Menarik atau melepaskan elektron valensi penggunaan bersama elektron valensi.
Pada pembentukan ikatan dengan cara menarik dan melepaskan elektron valensi akan menghasilkan ikatan yang disebut ikatan ion, sedangkan ikatan yang terbentuk akibat penggunaan bersama elektron valensi di sebut ikatan kovalen.
I. Senyawa ion
NaCl merupakan senyawa ion. Jika kristal NaCl dilarutkan dalam air, maka ikatan antara ion positif Na+ dan ion negatif Cl– terputus dan ion-ion itu berinteraksi dengan molekul air. Ion-ion ini dikelilingi oleh molekul air. Peristiwa ini disebut hidrasi. Dalam keadaan terhidrasi, ion-ion bebas bergerak di seluruh bagian larutan.
Perhatikan ilustrasi proses hidrasi senyawa ion pada Gambar 1.
Gambar 1. Proses Hidrasi Senyawa Ion
Jika kristal NaCl dilarutkan dalam air, maka ikatan antara ion positif Na+ dan ion negatif Cl– terputus dan ion-ion itu berinteraksi dengan molekul air. Ion-ion ini
KEMDIKBUD
PPPPTK IPA PPPPTK IPA
dikelilingi oleh molekul air. Peristiwa ini disebut hidrasi. Dalam keadaan terhidrasi, ion-ion bebas bergerak di seluruh bagian larutan.
Pelarutan NaCl dalam air dinyatakan dengan persamaan berikut:
Na + Cl → Na+ + Cl- → NaCl
Semua senyawa ion merupakan senyawa elektrolit sehingga bila dilarutkan dalam air akan terdisosiasi menjadi ion negatif dan ion positif.
Contoh penguraian senyawa ion :
KCl (aq) K+ (aq) + Cl - (aq)
BaCl2 (aq) Ba 2+ (aq) + 2 Cl – (aq)
Senyawa ion dalam keadaan padat tidak dapat menghantarkan listrik karena antara ion positif dan ion negatifnya terikat dengan kuat.Sedangkan bila senyawa ion dalam keadaan lelehan dapat menghantarkan arus listrik karena antara ion positif dan ion negatifnya dapat bergerak bebas.
II. Senyawa kovalen
Ikatan kovalen adalah sejenis ikatan kimia yang dikarakterisasikan oleh pasangan elektron yang saling terbagi (kongsi elektron) di antara atom-atom yang berikatan. Singkatnya, stabilitas tarikan dan tolakan yang terbentuk di antara atom-atom ketika mereka berbagi elektron dikenal sebagai ikatan kovalen.(http://id.wikipedia.org/wiki/Ikatan_kovalen) senyawa yang mengandung ikatan kovalen disebut senyawa kovalen.
Bila senyawa kovalen terbentuk antar dua unsur nonlogam yang mempunyai perbedaan keelektronegatifan, maka akan terjadi senyawa yang mempunyai momen dipol, senyawa ini disebut senyawa kovalen polar. senyawa kovalen polar bila dilarutkan dalam air akan terionisasi. Hidrogen klorida merupakan salah satu contoh senyawa kovalen polar, senyawa kovalen polar bila dilarutkan dalam air akan menghasilkan larutan yang dapat
KEMDIKBUD
PPPPTK IPA PPPPTK IPA
menghantarkan listrik, hal ini disebabkan ketika HCl dilarutkan ke dalam air, terjadilah pembentukan ion, yaitu:
ion H+ dan ion Cl–. Reaksi ionisasinya:
Contoh senyawa kovalen polar dan ionoisasinya
H2SO4(aq) 2 H+(aq) + SO4(aq)
CH3COOH(aq) CH3COO-(aq) + H+(aq)
Selain proses pelarutan, larutan elektrolit ada yang dihasilkan akibat reaksi senyawa kovalen dengan air, sehingga membentuk ion-ion. Contoh NH3 dan SO2.
Reaksi :
NH3(g) + H2O(l) 4+
(aq) + OH-(aq)
SO2(g) + H2O(l) ↔ 2H+(aq) + SO32–
(aq)
Berdasarkan uraian di atas larutan elektrolit dapat bersumber dari senyawa ion (senyawa yang mempunyai ikatan ion) atau senyawa kovalen polar (senyawa yang mempunyai ikatan kovalen polar).
TUGAS
Rancanglah alat uji elektrolit untuk kegiatan praktek di sekolah anda dan cobalah menggunakan larutan yang ada di laboratorium , serta buatlah dokumentasinya dalam bentuk vidio visual atau foto.
Kirimkan : Rancangan,laporan praktikum dan vidio visual atau foto kirimkan
KEMDIKBUD
PPPPTK IPA PPPPTK IPA
Glosarium
Larutan Campuran homogen yang terdiri dari dua zat atau lebih
zat terlarut Zat yang dilarutkan dalam pelarut
Pelarut Pada campuran zat yang jumlahnya lebih banyak
larutan elekrolit Larutan yang dapat menghantarkan arus listrik Larutan non elektrolit Larutan yang tidak dapat menghantarkan arus listrik
Larutan elektrolit kuat Larutan yang dapat menyalakan lampu dengan terang dan
pada elektroda menghasilkan gelembung gas.
Larutan elektrolit lemah larutan yang menghasilkan nyala lampu redup dan atau
menghasilkan gelembung gas sedikit pada elektroda
KEMDIKBUD
PPPPTK IPA PPPPTK IPA
Daftar Pustaka
Chang Raymond , 2003, General Chemistry: The Essential Concepts, Third Edition, Boston : Mc Graw Hill.
James E. Brady, tahun 2009. General Chemistry
Siti Kalsum,dkk.., 2009,Kimia 1 Kelas X SMA/MA.Depdikbunas : , : Pusat Perbukuan, Depdiknas. Jakarta
Sunarya, Y., Setiabudi, A., 2009, Mudah dan Aktif Belajar Kimia 1 Depdiknas : Pusat perbukuan. Jakarta.