1
Sistem penghantaran obat yang tertarget merupakan salah satu strategi pengobatan yang banyak dikembangkan akhir-akhir ini karena dapat langsung menghantarkan obat menuju daerah aksi secara spesifik ( Hillary dkk., 2001). Salah satu teknologi yang banyak digunakan dalam penghantaran obat tertarget adalah nanopartikel. Teknologi nanopartikel mempunyai kelebihan dapat dikonjugasikan dengan berbagai molekul pendukung tambahan seperti protein pembawa sehingga menghasilkan sistem baru dengan spesifikasi yang lebih lengkap (Martien dkk., 2012). Konjugasi dengan protein pembawa merupakan tahap yang sangat penting karena akan menentukan keberhasilan dari sistem penghantaran obat. Nanopartikel polimerik atau yang dilapisi dengan polimer hidrofilik sangat potensial untuk digunakan karena kemampuannya sebagai pembawa DNA dalam terapi gen, dan kemampuannya untuk menghantarkan protein, peptida dan gen (Larger, 2000; Bhadra dkk., 2000; Kommareddy dkk., 2005; Lee dan kim, 2005).
Pada penelitian sebelumnya telah dilakukan konjugasi antara polimer pektin dengan BSA menggunakan katalis EDAC sebagai acuan untuk pengembangan nanopartikel. Untuk identifikasi adanya konjugasi telah berhasil dilakukan dengan analisis kualitatif menggunakan metode Native-PAGE
berdasarkan bobot molekulnya (Juhairiyah, 2015). Metode native-PAGE kemungkinan juga bisa memisahkan konjugasi nanopartikel-MJ-30 dengan BSA.
Pengaruh konsentrasi gel poliakrilamid yang digunakan dan waktu pengembangan terhadap pita elektroforesis yang dihasilkan perlu dilakukan penelitian lebih lanjut. Identifikasi konjugasi pektin dengan BSA dengan waktu pengembangan yang terbatas tidak akan bisa memperoleh hasil pemisahan yang baik karena sampel konjugasi belum turun dengan sempurna dan belum memasuki gel poliakrilamid dengan baik (Juhairiyah, 2015). Pada elektroforesis nanopartikel MJ-C dengan polimer kitosan rantai pendek dan pektin metilasi rendah terkonjugasi anti-EpCAM tidak ada pita yang bisa terlihat karena sampel tertahan di atas dan tidak bisa melewati gel karena ukuran gel yang terlalu kecil dan waktu pengembangan yang masih kurang (Kristiani, 2015).
Waktu pengembangan dan daya listrik yang digunakan juga akan mempengaruhi pita protein karena menghasilkan panas dengan istilah Joule heat yang akan mengakibatkan terjadinya distorsi pita hasil elektroforesis, meningkatkan proses difusi, inaktivasi enzim, dan denaturasi protein. Analisis gel dengan daya listrik yang kecil dan waktu yang lebih lama akan mengurangi dampak yang ditimbulkan oleh joule heat (Garvin, 2008) selain itu penggunaan daya listrik yang tinggi dapat menyebabkan protein yang mempunyai bobot molekul besar bermigrasi dengan tidak sempurna.
Oleh karena itu, pada penelitian ini akan dilihat pengaruh variasi konsentrasi gel dan waktu pengembangan elektroforesis sehingga didapatkan kondisi optimum yang bisa mengidentifikasi konjugasi antara nanopartikel MJ-30
menggunakan alginat sebagai polimer dengan protein BSA. Hasil akhir penelitian ini diharapkan dapat dijadikan acuan dan pedoman dalam pengembangan obat dengan sistem penghantaran yang tertarget.
B. Rumusan Masalah
1. Bagaimanakah pengaruh perbedaan konsentrasi gel poliakrilamid pada identifikasi konjugasi BSA dengan nanopartikel MJ-30 ?
2. Bagaimanakah pengaruh waktu pengembangan terhadap hasil elektroforesis pada identifikasi konjugasi BSA dengan nanopartikel MJ-30 ?
C. Tujuan penelitian 1. Tujuan Umum
Penelitian ini bertujuan untuk mengetahui pengaruh konsentrasi gel poliakrilamid dan waktu pengembangan terhadap pita hasil elektroforesis sehingga didapatkan kondisi yang optimum untuk identifikasi biokonjugasi antara nanopartikel MJ- 30 dengan BSA.
2. Tujuan Khusus
a. Melakukan optimasi konsentrasi gel poliakrilamid untuk mengidentifikasi hasil reaksi biokonjugasi BSA dengan nanopartikel MJ-30 secara kualitatif. b. Melakukan optimasi waktu pengembangan elektroforesis sehingga
D. Manfaat Penelitian
Penelitian ini diharapkan bisa memberikan informasi mengenai konsentrasi dan waktu pengembangan gel elektroforesis yang optimum sehingga memudahkan untuk mengidentifikasi nanopartikel MJ-30 yang terkonjugasi BSA yang nantinya dapat digunakan pada inovasi baru dalam pengobatan kanker yang lebih efektif dan aman.
E. Tinjauan Pustaka 1. Biokonjugasi
Konjugasi (Crosslinking) merupakan suatu proses kimia untuk menggabungkan dua atau lebih molekul dengan suatu ikatan kovalen. Disebut sebagai biokonjugasi jika molekul yang digabungkan berupa biomolekul (Hayworth, 2014.). teknik ini dapat diaplikasikan untuk membuat suatu sistem termodifikasi berbasis protein yang berfungsi untuk deteksi, assay tracking atau mentarget suatu molekul biologi (Hermanson, 1996).
Biokonjugasi antara suatu molekul sintetik dengan suatu protein memiliki peranan yang besar dalam dunia kesehatan, misal pada pengembangan suatu agen terapi berbasis protein dengan menggabungkan suatu polimer atau suatu molekul obat pada protein. Gugus fungsional protein yang bisa dijadikan target dalam biokonjugasi adalah amina primer (-NH2), karboksilat (-COOH), sulfhydryl (-SH)
dan karbonil (-CHO). Tujuan dari konjugasi ini adalah untuk menaikkan sifat farmakokinetik dari komponen terapinya (Witus, 2012). Teknik biokonjugasi tergantung pada gugus fungsional reaktif dari reagen crosslinking maupun dari
molekul target. Jika salah satu tidak memiliki gugus fungsional reaktif, atau jika keduanya tidak kompatibel maka reaksi konjugasi tidak akan berhasil (Hermanson, 1996). Sehingga jika ingin mendapatkan hasil reaksi yang optimal, perlu dilakukan pemilihan antara reagen crosslinking dan molekul target yang tepat. Reagen biokonjugasi memiliki gugus fungsi yang reaktif secara spontan dan selektif untuk terikat pada gugus fungsional spesifik molekul target. Sebagian lainnya tidak langsung dapat menjadi crosslinker, tetapi ada yang akan membentuk intermediet aktif (Hermanson, 1996).
Selain bergantung dari gugus fungsional reaktif yang bereaksi, keberhasilan konjugasi juga ditentukan oleh kondisi sistem saat dilakukan konjugasi, misalkan pH medium, waktu dan suhu reaksi, serta konsentrasi dari pereaksi yang digunakan harus sesuai dengan reaksi yang dilakukan agar reaksi biokonjugasi berjalan dengan baik. Jika kondisi reaksi optimum dalam konjugasi belum diketahui secara pasti, maka perlu dilakukan optimasi untuk memperoleh hasil konjugasi yang optimum (Wong, 2002)
2. Gel Elektroforesis
Gel elektroforesis merupakan metode yang biasa digunakan pada analisis dan purifikasi protein karena bisa memberikan informasi berat molekul dan muatan protein, struktur sub unit protein, dan kemurnian pada penelitian khusus preparasi protein. Metode gel elektroforesis mudah untuk digunakan dan sangat reprodusibel. Analisis kualitatif pada kompleks campuran protein merupakan analisis yang sering menggunakan gel elektroforesis (Garvin, 2008). Ada dua
teknik dalam pemisahan protein menggunakan gel poliakrilamid elektroforesis, yaitu :
a. SDS-PAGE Protein
SDS-PAGE meupakan metode yang secara luas digunakan untuk menganalisis protein secara kualitatif berdasasarkan ukurannya dan dapat digunakan pula untuk menentukan berat molekul relatif suatu protein (Walker, 2002). Dalam metode ini, sampel bufer yang digunakan mengandung β-merkaptoetanol dan SDS. SDS (Sodium Dodecyl sulfat) dengan struktur kimia CH3-[CH2]10-CH2OSO3-Na+ merupakan suatu deterjen anionik yang memiliki
ujung hidrofobik pada bagian dodesil, dan bagian yang sangat bermuatan pada gugus sulfatnya. SDS akan terikat kuat pada bagian hidrofobik asam amino yang menentukan konformasi 3D protein. Akibat terikat oleh SDS maka struktur globular protein akan terdenaturasi total menjadi protein yang linear (Anonim, 2016). Struktur linear ini menjadikan protein kehilangan muatan native-nya dan menjadi bermuatan negatif. Akibat perlakuan tersebut tidak ada perbedaan muatan dan konformasi antar protein. Sedangkan merkaptoethanol digunakan untuk memutus ikatan disulfida yang membentuk struktur tersier suatu protein (Walker, 2002).
b. Native-PAGE Protein
Native-PAGE digunakan jika ingin mempertahankan bentuk native protein yang dapat digunakan untuk mengidentifikasi aktivitas biologi misal, aktivitas enzim, ikatan reseptor, ikatan antibodi dan lain sebagainya. Pada tipe
native, tidak digunakan SDS maupun agen pereduksi lainnya seperti merkaptoetanol pada saat preparasi gel elektroforesis, loading bufer dan running bufer, selain itu pemanasan sampel juga tidak diperlukan (Walker, 2002).
Migrasi protein melewati gel elektoforesis menuju anoda dipengaruhi oleh berbagai macam faktor seperti, ukuran molekul, bentuk dan muatan native dari protein itu sendiri. Oleh karena itu resolusi dari Native-PAGE tidak sebaik pada SDS-PAGE, namun teknik ini sangat bermanfaat jika ingin mempertahankan struktur native protein selama analisis (Smet dkk.,2006) .
Titik isoelektrik atau isoelectric point dan electrophoretic mobilitiy merupakan dua sifat fisika dari protein yang sangat berpengaruh pada elektroforesis. electrophoretic mobilitiy atau kecepatan migrasi protein bergantung pada muatan, ukuran, dan bentuk sedangkan titik isoelektrik hanya bergantung pada muatan protein (Garfin,2003).
Protein merupakan molekul amfoter karena bisa bermuatan positif, negatif, atau tidak bermuatan yang dipengaruhi oleh pH lingkungannya. Muatan native protein dapat dipengaruhi oleh pH gel. Jika pH gel lebih kecil dari titik isoelektrik (pI) protein sampel, maka akan menghasilkan muatan positif pada protein, dan jika di atas pI protein maka akan memberikan muatan akhir negatif. Protein sampel harus memiliki pI < 7,0 agar memiliki muatan negatif dan dapat menuju anoda. Secara umum, pada pH 2,0 hingga 4,0 maka protein akan bermuatan positif, dan akan bermuatan negatif pada pH diatas 8,0. Oleh karena itu pemilihan pH yang cocok sangat penting untuk memastikan bahwa protein yang kita inginkan dapat bermigrasi dalam gel (Gallagher, 1999).
Komponen- komponen yang penting dalamelektroforesis : a) Konsentrasi gel poliakrilamid
Gel merupakan komponen kunci dalam sistem elektroforesis. Gel akan menentukan kecepatan migrasi protein dan menahan protein selama proses elektroforesis berlangsung sampai bisa diwarnai untuk visualisasi. Gel poliakrilamid merupakan metode umum digunakan untuk protein. Sedangkan gel agarosa digunakan untuk memisahkan protein yang berukuran besar dari 500 kDa dan untuk imunoelektroforesis. Gel poliakrilamid cocok digunakan untuk memisahkan protein karena beberapa hal yaitu ukuran pori gel bisa diatur sesuai dengan ukuran protein, reaksi polimerisasi gel mudah terjadi, gel poliakrilamid bersifat hidrofilik serta transparan pada gelombang cahaya diatas 250 nm dan tidak berikatan dengan pewarna protein.
Gel poliakrilamid merupakan hasil polimerasi dari monomer akrilamid dengan adanya N,N’-methylene-bis-acrylamide (bis-akrilamid) yang berfungsi sebagai pembentuk silang, dimana keduanya akan berpolimerasi dengan adanya senyawa radikal (Gambar 1). Senyawa radikal yang biasanya digunakan adalah amonium persulfat (APS). Untuk mendekomposisi APS agar menjadi senyawa radikal dan menyetabilkannya, maka ditambahkan TEMED (N,N,N’,N’-tetrametil etilendiamin). Ukuran pori gel sangat ditentukan oleh perbandingan jumlah akrilamid dan bis-akrilamid. Polimerisasi pada gel sangat dipengaruhi oleh 3 hal yaitu jmlah monomer dan bis akrilamid yang diberikan, suhu, dan kemurnian dari reagen- reagen yang digunakan.
Gambar 1. Polimerasi akrilamid (Walker, 2002)
Untuk protein elektroforesis, ukuran pori gel sangat penting karena selama proses elektroforesis berlangsung, protein bermigrasi melaui pori. Ukuran dari pori gel sulit untuk diukur secara langsung. Tapi, bisa ditentukan secara operasional berdasarkan batas ukuran protein yang bisa melewati pori gel (Garfin, 2003).
b) Bufer
Arus listrik pada sel elektroforesis sebagian besar dihantarkan melalui ion- ion pada sistem bufer, protein hanya berperan kecil dalam penghantaran arus. Bufer berfungsi untuk mensuplai arus yang dibawa oleh ion, menjaga pH yang diinginkan, dan mencegah medium untuk kelebihan panas yang nantinya dapat merusak protein yang akan dianalisis. Pada sistem native PAGE bufer juga berfungsi untuk menjaga pH lingkungan yang diperlukan untuk aktivitas protein. Sistem bufer diklasifikasikan menjadi continuous dan discontinuous tergantung dari satu atau lebih bufer yang digunakan. Untuk sampel yang terdilusi akan
mendapatkan hasil yang lebih baik dengan menggunakan discontinuous bufer sedangkan untuk sampel dengan konsentrasi protein yang tinggi bisa menggunakan continuous bufer (Garfin, 2003).
Continuous bufer
Menggunakan pH yang konstan dan bufer yang sama pada gel, sampel, dan elektroda. Ketika sampel dimasukkan pada gel, proses pemisahan akan langsung terjadi.
Discontinuous bufer
Discontinuous bufer digunakan untuk mendapatkaan resolusi yang tinggi dalam pemisahan gel. Terdapat dua macam gel yang digunakan dalam pemisahan protein menggunakan gel poliakrilamid yaitu gel penumpuk (stacking gel) dan gel pemisah (separating gel). Gel pemisah digunakan untuk memisahkan protein berdasarkan bobot molekulnya. Ukuran pori gel pemisah dapat bervariasi sesuai dengan range ukuran protein yang ingin dipisahkan. Stacking gel atau gel penumpuk berfungsi untuk tempat
loading sampel atau ruang pembatas antar sampel. Ukuran pori gel pada
bagian ini sangat besar yaitu sekitar 4% dengan tujuan agar protein dapat bermigrasi dengan mudah (Walker, 2002).
c) Pertimbangan sumber daya listrik
Digunakan untuk desain elektroforesis yang akan mengontrol kecepatan migrasi protein atau elektroforetik. Voltase tetap, arus tetap, atau sumber daya listrik tetap dapat digunakan. Pemilihan sumber daya listrik didasari oleh kemampuan dari bejana elektroforesis untuk menstabilkan panas akibat arus listrik
yang digunakan. Panas yang ditimbulkan akibat arus listrik selama proses elektroforesis dinamakan joule heat. Joule heat akan mengakibatkan terjadinya distorsi pita hasil elektroforesis, meningkatkan proses difusi, inaktivasi enzim, dan denaturasi protein. Bejana elektroforesis yang baik akan mentransfer panas dari gel ke lingkungannya sehingga efek yang tidak diinginkan bisa teratasi. Sel vertikal biasanya tahan pada sumber daya listrik 10- 20 V/cm dan arus dengan rentang 15- 25 mA/mm tebal gel (Garvin,2003).
d) Pewarnaan gel
Deteksi protein setelah elektroforesis umumnya menggunakan pewarna organik atau silver. Silver staining sangat sensitif akan tetapi prosesnya lebih rumit, reagen yang digunakan harus murni, dan menggunakan zat kimia yang berbahaya. Untuk pewarna organik biasanya menggunakan Coomassie Brilliant
Blue. Coomassie Brilliant Blue akan membentuk ikatan yang kuat dengan protein
tapi bukan ikatan kovalen. Kebanyakan adalah kombinasi antara ikatan van der Waals dengan interaksi elektrostatik.
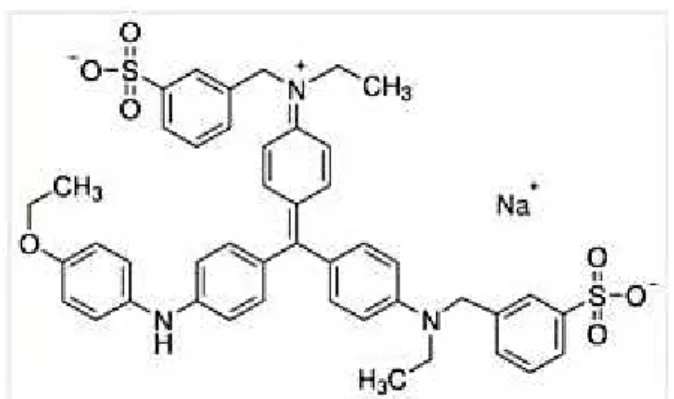
Kompleks protein dan pewarna akan membentuk warna biru yang terlihat pada membran atau gel karena muatan negatif dari bentuk anionik dari pewarna. Molekul pewarna yang berikatan pada pita hasil elektroforesis sebanding dengan jumlah protein yang ada pada pita. Struktur dari coomassie seperti pada Gambar 2 memiliki gugus asam sulfonat yang mempunyai peranan penting dalam pewarnaan protein karena akan bereaksi dengan gugus amina pada protein.
Gambar 2. Struktur dari coomassie Brilliant Blue R250
3. Ribosome Inactivating Protein (RIP) MJ- 30
Ribosome Inactivating Protein (RIP) merupakan sekelompok sitotoksin
yang memiliki aktivitas menghambat sintesis protein pada eukariotik sehingga berpotensi untuk dikembangkan sebagai senyawa antikanker. RIP bersifat merusak ribosom secara irreversible, dengan menghilangkan residu adenin dari rRNA dan juga mendepurinasi asam nukleat lainnya. Penggunaan RIP sebagai komponen konjugasi dengan antibodi atau sebagai imunotoksin (Stirpe, 2006).
RIP terdistribusi luas dalam tanaman tingkat tinggi. Kebanyakan spesies tanaman yang mengandung RIP termasuk subdivisi angiospermae. Fraksi protein dari daun M. jalapa L. diketahui mempunyai aktivitas untuk memotong DNA superkoil dan aktivitas N-glikosidase. Aktivitas rRNA N-glikosidase ini menyebabkan depurinasi adenin pada posisi 4324 dari 28S rRNA. Protein dari akarnya sitotoksik terhadap sel HeLa, dan fraksi protein totalnya terbukti aktif menginduksi apoptosis sel HeLa (Sudjadi dkk., 2007). Ekstrak daun, biji, dan akar tanaman ini mengandung protein-protein sejenis RIP yang disebut Mirabilis Antiviral Protein (MAP) dan MJ- 30 yang mempunyai efek sitotoksik terhadap sel
Hela (Kataoka dkk., 1992; Sudjadi dkk., 2007). Ribosom inactivating protein (RIP) diisolasi dari daun Mirabilis jalapa dan dinamakan MJ-30 karena mempunyai berat molekul 30 kD. MJ-30 memiliki efek sitotoksik terhadap sel T47D dan sel siHa yang merupakan sel line kanker payudara dan kanker serviks. Efek sitotoksik MJ-30 pada sel kanker lebih tinggi daripada sel normal (Ikawati dkk., 2006).
4. Bovine Serum Albumin (BSA)
Bovine serum albumin (BSA) sering digunakan sebagai model untuk studi fisika-kimia protein karena merupakan polipeptida yang mudah tersedia (Carter & Ho, 1994). BSA merupakan suatu protein globular yang tersusun dari dua puluh asam amino esensial dalam struktur yang terdiri dari 583 unit (Peters, 1995). Berat molekul (dikalkulasikan dari teknik yang berbeda) sekitar 66411 hingga 66700 Da, dan saat berada dalam larutan berat molekul yang dianggap paling benar adalah 66500 Da (Peters, 1995; Gonzalez Flecha dkk, 2003).
BSA sangat mudah larut dalam air dan hanya dapat diendapkan menggunakan garam netral yang memiliki konsentrasi tinggi seperti ammonium sulfat. BSA sering digunakan sebagai penstabil untuk protein terlarut lainnya atau enzim yang labil. Dalam aplikasi di bidang biokimia, BSA digunakan sebagai
Enzyme-Linked Immunosorbent Assay (ELISA), Immunoblots, dan
Immunohistochemistry (IHC) (Rani, 2012). BSA juga dapat digunakan sebagai
standar pada kalibrasi protein untuk menentukan kuantitas protein lain dengan menggunakan metode Lowry dan Bradford protein assay, dan sebagai blocking
agent pada Western blot (Patnam, 1975 & Rani, 2012). Pada penelitian ini BSA
digunakan sebagai protein model yang akan dikonjugasikan dengan permukaan nanopartikel alginat.
BSA memiliki range Isoelektrik Point (pI) antara pH 4,7 sampai 5,2 (Kongraksawech dkk, 2007) dan transformasi konformasi proteinnya dipengaruhi oleh perubahan pH (Gambar 3). Pada pH antara 4.5 dan 7,0 BSA berada pada bentuk native (N). Pada pH 3.5 bentuk native (N) BSA akan berubah secara reversible menjadi bentuk fast (F) yang mengakibatkan BSA bermigrasi secara cepat pada gel elektroforesis. Pada pH 2,0 konformasi BSA menjadi bentuk
expanded (E) sehingga konformasinya menjadi lebih besar. Ketika pH lebih dari
7,0 hingga 9,0 bentuk N akan berubah menjadi bentuk basic (B) dan selanjutnya menjadi bentuk E jika pH terus dinaikkan. Konformasi native (N) merupakan bentuk paling kompak/padat, sedangkan bentuk expanded (E) merupakan struktur yang paling terbuka (Foster, 1977; Michnik dkk., 2005; Yamasaki dkk., 1990). Pada penelitian ini, nanopartikel MJ-30-BSA diformulasikan pada pH 4.5, 5.5, dan pH 6.5 sehingga BSA berada pada bentuk native.
Gambar 3. Transformasi konformasi BSA yang dipengaruhi oleh perubahan pH (Foster, 1977; Michnik dkk., 2005; Yamasaki dkk., 1990)
5. Alginat
Alginat merupakan senyawa polisakarida hasil ekstraksi dari kelompok alga coklat atau Alginophyta. Alginat adalah garam dari asam alginat yang mengandung ion natrium, kalsium atau kalium (Kadi dan Atmaja, 1988). Berat molekul alginat adalah 32- 200 kDa, berhubungan erat dengan derajat polimerisasi 180- 930, nilai pK gugus karboksil adalah 3,4- 4,4.Alginat mempunyai kandungan air yang tinggi disebabkan oleh pengaruh garam yang bersifat higroskopis. Kandungan air dalam alginat bervariasi tergantung pada kelembaban relatif dari lingkungannya (Yunizal,2004).
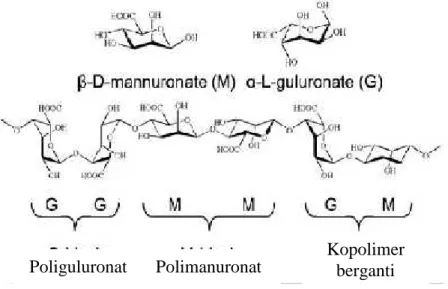
Alginat yang banyak dikenal adalah bentuk garam dari asam alginat yang tersusun oleh asam D-mannuronat dan asam L-guluronat. Alginat merupakan poliuronat yang mengandung asam ß-D-mannuronat (M) dan asam α-L-gulukoronat (G), dan kedua asam tersebut dihubungkan oleh ikatan pada atom C1 dan C4. Selain mengandung asam polimanuronat (MM) dan poliguluronat (GG), juga mengandung kopolimer berganti (MG) (Gambar 4).
Gambar 4 . struktur dan tipe polimer dari alginat ( Higham.,dkk) Kopolimer
berganti Poliguluronat Polimanuronat
Karakter dari alginat adalah : a. Kelarutan
Alginat bersifat larut air dalam bentuk garam alkali, magnesium, ammonia atau amin (Belitz & Grosch, 2004). Alginat tidak larut air dalam bentuk garam kalsium alginat atau asam alginat. Kelarutan alginat dan kemampuannya mengikat air bergantung pada jumlah ion karboksilat, berat molekul dan pH. Kemampuan mengikat air meningkat jika jumlah ion karboksilat semakin banyak dan pada pH di bawah 3 terjadi pengendapan (McHugh, 2003).
b. Pembentukan gel
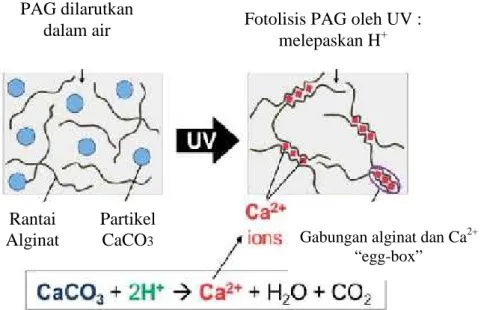
Alginat yang larut dalam air membentuk gel pada larutan asam karena adanya ion kalsium atau kation logam polivalen lainnya. Penggantian kation Na+ lebih dari 35 % dengan kation Ca2+ akan menggantikan pergeseran molekul dan terbentuk struktur gel yang stabil. Secara kasar penambahan kation Ca2+ pada konsentrasi rendah tidak menimbulkan perubahan shear dan membentuk gel, sedangkan jumlah Ca2+ yang tinggi menyebabkan perubahan shear yang tinggi dan membentuk gel kalsium alginat. Ketika ada crosslinker berupa Ca2+ maka struktur alginat akan membentuk egg-box seperti yang bisa dilihat pada Gambar 5.
c. Viskositas
Viskositas dari larutan alginat dipengaruhi oleh konsentrasi, pH, bobot molekul, suhu dan adanya kation logam polivalen. Semakin tinggi konsentrasi atau bobot molekul maka semakin tinggi viskositasnya (Chapman, 1970).
Viskositas larutan alginat akan menurun dengan pemanasan, meningkat lagi bila didingankan kembali, kecuali dengan pemanasan pada suhu tinggi dan waktu relatif lama akan mengakibatkan degradasi molekul dan menyebabkan penurunan viskositas (Klose dan Glicksman, 1972). Pada kondisi larutan tanpa kation barvalensi dua atau tiga atau dengan adanya bahan pengkelat, viskositas larutan alginat rendah. Sebaliknya dengan penigkatan kation multivalen ( misalnya kalsium) terjadi peningkatan viskositas yang bersifat paralel. Oleh karena itu, viskositas larutan alginat dapat diatur sesuai keinginan. Proses freezing dan
thawing Na- alginat yang mengandung ionCa2+dapat menghasilkan peningkatan viskositas (Belitz & Grosch, 2004).
Gambar 5. visualisasi UV pembentukan dari hidrogel alginat dengan menggunakan crosslinking CaCO3. Sistem mengandung sodium alginat dan photoacid generator (PAG) yang
larut dalam air dan terdispersi dengan partikel CaCO3. (Javvaji.,dkk) PAG dilarutkan
dalam air Fotolisis PAG oleh UV :
melepaskan H+
Rantai Alginat
Partikel
CaCO3 Gabungan alginat dan Ca2+ “egg-box”
6. Nanopartikel
Nanopartikel didefinisikan sebagai disperse partikulat atau partikel padat dengan jarak ukuran 1 – 1000 nm. Obat dilarutkan, dijerat, dienkapsulasi, dan diikat dalam matriks nanopartikel. Berdasarkan metode pembuatannya dapat diperoleh nanopartikel, nanospheres, dan nanokapsul. Nanokapsul merupakan sistem dimana obat berada dalam rongga yang dikelilingi oleh membran polimer yang unik, sedangkan nanosphere merupakan sistem matriks dimana obat terdispersi secara fisik dan secara merata. Nanopartikel polimerik terbiodegradasi sering digunakan akhir-akhir ini, terutama yang dilapisi dengan polimer hidrofilik digunakan sebagai alat penghantaran obat yang potensial karena kemampuannya untuk bersirkulasi dalam waktu yang diperpanjang dalam organ target, sebagai pembawa DNA dalam terapi gen, dan kemampuannya untuk menghantarkan protein, peptida, dan gen (Larger, 2000; Bhadra dkk., 2000; Kommareddy dkk., 2005).
Nanopartikel banyak diaplikasikan karena memiliki kelebihan yaitu dapat melindungi senyawa terapeutik dari degradasi oleh berbagai macam senyawa dalam tubuh, meningkatkan absorbsi obat yang berefek langsung pada peningkatan bioavailabilitas, pelepasan obat dapat dikontrol, lebih dapat tertarget pada sel spesifik, serta dapat menaikkan penetrasi intraseluler (Hu dkk., 2012; Peer dkk., 2007, Mardiyati dkk., 2012). Nanopartikel dari bahan polimer alam banyak digunakan pada sistem penghantaran obat karena bersifat biokompatibel, biodegradabel dan non-toxic (Wilczewska dkk., 2012; Mardiyati dkk, 2012).
material karbon, dan magnetic nanopartikel merupakan contoh dari nanocarrier yang telah diuji sebagai drug delivery sytem (DDS) (Gambar 6).
Gambar 6. Jenis Nanocarrier yang digunakan sebagai drug delivery sistem (DDS) (Wilczewska dkk., 2012).
Walaupun liposom telah digunakan sebagai pembawa potensial dengan keuntungan yang unik seperti melindungi obat dari degradasi, bertarget ke tempat aksi dan mengurangi efek toksik dan efek samping, namun penggunaannya terbatas karena sifatnya yang bermasalah seperti efisiensi enkapsulasi yang rendah, obat yang larut air mudah lepas dengan cepat dalam komponen darah, dan stabilitas penyimpanan yang rendah sementara nanopartikel polimerik memiliki beberapa keuntungan spesifik dibandingkan liposom. Sebagai contoh, nanopartikel polimerik membantu meningkatkan stabilitas dari obat dan protein dan menghasilkan sifat pelepasan terkontrol (Vila dkk .,2002; Mu dan Feng, 2003)
Biokonjugasi antara nanopartikel dengan suatu molekul penarget (targeting agent) sebagai suatu sistem penghantaran obat tertarget merupakan alternatif yang menarik. Nanopartikel yang telah termodifikasi menunjukkan
kenaikan efek terapi dibandingkan dengan tanpa konjugasi (Broyer dkk., 2011), hal ini diakibatkan karena obat ditransportkan ke tempat aksi secara spesifik sehingga dapat lebih efektif dan dapat mengurangi efek samping. Strategi konjugasi menjadi faktor penting dalam keberhasilan pembuatan terapi yang tertarget. Strategi pembuatan terletak pada pengikatan gugus aktif pada permukaan nanopartikel dengan suatu molekul penarget (Wilczewska dkk., 2012). Sistem penghantaran tertarget ini sering diaplikasikan pada pengobatan kanker. Targeting agent dapat berupa protein (monoklonal antibodi dan fragmen-fragmennya), asam nukleat, atau ligan lainnya (peptida, vitamin, karbohidrat) (Peer dkk., 2007). Pada penelitian ini menggunakan nanopartikel dari alginat. Yang secara umum mempunyai ukuran sekitar 10- 100 nm. Nanopartikel alginat bisa membawa enzim, obat, dan senyawa kimia lainnya dengan cara dijerap di dalam nanopartikel atau dengan menempelkan/konjugasi pada matriks dari naopartikel (paques dkk.,2014). Berikut beberapa metode yang digunakan untuk membentuk nanopartikel, yaitu :
a) Gelasi ionik
Penyiapan nanopartikel dengan metode gelasi ionik pertama kali dilaporkan oleh Calvo (1998) dan telah diuji dan dikembangkan secara luas (Janes dkk., 2001; Pan dkk., 2002). Mekanisme pembentukan nanopartikel didasarkan pada interaksi elektrostatik antara gugus amina alginat dan muatan negative kelompok polianion seperti tripolifosfat.
b) Dispersi polimer
1. Metode penguapan solven
Polimer dilarutkan ke dalam pelarut organik seperti diklorometan, kloroform, atau etil asetat. Pelarut yang digunakan adalah pelarut yang digunakan juga untuk melarutkan obat-obat yang hidrofobik. Campuran polimer dan larutan obat kemudian dielmusikan ke dalam larutan berair yang mengandung surfaktan atau emulsifying agent. Setelah terbentuk emulsi yang stabil, pelarut organik diuapkan masing-masing dengan pengurangan tekanan atau pengadukan terus-menerus. Ukuran partikel yang terbentuk dipngaruhi oleh tipe dan konsentrasi stabilizer, kecepatan pengadukan dan konsentrasi polimer (Kwon., 2001).
2. Metode difusi spontan
Dalam metode ini, air bercampur pelarut bersama dengan sejumlah kecil air bercampur pelarut organik digunakan sebagai fase minyak. Karena difusi spontan pelarut sebuah turbulensi antar muka yang dibuat antara 2 fase yang mengarah ke pembentukan partikel kecil. Konsentrasi air bercampur pelarut meningkat, penurunan ukuran dapat dicapai.
c) Metode polimerisasi monomer
Polimer dibuat dengan proses polimerisasi untuk membentu nanopartikel dalam medium polimerisasi bersama dengan monomer, kemudian diinisiasi dengan penambahan ion atau radikal bebas atau radiasi sinar berenergi seperti sinar gamma, UV-Vis atau dengan menambahkan obat dalam polimer nanopartikel yang sudah terbentuk sebelumnya supaya monomer saling berikatan menjadi polimer yang mengendap dalam ukuran nanopartikel dengan membawa
obat (Reis dkk., 2006).
Karakterisasi nanopartikel yang berpengaruh pada penghantaran obat antara lain ukuran partikel. Ukuran partikel dan distribusi ukuran partikel dapat menggambarkan distribusi atau nasib obat di dalam tubuh, toksisitas dan kemampuan penargetan nanopartikel tersebut. Ukuran nanopartikel berpengaruh pada loading obat, pelepasan obat dan stabilitas nanopartikel (Panyam dan Labhasetwar, 2003). Nanopartikel mempunyai kemampuan uptake intracellular yang lebih tinggi dibandingkan dengan mikropartikel dan mempunyai range target terapi biologis yang lebih luas karena ukurannya yang lebih kecil dan mudah bergerak. Metode menentukan ukuran nanopartikel dapat dilakukan dengan alat
Scanning Electron Microscopy (SEM) atau Transmission Electron Microscope
(TEM) (Kroll dkk., 1998).
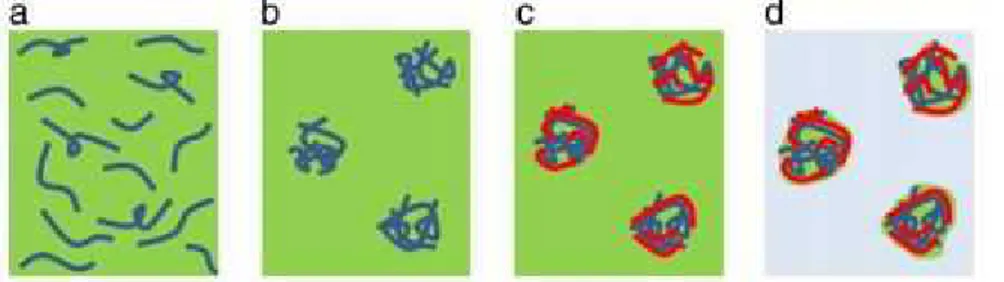
Formula dari nanopartikel alginat yang membawa senyawa obat biasanya berukuran 250- 850 nm (Rajaonarivony dkk,1993). Pada pembentukan nanoagregat (Gambar 7) konsentrasi alginat dan kationik polimer yang digunakan, berat molekul, konsentrasi CaCl2sangat berpengaruh pada ukuran nanopartikel.
Gambar 7. Skema pembentukan nano agregat. Keterangan : (a) pregel setelah ditambahkan CaCl2(b). penambahan polimer kation (c) isolasi, pencucian (d). nanoagregat (J.P paques
F. Landasan Teori
Metode analisa kualitatif yang sederhana untuk sampel yang mengandung protein adalah teknik elektroforesis menggunakan gel akrilamid. Prinsip metode ini adalah memisahkan protein berdasarkan perbedaan bobot atau ukuran molekulnya (Wong dan Jameson, 2012). BSA yang terkonjugasi oleh nanopartikel MJ-30 akan memiliki bobot molekul yang lebih besar dibandingkan dengan BSA bebas. BSA dengan ukuran yang lebih besar akan memiliki jarak migrasi lebih pendek saat bergerak pada gel yang diberi aliran listrik menuju anoda.
Penelitian terdahulu bisa mengidentifikasi kojugasi antara polimer pektin dengan BSA menggunakan Non-Denaturating Polyacrilamid Gel Electrophoresis (Native-PAGE) karena dapat mempertahankan bentuk asli protein. Sodium
Duodecyl Sulphonate atau SDS-PAGE bisa memutus ikatan amida antara BSA
dan pectin. BSA lebih terikat kuat pada SDS dibandingkan dengan pektin karena SDS merupakan senyawa yang mampu terikat kuat pada bagian hidrofobik asam amino dan memberikan muatan negatif pada semua protein karena memiliki bagian yang sangat bermuatan pada gugus sulfatnya (Juhairiyah., 2015). Untuk menghindari putusnya konjugasi antara BSA dengan alginat pada permukaan nanopartikel MJ-30 maka dilakukan metode elektroforesis menggunakan prinsip Native-PAGE.
Konsentrasi gel poliakrilamid dan lama waktu pengembangan elektroforesis merupakan faktor yang penting pada pita hasil pemisahan protein.
Ukuran pori gel pada poliakrilamid tergantung pada konsentrasi dari akrilamid dan bis-akrilamid yang digunakan. Konsentrasi yang dipilih tergantung dari ukuran pori gel yang ingin dipisahkan. Semakin kecil bobot molekul protein yang akan dipisahan maka konsentrasi gel yang dibutuhkan makin tinggi (Arora dkk., 2013). Namun, ukuran dari pori tersebut sulit untuk diperkirakan secara tepat. Nanopartikel MJ30 dengan polimer alginat terkonjugasi BSA mempunyai kisaran ukuran 129 kDa sampai 297 kDa. Gel poliakrilamid dengan konsentrasi 8% dapat memisahkan protein dengan bobot molekul 40 kDa sampai dengan 250 kDa (Thermo Fisher Scientific Inc.,2016). Alginat mempunyai karakter mudah untuk
swelling dan dalam satu nanopartikel tidak dapat dipastikan berapa molekul
alginat yang membentuk gel. Untuk itu dibutuhkan gel dengan ukuran pori yang lebih besar dari 8%.
Waktu pengembangan elektroforesis merupakan komponen yang sangat penting pada identifikasi pita hasil konjugasi. Waktu pengembangan yang terlalu pendek tidak akan menghasilkan pemisahan yang sempurna dari sampel. Pada metode Native-PAGE, penentu kecepatan migrasi BSA adalah muatan asli protein itu sendiri tanpa adanya tambahan muatan negatif oleh SDS sehingga pergerakan protein akan menjadi lebih lama. Lama waktu pengembangan elektroforesis berkaitan dengan sumber daya listrik yang digunakan. Sel vertikal biasanya menggunakan sumber daya listrik 10- 20 V/cm dan arus listrik dengan rentang 15- 25 mA/mm tebal gel. Jika kelebihan panas dapat mengakibatkan kerusakan pada protein sampel maupun pada gel (Garvin, 2003). Untuk itu perlu dilakukan pemilihan sumber daya listrik yang tepat.
Untuk interpretasi pita hasil elektroforesis dilakukan dengan pewarnaan. Poliakrilamid gel elektroforesis umumnya mendeteksi protein dengan pewarna organik yaitu coomassie Blue. Pewarna Coomassie Brilliant Blue R-250 merupakan pewarna yang memiliki gugus asam sulfonat yang akan bereaksi dengan gugus amina pada protein (BioTechniques, 1996). Selain itu, penelitianpenelitian sebelumnya yang menggunakan BSA ataupun protein lain menggunakan coomassie blue sebagai pewarna (Juhairiyah, 2015; Kristiani, 2015; Maakh, 2015 ).
G. Hipotesis
1. Gel poliakrilamid dengan konsentrasi antara 5-8% akan menghasilkan pita elektroforesis dengan pola migrasi yang baik sehingga dapat mengidentifikasi adanya konjugasi nanopartikel MJ- 30 dengan BSA.
2. Waktu pengembangan yang lebih lama akan menghasikan pemisahan pita elektroforesis yang lebih baik.