SELAMA PERIODE KEMUNDURAN MUTU
MOHAMMAD IRFAN C34051397
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2010
SELAMA PERIODE KEMUNDURAN MUTU
Oleh: Mohammad Irfan
C34051397
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2010
Judul Skripsi : Aktivitas Enzim Katepsin dan Kolagenase
pada Kulit Ikan Bandeng (Chanos chanos, Forskal) selama Periode Kemunduran Mutu
Nama Mahasiswa : Mohammad Irfan
NRP : C34051397
Menyetujui, Komisi Pembimbing
Pembimbing I Pembimbing II
(Dr. Tati Nurhayati, S.Pi, M.Si) (Dra. Ella Salamah, M.Si) NIP 19700807 199603 2 002 NIP 19530629 198803 2 001
Mengetahui,
Ketua Departemen Teknologi Hasil Perairan
(Dr. Ir. Ruddy Suwandi, MS, M.Phil) NIP 19580511 198503 1 002
pada Kulit Ikan Bandeng (Chanos chanos, Forskal) selama Periode Kemunduran
Mutu. Dibimbing oleh TATI NURHAYATI dan ELLA SALAMAH.
Autolisis oleh enzim diketahui merupakan salah satu hal yang berperan dalam kemunduran mutu kulit ikan. Enzim-enzim yang berperan dalam kemunduran mutu kulit ikan adalah enzim-enzim proteolitik, seperti katepsin dan kolagenase. Katepsin merupakan enzim yang terdapat dalam lisosom sel dan mendegradasi protein miofibril pada otot ikan, sedangkan kolagenase mendegradasi ikatan polipeptida terutama pada jaringan ikat dari ikan.
Penelitian dilakukan untuk mengetahui fase kemunduran mutu (post mortem) ikan bandeng (Chanos chanos, Forskal), pola kemunduran mutu,
perubahan parameter kesegaran, serta aktivitas enzim katepsin dan kolagenase pada kulit ikan bandeng. Penelitian dilakukan pada kulit ikan bandeng yang tidak dipuasakan sebelum dipanen dan disimpan pada suhu ruang (kode: P), dipuasakan sebelum dipanen dan disimpan pada suhu ruang (kode: Q), tidak dipuasakan sebelum dipanen dan disimpan pada suhu chilling (kode: R), dipuasakan sebelum
dipanen dan disimpan pada suhu chilling (kode: S).
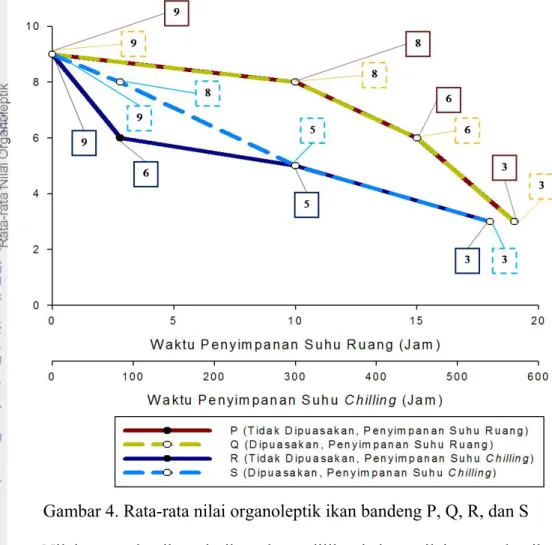
Hasil penelitian menunjukan bahwa fase pre rigor ikan P dan Q terjadi
sesaat setelah ikan mati atau pada jam ke-0 penyimpanan, rigor mortis terjadi
pada jam ke-10 penyimpanan, post rigor jam ke-15, serta busuk pada jam ke-19
penyimpanan. Ikan dengan perlakuan R dan S, fase pre rigor terjadi sesaat
setelah ikan mati atau pada jam ke-0 penyimpanan, rigor mortis terjadi pada
jam ke-84 penyimpanan, post rigor jam ke-300, serta busuk pada jam ke-540
(23 hari) penyimpanan. Kemunduran pada ikan yang disimpan pada suhu ruang (ikan P dan Q) terjadi lebih cepat dibanding dengan ikan yang disimpan pada suhu
chilling (R dan S).
Hasil penelitian menunjukan bahwa terdapat perbedaan aktivitas enzim
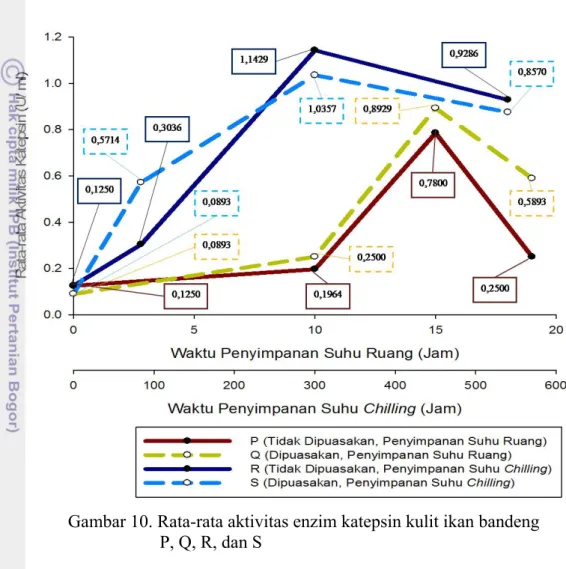
katepsin dan kolagenase pada tiap fase kemunduran mutu (ANOVA; α=0,05). Aktivitas enzim katepsin tertinggi terdapat pada fase post rigor. Aktivitas enzim katepsin pada kulit ikan bandeng P, Q, R, dan S
pada fase post rigor adalah 0,7800 U/ml; 0,8929 U/ml; 1,1429 U/ml, dan
1,0357 U/ml. Aktivitas enzim kolagenase pada kulit ikan bandeng P, Q, R, dan S tertinggi terdapat pada fase post rigor. Aktivitas enzim kolagenase ikan P, Q, R,
dan S pada fase post rigor adalah, 0,0708 U/ml; 0,0792 U/ml; 0,0667 U/ml, dan
0,0750 U/ml. Hubungan korelasi linier sederhana menunjukkan bahwa aktivitas enzim katepsin dan kolagenase berhubungan erat dengan parameter kesegaran ikan, yaitu organoleptik, TVB dan TPC. Aktivitas enzim katepsin dan kolagenase berhubungan kurang erat dengan nilai pH. Hubungan antara aktivitas enzim katepsin dan kolagenase menjadi kurang erat ketika memasuki fase busuk.
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini Saya menyatakan bahwa skripsi saya yang berjudul “Aktivitas
Enzim Katepsin dan Kolagenase pada Kulit Ikan Bandeng (Chanos chanos, Forskal) selama Periode Kemunduran Mutu” adalah hasil karya
saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal dari kutipan atau karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di akhir bagian skripsi ini.
Bogor, Agustus 2010
Mohammad Irfan
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Allah SWT karena berkat rahmat, hidayah serta kesabaran yang diberikan-Nyalah penulis dapat menyelesaikan penyusunan skripsi dengan judul “Aktivitas Enzim Katepsin dan Kolagenase selama Periode Kemunduran Mutu”. Penelitian ini dapat terlaksana atas
pembiayaan dari program Hibah Bersaing 2008 atas nama Dr. Tati Nurhayati, S.Pi, M.Si. Penyusunan skripsi ini merupakan salah satu
syarat untuk memperoleh gelar sarjana di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada semua pihak yang telah membantu dalam penulisan skripsi ini, terutama kepada:
1. Ibu Dr. Tati Nurhayati S.Pi, M.Si selaku ketua komisi pembimbing yang telah memberikan kesempatan kepada penulis untuk melaksanakan penelitian serta memberikan arahan, bimbingan dan semangat kepada penulis.
2. Ibu Dra. Ella Salamah, M.Si selaku anggota komisi pembimbing yang telah memberikan arahan dan bimbingan kepada penulis dalam menyelesaikan penulisan skripsi ini.
3. Ibu Dra. Pipih Suptijah, MBA selaku dosen penguji yang telah memberikan masukan, saran dalam penulisan skripsi ini.
4. Bapak Dr. Ir. Agoes Mardiono Jacoeb, Dipl-biol selaku komisi pendidikan departemen Teknologi Hasil Perairan (THP) yang telah banyak membantu dalam penyelesaian skripsi ini.
5. Keluarga Penulis, terutama Ayah dan Ibu, kakak-kakak penulis yang telah memberikan dukungan dan membantu penulis dalam menyelesaikan skripsi ini.
6. Dina Dwi Astuti, S.Si atas kesabarannya dan semangat yang diberikan kepada penulis.
8. Ibu Ema (THP), Bapak Wahyu (FKH), Ibu Martini dan Bapak Arya (Biokimia) yang telah banyak membantu penulis.
9. Tim seperjuangan: Rustamaji, S.Pi, Nina Fentiana S.Pi, Jamaludin S.Pi, Rijan Zakaria S.Pi, Bapak Kurnianto PS atas dukungan dan kebersamaannya selama penelitian.
10.Bapak Oci beserta staf Dinas Kelautan dan Perikanan Kota Tangerang atas bantuannya selama pengambilan sampel penelitian.
11.Fuad Wahdan M, S.Pi, Sabda Aji Pambayu, S.Pi atas dukungan serta kebersamaannya dalam perkuliahan maupun penyelesaian skripsi ini. 12.Teman-teman THP 42 yang telah banyak membantu penulis sehingga
skripsi ini dapat diselesaikan dengan baik.
13.Seluruh civitas THP lain yang telah banyak membantu penulis dalam penyelesaian skripsi ini.
14.Semua pihak yang telah membantu penulis dalam menyelesaikan skripsi ini yang tidak dapat penulis sebutkan nama satu persatu.
Penulis menyadari bahwa masih banyak kekurangan dalam penulisan skripsi ini. Oleh karena itu, sangat diharapkan kritik dan saran dalam penyempurnaan skripsi ini. Semoga tulisan ini bermanfaat bagi pihak-pihak yang memerlukan.
Bogor, Agustus 2010
Mohammad Irfan
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 28 September 1987. Penulis merupakan anak ke-3 dari 3 bersaudara, dari pasangan Bapak A Rahim Jabbar dan Ibu Ratna Djuwita. Penulis memulai jenjang pendidikan formal pada SD Tunas Jakasampurna, Bekasi yang lulus pada tahun 1999. Setelah itu, penulis melanjutkan sekolah ke SLTPI Al-Azhar 6 Jakapermai, Bekasi dan lulus pada tahun 2002. Penulis menyelesaikan pendidikan menengah atas di SMUI Al-Azhar 1, Jakarta Selatan pada tahun 2005.
Penulis masuk ke Institut Pertanian Bogor (IPB) melalui jalur USMI (Undangan Seleksi Masuk IPB) pada tahun 2005 dan diterima sebagai mahasiswa mayor Teknologi Hasil Perairan pada tahun 2006. Selama menjalani pendidikan di IPB, penulis pernah menjadi asisten praktikum mata kuliah biokimia hasil perairan pada tahun ajaran 2007/2008 dan pernah mengikuti kegiatan Pengembangan Kreativitas Mahasiswa pada tahun 2007/2008. Penulis juga pernah menjadi staf Departemen Kewirausahaan Himpunan Mahasiswa Teknologi Hasil Perikanan tahun 2006/2007 lalu menjadi Kepala Departemen Kewirausahaan Himpunan Mahasiswa Teknologi Hasil Perikanan tahun 2007/2008. Selain itu, penulis juga aktif di kegiatan Unit Kegiatan Mahasiswa (UKM) Institut Karate-do Indonesia Institut Pertanian Bogor (INKAI IPB).
vii Halaman DAFTAR TABEL ... ix DAFTAR GAMBAR ... x DAFTAR LAMPIRAN ... xi 1. PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Tujuan ... 4 2. TINJAUAN PUSTAKA ... 5
2.1 Deskripsi dan Klasifikasi Ikan Bandeng (Chanos chanos, Forskal) .... 5
2.2 Kandungan Gizi Ikan Bandeng ... 6
2.3 Kulit Ikan ... 6
2.4 Mutu Ikan ... 7
2.5 Kemunduran Mutu Ikan ... 10
2.5.1 Pre rigor ... 11
2.5.2 Rigor mortis ... 12
2.5.3 Post rigor ... 12
2.5.4 Busuk ... 12
2.6 Metode Penentuan Kesegaran Ikan ... 13
2.7 Enzim ... 15
2.7.1 Enzim katepsin ... 16
2.7.2 Enzim kolagenase ... 17
2.8 Peranan Enzim Katepsin dan Kolagenase dalam Kemunduran Mutu Ikan ... 18
3. METODOLOGI ... 19
3.1 Pelaksanaan Penelitian ... 19
3.2 Bahan dan Alat Penelitian ... 19
3.3 Tahapan Penelitian ... 20
3.3.1 Penelitian pendahuluan ... 20
3.3.2 Penelitian utama ... 20
3.4 Analisis ... 21
3.4.1 Uji organoleptik (BSNb 2006) ... 21
3.4.2 Uji nilai pH (Apriyantono et al. 1989) ... 21
3.4.3 Uji total volatile base (TVB) (Apriyantono etal. 1989) ... 21
3.4.4 Uji total plate count (TPC) (Fardiaz 1987) ... 22
viii
3.5 Assay Aktivitas Enzim Katepsin (Dinu etal. 2002) ... 24
3.6 Assay Aktivitas Enzim Kolagenase (Moore dan Stein 1954 diacu dalam Kim etal. 2002) ... 25
3.7 Pengukuran Konsentrasi Protein Enzim (Bradford 1976) ... 26
3.8 Analisis Data ... 27
4. HASIL DAN PEMBAHASAN ... 29
4.1 Penelitian Pendahuluan ... 29
4.2 Penelitian Utama ... 31
4.2.1 Nilai organoleptik ... 31
4.2.2 Nilai pH ... 36
4.2.3 Nilai total volatile base (TVB) ... 39
4.2.4 Nilai total plate count (TPC) ... 41
4.2.5 Konsentrasi protein katepsin dan aktivitas enzim katepsin ... 43
4.2.6 Konsentrasi protein kolagenase dan aktivitas enzim kolagenase ... 47
4.3 Hubungan antara Aktivitas Enzim Katepsin dan Kolagenase dengan Parameter Kesegaran Ikan ... 50
4.4 Hubungan antar Parameter Kesegaran Ikan ... 55
5. KESIMPULAN DAN SARAN ... 59
5.1 Kesimpulan ... 59
5.2 Saran ... 60
DAFTAR PUSTAKA ... 61
ix
No Teks Halaman
1. Kandungan gizi ikan bandeng per 100 gr bahan ... 6
2. Ciri-ciri ikan segar dan ikan yang mulai busuk ... 8
3. Persyaratan mutu ikan segar ... 10
4. Jenis-jenis enzim autolisis pada ikan ... 16
5. Jenis-jenis enzim lisosom proteinase pada Ikan ... 17
6. Pembuatan larutan standar BSA konsentrasi 0,1-1,0 mg/mL ... 26
7. Koefisien korelasi linier sederhana aktivitas enzim katepsin dan kolagenase dengan parameter kesegaran ikan P, Q, R, dan S dari fase pre rigor hingga post rigor ... 53
8. Koefisien korelasi linier sederhana aktivitas enzim katepsin dan kolagenase dengan parameter kesegaran ikan P, Q, R, dan S dari fase pre rigor hingga busuk ... 53
x
No Teks Halaman
1. Ikan bandeng (Chanoschanos, Forskal) ... 5
2. Bagian-bagian dari kulit ikan ... 7
3. Perubahan setelah ikan mati (Eskin 1990) ... 10
4. Rata-rata nilai organoleptik ikan bandeng P, Q, R, dan S ... 32
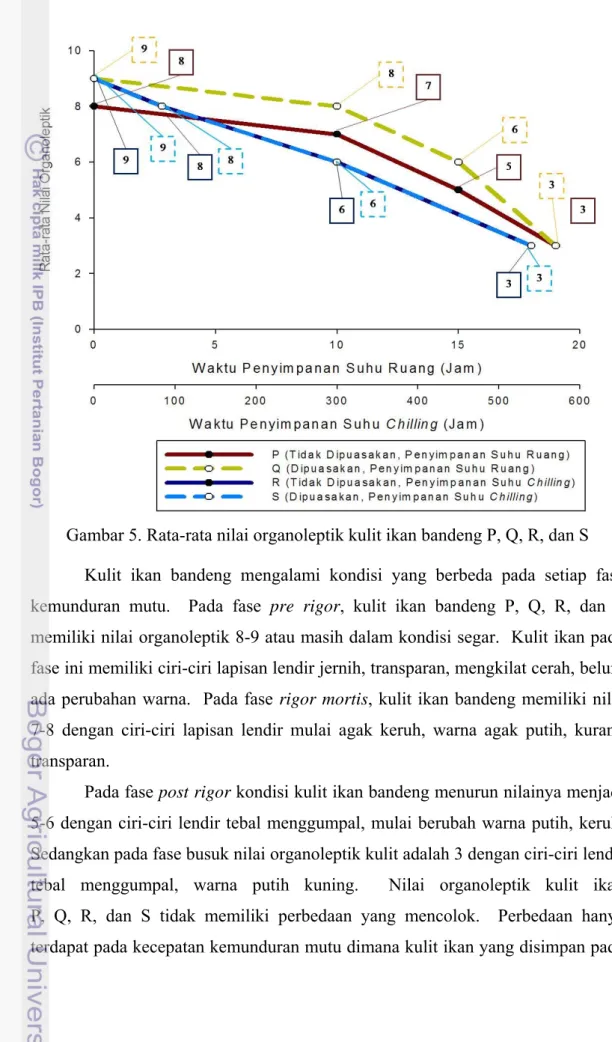
5. Rata-rata nilai organoleptik kulit ikan bandeng P, Q, R, dan S ... 35
6. Rata-rata nilai pH kulit ikan bandeng P, Q, R, dan S ... 37
7. Rata-rata nilai TVB kulit ikan bandeng P, Q, R, dan S ... 39
8. Rata-rata nilai log TPC kulit ikan bandeng P, Q, R, dan S ... 42
9. Rata-rata konsentrasi protein katepsin kulit ikan bandeng P, Q, R, dan S ... 44
10. Rata-rata aktivitas enzim katepsin kulit ikan bandeng P, Q, R, dan S ... 45
11. Rata-rata konsentrasi protein kolagenase kulit ikan bandeng P, Q, R, dan S ... 48
12. Rata-rata aktivitas enzim kolagenase kulit ikan bandeng P, Q, R, dan S ... 49
13. Korelasi linier sederhana aktivitas enzim katepsin dan kolagenase fase pre rigor hingga busuk pada kulit ikan bandeng P, Q, R, dan S; aktivitas katepsin dengan; (a) organoleptik ikan bandeng; (b) nilai organoleptik kulit ikan bandeng; (c) pH; (d) TVB; (e) TPC; aktivitas kolagenase dengan (f) nilai organoleptik ikan bandeng; (g) nilai organoleptik kulit ikan bandeng; (h) pH; (i) TVB; (j) TPC ... 52
14. Hubungan antara aktivitas enzim dan parameter kesegaran kulit ikan bandeng P ... 55
15. Hubungan antara aktivitas enzim dan parameter kesegaran kulit ikan bandeng Q ... 56
16. Hubungan antara aktivitas enzim dan parameter kesegaran kulit ikan bandeng R ... 57
17. Hubungan antara aktivitas enzim dan parameter kesegaran kulit ikan bandeng S ... 58
xi
No Halaman
1. Dokumentasi penelitian ... 65
2. Kerangka penelitian secara keseluruhan ... 68
3. Score sheet uji organoleptik ikan segar (SNI-10-2346-2006) ... 69
4. Kurva standar penentuan konsentrasi protein enzim ... 72
5. Uji ragam (ANOVA) nilai pH ... 74
6. Uji ragam (ANOVA) nilai TVB ... 76
7. Uji ragam (ANOVA) nilai TPC ... 78
8. Uji ragam (ANOVA) aktivitas enzim katepsin ... 80
9. Uji ragam (ANOVA) aktivitas enzim kolagenase ... 82
10. Data hasil pengujian pH, TVB, TPC, assay aktivitas enzim katepsin dan kolagenase, pengukuran konsentrasi protein katepsin dan kolagenase ... 84
1.1 Latar Belakang
Ikan merupakan sumberdaya hayati yang memiliki potensi pengembangan yang besar terutama di Indonesia. Ikan telah menjadi komoditas yang dikenal luas oleh masyarakat dan dimanfaatkan terutama sebagai bahan pangan maupun non-pangan. Ikan memiliki kandungan protein dan asam amino esensial yang dibutuhkan oleh tubuh sehingga ikan merupakan bahan makanan yang bernilai gizi tinggi serta mudah dicerna (Adawyah 2007). Salah satu potensi perikanan yang cukup besar adalah perikanan budidaya di tambak. Perikanan tambak memiliki potensi sebesar 1.224.076 km2 dan baru dimanfaatkan sebesar 613.175 km2 (Kelompok Kerja Data Statistik Kelautan dan Perikanan 2009). Salah satu hasil perikanan tambak yang banyak diminati oleh masyarakat Indonesia dan potensial pengembangannya adalah ikan bandeng.
Ikan bandeng (Chanos chanos, Forskal) merupakan ikan yang telah dikonsumsi oleh masyarakat Indonesia secara luas serta cukup potensial pengembangannya. Bandeng merupakan jenis ikan budidaya air payau (tambak) yang mempunyai bentuk badan yang memanjang, padat, dapat mencapai ukuran yang cukup besar serta rasanya cukup lezat sehingga membuat bandeng sangat disukai oleh masyarakat Indonesia secara luas. Penyebaran bandeng sangat luas karena ikan ini merupakan ikan yang hidup pada daerah payau (estuari) sehingga memiliki toleransi salinitas yang tinggi. Ikan-ikan yang hidup pada daerah estuari memiliki regulasi ion dan air isotonik yang membuatnya dapat hidup di habitatnya (Fujaya 2004). Produksi budidaya bandeng nasional pada tahun 2006 mencapai 212.883 ton kemudian menjadi 263.139 ton pada tahun 2007 dan 277.471 ton pada tahun 2008 (Kelompok Kerja Data Statistik Kelautan dan Perikanan 2009). Kenaikan produksi ikan bandeng terjadi seiring dengan usaha dari pemerintah untuk menaikan produksi bandeng karena besarnya potensi ikan bandeng (Irianto dan Soesilo 2007). Ikan bandeng mempunyai toleransi salinitas yang sangat tinggi sehingga tidak hanya dapat dipelihara ditambak tetapi juga di kolam air tawar sehingga dapat lebih terkontrol dan bandeng tahan terhadap temperatur
tinggi sehingga memang cocok untuk dibudidayakan di Indonesia (Saparinto 2009).
Kulit ikan bandeng merupakan salah satu bagian pada ikan bandeng yang banyak dimanfaatkan selain dagingnya. Kulit ikan bandeng didapat dari hasil pengolahan ikan bandeng yang memisahkan kulit dengan dagingnya. Pemanfaatan kulit ikan bandeng tidak hanya terbatas sebagai bahan pangan tetapi juga untuk produk non pangan. Kulit ikan bandeng sebagaimana kulit ikan lainnya diketahui memiliki unsur utama berupa protein kolagen yang banyak digunakan untuk bahan baku kulit olahan serta bahan perekat (Adawyah 2007). Kulit ikan sangat potensial pengembangannya karena dapat dijadikan sebagai alternatif bahan baku kulit olahan/kulit samak. Kebutuhan bahan baku kulit mentah untuk produk kulit olahan Indonesia saat ini berjumlah 100.000 ton, namun saat ini baru dapat dipenuhi sekitar 40 % saja yang berasal dari kulit sapi, kerbau, kambing, dan domba (Anonim 2008). Kulit ikan dapat dijadikan alternatif untuk memenuhi kekurangan bahan baku kulit tersebut. Perkembangan saat ini menunjukan bahwa kulit ikan diketahui mengandung enzim-enzim, seperti kolagenase yang dapat dimanfaatkan pada industri untuk memisahkan kulit ikan dengan daging (Shahidi dan Kamil 2001). Hal yang perlu diperhatikan dalam pemanfaatan kulit ikan adalah kesegaran kulit ikan yang akan diolah. Kulit ikan rentan terhadap kerusakan akibat aktivitas bakteri dan enzim sehingga diperlukan pengetahuan mengenai kemuduran mutu pada kulit ikan serta untuk menstabilkannya (Gimenez etal. 2005).
Sebagai bahan pangan maupun untuk bahan baku industri, ikan ternyata memiliki kekurangan yang mempengaruhi pemanfaatannya, yaitu kandungan air yang sangat tinggi (80 %) dan daging ikan yang sangat mudah dicerna oleh enzim autolisis. Hal-hal tersebut dapat menyebabkan kebusukan ikan yang cepat. Proses pembusukan pada ikan disebabkan oleh aktivitas enzim, mikroorganisme dan oksidasi lemak dalam tubuh ikan itu sendiri (Adawyah 2007).
Kekurangan yang terdapat pada ikan tersebut dapat menghambat usaha pemasaran hasil ikan sehingga tidak jarang menyebabkan kerugian besar terutama di saat produksi ikan melimpah. Oleh karena itu, diperlukan suatu proses untuk dapat mempertahankan mutunya. Pemanfaatan ikan dengan mutu yang baik harus
menjadi prioritas. Selain itu pada pemanfaatannya untuk agroindustri mana pun, bahan baku ikan dengan kualitas yang baik sangat mempengaruhi mutu dan daya saing dari produk tersebut (Mangunwidjaja dan Sailah 2005).
Mutu ikan berkaitan dengan kesegarannya. Kesegaran ikan dapat dipertahankan dengan menggunakan teknik penanganan yang tepat. Penanganan yang dapat dilakukan pada ikan untuk mempertahankan mutunya dapat dilakukan dengan berbagai cara. Cara-cara yang dapat dilakukan adalah dengan menurunkan suhu ikan atau mempertahankan ikan tetap hidup. Penanganan ikan dengan menurunkan suhunya dilakukan untuk ikan yang dikonsumsi dalam keadaan mati. Penurunan suhu ikan atau disebut juga pendinginan umumnya dilakukan sampai suhu dingin (chilling) yaitu (-1)-5 0C. Suhu chilling dapat mempertahankan mutu ikan dengan menghambat aktivitas bakteri (Huss 1995).
Autolisis oleh enzim diketahui merupakan salah satu hal yang berperan dalam kemunduran mutu pada ikan. Enzim yang berperan dalam kemunduran mutu ikan adalah enzim proteolitik. Enzim proteolitik merupakan enzim yang bekerja pada substrat protein dan mendegradasinya. Enzim yang berperan dalam kemunduran mutu ikan diantaranya adalah katepsin dan kolagenase. Enzim katepsin merupakan enzim yang banyak terdapat pada lisosom sel dan mendegradasi protein miofibril otot ikan. Enzim katepsin menyebabkan pelunakan jaringan pada ikan, Enzim kolagenase mendegradasi ikatan polipeptida terutama pada jaringan ikat dari ikan (Huss 1995).
Mutu bahan baku ikan yang baik akan memberikan manfaat yang maksimal bagi masyarakat serta pengembangan produk olahan dari bahan baku ikan tersebut. Oleh karena itu, penelitian ini dilakukan untuk mengetahui kemunduran mutu pada kulit ikan bandeng selama periode kemunduran mutu, serta aktivitas enzim katepsin dan kolagenase yang berpengaruh pada kemunduran mutu ikan. Penelitian ini diharapkan dapat dijadikan acuan data bagi masyarakat luas maupun bagi industri untuk pengembangan komoditas hasil perairan ikan bandeng terutama bagian kulitnya.
1.2 Tujuan
Tujuan dari penelitian ini adalah:
(1) menentukan fase post mortem ikan bandeng pada penyimpanan suhu ruang dan chilling;
(2) menentukan pola kemunduran mutu kulit ikan bandeng pada penyimpanan suhu ruang dan chilling berdasarkan analisis tingkat kesegaran ikan;
(3) menentukan aktivitas enzim katepsin dan kolagenase kulit ikan bandeng selama kemunduran mutu pada penyimpanan suhu ruang dan suhu chilling serta korelasinya terhadap parameter kesegaran ikan.
2. TINJAUAN PUSTAKA
2.1 Deskripsi dan Klasifikasi Ikan Bandeng (Chanos chanos, Forskal)
Ikan bandeng atau milkfish termasuk ikan yang sudah lama dikenal di Indonesia. Ikan bandeng termasuk jenis ikan pelagis yang mencari makan di permukaan dan sering dijumpai di daerah dekat pantai atau litoral. Ikan bandeng merupakan ikan bertulang keras (Teleostei) dengan habitat di perairan payau. Diantara Genus-nya, ikan bandeng hanya terdapat satu spesies, yaitu ikan bandeng (Chanos chanos). Klasifikasi ikan bandeng menurut Nelson (1984) adalah:
Filum : Chordata Kelas : Pisces Sub kelas : Teleostei
Ordo : Gonorhynchiformes Famili : Chanidae
Genus : Chanos
Spesies : Chanos chamos (Forskal 1775)
Gambar 1. Ikan Bandeng (Chanoschanos, Forskal) (www.ag.auburn.edu /fish/image_gallery/data/media/13/milk.png)
Ikan bandeng memiliki ciri ciri morfologi berupa tubuh berbentuk pipih, sirip dorsal 13-17, sirip anal 9-11, sirip caudal 16. Ikan bandeng memiliki mulut kecil dan tidak bergigi. Ikan bandeng dapat mencapai ukuran 30-90 cm (Nelson 1984).
Ikan bandeng merupakan salah satu komoditas perikanan yang terdapat pada perairan dekat pantai atau pertemuan antara air laut dan air tawar (payau). Secara geografis, ikan ini hidup di daerah tropis maupun sub-tropis pada batas 300 LU – 400 LS. Ikan bandeng tersebar di perairan Indo-Pasifik mulai dari pantai timur Afrika, laut merah, pantai barat dan timur India, Asia Tenggara, bagian
selatan Jepang, pantai utara Australia, sampai ke pantai barat California, dan Meksiko (Saparinto 2009).
Ikan bandeng sudah lama dikenal di negara Indonesia sebagai ikan yang banyak dipelihara di tambak yang tersebar hampir di seluruh pulau besar di Indonesia (Jawa, Sumatera, Kalimantan, Sulawesi). Ikan ini telah banyak dikonsumsi masyarakat baik ikan segar maupun dalam bentuk olahan. Ikan ini juga dipelihara di Filipina dan Taiwan. Ikan bandeng ini ditempat lain disebut banding, mulch, agam (Sumatera), bolu (Bugis), bangos (Filipina) dan sabahi (Taiwan) (Saparinto 2009).
2.2 Kandungan Gizi Ikan Bandeng
Bandeng merupakan komoditas perikanan payau yang rasanya cukup enak dan digemari masyarakat. Selain itu ikan bandeng mempunyai nilai gizi yang tinggi, aman dan sehat dimakan. Kandungan gizi ikan bandeng dapat dilihat pada Tabel 1.
Tabel 1. Kandungan gizi ikan bandeng per 100 g bahan
Kandungan Gizi Jumlah Satuan
Air 66 g Kalori 129 Kal Protein 20 g Lemak 4,8 g Ca 20 mg P 150 mg Fe 2 mg Vitamin A 150 SI Vitamin B1 0,05 mg Vitamin C - - Bidd 80 g Sumber: Saparinto (2009)
Dikarenakan kandungan gizi-nya yang cukup baik, ikan bandeng telah sejak lama dimanfaatkan sebagai bahan pangan. Pengolahan ikan bandeng sebagai bahan makanan antara lain bandeng presto, bandeng cabut duri, bandeng bakar, bandeng asap (Saparinto 2009).
2.3 Kulit Ikan
Kulit ikan sama seperti vertebrata yang lain, terdiri dari dua jaringan, yaitu bagian luar yang disebut epidermis dan bagian dalam yang disebut dermis (corium). Sisik menempel pada kulit ikan yang berfungsi sebagai pelindung dari
kerusakan mekanis, seperti benturan pada ikan. Kulit ikan mengandung air 69,6 %, protein 26,9 %, abu 2,5 % dan lemak 0,7 % (Koehler 1990). Bagian-bagian dari kulit ikan dapat dilihat pada Gambar 2.
Gambar 2. Bagian-bagian dari Kulit Ikan (1= epidermis; 2= dermis/ corium; 3= jaringan ikat; 4= otot rangka) (Koehler 1990)
Pemanfaatan kulit ikan tidak hanya terbatas sebagai bahan pangan tetapi juga untuk produk non-pangan. Kulit ikan diketahui memiliki unsur utama berupa protein kolagen yang banyak digunakan untuk bahan baku kulit olahan serta bahan perekat (Adawyah 2007).
Kulit ikan akan mengalami kemunduran mutu seperti bagian ikan yang lain ketika ikan mati. Kulit ikan rentan terhadap kerusakan akibat aktivitas bakteri dan enzim sehingga diperlukan pengetahuan mengenai kemuduran mutu pada kulit ikan serta untuk menstabilkannya (Gimenez et al. 2005). Enzim-enzim yang banyak berperan dalam kemunduran mutu kulit seperti halnya pada ikan adalah enzim-enzim proteolitik seperti enzim katepsin dan kolagenase (Haard 1994). 2.4 Mutu Ikan
Mutu ikan adalah ciri-ciri dari ikan yang memenuhi permintaan atau batas toleransi dari konsumen. Mutu ikan sangat penting karena merupakan sesuatu yang bersifat mutlak untuk pemanfaatan ikan baik sebagai bahan pangan maupun sebagai bahan baku industri. Mutu ikan berkaitan dengan kesegaran ikan. Ikan yang segar mempunyai dua pengertian, yang pertama adalah ikan yang baru saja ditangkap, tidak disimpan atau diawetkan. Kedua, ikan yang mutunya masih baik, disimpan atau diawetkan dan mempunyai mutu yang tidak berubah serta belum mengalami kemunduran mutu baik secara fisik, kimia maupun biologis, misalnya ikan-ikan yang disimpan dingin atau beku (Huss 1995).
1 2 3 4
Tingkat kesegaran memberikan kontribusi utama terhadap mutu ikan. Kesegaran ikan sangat penting bagi mutu dari produk yang dihasilkan pada semua produk perikanan. Secara umum, ada dua metode utama yang biasa digunakan untuk menilai kesegaran dan mutu ikan, yaitu metode sensori (subyektif) dan non-sensori (obyektif) (Robb 2002).
Mutu suatu komoditas meliputi unsur-unsur mutu yang terlihat dan tersembunyi serta dapat diukur dan tidak dapat diukur. Unsur mutu terdiri dari 3 kategori (Soekarto 1990), yaitu:
(1) Sifat mutu, yaitu sifat yang dapat diukur langsung secara subyektif atau obyektif;
(2) Parameter mutu, yaitu besaran yang mencirikan sifat mutu suatu produk; (3) Faktor mutu, yaitu hal-hal yang tidak dapat diukur dan diamati secara
langsung, seperti varietas, faktor genetik dan asal daerah.
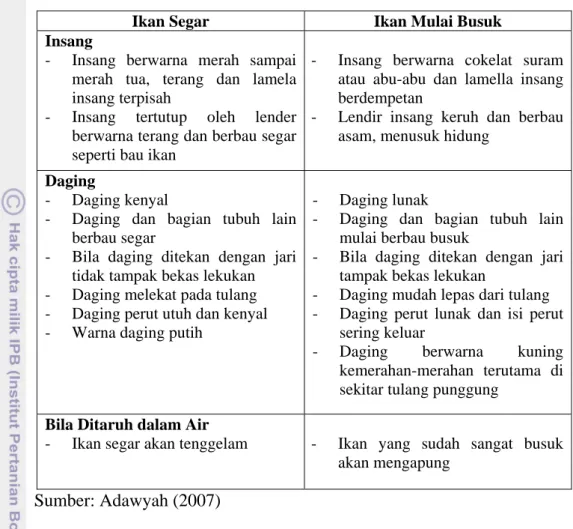
Ikan yang masih segar dapat ditentukan dengan beberapa parameter kesegaran ikan. Parameter-parameter tersebut merupakan standar mutu ikan. Parameter-parameter tersebut didapat dari sifat atau ciri fisika, kimia serta aktivitas mikrobiologis pada ikan yang menyebabkan ikan mengalami kemunduran mutu. Standar mutu ikan dapat dijadikan acuan untuk menentukan kesegaran ikan. Berikut ciri-ciri fisik ikan segar dan ikan yang mulai membusuk pada Tabel 2.
Tabel 2. Ciri-ciri ikan segar dan ikan yang mulai busuk
IkanSegar IkanMulaiBusuk
Kulit
- Warna kulit terang dan jernih Kulit masih kuat membungkus tubuh, tidak mudah sobek, terutama pada bagian perut
- Warna-warna khusus yang masih ada dan terlihat jelas
- Kulit berwarna suram, pucat dan berlendir banyak
- Kulit mulai terlihat mengendur di beberapa tempat tertentu
- Kulit mudah sobek dan warna-warna khusus sudah hilang
Sisik
- Sisik menempel kuat pada tubuh sehingga sulit dilepas
- Sisik mudah terlepas dari tubuh
Mata
- Mata tampak terang, jernih, menonjol dan cembung
- Tampak suram, tenggelam dan berkerut
Ikan Segar Ikan Mulai Busuk Insang
- Insang berwarna merah sampai merah tua, terang dan lamela insang terpisah
- Insang tertutup oleh lender berwarna terang dan berbau segar seperti bau ikan
- Insang berwarna cokelat suram atau abu-abu dan lamella insang berdempetan
- Lendir insang keruh dan berbau asam, menusuk hidung
Daging
- Daging kenyal
- Daging dan bagian tubuh lain berbau segar
- Bila daging ditekan dengan jari tidak tampak bekas lekukan - Daging melekat pada tulang - Daging perut utuh dan kenyal - Warna daging putih
- Daging lunak
- Daging dan bagian tubuh lain mulai berbau busuk
- Bila daging ditekan dengan jari tampak bekas lekukan
- Daging mudah lepas dari tulang - Daging perut lunak dan isi perut
sering keluar
- Daging berwarna kuning kemerahan-merahan terutama di sekitar tulang punggung
BilaDitaruhdalamAir
- Ikan segar akan tenggelam - Ikan yang sudah sangat busuk akan mengapung
Sumber: Adawyah (2007)
Selain ciri-ciri fisik, kesegaran ikan dapat dilihat dari parameter kimia (kadar air, pH, total volatile base (TVB), TBA, kadar histamin) dan aktivitas mikrobiologisnya. Badan Standarisasi Nasional (BSN) memberikan suatu standar dalam menentukan mutu ikan. Berikut persyaratan mutu ikan segar berdasarkan SNI 01-2729-2006 (BSNa 2006) pada Tabel 3.
Tabel 3. Persyaratan mutu ikan segar
Jenis Uji Satuan Persyaratan
a. Organoleptik Angka (1 – 9) Minimal 7 b. Cemaran mikroba*: - ALT - Escherichiacoli - Salmonella - VibrioCholerae Koloni/g APM/g APM/25 g APM/25 g Maksimal 5,0 x 105 Maksimal < 2 Negatif Negatif c. Cemaran kimia*: - Raksa (Hg) - Timbal (Pb) - Histamin - Cadmium (Cd) mg/Kg mg/Kg mg/Kg mg/Kg Maksimal 0,5 Maksimal 0,4 Maksimal 100 Maksimal 0,1
d. Parasit* Ekor Maksimal 0
*) Bila Diperlukan Sumber: BSNa (2006)
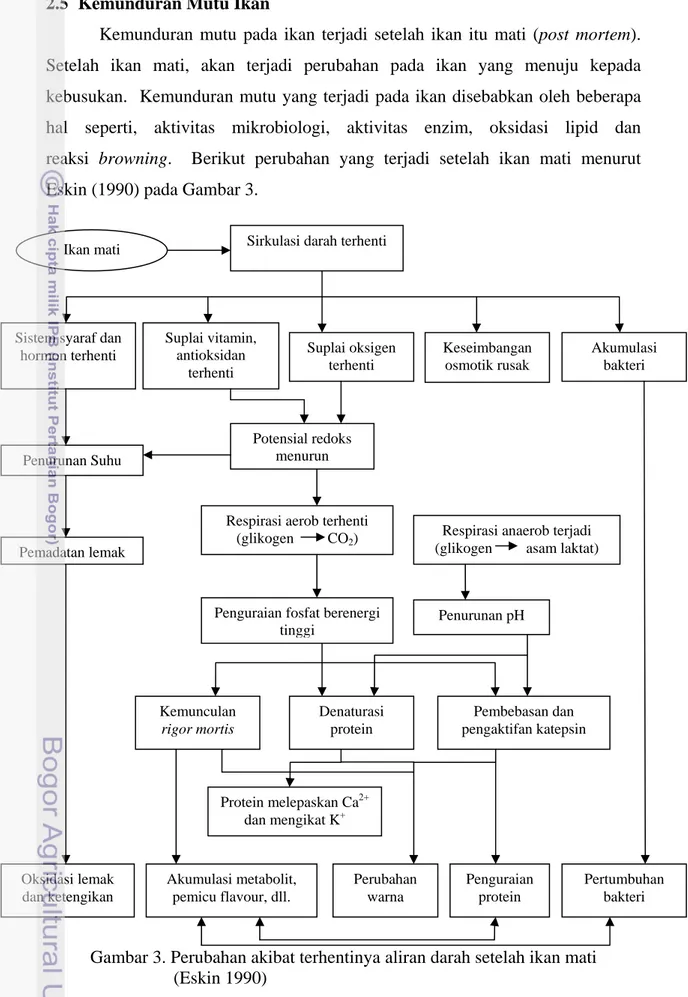
2.5 Kemunduran Mutu Ikan
Kemunduran mutu pada ikan terjadi setelah ikan itu mati (post mortem). Setelah ikan mati, akan terjadi perubahan pada ikan yang menuju kepada kebusukan. Kemunduran mutu yang terjadi pada ikan disebabkan oleh beberapa
hal seperti, aktivitas mikrobiologi, aktivitas enzim, oksidasi lipid dan reaksi browning. Berikut perubahan yang terjadi setelah ikan mati menurut Eskin (1990) pada Gambar 3.
Gambar 3. Perubahan akibat terhentinya aliran darah setelah ikan mati (Eskin 1990) Oksidasi lemak dan ketengikan Akumulasi metabolit, pemicu flavour, dll. Perubahan warna Pertumbuhan bakteri Penguraian protein Kemunculan rigor mortis Denaturasi protein Pembebasan dan pengaktifan katepsin Protein melepaskan Ca2+ dan mengikat K+ Penguraian fosfat berenergi
tinggi
Penurunan pH Pemadatan lemak
Respirasi aerob terhenti
(glikogen CO2) Respirasi anaerob terjadi
(glikogen asam laktat) Sistem syaraf dan
hormon terhenti Suplai vitamin, antioksidan terhenti Suplai oksigen terhenti Keseimbangan osmotik rusak Akumulasi bakteri Penurunan Suhu Potensial redoks menurun
Perubahan pasca kematian ikan (post mortem) terjadi setelah ikan mati dan aliran darah terhenti. Hasil dari terhentinya peredaran darah adalah serangkaian reaksi yang sangat kompleks dalam otot. Pengaruh yang cepat dari berhentinya peredaran darah dan penghilangan darah dari jaringan otot adalah kurangnya pemasukan oksigen ke dalam jaringan. Akibatnya jaringan tidak mampu membentuk kembali adenosin trifosfat (ATP) sebagai bahan energi sel, karena mekanisme transport elektron dan fosforilasi oksidatif segera terhenti. Hal ini menyebabkan respirasi anaerob yang menghasilkan asam laktat pada sel sehingga pH turun. Setelah pH turun, enzim proteolitik terutama katepsin akan bebas dan aktif kemudian mendegradasi protein. Pemecahan protein akan memacu pertumbuhan bakteri sehingga ikan akan semakin menunjukkan tanda-tanda kebusukan (Eskin 1990).
Proses kemunduran mutu ikan berlangsung cepat dikarenakan ikan merupakan bahan pangan yang cepat membusuk (highly perishable foods). Kecepatan kemunduran mutu ikan tersebut dipengaruhi oleh faktor internal dan
eksternal. Faktor internal meliputi spesies, ukuran, jenis kelamin. Faktor eksternal meliputi kondisi pembudidayaan, penanganan pasca panen serta sifat-sifat biokimia ikan (DKP dan JICA 2008).
Proses kemunduran mutu ikan terbagi menjadi beberapa fase sesuai
dengan urutan perubahan-perubahan yang terjadi setelah ikan mati. Fase kemunduran mutu tersebut secara umum menurut Junianto (2003) adalah:
fase pre rigor, rigor mortis, post rigor dan busuk. Fase-fase ini berkaitan erat dengan perubahan fisik, biokimiawi dan aktivitas bakteri yang diakibatkan terhentinya aliran darah setelah ikan mati.
2.5.1 Pre rigor
Fase prerigor merupakan perubahan yang terjadi pertama kali ketika ikan mati. Perubahan ini ditandai dengan pelepasan lendir dari permukaan dibawah kulit ikan. Perubahan ini terjadi karena terhentinya peredaran darah yang membawa oksigen dan energi untuk kegiatan metabolismenya. Meskipun ikan telah mati namun masih terjadi proses enzimatis. Proses ini berjalan tanpa kendali sehingga terjadi perubahan biokimia yang luar biasa (Yunizal dan Wibowo 1998).
Pada fase ini, terjadi penurunan kadar ATP dan kreatin fosfat serta perubahan glikogen menjadi asam laktat akibat respirasi anaerob. Hal ini akan menyebabkan turunnya pH pada ikan pada tahap selanjutnya. Tahap ini biasanya akan terjadi 1-7 jam setelah ikan mati (Adawyah 2007).
2.5.2 Rigor mortis
Fase selanjutnya adalah fase rigor mortis. Pada fase ini daging ikan menjadi lebih keras dari sebelumnnya. Daging ikan menjadi lebih keras dikarenakan terjadinya penggabungan protein aktin dan miosin menjadi kompleks aktin dan miosin yang bersifat irreversible (DKP dan JICA 2008). Pada fase ini belum terjadi aktivitas bakteri yang berarti, pH ikan masih turun dikarenakan penumpukan asam laktat sehingga bakteri belum bisa tumbuh dengan baik (Adawyah 2007).
Fase rigor mortis dianggap penting dalam industri perikanan. Hal ini karena fase ini dapat dijadikan petunjuk bahwa ikan masih segar. Fase ini dihindari pada industri fillet ikan karena daging ikan menjadi keras dan sulit untuk dilakukan pem-fillet-an (Huss 1995).
2.5.3 Post rigor
Setelah fase rigor mortis berakhir, ikan akan mengalami fase post rigor dimana daging ikan menjadi lemas kembali. Fase ini merupakan awal dari kebusukan ikan. Pada awalnya fase ini akan meningkatkan derajat penerimaan konsumen dikarenakan daging ikan akan lemas kembali. Setelah itu akan terjadi autolisis oleh enzim sehingga terjadi pendegradasian protein. Bakteri tumbuh pesat dikarenakan pH ikan mulai naik akibat degradasi protein oleh enzim yang menyediakan nutrien protein sederhana bagi bakteri (Huss 1995).
Proses autolisis oleh enzim mulai berlangsung pada tahap post rigor. Autolisis serta aktivitas bakteri juga akan menaikkan tingkat basa volatil yang terdapat pada ikan. Hal ini akan menyebabkan perubahan tekstur, rasa serta bau pada ikan (Poli et al. 2005).
2.5.4 Busuk
Fase busuk menandai akhir dari kemunduran mutu pada ikan dimana ikan tidak dapat lagi dikonsumsi. Fase ini ditandai dengan meningkatnya bakteri
pembusuk pada ikan. Tekstur, rasa dan bau sudah tidak dapat diterima lagi oleh konsumen.
Fase busuk ditandai dengan perubahan yang jelas pada tubuh ikan. Akan terjadi perubahan baik pada tekstur, rasa dan bau ikan. Nilai pH ikan akan naik akibat basa volatil yang terus menumpuk serta aktivitas bakteri yang meningkat pesat (Huss 1995).
Proses kemunduran mutu kesegaran ikan akan terus berlangsung jika tidak dihambat. Cepat lambatnya proses tersebut sangat dipengaruhi oleh banyak hal, baik faktor internal yang lebih banyak berkaitan dengan sifat ikan itu sendiri maupun eksternal yang berkaitan dengan lingkungan dan perlakuan manusia. Faktor biologis (internal) tidak mudah ditangani karena berkaitan dengan sifat ikan itu sendiri. Meski begitu, dalam beberapa hal beberapa tindakan dapat dilakukan. Misalnya, untuk ikan budidaya dipuasakan lebih dulu paling tidak 4 jam sebelum dipanen sehingga ikan tidak dalam kondisi kenyang ketika dipanen. Usaha yang paling dapat dilakukan adalah menangani faktor eksternal karena berkaitan dengan tindakan dan lingkungan yang diberikan (Junianto 2003).
Sifat ikan yang mudah rusak merupakan masalah bagi pemanfaatan ikan. Apalagi bila ikan akan didistribusikan ke tempat yang jauh dari tempat penangkapan maupun tempat budidaya ikan. Untuk menjaga mutu ikan yang cepat menurun, dua strategi dasar telah dikembangkan di seluruh dunia, yaitu
penyimpanan dingin (chilling) dan penyimpanan beku (frozen) (FAO 2007 diacu dalam Medina et al. 2009). Produk yang disimpan dalam suhu
dingin ((-1)-5 0C) dan suhu beku ((-30) 0C atau lebih rendah lagi) mendominasi pasar produk perikanan saat ini dan terus berkembang. Penyimpanan dingin dan beku diketahui dapat mencegah aktivitas bakteri namun kurang efektif untuk mencegah autolisis akibat enzim pada ikan (Huss 1995).
2.6 Metode Penentuan Kesegaran Ikan
Kesegaran merupakan tolak ukur untuk membedakan ikan yang bermutu baik dan tidak. Penentuan kesegaran ikan terdiri atas faktor-faktor sensori, kimia dan mikrobiologi. Berdasarkan kesegarannya ikan dapat digolongkan menjadi empat kelas mutu, yaitu ikan yang tingkat kesegarannya baik sekali (prima), ikan
yang kesegarannya baik (advanced), ikan yang kesegarannya mundur (sedang), ikan yang sudah tidak segar lagi (busuk) (Adawyah 2007).
Penentuan ikan secara sensori/organoleptik merupakan cara yang mudah, cepat dan praktis. Cara organoleptik merupakan cara penilaian dengan hanya menggunakan panca indera manusia. Metode ini termasuk ke dalam metode subyektif. Penilaian secara organoleptik dapat menggunakan standar penilaian organoleptik SNI 01-2346-2006 yang dibuat oleh Badan Standarisasi Nasional (BSN) (BSNb 2006).
Metode penentuan kesegaran ikan secara kimia yang biasa dilakukan adalah pengukuran pH ikan, analisis kandungan basa-basa volatil (TVB). Sedangkan untuk analisis mikrobiologi menggunakan total plate count (TPC). Nilai pH dapat dijadikan ukuran kesegaran ikan karena ikan yang sudah tidak segar akan memiliki pH yang tinggi (basa). Hal ini disebabkan reaksi biokimiawi yang terjadi pada ikan (Adawyah 2007).
Parameter kimia lain yang sering digunakan adalah kandungan basa-basa volatil atau total volatile base (TVB). Nilai TVB dapat dijadikan sebagai parameter indeks kesegaran ikan karena basa volatil terakumulasi dalam daging ikan sampai pada tahap kebusukan. Adapun batas penerimaan ikan ditinjau dari kandungan TVB, yaitu sebesar 20-30 mg N/100 g ikan. Hal ini dipengaruhi oleh jenis ikan. Berikut tingkat kesegaran ikan berdasarkan TVB menurut Farber (1965), yaitu:
- Ikan sangat segar dengan kandungan TVB 10 mg N/100 g atau lebih kecil; - Ikan segar dengan kadar TVB sebesar 10 – 20 mg N/100 g;
- Ikan yang berada pada garis batas kesegaran yang masih dapat dikonsumsi dengan kadar TVB 20 – 30 mg N/100 g;
- Ikan busuk yang sudah tidak dapat dikonsumsi lagi oleh manusia dengan kadar TVB lebih besar dari 30 mg N/100 g.
Pengujian secara mikrobiologi dapat dilakukan dengan penentuan total plate count (TPC). Penentuan TPC dilakukan dengan menghitung jumlah total koloni bakteri kemudian dibandingkan dengan standar mutu ikan segar. Selain dari analisis secara organoleptik, nilai pH, TVB dan TPC, penentuan kesegaran ikan dapat dilakukan dengan aanlisis kandungan biogenik amin,
hipoksantin, dimetil amin, trimetil amin, amoniak, oksidasi lipid dan nilai K (Huss 1995; Adawyah 2007).
2.7 Enzim
Enzim merupakan protein yang berfungsi sebagai katalis dan dapat mempercepat reaksi (Campbell dan Farrell 2007). Suatu reaksi kimia khususnya antara senyawa organik yang dilakukan dalam laboratorium membutuhkan suatu kondisi yang ditentukan oleh beberapa faktor seperti suhu, tekanan waktu dan lain-lain. Apabila salah satu kondisi tidak terpenuhi maka reaksi tidak akan terjadi. Pada mahkluk hidup, proses ini dapat berlangsung dengan baik tanpa suhu tinggi dan terjadi dalam waktu relatif singkat karena adanya katalis berupa enzim. Enzim dapat mempercepat reaksi 108-1011 kali lebih cepat dibanding reaksi yang dilakukan tanpa enzim. Enzim memiliki cara kerja dengan kekhasan
yang tinggi dimana enzim hanya akan bekerja pada substrat tertentu (lockandkey) (Poedjiadi 1994).
Enzim diketahui merupakan salah satu penyebab kemunduran mutu pada ikan. Enzim yang berperan dalam kemunduran mutu ikan merupakan jenis enzim proteolitik. Enzim ini bekerja dengan substrat protein. Enzim ini berperan dalam pendegradasian jaringan tubuh ikan yang sebagian besar merupakan protein. Enzim proteolitik juga diketahui mempercepat pertumbuhan bakteri pembusuk pada ikan dengan mendegradasikan protein pada jaringan tubuh ikan menjadi lebih sederhana dan menjadi sumber nutrien bagi bakteri pembusuk (Huss 1995).
Enzim-enzim yang berperan dalam kemunduran mutu ikan telah berhasil diketahui. Enzim-enzim ini merupakan enzim proteolitik yang menyebabkan autolisis pada ikan. Secara umum enzim proteolitik yang menyebabkan kemunduran mutu pada tubuh ikan dapat dilihat pada Tabel 4.
Tabel 4. Jenis-jenis enzim autolisis pada ikan
Enzim Substrat Perubahan yang
terjadi
Pencegahan
Enzim glikolitik Glikogen ATP
Produksi asam laktat dan penurunan pH daging, gaping Penyimpanan suhu dingin Nukleotidase ADP AMP IMP Kehilangan rasa kesegaran, hipoksantin Penyimpanan suhu dingin Katepsin Protein, peptida Pelunakan jaringan Penanganan ikan
dengan baik Karboksipeptidase Protein, peptida Autolisis jaringan
pencernaan (belly bursting)
Penyimpanan suhu beku Kalpain Protein miofibril Pelunakan daging Penghilangan
kalsium Kolagenase Jaringan ikat Pelunakan jaringan,
gaping
Penyimpanan suhu dingin TMAO dimetilase TMAO Formaldehida Penyimpanan
suhu beku Sumber: Huss (1995)
2.7.1 Enzim katepsin
Enzim katepsin merupakan enzim yang berperan dalam kemunduran mutu ikan. Beberapa enzim lain diketahui memiliki hubungan dengan kemunduran mutu ikan namun enzim katepsin merupakan enzim yang paling banyak ditemukan dalam jaringan tubuh ikan. Enzim katepsin merupakan enzim protease yang ditemukan tersimpan dalam organel sel yang bernama lisosom. Pada ikan yang masih hidup, enzim katepsin tidak aktif namun langsung aktif ketika ikan mati (Huss 1995).
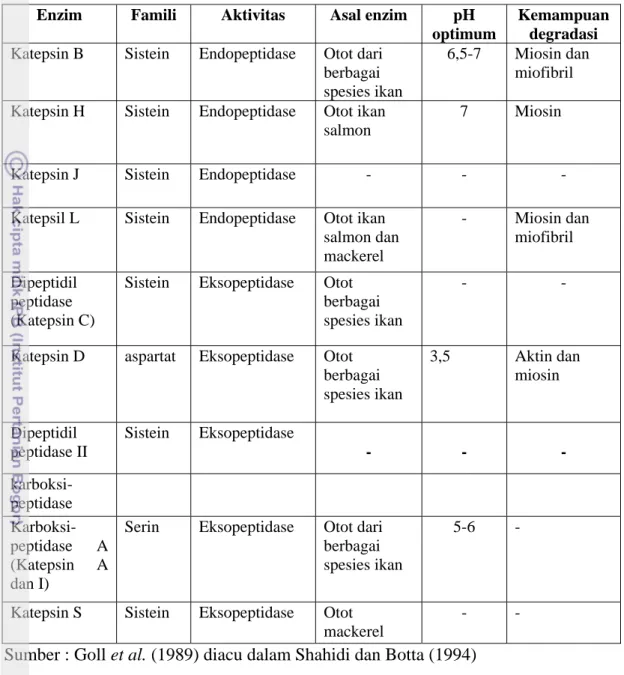
Enzim katepsin tersimpan dalam lisosom sehingga enzim ini dinamai juga enzim lisosom proteinase. Enzim katepsin terdiri dari beberapa jenis, seperti katepsin A, katepsin B, katepsin C, katepsin D, katepsin H dan katepsin L. Enzim katepsin bekerja optimum pada kisaran pH asam. Daging ikan mengadung katepsin D lebih banyak dibandingkan dengan mamalia lain. Katepsin A, B, C, H dan L termasuk ke dalam serin proteinase, sedangkan katepsin D termasuk ke dalam aspartat proteinase. Berikut jenis-jenis enzim lisosom proteinase yang terdapat pada ikan pada Tabel 5.
Tabel 5. Jenis-jenis enzim lisosom proteinase pada Ikan
Enzim Famili Aktivitas Asal enzim pH
optimum
Kemampuan degradasi
Katepsin B Sistein Endopeptidase Otot dari berbagai spesies ikan
6,5-7 Miosin dan miofibril Katepsin H Sistein Endopeptidase Otot ikan
salmon
7 Miosin
Katepsin J Sistein Endopeptidase - - -
Katepsil L Sistein Endopeptidase Otot ikan salmon dan mackerel - Miosin dan miofibril Dipeptidil peptidase (Katepsin C)
Sistein Eksopeptidase Otot berbagai spesies ikan
- -
Katepsin D aspartat Eksopeptidase Otot berbagai spesies ikan 3,5 Aktin dan miosin Dipeptidil peptidase II Sistein Eksopeptidase - - - karboksi-peptidase Karboksi-peptidase A (Katepsin A dan I)
Serin Eksopeptidase Otot dari berbagai spesies ikan
5-6 -
Katepsin S Sistein Eksopeptidase Otot mackerel
- - Sumber : Goll et al. (1989) diacu dalam Shahidi dan Botta (1994)
2.7.2 Enzim kolagenase
Enzim kolagenase secara umum didefinisikan sebagai enzim yang mampu mendegradasi ikatan polipeptida. Enzim ini dibagi menjadi dua tipe yang berbeda berdasarkan fungsi fisiologisnya. Serin kolagenase berkaitan dengan produksi hormon dan farmakologi-peptida aktif sebagai fungsi seluler. Fungsi tersebut meliput pencernaan protein, penggumpalan darah, fibrinolisis, aktivasi kompleks dan fertilisasi. Enzim tipe ini digunakan secara luas dalam industri kimia, obat, makanan dan eksperimen biologi molekuler. Tipe kedua dari enzim ini adalah metalokolagenase yang terdiri dari zinc yang membutuhkan kalsium untuk
kestabilan. Metalokolagenase termasuk ke dalam enzim ekstraseluler yang berat molekulnya bervariasi dari 30-150 kDa (Kim etal. 2002).
Enzim kolagenase merupakan enzim dari famili metaloprotease peptidase yang bekerja pada substrat kolagen. Pengaturan dari enzim kolagenase merupakan proses yang kompleks namun enzim kolagenase disintesis dan disekresikan pada jaringan ikat (Hagen et al. 2008). Enzim ini memiliki sifat yang stabil pada suhu rendah dan kehilangan aktivitasnya pada suhu diatas 40oC (Shahidi dan kamil 2001).
2.8 Peranan Enzim Katepsin dan Kolagenase dalam Kemunduran Mutu Ikan
Enzim katepsin dan enzim kolagenase berperan dalam kemunduran mutu ikan. Enzim katepsin dan kolagenase berperan dalam autolisis jaringan ikan. Enzim katepsin mendegradasi terutama bagian daging ikan sedangkan kolagenase mendegradasi jaringan ikat pada ikan. Kedua enzim ini memiliki hubungan yang sejalan dengan kemunduran mutu ikan (Hagen etal. 2008).
Aktivitas katepsin pada kemunduran telah banyak diteliti dan diketahui bahwa katepsin berperan dalam degradasi protein dan pelunakan daging ikan. Katepsin dapat mendegradasi banyak jenis protein. Katepsin B berperan dalam degradasi miosin rantai panjang, troponin I dan T. Katepsin B diketahui dapat mendegradasi protein kolagen. Katepsin L mendegradasi sebagian besar struktur protein miofibril seperti aktin dan miosin. Katepsin H berperan dalam mendegradasi troponin I. Enzim katepsin mulai aktif ketika pH ikan turun dikarenakan enzim ini memiliki pH optimum pada kisaran pH asam (Hagen etal. 2008).
Enzim kolagenase berperan dalam autolisis jaringan ikat pada ikan. Kolagenase menyebabkan kerusakan daging ikan dengan peristiwa gaping atau pecahnya miotom pada daging ikan sehingga mempercepat kemunduran mutu pada ikan. Enzim ini juga berperan dalam pelunakkan daging ikan dan pemendekan otot ikan. Pada kemunduran mutu ikan, enzim kolagenase akan mendegradasi protein kolagen yang menyebabkan pelunakan awal dari jaringan ikan (Sato et al. 1997 diacu dalam Hernandez-herrero et al. 2003).
3. METODOLOGI
3.1 Pelaksanaan Penelitian
Penelitian ini dilaksanakan di Laboratorium Karakteristik Bahan Baku Hasil Perairan, Laboratorium Biokiomia Hasil Perairan, Laboratorium Mikrobiologi Hasil Perairan, Laboratorium Bioteknologi Hasil Perairan II, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Laboratorium Terpadu, Fakultas Kedokteran Hewan, dan Laboratorium Penelitian I, Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Dokumentasi penelitian dapat dilihat pada Lampiran 1.
3.2 Bahan dan Alat Penelitian
Bahan-bahan yang digunakan dalam penelitian ini terdiri dari bahan utama ikan bandeng dengan ukuran 200-250 g/ekor. Ikan bandeng yang digunakan diberi empat perlakuan, yaitu ikan bandeng yang tidak dipuasakan sebelum dipanen dan disimpan pada suhu ruang (kode: P), ikan bandeng yang dipuasakan sebelum dipanen dan disimpan pada suhu ruang (kode: Q), ikan bandeng yang tidak dipuasakan sebelum dipanen dan disimpan pada suhu chilling (kode: R) dan
ikan bandeng yang dipuasakan sebelum dipanen pada penyimpanan suhu chilling
(kode: S). Bahan-bahan untuk analisis nilai pH (larutan buffer standar pH 4 dan 7,
akuades), analisis total volatile base (TVB) (H3BO3, K2CO3, TCA 7 %,
HCl 0,032 N), analisis total plate count (TPC) (larutan garam 0,85 % steril, nutrient agar), ekstraksi enzim katepsin (buffer tris-HCl pH 7,4), assay aktivitas
katepsin (akuades, hemoglobin, HCl 1 N, TCA 5 %, pereaksi folin, tirosin), pembuatan kolagen (kulit ikan bandeng dan asam asetat), ekstraksi enzim kolagenase (buffer tris-HCl (pH 8,0) yang mengandung 0,25 % Triton-X 100 dan
10 mM CaCl2), assay aktivitas kolagen (buffer tris-HCl pH 7,5 yang mengandung
5 mM CaCl2, TCA 5 %, ninhydrin, 50 % 1-propanol), pengukuran konsentrasi
protein (akuades, bovine serum albumin, coomassie brilliant blue G-250,
etanol 95 %, asam fosfat 85 % (b/v)).
Alat-alat yang digunakan dalam penelitian ini antara lain pisau, talenan, alat bedah, pH meter, cawan conway, inkubator, oven, sentrifuse suhu dingin,
spektrofotometer, mikropipet, timbangan analitik, homogenizer, magnetic stirer, hot plate, pipet volumetrik, bulb, pipet tetes, tabung reaksi, cawan petri,
erlenmeyer, kapas, tissue, aluminium foil, bunsen, jarum ose, beaker glass, dan
peralatan gelas lainnya serta peralatan uji organoleptik.
3.3 Tahapan Penelitian
Penelitian dilakukan dalam dua tahap, meliputi penelitian pendahuluan untuk menentukan fase post mortem ikan secara organoleptik. Penelitian utama
meliputi tiga tahap, yaitu tahap pertama adalah mempelajari pola kemunduran mutu serta perubahan parameter kesegaran kulit ikan yang terjadi, tahap kedua adalah ekstraksi enzim katepsin dan kolagenase serta mengetahui aktivitasnya. Tahap ketiga adalah pengukuran konsentrasi protein katepsin dan kolagenase. Kerangka penelitian secara keseluruhan dapat dilihat pada Lampiran 2.
3.3.1 Penelitian pendahuluan
Penelitian pendahuluan bertujuan untuk mengetahui waktu terjadinya fase
post mortem ikan, meliputi pre rigor, rigor mortis, post rigor dan busuk. Pada
tahap ini dilakukan penyimpanan pada suhu ruang (26-30 0C) dan suhu chilling
((-1)-5 0C). Penyimpanan pada suhu ruang dilakukan selama 19 jam dengan interval waktu pengamatan satu jam, sedangkan pada suhu chilling penyimpanan
dilakukan selama 540 jam (23 hari) dengan interval waktu pengamatan 12 jam. Pengamatan dilakukan secara organoleptik menggunakan score sheet berdasarkan
SNI 01-2346-2006 (Lampiran 3).
3.3.2 Penelitian utama
Penelitian utama bertujuan untuk mengetahui pola kemunduran ikan P, Q, R, dan S berdasarkan analisis tingkat kesegaran ikan pada setiap tahap
post mortem. Pada tahap ini dilakukan pengamatan terhadap sampel ikan
berdasarkan waktu yang didapat dari hasil penentuan fase post mortem pada
penelitian tahap pendahuluan. Analisis yang dilakukan pada setiap pengamatan
meliputi uji organoleptik menggunakan score sheet berdasarkan
SNI 01-2346-2006 (BSNb 2006), uji nilai pH, TVB dan TPC,
assay aktivitas
3.4 Analisis
Sampel kulit ikan bandeng pada setiap tahap post mortem diambil dan
dilakukan pengamatan serta analisis, meliputi pengamatan dan analisis tingkat kesegaran ikan (penilaian organoleptik, penentuan nilai pH, TVB, penghitungan jumlah total bakteri dengan menggunakan metode TPC), serta ekstraksi enzim katepsin dan kolagenase untuk assay aktivitas katepsin dan kolagenase.
3.4.1 Uji organoleptik (BSNb 2006)
Metode yang digunakan untuk uji organoleptik adalah dengan score sheet
berdasarkan SNI 01-2346-2006 (BSNb 2006). Pengujian organoleptik merupakan
cara pengujian yang bersifat subyektif menggunakan indera yang ditujukan pada mata, insang, lendir permukaan, badan, daging, bau, dan tekstur. Pada uji organoleptik ini, ada beberapa syarat yang harus disepakati oleh panelis (BSNb 2006) antara lain: tertarik dan mau, terampil dan konsisten dalam mengambil keputusan, siap sedia pada saat dibutuhkan dalam pengujian, tidak menolak contoh yang akan diuji, berbadan sehat, bebas dari penyakit THT dan tidak buta warna, serta jumlah panelis minimum untuk satu kali pengujian adalah 15 orang (semi-terlatih). Dari data yang diperoleh, kemudian dilakukan analisis kesegaran ikan dengan kriteria sebagai berikut (SNI 01-2346-2006):
Segar : nilai organoleptik berkisar antara 7-9 Agak segar : nilai organoleptik berkisar antara 5-6 Tidak segar : nilai organoleptik berkisar antara 1-3
3.4.2 Uji nilai pH (Apriyantono et al. 1989)
Pengukuran pH dilakukan dengan menggunakan pH meter dengan cara dikalibrasi terlebih dahulu. Sampel sebanyak 10 gram yang diambil dari bagian kulit ikan dihomogenkan dengan homogenizer dengan 90 ml air destilata.
Kemudian pH homogen diukur dengan pH meter yang sebelumnya telah dikalibrasi dengan buffer standar pH 4 dan 7.
3.4.3 Uji total volatile base (TVB) (Apriyantono et al. 1989)
Penetapan ini bertujuan untuk menentukan jumlah kandungan senyawa-senyawa basa volatil yang terbentuk akibat degradasi protein. Prinsip dari analisis total volatile base (TVB) adalah menguapkan senyawa-senyawa basa
volatil (amin, mono-, di-, dan trimetilamin). Senyawa tersebut kemudian diikat oleh asam borat dan kemudian dititrasi dengan larutan HCl.
Preparasi sampel dilakukan dengan cara menimbang 15 gram sampel yang diambil dari bagian kulit ikan, kemudian ditambahkan 45 ml TCA 7 % dan dihomogenkan selama satu menit. Hasil homogenisasi kemudian disaring sehingga diperoleh filtrat yang berwarna jernih. Setelah penyiapan sampel, maka
dilakukan uji TVB dengan cara memasukkan 1 ml H3BO3 ke dalam
inner chamber cawan conway dan tutup cawan diletakkan dengan posisi hampir
menutupi cawan. Dengan memakai pipet 1 ml yang lain, filtrat dimasukkan ke dalam outer chamber disebelah kiri. Kemudian 1 ml larutan K2CO3 jenuh
ditambahkan ke dalam outer chamber sebelah kanan sehingga filtrat dan K2CO3
tidak tercampur. Cawan segera ditutup dengan sebelumnya pinggir cawan diolesi vaselin agar proses penutupan sempurna, lalu digerakkan memutar sehingga kedua cairan di outer chamber tercampur. Disamping itu dikerjakan blanko
dengan prosedur yang sama tetapi filtrat diganti dengan TCA 7 %. Kemudian kedua cawan conway tersebut diinkubasi selama 24 jam pada suhu 37 0C. Setelah diinkubasi, larutan asam borat dalam inner chamber cawan conway yang berisi
blanko dititrasi dengan larutan HCl 0,032 N dan cawan digoyang-goyangkan perlahan sampai larutan asam borat berubah warna menjadi merah muda. Selanjutnya cawan conway yang berisi sampel juga dititrasi dengan larutan yang sama dengan blanko. Kadar TVB dapat dihitung dengan menggunakan rumus:
%N (mg N/100 g) = (j – i) x N HCl x 100 x fp x 14 mg N/100 g g contoh 1
Keterangan:
j : ml titrasi sampel fp : faktor pengenceran i : ml titrasi blanko N : normalitas HCl (0,032 N)
3.4.4 Uji total plate count (TPC) (Fardiaz 1987)
Prinsip kerja analisis TPC adalah penghitungan jumlah bakteri yang ada di dalam sampel (kulit ikan) dengan pengenceran sesuai kebutuhan dan dilakukan secara duplo. Pembuatan larutan contoh dilakukan dengan mencampurkan 10 gram sampel yang telah dihancurkan yang diambil dari bagian kulit ikan, lalu
dimasukkan ke dalam botol yang berisi 90 ml larutan garam 0,85 % steril, kemudian dikocok sampai larutan homogen. Campuran larutan contoh tersebut diambil 1 ml dan dimasukkan ke dalam botol berisi 9 ml larutan garam 0,85 % steril sehingga diperoleh contoh dengan pengenceran 10-2, setelah itu dikocok agar homogen. Banyaknya pengenceran dilakukan sesuai dengan keperluan penelitian, biasanya sampai pengenceran 10-5. Pemipetan dilakukan dari masing-masing tabung pengenceran sebanyak 1 ml larutan contoh dan dipindahkan ke dalam cawan petri steril secara duplo menggunakan pipet steril. Media agar dimasukkan ke dalam cawan petri sebanyak 10 ml dan digoyangkan sampai permukaan agar merata (metode tuang), kemudian didiamkan beberapa saat hingga dingin dan mengeras. Cawan petri yang telah berisi agar dan larutan contoh dimasukkan ke dalam inkubator pada suhu 35 0C selama 48 jam dengan posisi cawan petri yang dibalik. Selanjutnya dilakukan pengamatan dengan menghitung jumlah koloni yang ada di dalam cawan petri tersebut. Jumlah koloni bakteri yang dihitung adalah cawan petri yang mempunyai koloni bakteri antara 30-300 koloni.
3.4.5 Ekstraksi enzim katepsin (Dinu et al. 2002)
Penelitian tahap ini bertujuan untuk memperoleh ekstrak kasar enzim katepsin yang siap digunakan dalam pengujian selanjutnya. Ekstraksi katepsin dilakukan pada sampel P, Q, R, dan S pada setiap tahap kemunduran mutu. Proses ektraksi katepsin dilakukan dengan metode Dinu et al. (2002).
Tahap pertama dilakukan preparasi sampel untuk memperoleh ekstrak kasar protease dengan mengambil sampel kulit ikan. Kulit ikan disuspensikan dalam akuades dengan perbandingan kulit ikan dan akuades sebesar 1:5, lalu dihomogenisasikan pada suhu 0-4 0C. Ekstrak kulit hasil homogenisasi ini disentrifugasi pada 1.000 rpm selama 10 menit dan supernatan yang diperoleh kemudian disentrifugasi lagi pada 10.000 rpm selama 10 menit. Pelet yang
dihasilkan dari sentrifugasi ini kemudian dilarutkan dalam 0,1 M buffer tris-HCl pH 7,4 dengan jumlah yang sama seperti jumlah akuades
sebelumnya (1:5) dan disentrifugasi pada 4.000 rpm selama 10 menit. Supernatan (ekstrak kasar enzim) yang diperoleh merupakan protein utama dari mitokondria dan lisosom yang siap untuk diteliti aktivitasnya lebih lanjut.
3.4.6 Ekstraksi enzim kolagenase (Moore dan Stein 1954 diacu dalam Kim et al. 2002)
Penelitian tahap ini bertujuan untuk memperoleh ekstrak kasar enzim kolagenase yang siap digunakan dalam pengujian selanjutnya. Ekstraksi kolagenase dilakukan pada sampel P, Q, R, dan S pada setiap tahap kemunduran mutu.
Proses ekstraksi dilakukan dengan cara mencuci kulit ikan bandeng dengan air dingin, dan ditambahkan dengan 100 mM buffer Tris-HCl (pH 8,0),
dengan perbandingan bahan baku dan larutan buffer 1:5, kemudian dihomogenkan
dengan homogenizer. Selanjutnya kulit yang telah homogen tersebut,
disentrifugasi dengan kecepatan 7.000 rpm selama 20 menit. Setelah itu, pelet yang telah dihasilkan disentrifugasi kembali dengan kecepatan 7.000 rpm selama 20 menit menggunakan larutan buffer yang sama. Perbandingan antara bahan
baku dan larutan buffer sebesar 1:3. Selanjutnya supernatan yang dihasilkan
ditambahkan dengan 20 mM Tris-HCl (pH 8,0) yang mengandung 0,36 mM CaCl2, dan didiamkan pada suhu rendah (± 4 0C) selama 48 jam.
Larutan yang dihasilkan merupakan ekstrak kasar kolagenase yang akan digunakan untuk pengujian selanjutnya.
3.5 Assay Aktivitas Enzim Katepsin (Dinu et al. 2002)
Aktivitas proteolitik dari enzim katepsin diuji menggunakan hemoglobin terdenaturasi asam sebagai substratnya. Sebanyak 8 % hemoglobin dilarutkan dalam akuades dengan perbandingan 1:3. Kemudian pH dibuat menjadi 2,0 dengan HCl 1 N dan konsentrasi akhir hemoglobin dibuat sebesar 2 % dengan akuades. Selanjutnya 1 ml dari larutan substrat dengan 0,2 ml larutan enzim direaksikan dan diinkubasi selama 10 menit pada suhu 37 0C. Reaksi dihentikan dengan penambahan 2 ml TCA 5 %. Campuran disaring dan hasil reaksi yang didapat ditambah dengan 1 ml pereaksi folin serta diukur dengan spektrofotometer pada panjang gelombang 750 nm. Selain itu dilakukan pula pengukuran untuk larutan blanko dan larutan standar dengan prosedur yang sama seperti larutan sampel hanya untuk larutan blanko dan larutan standar enzimnya digantikan dengan akuades dan tirosin. Aktivitas enzim katepsin dapat dihitung dengan rumus berikut:
T xPx Abl Ast Abl Asp UA 1 − − =
UA : jumlah enzim yang menyebabkan Asp : nilai absorbansi sampel perubahan 1 μmol substrat per menit
Asp : nilai absorbansi sampel Abl : nilai absorbansi blanko Ast : nilai absorbansi standar P : faktor pengenceran T : waktu inkubasi
3.6 Assay Aktivitas Enzim Kolagenase (Moore dan Stein 1954 diacu dalam Kim et al. 2002)
Aktivitas kolagenolitik dapat diukur dengan metode Moore dan Stein (1954) dalam Kim et al. (2002) yang telah dimodifikasi dengan cara mereaksikan
5 ml kolagen dari kulit ikan dengan 1 ml 0,05 M Tris-HCl (pH 7,5) yang mengandung 5 mM CaCl2 dan 0,1 ml larutan enzim lalu diinkubasi pada suhu
37 0C selama 1 jam. Reaksi dihentikan dengan penambahan 0,2 ml 5 % TCA. Setelah 10 menit pada suhu ruang, larutan disaring dengan menggunakan kertas saring. Supernatan (0,2 ml) dicampur dengan 1,0 ml larutan nynhidrin, diinkubasi
pada suhu 100 0C selama 20 menit. Kemudian didinginkan pada suhu kamar. Campuran tersebut diencerkan dengan 5 ml 50 % 1-propanol untuk pengukuran absorbansi dengan spektrofotometer pada panjang gelombang 570 nm. Larutan
buffer (0,05 M Tris-HCl pH 7,5) yang mengandung 5 mM CaCl2 digunakan
sebagai pengganti larutan enzim sebagai larutan kontrol dan larutan tirosin digunakan sebagai larutan standar enzim kolagenase. Aktivitas enzim kolagenase dapat dihitung dengan rumus sebagai berikut:
T xPx Abl Ast Abl Asp UA 1 − − =
UA : jumlah enzim yang menyebabkan perubahan 1 μmol substrat per menit
Asp : nilai absorbansi sampel Abl : nilai absorbansi blanko Ast : nilai absorbansi standar P : faktor pengenceran T : waktu inkubasi
3.7 Pengukuran Konsentrasi Protein Enzim (Bradford 1976)
Konsentrasi protein ditentukan menggunakan metode Bradford dengan
bovine serum albumin sebagai standar. Persiapan pereaksi Bradford dilakukan
dengan cara melarutkan 25 mg coomasie brilliant blue G-250 dalam
12,5 ml etanol 95 %. Lalu ditambahkan dengan 25 ml asam fosfat 85% (b/v). Jika telah larut dengan sempurna, maka ditambahkan akuades hingga 0,5 l dan disaring dengan kertas saring Whatman-1 sesaat sebelum digunakan.
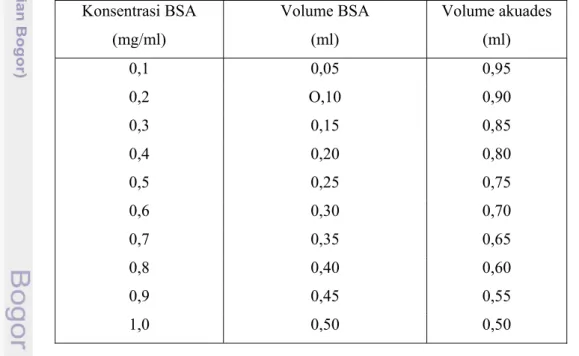
Konsentrasi protein ditentukan menggunakan metode Bradford dengan cara 0,1 ml enzim dimasukkan ke dalam tabung reaksi. Kemudian ditambahkan sebanyak 5 ml pereaksi Bradford, diinkubasi selama 5 menit dan diukur dengan spektrofotometer pada panjang gelombang 595 nm. Demikian pula untuk larutan standar dilakukan seperti larutan sampel dengan konsentrasi antara 1,0-1,0 mg/ml dari larutan stok BSA konsentrasi 2 mg/ml. Tabel pembuatan larutan standar BSA 0,1-1,0 mg/mL disajikan pada Tabel 6.
Tabel 6. Pembuatan larutan standar BSA konsentrasi 0,1-1,0 mg/ml
Konsentrasi BSA (mg/ml) Volume BSA (ml) Volume akuades (ml) 0,1 0,05 0,95 0,2 O,10 0,90 0,3 0,15 0,85 0,4 0,20 0,80 0,5 0,25 0,75 0,6 0,30 0,70 0,7 0,35 0,65 0,8 0,40 0,60 0,9 0,45 0,55 1,0 0,50 0,50
Nilai absorbansi yang didapat kemudian dimasukkan ke dalam kurva standar Bradford untuk menentukan konsentrasi protein yang terkandung dalam sampel enzim (Lampiran 4).
3.8 Analisis Data
Hasil yang diperoleh dari pengamatan serta pengukuran terhadap nilai organoleptik, pH, TVB dan TPC serta aktivitas enzim katepsin dan kolagenase, serta konsentrasi protein enzim dicari nilai rata-ratanya. Nilai rata-rata tersebut dihitung menggunakan rumus berikut (Steel dan Torrie 1989):
Keterangan :
X : nilai rata-rata
Xi : nilai X ke-i
N : jumlah data
Analisis terhadap hubungan tingkat kesegaran ikan (TPC, TVB, dan nilai pH), nilai aktivitas enzim dan konsentrasi protein enzim dilakukan melalui uji ragam (ANOVA) berupa rancangan acak kelompok dengan 4 perlakuan
(sampel P, Q, R, dan S) dan 4 kelompok
(pre rigor, rigor mortis, post rigor, dan busuk). Persamaan umum model
rancangan tersebut sebagai berikut:
Y
ij= µ +
τ
i+
β
j+
ε
ijKeterangan:
Yij : nilai pengamatan pada perlakuan ke-i kelompok ke-j
µ : nilai tengah populasi
τi : pengaruh perlakuan τ taraf ke-i
βj : pengaruh kelompok β taraf ke-j
εij : galat percobaan pada perlakuan ke-i kelompok ke-j
Hipotesis yang digunakan adalah: 1. Hipotesis perlakuan
a. H0 : pengaruh perlakuan tidak berbeda nyata
b. H1 : minimal ada 1 perlakuan yang memberikan pengaruh berbeda nyata
2. Hipotesis kelompok
a. H0 : pengaruh kelompok tidak berbeda nyata
b. H1 : minimal ada 1 kelompok yang memberikan pengaruh berbeda nyata
Apabila pengaruh perlakuan dan kelompok berbeda nyata dengan selang
kepercayaan 95 % (p <0.05), maka diadakan uji lanjut Duncan
(Steel dan Torrie 1989).
n
Xi
X
n i∑
==
1
Derajat hubungan linier antara aktivitas enzim (katepsin dan kolagenase) terhadap parameter kesegaran mutu (nilai organoleptik, pH, TVB, TPC) dilihat
menggunakan koefisien korelasi linier sederhana dengan rumus (Snedecor dan Cochran 1967):
Keterangan:
x : simpangan dari rataan peubah pertama (yang mempengaruhi) y : simpangan dari rataan peubah kedua (yang dipengaruhi) Nilai derajat korelasinya adalah:
r =>0,7 : hubungan sangat erat 0,5<= r <=0,7 : hubungan erat r <=0,5 : hubungan tidak erat
n Xi X n i ∑= =1
( )(
∑
∑
∑
)
= 2 2 y x xy r4.1 Penelitian Pendahuluan
Penelitian pendahuluan yang dilakukan adalah penentuan fase kemunduran mutu (post mortem) pada ikan bandeng. Penentuan fase post mortem pada ikan
bandeng dilakukan untuk mengetahui interval dan lama waktu terjadinya kemunduran mutu pada ikan bandeng selama penyimpanan. Penentuan fase
post mortem juga dilakukan untuk penelitian utama, yaitu mengenali kondisi
tingkat kesegaran kulit ikan bandeng terkait dengan besarnya nilai organoleptik, nilai pH, total volatile base (TVB), total plate count (TPC), aktivitas enzim
katepsin dan kolagenase pada fase kemunduran mutu. Seperti telah diketahui sebelumnya, berdasarkan Junianto (2003), bahwa fase kemunduran mutu pada ikan terdiri dari 4 fase, yaitu fase pre rigor, rigor mortis, post rigor dan busuk.
Penentuan fase kemunduran mutu pada ikan bandeng dilakukan dengan menggunakan metode sensori, yaitu secara organoleptik. Pengujian sensori dapat
digunakan untuk menentukan fase-fase post mortem pada kemunduran mutu ikan
(Huss 1995). Metode organoleptik merupakan cara yang paling mudah dan murah untuk mengetahui tingkat kemunduran mutu pada ikan dengan bantuan panca indera manusia. Metode organoleptik dapat menilai kemunduran mutu yang terjadi pada ikan yang jelas terlihat dari perubahan penampakan dan tekstur ikan. Penetapan fase kemuduran mutu pada ikan dilakukan menggunakan alat bantu berupa lembar nilai (score sheet) yang telah ditetapkan oleh Badan Standarisasi
Nasional (BSN) dengan SNI 01-2346-2006 (BSNb 2006).
Penentuan fase kemunduran mutu pada ikan bandeng dilakukan dengan melakukan pengamatan terhadap ikan bandeng yang tidak dipuasakan sebelum dipanen dan disimpan pada suhu ruang (kode: P), dipuasakan sebelum dipanen dan disimpan pada suhu ruang (kode: Q), tidak dipuasakan sebelum dipanen dan disimpan pada suhu chilling (kode: R), dipuasakan dan disimpan pada suhu chilling (kode: S). Suhu chilling yang dimaksud pada penelitian ini adalah
(-1)-5 0C. Ikan dimatikan dengan cara menusuk pada kepala bagian