LAPORAN PRAKTIKUM KIMIA TERAPAN
TITRASI ASAM BASA
(KARBONAT – BIKARBONAT)
OLEH
KELOMPOK 3
NAMA : NURUL KOMARIAH
(061540411563)
R.A DWI PUTRI A.S.R
(061540411564)
RENI PUSPITASARI
(061540411898)
TIARA DWI PUTRI
(061540411566)
YOGA DWI PANGESTU
(061540411567)
YUNIAR BALQIS
(061540411568)
KELAS
: 1 EG. A
INSTRUKTUR: IR. FATRIA, M.T.
TITRASI ASAM BASA
( PENENTUAN KARBONAT – BIKARBONAT )
I.
TUJUAN PERCOBAAN
Mahasiswa mampu melakukan penentuan karbonat – bikarbonat dalam cuplikan dengan cara titrasi menggunakan dua indicator.
II.
RINCIAN PERCOBAAN
1. Standarisasi larutan baku HCL dengan NA2CO3
2. Titrasi cuplikan untuk menentukan kadar karbonat dan bikarbonat dengan menggunakan dua indicator.
III.
DASAR TEORI
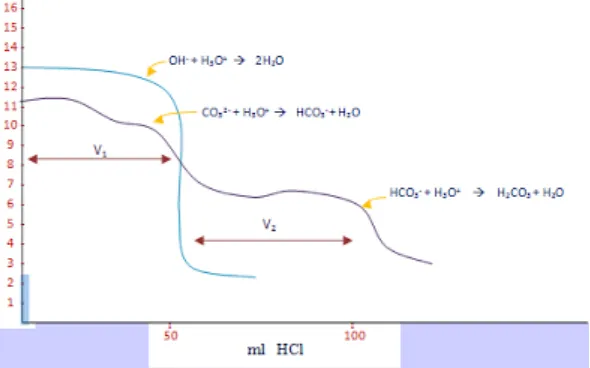
Ion karbonat dapat ditentukan dengan cara titrasi dua langkah yaitu dengan menggunakan dua indicator :
CO32- + H3O+ HCO3– + H2O (Fenolftalein)
HCO3– + H3O+ H2CO3 + H2O (Metil Orange)
Fenolftalein bekerja sebagai indicator untuk titrasi tahap pertama dengan perubahan warna dari merah ke tidak bewarna. Metal orange bekerja sebagai indicator tahap kedua dengan perubahan warna dari kuning menjadi jingga . fenolftalein dengan jangkauan pH 8,0 sampai 9,6 merupakan indicator yang cocok untuk titik akhir pertama, karena pH larutan NaHCO3 berjumlah 8,35 . metal orange dengan
jangkauan pH 3,1 – 4,4 cocok untuk titik akhir kedua. Suatu larutan
jenuh CO2 mempunyai pH kira – kira 3,9 . kedua titik akhir tersebut
tidak satu pun membentuk patahan yang sangat tajam.
Campuran karbonat dan bikarbonat , atau karbonat hidroksida dapat dititrasi dengan HCL standar sampai kedua titik akhir tersebut diatas.
Dalam table 1 , V1adalah volum asam dalam ml yang digunakan dari
permulaan sampai titik akhir fenolfatalein dan V2 merupakan volum
dari titik akhir fenolfatalein sampai titik akhir metal orange . hal ini membuktikan bahwa NaOH secara lengkap bereaksi dalam tahap
pertama , NaHCO3 hanya bereaksi dalam tahap kedua , dan
Na2CO3 bereaksi dalam kedua tahap dengan menggunakan volum
titran yang sama dalam kedua tahap.
Tabel : Hubungan Volum dalam Titrasi Karbonat
VI.
BAHAN YANG DIGUNAKAN
Cuplikan yang mengandung karbonat bikarbonat
HCl
Membuat larutan 0,1 M HCl dengan volume 500 ml
Menimbang dengan teliti 0,4 gr Na2CO3 , melarutkan dengan
aquadest sampai 100 ml
Menyiapkan 3 buah Erlenmeyer
Mengambil Alikot sebanyak 20 ml untuk masing-masing
Erlenmeyer
Menambahkan 2 tetes indikator metil merah
Mentritasi dengan HCl , kemudian mencatat volumenya
7.2 Penentuan Karbonat Bikarbonat
Menimbang dengan teliti 0,50 gr Cuplikan yang mengandung
Na2CO3 dan NaHCO3
Melarutkan kedalam air demineral
Menyiapkan 3 buah Erlenmeyer, mengisi masing-masing
dengan 25 ml alikot
Menambahkan 2 tetes indikator fenolftalein
Mentritasi dengan HCl hingga berubah warna dari merah menjadi
tidak berwarna
Mencatat volume titran
Menambahkan 2 tetes indikator metil orange
Mentritasi dengan HCl hingga berubah warna dari kuning menjadi
%NaOH = V HCl x NHCl x BE NaOH x 100
gr sampel x 1000 x 10 100
= 1,9 ml x 0,098 x 40 x 100 0,5 x 1000 x 10
100
=14,8 (praktek)
% NaOH = gr NaOH x 100
gr Sampel
= 0,25 x 100 0,5
= 50 (teori)
%kesalahan = T – P x100
T
=50 – 14,8 x100 50
X.
PERTANYAAN
1. Tuliskan rumus kimia untuk indicator fenolftalein , dan reaksinya terhadap perubahan pH ?
Jawab :
- Rumus kimia indikator fenolftlaein = C20H4O2
- Reaksi terhadap perubahan ph :
CO32- + H3O+ HCO3- + H2O
- Fenolftalein diteteskan pada larutan, larutan berubah
warnamenjadi merah muda. Lalu ditritrasi dan berubah menjadi tidak bewarna.
- Ph nya 8,0 – 9,6.
2. Berapakah jangkauan pH indicator yang digunakan pada percobaan ini ?
%Na2CO3 = gr Na2CO3
Dari percobaan yang telah dilakukan, langkah awal yang dilakukan
adalah mesndtandarisasi larutan HCl dengan Na2CO3. Hal ini dilakukan
guna untuk menetukan karbonat dan bikarbonat yang lebih akurat atau
seimbang. Pada cuplikan Na2CO3 (bewarna bening).ditetesi indikator
metil orange maka warnanya berubah menjadi kuning keruh, lalu ditetskan dengan larutan HCl 0,1 M. Titrasi dihentikan pada saat muncul warna merah muda (standarisasi). Persyaratan larutan standar : 1. Asam itu harus kuat, yaitu sangat distrosi
2. Tidak mudah menguap 3. Larutan harus stabil
4. Garam dari asam tersebut harus mudh larut
5. Asam tersebut bukan pengoksidasi yang cukup kuat untuk mengancurkan senyawa – senyawa organik yang digunakan sebagai indikator.
XII. KESIMPULAN
Pada percobaan ini dapat diambil kesimpulan :
1. HCl setelah di standarisasi menjadi 0,098 mek/ml
2. Syarat larutan standar :
- Asam itu harus kuat, yaitu sangat distrosi
- Tidak mudah menguap
- Larutan harus stabil
- Garam dari asam tersebut harus mudh larut
- Asam tersebut bukan pengoksidasi yang cukup kuat untuk
mengancurkan senyawa – senyawa organik yang digunakan sebagai indikator.
3. Persen kesalahan perhitungan standarisasi larutan HCl adalah 2 % 4. BE Na2CO3 adalah 53