LAPORAN AKHIR
PENELITIAN PASCASARJANA
DANA ITS TAHUN 2020
STUDI KARAKTERISTIK LIPID DARI PENGGUNAAN NUTRIEN
KOMERSIAL DALAM KULTUR MIKROALGA Botryococcus braunii
TERMUTASI SINAR UV-C
Tim Peneliti:
Prof. Dr. Ir. Arief Widjaja, M.Eng (Teknik Kimia / FTI / ITS)
Thea Prastiwi Soedarmodjo (Teknik Kimia / FTI / ITS)
Dibiayai oleh:
Direktorat Riset dan Pengabdian Kepada Masyarakat
Institut Teknologi Sepuluh Nopember
Kementerian Pendidikan dan Kebudayaan
sesuai dengan Perjanjian Pelaksanaan Penelitian Pascasarjana Dana ITS
Tahun 2020
Nomor : 914/PKS/ITS/2020, tanggal 02 April 2020
DIREKTORAT PENELITIAN DAN PENGABDIAN KEPADA MASYARAKAT
INSTITUT TEKNOLOGI SEPULUH NOPEMBER
SURABAYA
2020
2
DAFTAR ISI
DAFTAR ISI
DAFTAR GAMBAR
DAFTAR TABEL
BAB I. RINGKASAN
BAB II. HASIL DAN PEMBAHASAN
BAB III. STATUS LUARAN
BAB IV. PERAN MITRA
BAB V. KENDALA PELAKSANAAN PENELITIAN
BAB VI. RENCANA TAHAPAN SELANJUTNYA
BAB VII. DAFTAR PUSTAKA
BAB VIII. LAMPIRAN
LAMPIRAN 1 Tabel Daftar Luaran
3
DAFTAR GAMBAR
Gambar II.1 Kurva Pertumbuhan B.braunii Pre-Kultur 6 Hari
Gambar II.2 Kurva Pertumbuhan B.braunii Alami dan Termutasi UV-B
Selama 7 hari
Gambar II.3 Grafik Pertumbuhan Sel B.braunii Alami dan Mutasi UV-B
dengan Variabel Normal Nutrien dan Pengurangan Kadar
Nitrogen Dalam Nutrien Waktu Kultur 7 Hari dan 20 Hari
Gambar II.4 Grafik Perbandingan Konsentrasi Biomassa Variabel Kadar
Nitrogen dalam Nutrien dan Waktu Kultur
Gambar II.5 Grafik Perbandingan Produktivitas Lipid Variabel Kadar
Nitrogen dalam Nutrien dan Waktu Kultur
Gambar II.6 Grafik Perbandingan Lipid Content Variabel Kadar Nitrogen
dalam Nutrien dan Waktu Kultur
Gambar II.7 Hasil Analisa GC Lipid B.braunii Alami dengan Pengurangan
Kadar Nitrogen dalam Nutrien Waktu Kultur 7 Hari
Gambar II.8 Hasil Analisa GC Lipid B.braunii Mutasi dengan Pengurangan
Kadar Nitrogen dalam Nutrien Waktu Kultur 7 Hari
Gambar II.9 Hasil Analisa GC Lipid B.braunii Alami dengan Pengurangan
Kadar Nitrogen dalam Nutrien Waktu Kultur 20 Hari
Gambar II.10 Hasil Analisa GC Lipid B.braunii Mutasi dengan Pengurangan
4
DAFTAR TABEL
Tabel II.1 Jumlah Sel B.braunii Selama Pre-Kultur 6 Hari
Tabel II.2 Jumlah Sel B.braunii Sebelum dan Sesudah Mutasi Menggunakan Sinar
UV-B
Tabel II.3 Jumlah Sel B.braunii Alami dan Termutasi UV-B
Tabel II.4 Pertumbuhan Sel B.braunii Alami dan Termutasi UV-B Variabel
Waktu Kultur 7 Hari dan 20 Hari dengan Penambahan Normal Nutrien
dan Pengurangan Kadar Nitrogen dalam Nutrien
Tabel II.5 Perubahan pH Kultur Selama 7 Hari dan 20 Hari
Tabel II.6 Perhitungan Konsentrasi Biomassa Variabel Kadar Nitrogen dalam
Nutrien dan Waktu Kultur
Tabel II.7 Perhitungan Lipid Content dan Produktivitas Lipid Variabel Kadar Lipid
dalam Nutrien dan Waktu Kultur
Tabel II.8 Komposisi Senyawa Lipid B.braunii Alami dengan Pengurangan
Kadar Nitrogen dalam Nutrien Waktu Kultur 7 Hari
Tabel II.9 Komposisi Senyawa Lipid B.braunii Mutasi dengan Pengurangan
Kadar Nitrogen dalam Nutrien Waktu Kultur 7 Hari
Tabel II.10 Komposisi Senyawa Lipid B.braunii Alami dengan Pengurangan
Kadar Nitrogen dalam Nutrien Waktu Kultur 20 Hari
Tabel II.11 Komposisi Senyawa Lipid B.braunii Mutasi dengan Pengurangan
5
BAB I
RINGKASAN
Kebutuhan Energi Baru Terbarukan (EBT) di Indonesia terus mengalami
kenaikan seiring dengan berkurangnya bahan bakar fosil. Pemerintah memanfaatkan
Bahan Bakar Nabati (BBN) sebagai opsi penyediaan EBT. Salah satu jenis BBN berbasis
biofuel yang telah diterapkan adalah biodiesel. Mikroalga penghasil lipid memiliki
potensi karena lipid dapat dikonversi menjadi biodisel. Mikroalga air laut dapat tumbuh
bebas di pantai sehingga lahan pertumbuhannya tidak berkompetisi dengan tanaman lain,
serta memiliki kecepatan pertumbuhan yang jauh lebih tinggi dibanding tanaman
penghasil lipid yang tubuh di darat seperti kelapa sawit dan jarak pagar. Didukung dengan
kondisi geografis Indonesia yang mempunyai garis pantai terpanjang di dunia (lebih dari
80 ribu Km), budidaya mikroalga penghasil lipid dalam rangka pengadaan biodisel sangat
layak untuk dikembangkan. Akan tetapi beberapa faktor lingkungan seperti turunnya pH
karena terbentuknya HCO
3-, kecilnya kandungan lipid dalam kondisi normal serta daya
tahan terhadap perubahan suhu menjadi kendala bagi budidaya mikroalga yang perlu
diatasi.
Sebelumnya pengusul melakukan teknik mutasi pada mikroalga Botryococcus
braunii dan mampu meningkatkan produktifitas sel dan lipid, serta kemampuan
beradaptasi pada pH rendah. Tetapi belum dilakukan optimasi untuk hal ini. Dengan jenis
mikroalga air tawar, pengusul juga menemukan perpaduan yang tepat antara kadar N
rendah dan waktu kultivasi yang meningkatkan produksi lipid dan kualitasnya.
Penerapannya pada B. braunii perlu dilakukan.
Tujuan penelitian ini adalah meningkatkan produktifitas lipid mikroalga air laut
B. braunii melalui optimasi kondisi operasi baik strain alami maupun termutasi.
Mikroalga B. braunii termutasi sinar UV-C dibudidaya dalam media nutrien komersial
berupa kombinasi dari pupuk pertanian ZA (ammonium sulfat), Urea, dan TSP (triple
super phophate). Mikroalga hasil mutasi yang memiliki laju pertumbuhan sel dan kadar
lipid terbaik dikultivasi pada berbagai pH medium untuk mengetahui daya tahan terhadap
pH. Hal ini sebagai persiapan pembuatan biodiesel yang efektif diaplikasikan pada
budidaya mikroalga skala besar.
Dari penelitian didapatkan bahwa produktivitas lipid paling tinggi dihasilkan oleh
B. braunii termutasi UV-C dengan pengurangan kadar nitrogen dalam nutrien waktu
kultur 7 hari yaitu sebesar 0,09 (mg/mL)/ hari. Hal ini menunjukkan bahwa pengurangan
kadar nitrogen dalam nutrien dapat meningkatkan produktivitas lipid mikroalga.
6
BAB II
HASIL DAN PEMBAHASAN
II.1 Pre-Kultur B.braunii Alami
Telah dilakukan pre-kultur selama 6 hari pada Tabel.II.1
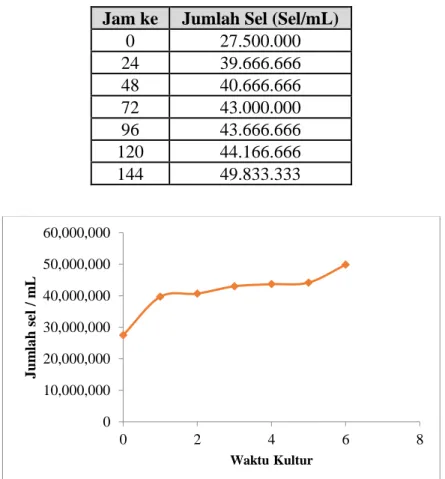
Tabel. II.1 Jumlah Sel B.Braunii Selama Pre-Kultur 6 Hari
Jam ke
Jumlah Sel (Sel/mL)
0
27.500.000
24
39.666.666
48
40.666.666
72
43.000.000
96
43.666.666
120
44.166.666
144
49.833.333
Gambar II.1 Kurva Pertumbuhan B.braunii Pre-Kultur 6 Hari
Berdasarkan Tabel II.1 diketahui bahwa pertumbuhan mikroalga B.braunii setiap
harinya meningkat dilihat dari jumlah sel dan kurva pada Gambar II.1. Pada perhitungan
jumlah sel dengan metode counting chamber, hanya sel yang hidup yang dihitung
jumlahnya. Perbedaan sel yang hidup dan mati dapat diketahui pada warna mikroalga.
Pada kondisi pertumbuhan optimal mikroalga berwarna hijau tua pekat, sedangkan dalam
kondisi pertumbuhan tidak optimal mikroalga berwarna hijau kekuningan, dan pada
keadaam mati mikroalga cenderung berwarna kuning. Kultur B.braunii alami dengan
jumlah sel 49.833.333 sel/mL selanjutnya digunakan sebagai bibit untuk mutasi B.braunii
dengan menggunakan sinar UV-B.
0 10,000,000 20,000,000 30,000,000 40,000,000 50,000,000 60,000,000 0 2 4 6 8 J um la h sel / m L Waktu Kultur
7
II.2
Mutasi B.braunii Alami dan Mutasi Menggunakan Lampu UV-B
Perlakuan mutasi dilakukan untuk menghasilkan mutasi mikroalga B.braunii yang
memiliki karakteristik serupa dengan mutasi yang telah dilakukan dalam penelitian
sebelumnya oleh Cecil-Wahyu (2017) agar hasil produktivitas lipid yang diperoleh
nantinya dapat dibandingkan. Karakteristik mutasi serupa yang dimaksud dalam hal ini
adalah mutasi yang memiliki persentase kematian sel sebesar 26 – 30%. Jumlah sel
B.braunii awal dengan jumlah sel yang hidup setelah pemaparan sinar UV-B dan
persentase kematiannya disajikan dalam Tabel II.2. Hasilnya menunjukkan bahwa terjadi
penurunan persentase sel yang hidup setelah pemaparan sinar UV-B. Sel yang masih
hidup setelah pemaparan sinar UV-B disebut sebagai mutasi.
Tabel II.2 Jumlah Sel B.braunii Sebelum dan Sesudah Mutasi Menggunakan Sinar
UV-B
Pemaparan
Sinar UV-B
(Menit)
Run
Jumlah Sel
B.braunii (sel/mL)
%
Kematian
Rata-rata
Sebelum Mutasi
Setelah Mutasi
3 Menit
Penelitian
sebelumnya
11.833.333
8.666.667
26,29
3 Menit
Run 1
49.833.333
26.500.000
29,76
Run 2
49.833.333
39.000.000
Run 3
49.833.333
39.500.000
Mutasi dilakukan dengan waktu pemaparan selama 3 menit dengan persentase
kematian sel rata-rata sebesar 29,76 % dari 3 kali pengulangan. Waktu pemaparan selama
3 menit dipilih berdasarkan kesimpulan penelitian sebelumnya yang dilakukan oleh
Cecil-Wahyu (2017) dimana waktu pemaparan 3 menit merupakan waktu pemaparan
terbaik jika dibandingkan dengan waktu pemaparan 1,5 menit dan 30 menit. Sinar UV-B
memiliki pengaruh terhadap pertumbuhan, kelangsungan hidup, pigmentasi, metabolisme
maupun fotosintesis dari mikroalga. Peningkatan radiasi UV-B secara umum akan
menurunkan kandungan klorofil dan menurunnya fotosintesis (efek pada fotosistem).
Penurunan kandungan klorofil dan fotosintesis ini menghasilkan biomassa yang lebih
rendah (Xue et al, 2005).
8
II.3
Pre-Kultur B.braunii Alami dan Termutasi UV-B
B.braunii
yang
telah
dimutasi
selanjutnya
dilakukan
kultur
atau
pengembangbiakkan B.braunii alami dan termutasi UV-B selama 7 hari
dan
dilakukan
counting chamber setiap hari. Hasil pertumbuhan sel B.braunii alami dan termutasi
UV-B selama 7 hari disajikan dalam Tabel II.3 berikut :
Tabel II.3 Jumlah Sel B.braunii Alami dan Termutasi UV-B Selama 7 Hari Kultur
Hari ke
Jumlah Sel B.braunii (sel/mL)
Alami
Mutasi UV-B
0
49.833.333
35.000.000
1
57.000.000
49.833.333
2
58.500.000
52.333.333
3
71.000.000
57.166.667
4
72.500.000
58.666.667
5
77.666.667
63.000.000
6
81.666.667
73.833.333
7
100.833.333
90.166.667
Gambar II.2 Kurva Pertumbuhan B.braunii Alami dan Termutasi UV-B Selama 7 Hari
Pada perhitungan jumlah sel dengan metode counting chamber, hanya sel yang
hidup yang dihitung jumlahnya. Hal ini dapat diketahui pada warna mikroalga. Pada
kondisi pertumbuhan optimal, mikroalga berwarna hijau tua pekat sedangkan mikroalga
akan berwarna hijau kekuningan bila kondisi pertumbuhannya tidak optimal dan
cenderung berwarna kuning bila mati.
0 20,000,000 40,000,000 60,000,000 80,000,000 100,000,000 120,000,000 0 2 4 6 8 Ju m lah s el (s el/m l) Waktu (hari) Mutasi Alami
9
Berdasarkan Tabel II.3 dan Gambar II.2 diatas dapat dilihat bahwa pertumbuhan
sel B.braunii alami dan mutasi mengalami penigkatan setiap harinya. Pertumbuhan sel
B.braunii alami pada hari ke 0 dengan jumlah sel sebesar 49.833.333 sel/mL dan pada
hari ke 7 naik menjadi 100.833.333 sel/mL. Sedangkan pertumbuhan sel B.braunii mutasi
UV-B menunjukkan pertumbuhan yang cukup signifikan pada hari ke 0 sebesar
35.000.000 sel/mL dan pada hari ke 7 naik menjadi 90.166.667 sel/mL.
II.4
Pengaruh Kadar Nitrogen Dalam Nutrien dan Pengaruh Waktu Kultur
II.4.1 Pertumbuhan Sel B.braunii Alami dan Termutasi UV-B Dengan
Pengurangan Kadar Nitrogen dalam Nutrien Waktu Kultur 7 Hari dan 20 Hari
Nitrogen merupakan unsur fungsional dan struktural pembentuk protein dalam sel
alga dan menyumbang 7-20% berat kering sel. Defisiensi nitrogen dalam kultur alga
adalah meningkatkan biosintesis dan akumulasi lipid. Keterbatasan nitrogen dapat
dianggap sebagai tekanan lingkungan yang efisien untuk meningkatkan akumulasi lipid.
Mikroalga dapat memanfaatkan sumber nitrat, ammonia, atau nitrogen. Secara garis besar
nitrogen mempengaruhi pertumbuhan dari sel mikrolaga seperti kandungan lipid dan
protein. Pada kondisi dimana kadar nitrogen kecil, maka produksi lipid pada sel akan
bertambah banyak, keadaan ini biasa disebut Nitrogen Starvation.
Pada tahap ini mikroalga B.braunii alami dan termutasi UV-B dikultur selama 7
hari dan 20 hari, kemudian ditambahkan nutrien dengan kadar nitrogen dalam nutrien
yang berbeda yaitu 100 mg/L untuk kadar nitrogen Normal Nutrien dan 0,03 mg/L untuk
pengurangan kadar nitrogen dalam nutrien. Mikroalga B.braunii alami dan termutasi
UV-B yang dikultur selama 7 hari dan 20 hari kemudian dilakukan perhitungan jumlah selnya
setiap hari untuk mengetahui pertumbuhan sel yang ditandai dengan semakin keruhnya
warna media kultur mikroalga. Dalam analisa perhitungan jumlah sel digunakan metode
counting chamber dengan menggunakan hemasitometer dan mikroskop.
Jumlah sel awal B.Braunii alami pada hari ke-0 sebesar 51.000.000 sel/mL, lebih
besar jika dibandingkan dengan jumlah sel awal mutasi UV-B. Sehingga kondisi awal
jumlah sel B.braunii alami harus dibuat sama dengan jumlah sel mutasi UV-B yaitu
sebesar 47.250.000 sel/mL dengan pengenceran pada kultur B.braunii alami.
Pengenceran dilakukan dengan menambahan air laut untuk mendapatkan jumlah sel awal
yang mendekati jumlah sel awal mutasi UV-B. Tujuan dari membuat jumlah sel B.braunii
alami dan mutasi UV-B sama pada hari ke-0 adalah untuk membandingkan laju
10
pertumbuhan sel B.braunii alami dan mutasi UV-B dengan mudah. Data pertumbuhan sel
mikroalga B.braunii alami dan mutasi UV-B setelah dikultur selama 7 hari dan 20 hari
dengan pemberian normal nutrien dan pengurangan kadar nitrogen dalam nutrien
disajikan dalam tabel berikut:
Tabel II.4 Pertumbuhan Sel B.braunii Alami dan Termutasi UV-B Variabel Waktu
Kultur 7 Hari dan 20 Hari Dengan Penambahan Normal Nutrien dan Pengurangan
Kadar Nitrogen Dalam Nutrien
Hari
ke
Jumlah sel (10
6sel/mL) pada Variabel Waktu Kultur 7 dan 20 Hari
Alami
Mutasi UV-B
Normal nutrient
(N=.. )
Rendah
nitrogen (N=..)
Normal nutrien
Rendah
nitrogen (N=..)
0
47,250
47,250
47,250
47,250
1
50,500
53,000
51,625
52,750
2
52,375
62,625
58,125
54,500
3
57,875
89,000
67,625
71,625
4
62,000
120,375
69,250
96,875
5
64,250
144,750
70,500
110,500
6
68,000
98,125
75,625
758,75
7
91,750
73,750
87,750
67,875
8
97,375
73,000
91,875
58,875
9
122,250
68,250
91,250
55,375
10
151,000
67,125
101,750
51,625
11
154,250
66,000
117,250
50,125
12
153,250
65,125
75,250
47,625
13
103,000
61,375
57,125
46,875
14
92,625
61,000
53,625
45,125
15
84,000
58,870
47,375
44,375
16
81,125
56,375
46,000
43,375
17
73,250
51,500
45,375
42,750
18
68,500
49,375
45,125
41,250
19
66,625
44,750
44,875
39,375
20
62,500
38,500
44,375
34,500
Berdasarkan Tabel II.4 diatas dapat dilihat bahwa pertumbuhan sel B.braunii
alami dan mutasi UV-B untuk variabel normal nutrien naik secara signifikan setiap
harinya sampai hari ke-11 dan mengalami penurunan pada hari ke-12 sampai hari ke-20.
Jumlah sel pada hari ke-7 untuk variabel alami sebesar 91.750.000 sel/mL, sedangkan
11
jumlah sel untuk variabel mutasi UV-B sebesar 87.750.000 sel/mL. Variabel alami dan
mutasi UV-B mencapai jumlah sel tertinggi pada hari ke-11 yaitu masing-masing sebesar
154.000.000 sel/mL untuk variabel alami dan 170.750.000 sel/mL untuk variabel mutasi
UV-B. Jumlah sel akhir pada hari ke-20 variabel alami sebesar 62.500.000 sel/mL dan
44.375.000 sel/mL untuk variabel mutasi UV-B. Penurunan jumlah sel dengan normal
nutrien dari hari ke-12 sampai hari ke-20 tidak sesuai dengan penelitian yang telah
dilakukan oleh Helmi-Dinny (2016) dimana sel yang diberi nutrien setiap harinya tidak
mengalami penurunan jumlah karena kebutuhan nutrisi yang tercukupi. Penurunan
jumlah sel pada penelitian ini diakibatkan terkontaminasinya media kultur oleh
kontaminan lain sehingga jumlah sel mengalami penurunan.
Sedangkan untuk variabel alami dan mutasi UV-B dengan pengurangan kadar
nitrogen dalam nutrien mengalami kenaikan jumlah sel sampai hari ke-5 dan penurunan
jumlah sel terjadi dari hari ke-6 sampai hari ke-20. Variabel alami memiliki jumlah sel
pada hari ke-7 sebesar 73.750.000 sel/mL dan 67.750.000 sel/mL untuk variabel mutasi
UV-B. Variabel alami dan mutasi UV-B mencapai jumlah sel tertinggi pada hari ke-6
yaitu masing-masing sebesar 144.750.000 sel/mL untuk variabel alami dan 110.500.000
sel/mL untuk variabel mutasi UV-B. Jumlah sel akhir pada hari ke-20 variabel alami
sebesar 38.500.000 sel/mL dan 44.500.000 sel/mL untuk variabel mutasi UV-B. Dapat
dilihat bahwa variabel pengurangan kadar nitrogen dalam nutrien berpengaruh terhadap
penurunan jumlah sel. Hal ini sesuai dengan kutipan Chrismada et al (2006) yang
menyebutkan bahwa kadar nitrogen yang rendah dalam media kultur dapat menyebabkan
penurunan jumlah sel. Kadar nitrogen tersebut terkait dengan hilangnya kemampuan sel
untuk membangun struktur fungsional yang terkait dengan unsur hara yang jumlahnya
terbatas tersebut.
12
Gambar II.3 Grafik Pertumbuhan Sel B.braunii Alami dan Mutasi UV-B dengan
Variabel Normal Nutrien dan Pengurangan kadar Nitrogen Dalam Nutrien Waktu
Kultur 7 Hari dan 20 Hari
Gambar II.3 merupakan grafik perbandingan pertumbuhan sel B.braunii alami
dan mutasi UV-B untuk kedua variabel yaitu kadar nitrogen dalam nutrien dan waktu
kultur, dimana data yang dipaparkan merupakan data rata-rata untuk 2 kali run yang telah
dilakukan.
Berdasarkan grafik tersebut dapat dilihat bahwa B.braunii alami menunjukkan
hasil terbaik untuk pertumbuhan jumlah sel dari semua variabel pada hari ke-7 maupun
jumlah sel akhir pada hari ke-20. Jumlah sel akhir B.braunii pada hari ke-7 sebesar
95.625.000 sel/ml dan pada hari ke-20 sebesar 62.500.000 sel/mL. Hal ini tidak sesuai
dengan penelitian sebelumnya yang telah dilakukan Helmi-Dinny (2016) yang
menyatakan bahwa mutasi UV-B dengan persentase kematian 29-30% memiliki
pertumbuhan sel yang lebih baik dibanding B.braunii alami.
II.4.2 Perubahan pH selama 7 Hari dan 20 Hari Kultur
pH memiliki pengaruh pada pertumbuhan mikroalga. Tiap – tiap spesies
mikroalga memiliki nilai minimum pH yang memungkinkan untuk kelangsungan
hidupnya. Berdasarkan penelitian yang dilakukan Czeslawa (1996), menyimpulkan
mikroalga tidak dapat tumbuh optimal pada pH di bawah 4,8 sebab dinding sel mikroalga
sudah tidak mampu lagi mempertahankan dirinya untuk bertahan hidup.
0 20000000 40000000 60000000 80000000 100000000 120000000 140000000 160000000 180000000 0 5 10 15 20 25 Jumlah sel (sel/ml) Waktu (hari)
Jumlah Sel B.braunii Alami dan Mutasi UV-B Variabel Normal
Nutrien dan Penurunan Kadar Nitrogen Dalam Nutrien Waktu Kultur
7 Hari dan 20 Hari
Alami Normal Nutrien Mutasi Normal Nutrien Alami no-N
13
Dinding sel mikroalga berfungsi sebagai lapisan buffer atau lapisan untuk
menjaga pH dalam tubuh mikroalga. Pada pH asam (pH<7), mikroalga akan
mengkonsumsi karbon dari HCO
3-(CO
2yang terlarut di dalam air) untuk membentuk
lapisan buffer yang berfungsi melindungi dirinya dari kondisi lingkungannya sehingga
mengakibatkan menurunnya kadar CO
2terlarut dalam air sehingga pH media berangsur
– angsur naik.
Pada pH yang terlampau tinggi, mikroalga akan mengkonsumsi CO
2langsung
dari udara. Dalam hal ini CO
2sangat mudah larut dalam air, akibatnya kadar CO
2terlarut
meningkat dan membentuk H
2CO
3yang bersifat asam sehingga pH media berangsur –
angsur turun (Czeslawa, 1996).
Dalam penelitian ini pH kultur tidak dikontrol, namun tetap diukur setiap harinya
menggunakan kertas pH. Perubahan pH selama 7 hari dan 20 hari kultur untuk semua
variabel disajikan dalam Tabel II.5.
Tabel II.5 Perubahan pH Kultur Selama 7 Hari dan 20 Hari
Hari
ke
pH Kultur
Alami
Mutasi UV-B
Normal nutrien
Pengurangan
kadar nitrogen
dalam nutrien
Normal nutrien
Pengurangan
kadar nitrogen
dalam nutrien
0
8,5
8,5
8,6
8,5
1
8,5
8,3
8,5
8,5
2
8,3
8,3
8,5
8,5
3
8,3
8,3
8,5
8,3
4
8,3
8,2
8,2
8,3
5
8,3
8,2
8,2
8,3
6
8,2
8,1
8,2
8,3
7
8,2
8,1
8,2
8,2
8
8
8,1
8,2
8,1
9
8
8,1
8
8
10
8
8,1
8
8
11
7,6
8,1
8
8
12
7,6
8,1
8
8
13
7,5
8,1
7,6
8
14
7,5
8
7,5
7,5
15
7,5
8
7,5
7,5
16
7,5
7,5
7,2
7,2
17
7,3
7,5
7,2
7,2
14
18
7,3
7,3
7
7
19
7,3
7,3
7
7
20
7,3
7,3
7
7
Berdasarkan Tabel II.5 diatas terlihat bahwa pH kultur turun untuk semua
variabel. Penurunan pH untuk semua variabel cenderung sama yaitu dari pH 8,5 pada hari
ke-0 menjadi pH 7,2 pada hari ke 20. Namun, terjadinya penurunan pH ini tidak terlalu
berpengaruh terhadap pertumbuhan mikroalga. Meskipun pH kultur berubah antara 6 –
8, B.braunii tetap tumbuh dengan baik tanpa adanya hambatan tertentu. Telah dilaporkan
juga oleh Dayananda et al (2007) bahwa pH kultur tidak memiliki pengaruh yang
signifikan terhadap yield biomassa dan produksi hidrokarbon dari B.braunii saat rentang
pH 6 – 8,5 (Yaming Ge et al, 2011).
II.4.3 Produktivitas Biomassa Variabel Kadar Nitrogen dalam Substrat dan
Waktu Kultur
Pada tahap ini semua variabel baik variabel kadar nitrogen dalam nutrien maupun
waktu kultur dipanen untuk selanjutnya dilakukan ekstraksi dan distilasi dimana nantinya
akan diperoleh lipid yang berasal dari mikroalga B.braunii. Untuk ekstraksi lipid pada
tahap ini digunakan biomassa kering mikroalga alami dan mutasi UV-B semua variabel.
Ekstraksi lipid dilakukan selama 6 jam dengan menggunakan pelarut n-heksan setelah
melalui pre-treatment. Proses pre-treatment meliputi, masing-masing mikroalga
disentrifugasi untuk didapatkan endapan alga basah. Selanjutnya mikroalga basah
dikeringkan di dalam oven pada suhu 60
oC selama 2 jam, setelah pengeringan biomassa
mikroalga kering ditimbang. Berat biomassa B.braunii alami untuk variabel normal
nutrien dan pengurangan kadar nitrogen dalam nutrien waktu kultur 7 hari berturut-turut
sebesar 1,69 gram dan 1,58 gram. Berat mikroalga kering B.braunii alami variabel normal
nutrien dan pengurangan kadar nitrogen dalam nutrien waktu kultur 20 hari berturut-turut
sebesar 1,58 gram dan 1,53 gram. Sedangkan berat mikroalga kering untuk mutasi UV-B
variabel normal nutrien dan pengurangan kadar nitrogen waktu kultur 7 hari
berturut-turut sebesar 1,62 gram dan 1,59 gram. Berat mikroalga kering untuk mutasi UV-B
variabel normal nutrien dan pengurangan kadar nitrogen dalam nutrien waktu kultur 20
hari berturut-turut sebesar 1,52 gram dan 1,45 gram. Dari berat kering mikroalga
diperoleh konsentrasi biomassa dalam 500 mL volume kultur sehingga massa sel dapat
15
ditentukan. Hasil konsentrasi biomassa dan massa sel untuk semua variabel disajikan
dalam Tabel II.6 dimana data yang dipaparkan merupakan data rata-rata untuk 2 kali run
yang telah dilakukan.
Tabel II.6 Perhitungan Konsentrasi Biomassa Variabel Kadar Nitrogen dalam Nutrien
dan Waktu Kultur
Kondisi
Variabel
Waktu
Kultur
Variabel Kadar
Nitrogen dalam
Nutrien
Konsentrasi
Biomassa
(mg/mL)
Konsentrasi
Sel (sel/mL)
Massa Sel
(mg/sel)
Alami
7 Hari
Normal Nutrien
3,39
91.750.000
3,694 x 10
-8Nutrien no-N
3,17
73.750.000
4,298 x 10
-820 Hari
Normal Nutrien
3,17
62.500.000
5,072 x 10
-8
Nutrien no-N
3,07
38.500.000
7,948 x 10
-8Mutasi
UV-B
7 Hari
Normal Nutrien
3,24
87.750.000
3,699 x 10
-8Nutrien no-N
3,18
67.875.000
4,567 x 10
-820 Hari
Normal Nutrien
3,04
44.375.000
6,850 x 10
-8
Nutrien no-N
2,90
34.500.000
8,405 x 10
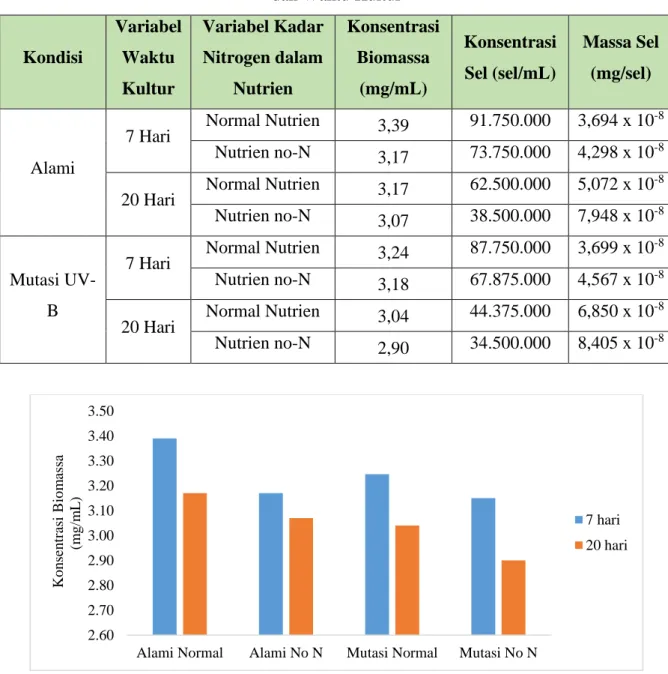
-8Gambar II.4 Grafik Perbandingan Konsentrasi Biomassa Variabel Kadar Nitrogen
dalam Nutrien dan Waktu Kultur
2.60 2.70 2.80 2.90 3.00 3.10 3.20 3.30 3.40 3.50Alami Normal Alami No N Mutasi Normal Mutasi No N
Ko n sen tr asi B io m ass a (m g /m L ) 7 hari 20 hari
16
Berdasarkan Tabel II.6 dan Gambar II.4 dapat dilihat bahwa konsentrasi
biomassa tertinggi didapatkan pada variabel normal nutrien dan waktu kultur 7 hari yang
masing-masing sebesar 3,39 mg/mL untuk B.braunii alami dan 3,24 mg/mL untuk
B.braunii mutasi UV-B. Sedangkan konsentrasi biomassa terendah didapatkan pada
variabel pengurangan kadar nitrogen dalam nutrien dan waktu kultur 20 hari yang
masing-masing sebesar 3,07 mg/mL untuk B.braunii alami dan 2,90 B.braunii mutasi
UV-B. Sedangkan dari semua variabel, konsentrasi biomassa tertinggi didapatkan pada
B.braunii alami variabel normal nutrien waktu kultur 7 hari sebesar 3,90 mg/mL.
Konsentrasi biomassa yang diperoleh dipengaruhi oleh laju pertumbuhan masing-masing
variabel, dimana laju pertumbuhan yang paling baik akan menghasilkan konsentrasi
biomassa yang lebih besar. Seperti yang telah disajikan dalam grafik pada Gambar II.3
bahwa sel akhir B.braunii alami variabel normal nutrien waktu kultur 7 hari memiliki
pertumbuhan sel yang terbaik jika dibanding variabel lainnya.
Dari Tabel II.6 diatas juga dapat diketahui massa sel untuk setiap variabel, yang
mana jika dibandingkan antara B.braunii alami dan mutasi UV-B akan diperoleh massa
sel B.braunii alami dengan normal nutrien dengan waktu kultur 7 hari lebih besar jika
dibandingkan dengan variabel lainnya. Sedangkan massa sel terkecil didapat pada
B.braunii mutasi UV-B variabel pengurangan kadar nitrogen dalam nutrien dengan waktu
kultur 20 hari. Mengutip dari Neha Kalla (2016) bahwa pengurangan kadar nitrogen
berpengaruh terhadap penurunan pertumbuhan jumlah sel dan biomassa mikroalga,
dimana dalam keadaan pengurangan kadar nitrogen mikroalga akan mengalami kondisi
stress sehingga mengakitbatkan penurunan jumlah sel dan produktivitas biomassa.
II.4.4 Lipid Content dan Produktivitas Lipid Variabel Kadar Nitrogen dalam
Substrat dan Waktu Kultur
Berdasarkan data produktivitas biomassa, konsentrasi biomassa, jumlah sel, dan
massa sel dapat ditentutan lipid content dan produktivitas lipid dari mikroalga. Lipid
content dapat diperoleh dari berat lipid yang dihasilkan dari proses ekstraksi dan berat
mikroalga kering, produktivitas lipid dapat diperoleh dari lipid content dalam gram
per-liter tiap harinya dan produktivitas biomassanya. Data lipid content dan produktivitas
lipid disajikan pada Tabel II.7, dimana data yang dipaparkan merupakan data rata-rata
17
untuk 2 kali run yang telah dilakukan. Sedangkan perbandingan Produktivitas lipid dan
lipid content disajikan dalam Gambar II.5 dan Gambar II.6
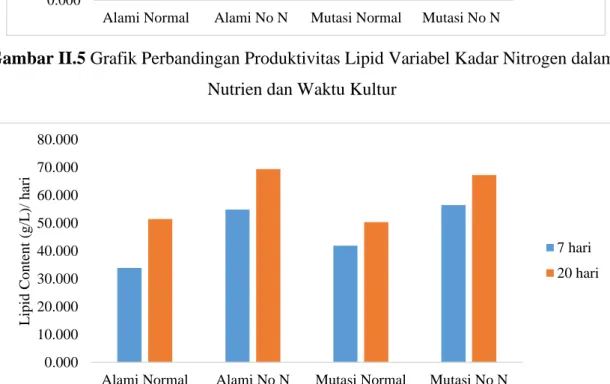
Gambar II.5 Grafik Perbandingan Produktivitas Lipid Variabel Kadar Nitrogen dalam
Nutrien dan Waktu Kultur
Gambar II.6 Grafik Perbandingan Lipid content Variabel Kadar Nitrogen dalam
Nutrien dan Waktu Kultur
0.000 0.010 0.020 0.030 0.040 0.050 0.060 0.070 0.080 0.090 0.100Alami Normal Alami No N Mutasi Normal Mutasi No N
P ro d u tiv itas L ip id ( m g /m L )/ h ar i 7 hari 20 hari 0.000 10.000 20.000 30.000 40.000 50.000 60.000 70.000 80.000
Alami Normal Alami No N Mutasi Normal Mutasi No N
L ip id C o n ten t (g /L )/ h ar i 7 hari 20 hari
18
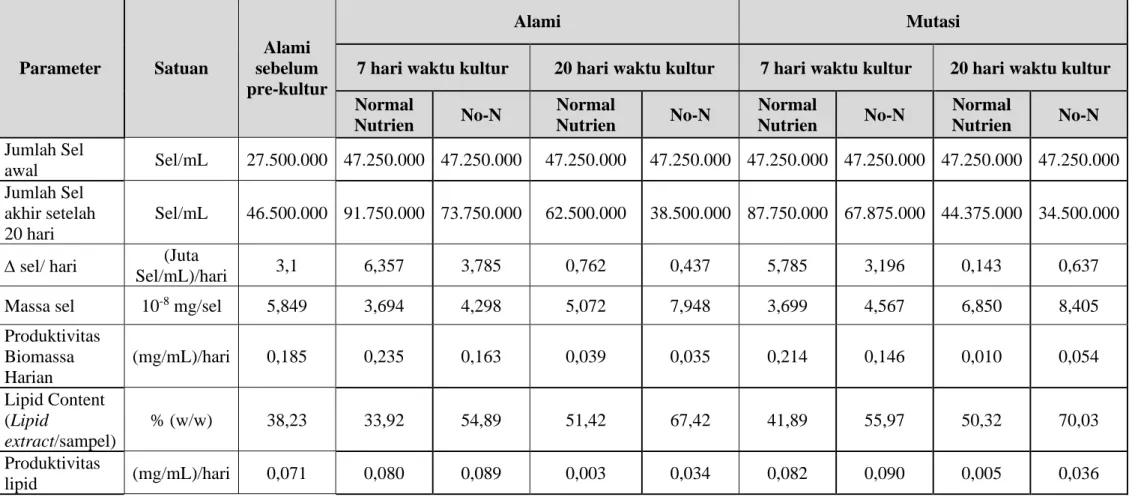
Tabel II.7 Perhitungan Lipid Content dan Produktivitas Lipid Variabel Kadar Nitrogen dalam Nutrien dan Waktu Kultur
Parameter
Satuan
Alami
sebelum
pre-kultur
Alami
Mutasi
7 hari waktu kultur
20 hari waktu kultur
7 hari waktu kultur
20 hari waktu kultur
Normal
Nutrien
No-N
Normal
Nutrien
No-N
Normal
Nutrien
No-N
Normal
Nutrien
No-N
Jumlah Sel
awal
Sel/mL
27.500.000 47.250.000 47.250.000
47.250.000
47.250.000 47.250.000 47.250.000 47.250.000 47.250.000
Jumlah Sel
akhir setelah
20 hari
Sel/mL
46.500.000 91.750.000 73.750.000
62.500.000
38.500.000 87.750.000 67.875.000 44.375.000 34.500.000
sel/ hari
(Juta
Sel/mL)/hari
3,1
6,357
3,785
0,762
0,437
5,785
3,196
0,143
0,637
Massa sel
10
-8mg/sel
5,849
3,694
4,298
5,072
7,948
3,699
4,567
6,850
8,405
Produktivitas
Biomassa
Harian
(mg/mL)/hari
0,185
0,235
0,163
0,039
0,035
0,214
0,146
0,010
0,054
Lipid Content
(Lipid
extract/sampel)
% (w/w)
38,23
33,92
54,89
51,42
67,42
41,89
55,97
50,32
70,03
Produktivitas
lipid
(mg/mL)/hari
0,071
0,080
0,089
0,003
0,034
0,082
0,090
0,005
0,036
19
Jumlah sel akhir paling tinggi didapatkan mikroalga B.braunii alami dengan normal
nutrien waktu kultur 7 hari yaitu sebesar 91.750.000 sel/mL, dan jumlah sel akhir paling
rendah didapatkan mikroalga mutasi UV-B dengan pengurangan kadar nitrogen dalam
nutrien waktu kultur 20 hari. Pertumbuhan sel per hari paling rendah didapatkan oleh
B.braunii mutasi dengan normal nutrien waktu kultur 20 hari jika dibandingkan dengan
variabel lainnya yaitu hanya sebesar 0,143 juta sel/mL per hari. Pertumbuhan sel per hari
ini lebih rendah dibandingkan pertumbuhan B. braunii alami normal nutrien waktu kultur
7 hari yang mencapai 6,357 juta sel/mL per hari.
Berdasarkan Tabel II.7 Produktivitas lipid paling tinggi dihasilkan oleh B.braunii
mutasi dengan pengurangan kadar nitrogen dalam nutrien waktu kultur 7 hari yaitu
sebesar 0,090 (mg/mL)/ hari. Dan disusul oleh B.braunii alami dengan pengurangan
kadar nitrogen dalam nutrien waktu kultur 7 hari yaitu sebesar 0,089 (mg/mL)/ hari. Pada
kondisi pertumbuhan normal, mikroalga yang memproduksi biomassa dalam jumlah
besar belum tentu memiliki produktivitas yang optimal. Sehingga untuk memperoleh
produktivitas lipid yang tinggi mikroalga perlu dibuat dalam kondisi stress, dalam hal ini
dengan pengurangan kadar nitrogen (Ruangsomboon, 2015).
Dapat dilihat pada Tabel II.7 bahwa pertumbuhan B.braunii yang paling baik
adalah B.braunii alami dengan normal nutrien waktu kultur 7 hari yaitu sebesar
91.750.000 sel/mL per hari, akan tetapi B.braunii mutasi UV-B dengan pengurangan
kadar nitrogen dalam nutrien waktu kultur 7 hari mempunyai lipid content terbesar
dengan pertumbuhan yang lebih rendah dibandingkan B.braunii alami dengan normal
nutrien waktu kultur 7 hari, yaitu sebesar 3,196 juta sel/mL per hari. Dapat dilihat juga
pada variabel lain yaitu B.braunii alami dengan pengurangan kadar nitrogen dalam
nutrien waktu kultur 7 hari yang memiliki pertumbuhan yang lebih rendah tetapi
produktivitas lipid yang lebih tinggi dibandingkan dengan B.braunii alami normal nutrien
waktu kultur 7 hari. Sehingga berdasarkan data-data tersebut dapat disimpulkan bahwa
pertumbuhan mikroalga yang lebih baik tidak selalu menghasilkan lipid yang lebih
banyak, begitu pula sebaliknya.
Pertumbuhan sel mikroalga paling tinggi yaitu B.braunii alami dengan normal
nutrien waktu kultur 7 hari sebesar 6,357 juta sel/ml. Kandungan lipid (Berat Lipid
extract/ berat sampel) tertinggi yaitu B.braunii alami dengan pengurangan kadar nitrogen
20
(Berat Lipid extract/ berat sampel) tertinggi juga diperoleh oleh B.braunii mutasi dengan
pengurangan kadar nitrogen dalam nutrien waktu kultur 20 hari yaitu sebesar 67,224%.
Hal ini menunjukkan bahwa perlakuan pengurangan kadar nitrogen dalam nutrien pada
waktu kultur paling optimum dapat meningkatkan kualitas mikroalga B.braunii yang
dibuktikan dengan hasil produktivitas lipid dan lipid content dari B.braunii dengan
variabel pengurangan kadar nitrogen dalam nutrien.
II.5
Analisa GC (Gas Chromatography)
Analisa GC digunakan untuk mengetahui kandungan senyawa dari lipid B.braunii
alami dan mutasi. Hasil analisa pada B.braunii alami dan mutasi dengan pengurangan
kadar nitrogen dalam nutrien waktu kultur 7 hari serta B.braunii alami dan mutasi dengan
pengurangan kadar nitrogen dalam nutrien waktu kultur 20 hari terlihat pada Gambar
II.6 berikut.
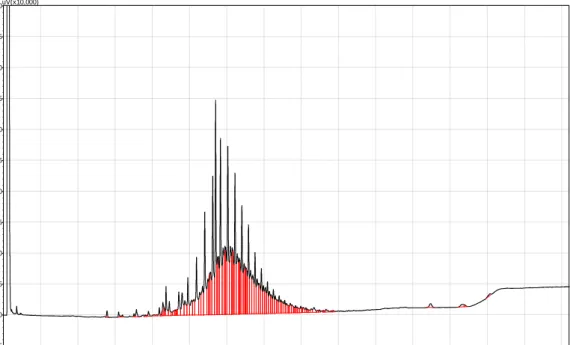
Gambar II.7 Hasil Analisa GC Lipid B.braunii Alami dengan Pengurangan Kadar
Nitrogen dalam Nutrien Waktu Kultur 7 Hari
Hasil analisa GC menunjukkan adanya beberapa senyawa yang terkandung dalam
lipid B.braunii alami seperti yang terdapat pada Tabel II.8 berikut.
Tabel II.8 Komposisi Senyawa Lipid B.braunii Alami dengan Pengurangan Kadar
Nitrogen dalam Nutrien Waktu Kultur 7 Hari
2.5 5.0 7.5 10.0 12.5 15.0 17.5 20.0 22.5 25.0 27.5 30.0 32.5 35.0 min -0.5 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0uV(x10,000)
21
No
Nama Komponen
Range Retention
Time
% Area
1. Asam lemak bebas (FFA)
11,009 – 14,126
15,810 %
2. Monoacylglycerol (MAG)
14,341 – 15,735
19,986 %
3. Diacylglycerol (DAG)
20,059 – 21,864
9,096 %
4. Triacylglycerol (TAG)
26,756 – 35,687
1,487 %
Untuk hasil analisa GC pada B.braunii mutasi dengan pengurangan kadar nitrogen
dalam nutrient waktu kultur 7 hari terlihat pada Gambar II.7 berikut.
Gambar II.8 Hasil Analisa GC Lipid B.braunii Mutasi dengan Pengurangan Kadar
Nitrogen dalam Nutrien Waktu Kultur 7 Hari
Hasil analisa GC menunjukkan adanya beberapa senyawa yang terkandung dalam
lipid B.braunii mutasi seperti yang terdapat pada Tabel II.9 berikut.
Tabel II.9 Komposisi Senyawa Lipid B.braunii Mutasi dengan Pengurangan Kadar
Nitrogen dalam Nutrien Waktu Kultur 7 Hari
2.5 5.0 7.5 10.0 12.5 15.0 17.5 20.0 22.5 25.0 27.5 30.0 32.5 35.0 min -0.5 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0uV(x10,000)
22
No
Nama Komponen
Range Retention
Time
% Area
1.
Asam lemak bebas (FFA)
11,009 – 14,126
22,544 %
2.
Monoacylglycerol (MAG)
14,341 – 15,735
33,289 %
3.
Diacylglycerol (DAG)
20,059 – 21,864
1,496 %
4.
Triacylglycerol (TAG)
26,756 – 35,687
0,761 %
Sedangkan untuk hasil analisa GC pada B.braunii alami dengan pengurangan
kadar nitrogen dalam nutrient waktu kultur 20 hari terlihat pada Gambar II.8 berikut.
Gambar II.9 Hasil Analisa GC Lipid B.braunii Alami dengan Pengurangan Kadar
Nitrogen dalam Nutrien Waktu Kultur 20 Hari
Hasil analisa GC menunjukkan adanya beberapa senyawa yang terkandung dalam
lipid B.braunii alami seperti yang terdapat pada Tabel II.9 berikut.
Tabel II.10 Komposisi Senyawa Lipid B.braunii Alami dengan Pengurangan Kadar
Nitrogen dalam Nutrien Waktu Kultur 20 Hari
2.5 5.0 7.5 10.0 12.5 15.0 17.5 20.0 22.5 25.0 27.5 30.0 32.5 35.0 min -0.5 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0uV(x10,000)
23
No
Nama Komponen
Range
Retention Time
% Area
1.
Asam lemak bebas (FFA)
11,009 – 14,126
22,446 %
2.
Monoacylglycerol (MAG) 14,341 – 15,735
38,289 %
3.
Diacylglycerol (DAG)
20,059 – 21,864
0,631 %
4.
Triacylglycerol (TAG)
26,756 – 35,687
1,006 %
Untuk hasil analisa GC pada B.braunii mutasi dengan pengurangan kadar nitrogen
dalam nutrien waktu kultur 20 hari terlihat pada Gambar II.9 berikut.
Gambar II.10 Hasil Analisa GC Lipid B.braunii Mutasi dengan Pengurangan Kadar
Nitrogen dalam Nutrien Waktu Kultur 20 Hari
Hasil analisa GC menunjukkan adanya beberapa senyawa yang terkandung dalam
lipid B.braunii mutasi seperti yang terdapat pada Tabel II.10 berikut.
Tabel II.10 Komposisi Senyawa Lipid B.braunii Mutasi dengan Pengurangan Kadar
Nitrogen dalam Nutrien Waktu Kultur 20 Hari
2.5 5.0 7.5 10.0 12.5 15.0 17.5 20.0 22.5 25.0 27.5 30.0 32.5 35.0 min -0.5 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0uV(x10,000)
24
No
Nama Komponen
Range
Retention Time
% Area
1.
Asam lemak bebas (FFA)
11,009 – 14,126
20,170 %
2.
Monoacylglycerol (MAG)
14,341 – 15,735
35,992 %
3.
Diacylglycerol (DAG)
20,059 – 21,864
1,298 %
4.
Triacylglycerol (TAG)
26,756 – 35,687
1,906 %
Dari keempat hasil analisa GC di atas, kandungan TAG yang terbesar diantara
keempat hasil analisa tersebut adalah B.braunii mutasi dengan pengurangan kadar
nitrogen dalam nutrien waktu kultur 20 hari. Hasil analisa GC untuk B.braunii alami
maupun B.braunii mutasi menunjukkan kandungan asam lemak bebas (FFA) yang lebih
besar dibanding kandungan TAG. Jenis FFA yang terdapat B.braunii didominasi oleh
asam oleat (C18) dan asam palmiat (C16). Hal ini sesuai dengan literatur yang
menyatakan bahwa lipid yang dihasilkan dari mikroalga memiliki kandungan FFA yang
besar. Meskipun kandungan FFA yang paling tinggi, mikroalga B.braunii ini dapat
digunakan sebagai bahan baku biodiesel melalui proses esterifikasi menggunakan katalis
asam dan transesterifikasi menggunakan katalis basa (Ashokkumar, 2014).
25
BAB III
STATUS LUARAN
Luaran Wajib:
1. Jurnal Internasional Published:
Judul: The effect UV-B mutation on biodiesel from microalgae Botryococcus
braunii
using esterification, transesterification and combination of esterification
transesterification
Published di: AIP Conference Proceedings 2217, 030021 (2020);
https://doi.org/10.1063/5.0000554
2. Jurnal Internaional under review:
Judul: Effect of Reducing Nitrogen Levels on Growth and Lipid Productivity of
Microalgae Botryococcus braunii Exposed by UV-C Rays
Luaran tambahan:
Seminar Internasional: di 2
ndInternational Conference on Engineering, Technology and
Social Science, 31 October 2020
26
BAB IV
PERAN MITRA
27
BAB V
KENDALA PELAKSANAAN PENELITIAN
Pandemi covid 19 menyebabkan aktifitas eksperimen di Lab menjadi sangat terganggu
sehinnga data yang dihasilkan tidak sesuai dengan rencana. Akan tetapi diupayakan
dengan data yang ada berhasil published di Jurnal dan presentasi di seminar internasional
bereputasi
28
BAB VI
RENCANA TAHAPAN SELANJUTNYA
Melanjutkan penelitian mutasi mikroalga dengan sinar UV-C dengan menggunakan
pupuk sehingga biaya operasi menjadi lebih murah. Serta direncanakan meningkatkan
kapasitas menjadi skala yang lebih besar (pilot scale) dan akhirnya penerapan pada skala
komersial.
29
BAB VII
DAFTAR PUSTAKA
Amini, Sri., et al. 2014. “Effect of Cell Wall Disruption Treated by using Microwave
and Sonicator of Botryococcus braunii and Nannochloropsis on The Amount of
Oil Produced”. 41-49.
Ashokkumar, Veeramuthu.
, et al.
2014. “Optimization and Characterization of
Biodiesel Production From Microalgae Botryococcus Grown at Semi-Continuous
System”. Energy Conversion and Management, 936-946.
Benson. 2001. “Microbiological Application”. New York: McGraw Hill Publisher.
Bharathiraja, B., et al. 2015. “Aquatic Biomass (Algae) as A Future Feedstock for
Bio-Refineries: A Review on Cultivation, Processing and Products”. Renewable and
Sustainable Energy Reviews, 634-653.
Chrismadha, Tjandra., et al. 2006. “Pengaruh Konsentrasi Nitrogen Dan Fosfor
Terhadap Pertumbuhan, Kandungan Protein, Karbohidrat dan Fikosianin Pada
Kultur Spirulinafusiformis”. Pusat Penelitian Limnologi-LIPI, Bogor.
Chisti, Yusuf. 2007. “Biodiesel from microalgae”. Biotechnology Advances, 294-306.
Dayananda, Chandrappa., et al. 2007. “Isolation and Characterization of Hydrocarbon
Producing Green Alga Botryococcus braunii from Indian Freshwater Bodies”.
Electronic Journal of Biotechnology.
Eugenia J. Olguín, S. G. 2003. “Annual Productivity of Spirulina (Arthrospira) and
Nutrient Removal in a Pig Wastewater Recycling Process Under Tropical
Conditions”. Journal of Applied Phycology, 249-257.
Faried, M., et al. 2017. “Biodiesel Production from Microalgae: Processes, Technologies
and Recent”. Renewable and Sustainable Energy Reviews, 894.
Ge, Yaming., et al. 2011. “Growth Characteristics of Botryococcus braunii 765 Under
High CO
2Concentration in Photobioreactor”. Bioresource Technology, 132-133.
Gunzler, H., et al. 2001. “Handbook of Analytical Technique”. Weinheim: Wiley-VCH.
Hadiyanto., et al. 2012. “Mikroalga, Sumber Pangan dan Energi Masa Depan”.
30
Isnansetyo, Alim., et al. 1995. ”Teknik Kultur Phytoplankton Zooplankton”. Pakan
Alam untuk Pembenihan Organism Laut. Kanisius. Yogyakarta.
Kalla, Neha., et al. 2016. “Effect of Nitrogen, Phosphorus Concentrations, pH and
Salinity Ranges on Growth, Biomass and Lipid Accumulation of Chlorella
Vulgaris”. International Journal of Pharmaceutical Sciences and Research,
397-405.
Kawaroe, Mujizat., et al. 2010. ”Mikroalga, Potensi dan Pemanfaatannya Untuk
Produksi Bio Bahan Bakar”. Bogor. IPB Press.
Lee, S.J., et al. 1998. ”Effects of Harvesting Method and Growth Stage on the
Flocculation of the Green Alga Botryococcus braunii”. Letters in Applied
Microbiology, 14-17.
Li Fen Wu., et al. 2013. “The Effects of Nitrogen Sources and Temperature on Cell
Growth and Lipid Accumulation of Microalgae”. International Biodeterioration
& Biodegradation, 1-5.
Nalewajko, Czeslawa., et al. 1997. “Effect of pH on Growth, Photosynthesis,
Respiration, and Copper Tolerance of Three Scenedesmus Strains”.
Environmental and Experimental Botany, 153-160.
Prastowo, Bambang., et al. 2014. ”Biodiesel Generasi-1 Generasi-2”. Jakarta. IAARD
Press, 1-9.
Ruangsomboon, S. 2012. “Effect of Light, Nutrient, Cultivation Time and Salinity on
Lipid Production of Newly Isolated of the Green Microalga, Botryococcus braunii
KMITL 2”. Bioresource Technology, 261-265.
Ruangsomboon, S., et al. 2017. “Enhanced Growth and Hydrocarbon Production of
Botryococcus braunii KMITL 2 by Optimum Carbon Dioxide Concentration and
Concentration-Dependent Effects on its Biochemical Composition and Biodiesel
Properties”. Bioresource Technology, 14-16.
Saputro, Bintoro Rudi., et al. 2015. “The Growth of Botryococcus braunii Microalgae
as a Lipid Producer in a Mixed Medium of Coconut Water and Seawater”. Jurnal
Sains dan Matematika, 94-100.
Sharma, Kalpesh K., et al. 2012. ”High Lipid Induction in Microalgae for Biodiesel
31
Smith, R. C., et al. 1992. “Ozone Depletion: Ultraviolet Radiation and Phytoplankton
Biology in Antartic Waters”. JSTOR, 952-959.
Su, Yujie., et al. 2015. “Progress of Microalgae Biofuel’s Commercialization”.
Renewable and Sustainable Energy Reviews, 403.
Susilowati,
Rini.,
et
al.
2010.
”Produksi Biodiesel dari
Mikroalga
Botryococcus
braunii”.Squalen, 27.
Verma, Narendra M., et al. 2009. ”Prospective of Biodiesel Production Utilizing
Microalgae as the Cell Factories : A Comprehensive Discussion”.African Journal
of Biotechnology, 1403.
Widaja, Arief., et al. 2009. ”Study of Increasing Lipid Production from Fresh Water
Microalgae Chlorella vulgaris”. Journal of the Taiwan Institute of Chemical
Engineers 40, 13-20.
Zhang, Kai., et al. 1998. “Effect of Light Intensity on Colony Size of Microalga
Botryococcus braunii in Bubble Column Photobioreactors. "Journal of
Fermentation and Bioengineering (86), 573-576.
Zhila, N.O., et al. 2004. “Effect of Nitrogen Limiation on the Growth and Lipid
Composition of the Green Alga Botryococus braunii Kütz IPPAS H-252”.
Russian Journal of Plant Physiology, 311-319.
Zul, Delita., et al. 2003. ”Mutagenesis pada Kluyveromyces Marxianus T-2 Penghasil
Inulinase Ekstraselular dengan Sinar Ultra Violet”. Jurnal Natur Indonesia,26.
ix
32
BAB VIII
LAMPIRAN
LAMPIRAN 1 Tabel Daftar Luaran
Program
: Hibah Dana Lokal ITS Pasca Sarjana Master
Nama Ketua Tim
: Prof. Dr. Ir. Arief Widjaja
Judul
: KARAKTERISTIK LIPID DARI PENGGUNAAN
NUTRIEN KOMERSIAL DALAM KULTUR
MIKROALGA Botryococcus braunii TERMUTASI
SINAR UV-C
1.Artikel Jurnal
No
Judul Artikel
Nama Jurnal
Status
Kemajuan*)
1
The effect UV-B mutation on biodiesel
from microalgae Botryococcus braunii
using esterification, transesterification
and combination of esterification
transesterification
AIP Conference
Proceedings 2217,
030021 (2020);
Published
2
Effect of Reducing Nitrogen Levels on
Growth and Lipid Productivity of
Microalgae Botryococcus braunii
Exposed by UV-C Rays
Under review untuk
selected ke Jurnal
Under review
*) Status kemajuan: Persiapan, submitted, under review, accepted, published
2. Artikel Konferensi
No
Judul Artikel
Nama Konferensi (Nama
Penyelenggara, Tempat,
Tanggal)
Status
Kemajuan*)
Effect of Reducing Nitrogen
Levels on Growth and Lipid
Productivity of Microalgae
Botryococcus braunii Exposed
by UV-C Rays
2
ndInternational
Conference on Engineering,
Technology and Social
Science, 31 October 2020
Presented
33
3. Paten
No Judul Usulan Paten
Status Kemajuan
1
Peningkatan Lipid Mikroalga dengan metode
Mutasi dengan sinar UV-C
Draft
*) Status kemajuan: Persiapan, submitted, under review
4. Buku
No
Judul Buku
(Rencana) Penerbit
Status Kemajuan*)
*) Status kemajuan: Persiapan, under review, published
5. Hasil Lain
No
Nama Output
Detail Output
Status Kemajuan*)
*) Status kemajuan: cantumkan status kemajuan sesuai kondisi saat ini
6. Disertasi/Tesis/Tugas Akhir/PKM yang dihasilkan
No Nama Mahasiswa
NRP
Judul
Status*)
1
Theia Prastiwi S
02211950010004
Tesis S2 berjudul:
Studi Karakteristik Lipid dari
Penggunaan Nutrien Komersial
dalam Kultur Mikroalga
Botryococcus braunii Termutasi
Sinar UV-C
In progres
AIP Conference Proceedings 2217, 030021 (2020); https://doi.org/10.1063/5.0000554 2217, 030021
© 2020 Author(s).
The effect UV-B mutation on biodiesel
from microalgae Botryococcus braunii
using esterification, transesterification
and combination of
esterification-transesterification
Cite as: AIP Conference Proceedings 2217, 030021 (2020); https://doi.org/10.1063/5.0000554
Published Online: 14 April 2020
Anggia Putri Ramadhani, Muhammad Hafizh Prashantyo, Thea Prastiwi Soedarmodjo, and Arief Widjaja
ARTICLES YOU MAY BE INTERESTED IN
Detection of forest fire used multi sensors system for peatland area in Riau Province AIP Conference Proceedings 2217, 020003 (2020); https://doi.org/10.1063/5.0000493
The Effect UV-B Mutation on Biodiesel from Microalgae
Botryococcus braunii using Esterification,
Transesterification and Combination of
Esterification-Transesterification
Anggia Putri Ramadhani
1,a), Muhammad Hafizh Prashantyo
1,b), Thea Prastiwi
Soedarmodjo
1,c), and Arief Widjaja
1,d)1Chemical Engineering Department, Institut Teknologi Sepuluh Nopember, Sukolilo, Surabaya, 60111, Indonesia
d)Corresponding author: arief_w@chem-eng.its.ac.id a)anggiapr99@gmail.com
b)muhammad.hafizhp@gmail.com c)theasoedarmodjo@gmail.com
Abstract. Biodiesel from microalgae as a third-generation fuel is promising due to its sustainability and eco-friendly
energy source. The objective of this study was comparing conversion of lipid from microalgae Botryococcus braunii mutated with UV-B using esterification, transesterification and combination of esterification-transesterification processes. In this study, Ultraviolet (UV-B) light was used to perform mutation of microalgae. It was used to damage the cell walls of microorganism. The conversion of lipid to biodiesel from UV-mutated and native microalgae using esterification method were 2.05% and 1.11%, respectively, under 1 : 10 molar ratio of algae lipid and methanol at 60oC,
1.5% w/w H2SO4, 200 rpm stirring speed for 2 h. Transesterification method did not produce biodiesel under 1 : 7 molar
ratio of algae lipid and methanol with 0.5% w/w NaOH catalyst at 60oC, 200 rpm stirring speed for 1 h. Furthermore, the
combination esterification-transesterification method resulted in 24.82% and 3.87% yield for mutated and native algae, respectively. In the first stage, esterification of the mutated and native algae decreased acid value from 24.13 to 0.567 mg KOH/g and from 23.21 to 0.486 mg KOH/g, respectively, under 1 : 8 molar ratio of algae lipid and methanol, 1.5% w/w H2SO4 catalyst, 60oC, 400 rpm stirring speed for 2 h. The next stage of transesterification was conducted at a molar ratio
of 9 : 1, 0.75% wt KOH catalyst concentration, 65oC at 600 rpm for 1 h. The results showed that combination
esterification-transesterification was the best method to convert lipid to biodiesel.
INTRODUCTION
Recently, the needs of renewable energy in Indonesia continue to increase along with the reduction in fossil fuel reserves. In 2025, the need for renewable energy is targeted to reach 23% of the total energy demand [1]. Therefore, the government prepares various options for utilizing renewable energy, one of these by utilizing biofuels. One of biofuel type that has been implemented by the government is biodiesel. However, lately the feedstocks of biodiesel are edible oil. The use of edible oil to fulfill energy demand makes some problems like the sustainability of this practice due to its competition with food. Microalgae is one of candidates that can be practically grown anywhere with enough sunshine as they do not compete with food crops for land and water. In addition, microalgae biomass productivity is several folds higher than terrestrial crops. Indonesia has been widely known as a maritime country whose two thirds of its territory is the ocean as the longest coastline in the world, it is about ± 80,791.42 Km.
B braunii is one of the largest microalgae containing lipids, about 20-75% dry weight. Microalgae lipids contain
high free fatty acids (FFA). The types of fatty acids found in B. braunii lipids are dominated by oleic and palmitic acids [2]. Through the process of esterification and transesterification of biomass, lipid microalgae can be converted
The 5th International Conference on Industrial, Mechanical, Electrical, and Chemical Engineering 2019 (ICIMECE 2019) AIP Conf. Proc. 2217, 030021-1–030021-8; https://doi.org/10.1063/5.0000554
Published by AIP Publishing. 978-0-7354-1971-1/$30.00 030021-1
into biodiesel [3]. Mutation in microorganisms is carried out to improve the nature of microorganisms. In research using UV-B mutagen, it was explained that microbes that were irradiated with UV-B light at the right dosage would produce higher activity than natural ones, because UV radiation would change in gene composition resulting in mutant genes that could cause increases certain microorganisms [4].
The use of alkaline catalyst in the transformation process to biodiesel has several disadvantages, such as the occurrence of saponification reactions, hydrolysis reactions, increased catalyst consumption, reduced effectiveness of catalysts and reduced amount of biodiesel production [5]. In addition, the separation of glycerin is very difficult due to the formation of soap which requires large amounts of alkaline water to wash the soap [6]. When an acid catalyst is used to overcome this problem, it takes longer to complete because the reaction rate is lower than the alkaline catalyst [7].
Therefore, the process of combining a two-stages was developed for biodiesel production from microalgae. Lipid from microalgae B. braunii can be esterified with acid catalyst in the first stage to convert FFA into biodiesel followed by transesterification with alkali catalyst to convert triglyceride content to biodiesel. So, that the biodiesel yield becomes maximal. This study aims to produce biodiesel from mutated microalgae B. braunii by combined esterification and transesterification.
MATERIALS AND METHODS
Materials
Microalgae strain of B. braunii was collected in Balai Budidaya Air Payau, Jepara, Central Java. The materials used in this study were aquadest, sea water from Balai Budidaya Air Payau Situbondo, East Java, phenolphthalein indicator, KOH, CH3OH, NaOH, H2SO4, CH3CH2OH, normal Walne nutrient, which has a composition per 1 Liter of solvent refers to Isnansetyo & Kurniastuty (1995): 100 mg / L NaNO3, 45 mg / L Na2EDTA; 33.6 mg / L H3BO3;
20 mg / L NaH2PO4.2H2O; 1.3 mg / L FeCl3.6H2O; 0.36 mg / L MnCl2.4H2O; 0.1 mg / L vitamin B1; 0.005 mg / L
vitamin B12, n-hexane solvent [8].
Methods of Biodiesel Microalgae B braunii
Pre-culture microalgae B brauniiFigure 1 shows the equipment design of microalgae cultivation. The first step was to gently shake the microalgae seeds contained in the bottle until homogeneous (there were no microalgae attached to the bottle walls). Then pouring 250 mL of microalgae seeds into Erlenmeyer slowly then mixing sea water with microalgae seeds to reach a concentration of 1 : 1. The purpose of the optimal temperature of microalgae growing media, where microalgae can grow optimally at a temperature of 23-30oC. This preculture microalgae was according to the method used by Widjaja et. al. (2009) [9].
FIGURE 1. Cultivation equipment design
Microalgae Mutation Process with UV-B Rays
Petridish containing microalgae B. braunii referring to Zul et.al. (2003), mutation was carried out with germicidal UV-B lamps with treatment in the darkened space, showed on Fig. 2. During radiation, the petrid lid was opened so that UV-B light transmission was not blocked [4]. Before being transferred using UV-B, microalgae were sampled to analyze the initial cell count. Furthermore, microalgae were exposed to UV-B light with the position of UV-B rays straight above the target cell with a distance of 3 cm for 3 minutes. To find out the number of cells that survived from the UV-B mutation process, the counting chamber was analyzed again.
FIGURE 2. Installing the UV-B Mutation Tool
Lipid Extraction
According to Widjaja et. al. (2009), the first step for lipid extraction was filtering microalgae. The extraction process was carried out for 6 hours until the color of the solvent becomes clear. The extracted n-hexane and lipids were separated by distillation. Distillation was carried out for approximately 2 hours using a distillation flask and Liebig condenser. The temperature of the distillation operation is maintained at 70oC [9].
Biodiesel Conversion with Esterification Method
This research was carried out in batch mode. The reactor was immersed in a thermostatic bath at 60oC. The ratio of lipid algae and methanol was 1 : 10 using a 1,8 wt% H2SO4 . Stirring intensity with magnetic stirrer was 200 rpm for 2 hours [10]. This process had two variables that were native and UV-B mutated algae. The reaction of native consisted of 0,2011 g lipid and methanol of 0,237 g or 0,29 ml with a density of methanol was 0,792 g/ml. In this reaction H2SO4 catalyst was needed as much as 0,002 ml or 0,0036 g with a density of 1,84 g/ml. While mutation variable using 0,2035 g and added methanol of 0,303 ml. In this reaction H2SO4 catalyst of 0,002 ml. The heating and stirring was stopped, and the reactor was removed from water bath. Then the reaction products were biodiesel and glycerol that transferred to a separator funnel and allowed to settle down for 2 hours. The difference in layers based on level of polarity of each compound. In this case biodiesel had non-polar characteristic while H2SO4 catalyst, methanol and H2O are polar that formed in 2 layers.
Biodiesel Conversion with Transesterification Method
This experiment was conducted in batch mode with a glass reactor. The glass reactor was immersed in a thermostatic bath at 60oC and agitated at 500 rpm using a magnetic stirrer for 2 hours. This process had 2 variables that were native and mutation UV-B. The ratio of lipid algae and methanol is 1: 7 using a 0,5 wt% NaOH [11]. This reaction of native consisted of 0,2044 g lipid and methanol of 0,0529 g or 0,068 ml with a density of methanol was 0,792 g/ml. In this reaction 0,5% NaOH catalyst was needed as much as 0,0013 g. While mutation variable using 0,1957 g and added methanol of 0,0515 g or 0,065 ml with a density of methanol was 0,792 g/ml. In this reaction 0,5% wt NaOH catalyst of 0,00124 g.
The heating and stirring was stopped, and the reactor was removed from water bath. Then the reaction products were biodiesel and glycerol that transferred to a separator funnel and allowed to settle down for 2 hours. The difference in layers based on level of polarity of each compound. In this case biodiesel had non-polar characteristic while NaOH Catalyst, methanol and H2O are polar that formed in 2 layers.