5 BAB II
TINJAUAN PUSTAKA
2.1 Limbah Cair Industri Tekstil
Industri tekstil termasuk salah satu industri yang sangat banyak mengeluarkan limbah cair, namun penanganan pengolahan limbah cair pada industri yang termasuk berskala kecil atau menengah kurang optimal. Limbah industri tekstil dihasilkan dari beberapa tahap proses, meliputi:
• Percucian
• Pencelupan dan system pewarnaan lainnya • Pengolahan akhir seperti pencucian kembali
Limbah cair dari industri tekstil umumnya mempunyai ciri-ciri sebagai berikut:
• Berwarna
• Bersifat sangat basa • BOD sangat tinggi
• Padatan tersuspensi tinggi • Suhu tinggi
Pada dasarnya tekstil terbagi menjadi tiga kelompok yaitu: katun, wol dan sintesis yang pengerjaan dan proses pewarnaannya berbeda-beda. Disamping itu dari masing-masing kelompok dapat diproses dengan berbagi cara dengan menggunakan bahan kimia yang berbeda-beda pula terutama pada proses pewarnaannya. Oleh karena itu limbahnya juga berlainan sehingga mempersulit
proses pengelolahannya. Potensi pencemaran air buangan industri tekstil sangat bervariasi tergantung pada proses dan kapasitas produksi serta kondisi lingkungan tempat pembuangan, sehingga akibat pencemarannya juga berbeda-beda.
Air buangan industri tekstil yang menggunakan bahan-bahan kimia banyak mengandung zat pencemar/racun yang dapat mengakibatkan gangguan terhadap lingkungan, kehidupan manusia, binatang maupun tumbuh-tumbuhan. Zat warna dapat mengakibatkan penyakit kulit dan yang sangat membahayakan adalah dapat mengakibatkan kanker kulit (Sugiharto, 1987). Dengan banyaknya zat pencemar yang ada di dalam air limbah, akan menyebabkan kadar oksigen yang terlarut dalam air menurun. Hal ini mengakibatkan ikan dan mikroba di dalam air akan mati, juga dapat menimbulkan kerusakan pada tanaman atau tumbuhan air, sehingga proses self purification yang seharusnya dapat terjadi pada air limbah menjadi terhambat (Sugiharto, 1987).
2.2 Zat warna
Molekul zat warna merupakan gabungan dari zat organik tak jenuh. Kromofor sebagai pembawa warna dan auksokrom sebagai pengikat antara warna dengan serat. Secara lebih luas, zat warna tersusun dari hidrokarbon tak jenuh, kromogen, auksokrom dan zat aditif (migration, levelling, wetting, agent dan sebagainya).
Zat warna dapat dikelompokkan berdasarkan beberapa hal. Berdasarkan sumber diperolehnya, zat warna dibedakan menjadi dua yaitu zat warna alam yang berasal dari tumbuhan dan hewan (lac dye) serta zat warna buatan.
Berdasarkan pemakaiannya, zat warna dibedakan menjadi dua yaitu zat warna yang dapat langsung mewarnai serat (zat warna substantif) dan zat warna yang memerlukan zat tambahan agar dapat mewarnai serat (zat warna reaktif).
Sedangkan Hennek (http://smk3ae.wordpress.com/2009/04/19/ mengenal-zat-warna-tekstil-zat-warna-reaktif-procion/) mengelompokkan zat warna berdasarkan warna yang ditimbulkannya, yaitu zat warna monogenetik apabila hanya memberikan satu warna dan zat warna poligenetik apabila dapat memberikan beberapa jenis warna.
Pengelompokkan zat warna menurut “Color Index” volume 3, yang terutama mengelompokkan atas dasar sistem kromofor yang berbeda. Misalnya zat warna Azo, Antrakuinon, Ftalosia, Nitroso, Indigo, Benzodifuran, Okazin, Polimetil, Di- dan Tri- Aril Karbonium, Poliksilik, Aromatik Karbonil, Quionftalen, Sulfer, Nitro, Nitrosol dan lain-lain.
Penggolongan lain yang biasa digunakan terutama pada proses pencelupan dan pencapan pada industri tekstil adalah penggolongan berdasarkan aplikasi (cara pewarnaan). Zat warna tersebut dapat digolongkan sebagai zat warna asam, basa, direct, dispersi, pigmen, reaktif, solven, belerang, bejana dan lain sebagainya.
2.3 Proses Penghilangan Warna
Warna dalam limbah cair industri tekstil sangat beragam tergantung pada pewarna yang digunakan. Secara sederhana, proses penghilangan warna merupakan proses hilangnya warna tanpa pemutusan bagian dari molekul kompleks zat warna yang sebenarnya. Reduksi sederhana senyawa zat warna akan menghasilkan senyawa tak berwarna. Hilangnya warna tidak berarti terjadi
degradasi molekul zat warna. Biasanya penghilangan warna terjadi ketika ikatan kromofor terputus, tetapi dengan fragmen utama molekul asli tetap utuh (Fuad, 2008).
Proses penghilangan warna dengan metode fisikokimia, meliputi filtrasi membran, adsorpsi, pertukaran ion, koagulasi, flokulasi, presipitasi dan floatasi. Sedangkan metode biologi meliputi biosorpsi bakteri dan jamur serta biodegradasi dengan proses aerob, anaerob, anoxik atau kombinasi antara proses anaerob/aerob. Filtrasi membran dapat memisahkan dua atau lebih komponen dari cairan berdasarkan ukuran molekuler. Metode ini merupakan metode yang cepat dengan sedikit persyaratan dan permeat (hasil resapan) dapat digunakan kembali. Kerugian dari filtrasi membran adalah penurunan fluks dan pengotoran membran, diperlukan pengolahan lebih lanjut untuk konsentrat yang dihasilkan serta biaya yang besar.
Adsorpsi dan pertukaran ion dapat digunakan untuk menghilangkan zat warna dengan menggunakan karbon teraktivasi. Secara umum, adsorpsi karbon tidak efisien dan ekonomis bila digunakan secara mandiri. Akan lebih baik bila adsoprsi karbon digunakan bersamaan dengan flokulasi polimer, reduksi kimia atau biodegradasi. Karbon teraktivasi dapat dibuat dari lignit dan batubara bituminous, kayu, residu pabrik pulp dan kulit kelapa. Banyak jenis material penyerapan yang dapat digunakan, seperti tandan buah palem, sekam dan lain-lain. Keuntungan dari metode ini adalah banyaknya alternatif material penyerapan yang dapat dipilih. Akan tetapi, pengolahan dengan metode ini menghasilkan lumpur yang harus diolah lebih lanjut.
Penghilangan warna dapat pula dilakukan dengan metode flokulasi dan koagulasi. Metode ini memerlukan penambahan koagulan yang akan bergabung dengan polutan, kemudian dihilangkan dalam bentuk flok. Contoh koagulan kimia adalah alum (Al2(SO4)3.8H2O), Fe2(SO4)3 dan FeCl3. Untuk flokulasi dapat digunakan polimer kationik atau non-ionik, (misal: poliakrilik, poliakrilamida). Kerugian dari metode ini adalah dihasilkannya lumpur beracun yang harus diolah dengan tepat (Nur Syahlinda, 2005).
Proses penghilangan warna dengan menggunakan metode biologi berdasarkan biotransformasi mikroba terhadap molekul zat warna. Biasanya zat warna mempunyai sifat tahan terhadap degradasi biologi (recalcitrance). Penggunaan bakteri dalam pengolahan limbah dengan metode biologi lebih murah dibandingkan pengolahan dengan metode kimia. Namun demikian, pengolahan limbah cair secara anaerob lebih banyak digunakan dibandingkan secara aerob.
2.4 Metode Elektrokoagulasi
Elektrokoagulasi merupakan metode pengolahan air secara elektrokimia dimana pada anoda terjadi pelepasan koagulan aktif berupa ion logam (biasanya aluminium atau besi) ke dalam larutan, sedangkan pada katoda terjadi reaksi elektrolisis berupa pelepasan gas hidrogen (Holt, et al., 2004). Sedangkan menurut Mollah (2004), elektrokoagulasi adalah proses kompleks yang melibatkan fenomena kimia dan fisika dengan menggunakan elektroda untuk menghasilkan ion yang digunakan untuk mengolah air limbah.
Saat ini penggunaan teknologi elektrokoagulasi dikembangkan untuk meningkatkan kualitas efluen air limbah. Elektrokoagulasi digunakan untuk
mengolah efluen dari beberapa air limbah yang berasal dari industri makanan, limbah tekstil, limbah rumah makan, limbah yang mengandung senyawa arsenik, air yang mengandung fluorida dan air yang mengandung partikel yang sangat halus, bentonit dan kaolinit.
Mollah (2001) dalam Aldilani (2008) telah memberikan gambaran tentang keuntungan dan kerugian dari penggunaan elektrokoagulasi. Beberapa keuntungan dari proses elektrokoagulasi adalah sebagai berikut:
a) Peralatan yang dibutuhkan sederhana dan mudah dioperasikan.
b) Air limbah yang diolah dengan elektrokoagulasi menghasilkan efluen yang jernih, tidak berwarna dan tidak berbau.
c) Lumpur yang dihasilkan elektrokoagulasi relatif stabil dan mudah dipisahkan karena sebagian besar berasal dari oksida logam. Selain itu, jumlah lumpur yang dihasilkan sedikit.
d) Flok yang terbentuk pada elektrokoagulasi memiliki kesamaan dengan flok yang berasal dari koagulasi kimia. Perbedaannya adalah flok dari elektrokoagulasi berukuran lebih besar dengan kandungan air yang sedikit, lebih stabil dan mudah dipisahkan secara cepat dengan filtrasi.
e) Elektrokoagulasi menghasilkan efluen dengan kandungan TDS (Total Dissolved Solid) lebih sedikit, sehingga mengurangi biaya recovery bila air hasil pengolahan digunakan kembali.
f) Elektrokoagulasi dapat mengolah partikel koloid yang sangat kecil karena penggunaan arus listrik menyebabkan proses koagulasi lebih mudah terjadi dan lebih cepat.
g) Proses elektrokoagulasi tidak memerlukan penambahan bahan kimia, sehingga tidak bermasalah dengan netralisasi kelebihan bahan kimia dan kemungkinan tidak membutuhkan pengolahan lebih lanjut bila terjadi penambahan senyawa kimia yang terlalu tinggi seperti pada penggunaan bahan kimia (koagulasi kimia).
h) Gelembung gas yang dihasilkan selama proses elektrolisis dan membawa polutan yang diolah untuk naik ke permukaan (floatasi) tersebut mudah terkonsentrasi, dikumpulkan dan dipisahkan.
i) Perawatan reaktor elektrokoagulasi lebih mudah karena proses elektrolisis yang terjadi cukup dikendalikan dari penggunaan listrik tanpa perlu memindahkan bagian di dalamnya.
Sedangkan kerugian dari penggunaan elektrokoagulasi adalah:
a) Elektroda yang digunakan dalam metode ini harus diganti secara teratur. b) Penggunaan listrik terkadang lebih mahal pada beberapa daerah.
c) Terbentuknya lapisan pada elektroda dapat mengurangi efisiensi pengolahan.
d) Proses elektrokoagulasi membutuhkan konduktivitas yang tinggi pada air limbah yang diolah.
e) Hidroksida seperti gelatin cenderung solubilize pada beberapa kasus.
Beberapa faktor yang mempengaruhi proses elektrokoagulasi antara lain: a. Kerapatan arus listrik
b. Waktu c. Tegangan
d. Kadar keasaman ( pH ) e. Ketebalan plat
f. Jarak antar elektroda (Purwaningsih, 2008).
2.4.1 Mekanisme Penghilangan Partikel Kontaminan dalam Elektrokoagulasi
Reaktor elektrokoagulasi merupakan suatu sel elektrokimia. Anoda yang berupa logam (biasanya aluminium, terkadang besi) melepas ion-ionnya yang akan berfungsi sebagai agen koagulan dan secara bersamaan terbentuk gelembung gas hidrogen pada katoda.
Elektrokoagulasi mampu mengolah berbagai polutan termasuk padatan tersuspensi, logam berat, tinta, bahan organik (seperti limbah domestik), minyak dan lemak, ion dan radionuklida. Karakteristik polutan mempengaruhi mekanisme pengolahan, misalnya polutan berbentuk ion akan diturunkan melalui proses presipitasi sedangkan padatan tersuspensi yang bermuatan akan diabsorbsi ke koagulan yang bermuatan.
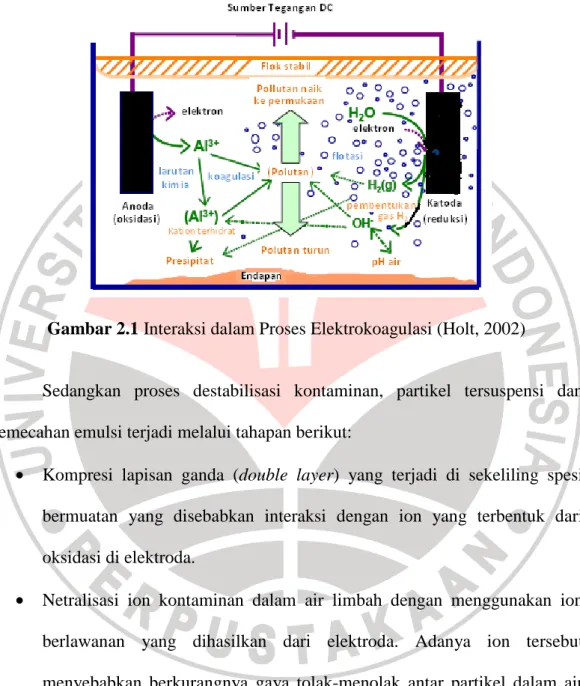
Gambar 2.1 menunjukkan proses elektrokoagulasi yang sangat kompleks. Koagulan dan produk hidrolisis saling berinteraksi dengan polutan atau dengan ion lain atau dengan gas hidrogen. Menurut Mollah (2004) dalam Aldilani (2008), mekanisme penyisihan yang umum terjadi dalam elektrokoagulasi terbagi dalam tiga faktor utama, yaitu (a) terbentuknya koagulan akibat proses oksidasi elektrolisis pada elektroda, (b) destabilisasi kontaminan, partikel tersuspensi dan
pemecahan emulsi dan (c) agregatisasi dari hasil destabilisasi untuk membentuk flok.
Gambar 2.1 Interaksi dalam Proses Elektrokoagulasi (Holt, 2002)
Sedangkan proses destabilisasi kontaminan, partikel tersuspensi dan pemecahan emulsi terjadi melalui tahapan berikut:
• Kompresi lapisan ganda (double layer) yang terjadi di sekeliling spesi bermuatan yang disebabkan interaksi dengan ion yang terbentuk dari oksidasi di elektroda.
• Netralisasi ion kontaminan dalam air limbah dengan menggunakan ion berlawanan yang dihasilkan dari elektroda. Adanya ion tersebut menyebabkan berkurangnya gaya tolak-menolak antar partikel dalam air limbah, sehingga gaya van der Waals menonjol dan proses koagulasi dapat berlangsung.
• Pembentukan flok akibat proses koagulasi sehingga terbentuk sludge blanket yang mampu menjebak dan menjembatani partikel koloid yang masih ada di air limbah.
2.4.2 Reaksi yang Terjadi pada Elektroda
Bila digunakan aluminium sebagai elektroda, beberapa kemungkinan reaksi yang dapat terjadi dalam sistem elektrokimia adalah sebagai berikut:
• Reaksi pada katoda
Bila larutan mengandung ion-ion logam alkali, ion-ion alkali tanah, ion Al3+ dan ion Mg2+, maka ion-ion logam tersebut tidak dapat direduksi dari larutan. Yang akan mengalami reduksi adalah pelarut (air) dan terbentuk gas hidrogen pada katoda.
2H2O (݈) + 2e− → 2OH−(ܽݍ) + H2(݃)
Dari daftar potensial elektroda diketahui bahwa reduksi terhadap air lebih mudah berlangsung daripada reduksi terhadap ion-ion tersebut.
Bila larutan bersifat asam, maka ion H+ dari asam akan direduksi menjadi gas hidrogen pada katoda.
2H+(ܽݍ) + 2e−→ H2(݃)
Bila larutan mengandung ion-ion logam lain, maka ion-ion logam ini akan direduksi menjadi masing-masing logamnya dan logam yang terbentuk itu diendapkan pada permukaan katoda.
Fe2+(ܽݍ) + 2e− → Fe(ݏ) Mn2+(ܽݍ) + 2e− → Mn(ݏ)
• Reaksi pada anoda
Elektroda pada anoda dioksidasi (bereaksi) berubah menjadi ion-ionnya.
Al(ݏ) → Alଷା(ܽݍ) + 3eି Zn(ݏ) → Znଶା(ܽݍ) + 2eି
Dalam sistem elektrokimia dengan elektroda terbuat dari aluminium, kemungkinan reaksi elektroda yang dapat terjadi adalah:
Anoda : Al(ݏ) → Alଷା(ܽݍ) + 3eି E0 = + 1,66 Katoda : 2H2O(݈) + 2e−→ H2(݃) + 2OH−(ܽݍ) E0 = - 0,8277
2H+ (ܽݍ) + 2e− → Hଶ(݃) E 0
= 0,00 O2(݃) + 4H+(ܽݍ) + 4e− → 2H2O(݈) E0 = + 0,682 Berdasarkan harga E0, disusun suatu deret unsur-unsur yang disebut deret potensial logam (deret Volta) mulai dari unsur yang memiliki E0 terkecil hingga unsur yang memiliki E0 terbesar.
Secara umum, bila potensial suatu elektroda bergerak melewati titik keseimbangannya (arus nol) ke potensial yang lebih negatif, zat yang akan direduksi pertama adalah oksidator dengan E0 paling positif. Sedangkan bila potensial elektroda bergerak dari arus nol ke potensial yang lebih positif, zat yang akan dioksidasi pertama adalah reduktor dengan E0 paling negatif.
2.4.3 Penggunaan Aluminium Sebagai Elektroda Sacrificial
Aluminium merupakan logam yang sering digunakan sebagai elektroda dalam proses elektrokoagulasi. Kation aluminium yang terlepas (tergantung pada kondisi polutan, pH dan konsentrasi larutan) secara langsung akan berinteraksi dengan polutan dan akan terjadi hidrolisis membentuk kompleks hidro-aluminium
atau juga terjadi presipitasi. Proses pembentukan kation ini sangat penting untuk memahami mekanisme elektrokoagulasi.
Reaksi yang terjadi pada aluminium ketika terlepas ke dalam larutan adalah sebagai berikut:
Al3+ (ܽݍ) + H2O (݈) → AlOH2+(ܽݍ) + H+(ܽݍ) (2-1)
AlOH2+(ܽݍ) + H2O(݈) → Al(OH)2+ (ܽݍ) + H+(ܽݍ) (2-2)
Al(OH)2+(ܽݍ)+ H2O(݈) → Al(OH)30 (ݏ) + H +
(ܽݍ) (2-3)
Al(OH)30 (ݏ) + H2O(݈) → Al(OH)4− (ܽݍ) + H+(ܽݍ) (2-4)
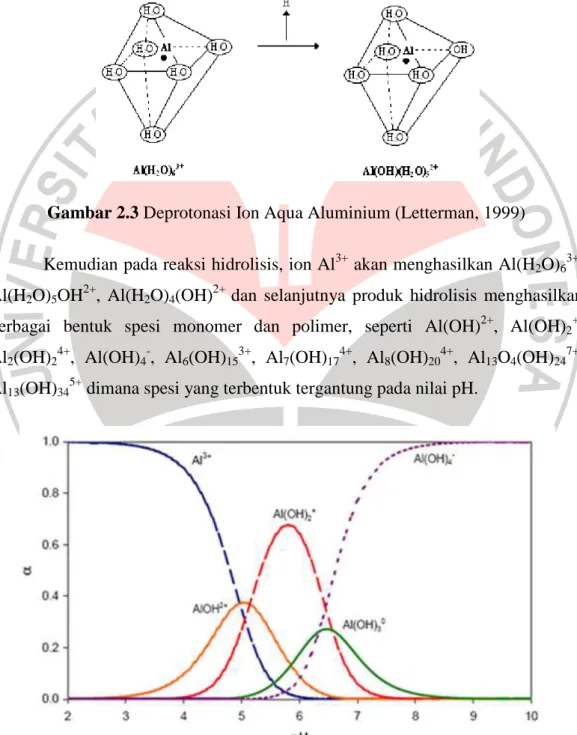
Reaksi tersebut menggambarkan reaksi yang sederhana dari ion aluminium dalam air karena setelah itu terjadi reaksi spontan yang menghasilkan dimeric, trimeric dan polinuklir (Gambar 2.2).
Pada awalnya, ion logam aluminium di dalam air akan mengikat enam atom oksigen dari air di sekelilingnya. Namun, ikatan atom oksigen dan hidrogen pada air yang relatif lemah menyebabkan ion H+ terlepas atau mengalami deprotonasi (Gambar 2.3).
Gambar 2.3 Deprotonasi Ion Aqua Aluminium (Letterman, 1999)
Kemudian pada reaksi hidrolisis, ion Al3+ akan menghasilkan Al(H2O)63+, Al(H2O)5OH2+, Al(H2O)4(OH)2+ dan selanjutnya produk hidrolisis menghasilkan berbagai bentuk spesi monomer dan polimer, seperti Al(OH)2+, Al(OH)2+, Al2(OH)24+, Al(OH)4-, Al6(OH)153+, Al7(OH)174+, Al8(OH)204+, Al13O4(OH)247+, Al13(OH)345+ dimana spesi yang terbentuk tergantung pada nilai pH.
Dengan hanya memperhatikan pembentukan mononuklir, jumlah aluminium dalam larutan (α) dengan nilai pH pada larutan dapat digambarkan dengan grafik pada Gambar 2.4. Pada diagram tersebut, distribusi yang ada menggambarkan proses hidrolisis yang tergantung pada konsentrasi total dari logam dan pH larutan.
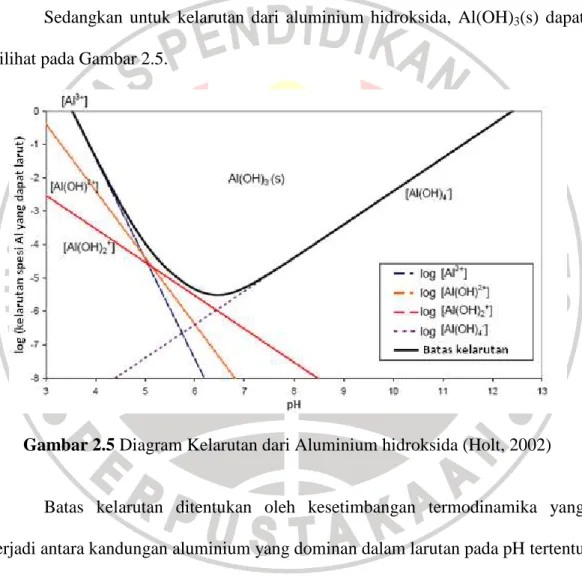
Sedangkan untuk kelarutan dari aluminium hidroksida, Al(OH)3(s) dapat dilihat pada Gambar 2.5.
Gambar 2.5 Diagram Kelarutan dari Aluminium hidroksida (Holt, 2002)
Batas kelarutan ditentukan oleh kesetimbangan termodinamika yang terjadi antara kandungan aluminium yang dominan dalam larutan pada pH tertentu dengan padatan aluminium hidroksida. Kelarutan minimum (0,03 mg Al/L) terjadi pada nilai pH 6,3 dan nilai kelarutan bertambah ketika larutan menjadi semakin asam atau basa.
Kation logam aktif yang dihasilkan pada anoda akan bereaksi dengan ion hidroksida yang dihasilkan di katoda untuk membentuk logam hidroksida yang akan berfungsi sebagai agen koagulan. Ketika berinteraksi dengan partikel polutan, logam hidroksida akan membentuk agregat yang memungkinkan untuk mengalami pengendapan atau juga dapat terbawa oleh gelembung gas hidrogen (yang dihasilkan di katoda) ke permukaan.
Gambar 2.6 Proses Sweep Coagulation (Duan, 2003)
Pada penambahan koagulan, setiap presipitasi logam dari aluminium hidroksida menyebabkan penghilangan polutan melalui mekanisme sweep coagulation (Gambar 2.6).
2.4.5 Reaktor Elektrokoagulasi
Dalam bentuk yang sederhana, reaktor elektrokoagulasi merupakan reaktor elektrokimia dengan sebuah anoda dan sebuah katoda. Ketika dihubungkan
dengan sumber listrik, material anoda mengalami korosi akibat oksidasi sedangkan katoda menjadi subyek yang pasif seperti yang disajikan pada gambar di bawah ini.