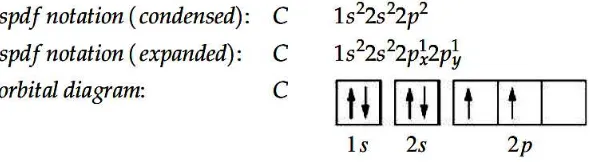1
PROGRAM STUDI PENDIDIKAN SAINS
KELAS P2TK 1
PROGRAM PASCASARJANA
UNIVERSITAS NEGERI SURABAYA
2015
Mata Kuliah Kajian Sains Kimia
2
KATA PENGANTAR
Segala puji bagi Dzat yang mengetahui posisi dan momentum elektron
secara tepat dan serentak, yang tidak terpengaruh oleh prinsip ketidakpastian
Heisenberg.
Bookreport ini ditulis untuk memenuhi sebagian tugas mata kuliah Kajian
Sains Kimia. Bookreport ini membahas struktur materi, oleh penulis difokuskan
pada sifat-sifat elektron dalam atom serta ikatan kimia, hal ini karena materi itu
berupa atom dan molekul (atom-atom yang berikatan).
Bookreport ini mengambil tiga bab dari buku:
General Chemistry Principles and Modern Applications Tenth Editionkarya Petrucci dan kawan-kawan yang
diterbitkan oleh Pearson Canada Inc., Toronto, Ontario pada tahun 2011, yaitu:
1.
Bab 8. Elektron dalam atom halaman 294
yang “direport” oleh Wahab
Abdullah
2.
Bab 10. Ikatan kimia I (konsep dasar) halaman 395
yang “direport” oleh
Satwika Trianti Ngandoh
3.
Bab 11. Ikatan kimia II (aspek-aspek tambahan) halaman 449 yang
“direport” oleh Ernawati.
3
BAB I
PENDAHULUAN
A.
Latar Belakang
Materi adalah setiap objek atau bahan yang membutuhkan ruang, yang
jumlahnya diukur oleh suatu sifat yang disebut massa. Secara umum materi dapat
juga didefinisikan sebagai sesuatu yang memiliki massa dan menempati volume.
Materi tersusun atas molekul-molekul, dan molekul pun tersusun atas
atom-atom. Materi umumnya dapat dijumpai dalam empat fase berbeda,
yaitu padat, cairan, gas, dan plasma. Namun, terdapat pula fase materi yang lain,
seperti kondensat Bose-Einstein.
Benda sehari-hari terdiri dari atom-atom. Materi atom ini terbentuk karena
adanya interaksi dari partikel subatom
—
sebuah inti atom dari beberapa proton dan
neutron, serta awan dari garis edar elektron-elektron. Secara khusus, sains
menganggap gabungan dari partikel-partikel ini merupakan materi karena mereka
memiliki massa diam dan volume. Sebaliknya, partikel tak bermassa, seperti foton,
tidak dianggap sebagai materi karena mereka tidak mempunyai massa diam atau
pun volume.
Book report ini membahas tentang struktur materi, oleh karenanya akan
dibahas keadaan elektron sebagai salah satu penyusun materi, misalnya bilangan
kuantum dan orbital elektron, orbital atom hidrogen, atom multi elektron,
konfigurasi elektron serta ikatan kimia (karena ikatan kimia melibatkan elektron).
Untuk mendukung pembahasan hal-hal tersebut, maka didahului pembahasan
teori-teori pendukungnya antara lain: teori-teori kuantum, atom Bohr, dualitas gelombang
partikel, prinsip ketidak pastian dan mekanika gelombang.
B.
Rumusan Masalah
Rumusan masalah yang akan dibahas pada book report ini adalah:
1.
Bagaimana menjelaskan radiasi benda hitam dan efek fotolistrik sebagai
dasar teori kuantum?
4
3.
Apakah yang dimaksud dengan dualitas gelombang-partikel dan prinsip
ketidakpastian sebagai dasar mekanika gelombang?
4.
Apakah yang dimaksud dengan mekanika gelombang sebagai dasar
untuk menjelaskan orbital elektron?
5.
Bagaimana bilangan kuantum menunjukkan sifat orbital dari suatu
elektron pada suatu atom?
6.
Bagaimana menafsirkan dan menggambarkan orbital atom hidrogen?
7.
Bagaimana aturan penulisan konfigurasi elektron?
8.
Bagaimana hubungan konfigurasi elektron dan tabel berkala?
9.
Bagaimana penjelasan dan penggambaran dari ikatan kimia?
C.
Batasan Masalah
Batasan masalah book report ini adalah struktur materi yang ditinjau dari sifat
elekton sebagai salah satu partikel penyusun materi.
D.
Tujuan
Setelah membaca book report ini, diharapkan pembaca dapat mengetahui:
1.
Radiasi benda hitam dan efek fotolistrik sebagai dasar teori kuantum.
2.
Atom hidrogen menurut teori atom Bohr.
3.
Dualitas gelombang-partikel dan prinsip ketidakpastian sebagai dasar
mekanika gelombang.
4.
Mekanika gelombang sebagai dasar untuk menjelaskan orbital elektron.
5.
Bilangan kuantum menunjukkan sifat orbital dari suatu elektron pada
suatu atom.
6.
Tafsiran dan gambaran orbital atom hidrogen.
7.
Aturan penulisan konfigurasi elektron.
8.
Hubungan konfigurasi elektron dan tabel berkala.
9.
Penjelasan dan penggambaran dari ikatan kimia.
E.
Manfaat
5
BAB II
PEMBAHASAN
A.
ELEKTRON DALAM ATOM
1.
TEORI KUANTUM
Fisika klasik tidak dapat menjelaskan dengan lengkap mengenai emisi cahaya
oleh padatan yang dipanaskan, yang dikenal dengan radiasi benda-hitam. Teori
klasik memprediksi bahwa intensitas radiasi yang dipancarkan akan naik secara
taktentu, sebagaimana pada gambar 01. Pada tahun 1900, untuk menjelaskan
fakta bahwa intensitas tidak naik secara tak tentu, Max Planck (1858-1947)
membuat usulan yang revolusioner:
energi, seperti materi adalah diskontinu.
Fisika klasik tidak memberikan batasan banyaknya energi yang dimiliki sistem,
sementara fisika kuantum membatasi energi dengan seperangkat nilai khas yang
diskret.
Selisihantara dua energi sistem yang dizinkan juga memiliki nilai
spesifik, yang dinamakan kuantum energi. Artinya energi meningkat dengan
lonjakan kecil, atau kuantum.
Gambar 01. Spektrum radiasi yang dihasilkan oleh benda yang dipanaskan.
Model Planck yang digunakan untuk emisi radiasi elektromagnetik.
6
harus memiliki energi yang terkait dengan persamaan
e = nhv,dengan
nadalah
bilangan bulat positif,
vadalah frekuensi osilator dan
hadalah konstanta Planck
yang diperoleh melalui eksperimen yang nilainya
h= 6,62607 x 10
-34Js. Planck
mempostulatkan: energi dari suatu kuantum radiasi elektromagnetik sebanding
dengan frekuensi radiasi. Pernyataan ini diringkas dalam persamaan Planck.
E = hv
(1)
Hanya setelah berhasil diaplikasikan pada gejala selain radiasi benda hitam,
hipotesis kuantum dapat memperoleh status sebagai teori ilmiah yang baru.
Keberhasilan pertama datang pada tahun 1905 dengan penjelasan kuantum oleh
Albert Einstein mengenai
efek fotolistrik.
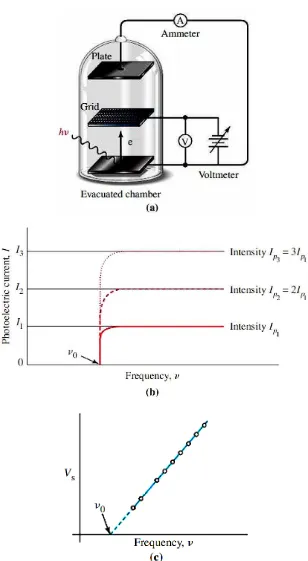
Pada tahun 1888, Heinrich Hertz menemukan bahwa ketika cahaya
mengenai permukaan logam tertentu, elektron ditolak. Gejala ini dinamakan
efek fotolistrik, ciri-ciri yang mencolok adalah:
Emisi elektron hanya terjadi bila frekuensi cahaya datang melebihi nilai
ambang tertentu (
vo). Jika syarat ini terpenuhi, maka
Banyaknya elektron yang dipancarkan bergantung pada intensitas cahaya
masuk, tetapi
Energi kinetik elektron yang dipancarkan bergantung pada frekuensi
cahaya.
7
Gambar 02. (a) Skema alat untuk pengukuran efek fotolistrik. (b) Arus
fotolistrik muncul bila frekensi lebih besar dari
vo(c) Voltase penghenti (
Vs)
8
Model Atom Rutherford tidak mengindikasikan bagaimana elektron tersusun di
luar inti atom. Menurut fisika klasik, elektron yang diam akan ditarik ke inti. Ini
berarti elektron harus bergerak mengorbit inti. Elektron yang mengorbit ini harus
mempercepat dan harus memancarkan energi. Dengan melepaskan energi,
elektron malah tertarik lebih dekat ke inti dan akan jatuh secara spiral ke
dalamnya. Pada tahun 1913, Niels Bohr (1885-1962) memecahkan persoalan ini
dengan menggunakan hipotesis kuantum Planck. Dengan menggabungkan teori
klasik dan teori kuantum, Bohr mempostulatkan untuk atom hidrogen:
1.
Elektron bergerak dalam orbit yang melingkari inti dengan gerak yang
dideskripsikan oleh fisika klasik.
2.
Elektron hanya memiliki satu set orbit tetap yang terizinkan, yang
dinamakan
keadaan stasioner. Asalkan elektron tetap dalam orbitnya,
energinya konstan dan tidak ada energi yang dipancarkan. Sifat elektron
ini dinamakan
momentum sudut angular. Nilai yang dimungkinkan
nh/2π
dengan
nbilangan bulat. Jadi
n=1 untuk orbit pertama,
n=2 untuk
orbit ke dua dan seterusnya.
3.
Elektron hanya dapat berpindah dari satu orbit terizinkan ke orbit
terizinkan lainnya. Dalam transisi ini, terlibat kuantitas energi diskrit
yang tetap (kuanta)-baik yang diserap atau dilepaskan.
Teori Bohr memprediksi jari-jari orbit yang terizinkan dalam atom hidrogen.
9
Gambar 03. Model atom Bohr untuk atom hidrogen. Cahaya dipancarkan
bila elektron jatuh ke orbit yang nomornya lebih rendah.
Teori Bohr ini juga memungkinkan untuk menghitung kecepatan elektron
dalam orbit ini dan yang terpenting adalah energinya.
(3)
RHadalah konstanta yang nilainya 2,179 x 10
-18J.
Normalnya, elektron ditemukan pada
keadaan dasar(
n= 1). Ketika
elektron menerima kuantum energi maka elektron bergerak ke tingkat yang lebih
tinggi (
n= 2, 3, dan seterusnya) yang disebut
keadaan tereksitasi. Ketika
elektron jatuh ke tingkat yang lebih rendah ia melepaskan energi khas.
Δ
E = Ef–
Ei = hv(4)
Persamaan (4) berhubungan dengan frekuensi foton
vyang dipancarkan
atom pada percobaan spektroskopi.
Gagasan Bohr ini dapat diaplikasikan untuk ionisasi atom seperti-hidrogen
He
+dan Li
+, yang hanya mempunyai satu elektron.
(5)
10
tidak dapat menjelaskan efek medan magnet pada spektrum emisi. Mekanika
kuantum modern menggantikan teori atom Bohr.
3.
DUA GAGASAN YANG MENGARAH KE MEKANIKA KUANTUM
BARU (MEKANIKA GELOMBANG)
3.1 Dualitas Gelombang Partikel
Pada tahun 1924, Louis de Broglie yang mempertimbangkan sifat cahaya
(dualisme sifat cahaya yang bersifat seperti partikel pada efek fotolistrik dan
bersifat sebagai gelombang pada dispersi cahaya oleh prisma) dan materi,
menawarkan usulan:
partikel materi yang kecil kadang-kadang menunjukkan sifat seperti gelombang.Ia sampai ke usulan tersebut dari olah persamaan
E = mc2, E = hv, p = mc, c =λv
sehingga diperoleh
p =h/λ
dan dengan
mensubstitusikan momentum partikel
p = mu, maka akan diperoleh persamaan
de Broglie
(6)
De Broglie menamakan gelombang yang terkait dengan partikel material ini
sebagai “gelombang materi”. Jika ada materi untuk partikel kecil, maka berkas
partikel seperti elektron akan memperlihatkan sifat khas gelombang, yaitu
difraksi. Jika jarak antara objek-objek yang menghamburkan gelombang
kira-kira sama dengan panjang gelombang radiasi maka interferensi teramati.
11
3.2 Prinsip Ketidakpastian
Selama tahun 1920-an, Bohr dan Werner Heisenberg mempertimbangkan
percobaan hipotetis untuk mengetahui seberapa tepat perilaku partikel subatom
dapat ditentukan. Dua variabel yang harus diukur adalah posisi partikel (
x) dan
momentumnya (
p = mu). Kesimpulan yang mereka tarik adalah bahwa akan
selalu ada ketidakpastian dalam pengukuran sehingga hasil kali ketidakpastian
dalam posisi, Δ
x, dan ketidakpastian dalam momentum, Δ
p, adalah
(7)
Signifikansi persamaan ini, yang disebut prinsip ketidakpastian Heisenberg,
adalah bahwa posisi dan momentum tidak dapat diukur dengan ketepatan tinggi
secara serempak. Dengan kata sederhana, jika lokasi partikel diketahui dengan
tepat, maka dari mana partikel ini datang atau kemana perginya tidak dapat
diketahui dengan tepat. Jika bagaimana partikel ini datang diketahui dengan
tepat, maka letak partikel tidak dapat diketahui dengan tepat.
Gambar 05. Prinsip ketidakpastian ditafsirkan secara grafis
12
4.
MEKANIKA GELOMBANG
Fungsi Gelombang Dari Elektron Atom Hidrogen
Pada tahun 1927, Schrodinger menunjukkan bahwa fungsi gelombang suatu
sistem mekanika kuantum dapat diperoleh dengan menyelesaikan persamaan
gelombang yang dikenal sebagai persamaan Schrodinger.
Solusi persamaan Schrodinger untuk atom Hidrogen memberikan fungsi
gelombang untuk elektron atom hidrogen. Fungsi gelombang ini dinamakan
orbital.
Persamaan Scrhodinger untuk elektron dalam tiga dimensi yang harus
dipakai untuk persoalan atom hidrogen atau ion seperti hidrogen, dengan
potensial listrik
Vadalah
–
Ze2/ryang menyebabkan gaya tarik antara elektron
dan muatan pada inti,
Ze, dengan
Zadalah nomor atom dari ion yang memiliki
satu elektron, adalah
(8)
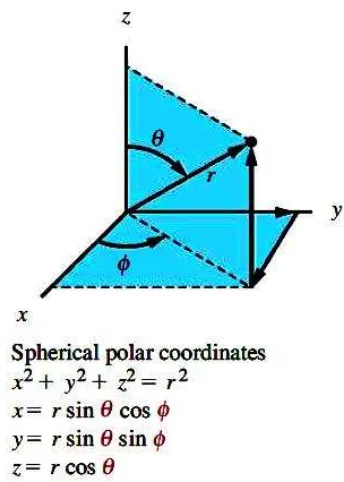
Persamaan (3) jika ditulis dalam koordinat bola berkutub
(9)
ketika massa elektron digantikan massa atom tereduksi yang lebih benar,
µ, yang
diberikan sebagai
Persamaan ini adalah persamaan Schrodinger dalam koordinat bola berkutub
untuk ion seperti-hidrogen bernomor atom
Zatau atom hidrogen jika
Z= 1.
Pada sistem bola berkutub, orbital dapat dapat dinyatakan dalam satu fungsi
13
Fungsi
Rdinamakan fungsi gelombang radial, dan fungsi
Ydinamakan fungsi
gelombang angular. Penyelesaian persamaan Schrodinger ini menghasilkan
satu set bilangan kuantum.
Gambar 06. Hubungan koordinat kartesius dan koordinat bola berkutub.
5.
BILANGAN KUANTUM DAN ORBITAL ELEKTRON
Bilangan pertama yang ditetapkan adalah bilangan kuantum utama,
n, yang
nilainya
n
= 1, 2, 3, ...
(9)
Yang kedua adalah bilangan kuantum sudut orbital,
l, yang nilainya
l
= 0, 1, 2, 3, ..., (
n-1)
(10)
Yang ketiga adalah bilangan kuantum magnetik,
ml, yang nilainya
ml
=
-l, (
-l+1), ..., -2, -1, 0, 1, 2, ... (
l-1), +
l(11)
Semua orbital dengan nilai
nyang sama berada dalam kulit elektronik
utama atau tingkat utama yang sama, dan semua orbital dengan nilai
ndan
lyang sama berada dalam subkulit atau subtingkat yang sama. Semakin besar
nmaka semakin jauh elektron dari inti. Bilangan kuantum
lmenentukan distribusi
14
Empat subkulit pertama adalah: subkulit
suntuk
l= 0, subkulit
puntuk
l=1,
subkulit
duntuk
l= 2 dan subkulit
funtuk
l= 3.
Banyaknya orbital dalam subkulit sama dengan banyaknya nilai
mlyang
terizinkan. Nama orbital sama dengan nama subkulit yang ditempatinya.
Misalnya ada satu orbital
sdalam subkulit
s(karena
l= 0 maka
ml= 0) dan ada
tiga orbital
ppada subkulit
p(karena
l= 1 maka
ml= 0, + 1).
6.
MENAFSIRKAN DAN MENGGAMBARKAN ORBITAL ATOM
HIDROGEN
15
6.1 Orbital
sUntuk memperoleh orbital 1
satom hidrogen digunakan
Z= 1 dan
n= 1.
Gambaran tiga dimensi orbital
sadalah berupa bola.
6.2 Orbital
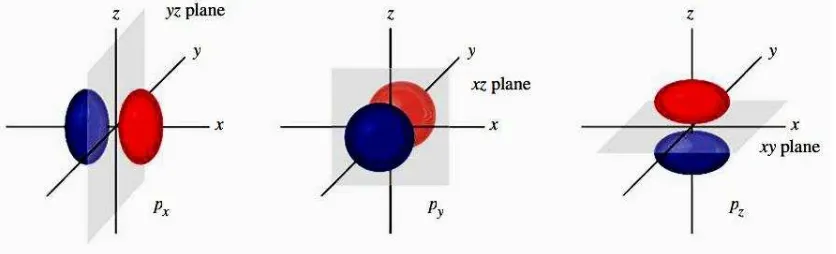
pOrbital 2
ptidak memiliki simpul radial. Berlawanan dengan orbital
syang bukan
nol pada
r= 0, orbital
philang pada
r= 0. Perbedaan ini mempunyai konsekuensi
penting pada atom multielektron. Probabilitas terbesar menemukan elektron
adalah di dalam dua cuping daerah berbentuk barbel (gambar 08). Perhatikan
bahwa daerah ini tidak berbentuk bola simetris. Perbedaan warna menyatakan
perubahan fase. Orbital
pbiasanya digambarkan mengarah ke sumbu-sumbu
x,
16
Gambar 08. Tiga orbital 2p.
6.2 Orbital
dPermukaan probabilitas kelima orbital
dditunjukkan pada gambar 09. Fase
relatif cuping fungsi gelombang awal dinyatakan dengan warna berbeda. Orbital
d
penting untuk memahami kimiawi unsur transisi.
Gambar 09. Penggambaran lima orbital d.
7.
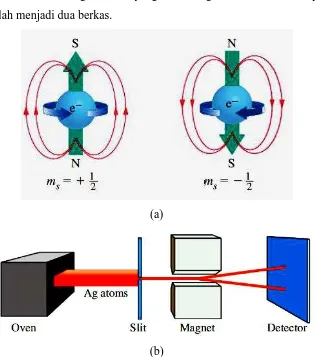
SPIN ELEKTRON: BILANGAN KUANTUM KEEMPAT
Pada tahun 1925, George Uhlenbeck dan Samuel Goudsmit mengajukan bahwa
beberapa fitur yang tidak dapat dijelaskan pada spektrum hidrogen dapat
dimengerti dengan mengasumsikan elektron berputar (spinning), seperti bumi
berputar pada sumbunya. Ada dua kemungkinan spin elektron. Kedua
kemungkinan ini memerlukan bilangan kuantum keempat, yaitu bilangan
kuantum spin elektron,
ms. Bilangan kuantum ini dapat mempunyai nilai + ½
(juga dilambangkan dengan ↑) atau –
½ (juga dilambangkan dengan ↓), nilai ini
tidak bergantung nilai bilangan kuantum lainnya (gambar 10a).
17
dilewatkan melalui medan magnet yang tidak seragam, dengan berkas terbelah
dua (gambar 10b). Berikut penjelasan yang disederhanakan.
1.
Suatu elektron, karena spinnya, menghasilkan medan magnet.
2.
Sepasang elektron dengan spin berlawanan tidak mempunyai medan magnet
netto.
3.
Pada atom perak 23 elektron mempunyai satu jenis spin dan 24 elektron
mempunyai jenis spin yang berlawanan. Arah medan magnet netto yang
dihasilkan hanya bergantung pada spin dari elektron yang tidak berpasangan.
4.
Elektron yang tidak berpasangan akan mempunyai peluang yang sama
memiliki spin +1/2 atau spin -1/2. Medan magnet yang diinduksi oleh atom
perak berinteraksi dengan medan yang tidak seragam, dan berkas atom perak
terbelah menjadi dua berkas.
(a)
(b)
18
8.
ATOM MULTI ELEKTRON
Schrodinger mengembangkan persamaan gelombangnya untuk atom hidrogen,
yaitu atom yang hanya memiliki satu elektron. Untuk atom multielektron, timbul
faktor baru: saling tolak di antara elektron-elektron yang menyebabkan saling
berjauhan. Pendekatan hampiran diambil sehingga orbital elektron yang akan
diperoleh akan memiliki jenis yang sama untuk hasil atom hidrogen, dan disebut
orbital
seperti-hidrogen. Dibandingkan atom hidrogen, bagian-bagian sudut dari
orbital suatu atom multielektron tidak berubah, namun bagian radialnya berubah.
Elektron pada orbital yang lebih dekat ke inti
menghalangi (shield)inti dari
elektron yang lebih jauh. Akibatnya elektron yang menghalangi tersebut
mengurangi efektifitas inti dalam menarik elektron yang lebih jauh. Elektron
pada orbital s lebih efektif melindungi inti dari elektron yang lebih luar
dibandingkan elektron pada orbital p dan d. Kemampuan elektron orbital s yang
memungkinkannya lebih dekat ke inti disebut
penembusan(
penetration).
Elektron pada orbital dengan penembusan yang baik akan lebih baik dalam
melindungi daripada elektron dengan penembusan rendah.
Dalam beberapa hal, efek kombinasi dari jarak yang memendek antara
tingkat-tingkat energi yang berurutan pada bilangan kuantum yang lebih tinggi
(akibat energi berbanding terbalik dengan kuadrat
n) dan pembelahan tingkat
energi subkulit (akibat perlindungan dan penembusan) mengakibatkan beberapa
tingkat energi yang tumpang tindih. Contohnya, berhubung penembusan ekstra
dari elektron 4
syang lebih tinggi dibandingkan elektron 3
d, maka tingkat energi
4
sdi bawah tingkat 3
dmeskipun bilangan kuantum utamanya
nlebih tinggi.
9.
KONFIGURASI ELEKTRON
Konfigurasi elektron suatu atom adalah penandaan bagaimana elektron
terdistribusikan di berbagai orbital pada kulit utama dan subkulit. Berikut adalah
aturan untuk menetapkan elektron pada orbital.
19
(12)
Gambar 11. Urutan pengisian elektron pada subkulit.
b)
Tidak ada dua elektron dalam suatu atom mempunyai semua empat
bilangan kuantum yang sama-prinsip eksklusi Pauli. Dengan kata lain
hanya dua elektron yang dapat menempati orbital yang sama, dan kedua
elektron ini pasti mempunyai spin yang berlawanan. Akibatnya subkulit
sterdiri dari satu orbital dengan kapasitas dua elektron, subkulit
pterdiri atas
tiga orbital dengan kapasitas total sebanyak enam elektron, dan seterusnya.
c)
Bila ada orbital yang energinya identik (orbital berdegenerasi), elektron
mula-mula menempati orbital ini satu-demi-satu. Sejalan dengan aturan
ini (dikenal dengan aturan Hund), suatu atom cenderung mempunyai
sebanyak-banyaknya elektron takberpasangan.
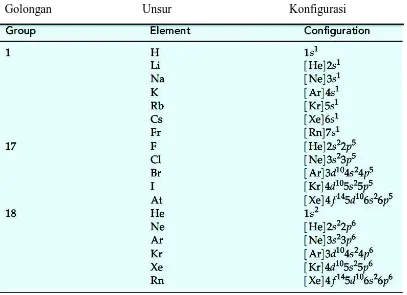
Konfigurasi elektron pada atom karbon dapat ditunjukkan dengan tiga cara
yang berbeda:
20
Konfigurasi yang paling stabil atau konfigurasi yang paling menguntungkan
secara energetik untuk atom yang terisolasi, yang dibahas di sini, dinamakan
konfigurasi elektron keadaan dasar
. Atom dengan konfigurasi yang bukan
paling stabil dikatakan atomnya berada dalam
keadaan tereksitasi.
Proses Aufbau. Untuk menuliskan konfigurasi elektron digunakan proses
aufbau (bahasa Jerman) yang berarti “membangun” adalah dengan
menetapkan konfigurasi elektron pada unsur tersebut sesuai urutan
meningkatnya nomor atom. Untuk maju dari satu atom ke atom berikutnya,
ditambahkan satu proton dan beberapa neutron ke dalam inti dan kemudian
mendeskripsikan orbital yang akan ditambahi elektron. Berikut beberapa
contoh.
Z = 1, H. Keadaan energi terendah untuk elektron adalah orbital 1
s.
Konfigurasi elektronnya adalah 1
s1.
Z = 2, He. Elektron kedua masuk orbital 1s dan kedua elektron
mempunyai spin yang berlawanan, 1
s2.
Z = 3, Li. Konfigurasi elektronnya 1
s22
s1.
Na: [Ne]3
s1dengan [Ne] disebut sebagai teras (core) neon dan 3
s1sebagai konfigurasi elektron valensi. Elektron yang ditambahkan ke
kulit elektronik yang mempunyai bilangan kuantum utama tertinggi
(kulit terluar atau kulit valensi) disebut elektron valensi.
Ar: [Ne]3
s23
p621
Konfigurasi yang ditulis untuk Na dan K ini adalah
konfigurasielektron ringkas berteraskan gas mulia
(
noble gas core abbreviated electron configuration). Berikut contoh lainnya:
10.
KONFIGURASI ELEKTRON DAN TABEL BERKALA
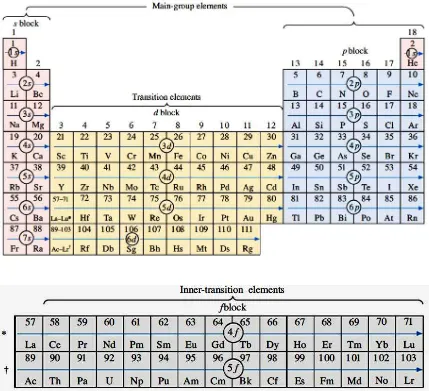
Menurut Bohr (1920) kaitan utama antara tabel berkala dengan teori kuantum
adalah konfigurasi elektron.
Unsur-unsur dalam golongan yang sama pada tabel akan memiliki konfigurasi lektron yang serupa.
Pada tabel 02, jika bilangan kuantum utama tertinggi, yaitu kulit terluar
(kulit valensi) diberi label
n, maka:
Atom golongan 1 (logam alkali) memiliki satu elektron pada kulit terluar
yaitu
ns1.
Atom golongan 17 (halogen) mempunyai tujuh elektron pada kulit
terluar dalam konfigurasi
ns2np5.
22
Tabel 02. Konfigurasi elektron beberapa golongan unsur
Golongan
Unsur
Konfigurasi
Gambar 13 mengaitkan proses aufbau dengan tabel berkala dengan membagi
tabel ke dalam empat blok unsur berdasarkan subkulit yang terisi.
Blok
s. Orbital
spada bilangan kuantum utama tertinggi (
n) terisi, terdiri
atas golongan 1 dan 2 (plus He dalam golongan 18).
Blok
p. Orbital
ppada bilangan kuantum utama tertinggi (
n) terisi, terdiri
atas golongan 13, 14, 15, 16, 17 dan 18 (kecuali He).
Blok
d. Orbital
dpada kulit elektronik
n-1 (sebelum yang terluar) terisi,
terdiri atas golongan 3 hingga 12.
Blok
f. Orbital
fpada kulit elektronik
n-2 terisi, unsur blok
fadalah
lantanida dan aktinida.
blok-23
blok, dapat menyederhanakan tugas penentuan konfigurasi elektron.
Contohnya, strontium ada dalam golongan 2, golongan blok s kedua,
sehingga konfigurasi kulit valensi adalah 5s
2sebab strontium berada
pada periode kelima. Elektron sisanya berda dalam teras kripton (gas
mulia pada periode sebelumnya, jadi konfigurasi elektron Sr adalah
Sr: [Kr]5s
224
B.
IKATAN KIMIA (Konsep Dasar)
1.
Teori Lewis
Pada periode 1916-1919, dua orang Amerika, G.N Lewis dan Irving
Langmuir, dan satu orang Jerman, Walther Kossel, mengajukan usulan penting
mengenai ikatan kimia. Teori yang muncul ini dinamakan Teori Lewis, berikut ini
beberapa gagasan dasar yang berkaitan dengan teori Lewis:
1.
Elektron, terutama yang terdapat di kulit elektron terluar (valensi), memainkan
peran fundamental dalam pembentukan ikatan kimia.
2.
Dalam beberapa kasus, elektron ditransfer dari satu atom ke atom lain. Ion
positif dan ion negatif terbentuk dan saling tarik melalui gaya elektrostatik yang
dinamakan ikatan ionik (ionic bond).
3.
Dalam kasus lain, satu atau lebih pasangan elektron digunakan bersama antara
atom-atom. Ikatan yang terbentuk oleh penggunaan bersama elektron di antara
atom-atom disebut ikatan kovalen (covalent bond).
4.
Elektron ditransfer atau digunakan bersama sehingga setiap atom mencapai
konfigurasi elektron yang sangat stabil. Biasanya ini disebut konfigurasi gas
mulia, yaitu konfigurasi dengan delapan elektron di kulit terluar atau suatu
oktet.
1.1
Simbol Lewis dan Struktur Lewis
Simbol Lewis terdiri atas simbol kimia untuk menyatakan inti atom
(nucleus) dan elektron teras suatu atom, bersama dengan titik-titik yang
ditempatkan di seputar simbol tersebut untuk menyatakan elektron valensi.
Simbol Lewis lazimnya ditulis untuk unsur-unsur golongan utama namun
sangat jarang untuk unsur-unsur transisi. Simbol Lewis untuk silicon, yang
memiliki konfigurasi elektron [Ne]3
s23
p2adalah:
Simbol Lewis lazimnya ditulis untuk unsur-unsur golongan utama
25
Struktur Lewis adalah kombinasi simbol-simbol Lewis yang
menyatakan transfer atau penggunaan bersama elektron dalam suatu ikatan
kimia.
Pada dua contoh tersebut, kami menyatakan elektron yang terlibat
dalam pembentukan ikatan dengan cara berbeda
–
(X) dari satu atom dan (∙)
dari atom lain. Hal ini membantu menekankan bahwa satu elektron
ditransfer dalam pembentukan ikatan ionik dan sepasang elektron
digunakan bersama dalam ikatan kovalen. Tentu saja, tidak mungkin untuk
membedakan elektron-elektron, dan selanjutnya kita hanya akan
menggunakan titik-
titik (∙) untuk menyatakan elektron dalam struktur
Lewis.
1.2
Struktur Lewis Untuk Senyawa Ionik
Untuk senyawa ionik dari unsur golongan utama, simbol Lewis dari
ion logam tidak mempunyai titik jika semua elektron valensinya lepas, dan
muatan ionik kation dan anionnya ditunjukkan. Gagasan ini digambarkan
seperti contoh sebagai berikut:
Contoh :
Tulislah struktur Lewis untuk senyawa berikut : (a) BaO; (b) MgCl
2;
(c) aluminium oksida.
Penyelesaian :
26
(b)
Atom Cl hanya dapat menerima satu elektron karena telah mempunyai
tujuh elektron valensi. Satu elektron lagi akan melengkapi oktetnya.
Sebaliknya, atom Mg harus melepaskan dua elektron agar mencapai
konfigurasi elektron gas mulia neon. Jadi, dua atom Cl diperlukan untuk
setiap atom Mg.
(c)
Rumus aluminium oksida langsung mengikuti struktur Lewis.
Gabungan satu atom Al, yang melepaskan tiga elektron, dan satu atom
O, yang memperoleh dua elektron, menyebabkan kelebihan satu
elektron yang lepas. Untuk mencocokkan banyaknya elektron yang
dilepaskan dan yang diperoleh, unit rumus harus didasarkan pada dua
atom Al dan tiga atom O.
27
2.
Ikatan Kovalen
Telah diketahui bahwa semakin rendah energi ionisasi suatu unsur, maka
akan semakin bersifat logam. Natrium jauh lebih bersifat logam dibandingkan
hidrogen. Faktanya, hidrogen dipandang sebagai nonlogam. Atom hidrogen dalam
wujud gas tidak memberikan elektron kepada atom nonlogam lainnya. Pengikatan
diantara atom hidrogen dan atom klorin melibatkan penggunaan bersama elektron,
yang menghasilkan ikatan kovalen. Untuk menekankan penggunaan bersama
elektron, coba kita pikirkan struktur Lewis HCl dengan cara berikut ini:
Lingkaran dengan garis terputus menyatakan kulit elektron terluar dari
atom-atom yang berikatan. Banyaknya titik pada atau di dalam setiap lingkaran
menyatakan banyaknya elektron efektif dalam setiap kulit valensi. Atom H
mempunyai dua titik, sebagaimana pada konfigurasi elektron He. Atom Cl
mempunyai delapan titik, bersesuaian dengan konfigurasi kulit terluar Ar.
Perhatikan bahwa dua elektron antara H dan Cl dihitung dua kali. Kedua elektron
ini digunakan bersama oleh atom H dan atom Cl. Pasangan elektron yang digunakan
bersama ini membangun ikatan kovalen.
28
2.1
Ikatan Kovalen Koordinat
Teori Lewis mengenai pengikatan menjelaskan ikatan kovalen
sebagai penggunaan bersama sepasang elektron, tetapi ini tidak selalu
berarti bahwa setiap atom menyumbangkan satu elektron kepada ikatan.
Suatu ikatan kovalen yang satu atomnya menyumbangkan sekaligus dua
elektron kepada pasanagan yang digunakan bersama dinamakan ikatan
kovalen koordinat.
Ikatan yang terbentuk antara atom N dari NH
3dan ion H
+pada
gambar struktur di atas adalah ikatan kovalen koordinat. Namun, perlu
dicatat bahwa begitu ikatan ini telah terbentuk tidak mungkin lagi
mengatakan mana dari keempat ikatan N
–
H yang merupakan ikatan
kovalen koordinat. Jadi, ikatan kovalen koordinat tidak dapat dibedakan dari
ikatan kovalen reguler.
2.2
Ikatan Kovalen Ganda
Seringkali lebih dari satu pasang elektron harus digunakan bersama
29
Pada aplikasi gagasan tentang struktur Lewis pada CO
2terlihat
bahwa atom C dapat menggunakan bersama satu elektron valensi dengan
setiap atom O sehingga membentuk dua ikatan tunggal karbon ke oksigen.
Namun, hal ini membuat atom C dan kedua atom O masih belum
oktet. Masalah ini diatasi dengan menggeser elektron tak berpasangan ke
dalam kawasan ikatan, yang ditunjukkan dengan tanda panah merah.
3.
Ikatan Kovalen Polar dan Peta Potensial Elektrostatik
Ikatan kovalen yang elektronnya tidak digunakan bersama secara setara
diantara dua atom disebut ikatan kovalen polar. Pada ikatan seperti ini, elektron
bergeser ke arah unsur yang lebih nonlogam. Penggunaan bersama yang tidak setara
ini menghasilkan muatan negatif parsial pada unsur yang lebih nonlogam, ditandai
dengan δ
-, dan muatan positif parsial pada unsur yang lebih logam, yang ditandai
dengan δ+. Jadi, dapat dinyatakan ikatan polar pada HCl menggunakan struktur
L
ewis, dengan muatan parsial δ+ dan δ
- menunjukkan bahwa pasangan elektron
ikatan terletak lebih dekat pada atom Cl daripada atom H.
Potensial elektrostatik adalah kerja yang dilakukan dalam menggerakkan
satu unit muatan positif dengan kecepatan konstan dari satu kawasan molekul ke
kawasan lain. Peta potensial elektrostatik diperoleh dengan menelusuri secara
hipotetis permukaan densitas elektron dengan muatan titik positif. Muatan titik
30
Gambar 14. Determinasi dari peta potensial elektrostatik untuk amonia.
Peta ini memberikan distribusi muatan elektron di permukaan.
3.1
Elektronegativitas
Ikatan H
–
Cl adalah polar sebab atom Cl mempunyai afinitas
elektron yang lebih besar dibandingkan atom H. Namun, afinitas elektron
adalah sifat atom, dan predikasi yang lebih bermakna dalam hal polaritas
ikatan adalah didasarkan pada sifat molekul, yaitu yang terkait dengan
kemampuan atom untuk melepaskan atau memperoleh elektron ketika atom
merupakan bagian dari molekul, bukannya sebagai atom yang terisolasi dari
atom lain.
31
relatif terhadap atom dengan energi ionisasi rendah dan afinitas elektron
kecil, seperti natrium.
Nilai elektronegativitas memungkinkan kita mendalami besarnya
sifat polar dalam ikatan kovalen berdasarkan selisih elektronegativitas, Δ
EN
–
nilai mutlak dari selisih nilai-nilai EN dari atom-atom yang berikatan. Jika
ΔEN kedua atom sangat kecil, ikatan diantaranya pada
dasarnya kovalen.
Jika ΔEN besar, ikatan tersebut pada dasarnya ionik. Untuk nilai ΔEN
pertengahan, ikatan dikatakan sebagai kovalen polar.
4.
Menuliskan Struktur Lewis
4.1
Persyaratan Dasar
Beberapa fitur penting dari struktur Lewis, yaitu :
Semua elektron valensi dari atom pada struktur Lewis harus muncul
dalam struktur.
Biasanya, semua elektron dalam struktur Lewis berpasangan.
Biasanya, setiap atom mencapai oktet elektron pada kulit terluarnya.
Namun, hidrogen dibatasi pada dua elektron pada kulit terluarnya.
Adakalanya, ikatan kovalen ganda diperlukan. Ikatan kovalen ganda
terbentuk paling mudah oleh atom C, N, O, P dan S.
4.2
Struktur Kerangka
Dalam struktur kerangka dengan lebih dari dua atom, biasanya
dibedakan antara atom pusat dan atom terminal. Atom pusat terikat pada
dua atai lebih atom, dan atom terminal terikat hanya pada satu atom lainnya.
32
Ada beberapa fakta tambahan mengenai atom pusat, atom terminal, dan
struktur kerangka, yaitu:
Atom hidrogen selalu merupakan atom terminal.
Atom pusat umumnya adalah atom dengan elektronegatvitas terendah.
Atom karbon selalu merupakan atom pusat.
Kecuali untuk sejumlah besar molekul organik seperti rantai, molekul
dan ion poliatomik umumnya mempunyai struktur kompak dan simetris.
4.3
Strategi Untuk Menuliskan Struktur Lewis
Langkah-langkah yang harus dilakukan agar tercapai struktur Lewis yang
masuk akal dapat digambarkan dalam skema sebagai berikut :
Hitunglah total banyaknya elektron dalam struktur
Letakkan dua elektron di setiap ikatan pada struktur kerangka
Letakkan elektron yang tersisa pada atom pusat
Kurangkan banyaknya elektron yang digunakan sampai tahap ini dari total banyaknya elektron
valensi. Apakah ada elektron tersisa? Gambarlah struktur kerangka
Indentifikasilah atom terminal
33
4.4
Muatan Formal
Muatan formal adalah muatan yang tampak pada atom-atom tertentu
pada struktur Lewis yang muncul bila atom-atom tidak menyumbangkan
banyaknya elektron secara setara kepada ikatan kovalen yang
menghubungkannya. Muatan formal pada suatu atom dalam struktur Lewis
adalah banyaknya elektron valensi dalam atom bebas minus banyaknya
elektron yang ditempatkan ke atom itu pada struktur Lewis, dengan
elektron-elektron ditempatkan dengan cara berikut:
Hitunglah elektron pasangan bebas seperti semuanya kepunyaan atom
yang mengembannya.
Bagilah elektron pasangan ikatan secara setara diantara atom-atom yang
berikatan.
Muatan formal pada struktur Lewis dapat ditunjukkan dengan angka kecil
yang dilingkari.
Berikut ini adalah aturan umum yang dapat membantu menentukan struktur
Lewis yang masuk akal berdasarkan muatan formalnya.
Jumlah muatannya formal pada struktur Lewis harus sama dengan nol
untuk molekul netral dan harus sama dengan besarnya muatan untuk ion
poliatomik.
Bila muatan formal diperlukan, angkanya harus sekecil-kecilnya.
Muatan formal negatif biasanya muncul pada atom yang paling
elektronegatif; muatan formal positif pada atom yang paling kurang
elektronegatif.
34
5.
Resonansi
Situasi ketika dua atau lebih struktur Lewis yang masuk akal dapat
dituliskan tetapi struktur yang benar tidak dapat dituliskan sama sekali disebut
resonansi. Struktur sejatinya adalah hibrid resonansi dari struktur-struktur
penyumbang yang masuk akal. Struktur penyumbang yang dapat diterima pada
hibrid resonansi semuanya harus mempunyai struktur kerangka yang sama;
atom-atom hanya dapat berbeda dalam cara pendistribusian elektron di dalam struktur.
Dalam banyak kasus, ada beberapa struktur resonansi penyumbang yang
tidak berkontribusi secara setara. Contohnya anion azida, N
3- dengan tiga struktur
resonansi berikut.
Kita dapat memutuskan struktur resonansi mana yang kemungkinan besar
berkontribusi paling banyak kepada hibrid dengan mengaplikasikan aturan umum
untuk muatan formal.
6.
Kekecualian Pada Aturan Orbit
6.1
Spesies Dengan Elektron Ganjil
Teori Lewis hanya menangani pasangan elektron dan tidak
menjelaskan tempat meletakkan elektron tak berpasangan; elektron ini
dapat berada pada atom N atau O. Namun, untuk mendapatkan suatu
struktur yang bebas dari muatan formal, kita akan meletakkan elektron tak
berpasangan pada atom N.
Kehadiran elektron tak berpasangan mengakibatkan spesies berelektron
ganjil bersifat paramagnetik. NO adalah paramagnetik. Molekul dengan
35
6.2
Oktet Tak Lengkap
Struktur Lewis untuk boron trifluoride mengarah ke struktur yang
atom B nya hanya memiliki enam elektron dalam kulit valensinya (oktet tak
lengkap). Suatu pengamatan yang mendukung struktur boron trifluoride
adalah bahwa panjang ikatan B
–
F pada BF
3lebih pendek dibandingkan
untuk ikatan tunggal. Ikatan yang lebih pendek menyiratkan bahwa terdapat
lebih dari dua elektron, artinya, ada sifat ikatan ganda dalam ikatannya.
Elektronegativitas fluorin yang tinggi dan elektronegativitas boron yang
jauh lebih rendah menyiratkan sifat ionik yang cukup besar pada ikatan
boron ke fluorin. Ini menyiratkan kemungkinan struktur ionik seperti
berikut.
Spesies dengan oktet tak lengkap terbatas pada beberapa senyawa berilium,
boron, dan aluminium.
6.3
Kulit Valensi Terkembang
36
7.
Bentuk Molekul
Bentuk molekul adalah gambaran geometrik yang diperoleh bila
menghubungkan inti-inti atom yang terikat dengan garis lurus. Untuk mendapatkan
penjelasan lengkap mengenai bentuk molekul, perlu diketahui dua kuantitas, yaitu:
Panjang ikatan, jarak antara inti-inti atom yang berikatan.
Sudut ikatan, sudut antara garis-garis bersebelahan yang mewakili ikatan.
Gambar 15. Bentuk geometrik molekul. Untuk menggambarkan geometri
bentuk molekul H
20 dibutuhkan besar panjang ikatan dan sudut ikatan.
Molekul diatomik hanya mempunyai satu ikatan dan tidak ada sudut ikatan.
Berhubung bentuk geometrik yang dibentuk oleh dua titik adalah garis lurus, maka
semua molekul diatomik adalah linear. Molekul triatomik mempunyai dua ikatan
dan satu sudut ikatan.
7.1
Teori Tolakan Pasangan
–
Elektron Kulit
–
Valensi (VSEPR)
Dalam teori VSEPR, berfokus pada pasangan elektron dalam kulit
elektron valensi atom pusat dalam suatu struktur. Akibatnya, akan
dihasilkan bentuk geometris tertentu untuk molekul.
37
Aspek lain dari teori VSEPR adalah fokus tidak saja pada pasangan
elektron, tetapi juga pada gugus elektron. Satu gugus elektron dapat berup
pasangan, baik pasangan bebas maupun pasangan ikatan, atau dapat pula
sebagai elektron tunggal yang tidak berpasangan pada atom dengan oktet
tak lengkap, seperti pada NO. Sebuah gugus dapat juga berupa ikatan
rangkap dua atau tiga diantara dua atom. Jadi, di dalam molekul
atom C pusat hanya mempunyai dua gugus elektron dalam
kulit valensinya. Setiap ikatan rangkap dua dengan dua pasang elektron
diperlakukan sebagai satu gugus elektron.
Dalam molekul H
2O, dua dari keempat gugus elektron adalah
pasangan ikatan dan dua lainnya adalah pasangan bebas. Bentuk molekul
diperoleh dengan menghubungkan kedua inti H ke inti O dengan garis lurus.
Untuk H
2O, geometri gugus elektronnya adalah tetrahedral dan geometri
molekulnya berbentuk V atau bengkok.
7.2
Beberapa Kemungkinan Untuk Distribusi Gugus Elektron
Geometri molekul sama seperti geometri gugus elektron hanya bila
semua gugus elektron merupakan pasangan ikatan. Jika satu atau lebih
gugus elektron adalah pasangan bebas, geometri molekulnya berbeda dari
geometri gugus elektron, meskipun diturunkan dari geometri tersebut.
Terdapat dua gagasan mengenai geometri gugus elektron dan geometri
molekul, yaitu :
1.
Semakin dekat dua gugus elektron dipaksakan, semakin kuat tolakan
diantaranya.
38
Strategi empat langkah berikut dapat digunakan untuk memprediksi bentuk
molekul, yaitu :
1.
Menggambar struktur Lewis yang masuk akal untuk spesies (molekul
atau ion poliatomik).
2.
Menentukan banyaknya gugus elektron di seputar atom pusat, dan
mengidentifikasi sebagai gugus elektron pasangan ikatan atau elektron
pasangan bebas.
3.
Menetapkan geometri gugus elektron di seputar atom pusat linear,
planar-trigonal, tetrahedral, bipiramida-trigonal, atau oktahedral.
4.
Menentukan geometri molekul dari posisi di seputar atom pusat yang
ditempati inti atom lain.
7.3
Molekul Dengan Lebih Dari Satu Atom Pusat
Walaupun banyak struktur yang hanya mempunyai satu atom pusat,
teori VSEPR dapat juga diaplikasikan pada molekul atau anion poliatomik
dengan lebih dari satu atom pusat. Dalam kasus ini, distribusi geometrik
atom-atom terminal di seputar setiap atom pusat harus ditentukan dan
hasilnya kemudian digabung menjadi satu deskripsi mengenai bentuk
molekul.
Contoh:
Mengaplikasikan teori VSEPR untuk molekul dengan lebih dari satu atom
pusat. Metil isosianat, CH
3NCO, digunakan dalam manufaktur insektisida,
seperti karbaril (Sevin). Dalam molekul CH
3NCO ini, tiga atom H dan atom
O adalah atom terminal dan dua atom C dan satu atom N adalah atom pusat.
Buatlah sketsa molekul ini.
Penyelesaian:
Untuk mengaplikasikan metode VSEPR, dimulai dengan struktur Lewis
yang masuk akal. Banyaknya elektron valensi pada struktur ini adalah :
Dari C
Dari N
Dari O
Dari H
39
Dalam menggambarkan struktur kerangka dan menempatkan elektron
valensi, pertama-tama kita memperoleh struktur dengan oktet tak lengkap.
Dengan menggeser elektron yang terindikasi, maka dapat dicapai oktet pada
setiap atom.
Atom C di sebelah kiri mempunyai empat gugus elektron disekitarnya
semua berupa psangan ikatan. Bentuk di bagian ujung molekul ini
tetrahedral. Atom C di sebelah kanan, dengan membentuk dua ikatan
rangkap, diperlukan seolah mempunyai dua gugus elektron disekitarnya.
Distribusinya linear. Untuk atom N, tiga gugus elektron terdistribusi dengan
cara planar trigonal. Sudut ikatan C
–
N
–
C haruslah sekitar 120
ᵒ
.
7.4
Bentuk Molekul dan Momen Dipol
Pada molekul HCl, atom Cl lebih elektronegatif dibandingkan atom
H. Elektron tergeser ke arah atom Cl. Molekul HCl adalah molekul polar.
Pada penggambaran berikut digunakan tanda panah dengan tanda silang di
ujungnya yang mengarah ke atom yang menarik elektron lebih kuat.
40
x meter (C.m), momen dipol (µ) mempunyai nilai yang disebut 1 debye (D).
Satu metode percobaan dalam menentukan momen dipol didasarkan pada
perilaku molekul polar di medan listrik.
Molekul CO
2adalah nonpolar. Perlu dibedakan antara perpindahan densitas
muatan elektron dalam ikatan tertentu dan dalam molekul secara
keseluruhan. Selisih elektronegativitas antara C dan O mengakibatkan
perpindahan densitas muatan elektron ke arah atom O dalam setiap ikatan
karbon ke oksigen dan menghasilkan dipol ikatan.
C.
IKATAN KIMIA (ASPEK-ASPEK TAMBAHAN)
1.
METODE IKATAN VALENSI
Pembentukan ikatan kovalen dari aspek pertumpangtindihan orbital atom
dinamakan metode ikatan valensi (
valence bond method). Terciptanya ikatan
kovalen dalam metode ikatan valensi biasanya didasarkan pada tumpang tindih
orbital terisi setengah, tetapi adakalanya tumpang tindih seperti itu melibatkan
orbital terisi penuh pada satu atom dan orbital kosong pada atom lainnya. Metode
ikatan valensi memberikan model pengiikatan elektron elektron terlokalisasi.
Elektron teras (
core) dan elektron valensi pasangan bebas mempertahankan lokasi
orbital yang sama seperti dalam atom
–
atom terpisah dan densitas muatan dari
elektron terikat terkonsentrasi di kawasan pertumpang tindihan orbital.
41
2.
HIBRIDASI ORBITAL ATOM
Dalam sebagian besar kasus, penjelasan tentang geometri molekul
berdasarkan pertumpangtindihan sederhana orbital atom yang tidak dimodifikasi
ternyata tidak cocok dengan hasil pengamatan. Contohnya, berdasarkan konfigurasi
elektron keadaan dasar dari kulit valensi karbon adalah
Hidrokarbon paling sederhana yang teramati pada kondisi normal laboratorium
adalah metana, CH
4. Metana adalah molekul stabil yang tidak reaktif dengan rumus
molekul yang konsisten dengan aturan oktet dari teori Lewis. Untuk mendapatkan
rumus molekul metana melalui metode ikatan valensi, kita memerlukan diagram
orbital untuk karbon dengan empat elektron takberpasangan sehingga
tumpangtindih orbital menghasilkan empat ikatan C
–
H. Konfigurasi elektron yang
dihasilkan adalah konfigurasi elektron keadaan tereksitasi.
Konfigurasi elektron pada keadaan tereksitasi ini menyiratkan suatu suatu molekul
dengan tiga ikatan C
–
H yang saling tegak lurus. Ikatan keempat akan mengarah
ke posisi manapun dalam molekul yang dapat mengakomodasi atom H keempat.
Suatu skema pengikatan yang didasarkan pada konfigurasi elektron keadaan
tereksitasi kurang dalam menjelaskan sudut ikatan dalam CH. Salah satu cara
mengatasi masalah ini adalah dengan memodifikasi orbital atom dari atom
–
atom
terikat. Kombinasi aljabar dari persamaan gelombang satu orbital 2
sdan tiga orbital
2
patom karbon menghasilkan satu set baru yang terdiri atas empat orbital identik.
Orbital baru ini, yang terarah secara tetrahedral, memiliki energi pertengahan antara
orbital 2
sdan 2
p. Orbital atom murni dengan orbital atom terformulasi untuk atom
42
Dalam skema hibridisasi, banyaknya orbital hibrid sama dengan total
banyaknya orbital atom penyusunnya. Simbol menunjukkan jumlah dan jenis
orbital yang terlibat. Jadi,
sp3menandakan bahwa satu orbital
sdan tiga orbital
pbergabung. Penggambaran untuk hibridisasi
sp3dari orbital kulit valensi karbon
adalah
Tujuan skema hibridisasi adalah menjelaskan bentuk molekul berdasarkan fakta
dari hasil percobaan. Hibridisasi bukanlah fenomena fisis yang sebenarnya. Untuk
beberapa ikatan kovalen tidak ada satu skema hibridisasi yang terbukti baik.
Namun, konsep hibridisasi bekerja dengan sangat baik untuk molekul yang
mengandung karbon sehingga banyak digunakan dalam kimia organik.
PENGIKATAN DALAM H
2O DAN NH
3Ketika diaplikasikan untuk H
2O dan NH
3, teori VSEPR menjelaskan
geometri gugus elektron tetrahedral untuk empat gugus elektron. Pengikatan dalam
NH
3, contohnya dapat dideskripsikan dari aspek diagram orbital kulit valensi untuk
nitrogen sebagai berikut :
43
ORBITAL HIBRID
sp2Tetangga golongan 13 karbon yaitu boron mempunyai empat orbital tetapi
hanya mempunyai tiga elektron dalam kulit valensinya. Untuk kebanyakan
senyawa boron, skema hibridisasi yang layak menggabungkan satu orbital 2
sdan
dua orbital 2
pmenjadi tiga orbital hibrid
sp2dan meninggalkan satu orbital
pyang
tidak terhibridisasi. Skema hibridisasi
sp2berkaitan dengan geometri gugus
elektron planar trigonal. Dalam skema hibridisasi dari teori ikatan valensi,
banyaknya orbital terkekalkan, artinya dalam atom yang berhibridisasi
sp2masih
ada empat orbital, tiga hibrid
sp2dan satu orbital
pyang tidak terhibridisasi.
Gambar 17. Skema hibridisasi
sp2ORBITAL HIBRID
sp44
berhibridisasi menjadi dua orbital hibrid
spdan dua orbital 2
psisanya tidak
berhibridisasi.
ORBITAL HIBRID
sp3dDAN
sp3d2Untuk menjelaskan skema hibridisasi yang berhubungan dengan geometri
gugus 5 elektron dan 6 elektron dari teori VSEPR, perlu melangkah lebih jauh dari
subkulit
sdan
ppada kulit valensi dan ini berarti melibatkan kontribusi orbital
d.
Tercapainya lima orbital fosforus terisi setengah untuk menjelaskan lima ikatan P
–
Cl dalam PCl
5dan geometri molekul bipiramida trigonalnya melalui hibridisasi
satu orbital
s, tiga orbital
pdan satu orbital
dpada kulit valensi menjadi lima orbital
hibrid
sp3d.
Tercapainya enam orbital sulfur terisi setengah untuk menjelaskan enam ikatan S
–
F dalam SF
6dan geometri molekul oktahedralnya melalui hibridisasi satu orbital
s,
tiga orbital
p, dan dua orbital
dpada kulit valensi menjadi enam orbital hibrid
sp3d2.
ORBITAL HIBRID DAN TEORI TOLAKAN PASANGAN ELEKTRON
KULIT VALENSI (VSEPR)
45
Ronald Nyholm pada tahun 1957. Keuntungan VSEPR adalah bahwa teori ini
memiliki kemampuan prediksi berdasarkan struktur Lewis, sementara skema
hibridisasi memerlukan pengetahuan awal mengenai geometri molekul. Skema
hibridisasi yang mungkin untuk atom pusat dalam struktur dalam metode ikatan
valensi dapat dipilih dengan:
Menuliskan struktur Lewis yang masuk akal untuk spesies yang diamati
Menggunakan teori VSEPR untuk memprediksi geometri gugus elektron
atom pusat yang mungkin
Menyeleksi skema hibridisasi yang berhubungan dengan geometri gugus
elektron.
3.
IKATAN KOVALEN GANDA
Dua jenis tumpang tindih orbital terjadi bila ikatan ganda dideskripsikan
dengan metode ikatan valensi. Contoh spesifik ikatan rangkap dua karbon ke
karbon dalam etilena, C
2H
4, dan ikatan rangkap tiga karbon ke karbon dalam
asetilena, C
2H
2.
Pengikatan Dalam C
2H
446
Etilena adalah molekul planar dengan sudut ikatan H
–
C
–
H dan H
–
C
–
C sebesar
1200. Teori VSEPR memperlakukan setiap atom C dikelilingi oleh tiga gugus
elektron dalam susuunan planar trigonal. Salah satu ikatan diantara dua atom
karbon dihasilkan dari tumpang tindih orbital hibrid
sp2dari setiap atom. Tumpang
tindih ini terjadi di sepanjang garis yang menghubungkan inti kedua atom tersebut.
Orbital
–
orbital yang bertumpang tindih dengan cara ujung ke ujung ini
menghasilkan ikatan sigma, dilambangkan d
engan σ. Ikatan kedua diantara kedua
atom C dihasilkan dari tumpang tindih orbital
pyang tidak berhibridisasi. Dalam
ikatan ini, ada kawasan dengan densitas muatan elektron yang tinggi di atas dan di
bawah bidang dari atom karbon dan atom hidrogen. Ikatan yang dihasilkan dengan
cara tumpang tindih sisi ke sisi dari dua orbital paralel dinamakan ikatan π.
Gambar 18.
Pengikatan σ dan π dalam C
2H
4Model bola dan tongkat mengilustrasikan pengikatan dalam etilena. Model ini
menunjukkan bahwa:
Bentuk molekul
ditentukan hanya oleh orbital yang membentuk ikatan σ
Rotasi pada ikatan rangkap dua sangat terbatas. Pada model bola dan
47
-CH
2ke luar bidang lainnya akan mengurangi banyaknya orbital
pyang
bertumpang tindih dan melemahkan ikatan π. Ikatan rangkap dua adalah
ikatan yang kaku dan molekul C
2H
4adalah planar.
Pengikatan Dalam C
2H
2Pengikatan dalam asetilena, C
2H
2, serupa dengan yang ada di C
2H
2tetapi dengan
perbedaan berikut. Struktur Lewis C
2H
2menampilkan ikatan kovalen rangkap tiga.
Molekul ini liniear. Skema hibridisasi untuk menghasilkan orbital hibrid dalam
orientasi liniear adalah
sp. Diagram orbital kulit valensi yang menyatakan
hibridisasi
spadalah pada ikatan rangkap tiga dalam C
2H
2, salah satu dari ikatan
karbon ke karbon adalah ikatan σ dan dua lainnya adalah ikatan π.
Gambar 19.
Pengikatan σ dan π dalam C
2H
248
4.
TEORI ORBITAL MOLEKUL
Teori orbital molekul (
molecular orbital theory), dimulai dengan gambar
sederhana molekul tetapi dengan cepat menjadi rumit pada rinciannya. Teori ini
menempatkan elektron
–
elektron dalam sebuah molekul ke dalam satu seri orbital
yang dimiliki oleh molekul tersebut secara keseluruhan. Orbital molekul yang
terbentuk oleh interferensi destruktif (pengurangan) dua orbital 1
smengakibatkan
berkurangnya probabilitas elektron di antara inti
–
inti. Ini menghasilkan orbital
molekul anti ikatan (antibonding molecular orbital), dilambangkan dengan
superskrip (*) sebab interferensi destruktif menempatkan densitas muatan elektron
yang sangat rendah di antara kedua inti. Probabilitas elektron atau densitas muatan
elektron dalam orbital
σ
*1sadalah (1
sA–
1
sB)
2. Dengan densitas muatan elektron
yang rendah diantara inti
–
inti atom, inti tidak terhalang dari inti lainnya, maka
terjadilah tolakan kuat dan ikatan melemah (sehingga diberi istilah anti ikatan).
Orbital molekul anti ikatan ini dilambangkan dengan
σ*
1sdan berada pada energi
yang lebih tinggi dibandingkan orbital atom 1
s.
49
GAGASAN DASAR YANG MENYANGKUT ORBITAL MOLEKUL
1.
Banyaknya orbital molekul (molecular orbital) yang terbentuk sama dengan
banyaknya orbital atom yang bergabung
2.
Dari dua orbital molekul yang terbentuk, bila dua orbital atom bergabung salah
satunya adalah orbital molekul ikatan pada energi yang lebih rendah
dibandingkan dengan orbital atom asalnya. Lainnya adalah orbital molekul anti
ikatan pada energi yang lebih tinggi.
3.
Pada konfigurasi keadaan dasar, elektron memasuki orbital molekul yang
energinya paling rendah
4.
Jumlah maksimum elektron dalam orbital molekul tertentu adalah dua
5.
Pada konfigurasi keadaan dasar, elektron
–
elektron memasuki orbital molekul
–
orbital molekul yang berenergi sama satu demi satu sebelum elektron
–
elektron tersebut mulai berpasangan
Suatu spesies molekul yang stabil memiliki lebih banyak elektron dalam orbital
ikatan dibandingkan dalam orbital anti ikatan. Dalam teori orbital molekul, orde
ikatannya adalah setengah dari selisih jumlah elektron ikatan dan elektron anti
ikatan.
MOLEKUL DIATOMIK UNSUR
–
UNSUR PERIODE PERTAMA
H
2+Spesies ini mempunyai satu elektron. Elektron ini memasuki orbital σ
1syaitu
orbital molekul ikatan. Orde ikatannya adalah ½
H
250
He
2+Ion ini mempunyai tiga elektron. Dua elektron berada pada orbital σ
1sdan satu
orbital pada
σ*
1s. spesies ini ada sebagai ion stabil dengan orde ikatan 1/2 .
He
2Dua elektron berada dalam orbital σ
1sdan dua dalam orbital
σ*
1s. Orde
ikatannya adalah 0. Tidak ada ikatan yang dihasilkan. He
2bukanlah ikatan
yang stabil.
Gambar 21. Diagram orbital molekul untuk molekul diatomik
dan ion
–
ion dari unsur periode pertama
ORBITAL MOLEKUL UNSUR
–
UNSUR PERIODE KEDUA
Orbital molekul yang terbentuk melalui penggabungan orbital atom 2s sama
dengan yang terbentuk dari orbital atom 1
s, kecuali berada pada energi yang lebih
tinggi. Dua cara yang mungkin bagi orbital atom 2
puntuk bergabung menjadi
orbital molekul dari ujung ke ujung dan sisi ke sisi. Tumpang tindih terbaik untuk
orbital
padalah di sepanjang garis lurus (artinya dari ujung ke ujung). Gabungan
ini menghasilkan orbital molekul
σ
, yaitu
σ
2pdan
σ*
2p. Dalam pembentukan
gabungan orbital ikatan dan anti ikatan di sepanjang sumbu antar intiharus
51
ke inti dan fungsi
–
fungsi gelombangnya sefase, maka penjumlahan kedua fungsi
gelombang menghasilkan kenaikan densitas elektron di kawasan antar inti dan
menghasilkan orbital
σ
2p.Bila dua orbital atom dengan cuping
–
cuping berlawanan
fase mengarah ke kawasan antar inti, sebuah bidang simpul di pertengahan antar
inti akan terbentuk dan menghasilkan orbital anti ikatan
σ*
2p.Penggabungan sisi
ke sisi dari sepasang orbital 2
pakan menghasilkan orbital molekul jenis π yaitu π
2pdan π
*
2p. orbital jenis π
2pterbentuk dengan cara menjumlahkan orbital
ppada satu
inti dengan orbital
ppada inti lainnya, sehingga cuping positif dan cuping negatif
dari satu orbital berada sefase dengan cuping positif dan cuping negatif dari orbital
pyang lain pada inti lainnya.
Orbital anti ikatan π
*
2pdibentuk melalui pengurangan
dua orbital
pyang tegak lurus terhadap sumbu antarinti. Selain bidang simpul yang
mengandung inti, suatu simpul terbentuk di antara inti
–
inti dan ini merupakan sifat
anti ikatan. Dalam orbital molekul anti ikatan yang ada di bidang simpul diantara
inti
–
inti dengan desitas muatan elektron menurun hingga nol.
52
Gambar 23. Penggabungan orbital atom 2
pDiagram tingkat energi untuk orbital molekul yang terbentuk dari orbital
53
Berikut ini adalah bagaimana penempatan elektron
–
elektron pada orbital
molekul dari molekul diatomik unsur
–
unsur periode kedua. Dimulai dengan
orbital σ
1sdan σ
*1syang terisi penuh. Kemudian menambahkan elektron sesuai
dengan urutan menaiknya energi ke orbital molekul kulit utama kedua yang
tersedia. Sama seperti saat menyusun orbital atom kulit valensi, orbital molekul
kulit kedua dari molekul diatomik dapat disusun dengan urutan menaiknya energi.
54
Gambar 24. Diagram orbital molekul untuk molekul diatomik homointi unsur
periode kedua
55
ke energi unsur yang lebih elektronegatif, sementara energi orbital anti ikatan lebih
dekat ke energi unsur yang kurang elektronegatif. Kedua atom tidak boleh terpisah
terlalu jauh nomor atomnya agar orde tingkat energinya tidak terlalu berbeda dari
yang ditemukan untuk spesies diatomik homointi.
56