iii
#
$
%
∗
&
'
( (
( (
"
∗
) *
"
∗
+
#
"
iv
Tesis magister sains ini tidak dipublikasikan, namun tersedia di perpustakaan dalam lingkungan ITB. Diperkenankan untuk dipakai sebagai referensi kepustakaan, tetapi pengutipan atau ringkasan hanya dapat dilakukan seizin pengarang dan harus menyebutkan sumbernya sesuai kebiasaan ilmiah.
v
Dengan memanjatkan rasa syukur kehadirat Allah S.W.T., karena hanya atas ridho-Nya penulis dapat menyelesaikan tugas akhir berupa penelitian dan penyusunan tesis magister ini sebagai salah satu syarat untuk menyelesaikan pendidikan program magister di Institut Teknologi Bandung.
Penelitian dan penyusunan tesis magister ini tidak terlepas dari bantuan berbagai pihak. Oleh karena itu, dengan kerendahan hati penulis mengucapkan rasa terima kasih yang tulus dan penghargaan setinggi-tingginya kepada yang terhormat Dra. Nuryati Juli, M.S. dan Dr. Taufikurahman, selaku pembimbing, yang telah banyak mengarahkan dan membimbing penulis selama pelaksanaan tugas akhir. Kepada Dr. Mumu Sutisna dan Dra. Pingkan Aditiawati, M.S. dan Dr. Adianto, selaku dosen penguji tesis, penulis menyampaikan terima kasih atas semua koreksi dan masukan dalam rangka penyempurnaan naskah tesis ini.
Ucapan terima kasih penulis sampaikan juga kepada yang terhormat: 1. Rektor, Dekan dan Ketua Jurusan Biologi Fakultas Matematika dan Ilmu
Pengetahuan Alam Universitas Sriwijaya, yang telah memberikan izin dan kesempatan untuk mengikuti pendidikan magister di ITB.
2. Direktorat Jendral Pendidikan Tinggi, yang telah memberikan beasiswa melalui Biaya Pendidikan Pascasarjana (BPPs) selama mengikuti program magister di ITB.
vi
4. Kepala Laboratorium Mikrobiologi jurusan Biologi ITB, yang telah memberikan izin untuk menggunakan fasilitas yang ada guna pelaksanaan penelitian ini.
5. Dr. Taufikurahman, selaku Peneliti Utama penelitian RUT III, yang telah membantu dalam pembiayaan selama penelitian berlangsung.
6. Ibu dan Bapak Priyono Sumarto selaku orang tua, Elfita istriku dan Maulia Sari Khairunnisa anakku, yang senantiasa memberikan dorongan dan do’a sehingga penulis dapat menyelesaikan pendidikan program magister ini.
7. Rekan-rekan mahasiswa Program Magister Biologi ITB terutama Drs. Agung Suprihadi, Drs. Sulaiman Gosalam, dan Dewi Gartika, S.Si serta semua pihak yang tidak dapat disebut satu persatu, yang telah banyak membantu dan berjasa dalam penelitian ini.
Semoga kebaikan Bapak, Ibu dan Saudara sekalian mendapat balasan dari Allah S.W.T.
Akhirnya penulis berharap semoga tesis magister ini dapat memberikan sumbangan terhadap perkembangan ilmu pengethuan dan bagi pihak yang memerlukannya.
Bandung, Januari 1999
vii
rizosfir dari hutan bakau di Cilacap dalam mendegradasi residu minyak bumi. Tujuan penelitian ini adalah mendapatkan isolat bakteri rizosfir dan menentukan kemampuan isolat bakteri tersebut sebagai kultur tunggal maupun campuran dalam mendegradasi residu minyak bumi. Bakteri diisolasi dari rizosfir yang tercemar maupun yang tidak tercemar oleh residu minyak bumi. Optimasi kandungan nutrisi medium uji dilakukan dengan menambahkan KNO3 sebagai sumber N dan K2HPO4 sebagai sumber P dengan rasio N:P 5:1, 10:1 dan 15:1 dan menambahkan residu minyak bumi dengan kadar 5%, 10%, 15%, 20% dan 25% (v/v) pada medium sebagai sumber karbon. Uji kemampuan degradasi isolat dalam bentuk kultur tunggal maupun campuran menggunakan medium dengan pH 6, 7, dan 8 pada rasio N:P = 10:1 serta kadar residu 20% (v/v). Kultur diinkubasi selama 14 hari pada suhu 30oC dan pengocokan 120 rpm. Viskositas, gravitasi spesifik, residu terlarut, berat residu akhir, penurunan pH medium dan pertumbuhan bakterinya diukur pada akhir percobaan. Ditemukan tiga isolat yaitu
Achromobacter sp., Pseudomonas vesicularis dan Bacillus brevis yang
mampu mendegradasi residu minyak bumi. Masing-masing isolat dalam bentuk kultur tunggal mempunyai kemampuan yang spesifik dalam mendegradasi residu minyak bumi, Achromobacter sp. mempunyai kemampuan paling tinggi dalam menurunkan viskositas (dari 54,642 cSt menjadi 28,986 cSt) dan menurunkan gravitasi spesifik (dari 0,7918 menjadi 0,7251), Pseudomonas vesicularis memiliki kemampuan paling tinggi dalam menurunkan pH medium (menurunkan hingga 35,58%), sedangkan Bacillus
brevis memiliki kemampuan paling tinggi dalam meningkatkan residu
viii
Abstract
A Research on isolation and capability test of rhizosphere bacteria isolates from mangrove forest in Cilacap to degrade oil residue has been conducted. The aim of the research is to find bacterial isolates and their capability in mono- and mixed culture to degrade oil residue. The bacteria were isolated from rhizosphere at polluted and unpolluted area. Optimation of nutrition content of the medium was conducted by the addition of KNO3 as N sources and K2HPO4 as P sources at ratio of 5:1, 10:1, and 15:1 and oil residue as C
sources at concentration of 5%, 10%, 15%, 20%, and 25% (v/v). Test for residual degradation was done in medium at the level pH of 6.0, 7.0, and 8.0 with N:P ratio = 10:1 and residual concentration 20%(v/v). The culture was incubated for 14 days at the temperature of 30oC and the agitation of 120 rpm. Viscosity, specific gravity, solubility of residue, the decrease of medium pH, remaining residual weight and the growth of bacteria were measured at the end of the experiment. Three bacterial isolates were found namely
Achromobacter sp., Pseudomonas vesicularis and Bacillus brevis which
ix
2.1. Rizosfir Sebagai Sumber Isolat Bakteri ……….….. 5
2.2. Pencemaran Lingkungan oleh Hidrokarbon minyak bumi………. 7
2.3. Tipe dan Karakteristik Senyawa Hidrokarbon ……. 8
2.4. Komposisi Residu Minyak Bumi ………..…… 11
2.5. Faktor Lingkungan yang Mempengaruhi Proses Degradasi ……….………… 11
2.5. Mikroorganisme Pemecah Hidrokarbon ……… 13
BAB III. METODOLOGI PENELITIAN ……… 23
3.1. Bahan dan Alat ……….…. 23
3.1.1. Bahan ……….…. 23
3.1.2. Alat ………. 23
3.2. Tata Kerja ……….…. 23
3.2.1. Pengambilan sampel ……….…. 23
3.2.2. Isolasi dan Pemurnian ……… 24
3.2.3. Seleksi dan Identifikasi Isolat..……… 26
3.2.4. Optimasi rasio N:P dari KNO3 dan K2HPO4 dan kadar residu medium ……… 27
3.2.5. Penentuan kurva pertumbuhan isolat bakteri. 28 3.2.6. Rancangan percobaan pengujian kemampuan degradasi isolat bakteri rizosfir ……… 29
3.2.7. Pengukuran variabel ………..……… 31
3.2.8. Metode analisis data ………. 34
BAB IV. HASIL DAN PEMBAHASAN ……… 35
4.1. Isolasi dan Pemurnian ………. 35
x
4.5. Pengujian Kemampuan Isolat Dalam Mendegradasi
Residu Minyak Bumi ……….. 50
4.5.1. Viskositas residu ……….. 50
4.5.2. Gravitasi spesifik residu ……….. 54
4.5.3. Residu terlarut ………. 59
4.5.4. Berat residu akhir ……… 62
4.5.5. Penurunan pH medium …….……….. 67
4.5.6. Jumlah sel bakteri ……… 71
BAB V. KESIMPULAN DAN SARAN…….……….. 76
5.1. Kesimpulan ………. 76
5.2. Saran ……… 77
DAFTAR PUSTAKA ……… 78
xi
2.1. Sifat fisika kimia beberapa senyawa hidrokarbon ……….. 10 2.2. Persentase dekomposisi senyawa aromatik pada tanah
lempung berpasir selama beberapa hari ……….. 13 4.1. Karakteristik isolat bakteri rizosfir ………. 41 4.2. Karakteristik tiga isolat bakteri rizosfir terpilih …………. 42 4.3. Pengaruh utama faktor inokulum terhadap beberapa nilai
variabel yang mengindikasikan degradasi residu minyak
bumi ……… 56
4.4. Pengaruh utama faktor pH awal medium terhadap nilai beberapa variabel yang mengindikasikan degradasi residu
xii
Halaman 2.1. Degradasi alkana melalui oksidasi terminal……….. 16 2.2. Degradasi alkana melalui oksidasi sub-terminal………… 17 2.3. Beberapa senyawa antara yang dihasilkan pada degradasi
Senyawa aromatik ……… 18
2.4. Degradasi benzen menjadi katekol melalui reaksi hidrok-
aromatik ……….. 18
2.5. Degradasi senyawa aromatik dua cincin (naftalen) menjadi
katekol ………. 19
2.6. Degradasi senyawa aromatik tiga cincin (fenantren) men-
jadi katekol ………. 19
2.7. Degradasi katekol dan asam protokatekuat melalui jalur
orto ……… 20
2.8. Degradasi katekol dan asam protokatekuat melalui jalur
meta ………. 21
2.9. Degradasi senyawa antara asam gentisat ………. 22 3.1. Bagan alir isolasi dan pemurnian ………. 25 3.2. Kurva standar untuk pengukuran residu terlarut………… 33 4.1. Medium Zobell ditambah residu minyak bumi yang di-
pakai pada seleksi tahap I untuk menentukan isolat bak- teri rizosfir yang mampu bertahan hidup dan tumbuh
pada lingkungan yang mengandu7ng residu minyak bumi.. 36 4.2. Medium Soeminarti ditambah residu minyak bumi yang
dipakai pada seleksi tahap II untuk menentukan isolat bakteri rizosfir yang tahan terhadap keberadaan residu minyak bumi dan mempunyai kemampuan untuk men-
degradasinya...………… 38 4.3. Morfologi sel bakteri rizosfir isolat-1 (Achromobacter
sp.) dengan perbesaran 2000 X ..……….. 40 4.4. Morfologi sel bakteri rizosfir isolat-2 (Pseudomonas
vesicularis ) dengan perbesaran 2000 X ....………. 43 4.5. Morfologi sel bakteri rizosfir isolat-3 (Bacillus brevis)
xiii
medium dengan berbagai rasio N:P dan pH medium 7
selama masa inkubasi 5 hari ……… 45 4.7. Jumlah sel masing-masing isolat bakteri rizosfir pada
medium dengan berbagai kadar residu selama masa inku-
basi 5 hari ……… 46
4.8. Kurva pertumbuhan ketiga macam isolat bakteri rizosfir terpilih pada medium modifikasi Soeminarti dengan
pH medium 7, rasio N:P = 10:1 serta kadar residu 20% .. 48 4.9. Pengaruh utama faktor inokulum terhadap viskositas
residu setelah diinkubasi 14 hari……….. 52 4.10. Pengaruh utama faktor inokulum terhadap viskositas
residu setelah diinkubasi 14 hari………..… 53 4.11. Pengaruh utama faktor inokulum terhadap nilai gravitasi
spesifik setelah diinkubasi 14 hari ….……… 55 4.12. Pengaruh utama faktor pH medium terhadap gravitasi
spesifik setelah diinkubasi 14 hari………. 58 4.13. Pengaruh utama faktor inokulum terhadap residu
terlarut setelah diinkubasi 14 hari ….……… 61 4.14. Pengaruh utama faktor pH medium terhadap nilai
residu terlarut setelah diinkubasi 14 hari …..……… 61 4.15. Pengaruh utama faktor inokulum terhadap berat residu
akhir setelah diinkubasi 14 hari ……… 64 4.16. Pengaruh utama faktor pH medium terhadap berat residu
akhir setelah diinkubasi 14 hari ………..………. 64 4.17. Pengaruh interaksi antara fakor pH medium dan taraf
faktor inokulum terhadap berat residu akhir setelah
diinkubasi 14 hari ………….……… 65 4.18. Pengaruh interaksi antara faktor macam inokulum dan
taraf faktor pH medium terhadap berat residu akhir
setelah diinkubasi 14 hari……….. 65 4.19. Pengaruh faktor inokulum terhadap penurunan pH
medium setelah diinkubasi 14 hari ……… 68 4.20. Pengaruh faktor pH medium terhadap penurunan pH
xiv
4.21. Pengaruh interaksi antara pH medium dan taraf faktor inokulum terhadap penurunan pH medium setelah
diinkubasi 14 hari ………..……… 70 4.22. Pengaruh interaksi antara faktor pH medium dengan
faktor inokulum terhadap penurunan pH medium setelah
diinkubasi 14 hari ..……… 71 4.23. Jumlah sel masing-masing taraf faktor inokulum selama
xv
1. Jumlah sel masing-masing isolat pada medium modifikasi Soeminarti dengan berbagai rasio N:P dan pH medium 7
selama masa inkubasi 5 hari ……….. 81 2. Jumlah sel masing-masing isolat pada medium modifikasi
Soeminarti dengan berbagai kadar residu dan pH medium
7, selama masa inkubasi 5 hari……….. 82 3. Jumlah sel masing-masing isolat pada medium modifikasi
Soeminarti dengan pH medium 7, rasio N:P = 10:1 serta
kadar residu 20% (v/v)……… 83 4. Jumlah sel masing-masing isolat dalam bentuk kultur
tunggal dan campurannya selama proses percobaan ber- langsung pada medium modifikasi Soeminarti dengan
rasio N:P dan kadar residu optimal……… 84 5. Analisis ragam nilai viskositas residu setelah masa
inkubasi 14 hari ……….. 85 5. Analisis ragam nilai gravitasi spesifik residu setelah
masa inkubasi 14 hari ……….. 85 7. Analisis ragam konsentrasi residu terlarut setelah masa
inkubasi 14 hari ……… 86
8. Analisis ragam berat residu akhir setelah masa inkubasi
14 hari ………. 86
9. Uji Duncan berat residu akhir untuk pengaruh interaksi faktor macam inokulum dan taraf pH awal
medium ……… 87
10. Uji Duncan berat residu akhir untuk pengaruh interaksi
antara faktor pH awal medium dan taraf macam inokulum 88 11. Analisis varian penurunan pH akhir medium setelah
masa inkubasi 14 hari ……… 89 12. Uji Duncan penurunan pH akhir medium untuk
interaksi faktor macam inokulum dan taraf pH awal
medium ………. 90
13. Uji Duncan penurunan pH akhir medium untuk pengaruh interaksi antara faktor pH awal medium
dan taraf macam inokulum ……… 91
14. Komposisi Medium BHMS ……….. 92
xvi
BAB I
PENDAHULUAN
1.1. Latar Belakang
Rizosfir merupakan suatu lapisan tanah yang berada di sekitar akar tumbuhan yang mengandung berbagai senyawa sebagai hasil eksudasi dari sistem perakaran tumbuhan. Senyawa-senyawa tersebut dapat memacu pertumbuhan komunitas mikroorganisme yang ada di dalam tanah, sehingga keanekaragaman dan jumlahnya meningkat.(19)
Hutan bakau merupakan tempat tumbuhnya berbagai tumbuhan pantai yang mempunyai sistem perakaran mulai dari permukaan air sampai masuk ke dalam substrat dasar perairan. Sistem perakaran tersebut akan membentuk daerah rizosfir pada substrat bawah permukaan.
Pencemaran minyak bumi di laut yang disebabkan oleh tumpahan minyak maupun buangan dari kilang minyak dapat menyebar sesuai dengan arah, sifat dan besarnya arus laut dilingkungan tersebut.(26) Pembuangan limbah minyak dari suatu pengilangan minyak terutama yang bertempat di sekitar pantai dapat mencemari perairan pantai. Hutan bakau di sekitar Unit Pengolahan minyak bumi IV Pertamina Cilacap merupakan salah satu perairan pantai yang tercemar limbah residu minyak bumi dari aktivitas pengilangan minyak bumi di Cilacap. Residu yang mencemarinya sudah mencapai dasar perairan dan masuk ke daerah rizosfir hutan bakau.
terancam. Komposisi penyusun residu diantaranya adalah senyawa hidrokarbon yang masih dapat digunakan oleh mikroorganisme sebagai sumber karbon.(29) Bakteri merupakan kelompok mikroorganisme yang mudah beradaptasi dengan lingkungannya, sehingga memungkinkan dapat menggunakan residu sebagai sumber karbon dan energi.
Di daerah rizosfir senantiasa terjadi proses esksudasi yang dilakukan oleh sistem perakaran. Eksudat yang dikeluarkan dapat berupa senyawa-senyawa yang digunakan sebagai nutrisi oleh bakteri. Senyawa-senyawa-senyawa yang terkandung dalam eksudat diantaranya adalah asam-asam amino dan nukleotida. Asam amino mengandung gugus amina yang dapat digunakan sebagai sumber N organik di daerah rizosfir, sedangkan nukleotida dapat digunakan sebagai sumber P, karena mengandung gugus fosfat. Kedua golongan senyawa tersebut akan mempengaruhi rasio N:P daerah rizosfir.(15) Bakteri sebagai jasad hidup memerlukan air untuk hidupnya. Disamping itu memerlukan juga elemen-elemen lain untuk pertumbuhannya. Elemen utama yang dibutuhkan berupa unsur diantaranya karbon, hidrogen, oksigen, nitrogen dan fosfor.(2) Dengan demikian adanya proses eksudasi tersebut dapat menyokong ketersediaan N dan P yang dibutuhkan untuk pertumbuhan bakteri, sehingga keanekaragaman dan jumlah bakteri di daerah rizosfir akan tetap tinggi.
Tingginya keanekaragaman dan jumlah mikroorganisme khususnya bakteri di daerah rizosfir memberikan peluang yang lebih besar untuk memperoleh jenis-jenis bakteri yang mempunyai potensi dapat mendegradasi residu minyak bumi .
residu minyak bumi maupun yang belum tercemar. Selanjutnya menyeleksi dan menguji kemampuan isolat tersebut dalam mendegradasi residu minyak bumi.
Manfaat yang diharapkan dari hasil penelitian ini antara lain memberikan informasi mengenai kemampuan isolat bakteri rizosfir dalam mendegradasi residu minyak bumi. Selanjutnya sebagai bahan pertimbangan untuk mengatasi masalah pencemaran limbah pengilangan minyak terutama pada sistem pengolahan residunya.
1.2. Tujuan Penelitian
Tujuan yang ingin dicapai dalam penelitian ini adalah:
x Mendapatkan isolat bakteri rizosfir yang mempunyai kemampuan mendegradasi residu minyak bumi.
x Menentukan rasio N:P dan kadar residu medium yang terbaik untuk pertumbuhan isolat bakteri rizosfir tersebut.
x Menentukan kemampuan isolat bakteri rizosfir dalam bentuk kultur tunggal dan campurannya dalam mendegradasi residu minyak bumi pada medium dengan pH yang berbeda.
1.3. Hipotesis Penelitian
Hipotesis yang diajukan dalam penelitian ini adalah:
x Terdapat isolat bakteri rizosfir yang mempunyai kemampuan mendegradasi residu minyak bumi.
BAB II
TINJAUAN PUSTAKA
2.1. Rizosfir Sebagai Sumber Isolat Bakteri
Istilah rizosfir sudah dikenal sejak tahun 1904 untuk menunjukkan bagian tanah yang dipengaruhi oleh perakaran tumbuhan. Rizosfir dicirikan oleh lebih banyaknya kegiatan mikrobiologis dibandingkan di dalam tanah yang jauh dari sistem perakaran tumbuhan. Intensitas kegiatan tersebut tergantung dari panjangnya jarak tempuh yang dicapai oleh eksudat atau getah yang dikeluarkan sistem perakaran.(19)
Eksudat merupakan getah akar yang bersifat musilagen atau musigel yang senantiasa dikeluarkan oleh sistem perakaran yang sedang aktif tumbuh. Eksudat tersebut berfungsi untuk melindungi permukaan akar serta membasahi tanah yang berada di sekitarnya. Eksudat yang dikeluarkan oleh akar tumbuhan mengandung berbagai senyawa organik seperti gula, asam amino, asam organik, asam lemak, sterol, vitamin, nukleotida, flavonon, enzim dan golongan senyawa lain, karena adanya proses translokasi hasil metabolisme ke akar. Translokasi ini dibuktikan dengan menggunakan 14CO2
berpengaruh terhadap kualitas dan kuantitas mikroorganisme tanah, sehingga menentukan keanekaragaman dan jumlah bakteri rizosfir.(15,19)
Keanekaragaman dan jumlah bakteri di daerah rizosfir lebih tinggi dibandingkan dengan tanah bukan daerah rizosfir. Senyawa-senyawa tertentu yang dihasilkan oleh proses eksudasi akar tumbuhan dapat merangsang terjadinya gerakan kemotaksis bakteri menuju daerah rizosfir. Contoh senyawa yang dapat merangsang bakteri untuk melakukan gerakan kemotaksis diantaranya adalah asam-asam amino seperti alanin, asparagin, aspartat, sistein, glutamat, glisin, metionin, serin, treonin akan merangsang
Escherichia coli melakukan gerakan kemotaksis mendekat sumber
rangsangan tersebut, tetapi asam amino arginin, glutamin, histidin, isoleusin, leusin, lisin, fenilalanin, triptofan, tirosin dan valin tidak memberikan rangsangan, sedangkan ribosa, arabinosa dan glukosa serta asam amino seperti arginin, aspartat dan metionin merangsang Pseudomonas lachryman
bergerak mendekat sumber rangsangan tersebut. Pada umumnya bakteri akan terangsang oleh senyawa hasil eksudasi sistem perakaran di daerah rizosfir jika konsentrasi senyawa tersebut di daerah rizosfir mencapai 10-4sampai 10
-3
mol.(28) Adanya senyawa-senyawa eksudat yang dapat merangsang bakteri bergerak mendekat ke daerah rizosfir menyebabkan tingginya keanekaragaman bakteri di daerah tersebut. Disamping itu hasil penelitian yang sudah dilakukan oleh seorang peneliti menunjukkan bahwa nilai rasio antara tanah rizosfir dengan tanah bukan rizosfir mencapai 23, ini berarti bahwa jumlah bakteri rizosfir lebih banyak 23 kali lipat dibandingkan dengan daerah bukan rizosfir.(15)
secara kuat bakteri Gram negatif, bentuk batang dan tidak berspora pada daerah rizosfir sebagian besar jenis tumbuhan. Beberapa genera bakteri seperti Pseudomonas, Arthrobacter, Agrobacterium, Azotobacter,
Mycobacterium, Flavobacterium, Cellulomonas, dan Micrococcus jumlahnya
akan mendominasi atau bahkan jarang ada pada tipe rizosfir tumbuhan tertentu.(19)
Kelompok bakteri yang sering ditemukan pada daerah rizosfir diantaranya Pseudomonas fluorescens, P. putida, Enterobacter
agglomerans, Citrobacter freundii, Serratia sp., kelompok bakteri Gram
negatif , tidak berspora dan kelompok bakteri korineform.(28)
2.2. Pencemaran Lingkungan oleh Hidrokarbon Minyak Bumi
Pencemaran hidrokarbon minyak bumi di suatu lingkungan dapat disebabkan oleh beberapa hal seperti kecelakaan tangker pembawa minyak bumi, kebocoran tanker, kebocoran atau tumpahan selama operasi pemboran lepas pantai dan kebocoran pipa saluran minyak bumi.(26) Disamping itu pembuangan residu minyak bumi dari suatu industri pengilangan minyak bumi, juga dapat menyebabkan terjadinya pencemaran hidrokarbon minyak bumi ke suatu lingkungan.
Pembuangan limbah minyak dari suatu pengilangan minyak terutama yang bertempat di sekitar pantai dapat mencemari perairan pantai. Hutan bakau di sekitar Unit Pengolahan minyak bumi IV Pertamina Cilacap merupakan salah satu perairan pantai yang tercemar limbah residu minyak bumi dari aktivitas pengilangan minyak bumi di Cilacap. Residu minyak bumi yang dibuang ke suatu perairan dapat menutup permukaan air sehingga menyebabkan gangguan di perairan tersebut. Fauna maupun flora di lingkungan ini dapat mati atau terganggu pertumbuhannya, kondisi lingkungan fisika dan kimiawinya mengalami perubahan, akibatnya ekosistem di lingkungan perairan tersebut akan rusak atau terganggu.(26)
Pencemaran residu minyak bumi menyebabkan kerusakan biologis yang lebih besar dibandingkan kerusakan biologis yang disebabkan oleh tumpahnya minyak mentah ke lingkungan.(23) Hal ini disebabkan oleh bahan beracun yang berupa senyawa hidrokarbon aromatik, logam berat sisa katalis pada saat proses perengkahan minyak bumi serta senyawa merkaptan yang banyak terkandung di dalam residu minyak bumi.(26)
2.3. Tipe dan Karakteristik Senyawa Hidrokarbon
Senyawa hidrokarbon dapat dibagi menjadi empat kelompok berdasarkan atom hidrogen dan atom carbon yang menyusunnya,(10) keempat kelompok tersebut yaitu:
x Alkana, mempunyai rumus umum CnH2n+2, dapat berupa rantai lurus
mengandung 5 – 15 atom karbon berbentuk cair, dan yang mengandung lebih dari 15 atom karbon berbentuk padat pada suhu kamar.
x Naftena, dicirikan adanya struktur cincin tertutup yang sederhana dari atom karbon penyusunnya. Rumus umumnya adalah CnH2n dan tidak
mempunyai ikatan rangkap antar atom karbonnya serta bersifat tidak larut dalam air.
x Aromatik, dicirikan adanya cincin yang terdiri dari enam atom karbon. Contoh yang paling sederhana adalah benzen, dan hampir semua senyawa hidrokarbon aromatik merupakan turunan dari benzen. Beberapa senyawa aromatik larut dalam air.
x Alkena, dicirikan adanya atom karbon yang disatukan dengan ikatan rangkap. Alkena disebut juga olefin dan mempunyai rumus umum CnH2n. Alkena yang mengandung 2 sampai 4 atom karbon berbentuk
gas pada suhu kamar, tetapi yang mengandung lebih dari 5 atom karbon biasanya berbentuk cair.
Pemecahan senyawa hidrokarbon oleh bakteri menjadi senyawa yang lebih sederhana, menyebabkan perubahan sifat fisika kimia senyawa tersebut. Beberapa sifat fisika kimia yang dapat sebagai indikator terjadinya proses degradasi senyawa hidrokarbon antara lain viskositas, gravitasi spesifik, gravitasi API, densitas, kelarutan dalam air, berat sisa, tegangan permukaan, dan sifat lainnya.(10)
Tabel 2.1. Sifat fisika kimia beberapa senyawa hidrokarbon
2.4. Komposisi Residu Minyak Bumi
Limbah akhir yang dihasilkan dari proses pengilangan minyak bumi adalah residu. Limbah ini merupakan hasil samping dari proses perengkahan dan destilasi fraksional minyak mentah, sehingga sangat sulit untuk diolah kembali. Komponen utamanya adalah fraksi berat yang mempunyai titik didih sangat tinggi yaitu lebih dari 648 oC, sehingga tidak terdestilasi pada proses pengolahan minyak mentah.(2)
Lebih lanjut dijelaskan bahwa limbah residu minyak bumi disamping mempunyai komponen molekul hidrokarbon fraksi berat, juga mempunyai komponen berupa molekul organik non hidrokarbon. Molekul hidrokarbon penyusun residu dapat dikelompokkan menjadi dua berdasarkan bentuk rantainya, yaitu hidrokarbon berantai lurus atau alifatik dan hidrokarbon yang mempunyai rantai cincin atau aromatik, sedangkan molekul organik non hidrokarbonnya berupa molekul yang mengandung atom oksigen, sulfur dan nitrogen.(3), (26)
Molekul non hidrokarbon yang mengandung oksigen diantaranya fenol, asam naftenat dan dibenzofuran, sedangkan yang mengandung sulfur meliputi tiofen (dalam bentuk mono dan polisiklik sulfida), benzotiofen dan naftotiofen.(8) Bentuk molekul non hidrokarbon yang mengandung nitrogen berupa turunan piridin (kuinolin dan fenantridin), turunan indol (pirol, karbazol dan benzokarbazol) dan amida aromatik.(12)
2.5. Faktor Lingkungan Yang Mempengaruhi Proses Degradasi
biodegradasi antara lain: aw (air bebas yang dapat digunakan untuk aktivitas bakteri), oksigen yang dibutuhkan dalam proses metabolisme secara aerob, pH dan suhu serta salinitas juga merupakan faktor penting terutama pada perairan laut atau payau.(21), (9), (20)
Disamping faktor diatas nitrogen (N) dan fosfor (P) juga merupakan faktor penting supaya bakteri dapat tumbuh dengan baik.(13) Medium untuk pertumbuhan bakteri disarankan memenuhi rasio C:N:P berturut-turut 120:10:1.(25) Laju pertumbuhan tertinggi kultur bakteri metanogenik pada media yang diperkaya hidrokarbon propionat dicapai pada nilai pH medium 7,2 dan suhu inkubasi antara 37 oC sampai 42 oC.(5)
Penambahan nutrien khususnya sumber N dan P dapat menstimulasi proses biodegradasi minyak. Secara teori untuk mengubah 1 gram senyawa hidrokarbon menjadi senyawa komponen sel dibutuhkan sekitar 150 mg nitrogen dan 30 mg fosfor. Nutrisi yang sering ditambahkan sebagai sumber N dan P berupa garam mineral dan senyawa organik. Garam mineral yang sering digunakan antara lain KNO3, NH4NO3, K2HPO4, dan MgNH4PO4,
sedangkan senyawa organiknya yang biasa digunakan berupa urea, mineral yang didukung oleh parafin (“paraffin supported mineral”), dan oktil fosfat.(20), (30)
Tabel 2.2. Persentase dekomposisi senyawa aromatik pada tanah lempung berpasir selama beberapa hari
Asam Persentase dekomposisi selama masa inkubasi:
aromatik 7 hari 14 hari 28 hari
benzoat 68 71 74
gafeat 38 55 59
protokatekuat 32 62 65
vanilat 52 61 65
veratrat 59 65 69
Sumber: Alexander, 1977(1)
2.6. Mikroorganisme Pemecah Hidrokarbon
Proses pemecahan hidrokarbon dan pemecahan komponen penyusun residu dapat terjadi baik secara non mikrobiologis maupun mikrobiologis. Secara non mikrobiologis misalnya karena penguapan, dan pelarutan, sedangkan secara mikrobiologis karena aktivitas mikroorganisme seperti bakteri, khamir, dan kapang.(13)
Pada perairan yang tidak tercemar minyak populasi mikroorganisme yang berpotensi mendegradasi minyak hanya sekitar 1%, tetapi pada perairan yang tercemar minyak akan meningkat menjadi 10% dari populasi total mikroorganisme heterotrofik.(27) Mikroorganisme yang dapat menggunakan senyawa hidrokarbon alifatik mulai dari hidrokarbon dengan berat molekul
rendah (Cd8) sampai hidrokarbon dengan berat molekul tinggi (Ct16) jumlahnya sekitar 3 sampai 17 persen dari mikroorganisme yang ada pada lapisan permukaan horison tanah.(1)
tertentu.(29) Fraksi hidrokarbon yang digunakan oleh bakteri sebagai sumber karbon dan energi dapat berasal dari fraksi hasil pemecahan hidrokarbon oleh dirinya sendiri maupun fraksi hasil pemecahan hidrokarbon oleh jenis lainnya. Beberapa jenis bakteri dapat memecah hidrokarbon tetapi tidak dapat menggunakan fraksi hasil pemecahannya sebagai sumber karbon dan energi. Untuk mempertahankan hidupnya jenis bakteri tersebut menggunakan fraksi yang dihasilkan oleh jenis mikroorganisme lain sebagai sumber karbon dan energinya. Pada komunitas mikroorganisme biasa terjadi proses ko-metabolisme antar jenis yang ada. Jenis mikroorganisme tertentu memecah hidrokarbon menjadi fraksi tertentu yang akan digunakan oleh jenis mikroorganisme yang lain, sedangkan dirinya sendiri menggunakan fraksi hasil pemecahan yang dilakukan oleh jenis lainnya.(1)
Jenis mikroorganisme yang sudah diketahui dapat memecah hidrokarbon dengan berat molekul rendah seperti etana, propana dan butana antara lain Mycobacterium, Nocardia, Streptomyces, Pseudomonas,
Flavobacterium, kelompok bakteri cocci, dan beberapa kapang berfilamen.
Senyawa hidrokarbon dengan berat molekul tinggi dapat didegradasi oleh berbagai kelompok bakteri seperti Mycobacterium, Nocardia, Pseudomonas,
Streptomyces, Corynobacterium, Acinetobacter, Bacillus, kelompok khamir
Candida, Rhodotorula dan beberapa kelompok kapang. Adapun kelompok
mikroorganisme khususnya bakteri yang dapat mendegradasi hidrokarbon aromatik seperti fenol, naftalena, dan antrasena, yang berisi satu, dua, dan tiga cincin benzen adalah Pseudomonas, Mycobacterium, Acinetobacter,
Arthrobacter, Bacillus, danNocardia.(1)
jenis bakterinya. Senyawa hidrokarbon yang mempunyai struktur alifatik, hidrokarbon berantai panjang, berikatan jenuh atau bercabang banyak, lebih mudah diurai oleh bakteri, sedangkan hidrokarbon berstruktur aromatik, rantai pendek, ikatan tak jenuh atau bercabang sedikit lebih sulit diuraikan oleh bakteri.(2)
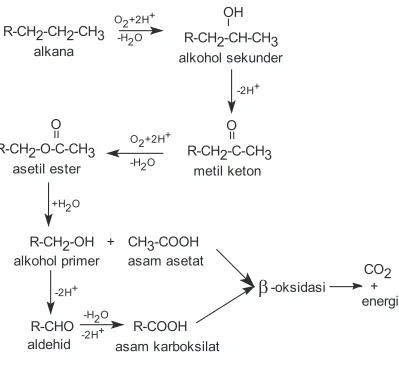
Mekanisme degradasi hidrokarbon alifatik alkana umumnya terjadi melalui proses oksidasi pada gugus metilnya. Oksidasi alkana dapat terjadi pada posisi atom C terminal seperti terjadi pada oksidasi alkana oleh
Acinetobacter dan posisi atom C subterminal oleh Pseudomonas, biasanya
pada atom karbon posisi nomor 3 - 8 subterminal. Alkana yang dapat teroksidasi melalui oksidasi terminal adalah semua alkana baik rantai pendek maupun rantai panjang, sedangkan alkana yang dapat teroksidasi melalui oksidasi subterminal adalah alkana yang mempunyai atom C berjumlah tujuh atau lebih. Disamping itu, oksidasi alkana dapat terjadi pada dua gugus metil yang terletak pada posisi atom karbon terminal dalam satu molekul alkana yang disebut oksidasi biterminal. Mekanisme degradasi alkana melalui oksidasi terminal atau subterminal tergantung oleh banyaknya atom karbon yang menyusun hidrokarbon alkana itu sendiri dan jenis bakteri yang mendegradasi.(14)
Mekanisme degradasi hidrokarbon alkana melalui oksidasi terminal akan mengalami tahapan perubahan berturut-turut menjadi alkohol primer,
menjadi alkohol sekunder, metilketon, asetilester, alkohol primer, aldehid dan
asam lemak atau asam karboksilat. Asam lemak ini melalui reaksi E-oksidasi akan didegradasi menghasilkan karbon dioksida dan energi seperti tercantum pada gambar 2.2.(4)
1/2O2
CH3COOH asam asetat
CO2 reaksi
-oksidasi
E
CH3(CH2)nCOOH asam lemak CH3(CH2)nCHO
aldehid
CH3(CH2)nCH2OH alkohol primer CH3(CH2)nCH3
alkana 1/2O2
H2
+ energi
Proses degradasi senyawa aromatik sangat ditentukan oleh tipe, jumlah dan posisi gugus yang tersubtitusi pada cincin aromatik tersebut. Gugus yang biasanya tersubtitusi pada cincin aromatik seperti benzen adalah -OH, -CH3, -COOH, -CH2OH, -NH2, dan -SO3H. Pada proses degradasi
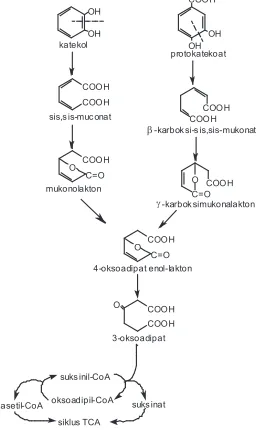
senyawa aromatik akan dihasilkan senyawa antara, yang jenisnya tergantung dari senyawa asal yang didegradasi. Namun demikian, secara umum senyawa antara yang terbentuk dapat dikelompokan menjadi
tiga yaitu katekol, asam protokatekuat dan asam gentisat.(1) Struktur ketiga kelompok senyawa antara tersebut terdapat pada gambar 2.3. Beberapa reaksi degradasi senyawa aromatik dengan satu, dua dan tiga cincin, secara berurutan benzen, naftalen, dan fenantren akan menghasilkan senyawa antara berupa katekol (gambar 2.4., 2.5. dan 2.6.).
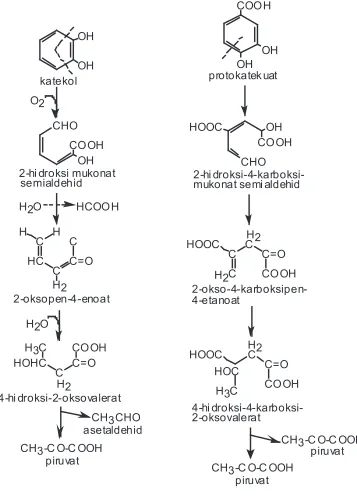
H
Gambar 2.4. Degradasi benzen menjadi katekol melalui reaksi hidroksilasi aromatik.(3)
Gambar 2.5. Degradasi senyawa aromatik dua cincin (naftalen) menjadi katekol.(1)
naftalena
OH
OH
OH
OH
1,2-Dihidroksinaftalena
Katekol
COOH
OH
asam salisilat
Gambar 2.6. Degradasi senyawa aromatik 3 cincin (fenantren) menjadi katekol.(1)
Fe nantren a
OH
COOH
OH OH
OH OH
1- Hidro ksi-2-as am n afto at 1,2 -Dihidro ksinaftalena
Ka te kol
COOH OH
Pemecahan cincin pada senyawa katekol atau katekol tersubstitusi dan asam protokatekuat dapat dilakukan melalui dua jalur yaitu orto dan meta. Kedua jalur tersebut sangat tergantung pada jenis bakteri dan jenis substratnya.(11), (26) Pemecahan katekol dan asam protokatekuat melalui jalur orto dapat dilihat pada gambar 2.7., sedangkan melalui jalur meta pada gambar 2.8.
Senyawa antara asam protokatekuat yang didegradasi melalui jalur orto akan menghasilkan asam asetat dan asam suksinat (gambar 2.7.), sedangkan jika didegradasi melalui jalur meta akan dihasilkan dua asam piruvat (gambar 2.8.). Senyawa antara yang lain yaitu asam gentisat akan didegradasi lebih lanjut menjadi asam fumarat dan asam piruvat, seperti yang tercantum pada gambar 2.9.(1)
Gambar 2.9. Degradasi senyawa antara asam gentisat.(1)
BAB III
METODOLOGI PENELITIAN
3.1. Bahan dan Alat
3.1.1. Bahan
Bahan yang dibutuhkan meliputi tanah rizosfir dari hutan bakau di Cilacap sebagai sumber isolat bakteri, medium Bushnell Haas Mineral Salt (BHMS) cair dan padat (Lampiran 14.) sebagai medium isolasi dan pemurnian isolat, medium Zobell padat (Lampiran 15.) sebagai medium skrining tahap pertama, medium Soeminarti (Lampiran 16.) sebagai medium skrining tahap kedua, dan bahan lain yang dibutuhkan seperti residu minyak bumi, reagen pewarnaan Gram dan endospora, akuades, dan lain-lain.
3.1.2. Alat
Alat yang dipakai terdiri atas peralatan gelas untuk pembuatan dan wadah media untuk isolasi, media untuk pertumbuhan bakteri, dan peralatan lain yang menunjang seperti autoklaf, inkubator, pH meter, mikroskop serta peralatan untuk pengukuran variabel-variabel yang menunjukkan terjadinya degradasi residu minyak bumi seperti viskometer, timbangan, spektrofotometer, dan lain-lain.
3.2. Tata Kerja
3.2.1. Pengambilan sampel
daerah Tritih dan kelompok kedua merupakan stasiun yang tercemar limbah minyak bumi yaitu daerah Donan. Sampel berupa tanah rizosfir dari sekitar akar tumbuhan yang berbeda secara acak berkelompok diambil dari setiap stasiun.
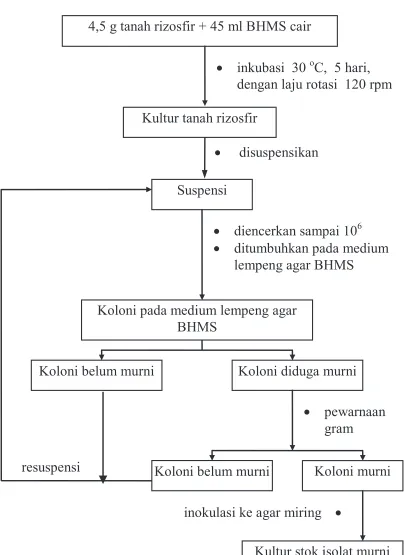
3.2.2. Isolasi dan pemurnian
Sampel berupa tanah rizosfir ditimbang sebanyak 4,5 gram dan diinokulasikan ke dalam 45 ml medium BHMS cair, lalu diinkubasi dalam “shaker incubator” selama lima hari pada suhu 30 oC dengan laju pengocokan 120 rpm. Selanjutnya diencerkan sampai 106, masing-masing pengenceran tersebut diambil sebanyak 1 ml dicampur dengan medium BHMS agar sampai merata, kemudian dituang ke dalam cawan petri steril, setelah medium BHMS agar dalam cawan perti memadat kemudian diinkubasi pada suhu 30 oC sampai ditemukan koloni bakteri yang tumbuh (lima hari).(18), (22).
(26)
resuspensi
x disuspensikan 4,5 g tanah rizosfir + 45 ml BHMS cair
x inkubasi 30 oC, 5 hari, dengan laju rotasi 120 rpm
Kultur tanah rizosfir
Suspensi
x diencerkan sampai 106
x ditumbuhkan pada medium lempeng agar BHMS
Koloni pada medium lempeng agar BHMS
Koloni diduga murni Koloni belum murni
x pewarnaan gram
Koloni murni Koloni belum murni
Kultur stok isolat murni inokulasi ke agar miring x
Kemurnian koloni ditentukan dengan uji pewarnaan Gram, jika warna dan bentuk selnya seragam berarti koloni sudah murni, tetapi jika warna dan bentuk selnya tidak seragam berarti koloni belum murni. Jika diperoleh koloni belum murni disuspensi ulang dan dikultur kembali pada medium BHMS padat dalam cawan petri, pekerjaan ini dilakukan sampai mendapatkan koloni yang murni (gambar 3.1.).
3.2.3. Seleksi dan Identifikasi Isolat
Selanjutnya isolat yang sudah diketahui mampu mendegradasi residu disebut sebagai isolat terpilih dan dibuat kultur persediaan.(21)
Isolat bakteri rizosfir yang terpilih dari hasil seleksi selanjutnya diidentifikasi. Tahapan identifikasi yang dilakukan meliputi: pengujian morfologi koloni, morfologi sel, sifat Gram, ada tidaknya endospora, pengujian biokimia yang terdiri atas: uji glukosa, laktosa, manitol, maltosa, sakarosa, IMViC, H2S, urea, motilitas, arabinosa, manosa, salisin, xilosa,
hidrolisis pati, gelatin, dan haemolisis. Selanjutnya untuk menentukan spesies isolat bakteri yang diperoleh, hasil pengujian pada tahap identifikasi dicocokan dengan buku Bergey’s Manual of Determinative Bacteriology.(7)
3.2.4. Optimasi rasio N:P dari KNO3 dan K2HPO4 dan kadar residu
medium
Masing-masing isolat terpilih yang telah diremajakan pada medium Zobell agar miring umur sekitar 48 jam dibuat suspensi dengan cara menginokulasikan masing-masing isolat sebanyak 1 ose ke dalam 10 ml larutan garam fisiologis dan dikocok sampai homogen. Suspensi masing-masing isolat diinokulasikan sebanyak 10% (v/v) ke dalam medium modifikasi Soeminarti cair dengan variasi rasio N:P = 5:1, 10:1 dan 15:1. Kultur diinkubasi pada suhu 30 oC selama lima hari. Masing-masing isolat pada masing-masing medium dengan berbagai rasio N:P tersebut dihitung jumlah selnya. Pada medium dengan rasio N:P yang menunjukkan jumlah sel bakteri paling tinggi berarti rasio N:P tersebut paling baik.
larutan garam fisiologis dan dikocok sampai homogen. Suspensi masing-masing isolat diinokulasikan sebanyak 10% (v/v) ke dalam medium modifikasi Soeminarti cair dengan kadar residu 5%, 10%, 15%, 20% dan 25% (v/v). Kultur diinkubasi pada suhu 30 oC selama lima hari. Masing-masing isolat pada Masing-masing-Masing-masing medium dengan berbagai kadar residu dihitung jumlah selnya. Pada medium dengan kadar residu yang menunjukkan jumlah sel bakteri paling tinggi berarti kadar residu tersebut yang paling baik untuk pertumbuhannya.
3.2.5. Penentuan kurva pertumbuhan isolat bakteri
Masing-masing isolat yang terpilih ditentukan kurva pertumbuhannya. Penentuan kurva pertumbuhan dilakukan dengan cara menginokulasikan masing-masing isolat pada medium Soeminarti cair dengan rasio N:P dan kadar residu optimal. Kultur diinkubasi pada suhu 30
o
g
= waktu generasit
X
= jumlah sel bakteri pada waktu akhir (tx)0
X
= jumlah sel bakteri pada waktu awal (t0)t
= waktu inkubasi dari t0 - tx3.2.6. Rancangan percobaan pengujian kemampuan degradasi isolat
bakteri rizosfir
Pengujian kemampuan isolat bakteri rizosfir dalam mendegradasi residu minyak bumi menggunakan rancangan dasar Rancangan Acak Lengkap (RAL) berpola faktorial.(24) Isolat bakteri rizosfir yang terpilih dalam bentuk kultur tunggal maupun campurannya diinokulasikan ke dalam medium Soeminarti yang ditambah residu minyak bumi dengan berbagai pH medium yang berbeda. Jadi faktor yang dicoba dalam rancangan percobaan ini terdiri atas:
(1) Jenis isolat bakteri rizosfir (I) yang terpilih meliputi
empat taraf:
i0 : tanpa isolat bakteri rhizosfir
i1 : isolat -1 bakteri rhizosfir
i2 : isolat -2 bakteri rhizosfir
i3 : isolat -3 bakteri rhizosfir
i4 : campuran isolat 1, 2, dan 3
(2) pH medium (M) meliputi tiga taraf:
m1 : medium dengan pH 6
m2 : medium dengan pH 7
sehingga jumlah kombinasi perlakuan ada 15 unit dan masing-masing diulang dua kali. Setiap unit perlakuan menggunakan erlenmeyer 250 ml yang diisi 150 medium Soeminarti dengan rasio N:P dan kadar residu optimal. Suspensi isolat yang ditambahkan sebanyak 10% (dengan jumlah sel
r 106/ml) dari volume medium. Setiap unit perlakuan diinkubasi pada suhu
30 oC pada “shaker incubator” dengan laju pengocokan 120 rpm selama 14 hari.(26) Selanjutnya dilakukan pengukuran variabel-variabel yang menunjukkan terjadinya degradasi residu minyak bumi.
Model linier dari rancangan percobaan penelitian ini dapat dituliskan sebagai berikut:
Yijk : nilai variabel yang diukur pada unit percobaan ke-k
yang memperoleh kombinasi perlakuan ij.
P : nilai rata-rata variabel yang sesungguhnya
Di : pengaruh pemberian faktor inokulum ke-i
Ej : pengaruh yang disebabkan oleh faktor pH awal
medium ke-k
(DE)ij : pengaruh interaksi antara faktor macam inokulum ke-i
dan pH awal medium ke-j
Hijk : pengaruh kesalahan percobaan pada unit percobaan
3.2.7. Pengukuran Variabel gelas tersebut. Selanjutnya penentuan viskositas digunakan persamaan berikut:
dimana: K : koefisien viskositas dinamik (Pa.s) r : jari-jari bola logam (m)
g : gaya gravitasi bumi (m/s2)
U : kerapatan bola logam (kg/m3)
Uo : kerapatan residu (kg/m3)
nilai viskositas yang diperoleh dikonversi menjadi viskositas kinematik
menggunakan persamaan berikut:
o
v
U
K
dalam satuan m2/s, selanjutnya
satuan viskositas kinematik yang digunakan adalah mm2/s yang setara dengan sentistock (cSt).
3.2.7.2. Pengukuran gravitasi spesifik
Gravitasi spesifik diukur dengan cara membandingkan kerapatan residu (kg/m3) dengan kerapatan akuades (kg/m3) pada suhu 30 oC. Kerapatan akuades pada suhu 30 oC terukut 1008,436 kg/m3.
3.2.7.3. Pengukuran residu terlarut
3.2.7.4. Pengukuran berat residu akhir
Berat residu akhir diukur dengan cara menimbang total residu pada akhir pengamatan yang telah dipisahkan dari fase media (air) dalam satuan gram.
3.2.7.5. Pengukuran pH
pH awal dan akhir medium diukur menggunakan alat pH meter manual Fisher pada suhu 30 oC. Persen penurunan pH dihitung dengan cara :
%
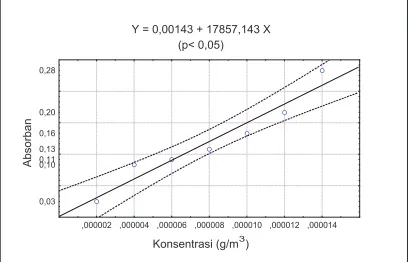
Gambar 3.2. Kurva standar yang digunakan untuk pengukuran residu terlarut
3.2.7.6. Penghitungan jumlah sel bakteri
Penghitungan jumlah sel bakteri dilakukan menggunakan metode angka lempeng total dan pelaporannya menggunakan angka lempeng standar. Sebelum jumlah sel bakteri dihitung masing-masing kultur dalam erlenmeyer dikocok terlebih dahulu sampai tercampur antara fase residu dengan fase media, kemudian diambil sampel untuk dihitung jumlah bakterinya dalam satuan sel/ml mulai hari ke-0 sampai hari ke-14. Data jumlah sel bakteri yang diperoleh dari masing-masing taraf faktor inokulum dibuat kurva sehingga dapat ditunjukkan hubungan antara jumlah sel dengnan waktu. Masing-masing kurva yang diperoleh ditentukan laju
pembelahannya (r) dengan persamaan
>
@
t
x
x
r
3
,
32
log
tlog
o ,dimana:
t
X
= jumlah sel bakteri pada waktu akhir (tx)0
X
= jumlah sel bakteri pada waktu awal (t0)t
= waktu inkubasi dari t0 - txsehingga dapat ditentukan kenaikan jumlah sel per unit waktu.(11)
3.2.8. Metode analisis data
Data yang diperoleh dari setiap variabel yang diukur dianalisis dengan analisis ragam dan jika hasilnya menunjukkan perbedaan yang nyata,
BAB IV
HASIL DAN PEMBAHASAN
4.1. Isolasi dan Pemurnian
Jumlah isolat bakteri yang diperoleh dari rizosfir tumbuhan bakau di Cilacap setelah dimurnikan adalah delapan macam. Enam macam isolat dari dearah Tritih dan dua macam isolat dari daerah Donan. Hasil tersebut menunjukkan bahwa isolat dari daerah Tritih lebih banyak macamnya dibandingkan dengan isolat dari daerah Donan, hal ini mungkin disebabkan karena di daerah Tritih belum tercemar oleh residu, sedangkan di daerah Donan sudah tercemar oleh residu. Belum tercemarnya daerah Tritih oleh residu menyebabkan bakteri rizosfir yang sensitif terhadap residu masih mampu bertahan hidup dan tumbuh.
4.2. Seleksi dan Identifikasi Isolat Bakteri
Hasil seleksi tahap I menunjukkan bahwa semua isolat bakteri rizosfir yang diperoleh yaitu isolat dengan kode Dam-1, Trm-2, 2, Tra-1, Trm-3, Tbg-Tra-1, Dra-Tra-1, dan Trm-1 mampu tumbuh pada kondisi medium yang mengandung residu minyak bumi. Pada seleksi tahap II hanya tiga dari delapan jenis isolat yang mampu tumbuh yaitu isolat dengan kode Dam-1, Trm-2, danTra-2.
Seleksi tahap I dilakukan untuk menentukan isolat bakteri rizosfir yang mampu bertahan hidup dan tumbuh pada kondisi lingkungan yang mengandung residu minyak bumi, walaupun isolat bakteri tersebut belum tentu mampu memanfaatkan residu minyak bumi sebagai sumber karbon dan energi. Medium Zobell yang digunakan pada seleksi tahap I merupakan medium kaya nutrisi, karena mengandung pepton (5 g/l) dan ekstrak ragi (1 g/l), pada medium tersebut bakteri rizosfir yang tahan terhadap residu tetapi tidak dapat memanfaatkan residu tersebut sebagai sumber karbon diduga masih tetap dapat tumbuh dan bertahan hidup dengan cara memanfaatkan nutrisi dari medium. Pada seleksi tahap I, isolat yang tidak tahan terhadap keberadaan residu minyak bumi dan tidak dapat memanfaatkan residu minyak bumi sebagai sumber karbon dan energi, isolat tersebut akan mati dan tidak tumbuh.
Seleksi tahap II bertujuan untuk menentukan isolat bakteri yang tahan terhadap keberadaan residu minyak bumi dan mampu memanfaatkannya sebagai sumber karbon dan energi. Oleh karena itu medium yang digunakannya merupakan medium yang miskin nutrisi, karena hanya mengandung ekstrak ragi 0,01 g, KNO3 0,1 g dan K2HPO4 0,1 g per
liter medium. Sumber karbon yang utama dalam medium tersebut berupa senyawa hidrokarbon dalam bentuk residu, sehingga isolat bakteri yang tahan terhadap keberadaan residu minyak bumi tetapi tidak dapat memanfaatkannya sebagai sumber karbon dan energi, maka isolat tersebut tidak mampu tumbuh dan bertahan hidup. Dengan demikian isolat bakteri rizosfir yang lolos pada seleksi tahap I belum tentu lolos seleksi tahap II.
limbah residu minyak bumi mempunyai kemampuan untuk mendegradasi residu minyak bumi tersebut dengan cara memanfaatkannya sebagai sumber karbon dan energi. Jadi dimungkinkan masih banyak bakteri yang hidup di lingkungan tercemar residu minyak bumi, tetapi tidak mempunyai kemampuan untuk mendegradasi residu yang mencemarinya.
Isolat bakteri rizosfir yang tidak dapat memanfaatkan residu sebagai sumber karbon, tidak dapat tumbuh dan bertahan hidup pada medium seleksi tahap II. Jadi tiga jenis isolat bakteri rizosfir yang terpilih melalui seleksi tahap II merupakan isolat bakteri rizosfir yang mampu bertahan hidup dan tumbuh dengan cara memanfaatkan residu sebagai sumber karbon dan energi.
Hasil identifikasi menunjukkan bahwa dari delapan isolat bakteri yang diperoleh, tujuh isolat bersifat Gram negatif, tidak berspora dan satu isolat bersifat Gram positif, berspora. Hasil identifikasi selengkapnya untuk masing-masing isolat terdapat pada tabel 4.1. Sedangkan tiga macam isolat bakteri rizosfir yang terpilih melalui seleksi tahap pertama dan tahap kedua adalah isolat-1 dengan kode Dam-1 teridentifikasi sebagai Achromobacter
sp., isolat-2 dengan kode Trm-2 teridentifikasi sebagai Pseudomonas
vesicularis dan isolat-3 dengan kode Tra-2 teridentifikasi sebagai Bacillus
brevis. Hasil identifikasi selengkapnya untuk masing-masing isolat terpilih
terdapat pada tabel 4.2.
Adapun senyawa organik yang dapat merangsang kelompok bakteri tersebut diantaranya asam-asam amino dan bermacam-macam gula. Beberapa asam amino dan gula tertentu dalam rizosfir terbukti dapat merangsang bakteri
Pseudomonas lachryman dan Escherichia coli yang termasuk ke dalam
kelompok bakteri bentuk batang, Gram negatif, dan tidak membentuk spora.(28)
4
Tbg : Tritih rizosfir Bruguiera gymnorrhiza
Dra : Donan rizosfir Rhizophora apiculata
Bentuk sel
Ket.:Dam: Donan rizosfir Avecennia marina
Tra : Tritih rizosfir Rhizophora apiculata
Trm: Tritih rizosfir Rhizophora mucronata
Tabel 4.2. . Karakteristik tiga isolat bakteri rizosfir terpilih
g BentukTepi sirkulerrata sirkulerbergerigi sirkulerrata
Elevasi cembung cembung cembung Pertumb. pd. agar miring bergerigi bercabang merata Bentuk sel dan sifat gram kokoid (-) basil (-) basil (+)
Endospora tidak ada tidak ada ada
A
rizosfir A. marina R. mucronata R. apiculata
Gambar 4.4. Morfologi sel bakteri rizosfir isolat-2 (Pseudomonas
vesicularis) dengan perbesaran 2000X. Mempunyai
bentuk sel basil dan bersifat Gram negatif
Gambar 4.5. Morfologi sel bakteri rizosfir isolat-3 (Bacillus brevis) dengan perbesaran 2000X. Mempunyai bentuk sel basil
4.3. Optimasi Rasio N:P dan Kadar Residu Medium
Hasil optimasi rasio N:P pada medium pertumbuhan menunjukkan bahwa medium dengan rasio N:P = 10:1 merupakan medium yang paling baik untuk pertumbuhan ketiga isolat terpilih, karena pada medium dengan rasio N:P= 10:1 menunjukkan jumlah sel ketiga isolat terpilih paling tinggi dibandingkan dengan jumlah sel pada medium dengan rasio N:P yang lain. Hasil selengkapnya jumlah sel masing-masing isolat pada medium dengan rasio N:P yang dicoba tercantum pada gambar 4.6. dan lampiran 1. Hasil tersebut tidak sesuai dengan salah satu teori yang menyatakan bahwa untuk mengubah senyawa hidrokarbon menjadi senyawa penyusun sel bakteri diperlukan N dan P dengan perbandingan 5:1.(20) Namun demikian hasil tersebut sesuai dengan rasio N:P medium pertumbuhan bakteri yang disarankan oleh Thomas dkk. yaitu sebaiknya rasio N:P medium untuk pertumbuhan bakteri adalah 10:1.(25) Fenomena di atas menunjukkan adanya perbedaan kebutuhan sumber N pada proses degradasi hidrokarbon oleh bakteri. Hal ini terjadi diduga berkaitan dengan penggunaan sumber N untuk sintesis enzim yang dimiliki oleh bakteri tersebut. Bakteri yang memiliki banyak enzim baik kualitas maupun kuantias akan membutuhkan sumber N lebih banyak dibandingkan dengan bakteri yang memiliki sedikit enzim. (16)
sel, maka unsur N dibutuhkan lebih banyak dibandingkan dengan unsur P. Asam nukleat terutama ARN berkaitan erat dengan biosintesis protein, supaya biosintesis protein dapat memenuhi kebutuhan sel, maka ketersediaan unsur N dan P dalam medium harus memenuhi rasio tertentu.
Hasil optimasi kadar residu medium menunjukkan bahwa
Achromobacter sp. mencapai jumlah sel maksimum pada medium dengan
kadar residu 5%, Pseudomonas vesicularis dengan kadar residu 15% dan
Bacillus brevis dengan kadar residu 20%. Walaupun demikian ketiga isolat
terpilih mampu tumbuh dengan baik pada medium dengan kadar residu 20%. Jumlah sel ketiga isolat pada medium tersebut mencapai lebih dari 107 sel/ml setelah diinkubasi 5 hari. Jumlah sel masing-masing isolat pada medium
Gambar 4.6. Jumlah sel masing-masing isolat pada medium Soeminarti dengan berbagai rasio N:P dan pH medium 7,
dengan berbagai kadar residu yang dicoba tercantum pada gambar 4.7. dan lampiran 2.
Pada tahap optimasi kadar residu menunjukkan bahwa masing-masing isolat mencapai jumlah sel maksimum pada medium dengan kadar residu yang berbeda. Ini menunjukkan bahwa kebutuhan sumber karbon dalam bentuk residu bagi masing-masing isolat adalah berbeda. Residu yang terlalu banyak tidak seluruhnya akan dimanfaatkan, demikian juga jika residu terlalu sedikit kebutuhan unsur karbon tidak dapat terpenuhi. Hal ini menunjukkan bahwa bakteri akan menggunakan residu sebagai sumber karbon sesuai dengan kebutuhan.
Residu terdiri atas senyawa hidrokarbon yang dapat digunakan sebagai sumber karbon (C) bagi bakteri. Penggunaan sumber C bagi bakteri tidak dapat lepas dari tersedianya sumber unsur lain seperti N dan P, karena komponen yang diperlukan untuk pertumbuhan terdiri atas senyawa-senyawa yang tersusun oleh ketiga unsur tersebut. Jadi dalam hal ini terdapat suatu keterkaitan antara kebutuhan C, N dan P, sehingga dalam medium yang baik untuk pertumbuhan bakteri harus ada sumber C, N dan P yang seimbang dalam rasio tertentu.(13), (25)
Unsur C diperlukan oleh bakteri sebagian besar untuk menyusun struktur sel misalnya dalam bentuk karbohidrat, lemak dan protein, sedangkan unsur N disamping sebagai penyusun struktur sel seperti protein struktural juga sebagai penyusun enzim dalam bentuk protein enzim atau protein fungsional. Kegunaan unsur P bagi bakteri diantaranya adalah untuk biosintesis ADN dan ARN dalam bentuk fosfat, disamping itu diperlukan juga untuk biosintesis NADP dan ATP dalam bentuk fosfat berenergi tinggi. Dengan demikian proporsi kebutuhan ketiga unsur tersebut bagi bakteri secara berurutan adalah C > N > P dalam rasio tertentu.(16)
4.4. Penentuan Kurva Pertumbuhan Isolat Terpilih
berkisar antara 6 – 8 hari. Disamping itu waktu generasi terpendek yang dicapai pada fase eksponensial oleh masing-masing isolat terpilih adalah berbeda.
Isolat-1 (Achromobacter sp.), fase eksponensialnya dimulai sehari setelah waktu inokulasi dan berlangsung selama 7 hari. Jumlah sel isolat tersebut selama fase eksponensial berkisar antara 105 - 1012 per ml. Sedangkan waktu generasi terpendeknya pada fase eksponensial adalah 6 jam dengan jumlah sel 5,5x1011 per ml yang dicapai pada hari ke 6 setelah inokulasi.
Gambar 4.8. Kurva pertumbuhan ketiga macam isolat bakteri rizosfir terpilih pada medium modifikasi Soeminarti
Isolat-2 (Pseudomonas vesicularis) memulai fase eksponensialnya juga sehari setelah waktu inokulasi dan berlangsung selama 8 hari. Jumlah sel selama fase eksponensial berkisar antara 105 – 1013 per ml dan waktu generasi terpendeknya pada fase eksponensial adalah 6,5 jam dengan jumlah sel 3,0x1012per ml yang dicapai pada hari ke-7 setelah inokulasi.
Isolat-3 (Bacillus brevis) juga memulai fase eksponensialnya sehari setelah waktu inokulasi dan berlangsung selama 6 hari. Jumlah sel selama fase eksponensial berkisar antara 106 – 1012 per ml. Waktu generasi terpendek pada fase eksponensial adalah 4,8 jam dengan jumlah sel 4,6x1012 per ml yang dicapai pada hari ke-5 setelah inokulasi.
Waktu generasi yang dibutuhkan oleh bakteri berbanding terbalik dengan kecepatan pertumbuhannya. Semakin singkat waktu generasi yang dibutuhkan maka semakin cepat pertumbuhan bakteri tersebut.(6) Berdasarkan waktu generasi terpendek pada fase eksponensial, maka, masing-masing isolat terpilih mempunyai kecepatan pertumbuhan yang berbeda. Isolat yang memiliki pertumbuhan paling cepat adalah Bacillus
brevis, disusul oleh Achromobactersp. kemudian Pseudomonas vesicularis.
waktu lebih lama.(16) Jadi ketiga isolat terpilih yang mampu menggunakan residu sebagai sumber karbon dan energi secara genetik memiliki kecepatan yang berbeda pada proses pembelahan selnya.
4.5. Pengujian Kemampuan Isolat Dalam Mendegradasi Residu Minyak Bumi
Hasil pengujian kemampuan isolat dalam mendegradasi residu minyak bumi yang diindikasikan dengan sifat fisika-kimia yang meliputi viskositas, gravitasi spesifik, kadar residu terlarut, berat residu akhir, dan penurunan pH medium serta jumlah total sel bakteri adalah sebagai berikut:
4.5.1. Viskositas residu
Pemberian faktor inokulum dan pH medium masing-masing berpengaruh nyata terhadap nilai viskositas residu, tetapi pengaruh interaksi antar kedua faktor tersebut tidak nyata. Fenomena ini menunjukkan bahwa antara faktor inokulum dan pH medium dalam mempengaruhi nilai viskositas residu, bekerja secara terpisah tidak saling ketergantungan. Dengan kata lain pengaruh pemberian faktor inokulum terhadap nilai viskositas residu adalah sama pada setiap pH medium yang dicoba. Hasil analisis varian data viskositas residu tercantum pada lampiran 5.
Masing-masing nilai viskositas residu akibat pemberian taraf faktor inokulum kultur tunggal Achromobacter sp., Pseudomonas vesicularis dan
Bacillus brevis berkisar diantara nilai viskositas residu akibat pemberian
kultur campurannya dan kontrol. Pemberian faktor inokulum dalam bentuk kultur tunggal Achromobacter sp. menunjukkan nilai viskositas terendah (28,97 cSt), jika dibandingkan dengan kultur tunggal lainnya. Pemberian faktor inokulum kultur campur menunjukkan viskositas paling kecil yaitu 22,88 cSt, hal ini diduga semua isolat pada kultur campur tersebut bekerja mendegradasi residu dengan memanfaatkan komponen residu yang sesuai untuk masing-masing isolat, sehingga dihasilkan fraksi yang lebih sederhana dalam jumlah banyak. Banyaknya fraksi sederhana tersebut menyebabkan menurunnya nilai viskositas. Grafik pengaruh utama pemberian faktor inokulum terhadap viskositas residu tercantum pada gambar 4.9.
Nilai viskositas residu yang disebabkan oleh pemberian faktor inokulum pada masing-masing kultur tunggal dan campurannya menunjukkan adanya penurunan dibandingkan dengan kontrol, sedangkan untuk faktor pH medium, nilai viskositas yang paling kecil ditunjukkan pada pH medium 7 yaitu 35,99 cSt, jika dibandingkan dengan nilai viskositas residu pada pH medium 6 yang mencapai 38,27 cSt dan 8 yang mencapai 38,67 cSt. Menurunnya nilai viskositas residu tersebut mengindikasikan residu yang terdapat pada medium uji mengalami degradasi, sehingga perubahan komposisi fraksi hidrokarbon penyusunnya dari fraksi hidrokarbon kompleks dengan berat molekul tinggi menjadi fraksi hidrokarbon yang lebih sederhana dengan berat molekul yang lebih rendah. Perubahan komposisi tersebut akan diikuti dengan menurunnya nilai
Gambar 4.9. Pengaruh utama faktor inokulum terhadap viskositas residu setelah di inkubasi 14 hari.
(Isolat-1=Achromobacter sp., isolat-2= P. vesicularis
viskositas jika dibanding dengan kontrol. Hal ini dapat terjadi karena viskositas senyawa hidrokarbon secara umum akan menurun nilainya, jika fraksi penyusunnya terdiri atas fraksi yang mudah menguap (“volatile fraction”) yang merupakan fraksi dengan berat molekul rendah yang terbentuk akibat proses pemecahan molekul hidrokarbon kompleks.(10) Grafik yang menunjukkan pengaruh utama faktor pH medium terhadap nilai viskositas residu dapat dilihat pada gambar 4.10.
Berdasarkan hasil analisis varian data viskositas residu pada lampiran 5. dapat diterangkan bahwa besarnya pengaruh pemberian faktor inokulum dan pH awal medium terhadap nilai viskositas residu adalah
99,30% yang dapat dirinci menjadi 98,20% merupakan pengaruh faktor inokulum dan 1,10% pengaruh dari pH medium.
Berdasarkan hasil analisis data viskositas tersebut menunjukkan bahwa perlakuan yang terbaik untuk menurunkan viskositas adalah inokulum campuran dengan pH medium 6, 7, atau 8, karena pada setiap pH medium yang dicoba pemberian inokulum campuran menunjukkan nilai viskositas residu yang sama. Dalam bentuk kultur tunggal, Achromobacter sp.
menunjukkan kemampuan menurunkan nilai viskositas residu paling baik dibanding dengan kultur tunggal Pseudomonas vesicularis dan Bacillus
brevispada semua pH medium yang dicoba.
4.5.2. Gravitasi spesifik residu
Pemberian faktor inokulum dan pH medium terhadap gravitasi spesifik residu sama dengan terhadap viskositas yaitu masing-masing faktor berpengaruh nyata terhadap nilai gravitasi spesifik residu, tetapi pengaruh interaksi antar kedua faktor tersebut tidak nyata. Hasil analisis varian data gravitasi spesifik residu akibat pemberian faktor inokulum dan pH medium tercantum pada lampiran 6.
Nilai gravitasi spesifik residu pada medium dengan pH 7 mencapai 0,7075, nilai ini berbeda nyata dengan nilai gravitasi spesifik pada medium dengan pH 6 yaitu 0,7277 dan 8 yaitu 0,7294, tetapi nilai gravitasi spesifik residu pada medium dengan pH 6 dan 8 berbeda tidak nyata. Turunnya nilai gravitasi spesifik pada medium dengan pH 7, jika dibandingkan dengan nilai gravitasi spesifik pada medium dengan pH 6 dan 8, diduga berkaitan dengan proses degradasi secara enzimatis yang dilakukan oleh masing-masing isolat seperti terjadinya penurunan viskositas yang telah diterangkan di atas. Hasil selengkapnya pengaruh faktor pH medium terhadap gravitasi spesifik tercantum pada tabel 4.4.
Gambar 4.11. Pengaruh utama faktor inokulum terhadap gravitasi spesifik residu setelah masa inkubasi 14 hari.
(Isolat-1 = Achromobactersp, isolat-2 = P. vesicularis
5
5
Nilai gravitasi spesifik berkaitan erat dengan nilai viskositas, senyawa hidrokarbon yang mempunyai nilai gravitasi spesifik rendah, maka viskositasnya juga rendah. Jadi hubungan antara gravitasi spesifik dengan viskositas berbanding lurus, yang berarti peningkatan gravitasi spesifik akan diikuti oleh peningkatan viskositas dan sebaliknya.(10) Grafik yang menunjukkan pengaruh utama faktor pH medium terhadap nilai gravitasi spesifik residu dapat dilihat pada gambar 4.12.
Berdasarkan hasil analisis varian data gravitasi spesifik residu pada lampiran 6. dapat diterangkan bahwa besarnya pengaruh pemberian faktor inokulum dan pH medium terhadap nilai gravitasi spesifik residu adalah 99,40% yang dapat dirinci menjadi 98,39% merupakan pengaruh faktor inokulum dan 1,01% pengaruh dari pH medium.
Perlakuan yang terbaik untuk menurunkan nilai gravitasi spesifik adalah inokulum campuran dengann pH medium 6, 7 atau 8, karena pada
semua pH medium yang dicoba, pemberian inokulum campuran menunjukkan nilai gravitasi spesifik residu yang sama. Dalam bentuk kultur tunggal, Achromobacter sp. menunjukkan kemampuan menurunkan nilai gravitasi spesifik residu paling baik dibanding Pseudomonas vesicularis dan
Bacillus brevis.
4.5.3. Residu terlarut
Pemberian faktor inokulum dan pH medium masing-masing berpengaruh nyata terhadap nilai residu terlarut tetapi pengaruh interaksi antar kedua faktor tersebut tidak nyata, fenomena ini menunjukkan bahwa antara faktor macam inokulum dan pH medium dalam mempengaruhi nilai residu terlarut, juga bekerja secara terpisah tidak saling ketergantungan. Dengan kata lain pengaruh faktor pemberian faktor inokulum terhadap nilai residu terlarut sama pada setiap pH medium yang dicoba. Hasil analisis varian data residu terlarut akibat pemberian faktor inokulum dan pH medium tercantum pada lampiran 7.
Banyaknya residu terlarut pada semua taraf faktor macam inokulum berbeda nyata dengan banyaknya residu terlarut pada medium tanpa inokulum (kontrol) yaitu 0,000039 g/m3, tetapi pada medium yang diberi inokulum campuran banyaknya residu terlarut sebesar 0,000396 g/m3 berbeda tidak nyata dengan banyaknya residu terlarut yang diberi inokulum kultur tunggal Bacillus brevis yaitu 0,000375 g/m3. Dalam bentuk kultur tunggal, residu terlarut pada medium yang diinokulasi dengan kultur tunggal Bacillus
brevis sebesar 0,000375 g/m3, merupakan nilai residu terlarut yang paling
Achromobacter sp. 0,000208 g/m3. Hasil tersebut menunjukkan bahwa kemampuan inokulum kultur tunggal Bacillus brevis sama dengan inokulum campuran dalam mendegradasi residu yang menghasilkan fraksi bersifat larut dalam air, tetapi paling baik jika dibandingkan dengan kultur tunggal isolat lainnya. Fenomena tersebut menunjukkan pada kultur campuran isolat yang bekerja memecah komponen residu menjadi fraksi yang larut dalam air didominasi oleh Bacillus brevis. Hasil selengkapnya residu terlarut yang diakibatkan oleh pemberian faktor inokulum dapat dilihat pada tabel 4.3.
Gambar 4.13. Pengaruh utama faktor inokulum terhadap residu terlarut setelah diinkubasi 14 hari.
(Isolat-1=Achromobacter sp., isolat-2= P. vesicularis
& isolat-3=B. brevis)