1
BAB I PENDAHULUAN
A. Latar Belakang Masalah
Seiring dengan perkembangan zaman, kebutuhan manusia akan obat juga semakin berkembang. Hal ini sejalan dengan prevalensi penyakit yang semakin sering bermunculan. Usaha penemuan obat baru baik dari bahan alam maupun sintetik terus dilakukan untuk mencapai efektifitas terapi yang optimal. Obat-obat baru diharapkan dapat menjadi obat pilihan dengan efek maksimal, efek samping minimal serta toksisitas yang minimal. Salah satu upaya untuk mengetahui hal tersebut, maka dilakukan berbagai penelitian spesifik tentang obat agar diketahui katakteristik suatu obat baik bagaimana efeknya di dalam tubuh maupun bagaimana nasib obat di dalam badan.
Salah satu senyawa yang telah berhasil disintesis dari alam adalah senyawa kurkumin yang telah diketahui memiliki berbagai macam efek terapi yang menguntungkan. Akan tetapi usaha sintesis dalam jumlah banyak mengalami kendala dikarenakan senyawa kurkumin selalu berada dalam dua substituen yang berbeda yaitu demetoksi kurkumin dan bis-demetoksi kurkumin. Oleh karena itu, dalam perkembangannya dilakukan modifikasi terhadap kurkumin untuk memperoleh senyawa yang lebih poten, stabil, aman, efektif, dan memiliki aktivitas yang lebih spesifik. Telah disintesis senyawa turunan dan analog kurkumin untuk dapat dikembangkan lebih lanjut, diantaranya adalah Pentagamavunon-0 (PGV-0), Pentagamavunon-1 (PGV-1), dan Gamavuton (GVT-0). Selain itu masih banyak
senyawa analog dan turunan kurkumin yang telah berhasil disintesis, misalnya Pentagamavunon-2 (PGV-2), Kalium Gamavuton (K2GVT-0), Diasetil Gamavuton-0 (diasetil-GVT-0), 0 (HGV-0), Heksagamavunon-1 (HGV-Heksagamavunon-1) dan Kalium Monogamavuton-0 (KMGVT-0).
Dari studi praklinik sebelumnya di laporkan bahwa Garam Kalium 4-(4’-hidroksi-3’-metoksifenil)-3-buten-2-on (garam kalium mono-GVT-0), KMGVT-0 aktif sebagai antioksidan, analgetik, dan antiinflamasi melalui mekanisme penghambatan enzim Cox (Nugroho et al., 2006; Yuniarti et al., 2007; Nugroho et al., 2007). KMGVT-0 sendiri merupakan bentuk garam dari monogamavuton (dehydrozingerone).
Monogamavuton (dehydrozingerone) dilaporkan memiliki spektrum farmakologi yang sangat luas (Hampannavar, et al., 2016) dan dengan diubahnya monogamavuton kedalam bentuk garam menjadi KMGVT-0 diharapkan akan memiliki kelarutan yang lebih baik dibanding pendahulunya (monogamavuton). Dengan kelarutan yang baik diharapkan akan memberikan bioavaibilitas yang baik pula baik secara oral maupun parenteral. Selain itu karena bentuknya berupa garam diharapkan dapat dibuat menjadi sediaan dengan pembawa air sehingga lebih ramah bagi tubuh.
Sampai saat ini belum pernah dilakukan penelusuran profil farmakokinetika dari senyawa KMGVT-0 baik dari pemberian secara oral, injeksi intravena, maupun secara intraperitoneal. Sehingga penelitian ini perlu dilakukan dalam rangka mengetahui profil absorbsi, distribusi, metabolisme, dan eliminasi dari senyawa
KMGVT-0. Pemberian secara intravena antara lain memiliki keuntungan karena tidak harus melalui proses absorpsi, selain itu obat juga terbebas dari proses metabolisme awal yang biasanya terjadi pada pemberian obat secara oral ketika melewati hepar. Selain itu pemberian intravena juga sangat menguntungkan saat digunakan pada keadaan mendesak bagi pasien.
Penelusuran profil farmakokinetika akan dilakukan dengan cara pemberian secara injeksi intravena pada tikus putih jantan Wistar. Parameter farmakokinetika yang diamati antara lain tetapan kecepatan eliminasi obat (Kel), waktu paro eliminasi (t1/2), Klirens (Cl), volume distribusi (Vd), area under curve (AUC0-t), dan AUC0-inf. Hasil yang diperoleh adalah diketahuinya profil farmakokinetika dari KMGVT-0 yang selanjutnya bisa diketahui bagaimana nasib KMGVT-0 didalam badan yaitu dari mulai obat dilepas, didistribusikan, hingga dieliminasi dari tubuh. Profil farmakokinetika ini penting dalam rangka menuju ’ketepatan pengobatan’ pada pasien, yaitu dalam hal tepat dosis obat untuk mencapai efek farmakologi yang diinginkan dan tepat dalam menentukan frekuensi penggunaan obat. Untuk menjadikan KMGVT-0 sebagai kandidat obat baru, masih banyak penelitian lanjutan drug development yang harus dilakukan, antara lain formulasi obat, uji toksisitas (akut, subkronis, kronis), dan uji klinik. Dengan adanya informasi mengenai profil farmakokinetika obat diharapkan dapat diketahui dosis yang tepat untuk administrasi KMGVT-0, yaitu dosis yang menghasilkan kadar dalam darah selama kurun waktu tertentu dan menimbulkan efek farmakologi. Sehingga kedepannya dapat diteliti lebih lanjut dan dapat dikonversikan untuk dosis manusia
B. Rumusan Masalah
Bagaimana profil farmakokinetika KMGVT-0 setelah pemberian secara intravena pada tikus putih jantan Wistar?
C. Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui profil farmakokinetika KMGVT-0 setelah pemberian secara intravena pada tikus putih jantan Wistar.
D. Manfaat Penelitian 1. Bagi masyarakat
Penelusuran profil farmakokinetika diharapkan dapat dijadikan sebagai sumber informasi untuk pengembangan obat baru yang nantinya dapat bermanfaat bagi masyarakat.
2. Bagi universitas
Penelitian ini diharapkan dapat menjadi penelitian unggulan Universitas Gadjah Mada dan dapat menjadi sumber pengembangan untuk penelitian lebih lanjut khususnya dalam bidang pengembangan obat.
3. Bagi mahasiswa
Penelitian ini dilakukan sebagai syarat penyelesaian studi jenjang S1 Fakultas Farmasi Universitas Gadjah Mada.
E. Tinjauan Pustaka 1. Farmakokinetika
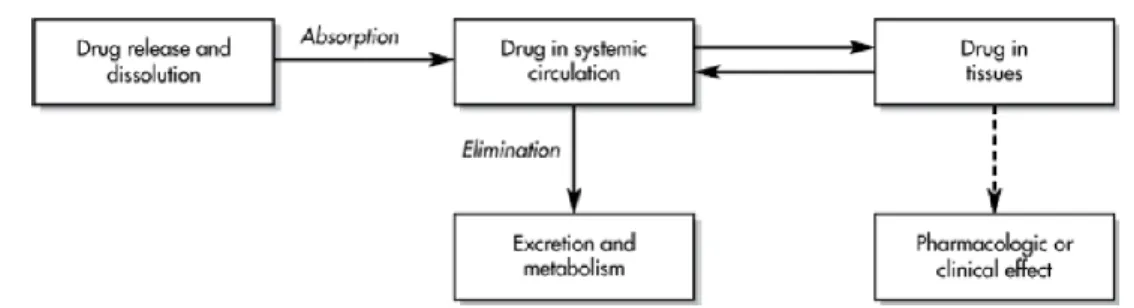
Farmakokinetika atau sering disebut dengan nasib obat dalam tubuh merupakan peristiwa-peristiwa yang dialami obat dalam tubuh. Aksi beberapa obat membutuhkan suatu proses untuk mencapai kadar yang cukup dalam jaringan sasarannya. Dua proses penting yang menentukan kadar obat di dalam tubuh pada waktu tertentu adalah translokasi dari molekul obat dan transformasi senyawa obat. Translokasi obat menentukan proses absorpsi dan distribusi sedangkan transformasi obat menentukan proses metabolisme obat atau proses eliminasi lain yang terlibat dalam tubuh. Farmakokinetika terkait dengan dosis yang menentukan keberadaan obat pada tempat aksinya (reseptor), dan intensitas efek yang dihasilkan sebagai fungsi waktu (Shargel et al., 2005).
Gambar 1. Proses Absorpsi, Distribusi, Metabolisme, dan Ekskresi (ADME) (Shargel et al., 2005)
Proses absorpsi dikaitkan dengan perpindahan obat dari permukaan tubuh (termasuk mukosa dan saluran cerna) atau tempat-tempat tertentu dalam organ menuju aliran darah atau dalam sistem pembuluh limfe. Proses ini dipengaruhi oleh anatomi dan fisiologi tubuh (Shargel & Yu, 1999). Setelah obat diabsorpsi obat akan didistribusikan ke seluruh tubuh melalui aliran darah sistemik. Proses
distribusi ini antara lain dipengaruhi oleh sifat fisika kimia dari obat, serta kecepatan aliran darah itu sendiri. Proses distribusi ini berlangsung hingga ke organ bahkan bisa mencapai bagian-bagian jaringan dan menembus otak untuk obat-obat dengan lipofilisitas tinggi (Shargel & Yu, 1999). Fase terakhir setelah obat didistribusikan adalah obat akan dieliminasi dari tubuh. Proses eliminasi sendiri dibagi menjadi dua proses yaitu, metabolisme dan ekskresi. Pada proses metabolisme secara umum obat akan diubah menjadi metabolitnya yang lebih polar sehingga akan lebih mudah untuk diekskresikan baik melalului ginjal maupun organ lain (Gibson & Skeet, 1991).
Farmakokinetika yang mempelajari absorpsi, distribusi, metabolisme dan ekskresi obat diterangkan oleh beberapa parameter untuk mengukur perubahan variabel fisiologi. Parameter yang digunakan dalam konteks tersebut adalah parameter farmakokinetika (khususnya parameter primer) yang diturunkan secara matematis dari hasil penetapan kadar obat utuh atau metabolitnya di dalam darah atau urin. Pada dasarnya terdapat tiga parameter farmakokinetika yaitu parameter primer, sekunder, dan turunan lainnya (Rowland dan Tozer, 1989; Shargel, 2005).
Parameter-parameter tersebut di atas pada dasarnya sangat dipengaruhi langsung maupun tidak langsung oleh variabel fisiologi tubuh. Dan parameter diatas tergantung dari parameter yang lainnya. Parameter yang harganya dipengaruhi secara langsung oleh satu atau lebih variabel fisiologi terkait adalah parameter primer. Parameter primer meliputi konstanta kecepatan absorpsi (ka), fraksi obat terabsorpsi (fa), volume distribusi (Vd), kliren tubuh total (Cl), kliren hepatik (ClH), dan kliren renal (ClR) (Rowland dan Tozer, 1989).
Parameter yang harganya dipengaruhi oleh parameter primer dinamakan parameter sekunder. Parameter sekunder meliputi tetapan kecepatan ekskresi (ke), waktu paruh eliminasi (t½ eliminasi), dan fraksi obat utuh yang diekskresi lewat urin (fe). Selain itu juga terdapat parameter turunan yang lain, yaitu luas di bawah kurva kadar obat utuh terhadap waktu pengambilan darah (AUC), kadar obat pada keadaan tunak (Css) dan availabilitas oral (F). Harga parameter AUC berguna sebagai ukuran dari jumlah total obat utuh yang mencapai sirkulasi sistemik. Harga parameter AUC dan Css tergantung dari dosis dan kecepatan pemberian obat (Shargel, 2005; Rowland dan Tozer, 1989).
Obat dapat diberikan baik secara ekstravaskuler maupun intravaskuler. Pemberian secara intravaskuler merupakan pemberian obat langsung kedalam darah yang biasanya melalui injeksi intravena atau intraarteri. Pada pemberian intravena tidak ada proses absorpsi sehingga obat langsung masuk ke dalam aliran sistemik. Sedangkan pemberian ekstravaskuler antara lain melalui oral, subkutan, intramuscular, pulmonar, per-rektal, bukal dan sublingual. Pada pemberian ekstravaskuler obat harus terabsorpsi dulu agar masuk aliran sistemik. (Rowland & Tozzer, 1995).
Pemberian secara injeksi intravena banyak memberikan keuntungan diantaranya efek yang timbul akan lebih cepat dibanding pemberian dengan per oral. Selain itu administrasi ini sangat cocok diberikan pada kondisi darurat dan terutama pada pasien yang kurang kooperatif (kondisi tidak sadar). Selain memberikan keuntungan terdapat kekurangan yang dimiliki pada pemberian secara intravena diantaranya adalah diperlukannya tenaga kesehatan dalam
pengadministrasiannya (sukar dilakukan sendiri oleh pasien). Selain itu proses penginjeksiannya harus secara aseptis agar terhindar dari kemungkinan kontaminasi (Ganiswara, 1995).
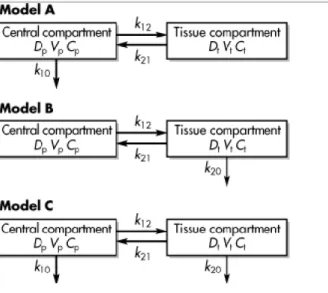
Pada pemberian secara intravena obat yang masuk ke dalam sirkulasi sistemik dapat mengikuti model kompartemen tunggal maupun kompartemen ganda. Pada model kompartemen tunggal obat dianggap langsung terdistribusi ke sirkulasi sistemik tanpa memasuki kompartemen lain (jaringan). Sedangkan pada model kompartemen ganda obat digambarkan terdistribusi ke berbagai kompartemen seperti pada gambar dibawah ini. (Shargel et al., 2005)
Gambar 2. Model Kompartemen Ganda Intravena (Shargel et al., 2005)
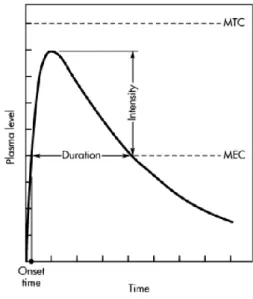
Salah satu aplikasi klinik dari farmakokinetika adalah berguna untuk penentuan nilai konsentrasi efektif minimum (KEM) dan konsentrasi toksik minimum (KTM). Informasi ini penting diketahui pada masing-masing obat guna mengetahui rentang terapetik dari suatu obat. Informasi mengenai rentang terapi
obat dapat digunakan sebagai acuan dalam pemberian regimen dosis obat yang tepat di dalam aplikasi klinik nantinya.
Gambar 3. KEM dan KTM (Shargel, et al., 2005)
Pengetahuan akan farmakokinetika obat memunculkan hubungan dengan farmakodinamika obat. Dalam farmakodinamika, dibahas hubungan antara konsentrasi obat di dalam reseptor (site of actions) dengan interaksi yang ditimbulkannya baik secara fisiologi maupun biokimia. Hal ini penting untuk mengetahui lebih dalam mengenai efek farmakologi suatu obat di dalam badan dan hubungannya dengan konsentrasi yang terukur (PK-PD relationship).
2. Kurkumin
Kurkumin merupakan zat aktif yang terdapat dalam tanaman marga Curcuma, tanaman yang biasa digunakan dalam ramuan tradisional untuk antiinflamasi dan analgetika (Majeed et al., 1995). Kurkumin sendiri dilaporkan
memiliki aktivitas sebagai antiinflamasi dan analgetika yang poten, begitu pula dengan beberapa analog dan turunannya (Majeed et al., 1995; Supardjan et al., 2005).
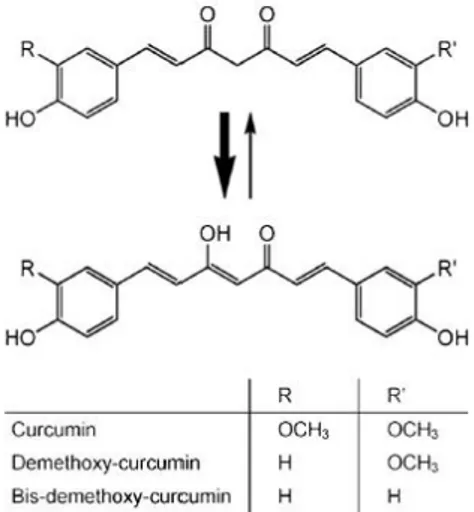
Gambar 4. Struktur Kurkumin (Siviero, et al, 2015)
Studi toksikologi menunjukkan bahwa senyawa kurkumin tidak toksik pada dosis tinggi (Tonnesan & Greenhill, 1992 cit. Alamin, 2006). Konsumsi kurkumin pada dosis hingga 500 mg/kgBB menunjukkan toksisitas minimal pada manusia (Ireson et al., 2001). Akan tetapi kurkumin sebagai senyawa dengan sifat sangat lipofil secara oral ternyata profil absorbsinya sangatlah buruk (Pan et al., 1999). Garam natrium dan kalium dari kurkumin pernah dilaporkan memiliki aktivitas antiinflamasi dan analgetika yang lebih poten dibandingkan kurkumin (Pan et al., 1999). Sebagai bentuk garam, baik garam natrium maupun garam kalium dari kurkumin memiliki kelebihan lain yaitu sangat larut di dalam air, sehingga dapat dibuat sediaan cair yang stabil.
Kurkumin diketahui memiliki efek biologi karena kemampuannya dalam berinteraksi dengan berbagai target molekul di dalam tubuh seperti kemampuannya
menekan beberapa faktor transkripsi sehingga bisa menekan kanker, dapat bereaksi dengan berbagai enzim seperti Cox2, menghambat protein kinase, menghambat produksi sitokin dan hormon pertumbuhan, menghambat reseptor diantaranya Her2/neu pada kanker, dan memiliki kemampuan cell cycle arrest serta memiliki kemampuan adesi terhadap molekul target seperti DNA (Siviero, et al, 2015).
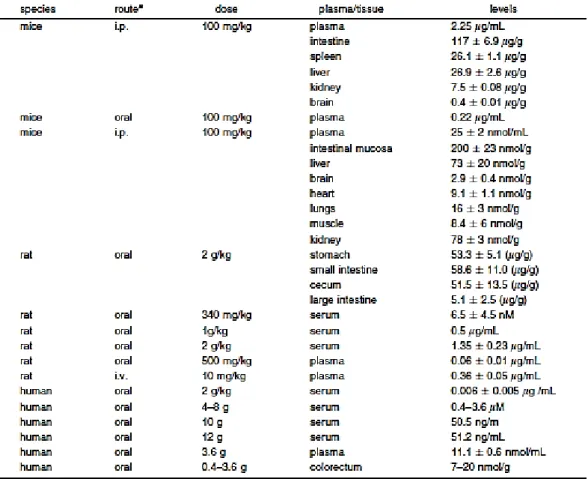
Kurkumin telah lama ditelusuri mengenai bioavaibilitasnya karena diketahui memiliki bioavaibilitas oral yang buruk. Berdasarkan review penelitian (Anand et al., 2007), kurkumin diketahui dapat meningkat bioavaibilitasnya dengan bantuan piperin. Selain itu dalam review tersebut juga dijelaskan mengenai konsentrasi serum yang dapat dicapai oleh kurkumin dari berbagai penelitian yang pernah dilakukan seperti pada tabel I. dibawah ini. Di dalam tabel terlihat bahwa konsentrasi kurkumin yang terdeteksi baik dalam plasma maupun serum sangatlah rendah pada pemberian secara oral. Selain percobaan pada tikus dan mencit (rodensia), kurkumin juga diteliti bioavaibilitasnya pada manusia dan dapat dilihat pada pemberian dosis hingga 2 g/kgBB pada manusiapun kadar kurkumin yang muncul dalam serum masih sangat rendah (0,006 µg/mL)
Berbagai upaya telah dilakukan dalam hal meningkatkan potensi dari kurkumin diantaranya dengan mempelajari bioavaibilitasnya, stabilitasnya, metabolismenya, serta berbagai aktivitas farmakologi dari kurkumin. Dua garis besar yang diambil sebagai upaya peningkatan potensi dari kurkumin adalah dengan melakukan sintesis dan dengan melakukan formulasi sediaan kurkumin. Modifikasi yang banyak dilakukan didasarkan kepada adanya analog kurkumin yang berasal dari alam serta adanya metabolit dari kurkumin yang masih memiliki
efek yang mirip. Hal ini mendorong para peneliti untuk mengembangkan analog kurkumin secara sintesis (Anand et al., 2008).
Tabel I. Kadar Kurkumin dalam Serum dan Jaringan pada Manusia dan Rodensia (Anand, et al., 2007)
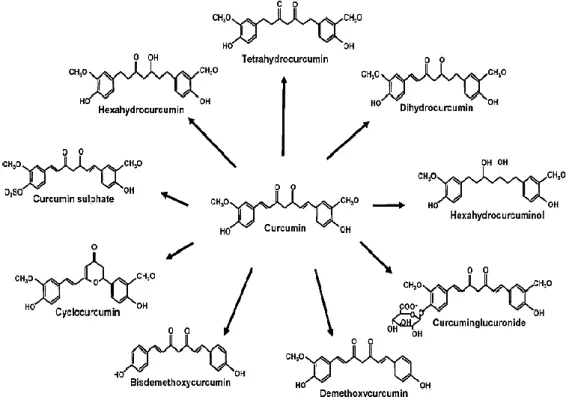
Selain itu dilaporkan pula bahwa metabolit yang terbentuk dari kurkumin menyesuaikan dari rute administrasi kurkumin itu sendiri. Pada pemberian secara oral kurkumin lebih banyak mengalami metabolisme fase II sehingga banyak ditemukan dalam bentuk konjugat dan sulfat. Sedangkan pada pemberian secara oral kurkumin diketahui lebih banyak dimetabolisme pada fase I yaitu dengan proses reduksi menjadi produk yang lebih polar seperti pada gambar 6. dibawah.
Gambar 5. Analog Kurkumin dan Metabolitnya dari Alam (Anand, et al., 2008)
3. Analog Kurkumin : Garam kalium 4-(4’-hidroksi-3’-metoksifenil)-3-buten-2-on) (garam kalium mono-GVT-0, KMGVT-0)
Penelitian terhadap kurkumin telah menghasilkan beberapa turunannya, yang secara garis besar dikelompokkan menjadi tiga kelompok yaitu Heksagamavunon, Pentagamavunon, dan Gamavuton (Sardjiman, 2000).Senyawa turunan dan analog kurkumin yang telah berhasil disintesis antara lain adalah PGV-0, PGV-1, GVT-PGV-0, PGV-2, K2GVT-0, diasetil-GVT-0, HGV-0, HGV-1 dan KMGVT-0. Turunan GVT-0 yaitu garam kalium dari 4-(4’-hidroksi-3’-metoksifenil)-3-buten-2-on) atau disebut juga garam kalium dari mono-GVT-0 (KMGVT-0) merupakan senyawa baru dengan nomor paten IDP000035157 (Supardjan et al., 2013). ) Gamavuton-0 (GVT-0) Pentagamavunon-0 (PGV-0) Heksagamavunon (HGV-0) O H3CO HO OCH3 OH O H3CO HO OCH3 OH Kurkumin Sebagai lead compound
O OC H3 OH CH 3O H O
KMGVT-0
Gambar 7. Analog Kurkumin
Senyawa KMGVT-0 merupakan senyawa analog kurkumin yang pernah dilaporkan sebagai hasil degradasi dari kurkumin. Sebagai garam dari sebuah analog kurkumin, KMGVT-0 dilaporkan memiliki aktivitas sebagai antiinflamasi dan analgetika yang lebih poten dan memiliki kelarutan yang lebih baik dalam air, baik dibandingkan dengan kurkumin maupun parasetamol. KMGVT-0 juga dilaporkan aktif sebagai antioksidan, analgetik, antiinflamasi melalui mekanisme penghambatan enzim Cox (Yuniarti et al., 2007a; Yuniarti et al., 2007b; Nugroho et al., 2007). Berdasarkan hasil penelitian (Mulyani, 2006), KMGVT-0 terbukti memiliki aktivitas menghambat enzim siklooksigenase dengan IC50 sebesar 17,28 µM. Sedangkan penelitian lebih lanjut yang dilakukan oleh (Sayekti, 2011), KMGVT-0 terbukti tidak selektif dalam menghambat aktivitas enzim Cox-2. Hal ini dikarenakan KMGVT-0 juga menghambat enzim Cox-1 sebesar 25,29 µM dan Cox-2 sebesar 103,56 µM.
KMGVT-0 memiliki pemerian berupa serbuk dengan warna merah bata, tidak berbau dan berasa khas, belum melebur pada suhu 200ºC, sangat mudah larut dalam air. Jika dilarutkan dalam air dan diasamkan akan menjadi serbuk berwarna kuning dengan titik lebur 124-127 ºC yang tidak larut dalam air, dan jika serbuk diidentifikasi dengan kromatografi gas – spektrometri massa didapat waktu retensi 17,076 menit dan m/z ion molekuler 192 (100%) (Supardjan, et al, 2013).
O
O O
Proses pembuatan KMGVT-0 relatif lebih mudah dan cepat serta memiliki rendemen yang relatif lebih banyak dibandingkan dengan kurkumin dan parasetamol. Secara ekonomis, produksi senyawa ini diperkirakan cukup murah karena menggunakan bahan-bahan dasar yang murah dan mudah didapat di Indonesia karena diproduksi di Indonesia, yaitu vanillin (hasil fermentasi dari biji tanaman vanili (Vanilla planifolia)), aseton, dan kalium hidroksida. Pemerian senyawa ini berupa serbuk berwarna merah kecoklatan, tidak berbau, dan berasa khas.
Dari studi praklinik untuk mengidentifikasi aktifitas farmakologi dilaporkan KMGVT-0 memberikan efek farmakologi positif sehingga menjanjikan untuk dijadikan kandidat sebagai obat baru. Sampai saat ini belum pernah dilakukan penelusuran profil farmakokinetika dari senyawa KMGVT-0 secara in vivo pada tikus melalui injeksi intravena. Sehingga penelitian ini perlu dilakukan dalam rangka mengetahui profil distribusi, metabolisme, dan eliminasi dari senyawa KMGVT-0.
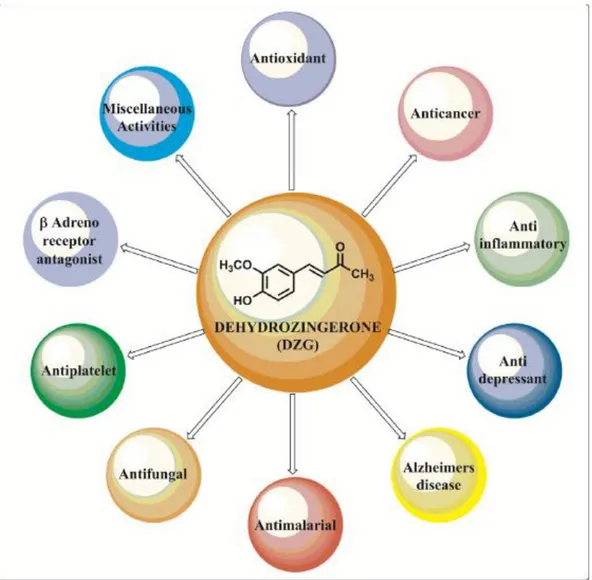
Berdasarkan review terbaru yang dilakukan oleh (Hampannavar et al., 2016), monogamavuton terbukti memiliki efek farmakologi yang luas seperti yang tercantum dalam gambar 8. yaitu sebagai antioksidan, antiinflamasi, antibakteri, antimutagen, antimalaria, antiplatelet, antifungal, bahkan hingga antidepresan dan untuk penyakit alzhaimer. Sehingga sangat menjanjikan untuk ditelusuri lebih lanjut.
Gambar 8. Efek Farmakologi Dehydrozingerone (Monogamavuton) (Hampannavar, et al., 2016)
Kelimpahan efek farmakologi dehydrozingerone (monogamavuton) dikaitkan dengan strukturnya (Gambar 9.) yang merupakan setengah dari kurkumin sehingga memiliki gugus fenolik yang diketahui banyak memberikan efek farmakologi. Monogamavuton diketahui memiliki gugus metoksi posisi ortho terhadap gugus fenolik serta rantai α,β unsaturated carbonyl dengan ujung gugus metil. (Hampannavar, et al., 2016)
Karena efek farmakologi monogamavuton yang cukup luas, banyak peneliti yang melakukan modifikasi terhadap gugus-gugus monogamavuton sehingga memiliki efek yang lebih poten. Salah satunya yang dilakukan oleh (Ratcovic et al., 2016) dengan judul Dehydrozingerone based 1-acetyl-5-aryl-4,5-dihydro-1H-pyrazoles:Synthesis, characterization and anticancer activity menghasilkan bahwa turunan monogamavuton tersebut memiliki efek antimutagen yang kuat.
Gambar 10. Sintesis Turunan Dehydrozingerone (Ratcovic et al., 2016)
4. Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi cair kinerja tinggi dikembangkan sejak tahun 1960 - 1970-an. Kini, penggunaannya secara luas diterima untuk analis maupun pemurnian sampel baik pharmaceutical, bioteknologi, polimer, dan makanan. Bahkan seiring
perkembangannya KCKT dikembangkan juga untuk analisis protein, karbohidrat, hingga analisis kiralitas (Settle, 1997).
Prinsip pemisahan pada kromatografi adalah karena terdapat perbedaan distribusi solute dalam fase gerak dan fase diam. Kromatografi yang diterapkan dalam pemisahan dengan KCKT ada berbagai mekanisme. Untuk mendapatkan pemisahan terbaik biasanya dilakukan pemilihan mekanisme sesuai dengan karakteristik senyawa yang akan dianalisis. Mekanisme yang umum digunakan antaralain adalah patrisi, adsorpsi, ion exchange, eksklusi ukuran, afinitas, dan kromatografi kiral (Katz, 1996; Settle, 1997).
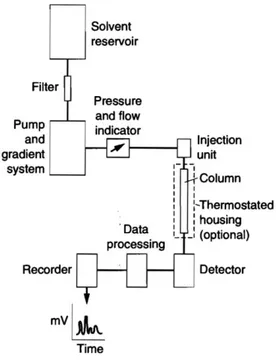
Gambar 11. Sistem KCKT (Settle, 1997)
Instrumen KCKT dibangun oleh delapan komponen dasar reservoir fase gerak, sistem penghantaran solven, alat pengenalan sampel, kolom, detektor, reservoir pembuangan, tabung penghubung, dan sebuah komputer, integrator atau rekorder. Penggunaan kromatografi cair akan berhasil apabila digunakan kombinasi
yang benar berkaitan dengan kondisi operasi tipe kolom dan fase gerak, panjang dan diameter kolom, kecepatan alir fase gerak, suhu kolom dan ukuran sampel (Settle, 1997).
Sistem KCKT harus terintegrasi dengan baik agar analisis dapat berjalan secara maksimal dimulai dari preparasi sampel hingga pembacaan hasil. Oleh karena itu pada analisis senyawa dengan KCKT dibutuhkan proses optimasi untuk mengetahui sistem apa yang cocok digunakan pada saat analisis seperti fase gerak apa yang digunakan, kecepatan alir berapa yang digunakan, hingga masalah detektornya (UV, MS). KCKT sendiri memiliki kekurangan diantaranya akan sulit jika untuk menganalisis sampel yang kompleks, hanya dapat menganalisis satu sampel dalam satu waktu, beberapa membutuhkan preparasi sampel, serta waktu analisis terkadang lama (Settle, 1997).
F. Keterangan Empirik
Senyawa garam kalium 4-(4’hidroksi-3’-metoksifenil)-3-buten-2-on (KMGVT-0) merupakan salah satu analog kurkumin dengan spektrum farmakologi yang luas sehingga berpotensi dikembangkan menjadi kandidat obat baru. Keterangan mengenai profil kadar obat dalam darah perlu diketahui dalam rangka menemukan regimen terapi yang tepat nantinya. Oleh karena itu perlu dilakukan penelitian mengenai profil farmakokinetika KMGVT-0 dalam darah setelah pemberian secara intravena pada tikus putih jantan Wistar dalam rangka menelusuri bagaimana nasib KMGVT-0 di dalam badan.