i
UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN RADIKAL 1,1DIFENIL-2-PIKRILHIDRAZIL (DPPH) DAN PENETAPAN KANDUNGAN FENOLIK TOTAL FRAKSI ETIL ASETAT EKSTRAK
METANOLIK KULIT BATANG APEL BELUDRU (Diospyros blancoi A. DC.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Theresia Nindyati Krissantini NIM : 098114110
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
vi
HALAMAN PERSEMBAHAN
Skripsi ini kupersembahkan untuk
Tuhan Yesus yang menjadi sumber kekuatanku dan senantiasa menyertaiku Bapak dan Ibu tercinta yang merawat dan
mendidikku dari kecil hingga saat ini Kakak, sahabat, teman, dan almamaterku
Yeremia 29:11
Sebab Aku ini mengetahui
rancangan-rancangan apa yang ada pada-Ku mengenai
kamu, demikianlah firman TUHAN, yaitu
rancangan damai sejahtera dan bukan
rancangan kecelakaan, untuk memberikan
kepadamu hari depan yang penuh harapan
Amsal 19:21
vii PRAKATA
Puji syukur kepada Tuhan Yang Maha Esa atas berkat, rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Uji Aktivitas Antioksidan Menggunakan Radikal 1,1Difenil-2-Pikrilhidrazil (DPPH) dan Penetapan Kandungan Fenolik Total Fraksi Etil Asetat Ekstrak Metanolik Kulit Batang Apel Beludru (Diospyros blancoi A. DC.)” sebagai salah satu syarat guna memperoleh gelar Sarjana Farmasi Universitas Sanata Dharma Yogyakarta.
Dalam proses penelitian dan penyusunan skripsi ini tidak lepas dari bantuan dan dukungan dari semua pihak sehingga skripsi ini dapat terselesaikan dengan baik. Oleh karena itu, pada kesempatan ini penulis ingin mengucapkan terimakasih yang sebesar-besarnya kepada :
1. Dekan Fakultas Farmasi Universitas Sanata Dharma yang telah memberikan arahan dan bimbingan.
2. Yohanes Dwiatmaka, M.Si. sebagai Dosen Pembimbing dan Dosen Penguji atas pengarahan, bimbingan dan kesediaannya memberikan ilmu dalam penelitian dan penyusunan skripsi ini.
3. Prof. Dr. CJ. Soegihardjo, Apt. sebagai Dosen Pembimbing yang telah memberikan pengarahan kesediaannya menguji skripsi ini.
4. Jeffry Julianus, M.Si. sebagai Dosen Penguji atas pengarahan dan kesediaannya menguji skripsi ini.
viii
6. Segenap dosen dan karyawan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
7. Segenap laboran Laboratorium Farmakognosi Fitokimia (Mas Wagiran) dan Kimia Fisika (Mas Agung) atas segala bantuan selama penulis melakukan penelitian di laboratorium.
8. Bapak Stephanus Robertus Suripto dan Ibu Fransisca Sri Maryati, S.Pd. atas doa dan kasih sayang serta dukungan yang telah diberikan baik moril maupun materil sehingga skripsi ini dapat selesai.
9. Kakak tercinta Monica Tita Kristantika atas perhatian dan doa serta dukungan dalam menyelesaikan skripsi ini.
10.Yulio Nur Aji Surya dan Johanes Baptista Yunio Rahmawan yang merupakan tim DPPH yang kompak dan hebat, terimakasih atas kerjasama yang telah dilewati bersama dalam penelitian ini.
11.Wisnu Brahmana Putra, Haris Witantyo, Arvi Mahendra, Augustinus Teti, Putut Wibisono dan Febrin Nessy yang selalu memberikan semangat dan dukungan kepada penulis.
12.Teman-teman KONCO KEKAL, Eric Antonius, Is Sumitro, Tri Pamulatsih, Sisilia Mirsya, Lucia Shinta, Tiatira Metri, Yustisia Laras, Novia Sarwoningtyas yang membantu dan memberi semangat disaat penulis merasa putus asa.
ix
14.Teman-teman tercinta Vincentia Adelina, Lani Agustina, Agnes Mutiara, Silvia Agustina, Maria Rosari, Sheilla Ardhistia, Vincentia Septima, Giovani Anggasta dan Dara Nastiandari yang setia memberikan semangat dan dukungan kepada penulis.
15.Teman-teman “Kost Dewi 2” yang memberi semangat dan dukungan kepada penulis.
16.Semua pihak yang telah memberi dukungan dan bantuan yang tidak dapat disebutkan satu persatu.
Penulis menyadari bahwa penyusunan skripsi ini banyak kekurangan dan jauh dari sempurna, untuk itu dengan segala kerendahan hati penulis mengharapkan saran dan kritik guna perbaikan dan penyempurnaan skripsi ini. Harapan penulis semoga penelitian dan penyusunan skripsi ini bermanfaat bagi perkembangan ilmu pengetahuan khususnya di bidang farmasi.
Yogyakarta, 19 Juli 2013
xi
1. Nama tumbuhan ..………... 6
2. Sinonim tumbuhan………... 6
3. Sistematika tumbuhan…..………... 7
4. Gambaran umum apel beludru……… 7
5. Asal dan penyebaran tanaman………. 8
6. Kandungan kimia apel beludru………..…. 8
B. Senyawa Fenolik………... 9
A. Jenis dan Rancangan Penelitian………... 17
B. Variabel Penelitian………. 17
1. Variabel bebas……….. 17
2. Variabel tergantung……… 17
3. Variabel pengacau terkendali……… 17
4. Variabel pengacau tak terkendali……… 17
xii
2. Pengumpulan dan penyiapan bahan (simplisia) ... …. 19
3. Ekstraksi simplisia ... …. 20
4. Pembuatan fraksi etil asetat ... …. 20
5. Pembuatan larutan DPPH, pembanding dan uji……….. 21
6. Uji pendahuluan ... … 23
7. Optimasi metode penetapan kandungan fenolik total ... …. 23
8. Optimasi metode uji aktivitas antioksidan ... …. 24
9. Penetapan kandungan fenolik total ... …. 25
10. Uji aktivitas antioksidan ... ….. 25
F. Analisis Hasil………. 26
xiii
2. Uji pendahuluan senyawa antioksidan ………. 36
E. Hasil Optimasi Metode Uji Fenolik Total……….. 37
1. Penentuan operating time(OT)………. 37
2. Penentuan panjang gelombang serapan maksimum ( maks)…….. 38
F. Hasil Estimasi Kandungan Fenolik Total……….….………..39
G. Hasil Optimasi Metode Uji Aktivitas Antioksidan…….…..…………. 42
1. Penentuan panjang gelombang maksimum ( maks)...…………... 42
2. Penentuan operating time(OT)……….…………..………... 45
H. Hasil Estimasi Penetapan Kandungan Fenolik Total ..………. 47
BAB V KESIMPULAN DAN SARAN………. 57
A. Kesimpulan……… 57
B. Saran……….. 57
DAFTAR PUSTAKA………. 58
LAMPIRAN……… 62
xiv
DAFTAR TABEL
Halaman Tabel I. Hasil scanning panjang gelombang maksimum asam galat yang
direaksikan dengan Folin-Ciocalteu ... 39 Tebel II . Hasil pengukuran absorbansi seri baku asam galat yang direaksikan
dengan Folin-Ciocalteu ……… 41 Tabel III. Hasil penentuan jumlah fenolik total fraksi etil asetat ekstrak
metanolik kulit batang apel beludru ... 42 Tabel IV. Hasil scanning panjang gelombang maksimum DPPH pada berbagai
konsentrasi ……… 44
Tabel V. Hasil aktivitas antioksidan kuersetin dengan metode DPPH… 50 Tabel VI. Hasil aktivitas antioksidan fraksi etil asetat ekstrak metanolik kulit
batang apel beludru dengan metode DPPH ... 51 Tabel VII. Hasil perhitungan IC50kuersetin ... 52 Tabel VIII. Hasil perhitungan IC50 fraksi etil asetat ekstrak metanolik kulit
batang apel beludru………. 53 Tabel IX. Penggolongan tingkat kekuatan antioksidan kuersetin dan fraksi etil
xv
DAFTAR GAMBAR
Halaman
Gambar 1. Tanaman apel beludru (Morton,1987)……… 6
Gambar 2. Struktur dasar flavonoid (Apak dkk., 2007)……….. 9
Gambar 3. Struktur kimia beberapa tipe flavonoid (Apak dkk., 2007)…… 10
Gambar 4. Struktur asam galat (Kalita, Kar dan Handique, 2011)………. 10
Gambar 5. 1,1-diphenyl-2picrylhidrazyl (radikal bebas) dan 1,1-diphenyl -2-picryhydrazyl (non radikal) (Molyneux, 2004)……….. 13
Gambar 6. Skema jalannya penelitian……….………. 27
Gambar 7. Hasil uji pendahuluan senyawa fenolik………...………... 35
Gambar 8. Hasil uji pendahuluan aktivitas antioksidan……….. 36
Gambar 9. Grafik penentuan operating time asam galat ……… 37
Gambar 10. Grafik penentuan operating time fraksi etil asetat kulit batang apel beludru……….. 38
Gambar 11. Reaksi asam galat dengan molybdenum yang merupakan komponen Folin-Ciocalteu……… 40
Gambar 12. Kurva persamaan regresi linier asam galat dalam penetapan fenolik total……… 41
Gambar 13. Gugus kromofor dan auksokrom radikal DPPH……… 43
Gambar 14. Scanning panjang gelombang maksimum DPPH pada berbagai konsentrasi………. 45
xvi
Gambar 16. Grafik penentuan operating time fraksi etil asetat kulit batang apel beludru (replikasi 1)……… 46 Gambar 17. Perubahan warna larutan pada reaksi radikal DPPH dengan
antioksidan (Witt, Lalk, Hager dan Voigt, 2010)……….. 47 Gambar 18. Struktur kuersetin (Apak dkk, 2007)……….. 48 Gambar 19. Kurva persamaan regresi linier aktivitas antioksidan kuersetin.. 52 Gambar 20. Kurva persamaan regresi linier aktivitas antioksidan fraksi etil
xvii
DAFTAR LAMPIRAN
Halaman Lampiran 1. Surat Pengesahan Determinasi Tanaman Apel Beludru………. 62 Lampiran 2. Gambar Tanaman Apel Beludru Yang Diambil Di Kampus III
Universitas Sanata Dharma.…. ... …. 63 Lampiran 3. Kulit Batang Apel Beludru………... 64 Lampiran 4. Hasil Ekstrak Metanol dan Perhitungan Rendemen Fraksi Etil
Asetat Ekstrak Metanolik Kulit Batang Apel Beludru ………. 64 Lampiran 5. Data Penimbangan Bahan Pengujian Aktivitas Antioksidan… 65 Lampiran 6. Data Perhitungan Konsentrasi DPPH, Larutan Pembanding dan
Larutan Uji . ... …. 66 Lampiran 7. Optimasi Metode Uji Aktivitas Antioksidan………. 71 Lampiran 8. Uji Aktivitas Antioksidan Menggunakan Radikal DPPH . .... 75 Lampiran 9. Perhitungan Nilai IC50 Kuersetin dan Fraksi Etil Asetat Ekstrak
Metanolik Kulit Batang Apel Beludru ... …. 78 Lampiran 10. Data Penimbangan Bahan untuk Uji Kandungan Fenolik Total 79 Lampiran 11. Optimasi Penentuan Fenolik Total ... .. 79
Lampiran 12. Penentuan Kandungan Fenolik Total……… 82 Lampiran 13. Uji Statistika……….. 86
xviii INTISARI
Penyakit degeneratif dan gangguan fungsi dan struktur sel serta mutasi dapat disebabkan oleh radikal bebas. Salah satu cara untuk menangkal radikal bebas yaitu menggunakan antioksidan. Apel beludru (Diospyros blancoi A. DC.) diketahui memiliki kandungan senyawa fenolik yang memiliki aktivitas sebagai antioksidan.
Penelitian ini bertujuan untuk penetapan kandungan fenolik total dan mengetahui aktivitas antioksidan kulit batang apel beludru. Kulit batang apel beludru diekstrak menggunakan campuran metanol : air (9:1) dan (1:1) kemudian difraksinasi dengan etil asetat. Penentuan kandungan fenolik total menggunakan senyawa Folin-Ciocalteu yang dinyatakan dalam massa ekivalen asam galat dan aktivitas antioksidan menggunakan radikal 1,1difenil-2-pikrilhidrazil (DPPH) yang dinyatakan dalam Inhibition Concentration (IC50).
Hasil penelitian menunjukkan bahwa fraksi etil asetat ekstrak kulit batang apel beludru mempunyai kandungan fenolik total fraksi etil asetat ekstrak metanolik kulit batang apel beludru sebesar 1311,3 ± 72,80 mg ekivalen asam galat per gram fraksi etil asetat (taraf kepercayaan 95 %) dan aktivitas antioksidan sangat kuat yang dinyatakan dengan IC50 sebesar 14,3 ± 1,42 µg/mL (taraf kepercayaan 95%).
xix
ABSTRACT
Degenerative diseases and disorders of cell structure and function, and mutations can be caused by free radicals. One way to counteract the free radicals using antioxidants. Velvet apple (Diospyros blancoi A. DC.) known to contain phenolic compounds that have antioxidant activity.
This study aimed at the determination of total phenolic content and antioxidant activity velvet apple of bark. Velvet apple bark was extracted using a mixture of methanol: water (9:1) and (1:1) and then fractionated with ethyl acetate. Determination of total phenolic content using the Folin-Ciocalteu compounds are expressed in gallic acid equivalent mass and antioxidant activity using 1,1-diphenyl-2 pikrilhidrazil radical (DPPH) which is expressed in the Inhibition Concentration (IC50).
The results showed that the ethyl acetate fraction of the velvet apple stem bark methanolic extract has a total phenolic content 1311.3 ± 72.80 mg gallic acid equivalents per gram fraction (95% confidence level) and antioxidant activity very strong expressed by IC50 14.3 ± 1.42 g / mL (95% confidence level).
1 BAB I PENGANTAR
A. Latar Belakang
Penyakit degeneratif, gangguan fungsi dan struktur sel, serta mutasi dapat disebabkan oleh radikal bebas. Radikal bebas merupakan kumpulan atom yang reaktif dan tidak stabil, karena memiliki satu elektron tidak berpasangan pada orbital terluarnya. Untuk mencapai kestabilan atom, radikal bebas akan bereaksi dengan molekul disekitarnya untuk mendapatkan pasangan elektronnya. Radikal bebas dapat mengoksidasi asam nukleat, protein, lipid atau DNA dan dapat memulai terjadinya penyakit degeneratif. Oleh karena itu, tubuh memerlukan suatu substansi penting yaitu antioksidan yang mampu menghambat mekanisme oksidatif yang menyebabkan penyakit degeneratif (Prakash, Rigelhof dan Miller, 2001).
lain), molekul kecil (asam askorbat, glutation, asam urat, tokoferol, karotenoid, polifenol) dan beberapa hormon (estrogen, angiotensin, melatonin) (Prior, Wu dan Schaich, 2005). Adanya kemungkinan efek samping yang belum diketahui dari antioksidan sintetik, maka antioksidan alami menjadi alternatif untuk menangkal radikal bebas (Rohdiana, 2001; Sunarni, 2005 cit., Sunardi, 2007). Hal inilah yang menyebabkan adanya penelitian eksplorasi sumber antioksidan alami yang berasal dari tanaman.
Senyawa fenolik merupakan senyawa antioksidan alami yang terdapat dalam bentuk senyawa aktif dalam makanan. Senyawa fenolik dapat mencegah berbagai jenis penyakit, seperti kanker dan jantung koroner. Senyawa ini pun berperan sebagai faktor pelindung terhadap bahaya oksidasi pada tubuh manusia (Ningsih, 2007).
Penelitian ini bertujuan untuk menentukan aktivitas antioksidan kulit batang apel beludru menggunakan radikal DPPH (1,1-diphenyl-2-picrylhydrazyl). Radikal DPPH memiliki kemampuan untuk direduksi atau distabilisasi oleh antioksidan diukur dengan mengukur penurunan absorbansi pada panjang gelombang 517 nm. Parameter yang digunakan untuk uji penangkapan radikal DPPH adalah IC50 konsentrasi ekstrak atau fraksi uji yang dibutuhkan untuk menangkap radikal DPPH sebesar 50 % (Zou, Lu dan Wei, 2004). Penentuan kandungan fenolik total dengan metode Folin-Ciocalteu yang menyatakan ekivalen asam galat pada uji aktivitas antioksidan sumber tumbuhan (Aqil, Ahmad dan Mehmood, 2006).
1. Permasalahan
a. Berapa kadar fenolik total fraksi etil asetat ekstrak metanolik kulit batang apel beludru yang dinyatakan dengan massa ekivalen asam galat?
b. Berapa nilai aktivitas antioksidan fraksi etil asetat ekstrak metanolik kulit batang apel beludru menggunakan radikal bebas DPPH yang dinyatakan dengan IC50?
2. Keaslian penelitian
dilakukan dengan metode DPPH dan penetapan kandungan fenolik total menggunakan instrumen spektrofotometer visibel.
Penelitian ini berbeda dengan penelitian sebelumnya, karena penelitian ini menggunakan kulit batang apel beludru yang diperoleh dari Kampus III Universitas Sanata Dharma Paingan, Maguwoharjo, Sleman, Yogyakarta. Kulit batang apel beludru dikeringkan kemudian diserbuk dan dimaserasi menggunakan metanol : air (9:1) dan metanol : air (1:1) selama satu hari. Penelitian ini dilakukan proses fraksinasi dengan petroleum eter dan dilanjutkan dengan etil asetat, sehingga diperoleh fraksi etil asetat ekstrak metanolik kulit batang apel beludru. Hasil fraksi etil asetat ekstrak metanolik kulit batang apel beludru inilah yang digunakan untuk pengujian aktivitas antioksidan menggunakan radikal DPPH dan penetapan kandungan fenolik total dengan menggunakan instrumen spektrofotometer visibel.
3. Manfaat penelitian
a. Manfaat teoritis.Memberikan pengetahuan dan bukti ilmiah mengenai aktivitas antioksidan fraksi etil asetat ekstrak metanolik kulit batang apel beludru menggunakan radikal bebas DPPH yang dinyatakan dengan IC50.
B. Tujuan Penelitian
1. Tujuan umum. Menguji kandungan fenolik total menggunakan metode Folin-Ciocalteu dan aktivitas antioksidan menggunakan radikal bebas DPPH dari fraksi etil asetat ekstrak metanolik kulit batang apel beludru.
2. Tujuan khusus
a. Mengetahui kadar fenolik total fraksi etil asetat ekstrak metanolik kulit batang apel beludru yang dinyatakan dengan massa ekivalen asam galat.
6 BAB II
PENELAHAAN PUSTAKA
A. Apel Beludru (Diospyros blancoi A. DC.)
Gambar 1. Tanaman apel beludru (Morton, 1987)
1. Nama tumbuhan
Buah mabolo kadang-kadang disebut dengan apel beludru. Di India disebut dengan persik mekar. Di Malaya disebut dengan buah mantega (buah mentega). Mabolo (atau mabulo) adalah nama umum di daerah Filipina, dengan nama lain kamagon (Spanyol) (Morton, 1987).
2. Sinonim tumbuhan
Sinonim tumbuhan apel beludru (Diospyros blancoi A. DC.) yaitu
3. Sistematika tumbuhan
(United States Department of Agriculture NRCS, 2013). 4. Gambaran umum apel beludru
berukuran 0,5 inci (12,5 mm). Buah apel beludru berbentuk bulat memiliki ukuran kira-kira 1-4 inci (5-10 cm). Buah muda berwarna coklat kemerahan yang berubah menjadi merah terang, kemudian agak kusam jika matang. Daging buah berwarna keputihan, agak keras, padat, dan kering. Rasanya manis agak sepat dan berbau khas seperti keju. Biji berbentuk baji dengan ukuran panjang sekitar 1,5 inci (4 cm) dan lebar 1 inci (2,5 cm) (Morton, 1987).
5. Asal dan penyebaran tanaman apel beludru
Mabolo (apel beludru) berasal dari hutan dataran rendah dan menengah Kepulauan Filipina dari pulau Luzon ke Key dari Kepulauan Sulu, dan umumnya yang dibudidayakan adalah buah dan bahkan lebih sebagai pohon peneduh untuk pinggir jalan. Pohon itu mulai diperkenalkan ke Jawa dan Malaya pada tahun 1881, dan masuk ke Calcutta Botanical Garden di Singapura. Benih dikirim ke Amerika Serikat Departemen Pertanian oleh WS Lyon, Biro Filipina Pertanian dan bibit berkembang di Pabrik Stasiun Pendahuluan di Miami . Ada spesimen yang tumbuh di tempat lain yaitu di Florida selatan dan beberapa tersebar di sekitar wilayah Karibia, di Jamaika, Puerto Rico, Kuba, Trinidad dan Lancetilla Taman Eksperimental di Honduras dan tanaman diterima dari Filipina pada tahun 1926 serta biji dari Kuba pada tahun 1927 (Morton, 1987).
6. Kandungan kimia apel beludru
B. Senyawa Fenolik
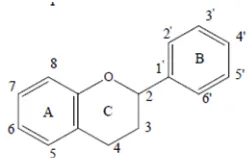
Senyawa fenolik merupakan sumber dari antioksidan alami yang aman digunakan dan termasuk dalam golongan mayoritas senyawa yang berperan sebagai antioksidan. Aktivitas antioksidan dari fenolik terjadi karena kemampuan mereduksi radikal bebas sehingga radikal menjadi stabil (Marxen dkk., 2007). Senyawa fenolik terdiri dari beberapa molekul besar dengan karakteristik utama adalah adanya cincin aromatik yang memiliki gugus hidroksil. Selain itu, senyawa fenolik memiliki kemampuan membentuk senyawa kelat dengan logam, mudah teroksidasi dan membentuk polimer yang menimbukan warna gelap. Kebanyakan dari senyawa fenolik termasuk dalam kelompok flavonoid (Pratt dan Hudson, 1990 cit., Ningsih, 2007).
Flavonoid merupakan antioksidan yang menetralisir radikal bebas. Flavonoid adalah bagian dari senyawa fenolik yang terdapat pada pigmen tumbuh-tumbuhan.. Flavonoid terbagi menjadi 7 kelompok, yaitu antosianin, proantosianin, isoflavon, flavonon, flavonol, flavanol, dan flavon. Flavonoid memiliki aktivitas antiokasidan di dalam tubuh sehingga disebut bioflavonoid (Apak dkk., 2007). Manfaat utama flavonoid adalah untuk melindungi struktur sel, membantu memaksimalkan manfaat vitamin C, mencegah keropos tulang, sebagai antibiotik dan antiinflamasi (Fadhli, 2008)
Fenol Flavanols Flavonols
Flavones Flavanones Isoflavones
Gambar 3. Struktur kimia beberapa tipe flavonoid (Apak dkk., 2007)
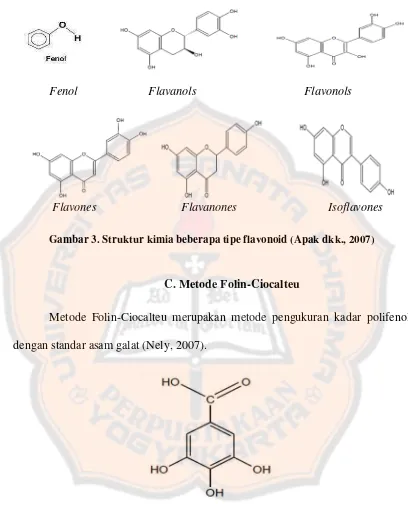
C. Metode Folin-Ciocalteu
Metode Folin-Ciocalteu merupakan metode pengukuran kadar polifenol dengan standar asam galat (Nely, 2007).
Gambar 4. Struktur asam galat (Kalita, Kar dan Handique, 2011)
dapat diukur absorbansinya pada panjang gelombang maksimum 745-750 nm. Metode Folin-Ciocalteu terjadi dalam suasana basa, sehingga dalam penentuan kadar fenolik dengan pereaksi Folin-Ciocalteu digunakan natrium karbonat yang bertujuan untuk membentuk suasana basa.
D. Radikal Bebas
Radikal bebas merupakan suatu atom atau molekul (kumpulan atom) yang memiliki elektron tidak berpasangan. Elektron tidak berpasangan pada radikal bebas cenderung akan mencari pasangan dengan cara menarik atau menyerang elektron dari senyawa lain sehingga reaktivitas radikal bebas menjadi tinggi. Senyawa radikal bebas juga dapat mengubah suatu molekul menjadi radikal. Target utama radikal bebas, yaitu asam lemak tak jenuh, lipoprotein dan protein, serta unsur DNA termasuk karbohidrat. Banyak kemungkinan yang terjadi akibat radikal bebas yaitu gangguan fungsi dan struktur sel bahkan mutasi sehingga memicu timbulnya penyakit (Winarsi, 2007).
Secara umum, tahapan pembentukan radikal bebas ada 3, yaitu :
1. Tahap inisiasi merupakan awal pembentukan radikal bebas dan reaksinya, yaitu RH R* + H*
2. Tahap propagasi, merupakan tahap pemanjangan rantai radikal R* + O2 ROO*
ROO* + RH ROOH +R*
ROO* +ROO* non radikal
R* + ROO* non radikal
R* + R* non radikal (Winarsi, 2007).
E. Antioksidan
Antioksidan merupakan senyawa kimia yang dapat menangkal radikal bebas karena dapat menyumbangkan satu atau lebih elektron kepada radikal bebas (Suhartono, 2002 cit., Sunardi, 2007). Antioksidan dapat menghambat ROS (Reactive Oxygen Species) dan radikal lainnya sehingga dapat mencegah terjadinya penyakit yang disebabkan oleh radikal bebas seperti kardiovaskuler, karsinogenesis, dan penuaan (Gutteridge dan Halliwell, 2000).
Karakteristik antioksidan, yaitu kemampuannya untuk menangkap radikal bebas. Komponen antioksidan yang terdapat pada tanaman seperti asam fenolat, polifenol dan flavanoid akan menangkap radikal bebas seperti peroksida, hidroperoksida atau lipid peroksil dan juga menghambat mekanisme oksidatif yang menyebabkan penyakit degeneratif (Prakash dkk., 2001).
F. Metode DPPH
dengan hidrogennya DPPH-H. Hasil dari pengurangan intensitas warna adalah stokiometri terhadap jumlah dari elektron yang ditangkap (Bondet, Brand-Williams dan Berset, 1997).
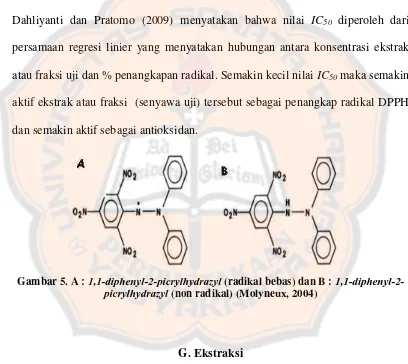
Parameter yang digunakan untuk uji penangkapan radikal DPPH adalah
IC50 yaitu konsentrasi ekstrak atau fraksi uji yang dibutuhkan untuk menangkap radikal DPPH sebesar 50 % (Zou dkk., 2004). Menurut Rohman, Riyanto, Dahliyanti dan Pratomo (2009) menyatakan bahwa nilai IC50 diperoleh dari persamaan regresi linier yang menyatakan hubungan antara konsentrasi ekstrak atau fraksi uji dan % penangkapan radikal. Semakin kecil nilai IC50 maka semakin aktif ekstrak atau fraksi (senyawa uji) tersebut sebagai penangkap radikal DPPH dan semakin aktif sebagai antioksidan.
Gambar 5. A : picrylhydrazyl (radikal bebas) dan B : 1,1-diphenyl-2-picrylhydrazyl (non radikal) (Molyneux, 2004)
G. Ekstraksi
destilasi tidak mungkin dilakukan. Ekstraksi cair-cair selalu terdiri dari sedikitnya dua tahap, yaitu pencampuran secara intensif bahan ekstraksi dengan pelarut dan pemisahan kedua fase cair itu sesempurna mungkin (Wibawa, 2007).
Maserasi merupakan suatu teknik penyarian yang sederhana, dilakukan dengan cara merendam serbuk simplisia ke dalam cairan penyari. Maserasi digunakan untuk menyari simplisia yang mengandung zat aktif yang mudah larut dalam cairan penyari, tidak mengandung zat yang mudah mengembang di dalam cairan penyari dan tidak mengandung benzoin. Cairan penyari akan menembus dinding sel dan akan masuk ke dalam rongga sel yang mengandung zat aktif kemudian zat aktif akan menjadi larut. Larutan yang paling pekat akan terdesak keluar karena adanya perbedaan konsentrasi dari larutan zat aktif yang ada di dalam dan di luar sel. Peristiwa tersebut akan terjadi secara berulang-ulang hingga tercapai kesetimbangan konsentrasi antara larutan di dalam dan di luar sel (Depkes RI, 1986).
Keuntungan dari teknik penyarian dengan cara maserasi yaitu cara pengerjaan dan peralatan yang digunakan sangat sederhana. Namun, kerugian cara maserasi adalah butuh waktu yang lama untuk proses pengerjaan dan penyarian yang kurang sempurna (Depkes RI, 1986).
H. Spektrofotometri Visibel
sampai 750 nm. Semua cahaya yang dapat dilihat oleh mata, warna putih, merah, biru, hijau atau warna apapun , maka cahaya tersebut termasuk ke dalam cahaya tampak (visibel). Prinsip dari spektrofotometri visibel adalah intensitas warna dari suatu larutan sebanding dengan jumlah cahaya yang diserap. Semakin pekat warna, semakin banyak cahaya yang diserap (Fatimah, 2012).
Menurut Gandjar dan Rohman (2007), ada tiga macam proses penyerapan energi sinar tampak, yaitu penyerapan oleh transisi elektron ikatan dan elektron anti ikatan, penyerapan oleh transisi elektron d dan f dari molekul kompleks, dan penyerapan oleh perpindahan muatan.
I. Landasan Teori
Radikal bebas merupakan suatu atom atau molekul yang memiliki elektron tidak berpasangan. Radikal bebas akan mencari pasangan elektron di sekitar orbital terluarnya untuk mencapai kestabilan atom, misalnya radikal bebas akan menyerang molekul alami dalam tubuh seperti protein, karbohidrat dan DNA sehingga memungkinkan terjadinya gangguan fungsi sel, kardiovaskuler, dan mutasi sehingga dapat memicu timbulnya penyakit. Antioksidan adalah senyawa yang dapat menangkal radikal bebas karena dapat menyumbangkan satu elektron pada radikal bebas, sehingga dapat mencegah timbulnya penyakit akibat radikal bebas.
sumber antioksidan alami dan mengandung kuersetin yang merupakan flavonoid yang memiliki kemampuan untuk menangkal radikal bebas.
Metode DPPH merupakan metode yang mudah dan cepat dilakukan untuk mengevaluasi aktivitas antiradikal dari antioksidan. Parameter yang digunakan untuk aktivitas antioksidan, yaitu IC50 yang menyatakan konsentrasi ekstrak atau fraksi uji yang dibutuhkan untuk menangkap radikal DPPH sebesar 50%. Metode Folin-Ciocalteu merupakan metode yang spesifik digunakan untuk mengukur senyawa fenolat yang ada di dalam sampel.
J. Hipotesis
1. Fraksi etil asetat ekstrak metanolik kulit batang apel beludru dapat ditentukan kadar fenolik total dinyatakan dengan massa ekivalen asam galat.
17 BAB III
METODELOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental rancangan acak sederhana karena subjek uji diberi perlakuan
B. Variabel Penelitian
1. Variabel bebas berupa konsentrasi fraksi etil asetat ekstrak metanolik kulit batang apel beludru.
2. Variabel tergantung berupa % IC fraksi etil asetat ekstrak metanolik kulit batang apel beludru.
2. Ekstrak metanolik adalah ekstrak cair kulit batang apel beludru yang diperoleh dari hasil maserasi dengan pengadukan pada orbital shaker menggunakan campuran metanol dan air (9:1) dan (1:1) selama satu hari serta telah dihilangkan kandungan metanolnya.
3. Fraksi etil asetat merupakan hasil fraksi ekstrak metanolik kulit batang apel beludru yang telah difraksinaasi menggunakan petroleum eter kemudian menggunakan etil asetat.
4. Persen inhibition concentration (% IC) adalah persen yang menyatakan kemampuan fraksi etil asetat ekstrak metanolik kulit batang apel beludru untuk menangkap radikal DPPH.
5. Persen inhibition concentration 50 (IC50) adalah konsentrasi fraksi etil asetat ekstrak metanolik kulit batang apel beludru yang menghasilkan penangkapan 50% radikal DPPH.
D. Bahan dan Alat Penelitian
1. Bahan penelitian
2. Alat penelitian
Alat-alat yang digunakan dalam penelitian ini berupa spektrofotometer UV-VIS (Shimadzu), vortex (Junke & Kunkel) , corong Buchner, oven, mikropipet 10-1000 µL; 1-10 mL (Acura 825, Socorex), neraca analitik (Scaltec SBC 22, BP 160P), vacuum rotary evaporator (Junke & Kunkel), tabung reaksi bertutup, ayakan nomor mesh 40, dan alat-alat gelas yang lazim digunakan di laboratorium analisis (Pyrex-Germany dan Iwaki).
E. Tata Cara Penelitian
1. Determinasi tanaman
Determinasi tanaman apel beludru dilakukan di Laboratorium Farmakognosi-Fitokimia, Fakultas Farmasi Universitas Sanata Dharma menurut Morton (1987) dan United States Department of Agriculture NRCS (2013).
2. Pengumpulan dan penyiapan bahan (simplisia) a. Pengumpulan bahan
b. Penyiapan bahan (simplisia)
Sebanyak 200 g kulit batang apel beludru ditimbang, dibersihkan , dicuci dengan air mengalir, lalu dikeringanginkan, kemudian dikeringkan pada oven dengan suhu 40-60oC. Kulit batang yang telah dikeringkan kemudian ditumbuk dan diserbuk menggunakan alat penyerbuk dan diayak dengan ayakan nomor mesh 40.
3. Ekstraksi simplisia
Simplisia yang telah dihaluskan ditimbang sebanyak 100 g dan dimasukkan ke dalam bejana maserasi, kemudian ditambah pelarut pertama berupa campuran metanol : air (9:1) sampai terendam sempurna dan dicampur homogen. Campuran dimaserasi dengan penggojogan pada orbital shaker pada suhu ruangan selama satu hari. Filtrat diperoleh melalui penyaringan menggunakan corong Buchner dengan bantuan pompa vakum. Ampas penyaringan dimaserasi dengan pelarut kedua yaitu campuran metanol : air (1:1) selama satu hari, lalu disaring. Filtrat hasil penyaringan pertama dan kedua digabungkan, kemudian filtrat diuapkan pelarutnya sehingga diperoleh ekstrak metanolik kulit batang apel beludru.
4. Pembuatan fraksi etil asetat
yaitu fraksi petroleum eter dan fraksi air. Selanjutnya, fraksi air diekstraksi cair-cair lagi menggunakan etil asetat dengan perbandingan larutan fraksi air : etil asetat (1:1 v/v) sehingga didapatkan fraksi air dan etil asetat. Setelah dipisahkan, fraksi etil asetat diuapkan dengan vacuum rotary evaporator hingga diperoleh ekstrak kental kemudian dioven selama satu hari sehingga diperoleh ekstrak kering. Lalu hasil fraksi etil asetat tersebut digunakan untuk analisis lebih lanjut. 5. Pembuatan larutan DPPH, pembanding dan uji
a. Pembuatan larutan DPPH
Sebanyak 15,9 mg DPPH dilarutkan ke dalam metanol p.a sehingga diperoleh larutan DPPH dengan konsentrasi 0,4 mM. Larutan tersebut ditutup dengan alumunium foil dan harus selalu dibuat baru.
b. Pembuatan larutan stok dan larutan intermediet kuersetin
Sebanyak 10,0 mg kuersetin dilarutkan dengan metanol p.a sampai 10,0 mL sebagai larutan stok. Kemudian dibuat larutan intermediet dengan mengambil 1 mL dari larutan stok kuersetin dan ditambahkan metanol p.a sampai 10,0 mL, sehingga diperoleh larutan dengan konsentrasi sebesar 100,0
g/mL.
c. Pembuatan larutan pembanding
d. Pembuatan larutan uji
1) Larutan uji untuk penentuan kandungan fenolik total
Sebanyak 10,0 mg fraksi etil asetat ditimbang, lalu ditambahkan metanol p.a 10 mL sampai diperoleh konsentrasi larutan uji sebesar 1000,0 µg/mL. Kemudian diambil 1,0 mL dari larutan tersebut kemudian ditambahkan metanol p.a sampai 10,0 mL sehingga diperoleh konsentrasi larutan uji sebesar 100,0 g/mL.
2) Larutan uji untuk aktivitas antioksidan
Sejumlah 10,0 mg fraksi etil asetat ditimbang dan ditambahkan metanol p.a sampai 10,0 mL. Kemudian dibuat larutan intermediet dengan diambil 1 mL stok larutan uji lalu ditambahkan metanol p.a hingga 10,0 mL sehingga diperoleh larutan dengan konsentrasi 100,0 g/mL. Diambil sebanyak 0,75; 1,0; 1,25; 1,5; 1,75 mL larutan tersebut, kemudian ditambahkan metanol p.a sampai 10,0 mL, sehingga diperoleh konsentrasi larutan uji sebesar 7,5; 10; 12,5; 15; 17,5 g/mL.
3) Pembuatan larutan baku asam galat
6. Uji pendahuluan
a. Uji keberadaan senyawa fenolik
Larutan uji dengan konsentrasi 200,0 g/mL dan larutan pembanding asam galat 150,0 g/mL diambil sebanyak 0,5 mL kemudian ditambahkan 2,5 mL
pereaksi fenol Folin-Ciocalteu yang telah diencerkan dengan akuades (1:10 v/v) ke dalam tabung reaksi lalu didiamkan selama 10 menit. Larutan natrium karbonat 1 M ditambahkan sebanyak 2 mL, kemudian amati warna larutan tersebut. Bandingkan dengan warna larutan yang berisi air : metanol (1:1) ditambah pereaksi, fraksi etil asetat dan asam galat tanpa diberi pereaksi.
b. Uji pendahuluan aktivitas antioksidan
Larutan DPPH diambil sebanyak 1 mL kemudian dimasukkan ke dalam masing-masing tiga tabung reaksi. Larutan DPPH ditambahkan masing-masing dengan 1 mL metanol p.a, larutan pembanding kuersetin 37,5 g/mL, dan larutan uji 200,0 g/mL. Selanjutnya, larutan tersebut ditambahkan dengan 3 mL metanol p.a. Larutan tersebut kemudian divortex selama 30 detik. Setelah 30 menit, diamati warna pada larutan tersebut. Bandingkan juga dengan warna larutan fraksi etil asetat dan kuersetin tanpa ditambahkan DPPH.
7. Optimasi metode penetapan kandungan fenolik total
Optimasi metode penetapan kandungan fenolik total ditentukan dengan menggunakan metode spektrofotometri sesuai dengan penelitian Nusarini ( 2007).
a. Penentuan operating time (OT)
Sebanyak 0,5 mL larutan asam galat 50; 100; dan 150 g/mL
akuades (1:10 v/v). Larutan selanjutnya ditambahkan dengan 4 mL natrium karbonat 1 M. Setelah itu, dibaca absorbansinya dengan spektrofotometer visibel pada panjang gelombang 750 nm selama 30 menit. Dilakukan demikian juga untuk larutan uji 100 g/mL dengan waktu pengamatan selama 60 menit.
b. Penentuan panjang gelombang maksimum
Sebanyak 0,5 mL larutan asam galat 50; 100; dan 150 g/mL ditambahkan
dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan akuades (1:10 v/v). Larutan selanjutnya ditambahkan dengan 4 mL natrium karbonat 1 M. Diamkan selama operating time, absorbansinya dibaca pada maksimum dengan spektrofotometer visibel pada panjang gelombang 600-800 nm.
8. Optimasi metode uji aktivitas antioksidan
a. Penentuan panjang gelombang serapan maksimum
Pada 3 labu ukur 10 mL, dimasukkan masing-masing 0,5; 1,0; 1,5 mL larutan DPPH. Ditambahkan larutan tersebut dengan metanol p.a hingga tanda batas sehingga konsentrasi DPPH menjadi 0,020; 0,040; dan 0,080 mM. Larutan tersebut kemudian divortex selama 30 detik. Diamkan selama operating time, lalu dilakukan scanning panjang gelombang serapan maksimum dengan spektrofotometer visibel pada panjang gelombang 400-600 nm.
b. Penentuan operating time (OT)
Sebanyak 2 mL larutan DPPH dimasukkan ke dalam masing-masing tiga labu ukur 10 mL, ditambahkan masing-masing dengan 2 mL larutan pembanding kuersetin 5,0; 10,0; 15,0 g/mL. Selanjutnya larutan tersebut ditambahkan
selama 30 detik. Setelah itu dibaca absorbansinya dengan spektrofotometer visibel pada panjang gelombang 516 nm selama 1 jam. Dilakukan demikian juga untuk larutan uji 7,5; 12,5; 17,5 g/mL.
9. Penetapan kandungan fenolik total a. Pembuatan kurva baku asam galat
Sebanyak 0,5 mL larutan asam galat 50; 75; 100; 125; dan 150 g/mL ditambah dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan akuades (1:10 v/v). Larutan selanjutnya ditambah dengan 4,0 mL natrium karbonat 1M. Setelah operating time, absorbansinya dibaca pada maksimum
terhadap blanko yang terdiri atas akuades : metanolik p.a (1:1), reagen Folin-Ciocalteu dan larutan natrium karbonat 1M. Pengerjaan dilakukan tiga kali.
b. Estimasi kandungan fenolik total larutan uji
Diambil 0,5 mL larutan uji 100 g/mL, kemudian dilanjutkan
sebagaimana perlakuan pada pembuatan kurva baku asam galat. Kandungan fenolik total dinyatakan sebagai gram ekivalen asam galat (mg ekivalen asam galat per g fraksi etil asetat). Dilakukan tiga kali replikasi.
10. Uji aktivitas antioksidan
a. Pengukuran absorbansi larutan DPPH (kontrol)
b. Pengukuran absorbansi larutan pembanding dan uji
Sebanyak 2 mL larutan DPPH dimasukkan ke dalam tabung reaksi 10 mL kemudian ditambahkan dengan 2 mL larutan pembanding dan uji pada berbagai seri konsentrasi telah dibuat. Selanjutnya larutan tersebut ditambah dengan metanol p.a hingga tanda batas. Larutan tersebut kemudian vortex selama 30 detik dan diamkan selama operating time. Larutan dibaca absorbansinya dengan spektrofotometer visibel pada panjang gelombang maksimum hasil optimasi. Pengujian dilakukan dengan tiga kali replikasi.
c. Estimasi aktivitas antioksidan
Hasil dari prosedur 8a dan 8b, dihitung nilai % IC dan IC50 untuk kuersetin dan fraksi etil asetat kulit batang apel beludru.
F.Analisis Hasil
Aktivitas penangkapan radikal DPPH (%) dihitung dengan rumus : Absorbansi (larutan kontrol) – Absorbansi sampel (larutan pembanding atau uji) X 100%
Absorbansi larutan kontrol
Data aktivitas tersebut dianalisis dan dihitung nilai IC50 mengunakan persamaan regresi linear dengan sumbu x adalah konsentrasi larutan uji maupun pembanding, sedangkan sumbu y adalah % IC. Lalu dianalisis secara statistik untuk menentukan ada atau tidak adanya perbedaan bermakna antara IC50 larutan pembanding dan larutan uji.
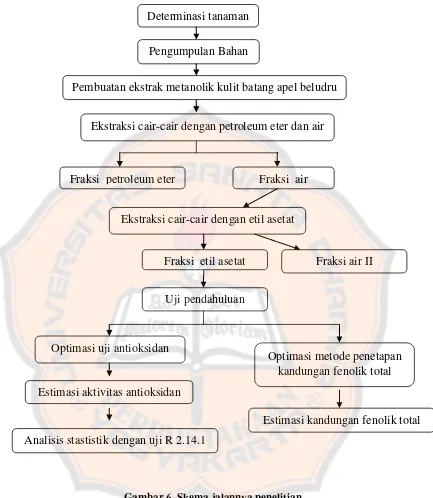
Gambar 6. Skema jalannya penelitian Determinasi tanaman
Pengumpulan Bahan
Pembuatan ekstrak metanolik kulit batang apel beludru
Ekstraksi cair-cair dengan petroleum eter dan air
Fraksi petroleum eter Fraksi air
Ekstraksi cair-cair dengan etil asetat
Optimasi metode penetapan kandungan fenolik total
Fraksi air II
Uji pendahuluan Fraksi etil asetat
Analisis stastistik dengan uji R 2.14.1 Estimasi aktivitas antioksidan
Optimasi uji antioksidan
28 BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi Tanaman
Determinasi merupakan suatu langkah awal dan syarat awal yang harus dilakukan dalam suatu penelitian menggunakan tanaman. Determinasi tanaman bertujuan untuk mengetahui kebenaran identitas tanaman yang digunakan dalam penelitian serta untuk meminimalisir adanya kesalahan yang terjadi saat pengambilan sampel untuk analisis fitokimia. Determinasi tanaman dilakukan di Laboratorium Farmakognosi-Fitokimia Fakultas Farmasi Universitas Sanata Dharma Yogyakarta pada tanggal 31 Mei 2013 dengan acuan Julia F. Morton (1987) dan United States Department of Agriculture NRCS (2013). Pembuktian determinasi ini diperkuat dengan adanya surat determinasi yang dikeluarkan oleh Laboratorium Kebun Tanaman Obat Fakultas Farmasi Universitas Sanata Dharma Yogyakarta pada lampiran 1 yang menyatakan bahwa tanaman yang digunakan untuk penelitian adalah benar-benar kulit batang apel beludru (Diospyros blancoi
A. DC.) yang diambil dari tanaman apel beludru.
B. Hasil Pengumpulan Bahan
kulit batang apel beludru dilakukan saat pagi hari agar kandungan metabolit sekunder yang berperan sebagai antioksidan belum berkurang (Andayani, Lisawati dan Maimunah, 2008). Pengambilan kulit batang apel beludru dilakukan pada kondisi tanaman yang sedang berbuah dengan cara mengambil kulit batang dengan jarak 80-100 cm dari bagian dasar tanaman, yaitu bagian tanah dan dipotong melintang sepertiga dari ukuran kulit batang dengan tinggi 10 cm, dengan jarak pengambilan kulit batang berikutnya, yaitu 20 cm agar sampel yang digunakan representatif. Tanaman apel beludru (Lampiran 2) yang diambil merupakan tanaman budidaya dan bukan tanaman liar, karena penggunaan tanaman budidaya sebagai tanaman penelitian jauh lebih baik dibandingkan dengan tanaman liar. Kerugian dari penggunaan tanaman liar, yaitu ketidakpastian dari kondisi dan perlakuan tanaman, terkait pemupukan dan intensitas cahaya matahari yang diterima tanaman sehingga kandungan metabolit sekunder menjadi berbeda. Ketidakpastian umur tanaman yang sama karena dengan adanya perbedaan umur tanaman juga akan mempengaruhi kandungan metabolit sekunder yang ada.
C. Hasil Preparasi Sampel 1. Hasil ekstraksi sampel
kerusakan yang disebabkan suatu enzim pada tanaman yang dapat merusak senyawa antioksidan sehingga perlu proses pengeringan untuk mengurangi terjadinya kerusakan senyawa antioksidan pada tanaman tersebut sehingga pada penelitian ini juga digunakan tanaman dengan proses pengeringan.
Proses pembuatan ekstrak simplisia kulit batang apel beludru dimulai dengan proses penyortiran dan pencucian kulit batang apel beludru menggunakan air mengalir yang bertujuan menghilangkan kontaminasi dari benda asing seperti tanah debu, dan bagian tanaman lain yang dapat mengacaukan penelitian. Kemudian, kulit batang apel beludru diangin-anginkan dengan tujuan menghilangkan air karena proses pencucian. Mursyidi (1990) menyatakan bahwa pengeringan dengan suhu di bawah 100oC tidak akan mengubah molekul flavonoid, karena proses pemanasan dimaksudkan untuk mencegah kerja enzim dan panas yang digunakan tidak terlalu tinggi. Oleh karena itu, proses selanjutnya adalah proses pengeringan pada oven dengan suhu 40-60oC hingga kulit batang apel beludru menjadi kering, rapuh dan mudah untuk dipatahkan.
Metode ekstraksi yang dipilih adalah maserasi karena ekstraksi dengan maserasi tidak melibatkan pemanasan sehingga dapat mengurangi terjadinya perubahan senyawa pada simplisia. Proses maserasi dilakukan dengan perendaman ekstrak tumbuhan dengan pelarut organik yang menyebabkan dinding dan membran sel pecah karena adanya perbedaan tekanan di dalam dan di luar sel sehingga metabolit sekunder yang ada di sitoplasma akan larut pada pelarut organik dan ekstraksi senyawa menjadi sempurna. Hal inilah yang menjadi keuntungan proses maserasi untuk isolasi senyawa dari bahan alam.
Cairan penyari yang dipilih adalah metanol karena metanol merupakan pelarut universal dan kemampuan penetrasi ke dalam sel tanaman lebih kuat dibandingkan etanol ataupun penyari yang lain (Depkes RI, 2000). Kepolaran metanol lebih tinggi dibandingkan dengan etanol, yaitu metanol 5,1 dan etanol 4,3 sehingga metanol lebih mudah untuk berinteraksi dengan senyawa fenolik yang memiliki sifat polar (like dissolve like) (Snyder, 1997). Penyari yang digunakan untuk proses maserasi adalah campuran metanol dan air karena penggunaan campuran metanol dan air akan menghasilkan jumlah rendemen lebih banyak dibandingkan dengan campuran lain (Sultana, 2009). Pelarut pertama adalah metanol : air (9:1), sedangkan pelarut kedua adalah metanol : air (1:1) (Mursyidi, 1990).
shaker agar proses maserasi menjadi efektif karena kontak antara penyari dengan sel-sel kulit batang apel beludru lebih banyak dibandingkan jika hanya didiamkan saja dan untuk menghindari terjadinya pengendapan. Pengendapan dapat mengurangi kontak antara penyari dengan serbuk simplisia diakibatkan oleh luas kontak serbuk dengan penyari menjadi lebih kecil karena adanya ikatan yang kuat antar partikel tersebut. Setelah dimaserasi selama satu hari kemudian dilakukan proses penyaringan menggunakan corong Buchner dan kertas saring dengan bantuan pompa vakum untuk mempercepat proses penyaringan. Ampas hasil penyaringan dimaserasi dengan pelarut kedua, yaitu metanol : air (1:1) selama satu hari kemudian dilakukan proses penyaringan dengan bantuan pompa vakum.
Filtrat yang diperoleh dari proses penyaringan pertama dan kedua digabung kemudian diuapkan dengan vacuum rotary evaporator dengan tujuan agar filtrat metanol yang diuapkan tidak kontak langsung dengan panas karena dapat merusak kandungan senyawa yang ada di filtrat metanol. Hasil ekstrak metanolik kulit batang apel beludru yang diperoleh yaitu, 400 mL.
2. Hasil fraksinasi ekstrak
Hasil ekstrak metanolik yang diperoleh diekstraksi lagi menggunakan petroleum eter yang bertujuan untuk menghilangkan senyawa yang yang bersifat non polar seperti lipid yang dapat mengganggu dalam penelitian. Menurut Snyder (1997) indeks polaritas petroleum eter, yaitu 0,1 berarti bersifat sangat non polar.
tingkat kepolaran berbeda. Ekstrak metanolik diekstraksi cair-cair menggunakan petroleum eter dengan menggunakan petroleum eter dengan perbandingan 1:1 pada corong pisah kemudian digojog dengan perlahan yang bertujuan sehingga memudahkan dalam pemisahan dengan pencampuran. Fase air akan berada di bagian bawah karena air memiliki berat jenis yang lebih besar dibandingkan petroleum eter, yaitu 0,730 sedangkan air sebesar 0,996 (Depkes RI, 1995). Fraksi air akan digunakan analisis lebih lanjut.
Fraksinasi bertujuan untuk menarik senyawa yang lebih larut dalam etil asetat untuk menguji aktivitas antioksidan sehingga akan lebih mendapatkan hasil yang spesifik pada senyawa flavonoid dengan golongan isoflavones, flavanones, methylated flavones, and flavonols (Andersen dan Markham, 2006). Fraksi air yang merupakan hasil fraksinasi menggunakan petroleum eter akan difraksinasi kembali dengan etil asetat. Indeks polaritas etil asetat yaitu 4,4 (Snyder, 1997). Etil asetat berfungsi untuk mengekstraksi aglikon polihidroksi misalnya aglikon flavonon, flavon dan flavonol (Rathee, Patro, Mula, Gamre dan Chattopadadhyay, 2006).
Fraksi etil asetat yang digunakan untuk analisis lebih lanjut kemudian diuapkan menggunakan vacuum rotary evaporator untuk mendapatkan ekstrak pekat. Penggunaan vacuum rotary evaporator bertujuan untuk meminimalkan terjadinya kerusakan senyawa fenolik karena adanya proses pemanasan. Sisa fraksi etil asetat kemudian dioven selama satu hari untuk menguapkan sisa pelarut sehingga didapatkan ekstrak kering. Sebelumnya cawan porselen yang masih kosong ditimbang untuk mendapatkan bobot fraksi etil asetat. Fraksi kering etil asetat kemudian ditaruh dalam cawan porselen yang dibungkus ditutup dengan alumunium foil supaya tidak terpapar udara dan sinar UV dan dapat mendegradasi senyawa fenolik yang terkandung. Fraksi etil asetat yang sudah dibungkus kemudian disimpan dalam desikator agar tidak terpapar lembab dan ditumbuhi jamur atau mikroba. Bobot fraksi etil asetat yang didapat sebesar 8,25 g dan rendemen fraksi etil asetat yang didapat adalah 4,125%.
D. Hasil Uji Pendahuluan 1. Uji pendahuluan fenolik
maka semakin banyak kromagen (biru), sehingga makin besar intensitas warna biru yang terbentuk.
Kontrol positif digunakan asam galat ditambahkan dengan Folin Ciocalteu dan Na2CO3. Pengujian fraksi etil asetat ekstrak metanolik kulit batang apel beludru menunjukkan hasil positif yaitu warna biru setelah direaksikan dengan Folin Ciocalteu dan Na2CO3 berarti fraksi etil asetat ekstrak metanolik kulit batang apel beludru mengandung senyawa fenolik. Hal ini berbeda ketika hanya kontrol negatif tanpa larutan uji berwarna bening yang memiliki warna mirip dengan asam galat.
Gambar 7. Hasil uji pendahuluan fenolik. Gambar A merupakan Folin Ciocalteu dan Na2CO3, gambar B adalah asam galat ditambah Folin Ciocalteu dan Na2CO3 , gambar C
larutan uji (fraksi etil asetat ekstrak metanolik kulit batang apel beludru ditambah Folin Ciocalteu dan Na2CO3) , gambar D adalah asam galat gambar E : larutan uji (fraksi etil
2. Uji pendahuluan aktivitas antioksidan
Uji pendahuluan bertujuan untuk mengetahui aktivitas antioksidan dari fraksi etil asetat ekstrak metanolik kulit batang apel beludru secara kualitatif. Uji ini menggunakan radikal DPPH dan senyawa uji yaitu fraksi etil asetat ekstrak metanolik kulit batang apel beludru. Menurut Badarinath, Mallikarjuna, Chetty, Madhu, Rajan dan Gnanaprakash (2010) prinsip metode DPPH untuk mengetahui aktivitas antioksidan yaitu berdasarkan reaksi reduksi DPPH. DPPH adalah suatu radikal bebas yang stabil pada suhu ruangan dan berwarna violet dalam metanol. Radikal DPPH ketika bereaksi dengan antioksidan akan merusak rantai yang bertanggung jawab sebagai pemberi warna violet sehingga menjadi warna kuning Kontrol positif yaitu radikal DPPH ditambahkan dengan kuersetin. Pengujian fraksi etil asetat ekstrak metanol kulit batang apel beludru menunjukkan hasil positif yaitu warna kuning saat direaksikan dengan DPPH yang berarti fraksi etil asetat kulit batang apel beludru memiliki aktivitas antioksidan.
Gambar 8. Hasil uji pendahuluan aktivitas antioksidan DPPH (Gambar A merupakan DPPH, gambar B adalah DPPH dan kuersetin, gambar C merupakan DPPH dan fraksi etil asetat ekstrak metanolik kulit batang apel beludru, gambar D
E. Hasil Optimasi Metode Uji Fenolik Total 1. Penentuan operating time (OT)
Penentuan operating time bertujuan untuk mendapatkan waktu optimum dimana reaksi antara larutan baku pembanding (asam galat) dan larutan uji (fraksi etil asetat ekstrak metanolik kulit batang apel beludru) terhadap reagen Folin-Ciocalteu. Penentuan operating time diperoleh ketika waktu absorbansi baku pembanding dan larutan uji terhadap reagen sudah mulai stabil. Estimasi waktu yang digunakan adalah dalam tiga puluh menit dengan selang waktu lima menit. Waktu akan dihitung setelah reagen dicampurkan dan absorbansi pertama dihitung setelah lima menit pertama. Panjang gelombang maksimum yang dipakai adalah panjang gelombang maksimum teoritis, yaitu 750 nm.
Gambar 10. Grafik penentuan operating time fraksi etil asetat
Gambar 9 merupakan gambar yang mewakili penentuan operating time
asam galat dari 3 replikasi dan dan diperoleh operating time asam galat, yaitu 20 menit karena pada waktu ini reaksi sudah bereaksi sempurna dan reaksi mulai stabil. Gambar 10 adalah penentuan operating time fraksi etil asetat ekstrak metanolik kulit batang apel beludru dan diperoleh OT 40 menit. Makin lama waktu yang digunakan maka absorbansi yang dihasilkan juga semakin tinggi. 2. Penentuan panjang gelombang serapan maksimum ( maks)
Tabel I. Hasil scanning panjang gelombang maksimum asam galat yang direaksikan direaksikan dengan Folin-Ciocateu dengan menggunakan tiga konsentrasi dan diperoleh panjang gelombang maksimum, yaitu 751 nm.
F. Hasil Estimasi Kandungan Fenolik Total
Gambar 11. Reaksi asam galat dengan molybdenum yang merupakan komponen Folin-Ciocalteu
Metode Folin-Ciocalteu adalah metode yang digunakan untuk penetapan
kandungan fenolik total. Folin-Ciocalteu akan mengoksidasi fenol menggunakan
garam alkali (natrium karbonat) dan mereduksi asam heteropoli menjadi suatu
kompleks molibdenum-tungsten, sehingga nilai yang didapat signifikan dengan
Tabel II. Hasil pengukuran absorbansi seri baku asam galat yang direaksikan dengan Folin-Ciocalteu
Asam galat
Replikasi 1 Replikasi 2 Replikasi 3
Konsentrasi
Gambar 12. Kurva persamaan regresi linier asam galat dalam penetapan fenolik total fraksi
etil asetat ekstrak metanolik kulit batang apel beludru
apel beludru. Gambar 12 merupakan gambar untuk penetapan kandungan fenolik total fraksi etil asetat ekstrak metanolik kulit batang apel beludru berdasarkan pada persamaan regresi linier asam galat dari tiga replikasi dan dipilih replikasi III dengan y = 5,378.10-3 x -0,0564 dan nilai r yang paling baik yaitu r= 0,9997.
Tabel III. Hasil penentuan jumlah fenolik total fraksi etil asetat ekstrak metanolik kulit batang apel beludru
Tabel III merupakan hasil penentuan fenolik total fraksi etil asetat ekstrak metanolik kulit batang apel beludru yang dihitung dari persamaan regresi linear yaitu y = 5,378.10-3 x -0,0564 sehingga diperoleh kandungan fenolik total fraksi etil asetat ekstrak metanolik kulit batang apel beludru sebesar 1311,3 ± 72,80 mg ekivalen asam galat per g fraksi etil asetat
G. Hasil Optimasi Metode Uji Aktivitas Antioksidan 1. Penentuan panjang gelombang maksimum ( maks)
ditimbulkan pada DPPH, karena DPPH memiliki gugus kromofor dan auksokrom. Kromofor merupakan semua gugus atau atom yang dapat menyerap sinar ultraviolet dan sinar tampak, dimana merupakan gugus tak jenuh yang dapat menjalani transisi π→π* dan n→π* dan auksokrom adalah gugus yang tidak dapat menjalani transisi π→π* tetapi dapat menjalani transisi elektron n) (Gandjar dan Rohman, 2007).
Gambar 13. Gugus kromofor dan auksokrom radikal DPPH
Metode DPPH digunakan dalam menentukan aktivitas antioksidan karena
merupakan metode yang cepat, efisien jika dibandingkan dengan deoksiribosa yang
terlebih dahulu membentuk radikal hidroksil fenton dan perlu adanya penambahan
Tabel IV. Hasil scanning panjang gelombang maksimum DPPH pada berbagai
Penentuan panjang gelombang maksimum menggunakan tiga konsentrasi yaitu 0,020; 0,040; dan 0,080 mM dengan tujuan agar dapat mempresentasikan panjang gelombang maksimum dari setiap konsentrasi untuk pembuatan kurva baku. Absorbansi sampel dihitung dengan autozero menggunakan pelarut yang digunakan yaitu metanol yang bertujuan agar tidak ada gangguan serapan dari metanol dan kontaminan dari metanol yang digunakan. Hasil scanning panjang gelombang maksimum pada tiga konsentrasi diperoleh rata-rata sebesar 515,8 nm sehingga dibulatkan menjadi 516 nm dan menjadi panjang gelombang yang digunakan untuk pengukuran.
Gambar 14. Scanning panjang gelombang maksimum DPPH pada beberapa konsentrasi
2. Penentuan operating time
Gambar 15 .Grafik penentuan operating time kuersetin (Replikasi 3)
Gambar 16. Grafik penentuan operating time fraksi etil asetat ekstrak metanolik kulit batang apel beludru (replikasi 1)
waktu operating time 30 menit karena pada waktu ini reaksi sudah bereaksi sempurna dan reaksi mulai stabil. Menurut Molyneux (2004) operating time 30 menit merupakan waktu yang sering digunakan dalam mereaksikan DPPH. Makin lama waktu penentuan operating time, maka semakin besar absorbansi yang dihasilkan.
H. Hasil Estimasi Aktivitas Antioksidan dengan Radikal DPPH
Metode DPPH merupakan suatu metode uji kuantitatif untuk mengetahui seberapa besar aktivitas antioksidan dari fraksi etil asetat kulit batang apel beludru. Badarinath dkk (2010) menyatakan bahwa metode DPPH memiliki beberapa keuntungan, yaitu efektif, teknik yang mudah dan cepat dalam pengerjaan penelitian karakteristik ekstrak tanaman, serta potensi sampel dapat diketahui.
Gambar 17 merupakan perubahan warna larutan reaksi DPPH dengan antioksidan. Molyneux (2004) menyatakan bahwa senyawa antioksidan akan mendonorkan H pada radikal DPPH sehingga DPPH menjadi tereduksi membentuk DPPH-H tereduksi. Perubahan DPPH menjadi DPPH-H tereduksi akan menyebabkan perubahan warna larutan DPPH yang semula berwarna ungu menjadi kuning yang diikuti dengan penurunan absorbansi DPPH yang digunakan untuk mengetahui aktivitas antioksidan.
Pada tanaman dengan profil kandungan kimia satu spesies tumbuhan dalam satu genus umumnya akan menunjukkan kandungan kimia yang mirip (Muharni, 2010). Menurut Duke (2001) tanaman Diospyros virginiana L yang masih satu genus dengan apel beludru (Diospyros blancoi A. DC.) ditemukan adanya kuersetin (Duke, 2001).Peneliti menduga bahwa kulit batang apel beludru memiliki potensi sebagai antioksidan karena secara empiris tanaman apel beludru ini memiliki khasiat untuk mengobati luka, demam, disentri dan diare (Das dkk., 2010). Kuersetin merupakan senyawa flavonoid yang cukup kuat sebagai senyawa antioksidan.
Parameter yang digunakan untuk mengetahui besarnya kemampuan senyawa sebagai antioksidan, yaitu IC50. IC50 merupakan konsentrasi senyawa antioksidan yang dibutuhkan untuk mengurangi radikal DPPH sebesar 50 % (Zou dkk., 2004). Menurut Rohman, dkk (2009) nilai IC50 diperoleh dari persamaan regresi linier yang menyatakan hubungan antara konsentrasi ekstrak atau fraksi uji dan % penangkapan radikal. Makin kecil nilai IC50 maka semakin aktif ekstrak atau fraksi (senyawa uji) tersebut sebagai penangkap radikal DPPH dan semakin aktif sebagai antioksidan.
Reaksi penghambatan radikal bebas DPPH oleh senyawa kuersetin dimulai dengan radikal bebas DPPH yang bereaksi dengan senyawa antioksidan akan mengikat H yang berasal dari antioksidan, yaitu kuersetin, sehingga sifat radikal bebas yang dimiliki DPPH menjadi hilang. DPPH-H yang tidak lagi berbentuk radikal maka delokalisasi elektron tidak terjadi sehingga intensitas warna menjadi berkurang. Reaksi lain yang mungkin muncul ketika kuersetin telah menjadi radikal yaitu transformasi dari radikal dengan DPPH maupun dimerisasi dengan sesama kuersetin sehingga terjadi polimerisasi.
Tabel VI. Hasil aktivitas antioksidan fraksi etil asetat ekstrak metanolik kulit batang apel beludru dengan metode DPPH
proporsional antara peningkatan konsentrasi dan % IC yang dihasilkan. Hasil ketiga replikasi pada kuersetin maupun fraksi etil asetat dapat disimpulkan bahwa replikasi ketiga pada kuersetin dan replikasi pertama fraksi etil asetat digunakan untuk perhitungan IC50 karena memiliki nilai r yang paling baik, yaitu 0,9997 dan 0,9924.
Tabel VII. Hasil perhitungan IC50 kuersetin
Kuersetin
Replikasi IC50
(µg/mL)
Rerata (µg/mL)
SD
I 11,04
10,80 0,31
II 10,92
III 10,45
Berdasarkan tabel VII nilai IC50 kuersetin sebesar 10,80 ± 0,31 µg/mL. Hal ini berarti dalam menangkap radikal bebas sebesar 50% diperlukan konsentrasi kuersetin sebesar 10,80 ± 0,31 µg/mL.
Gambar 19 merupakan kurva regresi linear konsentrasi kuersetin dengan aktivitas antioksidan menggunakan metode penangkapan radikal DPPH. Makin besar konsentrasi yang digunakan, maka semakin besar % IC yang akan dihasilkan.
Tabel VIII. Hasil perhitungan IC50 fraksi etil asetat ekstrak metanolik
kulit batang apel beludru
Fraksi etil asetat ekstrak metanolik kulit batang apel beludru
Replikasi IC50
(µg/mL)
Rerata (µg/mL)
SD
I 15,62
14,3 1,42
II 14,50
III 12,79
Berdasarkan tabel VIII nilai IC50 fraksi etil asetat kulit batang apel beludru sebesar 14,30 ± 1,42 µg/mL. Hal ini berarti dalam menangkap radikal bebas sebesar 50% diperlukan konsentrasi fraksi etil asetat ekstrak metanolik kulit batang apel beludru sebesar 14,30 ± 1,42 µg/mL.
Gambar 20 merupakan kurva regresi linier antara konsentrasi fraksi etil asetat kulit batang apel beludru dengan aktivitas antioksidan menggunakan metode penangkapan radikal DPPH. Semakin besar konsentrasi yang digunakan, maka semakin besar % IC yang akan dihasilkan.
Tabel IX. Penggolongan tingkat kekuatan antioksidan kuersetin dan fraksi etil asetat ekstrak metanolik kulit batang apel beludru (Ariyanto, 2006 cit., Sambada,
2011)
Intensitas Nilai IC50 Kuersetin Fraksi etil asetat ekstrak metanolik kulit batang
Pembacaan hasil aktivitas antioksidan kuersetin dan fraksi etil asetat kulit batang apel beludru digunakan uji kebermaknaan untuk membandingkan antara faktor eksperimental dengan statistik agar diperoleh keputusan yang benar.
asetat kulit batang apel beludru. Uji parametrik yang digunakan adalah uji t tidak berpasangan yang dilakukan untuk melihat adanya perbedaan antara rerata IC50 kuersetin dan etil asetat. Dari hasil perhitungan dengan program R didapatkan nilai p adalah 0,0142 dengan nilai signifikansi yang ditentukan, yaitu 0,05 (taraf kepercayaan 95%) Hnull ditolak karena nilai signifikansi yang dihasilkan lebih kecil daripada nilai signifikansi yang ditentukan. Oleh karena itu, dapat disimpulkan bahwa nilai rerata IC50 kuersetin berbeda bermakna dengan IC50 fraksi etil asetat ekstrak metanolik kulit batang apel beludru.
57 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Fraksi etil asetat ekstrak metanolik kulit batang apel beludru tiap gram memiliki kandungan fenolik total sebesar (1311,3 ±72,80) mg ekivalen asam galat (taraf kepercayaan 95%)
2. Nilai aktivitas antioksidan fraksi etil asetat ekstrak metanolik kulit batang apel beludru dengan menggunakan radikal bebas DPPH yang dinyatakan sebagai
IC50 sebesar (14,3 ± 1,42) µg/mL (taraf kepercayaan 95%) dan tergolong sangat kuat.
B. Saran
DAFTAR PUSTAKA
Andayani, R., Lisawati Y., dan Maimunah, 2008, Penentuan Aktivitas Antioksidan Kadar Fenolat Total dan Likopen Pada Buah Tomat (Solanum Lycopersicum L.), Jurnal Sains dan Teknologi Farmasi., 12(1), 31-37. Andersen, O. M., Markham, dan Kenneth R., 2006, Flavonoids, Chemistry
Biochemistryand Applications, Taylor and Francis Group, United States of America, pp. 2-3.
Apak, R., Guclu, K., Demirata, B., Özyürek, M., Celik, S. E., Bektaşoğlu , B., et al., 2007, Comparative Evaluation of Various Total Antioxidant Capacity Assays Applied to Phenolic Compounds with the CUPRAC Assay, 12, 1496-1547.
Aqil, F., Ahmad, I., dan Mehmood, Z., 2006, Antioxidant and Free Radical Scavenging Propertis of Tweleve Traditionally Used Indian Medical Plants, Turk J Biol., 30, 177-183.
Badarinath, A.V., Mallikarjuna, R. K., Chetty, C., Madhu, S. R., Rajan, T.V.S., Gnanaprakash, K., 2010, A Review on In-vitro Antioxidant Methods: Comparisions, Correlations and Considerations, Int. J. Pharm. Tech. Research., 2(2), 1276-1285.
Bondet, V., Brand-Williams, W., dan Berset, C., 1997, Kinetics and Mechanisms of Antioxidant Activity using the DPPH• Free Radical Method, Lebensm.-Wiss.U.-Technol., 30, 609–615.
Dahlan, M. S., 2012, Statistik untuk Kedokteran dan Kesehatan, Salemba Medika, Jakarta, p.17.
Das, S.C., Hamid, K., Bulbul, I.I., Sultana, S., dan Islam, S., 2010, In Vitro Antioxidant Activity of Different Parts of the Plant Diospyros discolor, J.Agric.Biol.Sci.Research., 6(4), 472-475.
Dehpour, A.A., Ebrahimzadeh, M.A., Fazel, N.S., dan Mohammad, N.S., 2009, Antioxidant Activity of The Methanol Extract of Ferula assafoetida and Its Essential Oil Composition, Grasas Y Aceites, 60(4), 405-412.
Depkes RI, 1986, Sediaan Galenik, Direktorat Jenderal Pengawasan Obat dan Makanan, Jakarta, pp.10-12.
Depkes RI, 1995, Farmakope Indonesia, Edisi, IV, Departemen Kesehatan Republik Indonesia, Jakarta, pp. 7, 1036, 1061.
Duke, J.A., 2001, Handbook of Phytochemical Constituents of Gras Herbs and Other Economic Plants, CRC Press, Washington, D.C., p. 235.
Fadhli, 2008, Uji Fitokimia, http ://www.scribd.com/doc/16766643/UjiFitokimia? Secret_password=autodown=pdf,diakses tanggal 15 Juni 2013.
Fatimah, 2012, Uji Kuantitatif Dna, Tesis, PBT Ahli Pertamina.
Gandjar, I.G., dan Rohman, A., 2007, Kimia Farmasi Analisis, Pustaka Pelajar, Yogyakarta, pp.229, 234, 255.
Gutteridge, J. M. C., dan Halliwell, B., 2000, Free Radical in Biology and Medicine; Oxford UniversityPress: New York, 136-138.
Howlader, M.S.I., Rahman, M.M., Khalipha, A.B.R., Ahmed, F., dan Rahman, M.M., 2012, Antioxidant anad Antidiarrhoeal Potentiality of Diospyros blancoi, Int. J. Pharm., 8(5), 403-409.
International Plant Names Index, 2013, Author Details : Candolle, Alphonse Louis Pierre Pyramus de (1806-1893), http://www.ipni.org/ipniauthorsearch page. do diakses 11 Juli 2013.
Kalita, D., Kar, R., dan Handique, J. G., 2011, A Theoretical Study On The Antioxidant Property Of Gallic Acid And Its Derivatives, J.Theor. Comput.Chem., 11(2), 391-402.
Lee, M.H., Jiang, C.B., Juan, S.H., Lin R.H., dan Hou, W.C., 2006, Antioxidant and heme oxygenase-1 (HO-1)-induced effects of selected Taiwanese plants, J.Fitote., 77, 109–115.
Markham, K.R., 1988, Techniques of Flavoniods Identification, diterjemahkan oleh Padmawinata, K., hal.15, Penerbit ITB, Bandung.
Marxen, K., Vanselow, K.H., Lippemeier, S., Hitsze, R., Ruser, A., dan Hansen, U., 2007, Determination of DPPH Radical Oxidation Caused by Methanolic Extract of Some Mircroalgal Species by Linear Regression Analysis of Spectrofotometric Measurements, Sensors, 7.