BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
A. Ekstraksi
Metode ekstraksi yang digunakan adalah metode perkolasi. Metode ini dipakai karena dapat melarutkan senyawa yang tahan panas maupun tidak tahan panas karena dalam proses perkolasi ini tidak menggunakan pemanasan.
Ekstraksi dilakukan dalam empat tahap menggunakan empat pelarut yang berbeda dari tingkat kepolaran rendah ke kepolaran tinggi. Berturut-turut menggunakan pelarut n-heksan, kemudian kloroform, etil asetat, dan etanol 96%. Jumlah ektrak yang diperoleh dari masing-masing pelarut dari 50 gram simplisia adalah ekstrak n-heksan sebesar 6,3 gram, ekstrak kloroform sebesar 5,4 gram, ekstrak etil asetat sebesar 4,6 gram, dan ekstrak etanol 96% sebesar 5,7 gram.
B. Uji Sitotoksisitas Ekstrak
Masing-masing ekstrak kemudian diuji sitotoksik menggunakan metode MTT Assay untuk mengetahui nilai LC50 dari masing-masing ektrak tersebut.
Nilai LC50 merupakan konsentrasi yang menyebabkan kematian sebanyak 50%
dari sel uji yang dapat diestimasi dengan grafik dan perhitungan. Sel kanker yang digunakan adalah sel HeLa (Djajanegara dan Wahyudi, 2009).
Kultur sel HeLa sering digunakan sebagai model penelitian karena tumbuh lebih cepat sehingga mampu memproduksi lebih banyak sel dalam satu flask dan
merupakan sel manusia yang umum digunakan untuk kepentingan kultur sel. Kultur sel HeLa bersifat semi melekat, karena sel kultur melepas suatu protein
commit to user
matriks ekstraseluler sehingga menyebabkan sel-sel tersebut menempel antara satu dan lainnya dan menempel pada dasar flask.
Metode MTT Assay memiliki beberapa keuntungan yaitu sederhana dan
sangat efisien untuk kemosensitifitas sehingga banyak digunakan dalam metode uji sitotoksik. Prinsip MTT Assay adalah metode spektroskopi dengan
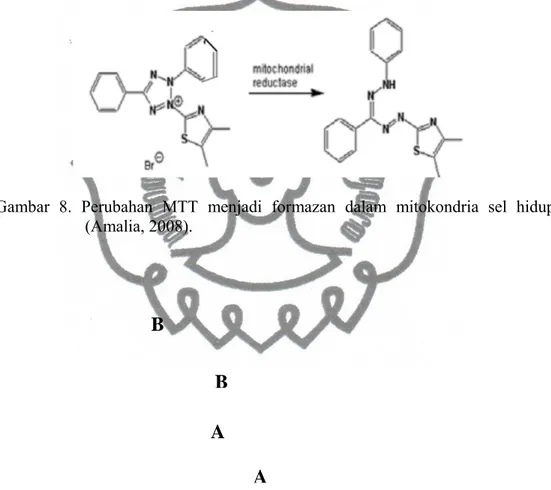
menentukan nilai absorbansi formazan. MTT akan diserap ke dalam sel dan masuk ke dalam sistem respirasi sel dalam mitokondria. Tindakan dari enzim aktif dalam sel mitokondria adalah memetabolisme garam tetrazolium, sehingga pemutusan cincin tetrazolium oleh enzim dehidrogenase yang menyebabkan tetrazolium formazan berubah menjadi tidak larut air tetapi larut dalam SDS 10% dan berwarna ungu. Formazan terbentuk berwarna ungu akan proporsional dengan jumlah sel hidup (Pebriana et al., 2008).
Sel yang mati dilarutkan dalam air dan tetap berwarna kuning karena mitokondria sel-sel yang mati tidak melakukan respirasi sehingga cincin tetrazolium terputus dan tidak dapat menyerap reagen MTT. Karakteristik morfologi sel-sel hidup berbentuk bulat dengan dinding sel yang bersinar dan menempel pada pelat bawah karena terbentuknya kristal formazan (Gambar 9A). Sel yang mati berwarna gelap dan tidak menempel pada plat dasar karena tidak membentuk kristal formazan (Gambar 9B), karena sel yang mati kehilangan kemampuannya untuk mempertahankan dan memberikan energi bagi fungsi metabolik serta pertumbuhan sel. Morfologi sel setelah penambahan MTT disajikan pada Gambar 9. Setelah penambahan MTT dan diinkubasi selama 4 jam, ditambah SDS dalam HCl 10%. Alasan penggunaan SDS 10% karena dapat
melarutkan kristal formazan dan hasil reaksi MTT tidak menyebabkan pengendapan. Setelah didiamkan semalam, kemudian dibaca menggunakan ELISA Reader untuk menentukan nilai absorbansi. panjang gelombang yang
digunakan adalah 550 nm merupakan panjang gelombang maksimum untuk mendapatkan pengukuran yang sensitif dan spesifik (Pebriana et al., 2008).
Gambar 8. Perubahan MTT menjadi formazan dalam mitokondria sel hidup (Amalia, 2008).
Gambar 9. Sel yang hidup membentuk kristal formazan, (A) Sel hidup, (B) Sel mati pada perbesaran 100 kali.
Sebelum dilakukan pengujian, sel ditumbuhkan hingga konfluen atau mencapai jumlah yang dibutuhkan yaitu mencapai kerapatan 2x104. Media kultur yang digunakan adalah media RPMI (Rosewell Park Memorial Institute) 1640
B
A
A
B
commit to user
kultur sel seperti sel HeLa (Freshney, 2000). Pada media RPMI 1640 juga ditambahkan serum FBS (Fetal Bovine Serum). Serum ini mengandung hormon
yang dapat memacu pertumbuhan sel. Komposisi media RPMI 1640 disajikan pada Lampiran 1.
Sel yang konfluen ditandai dengan menempelnya sel pada dasar tissue flask. Sel HeLa bersifat semi melekat sehingga untuk melepaskannya memerlukan
tripsin yang berfungsi untuk melepaskan interaksi antara molekul glikoprotein dan proteoglikan dengan permukaan tissue flask hingga sel tidak dapat melekat di
dasar tissue flask (Doyle dan Griffith, 2000). Sebelumnya tripsin telah diberikan
PBS (Phospate Buffer Saline) yang berfungsi untuk menghilangkan serum pada
media RPMI 1640 karena serum ini dapat menghambat kerja tripsin (Freshney, 2005). Morfologi sel HeLa terlihat berbentuk agak runcing karena melekat di dasar tissue flask, sedangkan yang telah diberi tripsin terlihat berbentuk bulat
karena tidak melekat pada dasar tissue flask yang dapat dilihat pada Gambar 10.
(a) (b)
Gambar 10. (a) sel HeLa sebelum diberi tripsin, (b) sel HeLa setelah diberi tripsin
pada perbesaran 100 kali. Keterangan: (A) sel hidup.
Sel yang sudah dipanen dipindahkan ke dalam conical tube berisi 12 mL
media RPMI komplit (FBS, Pens-strep, Fungizon) kemudian disentrifugasi A
dengan kecepatan 3400 rpm selama 5 menit. Dilanjutkan perhitungan kerapatan sel hingga mencapai jumlah 2x104 dengan hemocytometer.
Gambar 11. Morfologi sel HeLa pada saat perhitungan dengan hemocytometer
pada mikroskop cahaya dengan perbesaran 100 kali. Keterangan: (A) sel hidup.
Setelah 24 jam dilakukan pengamatan terhadap kematian sel di bawah mikroskop. Hasil pengamatan menunjukkan perbedaan jumlah kematian sel pada setiap perlakuan. Sel yang mati akan terlihat berwarna gelap, karena mengalami lisis sehingga protein dalam plasmanya akan berikatan dengan ekstrak sehingga sel menjadi berwarna gelap dan bentuknya tidak bulat lagi. Sedangkan sel yang hidup akan berbentuk bulat, lebih terang, dan jernih karena tidak mengalami kerusakan pada membran selnya. Morfologi sel HeLa dapat dilihat pada Gambar 12 dan untuk morfologi sel HeLa setiap perlakuan dapat dilihat pada Lampiran 2.
commit to user
Gambar 12. Morfologi sel HeLa setelah penambahan ekstrak pada perbesaran 100x dengan konsentrasi 2000 µg/mL. (a) ektrak etil asetat, (b) ektrak etanol 96%, (c) ekstrak n-heksan, (d) ekstrak kloroform, dan (e) kontrol negatif DMSO. Keterangan: (1) sel hidup tampak berbentuk bulat jernih dan bercahaya di tengahnya dan (2) sel mati tampak berbentuk bulat dan keruh di tengahnya.
Dari pengamatan terlihat bahwa penambahan konsentrasi ekstrak uji menyebabkan terjadinya peningkatan jumlah kematian sel. Jumlah sel hidup pada kontrol negatif lebih banyak dibandingkan dengan jumlah sel hidup yang ada pada sumuran dengan penambahan konsentrasi ekstrak uji. Kematian sel lebih banyak terlihat pada ekstrak n-heksan, eksrak kloroform, dan ekstrak etil asetat.
e
1 2d
2c
2b
1 2a
1 2Sedangkan ekstrak etanol 96% terlihat sangat sedikit kematian yang ditimbulkan seperti halnya kontrol negatif yaitu DMSO.
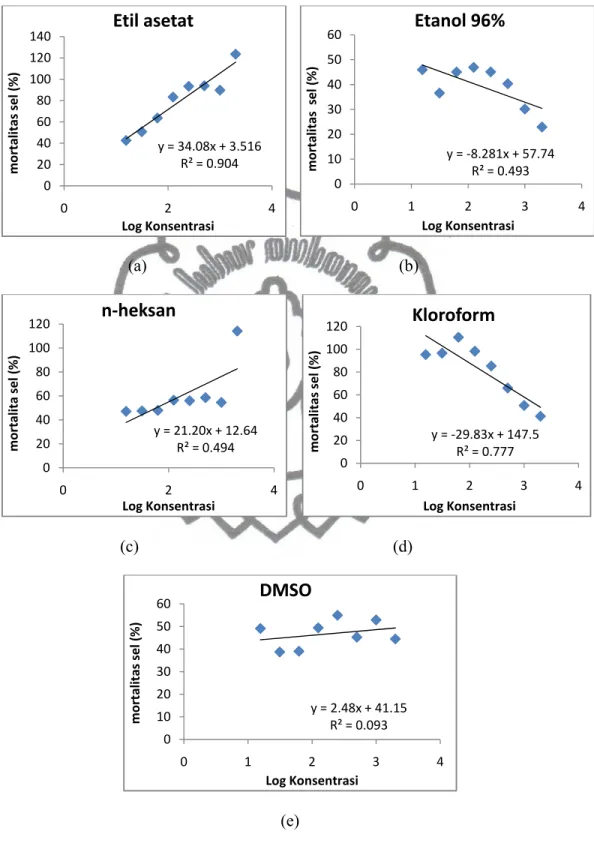
Rendahnya aktivitas sitotoksik pada ekstrak etanol 96% kemungkinan disebabkan karena dalam ekstrak tersebut terdapat beragam senyawa baik yang bersifat polar, semi polar, maupun non polar sehingga efek sitotoksiknya saling mempengaruhi (Djajanegara dan Wahyudi, 2009). Berdasarkan hasil dari persentase kematian sel (Lampiran 4), dilakukan analisis data dengan kurva regresi linier. Kurva regresi linier dapat dilihat pada Gambar 13.
Pada Gambar 13, dapat dilihat bahwa nilai R² grafik etil asetat (Gambar 13.a) dan grafik kloroform (Gambar 13.c) mendekati 1 atau tidak kurang dari 0,6. Hal ini menunjukkan kedekatan hubungan antara konsentrasi ekstrak yang digunakan dengan presentase kematian sel, sehingga dapat diketahui bahwa kematian sel benar-benar disebabkan oleh perlakuan ekstrak. Sedangkan, untuk grafik grafik etanol 96% (Gambar 13.b), ekstrak n-heksan (Gambar 13.c) dan grafik DMSO (Gambar 13.e) nilai R² < 0,6. Hal ini menunjukkan bahwa tidak adanya kedekatan antara ekstrak yang digunakan dengan presentase kematian sel, sehingga dapat diketahui bahwa kematian sel selain disebabkan oleh ekstrak juga disebabkan oleh faktor lain, misalnya fluktuasi dan human error (kesalahan
commit to user
(a) (b) (c) (d) (e)Gambar 13. Grafik hubungan antara presentase kematian dengan log konsenstrasi sampel. (a) etil asetat, (b) etanol 96%, (c) n-heksan, (d) kloroform, dan (e) DMSO. y = 34.08x + 3.516 R² = 0.904 0 20 40 60 80 100 120 140 0 2 4 mo rt ali tas se l (%) Log Konsentrasi
Etil
asetat
y = ‐8.281x + 57.74 R² = 0.493 0 10 20 30 40 50 60 0 1 2 3 4 mortalitas sel (% ) Log KonsentrasiEtanol
96%
y = 21.20x + 12.64 R² = 0.494 0 20 40 60 80 100 120 0 2 4 mortalita sel (%) Log Konsentrasin
‐
heksan
y = ‐29.83x + 147.5 R² = 0.777 0 20 40 60 80 100 120 0 1 2 3 4 mo rtal it as se l (% ) Log KonsentrasiKloroform
y = 2.48x + 41.15 R² = 0.093 0 10 20 30 40 50 60 0 1 2 3 4 mo rt al it as se l (%) Log KonsentrasiDMSO
Nilai LC50 sel HeLa setelah penambahan ekstrak menunjukkan bahwa
eksrak n-heksan memiliki nilai LC50 paling rendah yaitu 0,436 µg/mL, kemudian
ekstrak etil asetat sebesar 1,105 µg/mL, ektrak kloroform sebesar 59841,16 µg/mL. Dalam kasus ekstrak etanol 96% fluktuasi lebih banyak terjadi sehingga nilai LC50 yang diperoleh sebesar 3,467 x 10361 µg/mL. Demikian pula pada
kontrol negatif DMSO memiliki nilai LC50 sebesar 2,691 x 10-15µg/mL. Seperti
pada penelitian Patel et al., (2009) yaitu uji sitotoksisitas ekstrak Solanum nigrum
terhadap sel Vero dengan nilai LC50 sebesar 6,862 x 108 karena mengalami
banyak fluktuasi. Sel vero merupakan sel monolayer berbentuk poligonal dan pipih yang diisolasi dari sel ginjal monyet hijau afrika oleh Yasumura dan Kawakita di universitas Chiba, Jepang. Perhitungan secara lengkap dapat dilihat pada Lampiran 5.
Hasil LC50 menunjukkan bahwa ekstrak daun sirsak dengan pelarut
n-heksan dan etil asetat ini memiliki LC50 < 30 µg/mL sehingga dapat terlihat bahwa
ekstrak daun sirsak memiliki efek sitotoksik dan berpotensi sebagai anti kanker (Meyer et al., 1982). Semakin kecil nilai LC50 menunjukkan potensi senyawa
tersebut semakin kuat (Supardjan dan Da’i. 2005).
Pada penelitian Djajanegara dan Wahyudi (2009), fraksi kloroform daun srikaya (Annona squamosa) dan fraksi etanol 70% dinyatakan bersifat sitotoksik
karena memiliki nilai LC50 < 30 µg/mL. Fraksi kloroform sebesar 4,5467 µg/mL
dan fraksi etanol 70% sebesar 7,6984 µg/mL. Pada penelitian ini, ekstrak n-heksan dan etil asetat daun sirsak memiliki nilai LC50 < 30 µg/mL sehingga
commit to user
Pada penelitian Gajalakhsmi et al., (2012), menyatakan ekstrak etil asetat
daun sirsak (A. muricata L.) terhadap sel U 937 (sel kanker darah/leukemia)
bersifat lebih aktif membunuh sel daripada ekstrak n-heksan dan metanol daun sirsak (A. muricata L.). Hal tersebut membuktikan bahwa daun sirsak bersifat
sitotoksik untuk sel kanker.
Berdasarkan nilai LC50, dapat dikatakan ekstrak yang memiliki potensi
sebagai senyawa antikanker dengan aktivitas sitotoksik terbesar adalah ekstrak n-heksan yang kemudian ekstrak n-heksan akan dilanjutkan untuk proses pemisahan kandungan senyawanya dengan fraksinasi.
C. Deteksi Kandungan Senyawa Ekstrak Teraktif
Deteksi kromatogram ekstrak n-heksan dengan sinar UV254
memperlihatkan terjadinya peredaman yang ditandai dengan adanya beberapa zona gelap berlatar belakang flouresensi hijau (Gambar 14 dan 15). Peredaman tersebut menunjukkan adanya kandungan suatu senyawa. Selain itu, deteksi dengan sinar UV366 memperlihatkan bercak yang berpendar dan berwarna. Hal ini
menunjukkan bahwa senyawa tersebut memiliki ikatan rangkap terkonjugasi yang panjang sehingga dapat berpendar pada penyinaran dengan UV gelombang panjang. Deteksi dengan sinar tampak (visibel) menunjukkan beberapa bercak berwarna.
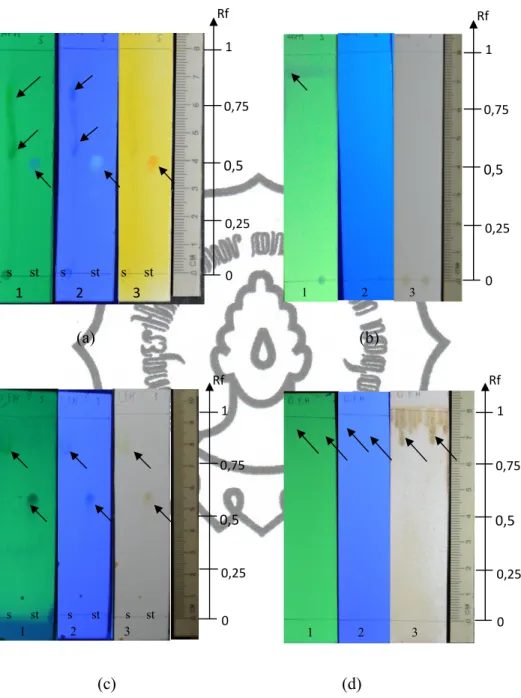
Profil KLT ekstrak n-heksan dengan berbagai profil kandungan senyawa dapat dilihat pada Gambar 14 dan 15.
(a) (b)
(c) (d)
Gambar 14. Profil kromatogram ekstrak n-heksan daun sirsak dengan berbagai metode kromatografi lapis tipis untuk masing-masing senyawa.
Keterangan: (a) alkaloid, (b) antrakuinon, (c) flavonoid, (d) glikosida. (1) UV254, (2) UV366, dan (3) sinar visible.
(s) sampel, (st) standard. 0,5 Rf 0 0,25 0,75 1 s st s st s st 1 2 3 0,5 Rf 0 0,25 0,75 1 1 2 3 0,5 Rf 0 0,25 0,75 1 s st s st s st 1 2 3 0,5 Rf 0 0,25 0,75 1 1 2 3
commit to user
(a) (b)
(c) (d)
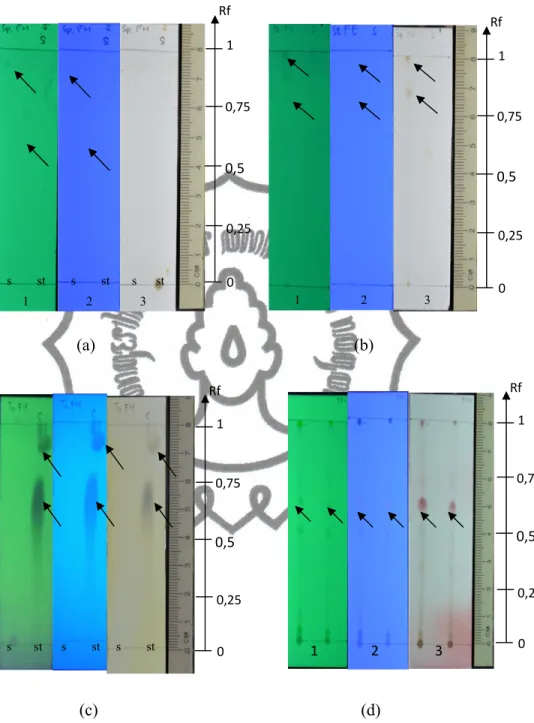
Gambar 15. Profil kromatogram ekstrak n-heksan daun sirsak dengan berbagai metode kromatografi lapis tipis untuk masing-masing senyawa. Keterangan: (a) saponin, (b) steroid, (c) tanin, dan (d) terpenoid. (1) UV254, (2) UV366, dan (3) sinar visibel. (s) sampel, (st) standard. 0,5 Rf 0 0,25 0,75 1 s st s st s st 0,5 Rf 0 0,25 0,75 1 1 2 3 0,5 Rf 0 0,25 0,75 1 s st s st s st 1 2 3 0,5 Rf 0 0,25 0,75 1 1 2 3
Hasil uji KLT ekstrak n-heksan dengan deteksi sinar tampak (visibel) yang telah disemprot dan sinar UV secara spesifik disajikan pada Tabel 1.
Tabel 1. Hasil uji KLT ekstrak n-heksan hasil ekstraksi dengan berbagai pereaksi semprot (uji).
Uji Senyawa Rf
Penampak Bercak (+)
/(-) UV254 UV366 Sinar
visibel Dragendroff (a) Alkaloid Ekstrak 0,56 0,81 Hijau Hijau Berpendar Berpendar - - (-)
Standard 0,5 Hijau Berpendar Oranye
KOH etanolik (b) Antrakuinon Ekstrak - - - - (-) AlCl3 (c) Flavonoid Ekstrak 0,84 Hijau Berpendar Kuning kecoklatan (+) Standard 0,62 Hijau Berpendar Kuning
kecoklatan Asam sulfat
30%
(d) Glikosida
Ekstrak 0,94 Hijau Berpendar Coklat tua (+) Anisaldehid asam sulfat (e) Saponin Ekstrak 0,87 - Berpendar - (-) Standard 0,56 - Berpendar - Lieberman burchad (f) Steroid Ekstrak 0,87 0,97 Hijau Hijau Berpendar Berpendar Coklat Coklat (+) Feriklorid 5% dalam HCl 0,1 N (g) Tanin Ekstrak - - - - (-) Standard 0,87 0,97 Abu-abu tua Abu-abu tua Berpendar Berpendar Abu-abu tua Abu-abu tua
commit to user
Masing-masing senyawa dideteksi menggunakan metode yang berbeda dan pereaksi semprot yang berbeda pula. Berikut keterangan dari masing-masing metode.
a. Deteksi senyawa alkaloid
Fase gerak yang digunakan untuk mendeteksi alkaloid berupa metanol : amoniak 10% (100:1,5 v/v). Pereaksi semprot yang digunakan untuk mendeteksi senyawa ini adalah dragendroff yang merupakan pereaksi semprot untuk mendeteksi keberadaan senyawa yang mengandung basa nitrogen secara umum dan alkaloid. Apabila hasilnya positif, akan menunjukkan bercak berwarna coklat kekuningan setelah disemprot dengan pereaksi semprot dragendroff (Harborne, 1987). Pada hasil kromatogram (Gambar 14.a) tidak muncul adanya bercak berwarna coklat kekuningan, sehingga dapat disimpulkan bahwa di dalam ekstrak n-heksan tidak terdapat senyawa golongan alkaloid.
b. Deteksi senyawa antrakuinon
Fase gerak yang digunakan untuk mendeteksi antrakuinon berupa n-heksan : etil asetat (60:40 v/v). Pereaksi semprot yang digunakan untuk mendeteksi senyawa ini adalah KOH etanolik. Apabila hasilnya positif, akan menunjukkan bercak berwarna semu merah atau merah coklat (Wagner and Bladt, 1996). Pada hasil kromatogram (Gambar 14.b) tidak muncul adanya bercak berwarna semu merah atau merah coklat, sehingga dapat disimpulkan bahwa di dalam ekstrak n-heksan tidak terdapat senyawa yang mengandung antrakuinon.
c. Deteksi senyawa flavonoid
Fase gerak yang digunakan untuk mendeteksi flavonoid berupa butanol : asam asetat : air (4 : 1 : 5 v/v). Pereaksi semprot yang digunakan adalah AlCl3 untuk mendeteksi senyawa ini. Flavonoid akan memberikan
warna kuning jika diamati dengan sinar visible (Wagner, 1984). Pada hasil kromatogram muncul bercak berwarna kuning dengan harga Rf 0,84 (Gambar 14.c), sehingga dapat disimpulkan bahwa di dalam ekstrak n-heksan mengandung senyawa golongan flavonoid.
Flavonoid yang merupakan senyawa fenolik alam memiliki sifat antioksidan dan berpotensi dalam menghambat pertumbuhan sel kanker melalui mekanisme penghambatan siklus sel, memacu apoptosis, penghambatan angiogenesis, antiproliferatif atau kombinasi dari beberapa mekanisme tersebut. Jenis flavonoid, misalnya genestein dan kuersetin, mampu menghambat aktivitas protein kinase pada daerah pengikatan ATP. Peran dari protein kinase sendiri, yaitu sebagai sinyal pertumbuhan pada sel-sel kanker dan pada jalur antiapoptosis (Meiyanto et al., 2007).
d. Deteksi senyawa Glikosida
Fase gerak yang digunakan untuk mendeteksi glikosida berupa kloroform : metanol (90:10 v/v). Asam sulfat 30% digunakan untuk mendeteksi senyawa glikosida. Menurut Wagner (1984) glikosida akan menimbulkan bercak berwarna coklat tua pada sinar visible. Pada hasil
kromatogram muncul bercak berwarna coklat tua dengan harga 0,94 (Gambar 14.d), sehingga dapat disimpulkan bahwa di dalam ekstrak n-heksan
commit to user
mengandung senyawa glikosida. Di dalam tanaman, glikosida tidak lagi diubah menjadi senyawa lain, kecuali bila memang mengalami peruraian akibat pengaruh lingkungan luar (misalnya terkena panas dan teroksidasi udara). Glikosida menghambat pertumbuhan tumor pada sel limfoid, sel tumor paru manusia, sel tumor serviks, dan melanoma tikus pada kisaran konsentrasi 0,38 – 0,46 mg/ml (Najib, 2007).
e. Deteksi senyawa saponin
Fase gerak yang digunakan untuk mendeteksi saponin berupa kloroform : metanol (95:5 v/v). Pereaksi semprot yang digunakan untuk mendeteksi glikosida adalah anisaldehid asam sulfat. Saponin akan memberikan reaksi positif apabila menimbulkan bercak berwarna biru. Pada hasil kromatogram (Gambar 15.a) tidak menimbulkan bercak berwarna biru, sehingga dapat disimpulkan bahwa di dalam ekstrak n-heksan tidak mengandung senyawa saponin.
f. Deteksi senyawa steroid
Fase gerak yang digunakan untuk mendeteksi steroid berupa toluene : etil asetat (80:20 v/v). Pereaksi semprot yang digunakan adalah Lieberman Burchad. Apabila hasilnya positif, makaakan menimbulkan berwarna coklat (Wagner, 1984). Pada hasil kromatogram (Gambar 15.b) menunjukkan adanya bercak berwarna coklat pada Rf 0,875 dan 0,97, sehingga dapat disimpulkan bahwa ekstrak n-heksan mengandung senyawa steroid.
g. Deteksi senyawa tanin
Fase gerak yang digunakan untuk mendeteksi tanin berupa etil asetat : asam formiat : asam asetat:air (100:11:11:27 v/v). Pereaksi
semprot yang digunakan untuk mendeteksi senyawa ini adalah feriklorid 5% dalam HCl 0,1 N. Apabila ekstrak ini mengandung tanin, maka akan menunjukkan bercak berwarna abu-abu sampai gelap. Pada hasil kromatogram (Gambar 15.c) menunjukkan tidak adanya bercak berwarna abu-abu sampai gelap, sehingga dapat disimpulkan bahwa ekstrak n-heksan tidak mengandung senyawa tanin.
h. Deteksi senyawa terpenoid
Fase gerak yang digunakan untuk mendeteksi terpenoid berupa toluen : etil asetat (93:7 v/v). Pereaksi semprot yang digunakan adalah vanillin sulfat.Apabila hasilnya positif mengandung terpenoid, maka akan menimbulkan bercak berwarna merah muda (Wagner, 1984). Pada hasil kromatogram (Gambar 15.d) menunjukkan adanya bercak berwarna merah muda pada Rf 0,62, sehingga dapat disimpulkan bahwa ekstrak n-heksan mengandung senyawa terpenoid.
D. Fraksinasi dan Uji Sitotoksisitas Fraksi
Fraksinasi dilakukan menggunakan metode Vacuum Liquid Chromatography (VLC). Fraksinasi ini bertujuan untuk dapat mengeliminir
senyawa-senyawa yang tidak dikehendaki dan dapat diperoleh konsentrasi senyawa aktif yang lebih tinggi. Metode ini mempunyai keuntungan bekerja
commit to user
sangat cepat, sederhana dan dapat digunakan secara luas. Selain itu pemisahan dengan metode ini efisien dalam waktu, banyaknya adsorben dan volume solven yang digunakan (Dewi dkk., 2009).
Ekstrak n-heksan sebagai ekstrak aktif selanjutnya difraksinasi untuk memisahkan kandungan senyawa-senyawa di dalamnya berdasarkan polaritasnya (Dewi dkk.,2009). Ekstrak n-heksan (0,2 gram) dicampurkan dengan silika gel 60 PF254 sehingga menjadi serbuk (1 gram). Ekstrak tersebut dielusi dengan
komposisi pelarut berdasarkan gradien polaritas, dimulai dengan gradien yang kepolarannya rendah kemudian tingkat kepolaran dinaikkan perlahan-lahan. Pemisahan dengan fraksinasi menghasilkan sebelas fraksi yang dapat dilihat pada Tabel 2.
Tabel 2. Fase gerak yang digunakan dalam fraksinasi ekstrak n-heksan daun sirsak dengan metode VLC dan berat kering fraksi yang diperoleh.
Fraksi Fase gerak Berat kering yang
diperoleh (mg)
1 n-heksan 100% 41,3
2 n-heksan : etil asetat (90:10) (v/v) 49,5 3 n-heksan: etil asetat (80:20) (v/v) 403,0 4 n-heksan : etil asetat (70:30) (v/v) 448,5 5 n-heksan : etil asetat (60:40) (v/v) 163,8 6 n-heksan : etil asetat (50:50) (v/v) 129,0 7 n-heksan : etil asetat (40:60) (v/v) 50,4 8 n-heksan : etil asetat (30:70) (v/v) 35,3 9 n-heksan : etil asetat (20:80) (v/v) 19,7 10 n-heksan : etil asetat (10:90) (v/v) 24,6
Kesebelas fraksi yang diperoleh kemudian dianalisis dengan KLT untuk kemudian dikelompokkan lagi berdasarkan kesamaan profil. Fase gerak yang digunakan adalah n-heksan : etil asetat (7:3 (v/v) yang dapat memberikan pemisahan yang cukup baik terhadap fraksi larut etil asetat. Profil kandungan kimia dideteksi dengan menggunakan sinar UV254, sinar UV366, dan secara visible.
Berdasarkan profil kandungan kimia pada gambar 16, fraksi-fraksi tersebut tidak memiliki profil KLT yang sama, sedangkan untuk fraksi 1, 10, dan 11 tidak tampak adanya spot atau bercak sehingga tidak diikutkan dalam uji sitotoksisitas untuk fraksi. Hal ini dikarenakan fraksi 1 dimungkinkan masih murni n-heksan sehingga tidak menimbulkan bercak, sedangkan fraksi 10 dan 11 dimungkinkan sudah terlarut dengan etil asetat sehingga tidak menimbulkan bercak. Dari hasil KLT tersebut, maka F2, F3, F4, F5, F6, F7, F8, dan F9 di uji sitotoksik sehingga menjadi F1, F2, F3, F4, F5, F6, F7, dan F8.
commit to user
Gambar 16. Profil kromatogram penggabungan fraksi hasil fraksinasi dari ekstrak n-heksan daun sirsak dengan (a) UV254, (b) UV366, (c) Lieberman
burchad, (d) vanillin sulfat.
Fase diam : Silika gel 60 GF254
Fase gerak : n-heksan:etil asetat 7:3 (v/v) Jarak pengembangan : 8 cm
Keterangan :
Fraksi 1 = fraksi larut n-heksan 100%
Fraksi 2 = fraksi larut n-heksan:etil asetat (90:10) (v/v) Fraksi 3 = fraksi larut n-heksan:etil asetat (80:20) (v/v) Fraksi 4 = fraksi larut n-heksan:etil asetat (70:30) (v/v) Fraksi 5 = fraksi larut n-heksan:etil asetat (60:40) (v/v) Fraksi 6 = fraksi larut n-heksan:etil asetat (50:50) (v/v) Fraksi 7 = fraksi larut n-heksan:etil asetat (40:60) (v/v) Fraksi 8 = fraksi larut n-heksan:etil asetat (30:70) (v/v) Fraksi 9 = fraksi larut n-heksan:etil asetat (20:80) (v/v) Fraksi 10 = fraksi larut n-heksan:etil asetat (10:90) (v/v) Fraksi 11 = fraksi larut etil asetat 100%
(b) (a) 1 2 3 4 5 6 7 8 9 10 11 0,5 R f 0 0,2 5 0,75 1 1 2 3 4 5 6 7 8 9 10 11 (d) 1 2 3 4 5 6 7 8 9 10 11 0,5 R f 0 0,2 5 0,75 1 1 2 3 4 5 6 7 8 9 10 11 (c)
Selanjutnya, fraksi aktif tersebut diuji sitotoksik terhadap sel HeLa untuk mengetahui fraksi yang paling sitotoksik dan berpotensi sebagai antikanker. Metode yang digunakan untuk uji sitotoksik fraksi sama dengan uji sitotoksik pada ekstrak yaitu dengan menggunakan metode MTT Assay. Hasil uji
commit to user
Tabel 3. Hasil uji sitotoksisitas fraksi aktif (F1 - F4) daun sirsak terhadap sel HeLa dan nilai LC50.
Konsentrasi (µg/mL) Presentase kematian (%) F1 F2 F3 F4 15,625 31,032 21,654 40,735 48,988 31,25 26,094 19,617 39,926 45,232 62,50 30,615 28,929 39,447 20,133 125 37,462 28,133 30,229 22,205 250 33,155 20,274 23,314 55,095 500 23,405 8,286 74,312 99,182 1000 16,923 50,398 104,235 100,735 2000 6,582 103,830 102,657 102,611 LC50 24934,120 12,359 5,129 4,918
Tabel 4. Hasil uji sitotoksisitas fraksi aktif (F5 - F8 dan DMSO) daun sirsak terhadap sel HeLa.
Konsentrasi (µg/mL) Presentase kematian (%) F5 F6 F7 F8 DMSO 15,625 44,465 70,435 39,823 50,915 46,475 31,25 47,787 46,774 47,107 45,743 40,004 62,50 45,164 39,482 49,154 47,577 44,413 125 38,472 51,247 79,982 80,094 40,295 250 63,735 99,699 99,725 102,508 41,027 500 100,749 101,714 102,399 101,694 43,329 1000 102,643 104,552 103,194 102,213 38,986 2000 103,421 103,754 102,403 102,511 35,893 LC50 2,667 0,687 0,957 0,967 29512092266663,857
Berdasarkan data tabel di atas dapat diketahui bahwa fraksi yang bersifat sitotoksik yaitu antara fraksi 6, fraksi 7, dan fraksi 8 yang menunjukkan nilai rata-rata kematian terbesar (Tabel 3). Nilai presentase kematian ketiga fraksi ini tidak jauh berbeda, hal ini dimungkinkan karena ketiga fraksi ini mempunyai kesamaan kandungan senyawa yang dapat menghambat kematian sel kanker. Seperti terlihat pada Gambar 16, bahwa fraksi 7, 8, dam 9 memiliki kemiripan profil senyawa kimia yang tidak jauh berbeda. Nilai rata-rata presentase kematian setiap fraksi yang diperoleh kemudian dibuat kurva regresi linier untuk menghitung nilai LC50.
Kurva regresi linier dapat dilihat pada Gambar 17 dan 18.
Gambar 17. Grafik hubungan antara presentase kematian dengan log konsenstrasi fraksi aktif (F1 - F4) daun sirsak (A. muricata L.).
y = ‐9.607x + 47.24 R² = 0.505 0 10 20 30 40 0 1 2 3 4 mortalitas sel (%) Log Konsentrasi
F1
y = 26.07x ‐23.47 R² = 0.404 0 20 40 60 80 100 120 0 1 2 3 4 mo rt al it as se l (%) Log KonsentrasiF2
y = 33.72x ‐18.94 R² = 0.590 0 20 40 60 80 100 120 0 1 2 3 4 mo rt al it as se l (%) Log KonsentrasiF3
y = 36.5x ‐20.26 R² = 0.606 0 20 40 60 80 100 120 0 1 2 3 4 mortalitas sel (%) Log KonsentrasiF4
commit to user
Gambar 18. Grafik hubungan antara presentase kematian dengan log konsenstrasi fraksi aktif (F5 – F8 dan DMSO) daun sirsak (A. muricata L.)
Pada Gambar 18 dapat dilihat bahwa nilai R² grafik mendekati 1 atau tidak kurang dari 0,6. Hal ini menunjukkan kedekatan hubungan antara konsentrasi ekstrak yang digunakan dengan presentase kematian sel, sehingga dapat diketahui bahwa kematian sel benar-benar disebabkan oleh perlakuan ekstrak (AOAC,
y = 34.76x ‐9.822 R² = 0.779 0 20 40 60 80 100 120 0 1 2 3 4 mo rt al it as sel (%) Log Konsentrasi
F5
y = 29.95x + 9.892 R² = 0.606 0 20 40 60 80 100 120 0 1 2 3 4 mo rtal it as se l (%) Log KonsentrasiF6
y = 32.74x + 5.623 R² = 0.837 0 20 40 60 80 100 120 0 1 2 3 4 mo rt al it as se l (%) Log KonsentrasiF7
y = 32.75x + 5.539 R² = 0.809 0 20 40 60 80 100 120 0 1 2 3 4 mortalitas sel (%) Log KonsentrasiF8
y = ‐3.232x + 48.56 R² = 0.510 0 10 20 30 40 50 0 1 2 3 4 mortalitas sel (%) Log KonsentrasiDMSO
2002). Hasil perhitungan menunjukkan bahwa nilai LC50 daun sirsak< 30 µg/mL
(Tabel 3) sehingga dapat terlihat bahwa ekstrak daun sirsak memiliki efek sitotoksik dan berpotensi sebagai anti kanker (Meyer et al., 1982). Perhitungan
lengkap LC50 dapat dilihat pada Lampiran 9. Berdasarkan perhitungan LC50 fraksi
yang memiliki aktivitas sitotoksik terbesar adalah F6 dengan nilai LC50 sebesar
0,687 µg/mL.
Penelitian sebelumnya menyatakan bahwa ekstrak etanol dari daun sirsak (A. muricata L.) memiliki aktivitas sitotoksik dalam cell line kanker payudara
T47D dengan IC50 sebesar 17,149 mg/mL dan dapat menginduksi apoptosis.
Fraksi etil asetat memiliki potensi terbaik dari sitotoksik diantara fraksi lainnya terhadap cell lines dari kanker payudara T47D dengan nilai IC50 adalah 31,268
mg/mL (Rachmani et al., 2012). Pada penelitian ini, menggunakan sampel yang
sama dengan pelarut yang berbeda terbukti memiliki aktivitas sitotoksik pada sel kanker yang berbeda dari penelitian sebelumnya yaitu menggunakan sel HeLa.
Pada penelitian Aziza (2010) menyatakan bahwa fraksi buah kuning memiliki aktivitas sitotoksik karena memiliki nilai LC50 < 30 µg/mL. Nilai LC50
untuk FA (ekstrak wash benzene : eter) sebesar 0,712 µg/mL, FB (ekstrak wash
benzene : etil asetat) sebesar 0,706 µg/mL, dan Fc (ekstrak metanol) sebesar 0,035 µg/mL.
Senyawa yang terdapat dari daun sirsak, dapat menembus membran sel melalui beberapa mekanisme transport, antara lain difusi pasif, transport terfasilitasi, transport aktif, dan endositosis. Sifat-sifat senyawa yang dapat menembus membran sel secara difusi pasif yaitu relatif larut dalam lemak, ukuran
commit to user
partikelnya kecil dan relatif tidak terionisasi. Lemak merupakan senyawa nonpolar sehigga senyawa yang dapat larut dalam lemak juga merupakan senyawa nonpolar (Priyanto, 2009). Ekstrak n-heksan yang bersifat nonpolar terbukti merupakan ekstrak yang paling aktif untuk menghambat sel kanker, sehingga dapat diperkirakan ekstrak menembus membran sel melalui difusi pasif. Setelah senyawa menembus membran sel, senyawa tersebut akan mampu mencapai sitoplasma dan menuju organel target. Struktur utama membran sel terdiri dari
phospholipids bi layer, yaitu fosfat sebagai “kepala” yang bersifat polar dan asam
lemak sebagai “ekor” yang bersifat nonpolar. Adanya perbedaan polaritas menyebabkan membran sel bersifat selektif permeabel sehingga hanya dapat dilewati senyawa tertentu (Rahman et al., 2010).
Senyawa obat yang telah melewati membran sel kemudian masuk ke sitoplasma dan berinteraksi dengan sel kanker yang menyebabkan kematian sel. Kematian sel dapat terjadi melalui dua mekanisme yaitu apoptosis dan nekrosis. Apoptosis ditandai dengan munculnya badan-badan apoptosis pada pengamatan dengan metode imunohistokimia. Nekrosis merupakan proses kerusakan sel yang ditandai dengan bertambahnya volume sel dan biasanya diikuti respon inflamasi (Nursid et al., 2006).
E. Deteksi Kandungan Senyawa Fraksi Teraktif
Berikut adalah hasil deteksi kandungan senyawa fraksi teraktif dengan metode KLT. Profil KLT ekstrak n-heksan dengan berbagai profil kandungan senyawa dapat dilihat pada Gambar 19.
Gambar 19. Profil kromatogram fraksi 6 daun sirsak dengan berbagai pereaksi
semprot. Keterangan: (1) dragendroff, (2) KOH etanolik, (3) AlCl3, (4) asam sulfat 30%, (5) anisaldehid asam sulfat,
(6) Lieberman burchad, (7) Feriklorid 5% dalam HCl 0,1 N, dan (8) Vanilin sulfat.
Fase diam : Silika gel 60 GF254
Fase gerak : n-heksana:etil asetat 7:3 (v/v) Jarak pengembangan : 8 cm
Hasil uji KLT fraksi 6 dengan deteksi sinar tampak (visibel) yang telah disemprot dan sinar UV secara spesifik disajikan pada Tabel 5.
UV254 0,5 Rf 0 0,25 0,75 1 UV366 0,5 Rf 0 0,25 0,75 1 0,5 Rf 0 0,25 0,75 1 1 2 3 4 5 6 7 8
commit to user
Tabel 5. Hasil uji KLT fraksi teraktif (1 – 4) dengan berbagai pereaksi semprot.
Rf Penampak Bercak
UV254 UV366 1 2 3 4
0,37 Peredaman berpendar Coklat (-) - Coklat (-) Coklat (-)
0,47 Hijau Berpendar - Coklat (-) - -
0,75 Peredaman Berpendar - - - -
0,87 Peredaman Berpendar - - - -
0,94 Peredaman Berpendar - - - -
Tabel 6. Hasil uji KLT fraksi teraktif (5 – 6) dengan berbagai pereaksi semprot
Rf Penampak Bercak UV254 UV366 5 6 7 8 0,37 Peredaman berpendar - - - -0,47 Hijau Berpendar - - - - 0,59 - - - Coklat (+) - - 0,72 - - - Coklat (+) - Merah muda (+) 0,75 Peredaman Berpendar - - - - 0,87 Peredaman Berpendar - - - -
0,94 Peredaman Berpendar - - - Merah
muda (+)
0,97 - - - Merah
muda (+) Keterangan: (1) dragendroff, (2) KOH etanolik, (3) AlCl3, (4) asam sulfat 30%,
(5) anisaldehid asam sulfat, (6) Lieberman burchad, (7) Feriklorid 5% dalam HCl 0,1 N, dan (8) Vanilin sulfat.
Hasil dari KLT menunjukkan bahwa F6 memiliki kandungan senyawa steroid karena pada Gambar 21.6 terlihat adanya bercak berwarna coklat pada Rf 0,59 dan 0,72. Menurut Wagner (1984), suatu sampel dinyatakan positif memiliki senyawa steroid apabila hasil kromatogramnya menampakkan bercak berwarna coklat. Selain steroid, F6 juga terdeteksi adanya kandungan senyawa terpenoid karena terlihat adanya bercak berwarna merah muda pada Rf 0,72, 0,94, dan 0,97 (Gambar 21.8). Menurut Wagner and Bladt (1996), terpenoid akan memberikan warna merah muda apabila diamati pada sinar visible.
Senyawa terpenoid dapat pula memblok siklus sel pada fase G2/M dengan menstabilkan benang-benang spindle pada fase mitosis sehingga proses mitosis dapat terhambat. Terpenoid juga dapat memicu apoptosis melalui mekanisme inhibisi enzim topoisomerase (Sugianto dkk., 2003). Salah satu golongan terpenoid yaitu monoterpen, dilaporkan memiliki aktivitas antitumor, salah satu diantaranya yaitu limonene. Senyawa ini mempunyai kemampuan kemoprevensi pada beberapa tipe sel kanker. Mekanisme aksi dari monoterpenoid yaitu dengan cara memblok dan menekan aktivitas antitumor (Crowell, 1999). Contoh lainnya seperti taxol yang merupakan senyawa golongan diterpen dari tanaman Taxus brevifolia yang telah digunakan secara luas untuk pengobatan kanker serviks dan kanker payudara. Mekanisme aksi antikanker taxol yaitu dengan cara menstabilkan tubulin sehingga mencegah terjadinya pembelahan sel (Artanti et al., 2005). Taxol diketahui dapat menghambat mitosis dengan cara
commit to user
2004). Steroid bekerja dengan menghambat kerja enzim DNA topoisomerasie. Enzim itu berperan dalam proses replikasi dan proliferasi sel kanker (Harfia, 2006).
Beberapa literatur menyebutkan bahwa kandungan acetogenins dalam Annona muricata memiliki efek kuratif terhadap sel kanker melalui mekanisme
inhibisi kompleks I mitokondria yang akan mengganggu proses transfer elektron. Inhibisi kompleks I mitokondria oleh Acetogenins akan menyebabkan
menurunnya produksi ATP. Penurunan jumlah ATP tersebut justru akan menginduksi terjadinya apoptosis (Bri’ere et al., 2009; Apte et al., 2009). Selain
itu hipoksia akibat penurunan produksi ATP juga dapat mengaktifkan p53, suatu tumor supressor genes, yang menyebabkan terhentinya siklus sel pada fase G1 sehingga dapat mencegah proliferasi sel yang berlebihan (Gonzalez et al., 2009).