PURIFIKASI PROTEASE DARI EKSKRETORI/SEKRETORI
STADIUM L
3Ascaridia galli
ABSTRAK
Enzim proteolitik yang disekresikan oleh parasit memainkan peran pada proses
penetrasi dan migrasi jaringan inang. Penelitian ini bertujuan untuk memurnikan
protease yang dilepaskan melalui ekskretori/sekretori stadium L
3A. galli
. L
3diperoleh
dari usus halus 100 ekor ayam petelur HySex Brown tujuh hari setelah pemberian dosis
6000 L
2melalui oesofagus ayam. Sebanyak 5 – 10 ekor L
3dikultur secara
in vitro
dalam setiap ml medium
Rosswell Park Memorial Institute (RPMI 1640)
, pH 6,8, tanpa
merah fenol dalam inkubator pada temperatur 37
oC dan 5% CO
2selama 3 hari.
Ekskretori/sekretori dipreparasi dari produk metabolisme L
3yang dilepaskan ke dalam
medium kultur. Protease dimurnikan dengan kromatografi filtrasi gel matriks sephadex
G-100 dan
anion exchange
matriks DEAE sephadex A-50. Aktivitas protease diuji
terhadap kasein. Konsentrasi protein dihitung mengikuti metode Bradford. Hasil
penelitian menunjukkan bahwa aktivitas enzim pada fraksi 31 kromatogram filtrasi gel
lebih tinggi dibandingkan dengan
anion exchange
. Protease yang disekresikan oleh
stadium L
3A. galli
dapat dimurnikan berdasarkan berat molekulnya.
Kata kunci:
Ascaridia galli, nematoda, ekskretori/sekretori, protease, kromatografi
ABSTRACT
Proteolytic enzymes secreted by parasites are thought to play a key role in the
processes of penetration and migration trough the host tissue. The research was carried
out to purify protease from exretory/secretory of A. galli L3 stage. A. galli L3 were
recovered from intestines of 100 HySex Brown
heads chickens 7 days after oesophagus
inoculation with 6000 L2. L3 recovered in this manner were cultured (5 – 10 ml
-1) in
flasks containing rosswell park memorial institute (RPMI) 1640 media, pH 6.8, without
phenol red. Cultures were incubated at 37
0C in 5% CO
2and culture fluid was collected
after 3 days in culture. Excretory/secretory was prepared from metabolic product of L3
released in culture medium. Protease purified using anion exchange matrix DEAE
sephadex A-50 and gel filtration matrix sephadex G-100 chromatography. The protease
activity was assayed against casein. Protein concentration were counted as described in
Bradford method. The result showed that enzyme activity on chromatography gel
filtration more highly compared anion exchange. These result indicate that the protease
secreted by A. galli L
3stage could purify based on molecular weight.
PENDAHULUAN
Protease yang dilepaskan melalui ekskretori/sekretori dari berbagai stadium
kehidupan cacing parasitik telah menarik perhatian para ilmuan karena peranannya yang
penting dalam reaksi biologi, termasuk metabolisme protein, reaksi imun, nutrisi parasit,
penetrasi ke jaringan inang, dan patogenesis helmintosis. Telah dibuktikan bahwa
peningkatan konsentrasi protease yang dilepaskan cacing parasitik pada peristiwa invasi
ke jaringan inang definitif (Cock
et al
. 1993; Hadas dan Stankiewicz 1997; Todorova
2000; dan Iglesias
et al
. 2005).
Ascaridia galli
adalah cacing parasitik nematoda yang dapat menginfeksi
berbagai jenis unggas, termasuk ayam petelur. Siklus hidup
A. galli
secara lengkap telah
dijelaskan oleh Permin dan Hansen (1998), dimana telur yang dihasilkan oleh
A. galli
dewasa di dalam lumen inang definitif akan mengalami maturasi di lingkungan
manakala dikeluarkan bersama tinja. Siklus hidup sebagai parasit dimulai ketika inang
definitif menelan telur infektif (L
2) sampai menjadi dewasa dan bereproduksi
menghasilkan telur. Sebelum menjadi dewasa,
A. galli
mengalami dua fase kehidupan di
dalam tubuh inang definitif, yaitu fase lumen dan fase jaringan. Mekanisme invasi ke
jaringan oleh L
3A. galli
untuk menjalani fase histotrofik belum banyak diketahui.
Diduga bahwa L
3melepaskan protease ekstraseluler untuk menembus pertahanan
mukosa saluran cerna inang definitif sehingga larva dapat
establish
di dalam jaringan.
Peneliti terdahulu melaporkan bahwa enzim proteolitik ditemukan pada ekstrak
somatis dan ekskretori/sekretori stadium L
3, L
4dan dewasa
Ostertagia ostertagi
(Cock
et al
. 1993). Hadas dan Stankiewicz (1997) menyatakan bahwa cacing nematoda
Trichostrongylus colubriformis
dan
Haemonchus contortus
melepaskan enzim
proteolitik pada stadium L
3. Hasil penelitian Todorova (2000) merefeksikan bahwa
protease serin, sistein dan metal hadir pada kultur
in vitro
stadium L
1Trichinella
spiralis
. Ford
et al
. (2005) membuktikan bahwa stadium L
3Onchocerca volvulus
menghasilkan protease serin. Namun, informasi tentang keberadaan protease pada
stadium L
3A. galli
belum pernah dilaporkan. Oleh karena itu, fokus penelitian ini adalah
memurnikan protease dari produk ekskretori/sekretori stadium L
3A. galli
. Tujuan
penelitian ini adalah untuk mendapatkan protease murni yang dilepaskan melalui
ekskretori/sekretori stadium L
3A. galli
.
METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Helmintologi, Bagian Parasitologi dan
Entomologi Kesehatan, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat
Veteriner, Fakultas Kedokteran Hewan, dan Laboratorium Mikrobiologi dan Biokimia
Pusat Antar Universitas Institut Pertanian Bogor. Waktu Penelitian berlangsung dari
bulan Mei 2005 sampai Mei 2006.
Rancangan Penelitian
Cacing
A. galli
betina dewasa diperoleh dari dalam lumen usus halus ayam
kampung yang terinfeksi secara alami. L
1diambil langsung dari uterus
A. galli
betina
dewasa. L
1diinkubasi secara
in vitro
selama 20 – 30 hari pada temperatur ruangan untuk
mendapatkan L
2. L
2dikultur secara
in vivo
untuk mendapatkan L
3pada 100 ekor ayam
Isa Brown
umur 12 minggu yang telah diperiksa telur cacing dalam tiap gram tinjanya
(TTGT), dipelihara secara individual dalam kandang baterei, diberi pakan komersial dan
air minum secara
ad libitum
sebagai ayam donor (Tiuria
et al
. 2003). Ayam dinekropsi
tujuh hari setelah pemberian L
2dan jumlah L
3yang ditemukan dihitung. Larva
A. galli
diinkubasi dalam sumur
cell culture plate
, masing-masing sumur diisi 25 – 50 larva
dalam 5 ml medium Rosswell Park Memorial Institute (RPMI 1640, Sigma-Aldrich), pH
6,8, tanpa merah fenol yang ditambahkan 100 unit/ml penisilin G, 100
µ
g/ml
streptomisin, 5
µ
g/ml gentamisin, dan 0,25
µ
g/ml kanamisin dalam inkubator CO
2selama 3 hari. Campuran medium dengan ekskretori/sekretori L
3A. galli
disentrifus
pada 12.000 g dengan temperatur 4
oC selama 5 menit. Protease yang dilepaskan melalui
ekskretori/sekretori L
3A. galli
dipurifikasi dengan kromatografi filtrasi gel dan
anion
Preparasi Ekskretori/Sekretori Stadium L
3A. galli
Telur cacing
A. galli
diambil dari uterus cacing betina dewasa. Telur cacing
tersebut diinkubasi dalam cawan petri plastik berisi aquadestilata steril hingga terbentuk
larva infektif (L
2) selama 21 – 30 hari pada suhu kamar (Tiuria 1991; Athaillah 1999
Darmawi 2003; Balqis 2004; dan Balqis
et al
. 2005). L
2A. galli
yang berkembang
diberikan secara oral kepada ayam petelur
HySex Brown
umur 12 minggu dengan dosis
6000 L
2, dan 7 hari kemudian dipotong untuk diambil isi lumen dan kerokan mukosa
usus halus. Isi lumen dibersihkan dengan NaCl fisiologis dan disaring dengan saringan
larva. L
3A. galli
dihitung di bawah mikroskop stereo (Bauer 2001; dan Balqis
et al
.
2005).
Sebanyak 25 – 50 ekor L
3dikultur dalam cawan petri berisi 5 ml medium
RPMI-1640 pH 6,8 (tanpa phenol red). Media diberi suplemen 100 unit/ml penicillin G, 100
µ
g/ml streptomisin, 0,25
µ
g/ml amphotericin B, dan 5
µ
g/ml gentamisin. Larva dikultur
selama 3 hari pada temperatur 37
0C dan tekanan CO
25%. Cairan kultur dikoleksi,
disentrifugasi (12.000 g) dan disaring dengan membran filter (0,2
µ
m), serta didialisa
dengan
phosphate-buffered saline
(PBS) untuk mendapatkan ekskretori/sekretori
A. galli
(Rhoads
et al
. 1997; dan Balqis
et al
. 2005).
Uji Konsentrasi Protein
Sepuluh mg
Bovine Serum Albumin
(BSA) dilarutkan dengan 10 ml aquadest dan
dibuat 10 tingkatan konsentrasi sebagai standar. Sebanyak 100
µ
l dari masing-masing
tingkatan ditempatkan dalam tabung reaksi steril lainnya dan ditambahkan dengan 5 ml
larutan Bradford. Sebagai blanko digunakan 3 tabung reaksi steril masing-masing diisi
dengan 100
µ
l aquadest dan ditambahkan dengan 5 ml larutan Bradford. Sebanyak 100
µ
l sampel substansi bioaktif asal larva stadium L
3A. galli
diisikan ke dalam tabung
reaksi steril dan masing-masing ditambahkan dengan 5 ml larutan Bradford. Standar,
blanko, dan sampel masing-masing dimasukkan kedalam tabung kuvet untuk dilihat
hasil absorbansinya dengan menggunakan
Spectrophotometer
pada panjang gelombang
(
λ
) 578 nm (Rukayadi dan Suhartono 1999).
Uji Aktivitas Enzim
Aktivitas proteinase diuji terhadap casein. Campuran 250
µ
l 0,2% casein
Hamarstain dalam Tris mM (pH 7,0) dan 50
µ
l enzim diinkubasi selama 10 menit pada
temperatur 70
oC. Reaksi dihentikan dengan penambahan 500
µ
l asam trichloroacetic 0,1
M dan diinkubasikan pada 37
oC selama 10 menit. Setelah pemusingan, 375
µ
l
supernatan dicampur dengan 1,25 ml sodium carbonate dan 50
µ
l reagen Folin-Ciocalteu
dan diinkubasikan pada 37
oC selama 20 menit. Jumlah degradasi ditentukan dari
absorbansi pada
λ
578 nm (Kong
et al
. 2000). Aktivitas 1 unit enzim ditetapkan sebagai
jumlah enzim yang dibutuhkan untuk menguraikan 1
µ
g tyrosine dan casein di dalam 1
ml volume reaksi per menit (Chung
et al
. 1997).
Pemurnian Protease Stadium L
3A. galli
Tahapan ekstraksi dan pemurnian protease
A. galli
meliputi pengendapan
protein, proses dialisis, penggunaan filtrasi gel dengan matriks sephadex G-100, dan
anion exchange
dengan matriks DEAE-Sephadex A-50. Untuk menggumpalkan protein,
sebanyak 500 ml supernatan hasil sentrifugasi yang mengandung enzim ekstrak kasar
ditambahkan dengan 40% (b/v) ammonium sulfat teknis, sedikit demi sedikit sambil
diaduk dengan
magnetik stirer
hingga larut dan dibiarkan selama satu malam pada suhu
rendah. Filtrat protease dipisahkan dengan sentrifugasi 12.000 g selama 40 menit lalu
dilarutkan dengan buffer Tris-HCl 10 mM pH 8. Setelah itu dilakukan pengujian
aktivitas dengan metode Walker (1984) pada substrat musin dan penentuan kadar protein
menurut metode Bradford (1976).
Ammonium sulfat yang ada dalam enzim dipisahkan dengan cara dialisis.
Kantong dialisis (
cut-off 12 kD
) dengan lebar 25 mm, diametar 16 mm dipotong
sepanjang 15 cm, disiapkan dengan cara berikut: kantong direndam dengan air mengalir
selama 3-4 jam guna menghilangkan glisin. Selanjutnya kantong dialisis diberi
perlakuan dengan 0,3% (w/v) larutan Na
2S dengan suhu 80°C selama 1 menit untuk
menghilangkan sulfur. Kemudian dicuci dengan air panas (suhu 60°C) selama 2 menit.
Selanjutnya direndam dalam H
2SO
40,2% (v/v). Terakhir dicuci dengan air panas sampai
bau asamnya hilang. Saat akan digunakan, salah satu ujung kantong diikat dengan
benang jahit, lalu dimasukkan 10 ml larutan enzim dan ujung yang lain diikat dengan
benang jahit pula. Kantong dimasukkan dalam larutan buffer Tris-Cl 20 mm, pH 8
dengan volume 100 kali volume filtrat dan diagitasi secara perlahan pada suhu 4°C
selama 4 jam.
Larutan Protease dimasukkan dengan menggunakan pipet dengan volume
sebesar 5 % dari 27,5 (void volume) yaitu 1,375 ml. Setelah semua sampel dimasukkan
dalam kolom, gradien pengelusi dan
fraction colector
(Pharmacia, Biotech)
dioperasikan. Buffer yang digunakan untuk elusi ialah Tris-HCl 10 mM pH 8,0. Ukuran
fraksi yang digunakan sebesar 2 ml per tabung, seluruhnya ada 20 fraksi. Setiap fraksi
diukur aktivitasnya pada substrat musin menurut Metode Walter (1984) dan
penghitungan kadar proteinnya menggunakan metode Bradford (1976).
Kromatografi
Sebelum aktivitas enzim diuji, terlebih dahulu dilakukan optimasi pada buffer
boraks, buffer universal, dan buffer Tris-HCl (pH 6 - 10), asam fosfat (pH 6 - 8), dan
asam asetat (pH 5 - 10). Protease yang dilepaskan melalui ekskretori/sekretori L
3A. galli
dipurifikasi dengan kromatografi filtrasi gel dan
anion exchange
. Supernatan kultur
diendapkan dengan ammonium sulfat 40% selama 1 malam pada temperatur 4
oC dan
disentrifus pada 10.000 rpm selama 10 menit. Pellet dilarutkan ke dalam buffer Tris-HCl
(pH 7) dan didialisa dengan buffer yang sama pada 4
oC selama 24 jam. Larutan
terdialisa digunakan pada kolom gel filtrasi matriks Sephadex G-100 (Sigma, USA) dan
anion exchange
matriks DEAE-Sephadex A-50 (Sigma, USA), disetimbangkan dengan
buffer HCl (pH 7) dan dielusi pada gradien NaCl 0 – 0,1 M dalam 0,01 mM
Tris-HCL (pH 7) pada nilai volume fraksi 0,5 ml/min dan 3 ml. Masing-masing fraksi diuji
konsentrasi protein dan aktivitas enzimatisnya (Kong
et al
. 2000; dan Balqis
et al
.
2006).
HASIL PENELITIAN
Pengaruh beberapa jenis dan pH buffer dilakukan dengan memberikan perlakuan
0,1 M Tris-HCl (pH 6 - 10), 0,05 M asam fosfat (pH 6 - 8), dan 0.05 M asam asetat (pH
5 - 10) disajikan pada Gambar 1. Aktivitas enzim diuji pada
crude
ekskretori/sekretori
stadium L
3A. galli
. Hasil optimasi diketahui bahwa buffer Tris mempunyai aktivitas
enzim yang tinggi dibandingkan dengan kedua jenis buffer lainnya, dimana aktivitas
enzim mulai terlihat pada pH 6 yang mencapai optimum pada pH 7 tetapi aktivitas
enzim rendah pada pH 8 dan semakin menurun pada suasana basa. Aktivitas enzim pada
buffer fosfat mulai terlihat pada pH 5 yang dapat dipertahankan pada pH 6, tetapi
aktivitasnya menurun pada pH 7 dan 8. Aktivitas enzim meningkat pH 9 dan
dipertahankan sampai pH 10. Aktivitas enzim juga terlihat dalam buffer asetat pada pH
6 dan aktivitasnya semakin meningkat sampai pada pH 8. Namun, nilai aktivitas enzim
yang dicapai pada buffer fosfat atau asetat masih berada di bawah nilai aktivitas enzim
pada buffer HCl. Berdasarkan hasil yang diperoleh diketahui bahwa buffer
Tris-HCl adalah buffer yang paling sesuai untuk optimasi aktivitas enzim dari
ekskretori/sekretori stadium L
3A. galli
sehingga untuk pengujian selanjutnya pada
penelitian ini digunakan buffer 0,1 M Tris-HCl pada pH 7.
0 0.002 0.004 0.006 0.008 0.01 0.012 0.014 4 5 6 7 8 9 10 11 pH A k ti v it a s e n z im ( u /m l)
0,1 M tris HCl 0,05 M fosfat 0,05 M asetat
Gambar 1. Aktivitas enzim
crude
ekskretori/sekretori stadium L
3Untuk mendapatkan enzim protease yang bebas dari molekul lainnya, dilakukan
pengendapan protein dengan menggunakan ammunium sulfat pada konsentrasi 20-70%.
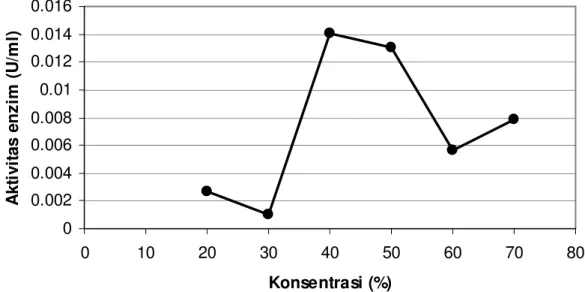
Hasil optimasi aktivitas enzim dengan ammunium sulfat disajikan pada Gambar 2.
Aktivitas enzim terdeteksi pada konsentrasi 20% dan menurun pada konsentrasi 30%.
Aktivitas enzim meningkat sebesar 14 kali pada konsentrasi 40%, tetapi aktivitas enzim
menurun pada konsentrasi 50% dan terus menurun pada konsentrasi 60%, sedangkan
pada konsentrasi 70% aktivitasnya terlihat sedikit meningkat. Berdasarkan hasil yang
diperoleh diketahui bahwa konsentrasi ammunium sulfat yang paling sesuai untuk
pengendapan protein dari ekskretori/sekretori stadium L
3A. galli
adalah ammunium
sulfat dengan konsentrasi 40%.
0 0.002 0.004 0.006 0.008 0.01 0.012 0.014 0.016 0 10 20 30 40 50 60 70 80 Konsentrasi (%) A k ti v it a s e n z im ( U /m l)
Gambar 2. Optimasi aktivitas enzim
crude
ekskretori/sekretori stadium L
3A. galli
dengan pengendapan ammunium sulfat
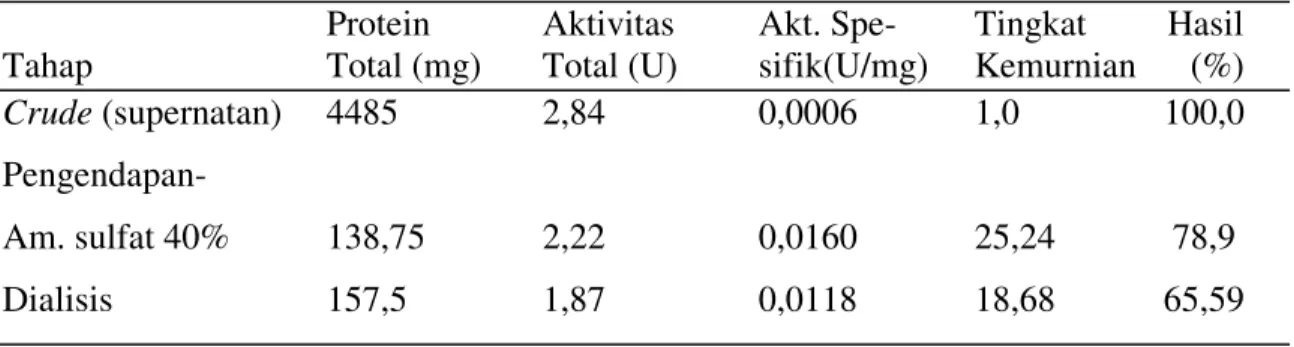
Aktivitas enzim pada pengendapan protein dan dialisis terjadi peningkatan
masing-masing sebesar 359,20% dan 362,05% dibandingkan dengan
crude
. Protein
total yang merupakan perkalian antara kadar protein dan volume pada pengendapan
protein dan dialisis terjadi penurunan sebesar 3,09% dan 3,51% dibandingkan dengan
crude
. Aktivitas total yang merupakan perkalian antara aktivitas enzim dan volume pada
pengendapan protein dan dialisis terjadi penurunan sebesar 78,16% dan 65,84%
dibandingkan dengan
crude
. Aktivitas spesifik yang merupakan pembagian antara
aktivitas enzim dan kadar protein pada pengendapan protein dan dialisis terjadi
peningkatan sebesar 2666,67% dan 1960,67% dibandingkan dengan
crude
. Tingkat
kemurnian pada pengendapan protein dan dialisis meningkat sebesar 2524% dan 1868%
dibandingkan dengan
crude
. Hasil yang merupakan pembagian antara aktivitas total dan
volume pada pengendapan protein dan dialisis terjadi penurunan sebesar 78,9% dan
65,59% dibandingkan dengan
crude
. Hasil uji konsentrasi protein, aktivitas enzim,
aktivitas spesifik enzim, tingkat kemurnian dan hasil dari ekskretori/sekretori stadium L
3A. galli
pada tiap-tiap tahap purifikasi disajikan pada Tabel 1.
Tabel 1.Tahapan purifikasi protease dari ekskretori/sekretori L
3A. galli
Protein
Aktivitas
Akt. Spe-
Tingkat Hasil
Tahap
Total (mg)
Total (U)
sifik(U/mg)
Kemurnian
(%)
Crude
(supernatan)
4485
2,84
0,0006
1,0
100,0
Pengendapan-
Am. sulfat 40%
138,75
2,22
0,0160
25,24 78,9
Dialisis
157,5
1,87
0,0118
18,68 65,59
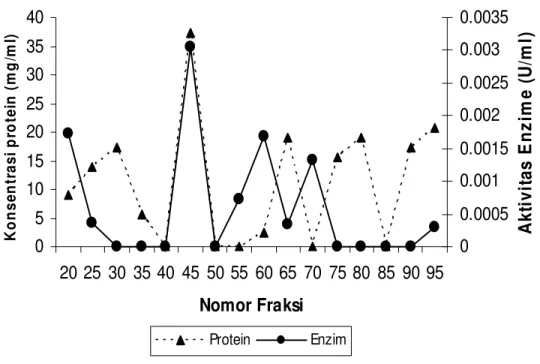
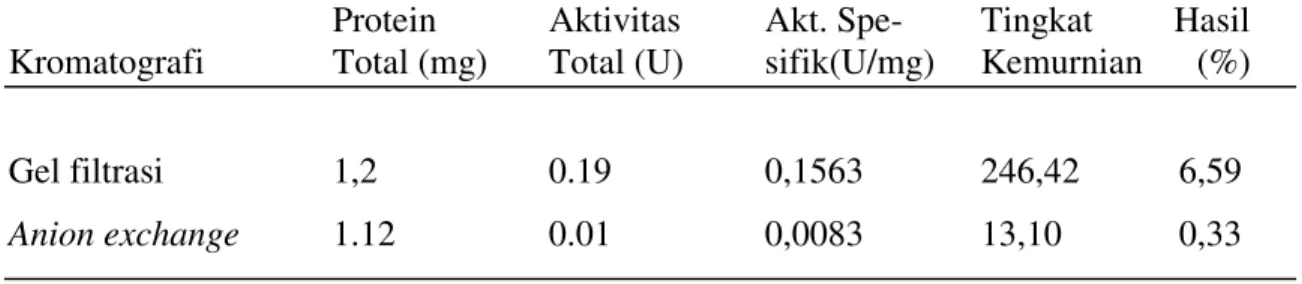
Aktivitas enzim terlihat pada dua
peak
(puncak) yang dielusi dari gel filtrasi
yaitu fraksi 8 dan 31 dengan aktivitas enzim masing-masing 0,10 U/ml dan 0.625 U/ml.
Kadar protein terlihat pada 2 puncak, yaitu fraksi gabungan 4 dan 5, dan fraksi 11
dengan konsentrasi protein 0,88 mg/ml dan 0,46 mg/ml. Hasil kromatografi gel filtrasi
disajikan dalam Gambar 3. Aktivitas enzimatik terlihat pada empat puncak yang dielusi
dari
anion exchange
yaitu fraksi gabungan 25 dan 30, fraksi 45, fraksi gabungan 55, 60,
65, dan 70, dan fraksi 95. Konsentrasi protein terlihat pada lima puncak, yaitu fraksi
gabungan 20, 25,30,dan 35, fraksi 45, fraksi gabungan 60 dan 65, 75 dan 80, dan fraksi
90. Fraksi 45 merupakan puncak
gabungan antara aktivitas enzim dan konsentrasi
protein tertinggi yaitu 0.003 U/ml dan 37,33 mg/ml (Gambar 4). Berdasarkan hasil yang
diperoleh dari kromatografi
anion exchange
dan gel filtrasi terlihat fraksi 31 mempunyai
aktivitas enzim tertinggi, sehingga fraksi 31 akan dipakai untuk imunisasi ayam petelur.
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1 1 3 5 7 9 11 13 15 17 19 21 23 25 27 29 31 33 35 Nomor fraksi K o n s e n tr a s i p ro te in (m g /m l) 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 A k ti v it a s e n z im e ( U /m l) Protein Enzim