5 2.1 Air
Sumber air merupakan salah satu komponen utama yang ada pada suatu sistem penyediaan air bersih, karena tanpa sumber air maka suatu system penyediaan air bersih tidak akan berfungsi (Sutrisno, 2000). Macam-macam sumber air yang dapat di manfaatkan sebagai sumber air minum sebagai berikut : 1. Air laut
Mempunyai sifat asin, karena mengandung garam NaCl. Kadar garam
NaCl dalam air laut 3 % dengan keadaan ini maka air laut tidak memenuhi syarat untuk diminum.
2. Air Atmosfer
Untuk menjadikan air hujan sebagai air minum hendaknya pada waktu menampung air hujan mulai turun, karena masih mengandung banyak kotoran. Selain itu air hujan mempunyai sifat agresif terutama terhadap pipa-pipa penyalur maupun bak-bak reservoir, sehingga hal ini akan mempercepat terjadinya korosi atau karatan. Juga air ini mempunyai sifat lunak, sehingga akan boros terhadap pemakaian sabun.
3. Air Permukaan
untuk pengambilan air sebaiknya dilakukan pada kedalaman tertentu di tengah-tengah.
4. Air tanah
Air tanah adalah air yang berada di bawah permukaan tanah didalam zone jenuh dimana tekanan hidrostatiknya sama atau lebih besar dari tekanan atmosfer (Suyono,1993).
5. Mata air
Yaitu air tanah yang keluar dengan sendirinya ke permukaan tanah dalam hampir tidak terpengaruh oleh musim dan kualitas atau kuantitasnya sama dengan air dalam.
Sistem penyediaan air bersih meliputi besarnya komponen pokok antara lain: unit sumber baku, unit pengolahan, unit produksi, unit transmisi, unit distribusi dan unit konsumsi, yaitu (1)Unit sumber air baku merupakan awal dari sistem penyediaan air bersih yang mana pada unit ini sebagai penyediaan air baku yang bisa diambil dari air tanah, air permukaan, air hujan yang jumlahnya sesuai dengan yang diperlukan. (2) Unit pengolahan air memegang peranan penting
dalam upaya memenuhi kualitas air bersih atau minum, dengan pengolahan fisika, kimia, dan bakteriologi, kualitas air baku yang semula belum memenuhi syarat kesehatan akan berubah menjadi air bersih atau minum yang aman bagi manusia. (3). Unit produksi adalah salah satu dari sistem penyediaan air bersih yang menentukan jumlah produksi air bersih atau minum yang layak didistribusikan ke beberapa tandon atau reservoir dengan sistem pengaliran gravitasi atau pompanisasi. (4). Unit produksi merupakan unit bangunan yang mengolah jenis-jenis sumber air menjadi air bersih.
2.1.1 Karakteristik Air • Parameter Fisik
a. Suhu
Temperatur air maksimum yang diiznkan oleh MENKES RI
No.416/MENKES/PER/IX/1990 adalah 300C. Penyimpangan terhadap ketetapan ini akan mengakibatkan meningkatnya daya/tingkat toksisitas bahan kimia atau bahan pencemar dalam air dan pertumbuhan mikroba dalam air.
b. Warna
Banyak air permukaan khususnya yang berasal dari daerah rawa rawa
seringkali berwarna sehingga tidak dapat diterima oleh masyarakat baik untuk keperluan rumah tangga maupun keperluan industri, tanpa dilakukannya pengolahan untuk menghilangkan warna tersebut. Bahan bahan yang menimbulkan warna tersebut dihasilkan dari kontak antara air dengan reruntuhan organis yang mengalami dekomposisi.
c. Bau
Air yang memenuhi standar kualitas harus bebas dari bau. Biasanya bau disebabkan oleh bahan-bahan organik yang dapat membusuk serta senyawa kimia lainnya fenol. Air yang berbau akan dapat mengganggu estetika.
d. Rasa
Biasanya rasa dan bau terjadi bersama-sama, yaitu akibat adanya dekomposisi bahan organik dalam air. Seperti pada bau, air yang memiliki rasa juga dapat mengganggu estetika.
e. Kekeruhan
Air dikatakan keruh, apabila air tersebut mengandung begitu banyak partikel bahan yang tersuspensi sehingga memberikan warna/rupa yang berlumpur dan kotor. Bahan-bahan yang menyebabkan kekeruhan ini meliputi tanah liat, lumpur, bahan bahan organik yang tersebar.
f. Padatan/solid
Semua kontaminan/pengotor dalam air kecuali gas terlarut merupakan bagian dari beban padatan dalam air. Padatan dapat diklasifikasikan menurut
padatan dalam air dapat diklasifikasikan menurut ukuran dan posisinya seperti dapat mengendap, suspensi, koloid atau terlarut. Parameter fisik kualitas air dapat dilihat pada Tabel 1.
Tabel 1. Parameter Fisik Kualitas Air
No Test Singkatan Kegunaan
1 Kekeruhan NTU Mengetahui Kejernihan air
2 Padatan (Solids)
Total Solid
Total Volatile Solids
Suspended Solids
Volatile Suspended
Solids
Total Dissolved Solids
(TS-SS)
Settleble Solids
TS TVS
SS
VSS
TDS
Mengetahui potensi penggunaan kembali air buangan dan untuk menentukan jenis proses
pengolahan yang sesuai. Tes TDS untuk mengetahui kesesuaian
peruntukan air (rumah tangga, industri atau pertanian).
Untuk mengetahui padatan yang dapat mengendap oleh gaya gravitasi data yang diperoleh digunakan untuk rancangan bak sedimentasi.
3 Warna Untuk mengetahui keberadaan zat
warna alami atau sintetis.
4 Bau MDTOC
5 Temperatur ºC Untuk rancangan proses
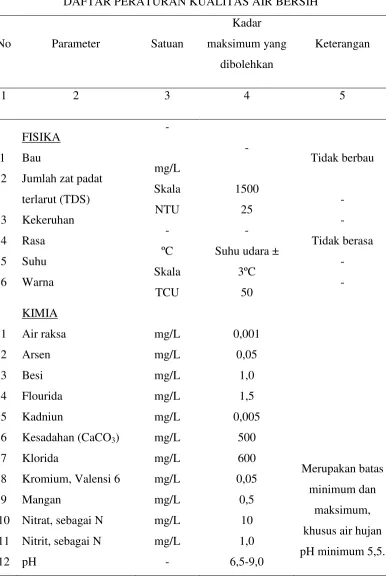
Untuk lebih terperinci, adapun syarat mutu untuk air sumur menurut Permenkes No. 416/Men. Kes/Per./IX/1990 terdapat di Tabel 2.
Tabel 2. Syarat Mutu Air Sumur
No. Parameter Satuan Standar Teknik Pengujian
A. FISIKA
1. Bau - - Organoleptik
2. Jumlah Zat Padat Terlarut mg/l 1.500 Gravimetri
3. Kekeruhan NTU 25 Spektrofotometri
4. Rasa - - Organoleptik
5. Suhu oC Suhu udara -30C Temometer
6. Warna TCU 50 Spektrofotometri
B. KIMIA
a. Kimia Anorganik
1. Air Raksa (Hg) mg/l 0.001 AAS
2. Arsen (As) mg/l 0.05 AAS
3. Besi (Fe) mg/l 1.0 AAS
4. Fluorida (F) mg/l 1.5 Spektrofotometri
5. Kadmium (Cd) mg/l 0.005 AAS
6. Kesadahan sebagai CaCO3 mg/l 500 Titrimetri
7. Klorida (Cl-) mg/l 600 Argentometri
8. Kromium, valensi 6 (Cr6+) mg/l 0.05 AAS
9. Mangan (Mn) mg/l 0.5 AAS
10. Nitrat (NO3) mg/l 10 Spektrofotometri (Brusin)
11. Nitrit (NO2) mg/l 1.0 Spektrofotometri (Nesler)
12. pH - 6.5-9.0 pH meter
13. Selenium (Se) mg/l 0.01
-14. Seng (Zn) mg/l 15 AAS
15. Sianida (CN) mg/l 0.1 Destilasi
16. Sulfat (SO4) mg/l 400 Spektrofotometri
17. Timbal (Pb) mg/l 0.05 AAS
b. Kimia Organik
1. Detergent mg/l 0.50 Spektrofotometri
2. Zat Organik mg/l 10.00 Gravimetri
3. Pestisida Gol. Organo Fosfat mg/l 0.00 -4. Pestisida Gol. Organo Klorida mg/l 0.00 -5. Pestisida Gol. Organo Karbamat mg/l 0.00
-C. MIKROBIOLOGIK
• Parameter Kimia
a. Derajat keasamaan (pH)
pH merupakan salah satu faktor yang sangat penting mengingat pH dapat mempengaruhi pertumbuhan mikroba di dalam air. Sebagian besar mikroba di dalam air. Sebagian besar mikroba akan tumbuh dengan baik pada pH 6,0-8,0 pH juga akan menyebabkan perubahan kimiawi di dalam air. Menurut standar kualitas air , pH 6,5-9,2. Apabila pH kecil dari 6,5 atau lebih besar dari 9,2 maka akan menyebabkan korosifitas pada pipa-pipa air yang dibuat dari logam dan dapat mengakibatkan beberapa senyawa kimia berubah menjadi racun yang dapat
mengganggu kesehatan manusia. b. TotalSolid
Tingginya angka total solid merupakan bahan pertimbangan dalam menentukan sesuai atau tidaknya air untuk penggunaan rumah tangga. Air yang baik digunakan untuk keperluan rumah tangga adalah dengan angka total solid di dalam air minum adalah 500-1500 mg/l. Apabila melebihi, maka akan berakibat air tidak enak rasanya, rasa mual dan terjadinya cardiac diseases serta toxaemia pada wanita-wanita hamil
c. Kesadahan jumlah (total hardness)
Kesadahan adalah merupakan sifat air yang disebabkan oleh adanya ion-ion (kation) logam valensi dua. Ion-ion ini mampu bereaksi dengan sabun membentuk kerak air. Kation-kation penyebab utama dari kesadahan Ca++,Mg++, Sr++,Fe++dan Mn++. Kesadahan total adalah kesadahan yang disebabkan oleh Ca++dan Mg++secara bersama-sama. Standar kualitas menetapkan kesadahan total adalah 5-10 derajat jerman. Apabila kesadahan kuran dari 5 derajat jerman maka air akan menjadi lunak. Jika lebih dari 10 derajat jerman maka akan mengakibatkan kurangya efektifitas sabun, menyebabkan lapisan kerak pada alat dapur dan sayur-sayuran menjadi keras apabia dicuci dengan air ini
d. Zat Organik
Adanya zat organik di dalam air, disebabkan karena air buangan dari rumah tangga, industri, kegiatan pertanian dan pertambangan. Zat organik di dalam air
standar kualitas, ditentukan maksimal angka permangantnya 10mg/l. Penyimpangan standar kualitas tersebut akan mengakibatkan timbulnya bau tak sedap danmenyebabkan sakit perut.
e. Kimia Anorganik
1. Calcium (Ca)
Adanya Ca dalam air sangat dibutuhkan dalam jumlah tertentu, yaitu untuk pertumbuhan tulang dan gigi. Sedangkan bila telah melewati ambang batas, kalsium dapat menyebabkan kesadahan, kesadahan dapat berpengaruh secara ekonomis maupun terhadap kesehatan yaitu efek korosif dan menurunnya efektifitas dari kerja sabun. Standar yang ditetapkan DEPKES sebesar 75-200 mg/l. Sedangkan WHO inter-regional water study group adalah sebesar 75-150 mg/l.
2. Tembaga
Ukuran batas ada atau tidaknya tembaga adalah 0,05-1,5 mg/l. Dalam jumlah kecil Cu sangat diperlukan untuk pembentukan sel darah merah, sedangkan dalam jumlah yang besar dapat menyebabkan rasa yang tidak enak di
lidah, disamping dapat menyebabkan kerusakan pada hati. 3. Sulfida (S2atau H2S)
H2S sangat beracun dan berbau busuk, oleh karena itu zat ini tidak boleh
terdapat dalam air minum. Dalam jumlah besar dapat menimbulkan atau memperbesar keasaman air sehingga menyebabkan korosifitas pada pipa-pipa logam.
4. Amonia
Bahan ini sangat berbau yang sangat menusuk hidung atau baunya sangat tajam sehingga tidak boleh sama sekali dalam air minum.
5. Besi (Fe)
mg/l. jika dalam jumlah besar Fe dapat merusak dinding usus, rasa tidak enak dalam air, pada konsentrasi lebih dari 2 mg/l dan menimbulkan bau dan warna dalam air.
6. Magnesium
Efek yang ditimbulkan oleh Mg sama dengan kalsium yaitu menyebabkan terjadinya kesadahan. Dalam jumlah kecil Mg dibutuhkan oleh tubuh untuk pertumbuhan tulang, sedang dalam jumlah yang lebih besar dari 150 mg/l dapat meyebabkan rasa mual
7. Florida
Florida selalu ditemukan dalam bentuk senyawa. Florida bersifat lebih toksis dan lebih iritan daripada yang organik. Keracunan kronis dapat menyebabkan orang menjadi kurus, pertumbuhan tubuh terganggu, gangguan pencernaan dan dehidrasi.
8. Cadnium
Dalam standar kualitas ditetapkan konsentrasi maksimal 0,01 mg/l. Apabila cadmium melebihi standar, maka Cadmium tersebut akan terakumulasi dalam
jaringan tubuh sehingga mengakibatkan penyakit ginjal, gangguan lambung, kerapuhan tulang, mengurangi hemoglobine darah dan pigmentasi.
9. Mangan
Tubuh manusia membutuhkan Mangan rata-rata 10 mg/l sehari yang dapat dipenuhi dari makanan. Tetapi Mangan bersifat toxis terhadap alat pernafasan. Standar kualitas menetapkan: kandungan mangan di dalam air 0,05-0,5 mg/l.
10. Air Raksa
Merupakan logam berbentuk cair dalam suhu kamar yang bersifat toksis. Di dalam standar ditetapkan sebesar 0,001 mg/l. Jika dalam air terdapat air raksa lebih dari standar, akan menyebabkan keracunan sel-sel tubuh kerusakan ginjal, hati dan syaraf dan keterbelakangan mental dan cerebral polcy pada bayi.
11. Seng
12. Arsen
Arsen dapat diperbolehkan dalam air paling banyak sebesar 0,05 mg/l. Jika dalam jumlah yang banyak dapat menyebabkan gangguan pada sistem pencernaan, kanker kulit, hati dann saluran empedu
13. Pheonolix
Phenol hanya boleh terdapat dalam air minum dengan kadar 0,001-0,002 mg/l dan apabila bereaksi dengan chlor dapat menimbulkan bau yang tidak enak
14. NO3
Batas maksimum NO2 dalam air minum adalah sebesar 20mg/l. Jumlah
Nitra yang besar cenderung berubah menjadi nitrit, yang dapat bereaksi langsung dengan hemoglobine yang dapat menghalangi perjalanan oksigen di dalam tubuh.
15. Sulfat
Kadar yang dianjurkan 200-400 mg/l, apabila jumlahnya besar dapat bereaksi dengan ion natrium atau magnesium dalam air sehingga membentuk garam natrium sulfat atau magnesium sulfat yang dapat menimbulkan rasa mual.
f. Kimia Organik
Jumlah zat organic pada air alam umunya kecil. Sumber zat organik pada air alam adalah dari tanaman yang membusuk. Adanya zat organik dapat mengakibatkan gangguan misalnya :
- Aldrin dan Dieldrin, terjadi biokumulasi pada organisme air yang dimakan manusia dan menimbulkan kanker dan mutasi
- Benzen, menimbulkan rasa, warna atau bau tidak sedap.
- Chlordine (total isomer) merupakan insektisida. Penyakit yang ditimbulkan hyperexytasi, konvulsi, anemia, trombochytopenia, agranulocytosis
Karakteristik air berdasarkan parameter- parameter diatas dapat dilihat dari Tabel 3.
Jumlah per
100 ml
10 Air perpipaan
RADIOAKTIVITAS Aktivitas Alpha (Gross Alpha Activity)
Aktivitas Beta (Gross Beta Activity)
Bq/L
Bq/L
0,1
1,0
(Nomor : 416/MENKES/PER/IX/1990/ Tanggal 3 September 1990)
Golongan A : air untuk air minum tanpa pengolahan terlebih dahulu
Golongan B : air yang dipakai sebagai bahan baku air minum melalui suatu pengolahan
Golongan C : air untuk perikanan dan peternakan
Golongan D : air untuk pertanian dan usaha perkotaan, industri dan PLTA.
2.1.2 Logam Besi (Fe) dan Mangan (Mn) dalam Air
Air merupakan zat kehidupan dimana tidak satupun mahluk hidup yang tidak membutuhkan air. Hasil penelitian menunjukan 65 - 75 % dari berat badan manusia terdiri dari air. Menurut ilmu kesehatan, setiap orang memerlukan air minum sebanyak 2,5 – 3 liter setiap hari termasuk air yang berada didalam makanan. Adapun kegunaan air antara lain adalah untuk minum, keperluan rumah tangga, untuk industri, mengairi sawah, kolam perikanan dan lain-lain.
Sehingga pada umumnya air tanah mengandung kation dan anion terlarut dan beberapa senyawa anorgnik. Ion-ion yang sering ditemui pada air tanah adalah besi dan mangan. Keberadaan zat besi dan mangan di dalam sistem penyediaan air minum domestik telah menjadi masalah yang serius sejak lama karena pada umumnya berada dalam keadaan bervalensi dua. Adanya kandungan Besi (Fe) dan Mangan (Mn) dalam air menyebabkan warna air tersebut berubah menjadi kuning kecoklatan setelah beberapa saat kontak dengan udara. Disamping menimbulkan gangguan kesehatan juga menimbulkan bau yang kurang enak dan
Air tanah mengalami kontak dengan berbagai macam material yang terdapat di dalam bumi. Sehingga pada umumnya air tanah mengandung kation dan anion terlarut dan beberapa senyawa anorganik seperti silika (SiO2). Ion-ion
yang biasanya terkandung dalam air tanah meliputi kalsium, besi, magnesium, natrium, kalium, klorida. Sedangkan gas-gas terlarut meliputi nitrogen, karbondioksida, metana, oksigen, dan hidrogen sulfida (Fetter, 1999)
Pada umumnya besi dalam air dapat bersifat: 1. Terlarut sebagai Fe2+(Ferro) atau Fe3+(Ferri).
2. Tersuspensi sebagai butir koloidal (diameter < 1 μ m) atau yang lebih besar seperti Fe2O3, FeO, Fe(OH)3,dan sebagainya.
3. Tergabung dengan zat organik atau zat padat yang inorganik seperti tanah liat.
Pada air permukaan jarang ditemui kadar Fe lebih besar dari 1 mg/Liter, tetapi dalam air tanah kadar Fe dapat jauh lebih tinggi. Konsentrasi Fe yang tinggi ini dapat dirasakan dan dapat menodai kain, perkakas dapur, dan alat sanitsi.
Kehadiran mangan dalam air tanah bersamaan dengan besi yang berasal
dari tanah dan bebatuan. Mangan dalam air berbentuk mangan bikarbonat (Mn(HCO3)2), mangan klorida (MnCl2) dan mangan sulfat (MnSO 4).
Besi (Fe) adalah logam berwarna putih keperakan, liat dan dapat dibentuk. Fe di dalam susunan unsur berkala termasuk logam golongan VIII, dengan berat atom 55,85g.mol-1, nomor atom 26, berat jenis 7.86g.cm-3 dan umumnya mempunyai valensi 2 dan 3 (selain 1, 4, 6). Besi (Fe) adalah logam yang dihasilkan dari bijih besi, dan jarang dijumpai dalam keadaan bebas, untuk mendapatkan unsur besi, campuran lain harus dipisahkan melalui penguraian kimia. Besi digunakan dalam proses produksi besi baja, yang bukan hanya unsur besi saja tetapi dalam bentuk alloy (campuran beberapa logam dan bukan logam, terutama karbon) (Eaton Et.al, 2005; Rumapea, 2009 dan Parulian, 2009).
konsentrasi besi pada air tanah bervariasi mulai dan 0,01 mg/l sampai dengan + 25 mg/l. Di alam biasanya banyak terdapat di dalam bijih besi hematite, magnetite, taconite, limonite, goethite, siderite dan pyrite (FeS), sedangkan di dalam air umumnya dalam bentuk terlarut sebagai senyawa garam ferri (Fe3+) atau garam ferro (Fe2+); tersuspensi sebagai butir koloidal (diameter < 1 mm) atau lebih besar seperti, Fe(OH)3; dan tergabung dengan zat organik atau zat padat yang anorganik
(seperti tanah liat dan partikel halus terdispersi). Senyawa ferro dalam air yang sering dijumpai adalah FeO, FeSO4, FeSO4.7 H2O, FeCO3, Fe(OH)2, FeCl2
sedangkan senyawa ferri yang sering dijumpai yaitu FePO4, Fe2O3, FeCl3,
Fe(OH)3. (Eaton Et.al, 2005).
Pada air yang tidak mengandung oksigen O2, seperti seringkali air tanah,
besi berada sebagai Fe2+ yang cukup dapat terlarut, sedangkan pada air sungai yang mengalir dan terjadi aerasi, Fe2+ teroksidasi menjadi Fe3+ yang sulit larut pada pH 6 sampai 8 (kelarutan hanya di bawah beberapa m g/l), bahkan dapat menjadi ferihidroksida Fe(OH)3, atau salah satu jenis oksida yang merupakan zat
padat dan bisa mengendap.(Alaerts,1987)
Konsentrasi besi dalam air minum dibatasi maksimum 0.3 mg/l (sesuai Kepmenkes RI No. 907/MENKES/SK/VII/2002), hal ini berdasarkan alasan masalah warna, rasa serta timbulnya kerak yang menempel pada sistem perpipaan. Manusia dan mahluk hidup lainnya dalam kadar tertentu memerlukan zat besi sebagai nutrient tetapi untuk kadar yang berlebihan perlu dihindari. Garam ferro misalnya (FeSO4) dengan konsentrasi 0.1 – 0.2 mg/L dapat menimbulkan rasa
yang tidak enak pada air minum. Dengan dasar ini standar air minum WHO untuk Eropa menetapkan kadar besi dalam air minum maksium 0.1 mg/l sedangkan USEPA menetapkan kadar maksimum dalam air yaitu 0.3 mg/l. (Arifin, 2007).
Unsur besi mempunyai sifat – sifat yang sangat mirip dengan mangan sehingga pengaruhnya juga hampir sama meskipun beberapa hal berbeda terutama nilai ambang batas.
1. Menimbulkan penyumbatan pada pipa disebabkan. Secara langsung oleh deposit (tubercule)yang disebabkan oleh endapan besi sedangkan secara tidak langsung, disebabkan oleh kumpulan bakteri besi yang hidup di dalam pipa, karena air yang mengandung besi, disukai oleh bakteri besi.
2. Selain itu kumpulan bakteri ini dapat meninggikan gaya gesek (losses) yang juga berakibat meningkatnya kebutuhan energi. Selain itu pula apabila bakteri tersebut mengalami degradasi dapat menyebabkan bau dan rasa tidak enak pada air.
3. Besi dan mangan sendiri dalam konsentrasi yang lebih besar dan beberapa mg/l, akan memberikan suatu rasa pada air yang menggambarkan rasa logam, atau rasa obat.
4. Keberadaan besi dan mangan juga dapat memberikan kenampakan keruh dan berwarna pada air dan meninggalkan noda pada pakaian yang dicuci dengan menggunakan air ini, oleh karena itu sangat tidak diharapkan pada industri kertas, pencelupan/textil dan pabrik minuman.
5. Meninggalkan noda pada bak-bak kamar mandi dan peralatan lainnya (noda
kecoklatan disebabkan oleh besi dan kehitaman oleh mangan).
6. Endapan logam ini juga yang dapat memberikan masalah pada sistem penyediaan air secara individu (sumur).
7. Pada ion exchanger endapan besi dan mangan yang terbentuk, seringkali mengakibatkan penyumbatan atau menyelubungi media pertukaran ion (resin), yang mengakibatkan hilangnya kapasitas pertukaran ion.
8. Menyebabkan keluhan pada konsumen (seperti kasus “red water”) bila endapan besi dan mangan yang terakumulasi di dalam pipa, tersuspensi kembali disebabkan oleh adanya kenaikan debit atau kenaikan tekanan di dalam pipa/sistem distribusi, sehingga akan terbawa ke konsumen.
9. Fe2+ juga menimbulkan corrosive yang disebabkan oleh bakteri golongan CrenothricdanClonothrix(Oktiawan, dkk., 2007).
yang memungkinkan sel darah merah membawa oksigen dan mengantarkannya ke jaringan tubuh. Kelebihan zat besi (Fe) bisa menyebabkan keracunan dimana terjadi muntah, kerusakan usus, penuaan dini hingga kematian mendadak, mudah marah, radang sendi, cacat lahir, gusi berdarah, kanker, cardiomyopathies, sirosis ginjal, sembelit, diabetes, diare, pusing, mudah lelah, kulit kehitam – hitaman, sakit kepala, gagal hati, hepatitis, mudah emosi, hiperaktif, hipertensi, infeksi, insomnia, sakit liver, masalah mental, rasa logam di mulut,myasthenia gravis, nausea, nevi, mudah gelisah dan iritasi, parkinson, rematik, sikoprenia, sariawan perut, sickle-cell anemia, keras kepala, strabismus, gangguan penyerapan vitamin dan mineral, serta hemokromatis.
(Parulian, 2009).
Besi (Fe) dibutuhkan oleh tubuh dalam pembentukan haemoglobin sehingga jika kekurangan besi (Fe) akan mempengaruhi pembentukan haemoglobin tersebut. Besi (Fe) juga terdapat dalam serum protein yang disebut dengan“transferin”berperan untuk mentransfer besi (Fe) dari jaringan yang satu ke jaringan lain. Besi (Fe) juga berperan dalam aktifitas beberapa enzim seperti sitokrom dan flavo protein. Apabila tubuh tidak mampu mengekskresikan besi (Fe) akan menjadi akumulasi besi (Fe) karenanya warna kulit menjadi hitam. Debu besi (Fe) juga dapat diakumulasi di dalam alveori menyebabkan berkurangnya fungsi paru-paru. Kekurangan besi (Fe) dalam diet akan mengakibatkan defisiensi yaitu kehilangan darah yang berat yang sering terjadi pada penderita tumor saluran pencernaan, lambung dan pada menstruasi. Defisiensi besi (Fe) menimbulkan gejala anemia seperti kelemahan, fatigue, sulit bernafas waktu berolahraga, kepala pusing, diare, penurunan nafsu makan, kulit pucat, kuku berkerut, kasar dan cekung serta terasa dingin pada tangan dan kaki. (Rumapea, 2009 dan Siregar, 2009).
Mangan (Mn) adalah logam berwarna abu – abu keperakan yang merupakan unsur pertama logam golongan VIIB, dengan berat atom 54.94 g.mol
-1
makanan. Di alam jarang sekali berada dalam keadaan unsur. Umumnya berada dalam keadaan senyawa dengan berbagai macam valensi. Di dalam hubungannya dengan kualitas air yang sering dijumpai adalah senyawa mangan dengan valensi 2, valensi 4, valensi 6.
Di dalam sistem air alami dan juga di dalam sistem pengolahan air, senyawa mangan dan besi berubah-ubah tergantung derajat keasaman (pH) air. Perubahan senyawa besi dan mangan di alam berdasarkan kondisi pH secara garis besar dapat ditunjukan sesuai gambar 1 yang memperlihatkan bahwa di dalam sistem air alami pada kondisi reduksi, mangan dan juga besi pada umumnya mempunyai valensi dua yang larut dalam air. Oleh karena itu di dalam sistem pengolahan air, senyawa mangan dan besi valensi dua tersebut dengan berbagai cara dioksidasi menjadi senyawa yang memiliki valensi yang lebih tinggi yang tidak larut dalam air sehingga dapat dengan mudah dipisahkan secara fisik. Mangan di dalam senyawa MnCO3, Mn(OH)2 mempunyai valensi dua, zat
tersebut relatif sulit larut dalam air, tetapi untuk senyawa Mn seperti garam MnCl2, MnSO4, Mn(NO3)2mempunyai kelarutan yang besar di dalam air (Eaton,
2005).
Kandungan Mn di bumi sekitar 1060 ppm, di tanah sekitar 61–1010 ppm, di sungai sekitar 7 mg/l, di laut sekitar 10 ppm, di air tanah sekitar <0.1 mg/l. Mangan terdapat dalam bentuk kompleks dengan bikarbonat, mineral dan organik. Unsur mangan pada air permukaan berupa ion bervalensi empat dalam bentuk organik kompleks. Mangan banyak terdapat dalam pyrolusite (MnO2), braunite,
(Mn2+Mn3+6)(SiO12), psilomelane (Ba,H2O)2Mn5O10 danrhodochrosite (MnCO3).
(Eaton, 2005)
minum maksimum 0.05 mg/l. Jepang menetapkan total konsentrasi besi dan mangan di dalam air minum maksimum 0.3 mg/l. Indonesia berdasarkan Keputusan Menteri Kesehatan No. 907 tahun 2002 menetapkan kadar zat besi di dalam air minum maksimum 0.3 dan Mangan maksimum sebesar 0.1 mg/l (Eaton, 2005).
Baik besi maupun mangan, dalam air biasanya terlarut dalam bentuk senyawa atau garam bikarbonat, garam sulfat, hidroksida dan juga dalam bentuk kolloid atau dalam keadaan bergabung dengan senyawa organik. Oleh karena itu cara pengolahannyapun harus disesuaikan dengan bentuk senyawa besi dan mangan dalam air yang akan diolah. Pada proses penghilangan besi dan mangan, prinsipnya adalah proses oksidasi, yaitu menaikkan tingkat oksidasi oleh suatu oksidator dengan tujuan merubah bentuk bentuk besi terlarut menjadi bentuk besi tidak terlarut (endapan). Endapan yang terbentuk dihilangkan dengan proses sedimentasi dan filtrasi (Oktiawan, dkk., 2007).
Pada umumnya metode yang digunakan untuk menghilangkan besi dan mangan adalah metode fisika, kimia, biologi maupun kombinasi dari masing –
masing metode tersebut. Metode fisika dapat dilakukan dengan cara filtrasi, aerasi, presipitasi, elektrolitik, pertukaran ion (ion exchange), adsorpsi dan sebagainya. Metode kimia dapat dilakukan dengan pembubuhan senyawa khlor, permanganat, kapur – soda, ozon, polyphosphat, koagulan, flokulan, dan sebagainya. Metode biologi dapat dilakukan dengan cara menggunakan mikroorganisme autotropis tertentu seperti bakteri besi yang mampu mengoksidasi senyawa besi dan mangan (Oktiawan, dkk, 2007).
2.2. Karbon Aktif
Karbon aktif, atau sering juga disebut sebagai arang aktif, adalah suatu jenis karbon yang memiliki luas permukaan yang sangat besar. Hal ini bisa dicapai dengan mengaktifkan karbon atau arang tersebut. Hanya dengan satu gram dari karbon aktif, akan didapatkan suatu material yang memiliki luas permukaan kira-kira sebesar 500 m2 (didapat dari pengukuran adsorpsi gas nitrogen). Biasanya pengaktifan hanya bertujuan untuk memperbesar luas permukaannya saja, namun beberapa usaha juga berkaitan dengan meningkatkan kemampuan adsorpsi karbon aktif itu sendiri. Karbon aktif merupakan bentuk umum untuk senyawa berbahan dasar karbon yang telah diolah, sehingga menghasilkan derajat pirositas tinggi. Karbon atau arang aktif adalah material yang berbentuk butiran atau bubuk yang berasal dari material yang mengandung karbon misalnya batubara, kulit kelapa, dan sebagainya (Anonim, 2012).
Dalam satu gram karbon aktif, pada umumnya memiliki permukaan seluas 500-1500 m2, sehingga sangat efektif dalam menangkap partikel-partikel yang sangat halus berukuran 0.01-0.0000001 mm. Karbon aktif bersifat sangat aktif dan
akan menyerap apa saja yang kontak dengan karbon tersebut. Dalam waktu 60 jam biasanya karbon aktif tersebut menjadi jenuh dan tidak aktif lagi. Oleh karena itu biasanya karbon aktif dikemas dalam kemasan kedap udara.
Ada tiga jenis karbon aktif yang banyak dipasaran yaitu:
• Bentuk serbuk.
Karbon aktif berbentuk serbuk dengan ukuran lebih kecil dari 0,18 mm (80#). Terutama digunakan dalam aplikasi fasa cair dan gas. Digunakan pada industry pengolahan air minum, industry farmasi, terutama untuk pemurnian monosodium glutamate, bahan tambahan makanan, penghilang warna asam furan, pengolahn pemurnian jus buah, penghalus gula, pemurnian asam sitrtat, asam tartarikk, pemurnian glukosa dan pengolahan zat pewarna kadar tinggi.
• Bentuk Granular.
dari jenis ini digunakan untuk: pemurnian emas, pengolahan air, air limbah dan air tanah, pemurni pelarut dan penghilang bau busuk.
• Bentuk Pellet. Karbon aktif berbentuk pellet dengan diameter 0,8-5 mm.
Kegunaaan utamanya adalah untuk aplikasi fasa gas karena mempunyai tekanan rendah, kekuatan mekanik tinggi dan kadar abu rendah.Digunakan untuk pemurnian udara, control emisi, tromol otomotif, penghilangbau kotoran dan pengontrol emisi pada gas buang.
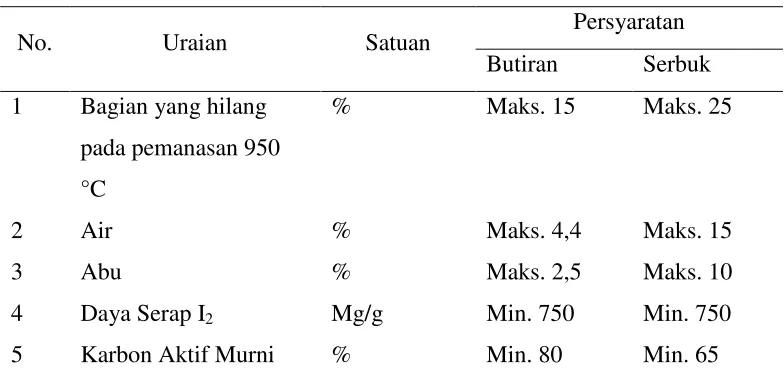
Dalam pembuatan karbon aktif harus memenuhi syarat mutu karbon aktif, dimana syarat mutu tersebut digunakan sebagai standart untuk suatu karbon aktif.
Tabel 4. Syarat Mutu Karbon Aktif Teknis (SNI) No. 06-3730-1995
(Sumber : LIPI, 2005)
2.2.1 Proses Pembuatan Karbon Aktif
Secara umum proses pembuatan karbon aktif terdiri dari tiga tahap yaitu: 1. Dehidrasi : Proses penghilangan air dimana bahan baku dipanaskan sampai
temperatur 170°C.
2. Karbonisasi : Pemecahan bahan-bahan organik menjadi karbon. Suhu diatas 170°C akan menghasilkan CO, CO2 dan asam asetat. Pada suhu 275°C,
dekomposisi menghasilkan “ter”, metanol dan hasil samping lainnya.
Pembentukan karbon terjadi pada temperatur 400-600°C
No. Uraian Satuan Persyaratan
Butiran Serbuk
1 Bagian yang hilang
pada pemanasan 950 °C
% Maks. 15 Maks. 25
2 Air % Maks. 4,4 Maks. 15
3 Abu % Maks. 2,5 Maks. 10
4 Daya Serap I2 Mg/g Min. 750 Min. 750
3. Aktivasi : Dekomposisi tar dan perluasan pori-pori. Dapat dilakukan dengan uap atau CO2 sebagai aktivator. Proses aktivasi merupakan hal yang
penting diperhatikan disamping bahan baku yang digunakan. Yang dimaksud dengan aktivasi adalah suatu perlakuan terhadap karbon yang bertujuan untuk memperbesar pori yaitu dengan cara memecahkan ikatan hidrokarbon atau mengoksidasi molekul-molekul permukaan sehingga karbon mengalami perubahan sifat, baik fisika maupun kimia, yaitu luas permukaannya bertambah besar dan berpengaruh terhadap adsorpsi.
Metode aktivasi yang umum digunakan dalam pembuatan arang aktif adalah
1. Aktivasi Kimia
Aktivasi ini merupakan proses pemutusan rantai karbon dari senyawa organik dengan pemakaian bahan-bahan kimia. Aktivator yang digunakan adalah bahan-bahan kimia seperti: hidroksida logam alkali garam-garam karbonat, klorida, sulfat, fosfat dari logam alkali tanah dan khususnya ZnCl2, asam-asam
anorganik seperti H2SO4,HCl dan H3PO4.
2. Aktivasi Fisika
Aktivasi ini merupakan proses pemutusan rantai karbon dari senyawa organik dengan bantuan panas, uap dan CO2. Umumnya arang dipanaskan
didalam tanur pada temperatur rendah merupakan reaksi eksoterm sehingga sulit untuk mengontrolnya. Sedangkan pemanasan dengan uap atau CO2 pada
temperatur tinggi merupakan reaksi endoterm, sehingga lebih mudah dikontrol dan paling umum digunakan.
2.2.2 Penggunaan Karbon Aktif
Hampir 60% produksi karbon aktif di dunia digunakan pada industri-industri gula dan pembersih minyak dan lemak, kimia dan farmasi. Penggunaan karbon aktif secara umum dapat diuraikan sebagai berikut :
1. Industri Gula
senyawa-senyawa nitrogen, sehingga proses penyaringan menjadi lebih sempurna. Basa yang timbul pada proses penguapan akan berkurang serta akan mempercepat proses kristalisasi. Pada industri gula bit dan glukosa, ternyata pemakaian karbon aktif memberikan hasil lebih memuaskan dan operasionalnya lebih fleksibel.
2. Industri Minyak dan Lemak
Pada pengolahan minyak nabati, hasil yang lebih ekonomis akan diperoleh bila pada proses pemurniannya digunakan campuran karbon aktif. Dalam hal ini fungsi karbon aktif adalah menghilangkan zat-zat warna dan feroksid. Untuk minyak yang mengalami hidrolisa, pemakaian karbon aktif berfungsi untuk menghilangkan katalis yang masih tersisa pada minyak. Pada umumnya pemurnian dengan karbon aktif dilaksanakan pada temperatur 70–1200C.
3. Industri Kimia dan Farmasi
Karbon aktif digunakan untuk menyerap kotoran-kotoran yang tidak diingikan yang berupa koloid, karbon aktif dapat juga berfungsi sebagai filter
sehingga proses kristalisasi dapat dipercepat. Penggunaan karbon aktif dalam industri kimia dan farmasi sering dijumpai dalam pembuatan kafein, asam sitrat, gliserin, asam laktat, dan antibiotika penisilin danstreptomysin.
4. Penjernih Air
Pemakaian klorin sebagai disinfektan pada penjernih air akan menimbulkan bau dan rasa yang tidak enak, ini ditimbulkan oleh reaksi antara klorin dengan mikro organisme. Untuk mencegah hal ini maka pada tahapan proses yang terakhir dapat digunakan karbon aktif sebagai adsorben dari reaksi yang ditimbulkan klorin dengan mikro organisme (Sihite, 2003).
2.3. Bambu
2.3.1. Pengertian Bambu
aur, dan eru. Di dunia ini bambu merupakan salah satu tanaman dengan pertumbuhan paling cepat. Karena memiliki sistem rhizoma-dependen unik, dalam sehari bambu dapat tumbuh sepanjang 60cm (24 Inchi) bahkan lebih, tergantung pada kondisi tanah dan klimatologi tempat ia ditanam (Adri, 2011).
2.3.2. Anatomi Bambu
Kolom bambu terdiri atas sekitar 50% parenkim, 40% serat dan 10% sel penghubung (pembuluh dan sieve tubes). Parenkim dan sel penghubung lebih banyak ditemukan pada bagian dalam dari kolom, sedangkan serat lebih banyak ditemukan pada bagian luar. Sedangkan susunan serat pada ruas penghubung antar buku memiliki kecenderungan bertambah besar dari bawah ke atas sementara parenkimnya berkurang. Semakin besar dinding sel serat maka makin besar pula kandungan alfa dan holoselulosa serta lignin. Selulosa dan lignin adalah komponen utama dinding sel serat batang bambu. Pada bambu betung selulosa yang terkandung 44,94%, lignin sebesar 27,37%, dan holoselulosa sebesar 73,63% (E. Manuhuwa dan M. Loiwatu).
2.4. Adsorpsi
2.4.1. Pengertian Adsorpsi
Adsorpsi merupakan proses pemisahan dimana komponen tertentu dari satu fase fluida berpindah ke permukaan zat padat yang menyerap. Peristiwa adsorpsi ini disebabkan oleh gaya tarik molekul-molekul di permukaan adsorben. Biasanya partikel-partikel kecil zat menyerap ditempatkan didalam suatu hamparan tetap, dan fluida dialirkan melalui hamparan itu sampai zat padat itu mendekati jenuh dan pemisahan yang dikehendaki tidak dapat lagi berlangsung. Aliran itu lalu dipindahkan ke hamparan kedua sampai adsorbat telah jenuh dapat diganti atau diregenerasi.
menyebabkan sebagian molekul melekat pada permukaan yang lebih erat daripada molekul-molekul lainnya. Dalam kebanyakan hal, komponen yang diadsorpsi atau adsorbat melekat sedemikian kuat sehingga memungkinkan pemisahan komponen itu secara menyeluruh dari fluida tanpa terlalu banyak adsorpsi terhadap komponen yang lain. Regenerasi adsorben dapat dilaksanakan untuk mendapatkan adsorbat dalam bentuk terkonsentrasi atau hampir murni (Mc.Cabe, 1999).
Karbon aktif yang merupakan adsorben adalah suatu padatan berpori, yang sebagian besar terdiri dari unsur karbon bebas dan masing-masing berikatan secara kovalen, dengan demikian permukaan karbon aktif bersifat non polar. Selain komposisi dan polaritas, struktur pori juga merupakan faktor yang penting.
Sturktur pori berhubungan dengan luas permukaan, semakin kecil pori-pori karbon aktif, mengakibatkan luas permukaan semakin besar sehingga kecepatan adsorpsi bertambah. Untuk meningkatkan kecepatan adsorpsi, dianjurkan agar menggunakan karbon aktif yang telah dihaluskan. Sifat karbon aktif yang paling penting adalah daya serap.
Dalam hal ini, ada beberapa faktor yang mempengaruhi daya serap
adsorpsi, yaitu: 1. Luas permukaan
Semakin luas permukaan adsorben, maka makin banyak zat yang teradsorpsi. Luas permukaan adsorben ditentukan oleh ukuran partikel dan jumlah dari adsorben.
2. Jenis adsorbat
a. Peningkatan polarisabilitas adsorbat akan meningkatkan kemampuan adsorpsi molekul yang mempunyai polarisabilitas yang tinggi (polar) yang memiliki kemampuan tarik menarik terhadap molekul lain dibandingkan molekul yang tidak dapat membentuk dipol (non polar)
b. Peningkatan berat molekul adsorbat dapat meningkatkan kemampuan adsorpsi c. Adsorbat dengan rantai yang bercabang biasanya lebih mudah diadsorpsi
Hidroksil dan amino mengakibatkan penurunan kemampuan penyisihan sedangkan nitrogen meningkatkan kemampuan penyisihan
4. Konsentrasi Adsorbat
Semakin besar konsentrasi adsorbat dalam larutan maka semakin banyak jumlah substansi yang terkumpul pada permukaan adsorben
5. Temperatur
a. pemanasan atau pengaktifan adsorben akan meningkatkan daya serap adsorben terhadap adsorbat yang menyebabkan pori-pori adsorben lebih terbuka
b. Pemanasan yang terlalu tinggi menyebabkan rusaknya adsorben sehingga kemampuan penyerapannya menurun
6. pH
pH larutan mempengaruhi kelarutan ion logam, aktivitas gugus fungsi pada biosorben dan kompetensi ion logam dalam proses adsorpsi
7. Waktu Kontak
Penentuan waktu kontak yang menghasilkan kapasitas adsorpsi maksimum terjadi pada waktu kesetimbangan
Mekanisme yang terjadi pada proses adsorpsi yaitu:
a. Molekul-molekul adsorben berpindah dari fase bagian terbesar ke permukaan antara adsorben yaitu lapisan film yang melapisi permukaan adsorben
b. Molekul-molekul adsorben berpindah dari permukaan antara adsorben ke permukaan luar
c. Molekul-molekul adsorbat berpindah dari permukaan luar adsorben, dimana molekul tersebut menyebar menuju pori-pori adsorben
Sifat dan daya serap karbon aktif terbagi atas dua bagian yaitu absorpsi
(gaya van der waals) tetapi dalam hal-hal tertentu dapat melibatkan adsorpsi kimia
(khemisorpsi). Keduanya didapat dari ada atau tidaknya perubahan kimia yang terjadi antara zat yang dikumpulkan (absorban) dan zat mengumpulkan (absorben). Adsorpsi fisik biasanya melibatkan perubahan energi yang lebih kecil (ikatan lebih lemah) dari padakhemisorpsi.
Contohnya dari adsorpsi N2pada karbon melepaskan energi kira-kira 5000
kalori per mol, sedangkan adsorpsi O2pada 00C melepaskan energi lebih 100.000
kalori per mol. Hal ini terjadi karena adsorpsi O2 pada karbon juga melibatkan
khemisorspi yang ditunjukkan dengan terbentuknya gas CO dan CO2jika karbon
dipanaskan. Pada karbon yang mengadsorpsi N2jika dipanaskan hanya dilepaskan
gas N2.
Beberapa teori yang menerangkan gejala daya serap yang sebenarnya, belum cukup untuk mengemukakan dengan daya serap tersebut adalah sebagai berikut :
a. Dengan adanya pori-pori mikro yang sangat banyak jumlahnya pada karbon
aktif ini, akan menimbulkan gejala kapiler yang menyebabkan adanya daya serap. b. Permukaan yang luas 500 – 1000 m2/gr yang dimiliki karbon aktif dapat menyebabkan timbulnya daya serap (Sihite, 2003).
Pada kondisi yang bervariasi ternyata hanya sebagian permukaan yang mempunyai daya serap. Hal ini terjadi karena permukaan dianggap heterogen, sehingga hanya beberapa jenis zat yang diserap oleh sebagian permukaan yang lebih aktif yang disebut “active center”.
2.4.2 Isoterm Adsorpsi
tipe isoterm Freunlich dan Lengmuir (Atkins, 1999). Adsorben yang baik memiliki kapasitas adsorpsi dan persentasi penyerapan yang tinggi.
Kapasitas adsorpsi dapat dihitung dengan menggunakan rumus:
Q = x V
Sedangkan persentasi adsorpsi (efisiensi adsorpsi) dan dihitung dengan menggunakan rumus:
%E = x 100%
Keterangan:
Q = kapasitas adsorpsi per bobot molekul (mg/g) C1 = konsentrasi awal larutan (mg/L)
C2 = konsentrasi akhir larutan (mg/L)
M = massa adsorben (g)
V = volume larutan (mL)
%E = efisiensi adsorpsi
2.4.3 Isoterm Freunlich
Isoterm Freunlich merupakan isoterm yang paling umum digunakan dan dapat mencirikan proses adsorpsi dengan lebih baik (Jason,2004). Isoterm Freunlich menggambarkan hubungan antara sejumlah komponen yang teradsorpsi per unit adsorben dan konsentrasi komponen tersebut padakesetimbangan. Freunlich memformulasikan persamaan isotermnya sebagai berikut:
= ⁄
Apabila dilogaritmakan, persamaan akan menjadi:
=log + log
Keterangan:
x/m = jumlah adsorbat teradsorbsi perunit massa adsorben (mg/g) c = konsentrasi kesetimbangan adsorbat dalam larutan setelah
diadsorbsi
Isoterm Freunlich mengganggap bahwa pada semua sisi permukaan adsorben akan terjadi proses adsorpsi dibawah kondisi yang diberikan. Isoterm Freunlich tidak mampu memperkirakan adanya sisi-sisi pada permukaan yang mampu mencegah adsorpsi pada saat kesetimbangan tercapai dan hanya ada beberapa sisi aktif saja yang mampu mengadsorpsi molekul terlarut (Jason,2004).
sumber: Ade Apriliani,2010
Gambar 1. Kurva Isoterm Freunlich
2.4.4 Isoterm Langmuir
Tipe Isoterm Lengmuir merupakan proses adsorpsi yang berlangsung secara kimisorpi satu lapisan. Kimisorpsi adalah adsorpsi yang terjadi melalui ikatan kimia yang sangat kuat antara sisi aktif permukaan dengan molekul adsorbat dan dipengaruhi oleh densitas elektron. Adsorpsi satu lapisan terjadi karena ikatan kimia biasanya bersifat spesifik sehingga permukaan adsorben mampu mengikat adsorbat dengan ikatan kimia. Isoterm Lengmuir diturunkan
berdasarkan teori dengan persamaan:
=
Isoterm Lengmuir dipelajari untuk menggambarkan pembatasan sisi adsorpsi dengan asumsi bahwa sejumlah tertentu sisi sentuh adsoeben ada pada permukaannya dan semua memiliki energi yang sama, sertaadsorpsi bersifat balik
(Atkins, 1999). Konstanta α dan β dapat ditemukan dari kurva hubungan
/
/ = +
sumber:Ade Apriliani, 2010
Gambar 2. Kurva Isoterm Lengmuir
2.4.5 IsotermBrunauer, Emmet and Teller(BET)
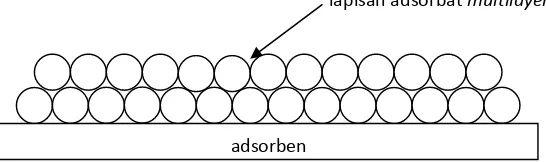
Teori isoterm adsorpsi BET merupakan hasil kerja dari S. Brunauer, P.H. Emmet, dan E. Teller. Teori ini menganggap bahwa adsorpsi juga dapat terjadi di atas lapisan adsorbat monolayer. Sehingga, isoterm adsorpsi BET dapat diaplikasikan untuk adsorpsi multilayer. Keseluruhan proses adsorpsi dapat digambarkan sebagai
a. Penempelan molekul pada permukaan padatan (adsorben) membentuk lapisanmonolayer
b. Penempelan molekul pada lapisan monolayer membentuk lapisan
multilayer
Gambar 3 . Pendekatan isoterm adsorpsi BET
Pada pendekatan ini, perbandingan kekuatan ikatan pada permukaan adsorben dan pada lapisan adsorbat monolayer didefinisikan sebagai konstanta c.
lapisan adsorbatmultilayer
Lapisan adsorbat akan terbentuk sampai tekanan uapnya mendekati tekanan uap dari gas yang teradsorpsi. Pada tahap ini, permukaan dapat dikatakan ”basah
(wet)”. Bila V menyatakan volume gas teradsorpsi, Vm menyatakan volume gas
yang diperlukan untuk membentuk lapisan monolayer, dan x adalah P/P*, maka isoterm adsorpsi BET dapat dinyatakan sebagai
) 1
)( 1
( x x cx
cx V
V
m − − +
=
Kesetimbangan antara fasa gas dan senyawa yang teradsorpsi dapat dibandingkan dengan kesetimbangan antara fasa gas dan cairan dari suatu senyawa. Dengan menggunakan analogi persamaan Clausius–Clapeyron, maka
( )
2 ln
RT H dT
P
d =−∆ ads
dimana ΔHads adalah entalpi adsorpsi. Sehingga dapat ditarik kesimpulan bahwa
tekanan kesetimbangan dari gas teradsorpsi bergantung pada permukaan dan