117 PENGARUH GEOMETRIK SELUBUNG, TEGANGAN DAN KEDALAMAN ANODA PADA
PROSES PRODUKSI GAS KLOR MENGGUNAKAN METODE ELEKTROLISIS PLASMA Nelson Saksono1, Dimas Riska Irawan, Setijo Bismo
1Departemen Teknik Kimia, Fakultas Teknik, Universitas Indonesia, Kampus UI Depok Kampus Baru UI- Depok 16424, Telp/Fax: (021)7863516
*Email : nelson@che.ui.ac.id
Abstrak
Industri klor-alkali merupakan salah satu industri penting yang menghasilkan gas klor dan soda api dari bahan baku NaCl dan air. Penelitian ini telah berhasil melakukan pengujian pengaruh geometrik selubung, Konsentrasi NaCl, tegangan, dan kedalaman anoda pada proses produksi gas klor dengan metode elektrolisis plasma. Konsumsi energi terendah didapat pada selubung panjang sebesar 27,98 kJ.mmol. Produksi gas klor tertinggi dan konsumsi energi terendah masing-masing sebesar 26,22 mmol dan 27,06 kJ/mmol yang dicapai pada tegangan 700V, 1 M NaCl dan kedalaman anoda sebesar 1 cm menggunakan selubung panjang. Sementara pada konsentrasi 0,5M NaCl, produksi gas klor tertinggi sebesar 21,09 mmol dan konsumsi energinya sebesar 28 kJ/mmol pada kedalaman anoda 2 cm. Produksi gas klor dengan proses elektrolisis plasma mencapai hingga 2,77 kali lebih tinggi dibandingkan dengan perhitungan elektrolisis Faraday dan 16,59 kali lebih tinggi dibanding proses elektrolisis pada tingkat konsumsi energi yang sama.
Kata Kunci:Chlor-Alkali, Elektrolisis Plasma, Konsumsi Energi Abstract
Chlorine-alkali industry is one of the most important industries for production of chlorine and caustic soda from NaCl and water. This research has succeeded to investigate the effect of veil geometric, NaCl concentration, voltage, and the depth of anode in the process of chlorine production by using plasma electrolysis method. The lowest energy consumption is obtained for the long veil at 27,98 kJ.mmol. The highest chlorine production and the lowest energy consumption is 26,22 mmol and 27,06 kJ/mmol, respectively, which were achieved at the voltage of 700 V, 1 M NaCl, and 1 cm depth of anode by using the long veil. With 0,5 M NaCl, the highest chlorine production is 21,09 mmol, and the highest energy consumption is 28 kJ/mmol with the depth of anode at 2 cm. Chlorine production with the process of plasma electrolysis is 2,77 times higher than the one obtained with the calculation of Faraday electrolysis. It is 16,59 times higher than electrolysis process at the same rate of energy consumption.
Keywords:Chlor-Alkali, Plasma Electrolysis, Energy Consumption
1. Pendahuluan
Sektor industri klor-alkali merupakan salah satu sektor industri penting dalam industri kimia yang menghasilkan produk-produk seperti klor, hidrogen, soda api (caustic soda, NaOH), hipoklorit, serta turunan klor lainnya dari bahan baku NaCl dan air (Abdel Al, 2010; Bommaraju., 2011). Namun sektor produksi klor-alkali memiliki suatu permasalahan besar, yaitu merupakan pengguna listrik terbanyak yang tidak dapat
tergantikan dan merepresentasikan 70% dari harga penjualan (Santorelli, 2009). Salah satu teknologi yang dapat diterapkan untuk mengurangi konsumsi energi produksi klor-alkali adalah dengan menggunakan teknologi elektrolisis plasma (Saksono, 2010). Teknologi ini terbukti mampu meningkatkan efektivitas produksi klor-alkali serta mampu mengurangi konsumsi energi dibandingkan metode elektrolisis (Saksono, 2013).
118 Produksi klor-alkali dengan
menggunakan metode elektrolisis plasma telah berhasil dilakukan dengan menggunakan reaktor kompartemen tunggal dan ganda (Saksono, 2013). Pada penelitian tersebut diperoleh hasil bahwa produksi gas klor mencapai dua kali lebih banyak dibandingkan dengan reaktor tunggal. Selain itu, semakin dalam anoda menyebabkan produksi gas klor semakin banyak karena mempengaruhi banyaknya selubung uap yang terbentuk dipermukaan anoda. Semakin luas area anoda yang terselubungi, semakin besar plasma yang terbentuk (Jin, 2010). Hal ini meningkatkan jumlah radikal yang terbentuk, sehingga produksi gas klor akan bertambah banyak (Saksono, 2013).
Pada penelitian ini telah berhasil diteliti lebih jauh mengenai pengaruh geometrik penggunaan selubung yang mengelilingi anoda dan peningkatan suhu larutan terhadap pembentukan gas klor. Anoda yang dikelilingi oleh selubung membuat proses pembentukan plasma menjadi lebih cepat karena efek pemanasan Joule yang dibutuhkan untuk membentuk plasma semakin efektif dan plasma yang dihasilkan menjadi lebih stabil,
sehingga produk gas klor yang dihasilkan semakin banyak (Abqari, 2013). Adapun proses elektrolisis akan lebih efisien seiring dengan bertambahnya suhu (Nikolic, 2010). Selain itu, konduktivitas ion dan reaksi permukaan elektrolit akan meningkat secara signifikan dengan kenaikan suhu (Udagawa, 2007). Semakin besar konduktivitas larutan maka radikal yang terbentuk pun semakin besar, sehingga produk yang dihasilkan akan lebih baik (Gao, 2008). Penelitian ini juga telah berhasil menguji kinerja proses elektrolisis plasma pada tegangan dan konsentrasi larutan yang lebih tinggi dari penelitian sebelumnya (Saksono, 2013). Hal ini dilakukan karena tegangan dan konsentrasi yang tinggi diduga dapat meningkatkan produksi gas klor dan menekan konsumsi energi pada proses elektrolisis plasma.
2. Percobaan
Desain reaktor pada Gambar 1 terdiri atas dua kompartemen dengan stainless steel sebagai katoda yang juga berfungsi sebagai pendingin larutan dan grafit sebagai anoda.
1. Reaktor 2. Anoda (Grafit)
3. Katoda (Stainless Steel) 4. Pompa Peristaltik 5. Air Distilat (Katolit)
6. Larutan NaCl (Anolit) 7. Bubbler Larutan KI 8. Hidrogen Analyzer 9. Termometer Anolit 10.Ampermeter 11. Dioda Bridge 12. Transformer 13. Slide regulator 14. Termometer Anolit 15. katup pembuangan
Gambar 1. Konfigurasi Alat Elektrolisis Plasma produksi klor dengan kompartemen ganda Permukaan katoda yang tercelup dalam
larutan harus lebih luas daripada anoda agar plasma dapat terbentuk di anoda (Sengupta, 1994). Reaktor dengan sistem semi-batch ini terbuat dari housing filter akrilik yang dihubungkan dengan water murr dengan jarak 5 cm. Pada kompartemen sisi anoda diberikan lubang untuk sirkulasi internal.
Sumber listrik dihubungkan dengan slide
regulator 3-kVA dan bagian keluarannya
dihubungkan ke transformer step up.
Jembatan diode digunakan untuk mengubah arus AC ke DC. Arus listrik yang terbentuk diukur dengan amperemeter Yuhua A830L. Hasil yang diperoleh akan dibandingkan konsumsi energi dan produksi gas klor nya
119 pada konsentrasi 0,5M – 1M dengan tegangan
200V – 900V. Senyawa yang keluar dari kompartemen anoda berupa gas klor dan uap air melainkan ada sejumlah kondensat dari hasil reaksi antara gas klor dengan uap air yang keluar bersamaan dengan gas klor. Kondensat ini kemudian diukur volume dan nilai pH-nya dengan menggunakan pH meter. Gas klor yang keluar dari kondenser diukur laju alir volumnya dengan flowmeter buble soap, sementara konsentrasinya diukur dengan metode Titrasi Iodometri dimana gas Klor di kontakkan dengan larutan KI 2% volume. KI yang berikatan dengan gas klor
berubah warna menjadi oranye kekuningan lalu larutan dititrasi dengan Na2S2O3 0,01 M. 3. Hasil dan Pembahasan
3.1 Pengaruh Penggunaan Selubung pada Anoda
Selubung merupakan suatu media yang dipasang mengelilingi anoda untuk membuat proses pembentukan selubung gas akibat efek pemanasan Joule di sekitar anoda menjadi lebih intensif. Gambar 1 menunjukkan penampakan berbagai jenis selubung yang digunakan dalam penelitian ini sementaraTabel 1 memberikan dimensi geometrik dari selubung yang digunakan .
Gambar 1. Selubung pendek (1), Selubung panjang (2) dan selubung besar (3) dimana: A. Dilihat dari samping dan B dilihat dari sisi bawah
Tabel 1. Dimensi geometrik Selubung Anoda yang Digunakan dalam Penelitian No. Penggunaan Selubung L (cm) D (cm) Skema Selubung
1. Tanpa Selubung 0 0
2. Panjang 15 3
3. Pendek 10 3
4. Besar 15 5
Tabel 2 menunjukkan semakin panjang dan semakin besar diameter selubung yang digunakan, semakin banyak gas klor yang diproduksi, sedangkan energi yang dikonsumsi cenderung menurun kecuali pada selubung besar.
Saat penelitian dilakukan tanpa menggunakan selubung, kondisi plasma sulit terbentuk, tidak stabil, dan membutuhkan waktu yang lama, sehingga produksi gas klor hanya mencapai 6,96 mmol dengan konsumsi energi sebesar 95,88 kJ/mmol. Hal ini
disebabkan oleh tidak intensifnya efek pemanasan Joule disekitar anoda karena zona larutan yang dipanasi sangat luas, sehingga kondisi plasma menjadi sulit terbentuk dengan rata-rata arus listrik sebesar 1,06A. ketika digunakan selubung pendek, walaupun pembentukan plasma menjadi lebih mudah dan produksi gas klor meningkat menjadi 7,23 mmol, akan tetapi plasma masih belum stabil, sehingga penurunan konsumsi energi tidak terlalu signifikan, yaitu sebesar 73,44 kJ/mmol.
Tabel 2. Konsumsi energi pada berbagai geometrik selubung anoda untuk 0,5 M NaCl dan 700 V pada kedalaman anoda 1 cm
Selubung Anoda*
Produksi Gas Klor (mmol) Arus Rata-Rata (A) Daya Listrik (kJ) Konsumsi Energi (kJ/mmol) Tanpa 6,96 1,06 667,33 95,88 Pendek 7,23 0,84 530,99 73,44 Panjang 10,74 0,48 300,54 27,98 Besar 11,19 1,28 803,59 71,81
120 Pada selubung panjang, plasma menjadi
lebih mudah terbentuk, tidak membutuhkan waktu yang lama, dan relatif stabil, sehingga produksi gas klor semakin meningkat menjadi 10,74 mmol dan konsumsi energi turun secara signifikan menjadi 27,98 kJ/mmol dengan rata-rata arus listrik sebesar 0,48A. Adapun ketika selubung besar digunakan, produksi gas klor memang meningkat menjadi 11,19 mmol namun kondisi plasma lebih lama tercapai dan plasma yang terbentuk kurang stabil karena zona larutan yang harus dipanasi menjadi lebih besar. Hal ini dapat dilihat pada meningkatnya konsumsi energi menjadi 71,81 kJ/mmol.
Saat selubung kaca mengelilingi anoda, efek pemanasan Joule yang terjadi disekeliling anoda menjadi semakin intensif. Hal ini menyebabkan selubung gas di anoda semakin mudah terbentuk dan semakin memicu tumbukan antara gelembung gas dengan muatan listrik. Selain itu, hamburan energi yang terjadi menjadi semakin besar dan memicu terbentuknya plasma (Sengupta, 1997). Pada penelitian dengan menggunakan selubung panjang, plasma yang terbentuk menjadi lebih mudah dan stabil. Hal ini dikarenakan semakin panjang selubung yang digunakan semakin efektif dalam mencegah panas yang keluar dari selubung, sehingga plasma yang terbentuk menjadi lebih stabil. Kestabilan plasma inilah yang membuat produksi gas klor semakin meningkat. Selain itu, pembentukan selubung gas yang semakin besar ini membuat arus menjadi menurun karena gas memiliki konduktivitas yang rendah (hambatannya tinggi), sehingga arus listrik menurun (Sengupta, 1997).
3.2 Pengaruh Tegangan dan kedalaman anoda terhadap Produksi Gas Klor
Tegangan dan kedalaman anoda adalah parameter penting yang mempengaruhi produksi gas klor dan konsumsi energi proses. Gambar 2 menunjukkan skema posisi anoda terhadap permukaan larutan dalam reaktor elektrolisis plasma. Pada kedalaman 0 cm, maka ujung anoda hanya menyentuh permukaan larutan NaCl
Gambar 2 menunjukkan sebuah pola dimana produksi gas klor paling tinggi dicapai pada tegangan 700V untuk semua kedalaman anoda. Produksi klor tertinggi pada konsentrasi 0,5 M NaCl adalah sebesar 21,09 mmol yang dicapai pada tegangan 700 V cm dan kedalaman anoda 2 cm. Meningkatnya kedalaman anoda menyebabkan ukuran plasma menjadi lebih besar sehingga akan semakin banyak spesies radikal Cl yang dapat terbentuk dilarutan sehingga pada akhirnya dapat meningkatkan produksi gas klor.
Tabel 3 menunjukkan konsumsi energi terendah sebesar 28 kj/mmol didapat pada kedalaman anoda sebesar 0 cm, sementara konsumsi energi tertinggi sebesar 42 kJ/mmol terjadi pada kedalaman anoda 1 cm. Secara umum energi listrik yang dibutuhkan akan semakin besar dengan semakin dalamnya anoda tercelup. Peningkatan produksi klor dari 0 cm menjadi 1 cm hanya 20 %, sementara peningkatan produksi klor pada kedalaman 2 cm mencapai 100 % (Tabel 3). Itu sebabnya mengapa konsumsi energi pada kedalam anoda 1 cm adalah yang tertinggi.
Tabel 3. Produksi gas Klor dan Konsumsi energi pada berbagai kedalaman anoda dengan Larutan NaCl 0,5M Menggunakan Selubung Panjang dan tegangan 700 V
No . Kedalaman Anoda (cm) Produksi gas Klor (mmol) Konsumsi Energi (kJ/mmol) 1. 0 10,74 28 2. 1 12,84 42 3. 2 21,09 33
Menurunnya produk gas klor pada tegangan diatas 700 V berbeda dengan hasil yang didapatkan oleh Gao (2008) untuk proses produksi gas hidrogen dengan metode elektrolisis plasma. Gao menyatakan bahwa semakin tinggi tegangan listrik yang digunakan untuk menghasilkan plasma, konsentrasi radikal aktif yang terbentuk akan
semakin tinggi pula. Hal ini dikarenakan dengan perbedaan tegangan yang tinggi, energi pengeksitasi elektron untuk menghasilkan radikal juga semakin tinggi. Akibatnya semakin tinggi tegangan listrik yang digunakan, pembentukan radikalnya pun juga semakin besar, sehingga produksi produk utamanya semakin meningkat seiring
121 dengan kenaikan tegangan. Namun pada
produksi gas klor dengan elektrolisis plasma, terjadi fluktuasi arus listrik yang menyebabkan pancaran plasma menjadi terputus-putus, sehingga diduga zona plasma menjadi tidak stabil dan kembali menjadi zona elektrolisis. Pada zona elektrolisis gas klor yang terbentuk hanya berdasarkan reaksi ion-ion Cl- yang bergabung menjadi gas Cl2, sedangkan pada elektrolisis plasma, mekanisme pembentukan gas klor tidak hanya melalui ion-ion Cl- melainkan juga dapat terbentuk melalui radikal-radikal OH maupun radikal-radikal Cl yang ada dalam larutan (Jin dkk., 2010). Mekanisme pembentukan gas klor pada elektrolisis plasma dapat dijelaskan melalui reaksi berikut ini: Cl- Cl● + e* ●OH + Cl- Cl● + OH -Cl● + -Cl● Cl2 Cl2 + H2O HCl + HClO 2HClO + H2O2 2Cl- + O2 + 2H+
Penelitian yang dilakukan oleh Jin dkk. (2010) menunjukkan bahwa pada larutan NaCl, Cl- dapat dirubah menjadi radikal klor. Dua radikal klor akan bereaksi satu sama lain membentuk molekul Cl2. Selain Cl2, HClO juga terbentuk dalam reaksi yang mengonsumsi H2O2 di dalam anolit, sehingga konsentrasi H2O2 dalam larutan NaCl menjadi lebih rendah dibandingkan dengan larutan lainnya. Adapun berdasarkan analisis di atas, produksi gas klor tertinggi pada tegangan 700V. Ketika tegangan dinaikkan menjadi 800V dan 900V, kondisi plasma menjadi tidak stabil. Ketidak stabilan ini menyebabkan pembentukan radikal-radikal klor menjadi terganggu, sehingga menyebabkan produksi gas klor menjadi berkurang. Selain itu, plasma yang
terbentuk pada tegangan 600V belum mencapai kondisi yang optimal, sedangkan plasma yang terbentuk pada tegangan 700V jauh lebih stabil dengan pancaran plasma tidak terputus-putus. Adapun pada tegangan 800V dan 900V, walaupun plasma terbentuk akan tetapi pembentukannya semakin tidak stabil yang ditandai dengan pancaran plasma yang semakin terputus-putus. Hal ini diduga merupakan suatu karakteristik tersendiri yang terjadi pada pembentukan gas klor dengan metode elektrolisis plasma, khususnya pada konsentrasi 0,5M dengan tegangan di atas 700V karena pada produksi hidrogen dengan elektrolisis plasma, jumlah hidrogen yang dihasilkan berbanding lurus dengan tegangan yang digunakan (Yan, 2008). Oleh karena itu, perlu dilakukan penelitian lebih lanjut untuk menjelaskan fenomena ini. 4. Perbandingan Produksi Gas Klor dan Konsumsi Energi antara Elektrolisis Plasma dengan ElektrolisisFaraday
Tabel 4 menunjukkan produksi gas klor selama 15 menit yang diukur dengan menggunakan tiga metode elektrolisis yang berbeda, yaitu: elektrolisis plasma pada 700V, elektrolisis pada 200V, dan elektrolisis Faraday. Metode elektrolisis dilakukan dengan konfigurasi reaktor yang sama dengan elektrolisis plasma, hanya saja tegangannya diturunkan menjadi 200V dimana plasma belum terbentuk. Adapun elektrolisis Faraday merupakan metode perhitungan kandungan gas klor secara teoritis dengan menggunakan persamaan sebagai berikut (Yan, 2009): dimana Q, F, dan adalah muatan elektrik (coulomb), konstanta Faraday, dan volum produk hidrogen. Dengan mengganti dengan yang diperoleh dari hasil titrasi iodometri pada elektrolisis 200V.
Tabel 4. Produksi Gas Klor pada Larutan NaCl 0,5M-1M Kedalaman Anoda 1 cm Selama 15 menit
Konsentrasi (M)
Produksi Gas Klor 15 Menit (mmol) Elektrolisis (200V) Elektrolisis Plasma (700V) Elektrolisis Faraday 0.5 0.45 12.84 2.69 0.75 1.29 19.47 6.74 1 2.1 26.22 8.85
Produksi gas klor dengan metode elektrolisis pada konsentrasi 1M mencapai 5 kali lebih besar daripada konsentrasi 0,5M.
Sementara kenaikan produksi gas klor pada konsentrasi 1M dengan elektrolisis plasma hanya sekitar 2 kali lipat dari konsentrasi
122 0,5M. Begitu pula dengan kenaikan produksi
gas klor pada konsentrasi 1M hanya sekitar 3 kali lipat dari konsentrasi 0,5M dengan elektrolisis Faraday. Hal inilah yang menyebabkan mengapa semakin tinggi konsentrasi larutan, konsumsi energi dan rasio G pada Tabel 5 dan Tabel 6 semakin menurun.
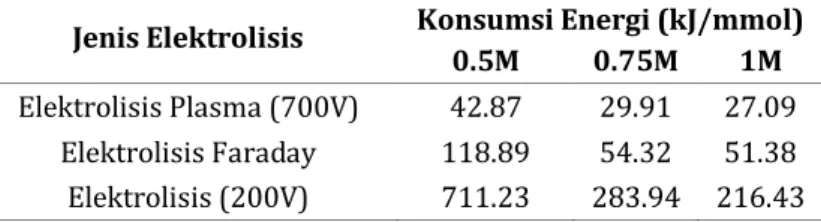
Konsumsi energi merupakan hal utama yang menjadi sorotan dalam industri klor-alkali karena penggunaan listriknya merepresentasikan 70% dari harga penjualan (Santorelli dkk, 2009). Satuan konsumsi energi yang digunakan adalah kJ/mmol. Tabel 5 menunjukkan data bahwa energi terendah yang dikonsumsi untuk menghasilkan 1 mmol gas klor dicapai dengan menggunakan elektrolisis plasma. Apabila menggunakan
metode elektrolisis, energi yang dikonsumsi mencapai 711,23 kJ/mmol Cl2 pada konsentrasi 0,5M. Adapun energi yang dikonsumsi pada konsentrasi 0,75M dan 1M dengan metode elektrolisis juga masih tetap tinggi di atas 200 kJ/mmol Cl2. Kemudian jika menggunakan perhitungan elektrolisis Faraday, diperoleh hasil konsumsi energi yang masih lebih besar daripada energi yang dikonsumsi dengan metode elektrolisis plasma. Hasil ini semakin menunjukkan bahwa produksi gas klor dengan menggunakan elektrolisis plasma tidak hanya dapat meningkatkan produksi gas klor tetapi juga dapat menekan jumlah energi yang dikonsumsi, sehingga prosesnya menjadi lebih efisien.
Tabel 5. Konsumsi Energi dengan Metode Elektrolisis yang Berbeda pada Larutan NaCl 0,5M-1M Kedalaman Anoda 1 cm Selama 15 menit
Jenis Elektrolisis Konsumsi Energi (kJ/mmol)
0.5M 0.75M 1M
Elektrolisis Plasma (700V) 42.87 29.91 27.09 Elektrolisis Faraday 118.89 54.32 51.38 Elektrolisis (200V) 711.23 283.94 216.43 Perhitungan konsumsi energi ini ini
didasarkan pada persamaan berikut (Yan dkk, 2006):
dengan V, Q, dan n adalah tegangan, muatan listrik, dan jumlah mol hidrogen. Namun dalam konteks ini diganti dengan mmol gas Cl2 yang terukur berdasarkan titrasi iodometri.
Selanjutnya dapat ditentukan rasio perbandingan jumlah mol yang dihasilkan dari elektrolisis plasma dengan elektrolisis dan dari elektrolisis plasma dengan elektrolisis Faraday dari energi yang
dikonsumsi pada Tabel 5. Hasil yang diperoleh pada Tabel 6 menunjukkan bahwa produksi gas klor dengan proses elektrolisis plasma pada larutan 0,5M menghasilkan gas klor 16,59 kali lebih banyak daripada proses elektrolisis, sedangkan pada konsentrasi 0,75M dan 1M perbandingannya mencapai 9,49 dan 7,99 kali lebih besar dibandingkan proses elektrolisis. Kemudian jika dibandingkan dengan perhitungan elektrolisis Faraday, produksi gas klor dapat meningkat hingga 2,77 kali lebih besar pada 0,5M.
Tabel 6. Rasio Perbandingan Produksi Gas Klor pada Larutan NaCl 0,5M-1M Kedalaman Anoda 1 cm Selama 15 menit
G (mol/mol) Konsentrasi (M)
0.5 0.75 1
Elektrolisis Plasma/Elektrolisis 16.59 9.49 7.99
Elektrolisis Plasma/Elektrolisis Faraday 2.77 1.82 1.9 Menurunnya nilai rasio G dengan
meningkatnya konsentrasi larutan seperti yang ditunjukkan pada Tabel 6 disebabkan adanya peningkatan produksi gas klor yang
signifikan dengan meningkatnya konsentrasi larutan pada proses elektrolisis (Tabel 4). Secara Teoritis, jumlah gas klor yang didapat dari perhitungan Elektrolisis Faraday adalah
123 jumlah maksimum yang dapat dicapai dari
proses elektrolisis (efisiensi proses 100 %). Tabel 6 menunjukkan metode Elektrolisi Plasma mampu mencapai produksi gas klor hingga 277 % lebih besar dibanding perhitungan elektrolisis Faraday. Hal ini menunjukkan bahwa memang terjadi mekanisme pembentukan gas klor yang berbeda, dimana untuk proses elektrolisis mengikuti mekanisme reaksi redoks, sedangngkan untuk Elektrolisis plasma, selain mekanisme redoks juga melalui mekanisme pembentukan radikal klor yang dapat meingkatkan produksi gas klor (Jin, 2010). 5. Kesimpulan
Penelitian ini telah berhasil melakukan pengujian berbagai variabel utama pada proses produksi gas klor dengan metode elektrolisis plasma meliputi pengaruh geometrik penggunaan selubung, peningkatan suhu larutan, konsentrasi larutan, dan tegangan listrik. Stabilitas plasma dan banyaknya kondensat yang terbentuk sangat berpengaruh pada jumlah gas klor yang dihasilkan. Pada tegangan di atas 700V dengan konsentrasi NaCl 0,5M, terjadi ketidakstabilan plasma yang berdampak pada penurunan produksi gas klor. Untuk jumlah energi yang sama, rasio G dapat mencapai hingga 2,77 kali lebih tinggi dibandingkan dengan elektrolisis Faraday pada konsentrasi NaCl 0,5M dan tegangan 700V.
Acknowledgement / Ucapan Terima kasih Penelitian ini didanaioleh Direktorat Jendral Pendidikan Tinggi Kementrian Pendidikan Republik Indonesia dan Direktorat Penelitian dan Layanan Publik Universitas Indonesia (DRPM UI) melalui pendanaan RUUI PUPTN 2014.
Daftar Pustaka
Abdel-Aal, H. K., Zohdy, K. M. & Kareem, M. A. (2010). Hydrogen Production Using Sea Water Electrolysis. the Open Fuel Cells Journal, 3, 1-7.
Abqari, F. (2012). Aplikasi Teknologi Elektrolisis Plasma pada Proses Produksi Klor-Alkali. Sarjana, Universitas Indonesia.
Bommaraju, T., Orosz, P. J., and Sokol, E. A. (2007). Brine Electrolysis. Available:
http://electrochem.cwru.edu/encycl [Accessed 23rd February 2014].
Gao, J. Z., Wang, A. X., Fu, Y., Wu, J. L., Ma, D. P., Guo, X., Li, Y. and Yang, W. (2008). Analysis of Energetic Species Caused by Contact Glow Discharge Electrolysis in Aqueous Solution.Plasma Science and Technology, Vol. 10, No. 1, Feb. 2008. Jin, X. L., Wang, X. Y., Zhang, H. M., Xia, Q., Wei,
D. B. & Yue, J. J. (2010). Influence of Solution Conductivity on Contact Glow Discharge Electrolysis. Plasma Chem Plasma Process, 30, 429 – 436.
Nikolic V.M., Tasic G.S. dkk. (2010). International Journal Hydrogen Energy. Vol. In Press, Corrected Proof.
Saksono, N., Ariawan, B. & Bismo, S. (2010). Hydrogen Productions System Using Non-Thermal Plasma Electrolysis In Glycerol-KOH Solution. S1, Universitas Indonesia. Saksono, N., Abqari, F., Bismo,S.&
Kartohardjono S. (2013). Effect of Process Condition in Plasma Electrolysis of Chloralkali Production.International Journal of Chemical Engineering and Applications. Vol 4 No.5
Santorelli, R. & Schervan, A. (2009). Energy Production From Hydrogen Co-Generated In Chlor-Alkali Plants By The Means Of Pem Fuel Cells Systems. Nuvera Fuel Cells
Europe, Via XXV Aprile 2, 2009.
Sengupta, S. K. & Singh, O. P. (1994). Contact glow discharge electrolysis: a study of its chemical yields in aqueous inert-type electrolytes. Journal of Electroanalytical
Chemistry, 369, 113-120.
Udagawa J., Aguiar P. & Brandon N.P. (2007). Journal Power Sources. 166, 127.
Yan, Z. C., Li, C. & Lin, W. H. (2006). Experimental Study of Plasma Under-liquid Electrolysis in Hydrogen Generation. The Chinese Journal of Process
Engineering, Vol.6 No.3.
Yan, Z. C., Li, C. and Lin, W. H. (2008). Hydrogen generation by glow discharge plasma electrolysis of ethanol solutions. Journal of Physics D: Applied Physics, 41 155205 (7pp).
Yan, Z. C., Li, C. and Lin, W. H. (2009). Hydrogen generation by glow discharge plasma electrolysis of methanol solutions. International Journal of Hydrogen Energy, 34, 48 - 55.