DESY KURNIAWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2009
PERTUMBUHAN PADA TIKUS PUTIH (Sprague Dawley) adalah karya saya sendiri dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, November 2009
Desy Kurniawati NIM G851070021
Bukittinggi as Growth Promoter in Rattus norvegicus Strain Sprague Dawley. Under direction of I MADE ARTIKA, BUDI HARYANTO, and A. E. ZAINAL HASAN.
The use of antibiotics as growth promoters has been banned in many countries because of the emergence of antibiotic resistancies in human commonly pathogenic bacteria. The aim of this research is to analyze antibacterial potency of Propolis Trigona spp to increase weight of Sprague Dawley and decrease population of Escherichia coli (E coli). Propolis was extracted by repeated maceration of hives of Trigona spp with ethanol, and the solvent was eliminated by freeze drying. Three types propolis were used to analyze antibacterial potency, raw propolis, 2% microcapsul propolis (M2%) and 4% microcapsul propolis(M4%). The results showed that propolis increases body as weight of Sprague Dawley (raw propolis 15.3% , M2% 9.34% and M4% 2.12%) and decrease population of E coli (raw propolis 5.48 CFU/g, M2% 2.79 CFU/g and M4% 6.22 CFU/g). Raw propolis and M2% have potential as growth promoters and antibacterial. Propolis from Trigona spp shows potency to be used as growth promoter and antibacterial agent.
oleh I MADE ARTIKA, BUDI HARYANTO, dan A. E. ZAINAL HASAN. Bakteri merupakan organisme yang sangat adaptif karena regenerasinya memerlukan waktu yang singkat dan mempunyai kecenderungan melakukan pertukaran informasi genetika. Bakteri yang resistensi akibat penggunaan antibiotika menimbulkan masalah yang baru, karena bakteri ini tahan terhadap antibiotika yang telah dipakai tersebut. Resistensi bakteri ini sulit untuk ditangani Sejumlah upaya telah dilakukan untuk mengembangkan alternatif yang sesuai untuk mengatasi dampak yang merugikan dengan pelarangan penggunaan antibiotik pemacu pertumbuhan. Substansi lain, dikenal dengan natural growth promoter, telah diidentifikasikan mempunyai khasiat dan aman untuk menggantikan fungsi antibiotik pemacu pertumbuhan ternak
Propolis merupakan bahan alamiah yang dihasilkan oleh lebah dan telah dibuktikan mempunyai banyak manfaat terutama dalam bidang kesehatan dan saat ini digunakan secara luas sebagai obat berbagai penyakit. Propolis merupakan getah yang dikumpulkan oleh lebah dari berbagai pucuk tanaman dan dari tanaman yang patah dimana getah tanaman tersebut kemudian dicampur dengan enzim yang terdapat dalam kelenjar ludah lebah dan digunakan untuk melindungi sarang dari berbagai bakteri, virus dan jamur.
Penelitian yang dilakukan oleh Hasan (2006) menunjukkan bahwa propolis hasil ekstrak etanol 70% dapat digunakan sebagai senyawa anti bakteri baik bakteri Gram positif maupun bakteri Gram negatif. Penelitian lain menunjukkan bahwa propolis sangat efektif melawan mikroorganisme yang telah resisten terhadap antibiotika lain. Beberapa bentuk sediaan propolis memiliki potensi sebagai anti bakteri. Mikrokapsulasi merupakan suatu metode penyalutan langsung zat aktif dengan suatu bahan penyalut. Zat aktif disebut inti atau isi, sedangkan penyalut disebut dinding atau kulit. Pada penelitian ini digunakan beberapa bentuk sediaan propolis sebagai alternatif pemacu pertumbuhan dan antibakteri.
Penelitian ini bertujuan untuk mengetahui pengaruh pemberian propolis Trigona spp asal bukit tinggi terhadap peningkatan bobot badan tikus Sprague Dawley dan terhadap penurunan jumlah bakteri E. coli di usus tikus Sprague Dawley. Manfaat penelitian ini adalah memberikan informasi mengenai propolis Trigona spp asal BukitTinggi Sumatera Barat sebagai bahan pemacu pertumbuhan alami dan sebagai senyawa anti bakteri. Hipotesis yang diajukan pada penelitian ini adalah bentuk sediaan Propolis Trigona spp asal Bukittinggi Sumatera Barat dapat meningkatkan pertumbuhan bobot badan tikus dan menurunkan jumlah bakteri E coli di usus tikus Sprague Dawley sehingga berpotensi untuk digunakan sebagai senyawa anti bakteri dan bahan pemacu pertumbuhan alami.
(konsentrasi 2% dan 4%), bahan penyalut maltodekstrin dan magnesium stearat. Persentase pertumbuhan perlakuan : standar 4,93%, Kontrol positif 26% , raw 15.3% , mikrokapsul propolis 2% 9.34% dan mikrokapsul propolis 4% 2.12%. Bobot badan tikus yang mengalami peningkatan, didukung pula dengan adanya peningkatan konsumsi pakan. Pada mikrokapsul propolis 2% terjadi hal yang berbeda, konsumsi pakan mengalami penurunan akan tetapi pertumbuhan mengalami peningkatan. Hal ini menunjukkan adanya efisiensi konsumsi pakan. Raw Propolis dan mikrokapsul propolis 2% memiliki potensi yang lebih baik sebagai pemacu pertumbuhan dibandingkan mikrokapsul propolis 4%. Mikrokapsul propolis 2% memiliki jumlah E. coli pada feses yang lebih stabil dibandingkan kelompok lain serta jumlah E. coli di usus yang relatif kecil.
atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan, atau makalah.
b. Pengutipan tidak merugikan yang wajar di IPB.
2.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin Institut Pertanian Bogor.DESY KURNIAWATI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biokimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2009
Disetujui Komisi Pembimbing
Dr. Ir. I Made Artika, M.App.Sc. Ketua
Dr. Budi Haryanto, MSc Ir. A. E Zainal Hasan, MSi Anggota Anggota
Diketahui
Ketua Program Studi Biokimia Dekan Sekolah Pascasarjana
Prof. Dr. drh. Maria Bintang, M.S Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
panjatkanke hadirat Allah SWT atas rahmat dan hidayah-Nya yang telah dilimpahkan kepada penulis sehingga tesis ini dapat diselesaikan. Tesis ini mengambil tema mengenai Potensi antibakteri propolis Trigona spp. Bukittinggi sebagai pemacu pertumbuhan pada tikus putih (Sprague Dawley).
Penyusunan tesis bukanlah pekerjaan yang mudah. Tanpa adanya dukungan dari berbagai pihak tentu sukar bagi penulis untuk menyelesaikan tugas ini. Oleh karena itu, penulis mengucapkan terimakasih dengan tulus dan penghargaan setinggi-tingginya kepada semua pihak yang telah membantu, terutama kepada:
1. Bapak Dr. Ir. I Made Artika, M.App.Sc selaku ketua komisi pembimbing yang telah banyak memberikan motivasi, arahan, masukan dan ilmu pengetahuan selama studi hingga penyelesaian tesis ini.
2. Bapak Dr. Budi Haryanto sebagai dosen pembimbing yang telah banyak memberikan masukan dan pandangannya mengenai mikroflora saluran pencernaan serta teknik penulisan dalam tulisan ini
3. Bapak Ir. H. A. E. Zainal Hasan, M.Si sebagai dosen pembimbing yang telah banyak memberikan arahan, masukan, serta ilmu pengetahuan selama proses penelitian hingga selesainya penyusunan tesis ini.
4. Ibu Prof. Dr. drh. Maria Bintang. M.S selaku ketua program studi biokimia IPB dan Penguji luar komisi yang telah memberikan ilmu pengetahuan dan masukan untuk perbaikan penulisan tesis dan teknik penelitian penulis.
5. Segenap staf pengajar dan manajemen Program Studi Biokimia IPB
6. Keluarga, orang tua serta adik yang telah banyak memberikan dukungan moril dalam menjalani masa studi.
dan meningkatkan optimisme membangun masa depan yang lebih baik.
Bogor, November 2009
Halim dan ibu Sunarsi. Penulis merupakan putri pertama dari dua bersaudara. Tahun 2000 penulis menjadi mahasiswa strata satu Program Studi Kimia pada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Haluoleo Kendari, lulus tahun 2005. Pada tahun 2006 penulis menjadi staf pengajar di Program Studi Kimia pada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Haluoleo. Pada tahun 2007 penulis memperoleh kesempatan untuk melanjutkan pendidikan sekolah pascasarjana pada Program Studi Biokimia Institut Pertanian Bogor.
DAFTAR TABEL………... i
DAFTAR GAMBAR……….………... ii
DAFTAR LAMPIRAN………... iii
PENDAHULUAN……… ...……... 1 Latar Belakang………... 1 Tujuan Penelitian... 3 Manfaat Penelitian... 3 Hipotesis... ... 3 TINJAUAN PUSTAKA... 4 Trigona spp... 4
Sarang Lebah Madu Trigona spp... 5
Propolis... 6
Kandungan dan Manfaat Propolis... 7
Senyawa Pemercepat pertumbuhan... 9
Mikrokapsulasi... 10
Mikrokapsul... 13
Escherichia coli... 13
METODOLOGI PENELITIAN... 15
Waktu dan Tempat Penelitian... 15
Alat dan Bahan... 15
Metode Penelitian... 15
HASIL DAN PEMBAHASAN... 19
Mikrokapsulasi propolis... 19
Penanganan dan kondisi fisik hewan coba... 21
Perbandingan Potensi propolis terhadap Standar perlakuan... 27
Perbandingan Potensi propolis terhadap Ampisilin... 27
Perbandingan Potensi mikrokapsulasi propolis terhadap raw propolis... 29
Populasi Bakteri Pada feses (Escherichia coli... 30
Bakteri Pada Usus Besar (Escherichia coli)... 32
KESIMPULAN DAN SARAN... 35
Kesimpulan... 35
Saran ... 35
DAFTAR PUSTAKA... 36
DAFTAR TABEL
Halaman 1. Komponen Kimia Propolis...8 2. Kondisi Fisik Hewan Coba...22
DAFTAR GAMBAR
Halaman
1. Trigona spp... 4
2. Sarang Lebah Trigona spp... 5
3. Bakteri E. coli ………... 14
4. Hasil A. Mikrokapsul Propolis Bukittinggi 2% B. Mikrokapsul Propolis Bukittinggi 4%... 21
5. Bobot badan tikus pada masa adaptasi...…………... 22
6. Bobot badan tikus pada masa perlakuan……… ……… 23
7. Konsumsi pakan dari masa adaptasi hingga perlakuan... 25
8. Konsumsi minum dari masa adaptasi hingga masa perlakuan… 26 9. Potensi sediaan Propolis terhadap standar perlakuan... 27
10. Potensi propolis terhadap Ampisilin sebagai pemacu pertumbuhan... 28
11. Potensi mikrokapsul propolis terhadap Raw propolis ... 29
12. Jumlah sel Escherichia coli (CFU/gram) pada feses... 32
13. Jumlah sel Escherichia coli (CFU/gram) pada usus ....….……. 33
2. Diagram Alir Percobaan... 44
3. Rancangan percobaan hewan uji... 45
4. Pembuatan larutan cekok untuk perlakuan... 46
5. Data bobot badan tikus selama penelitian (gram)………... 47
6. Hasil uji Anova bobot badan masa perlakuan menggunakan SAS……….. 48
7. Data konsumsi pakan selama penelitian (gram)……….. 49
8. Hasil uji Anova konsumsi pakan masa perlakuan menggunakan SAS...……… 50
9. Konsumsi minum dari masa adaptasi hingga masa perlakuan………... 51
10. Hasil uji Anova konsumsi minum masa perlakuan menggunakan SAS... 52
11. Jumlah sel Escherichia coli feses pada tikus (Log CFU/gram)………... 53
12. Hasil uji Anova jumlah sel Escherichia Coli di feses masa perlakuan menggunakan SAS... 54
13. Jumlah sel Escherichia Coli Usus tikus (Log CFU/gram).……. 55
14. Hasil uji Anova jumlah sel Escherichia Coli di feses masa perlakuan menggunakan SAS... 56
15. Contoh hasil metode cawan sebar……… 57
16. Profil tikus penelitian………... 58
PENDAHULUAN
Latar Belakang
Kesadaran masyarakat akan kesehatan akhir-akhir ini semakin meningkat. Masyarakat memahami bahwa pola hidup sehat dapat berperan penting untuk mencegah penyakit dan memperbaiki kesehatan manusia. Berbagai hal telah dilakukan dalam upaya memperbaiki kesehatan, termasuk diantaranya penggunaan antibiotik sebagai alternatif pengobatan. Namun penggunaan antibiotik dalam jangka waktu yang lama dapat mengakibatkan bakteri penyebab penyakit menjadi resisten.
Bakteri merupakan organisme yang sangat adaptif karena regenerasinya memerlukan waktu yang singkat dan mempunyai kecenderungan melakukan pertukaran informasi genetika. Bakteri yang resistensi akibat penggunaan antibiotika menimbulkan masalah yang baru, karena bakteri ini tahan terhadap antibiotika yang telah dipakai tersebut. Resistensi bakteri ini sulit untuk ditangani. Strain bakteri yang telah ditemukan resisten terhadap antibiotika meliputi Salmonella spp., E. coli, dan Campylobacter spp. (Evans and Wegener, 2003).
Sejumlah upaya telah dilakukan untuk mengembangkan alternatif yang sesuai untuk mengatasi dampak yang merugikan dengan pelarangan penggunaan antibiotik pemacu pertumbuhan. Substansi lain, dikenal dengan natural growth promoter, telah diidentifikasikan mempunyai khasiat dan aman untuk menggantikan fungsi antibiotik pemacu pertumbuhan ternak.
Propolis merupakan bahan alamiah yang dihasilkan oleh lebah dan telah dibuktikan mempunyai banyak manfaat terutama dalam bidang kesehatan dan saat ini digunakan secara luas sebagai obat berbagai penyakit. Propolis merupakan getah yang dikumpulkan oleh lebah dari berbagai pucuk tanaman dan dari tanaman yang patah dimana getah tanaman tersebut kemudian dicampur dengan enzim yang terdapat dalam kelenjar ludah lebah dan digunakan untuk melindungi sarang dari berbagai bakteri, virus dan jamur. Propolis tidak hanya penting bagi koloni lebah tetapi juga penting bagi kesehatan manusia maupun hewan.
Penelitian yang dilakukan oleh Hasan (2006) menunjukkan bahwa propolis hasil ekstrak etanol 70% dapat digunakan sebagai senyawa anti bakteri baik bakteri Gram positif maupun bakteri Gram negatif. Penelitian yang dilakukan oleh Kwon et al. (1999) (dalam Fearnley 2001) menunjukkan bahwa pemakaian propolis akan mengurangi diare anak sapi yang diinfeksi oleh E. coli. Penelitian lain menunjukkan bahwa propolis sangat efektif melawan mikroorganisme yang telah resisten terhadap antibiotika lain. Menurut Palmbakha (1978) pemakaian propolis dalam jangka panjang secara oral tidak mengganggu mikroflora saluran pencernaan. Selain sebagai obat dalam mengurangi kejadian diare, propolis juga dapat dipakai sebagai pemacu pertumbuhan anak sapi yang dapat meningkatkan bobot badan dengan cepat (Budicza, Molnar 1987 dalam Fearnley 2001).
Mikrokapsulasi merupakan suatu metode penyalutan langsung zat aktif dengan suatu bahan penyalut. Zat aktif disebut inti atau isi, sedangkan penyalut disebut dinding atau kulit. Mikrokapsulasi berkembang pada awal abad ke 20 dan mengalami kemajuan pesat karena diaplikasikan pada berbagai macam industri, termasuk industri farmasi. Tujuan mikrokapsulasi antara lain: mengubah cairan menjadi bentuk padatan, melindungi inti dari pengaruh lingkungan dan mengendalikan pelepasan obat (Deasy 1984). Penelitian tentang mikrokapsulasi telah banyak dilakukan namun belum pada mikrokapsulasi propolis yang dihasilkan dari Trigona spp. yang nantinya dapat digunakan sebagai pemacu pertumbuhan ternak dan zat anti bakteri.
Bankova et all (2000) menjelaskan komposisi kimia propolis bervariasi tergantung dari lokasi pengambilan, hal ini disebabkan ekosistem tumbuhan sebagai sumber propolis juga berbeda. Berdasarkan latar belakang tersebut, maka perlu dilakukan penelitian pada beberapa bentuk sediaan propolis Trigona spp secara in vivo terhadap tikus. Penelitian ini akan menggunakan propolis Trigona spp yang berasal dari Bukittinggi Sumatera Barat, dengan tujuan untuk menguji potensinya sebagai zat pemacu pertumbuhan dan juga senyawa anti bakteri.
Tujuan Penelitian
Penelitian ini bertujuan:
1. Mengetahui pengaruh pemberian propolis Trigona spp asal Bukittinggi terhadap peningkatan bobot badan tikus Sprague Dawley.
2. Mengetahui pengaruh pemberian propolis Trigona spp asal Bukittinggi terhadap penurunan jumlah bakteri E. coli di usus tikus Sprague Dawley.
Manfaat Penelitian
Hasil penelitian ini bermanfaat untuk memberikan informasi mengenai propolis Trigona spp asal Bukittinggi Sumatera Barat sebagai bahan pemacu pertumbuhan alami dan sebagai senyawa anti bakteri.
Hipotesis
Bentuk sediaan Propolis Trigona spp asal Bukittinggi Sumatera Barat dapat meningkatkan pertumbuhan bobot badan tikus dan menurunkan jumlah bakteri E coli di usus tikus Sprague Dawley.
TINJAUAN PUSTAKA
Trigona spp
Lebah madu Trigona spp. merupakan salah satu serangga sosial yang hidup berkelompok membentuk koloni. Satu koloni lebah ini berjumlah 300 -80.000 lebah. Trigona spp. banyak ditemukan hidup di daerah tropis dan sub tropis, ditemukan di Amerika Selatan, dan Asia Selatan (Free 1982). Trigona spp. Diklasifikasikan sebagai berikut:
Divisi : Animalia Filum : Arthropoda Kelas : Insecta Ordo : Hymenoptera SuperFamili : Apoidea Famili : Apidae SubFamili : Apinae Genus : Trigona Spesies : Trigona spp
Trigona spp. (gala-gala, lebah lilin), dalam bahasa daerah disebut klanceng, lanceng (Jawa), atau teuweul (Sunda) (Perum perhutani 1986). Jumlah madu yang dihasilkan lebih sedikit dan lebih sulit diekstrak, namun jumlah propolis yang dihasilkan lebih banyak dibandingkan lebah jenis lain (Sing 1962).
Trigona merupakan salah satu lebah tanpa sengat. Mereka tidak memiliki sengat yang dapat digunakan untuk pertahanan diri. Namun beberapa spesies Trigona mempertahankan dirinya dengan gigitan. Lebah ini akan menggigit musuhnya atau membakar kulit musuhnya dengan larutan basa (Free 1982).
Trigona spp. lebih banyak mencari makan pada pagi hari dibandingkan dengan sore hari. Hal ini dipengaruhi oleh intensitas cahaya matahari. Ukuran tubuh juga mempengaruhi jarak terbang lebah mencari makanan. Makin besar tubuh lebah, maka makin jauh jarak terbangnya. Trigona spp dengan ukuran 5 mm mempunyai jarak terbang sekitar 600 m (Amano et al.2000).
Sarang Lebah Madu Trigona spp
Trigona spp. atau klanceng membuat sarang di dalam lubang-lubang pohon, celah-celah dinding atau lubang bambu di dalam rumah, tidak suka berpindah rumah karena lebah ratunya sangat gemuk dan tidak pandai terbang (perum perhutani 1986). Klanceng dipelihara masyarakat secara terbatas dengan menyiapkan batang-batang bambu yang dibelah lalu diikat kembali dengan tali (Suwanda 1986).
Gambar 2. Sarang lebah Trigona spp
Sarang Trigona dibangun dari lilin dan resin. Di dalam sarang terdapat sel-sel tetasan yang dilindungi oleh selubung yang lembut yang disebut involucrum dan sel-sel ini dikelilingi tempat penyimpanan makanan. Madu dan polen disimpan di dalam pot-pot yang terpisah. Trigona yang lebih
primitif, membangun sarang yang lebih sederhana. Pot-pot sferikal untuk menyimpan madu dan pipa-pipa yang kaya lilin untuk menyimpan polen. Kadang-kadang madu dan polen disimpan pada pot yang sama (Free 1982).
Salah satu sifat lebah madu yang memungkinkannya bertahan hidup pada kondisi lingkungan yang berbeda-beda adalah kemampuannya mengatur temperatur di dalam sarang. Oleh karena itu, lebah membuat sarang yang terlindung, volume ruang yang cukup, arah pintu, dan pemanfaatan ruang yang baik. Koloni lebah lebih suka memilih ruangan dengan pintu masuk mengarah ke selatan, lubang kurang dari 60 cm dan terletak di dasar ruangan. Lubang-lubang kecil pada sarang akan ditutup dengan propolis (Sihombing 1997).
Koloni lebah madu mempunyai cara yang unik untuk mempertahankan temperatur di dalam sarang. Pada daerah tetasan, dijaga tetap 33-36oC, bila temperatur turun, biasanya 14-18 oC, mereka akan merapatkan koloni (cluster) dan lebah yang berada dipinggir merentangkan sayapnya untuk mencegah hilangnya panas. Bila suhu semakin rendah, kepala dan dadanya dibenamkan ke dalam rapatan koloni. Selain itu, lebah madu juga menghasilkan panas dengan memetabolisme madu dan menggerak-gerakkan otot dadanya (Sihombing 1997).
Apabila temperatur naik terus melampaui batas normal, lebah akan menyebar di atas permukaan sisiran, lalu pindah ke dekat pintu sarang, dan akhirnya keluar. Lebah-lebah di sekitar pintu akan menggetarkan sayapnya agar udara mengalir ke dalam sarang. Mereka menguapkan air dan mencairkan madu untuk mempertahankan suhu sekitar 35oC (Sihombing 1997). Jika suhu lebih dari 40 oC lebah akan meninggalkan sarang dan jika suhu naik lebih ekstrim lagi koloni akan hijrah membuat sarang yang baru (Sumoprastowo 1980).
Propolis
Propolis merupakan nama generik dari resin lebah. Kata propolis berasal dari bahasa Yunani, yaitu ”pro” artinya sebelum atau pertahanan dan ”polis” artinya kota atau sarang lebah. Jadi, propolis adalah pertahanan kota
atau disebut juga sebagai sistem pertahanan sarang lebah. Karena sifatnya yang lengket seperti lem, propolis disebut sebagai bee-glue.
Menurut Gojmerac (1983), propolis adalah bahan perekat atau dempul yang bersifat resin yang dikumpulkan oleh lebah pekerja dari kuncup, kulit tumbuhan atau bagian-bagian lain dari tumbuhan. Resin-resin yang diperoleh dari bermacam-macam tumbuhan ini dicampur dengan saliva dan enzim lebah sehingga berbeda dari resin asalnya. Propolis berwarna kuning sampai coklat tua, bahkan ada yang transparan. Hal ini dipengaruhi oleh kandungan flavonoidnya. Propolis dipengaruhi oleh temperaturnya. Pada temperatur di bawah 15 oC, propolis keras dan rapuh, tapi kembali lebih lengket pada temperatur yang lebih tinggi (25-45 oC). Propolis umumnya meleleh pada temperatur 60-69 oC dan beberapa sampel mempunyai titik leleh di atas 100oC (Woo 2004).
Resin digunakan lebah untuk melapisi sarang bagian dalam, memperbaiki sisiran yang rusak, menambal lubang-lubang, dan memperkecil ukuran jalan masuk sel untuk menghindari udara dingin. Jika ada binatang yang mati di dalam sarang dan terlalu berat untuk dibuang, lebah akan membungkusnya dengan propolis. Yang juga penting, propolis digunakan sebagai campuran malam untuk menutup sel berisi larva sehingga terlindungi dari serangan penyakit (Suranto 2007).
Kandungan dan Manfaat Propolis
Setiap jenis lebah memiliki sumber resin tertentu yang ada di daerahnya sehingga komposisi propolis amat bervariasi. Tingginya variasi tergantung jenis pohon, suhu wilayah, bahkan hari (saat) ketika propolis disimpulkan. Misalnya, propolis yang diambil dari pohon populos mempunyai flavonoid yang tinggi, sedangkan yang diambil dari pohon aspen memiliki lebih banyak asam aromatik (Suranto 2007).
Gojmeraj (1983) menyatakan bahwa propolis mengandung bahan campuran kompleks malam, resin, balsam, minyak dan sedikit polen.
Komposisinya bervariasi tergantung dari tumbuhan asal. Propolis juga mengandung zat aromatik, zat wangi, dan berbagai mineral.
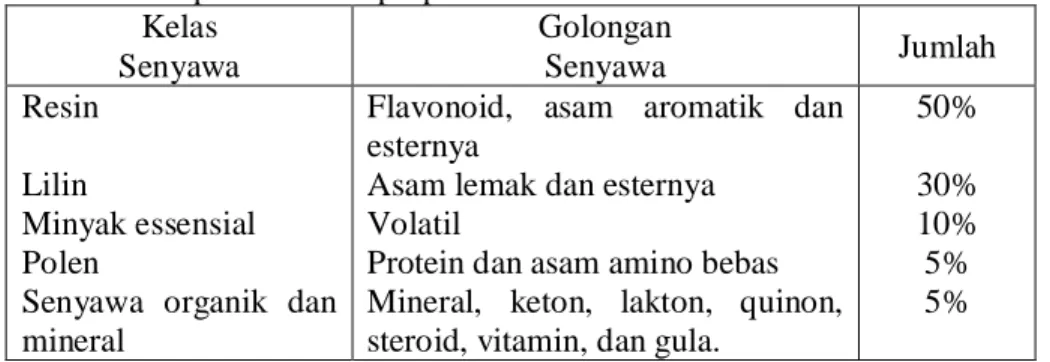
Propolis dan jumlah senyawa-senyawanya menunjukkan bermacam-macam efek biologis dan aktivitas farmakologis. Lebih dari 200 senyawa yang terkandung di dalam propolis sudah diketahui (Khismatullina 2005). Data komponen kimia propolis dapat dilihat pada Tabel 1.
Tabel 1. Komponen Kimia propolis Kelas Senyawa Golongan Senyawa Jumlah Resin Lilin Minyak essensial Polen
Senyawa organik dan mineral
Flavonoid, asam aromatik dan esternya
Asam lemak dan esternya Volatil
Protein dan asam amino bebas Mineral, keton, lakton, quinon, steroid, vitamin, dan gula.
50% 30% 10% 5% 5% (Khismatullina 2005)
Propolis terdiri dari sekitar 150 bahan kimia yang berbeda yang masih terus ditemukan setiap tahun. Komponen utamanya adalah flavonoid dan asam fenolat, termasuk caffeic acid phenethyl ester (CAPE) yang kandungannya mencapai 50% dari seluruh komposisi. Diantara 150 bahan kimia tersebut ditemukan zat dengan efek antivirus (fenolik, ester caffeic, asam ferulat, luteolins, quercentin), anti peradangan (asam caffeic, ester fenil, galangin, kaempferol, dan kaempferid), mengurangi nyeri (alkohol, campuran ester caffeat), antitumor (asam caffeic, ester fenetil), dan anti mikroba (flavonoid, galangin, pinocembrin) (Suranto 2007).
Flavonoid terdapat hampir di semua spesies bunga. Jenis flavonoid yang terpenting dalam propolis adalah pinocembrin dan galangin. Kandungan kimianya sedikit berbeda dengan flavonoid dari bunga karena adanya pemrosesan oleh lebah. Kandungan flavonoid dalam propolis bervariasi 10-20%. Kandungan ini merupakan yang terbanyak dibandingkan kandungan flavonoid dalam produk lebah lainnya (Suranto 2007).
Propolis dianggap sebagai pencemar bagi malam (lilin), tetapi propolis berfungsi untuk melindungi sarang dari bakteri serta virus dan
melindungi telur-telurnya dari Bacillus larvae yang menyebabkan kebusukan telur-telur tersebut dan mensterilkan simpanan makanan. Bangsa Romawi dan Yunani menggunakannya sebagai obat dan dipakai sebagai perekat dalam pembuatan kano (Winingsih 2004). Bangsa Italia memakai bahan tersebut untuk mempernis biola (Khismatullina 2005).
Di dalam dunia pengobatan, propolis dimanfaatkan dalam penyembuhan berbagai penyakit. Manfaat propolis yang bermacam-macam ini dapat dimungkinkan karena kandungan kimianya yang beragam. Beberapa hasil penelitian menunjukkan bahwa propolis efektif sebagai antikanker, antivirus, antifungi, antibakteri, antioksidan, atiinflamasi, meningkatkan imunitas tubuh, memperkuat dan mempercepat regenerasi sel, dan lain-lain. Beberapa penelitian menyatakan propolis bersifat bakterisida, bakterostatik dan memiliki sifat antibiotik. Ada juga yang melaporkan ekstrak propolis ampuh untuk menyembuhkan luka, penyakit mulut dan kuku pada sapi, membunuh virus influenza dan membantu penyembuhan penyakit kulit. Seorang dokter gigi Rusia melaporkan, sebagai bahan anestesia 3-4% ekstrak propolis 3-5 kali lebih efektif dari kokain (Gojmeraj 1983).
Kelebihan propolis sebagai antibiotik alami dibandingkan dengan bahan sintetik adalah lebih aman serta efek samping yang kecil. Satu-satunya efek samping yang terjadi dan itupun jarang yaitu timbulnya reaksi alergi yang digunakan secara peroral tidak menimbulkan resistensi. Selain itu propolis sebagai antibiotik memiliki selektivitas tinggi. Propolis hanya membunuh penyebab penyakit sedangkan mikroba yang berguna seperti flora usus tidak terganggu (Winingsih 2004).
Senyawa Pemercepat Pertumbuhan
Senyawa antibiotik yang digunakan untuk mempercepat pertumbuhan (antibiotic growth promoters = AGP) merupakan obat yang digunakan untuk membunuh atau menghambat bakteri, digunakan dalam konsentrasi rendah pada dosis subterapi. Menurut National Office of Animal Health (NAOH, 2001) AGP digunakan untuk membantu pertumbuhan hewan
dengan mencerna makanan lebih efisien, sehingga menguntungkan dan dapat tumbuh kuat dan sehat. Mekanisme kerja antibiotik ini belum jelas, namun dipercaya banyak peneliti bahwa antibiotik ini menekan populasi bakteri pada saluran pencernaan. Estimasi energi yang hilang sekitar 6% dari diet pada babi karena fermentasi mikroba dalam usus (Jensen, 1998). Jika populasi dapat dikendalikan, maka kehilangan energi dapat dialihkan untuk pertumbuhan.
Thomke dan Elwinger (1998) berpendapat, apabila sitokinin dilepaskan akibat respon imun, dapat menstimulasi pelepasan hormon katabolit, sehingga mengurangi massa otot. Dengan demikian, pengurangan infeksi pada saluran pencernaan akan meningkatkan bobot otot. Penggunaan AGP dapat meningkatkan laju pertumbuhan 1 – 10% daging yang dihasilkan. Menurut Prescott dan Baggot (1993) efek AGP akan lebih signifikan pada hewan yang sakit dan di dalam kandang dengan kondisi tidak higienis.
Mikrokapsulasi
Mikrokapsulasi adalah suatu proses penyalutan tipis suatu bahan inti baik berupa padatan, cairan atau gas dengan suatu polimer sebagai dinding pembentuk mikrokapsul (Luzzi 1970). Mikrokapsul yang terbentuk dapat berupa partikel tunggal atau bentuk agregat, dan biasanya memiliki rentang ukuran partikel antara 5-50 m. Ukuran tersebut bervariasi tergantung metode dan ukuran bahan inti yang digunakan.
Mikrokapsulasi merupakan teknik yang digunakan untuk mengungkung suatu senyawa dengan menggunakan bahan penyalut dengan ukuran sangat kecil berdiameter rata-rata 15-20 mikron atau kurang dari setengah diameter rambut manusia. Terdapat lebih dari 400 miliar kapsul kecil dalam setiap galon material yang termikrokapsul (Sutriyo et.al., 2004).
Proses mikrokapsulasi memiliki beberapa tujuan yaitu (Deasy 1984):
1) mengubah cairan menjadi bentuk padat (pseudo solid) 2) mengubah bobot jenis atau volume
3) melindungi inti atau zat dari pengaruh lingkungan seperti suhu, oksidasi dan kelembaban
4) mengurangi sifat penguapan bahan yang mudah menguap 5) menurunkan sifat higroskopis dari zat aktif
6) mencegah reaksi antara zat yang tak tersatukan dalam satu sistem
7) memodifikasi sifat pelepasan zat dalam mikrokapsul dan mengontrol disolusi zat
8) menutupi bau atau rasa yang tidak enak 9) memperbaiki aliran serbuk
10) memperbaiki stabilitas inti
Faktor-faktor yang mempengaruhi keberhasilan proses mikrokapsulasi antara lain: sifat fisika kimia bahan inti atau zat aktif, bahan penyalut yang digunakan, pelarut, metode yang digunakan, tahap atau proses (tunggal atau bertingkat), sifat dan struktur dinding mikrokapsul serta kondisi pembuatan (basah atau kering) (Valkenburg 1979). Bahan yang terlibat dalam proses mikrokapsulasi meliputi bahan inti, bahan penyalut dan pelarut.
Bahan inti
Inti adalah bahan spesifik yang akan disalut, dapat berupa bahan cair, padat atau gas. Komposisi bahan inti dapat bervariasi, misalnya pada bahan inti cair dapat terdiri dari bahan terdispersi atau bahan terlarut. Sedangkan bahan inti padat dapat berupa zat tunggal atau campuran zat aktif dengan bahan pembawa lain seperti stabilisator, pengisi, penghambat atau pemacu pelepasan bahan aktif dan sebagainya. Selain itu bahan inti yang digunakan sebaiknya tidak larut atau tidak bereaksi dengan bahan penyalut dan pelarut yang akan digunakan (Deasy 1984).
Bahan penyalut
Penyalut adalah bahan yang digunakan untuk menyelaputi inti dengan tujuan tertentu. Bahan penyalut harus mampu memberikan suatu lapisan tipis yang kohesif dengan bahan inti, dapat bercampur secara kimia,
tidak bereaksi dengan inti (bersifat inert) dan mempunyai sifat yang sesuai dengan tujuan penyalutan. Jumlah penyalut yang dapat digunakan antara 1-70% dan pada umumnya digunakan 3-30% dengan ketebalan dinding penyalut 0,1-60 m (Luzzi 1970). Bahan yang umum digunakan sebagai bahan penyalut meliputi maltodekstrin dan lakstosa.
Maltodekstrin merupakan salah satu produk turunan pati yang dihasilkan melalui hidrolisis parsial dengan enzim -amilase atau secara kimia yang memiliki nilai Dextrose Equivalent (DE) kurang dari 20. DE 100 akan diperoleh pada glukosa murni dan DE 0 akan diperoleh pada amilum murni yang belum mengalami proses hidrolisis (Zobel 1992).
Maltodekstrin mengandung karbohidrat lebih dari 99% dengan kadar air 5-6%, ion-ion, protein, lemak dan serat kasar. Maltodekstrin mempunyai sifat alir dan kompresibilitas yang baik, higroskopis, dapat membentuk larutan dengan viskositas tertentu, mencegah efek browning, mencegah pergerakan molekul, dapat membentuk lapisan film yang melindungi dari pengaruh oksidasi dan mempunyai daya ikat yang baik.
Pemanfaatan maltodekstrin sangat luas, terutama dalam industri makanan karena sifatnya dapat memperbaiki rasa di mulut sehingga dapat menggantikan lemak tanpa mengurangi rasa akhir dari produk. Penggunaan maltodekstrin antara lain sebagai pengganti lemak dalam produk makanan diet, mengontrol titik beku dan pembentukan kristal es pada produk makanan beku, sebagai bahan tambahan pada pembuatan makanan dan sereal serta sebagai agen pengembang pada pembuatan produk roti, es krim dan selai. Maltodekstrin juga digunakan dalam formulasi obat dan penyalutan tablet, sebagai peningkat viskositas larutan dan untuk mencegah kristalisasi sirup.
Pelarut
Pelarut adalah bahan yang digunakan untuk melarutkan bahan penyalut dan mendispersikan bahan inti. Pemilihan pelarut biasanya berdasarkan sifat kelarutan dari bahan inti atau zat aktif dan bahan penyalut,
dimana pelarut yang digunakan tersebut tidak atau hanya sedikit melarutkan bahan inti tetapi dapat melarutkan bahan penyalut (Deasy 1984).
Mikrokapsul
Mikrokapsul yang akan dibuat dalam bentuk tepung dapat dilakukan pengeringan dengan beberapa cara yaitu penjemuran, pengeringan buatan (menggunakan alat pengering), dan pengeringan secara pembekuan (freeze drying). Pemilihan alat pengering ini disesuaikan dengan sifat dan karakteristik bahan yang dikeringkan, bentuk produk akhir yang diinginkan, dan cara kerja mesin pengering. Macam-macam alat pengering yang biasa digunakan dalam pengeringan buatan, antara lain pengering rak, pengering conveyor, pengering rotary, pengering flash (pneumatic), pengering fluidized bed, spray dryer, drum dryer, freeze dryer dan vacuum dryer .
Pengeringan Vakum (vacuum dryer)
Pada pengeringan dangan vacuum dryer kadar air bahan dikurangi dengan menguapkannya pada tekanan di bawah tekanan atmosfir. Pengeringan dengan vacuum dryer biasanya digunakan untuk bahan-bahan yang sensitif terhadap panas seperti obat-obatan, makanan dan sebagainya. Suhu pengeringan tidak kurang dari 40° C.
Semua sistem pengering vakum mempunyai 4 elemen terpenting yaitu ruang hampa dengan konstruksi tertentu, alat-alat untuk mensuplai panas, alat-alat mempertahankan kondisi hampa dan komponen untuk mengumpulkan uap air yang dievaporasikan dari bahan pangan.
Escherichia coli (E. coli)
E. coli merupakan jenis mikroorganisme yang biasa terdapat pada sistem pencernaan. E. coli merupakan bakteri gram negatif, berbentuk batang, uji indole positif dan mampu memfermentasi berbagai karbohidrat seperti glukosa, laktosa, manitol dan arabinosa. E. coli menyebabkan jaringan epitel
di dalam usus berubah fungsi, dari penyerapan nutrisi menjadi pengeluaran (diare) (Srikandi Fardiaz, 1993)
Gambar 3. Bakteri E. Coli
E. coli biasanya terdapat pada sistem pencernaan hewan berdarah panas. Kebanyakan strain E. coli yang sama tidak berbahaya, namun beberapa jenis yang lain dapat menyebabkan diare parah, keracunan dan bahkan kematian (Vogt dan Dippold 2005). Strain E. coli yang virulen juga dapat menginfeksi saluran perkemihan dan menyebabkan meningitis neonatal. Pada beberapa kasus, E. coli virulen dapat menyebabkan mastitis, peritonitis, dan pneumonia Gram negatif (Todar 2007). E. coli yang tidak berbahaya merupakan flora normal dalam usus besar, dapat menguntungkan inang dengan membentuk vitamin K2 (Bentley dan Meganathan 1982).
METODOLOGI PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini berlangsung selama 6 bulan, mulai bulan Januari 2009 sampai dengan Juni 2009, bertempat di Laboratorium Biokimia Institut Pertanian Bogor (IPB).
Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini antara lain spektrofotometer visibel, vakum evaporator, pengering vakum, termometer, neraca analitik, pelat pemanas, laminar, autoklaf dan alat-alat gelas.
Bahan yang digunakan antara lain sarang lebah Trigona spp., etanol 70%, propilen glikol, maltodekstrin, n-heksan, Kandang hewan uji dan timbangan hewan uji.
Hewan percobaan yang digunakan adalah tikus jantan sprague dawley sebanyak 25 ekor berumur sekitar 1 bulan dengan bobot badan antara 70 – 110 gram. Tikus tersebut diperoleh dari Fakultas Peternakan IPB Bogor.
Metode Penelitian
Ekstraksi Propolis Trigona spp
Propolis diekstraksi dengan metode Harborn (1987) dan Matienzo & Lamorena (2004). Sarang lebah Trigona spp sebanyak 200 g dimaserasi menggunakan etanol 70%. Ekstraksi ini dilakukan dengan merendam 200 g sarang lebah menggunakan 650 ml etanol 70% selama 7 hari, dengan penggojokan 24 jam. Setelah perendaman tujuh hari, filtrat didekantasi, residu yang tersisa diekstrak kembali dengan 50 mL etanol 70%, dikocok 24 jam dengan kecepatan 120 rpm, dan filtrat didekantasi. Ekstraksi residu diulang sampai tujuh hari, sehingga total pelarut yang digunakan 1000 mL, dan total waktu maserasi 14 hari. Filtrat dikumpulkan dalam wadah. Filtrat dipekatkan dengan menggunakan rotary evaporator, terbentuk ekstrak pasta yang siap digunakan untuk pengujian selanjutnya (EEP: ekstrak etanol propolis).
Mikrokapsulasi Propolis Trigona spp
Mikrokapsul propolis dibuat dengan metode vacuum dryer menggunakan pelarut akuades untuk melarutkan bahan penyalut maltodekstrin. Setelah bahan penyalut dilarutkan dalam larutan yang sesuai, propolis dengan konsentrasi 2% dan 4% yang telah dilarutkan dengan propilen glikol didispersikan ke dalam larutan penyalut. Lalu campuran larutan tersebut dialirkan ke dalam alat vacuum dryer dengan suhu 40 °C, hingga terbentuk mikrokapsul propolis.
Hewan Uji dan Rancangan Percobaan
Hewan uji yang digunakan adalah tikus putih Sprague Dawley dengan jenis kelamin jantan, sehat dan mempunyai aktivitas normal, umur sekitar 1 bulan dengan berat badan 70 – 110 gram. Sebelum mendapat perlakuan, tikus diadaptasikan selama dua minggu untuk menyeragamkan cara hidup dan makanannya.
Tahap perlakuan dilaksanakan selama 30 hari. Pada awal masa perlakuan tikus putih dikelompokkan menjadi 5 kelompok. Kelompok I atau kelompok normal pada masa perlakuan diberi pakan standar. Kelompok II atau kontrol positif, diberi pakan standar dan antibiotik (ampisilin). Dan berturut-turut kelompok III, IV dan V masing-masing diberi pakan standar dan raw propolis, mikrokapsulasi 2 % dan 4%. Pemberian propolis dilakukan 3 hari sekali dengan cara di cekok dengan dosis propolis 100mg/kg bobot badan tikus per pemberian.
Perlakuan berlangsung selama 30 hari setelah masa adaptasi. Bobot badan ditimbang setiap hari. Setelah masa perlakuan 30 hari, selanjutnya usus diambil untuk analisis jumlah bakteri E. coli. Nekropsi tikus setelah perlakuan selama 30 hari, tikus dinekropsi untuk diambil sampel bakteri E.coli usus tikus. Bakteri usus ini dihitung menggunakan metode hitungan cawan (TPC) sama seperti menghitung E.coli pada feses. Nekropsi dilakukakan di Laboratorium Hispatologi, Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Penentuan Jumlah Bakteri pada Feses dan Usus
Metode yang digunakan dalam penentuan jumlah bakteri adalah metode hitungan cawan. Metode ini dipilih karena mudah dan umum digunakan dalam uji aktivitas antibakteri. Metode hitungan cawan bersifat kuantitatif yang didasarkan atas anggapan bahwa setiap sel yang dapat hidup di dalam larutan sampel akan berkembang menjadi satu koloni. Media yang digunakan untuk menumbuhkan E.coli yaitu EMB. Media EMB adalah media spesifik yang digunakan untuk isolasi dan diferensiasi bakteri Enteric basilli (Holt et al. 2004). Komposisi media EMB, yaitu enzim pemecah gelatin, kalium fosfat, pewarna (eosin Y dan biru metilena), laktosa, sukrosa, dan agar. Gelatin digunakan sebagai sumber nitrogen. Bakteri Gram negaitif dihambat pada media EMB. Pada media ini, E. coli akan tumbuh dengan ciri-ciri berwarna biru-hitam, inti berwana hijau gelap, dan berkilau metalik jika terkena cahaya
Sampel yang telah diambil dari masing-masing perlakuan berupa usus pada tikus yang diperkirakan mengandung 300 sel mikroba per gram, memerlukan pengenceran sebelum ditumbuhkan pada medium cawan petri, sehingga sebelum inkubasi akan terbentuk koloni pada cawan tersebut dalam jumlah yang dapat dihitung. Pengenceran dilakukan secara desimal untuk memudahkan perhitungan.
Dari pengenceran yang telah dilakukan, sebanyak 1 ml atau 0,1 ml larutan dipipet ke dalam cawan. Kemudian ke dalam cawan dimasukkan agar cair steril yang telah didinginkan sampai 50 oC. Kemudian dilakukan inkubasi pada suhu 37 oC. Selama inkubasi, sel-sel yang masih hidup akan tumbuh dan membentuk koloni yang dapat terlihat langsung oleh mata atau dengan menggunakan coloni counter. Setelah akhir masa inkubasi (24 jam), koloni yang terbentuk dihitung. Data yang diperoleh selanjutnya dianalisis dengan analisis RAL
Analisis Data
Analisis data dilakukan menggunakan metode Rancangan Acak Lengkap (RAL) intime. Berikut ini merupakan model rancangannya (Matjik dan Sumertajaya 2002):
Yij = µ + i+ ij
Keterangan:
Yij= Pengamatan pada perlakuan ke-i dan ulangan ke-j µ = Pengaruh rataan umum
i = Pengaruh perlakuan ke-i, i = 1,2,3,4,5
ij = Pengaruh acak pada perlakuan ke-i dan ulangan ke-j, j = 1,2,3,4,5
Data yang diperoleh akan dianalisis dengan ANOVA (Analysis of Variance) pada selang kepercayaan 95% dan taraf 0,05. Uji lanjut yang digunakan adalah Duncan. Seluruh data dianalisis dengan menggunakan program SAS (Statistical Analysis System).
HASIL DAN PEMBAHASAN
Mikrokapsulasi Propolis
Proses Mikrokapsulasi yang dilakukan menghasilkan mikrokapsul dengan konsentrasi propolis 2% (M2%) dan mikrokapsul 4% (M4%). Dimana hasil dari mikrokapsulasi yang dihasilkan berupa serbuk dan berwarna putih kecoklatan. Penelitian serupa juga telah dilakukan oleh Suseno dan Saputra (2009), dimana dihasilkan mikrokapsul propolis 2% dan 4% berbentuk serbuk serta berwarna putih kecoklatan. Hasil uji pendahuluan ketahanan mikrokapsul propolis 2% dan 4% secara in vitro memperlihatkan bahwa pelepasan senyawa aktif terjadi pada jam ke 9 hingga maksimum pada jam ke 24 dan adanya zona bening pada uji Konsentrasi Hambat Tumbuh Minimum (KHTM). Hal ini membuktikan bahwa senyawa aktif propolis telah termikrokapsulasi dengan baik.
Komposisi mikrokapsul pada penelitian ini terdiri atas ekstrak propolis asal Bukittinggi sebagai zat aktif (konsentrasi 2% dan 4%). Bahan penyalut maltodekstrin dan magnesium stearat. Mikrokapsulasi merupakan metode yang digunakan untuk mengubah pasta ekstrak propolis menjadi bentuk padat. Salah satu tujuan mikrokapsulasi ini adalah melindungi senyawa aktif propolis.
Mikrokapsul propolis asal Bukit Tinggi dibuat dengan melarutkan dua campuran A dan B. Campuran A (akuades dan maltodekstrin) sedangkan B (ekstrak propolis dan Propilen glikol). Penggunaan akuades dalam campuran A adalah untuk melarutkan maltodekstrin. Campuran B dibuat dengan melarutkan propilen glikol dan ekstrak pekat propolis dengan perbandingan 1:1. Propilen glikol digunakan untuk melarukan ekstrak pekat propolis Bukit Tinggi sehingga dalam pencampuran dengan campuran A lebih mudah. Propilen glikol merupakan salah satu pelarut yang biasa digunakan untuk melarutkan propolis di dalam dunia farmasi dan kosmetik (Tosi et al. 1996).
Bahan penyalut propolis yang digunakan adalah maltodekstrin. Maltodekstrin merupakan salah satu jenis pati yang biasa digunakan dalam teknik penyalutan obat. Harganya yang murah dan mudah diperoleh menjadikan pati sering digunakan sebagai alternatif bahan penyalut (Rahmawati 2000). Pemilihan
maltodekstrin dikarenakan strukturnya relatif lebih pendek sehingga pada saat mikrokapsulasi menghasilkan mikrokapsul yang lebih kering, berukuran seragam, dan tidak lengket.
Maltodekstrin (MDE) merupakan gula tidak manis dan berbentuk bubuk berwarna putih dengan sifat larut dalam air. Gula ini dapat dibuat dari hidrolisis pati jagung secara tidak sempurna dengan bantuan asam atau enzim. Gula ini merupakan polimer disakarida terdiri atas D-glukosa yang berikatan terutama dengan ikatan -1,4 glikosidik (Schenk & Hebeda dalam Yudha 2008). Dalam mikrokapsulasi, struktur MDE yang berongga akan diisi oleh propolis sehingga senyawa aktif propolis dapat terlindungi oleh MDE.
Setelah kedua campuran A dan B bercampur, tahap berikutnya adalah tahap pengeringan. Teknik pengeringan yang digunakan adalah vacuum drying (pengeringan vakum). Alat yang dipakai dalam proses vacuum drying adalah vaccum pan evaporator yang terdapat di Pusat Antar Universitas (PAU) Institut Pertanian Bogor (IPB). Spesifikasi komponen alat yang dipakai, yaitu pemanas listrik 14.000 watt, pompa vakum 750 watt, kecepatan pengaduk 125 rpm, panjang rotor 1 cm, diameter baling-baling 20 cm, suhu 40-50°C, dan tekanan vakum 72 cmHg. Alasan pemilihan teknik vacuum drying adalah teknik ini cocok untuk melindungi senyawa aktif propolis seperti flavonoid, yang berperan sebagai antimikrob. Hal ini dikarenakan suhu yang digunakan pada proses vakum tidak akan merusak komponen aktif propolis.
Keseragaman pencampuran dalam pembuatan mikrokapsul merupakan faktor yang penting. Campuran yang belum larut secara sempurna akan menyebabkan ukuran mikrokapsul yang terbentuk tidak seragam dan menyebabkan bahan inti atau komponen aktif tidak tersalut dengan sempurna oleh bahan penyalut. Dalam prosesnya pelarut yang digunakan yaitu air dan propilen glikol akan menguap dengan panas sehingga dihasilkan serbuk mikrokapsulasi. Ukuran mikrokapsul yang dihasilkan dengan metode ini berkisar antara 5-5000 m (Lachman 1994).
Gambar 4. Hasil A. Mikrokapsul Propolis Bukittinggi 2% B. Mikrokapsul Propolis Bukittinggi 4%
Penanganan dan Kondisi Fisik Hewan Coba
Penelitian ini menggunakan 25 ekor tikus jantan strain Sprague Dawley (SD), dibagi dalam 5 kelompok yang masing-masing terdiri dari 5 ekor tikus. Tikus Sprague Dawley yang digunakan berumur sekitar satu bulan dengan bobot badan antara 70 – 110 gram. Pemilihan tikus SD berumur satu bulan adalah karena pada masa satu bulan tersebut merupakan masa lepas sapih dan tikus telah dapat menerima nutrisi dari luar. Beberapa parameter yang digunakan dalam penelitian ini berupa pengukuran bobot badan, konsumsi pakan dan minum serta pengamatan jumlah E. coli pada usus dan feses tikus.
Tikus SD dalam penelitian ini, dibagi dalam 5 kelompok dengan masing-masing 4 kali ulangan. Tiap kelompok melalui tahap adaptasi selama 21 hari dengan pemberian pakan dan air minum secara ad libitum. Tahap adaptasi ini dilakukan agar masing-masing tikus diharapkan dalam kondisi yang sama sebelum diberi perlakuan untuk penelitian. Kemudian dilanjutkan tahap perlakuan selama 30 hari, dimana pemberian pakan dan minum tetap secara ad libitum, sedangkan masing-masing perlakuan diberikan dengan cara dicekok tiga hari sekali.
Dari hasil pengamatan, terdapat beberapa persamaan dan perbedaan kondisi fisik tikus pada saat adaptasi dan setelah pemberian perlakuan. Kondisi fisik yang terlihat sama pada saat adaptasi dan setelah perlakuan yaitu mata yang berwarna merah, dengan tingkah laku yang normal, dan warna urin kuning jernih.
Sementara perbedaan terlihat pada feses yang dihasilkan, pada kelompok tikus yang diberi perlakuan berwarna coklat lebih tua, tekstur lebih lunak dan lebih berbau. Hasil pengamatan fisik tikus dapat dilihat pada Tabel 2.
Tabel 2. Kondisi Fisik Hewan Coba
Keterangan Parameter Normal Perlakuan Warna mata Warna feses Tekstur feses Tingkah laku Warna urin Merah Cokelat Padat Normal Kuning jernih Merah Cokelat tua Lunak Normal Kuning jernih
Pertumbuhan Bobot Badan Hewan Coba
Pertumbuhan bobot badan hewan coba selama masa adaptasi
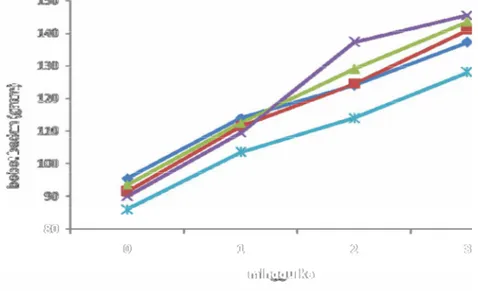
Selama masa adaptasi semua tikus mengalami kenaikan bobot badan (Gambar 5) secara keseluruhan sebesar 47,59 %. Rata-rata bobot badan tikus pada awal masa adaptasi sebesar 91,3 gram. Sedangkan pada akhir masa adaptasi bobot badan rata-rata sebesar 134,75 gram.
Pada semua kelompok perlakuan terjadi kenaikan bobot badan secara bertahap setiap minggu, yang mempunyai kecenderungan yang sama. Berdasarkan uji ANOVA dengan uji lanjut duncan, kenaikan bobot badan antara masing-masing kelompok tidak berbeda nyata (P<0,05). Artinya, kenaikan bobot badan masing-masing kelompok tidak dipengaruhi oleh faktor dari luar karena kelompok-kelompok tersebut belum diberi perlakuan. Hal ini menunjukkan bahwa kondisi tikus dalam keadaan sehat dan berhasil dalam masa adaptasi sehingga tikus dapat terus dipergunakan selama percobaan.
Pertumbuhan bobot badan hewan coba selama masa perlakuan
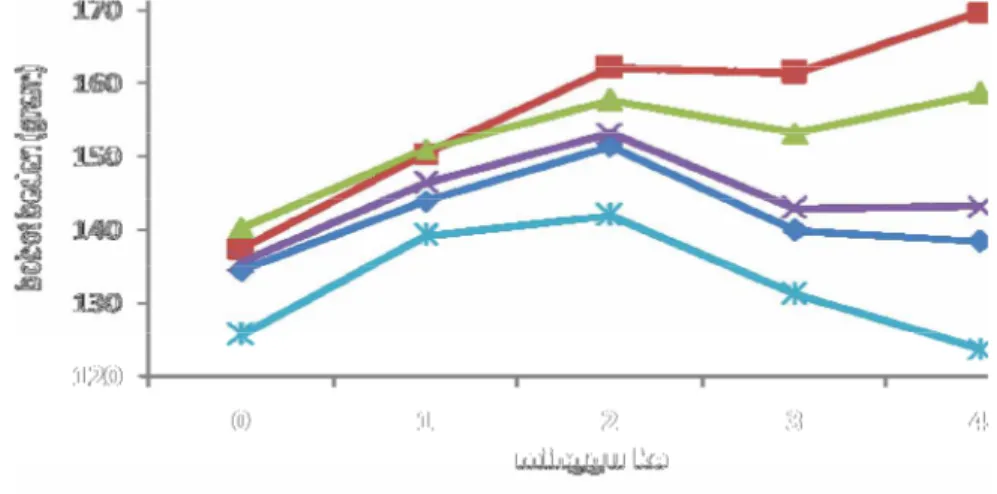
Pada masa perlakuan kenaikan bobot badan pada masing-masing kelompok terjadi pada minggu pertama dan kedua, hal ini menunjukkan bahwa tikus tidak mengalami stress setelah perlakuan. Namun, pada minggu ketiga setelah perlakuan terjadi penurunan bobot badan (Gambar 6). Penurunan bobot badan terjadi pada kelompok standar dan mikrokapsulasi 4% (M4%), dimana kelompok M4% mengalami penurunan yang signifikan dibandingkan dengan kelompok yang lainnya. Penurunan dan peningkatan bobot badan ini diduga karena adanya perubahan jumlah populasi mikroflora bakteri yang ada pada sistem pencernaan, yang akan dibahas selanjutnya.
Pada grafik (Gambar 6) dapat dilihat bobot badan kelompok raw, kontrol positif dan mikrokapsul 2% (M2%) cenderung lebih stabil. Hal ini diduga karena miklofora di usus tetap dalam kondisi seimbang. Dimana pada kelompok raw, kontrol positif dan M2% memiliki jumlah E. coli di usus yang relatif lebih kecil. Mikroflora yang stabil dan seimbang merupakan pertanda keadaan saluran cerna yang sehat. Beberapa mekanisme penyerapan lemak,karbohidrat dan protein dapat dipengaruhi oleh kehadiran mikroflora usus.
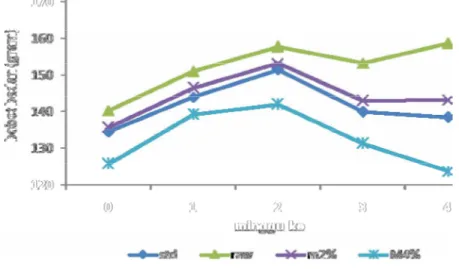
Berdasarkan uji statistik, bahwa perlakuan berpengaruh nyata (P<0,05) terhadap perubahan bobot badan. Dimana kelompok perlakuan M4% memiliki persentase kenaikan bobot badan terkecil dan menunjukkan hasil analisis yang berbeda nyata terhadap kelompok lainnya.
Bobot badan tikus yang mengalami peningkatan, didukung pula dengan adanya peningkatan konsumsi pakan (Gambar 7). Pertumbuhan dan perkembangan yang baik dari mahkluk hidup ditandai dengan terjadinya kenaikan bobot badan yang mengikuti bentuk kurva pertumbuhan yang sigmoid. Pertumbuhan dan perkembangan berat badan sangat dipengaruhi oleh kandungan nutrisi makanan, kandungan energi, aktivitas metabolisme, dan aktivitas fisik hewan yang bersangkutan. Pada fase pertumbuhan proses biosintesis berlangsung dengan cepat sehingga dibutuhkan energi untuk berlangsungnya proses metabolisme tubuh.
Jumlah pakan yang dikonsumsi selama masa adaptasi rata-rata sebesar 10.80 gram/hari, sementara pada masa perlakuan konsumsi pakan rata-rata sebesar 11,36 gram/hari. Peningkatan yang terjadi menunjukkan bahwa tikus masih berada dalam kondisi nafsu makan yang normal. Dari grafik (Gambar 7) dapat dilihat bahwa konsumsi pakan untuk kelompok standar, raw dan M2% lebih stabil, artinya tidak terjadi perubahan yang besar. Sebaliknya, kontrol positif dan M4% terdapat perubahan yang relatif lebih besar. Sehingga hal ini mempengaruhi bobot badan tikus.
Berdasarkan uji statistik pada masa perlakuan, konsumsi pakan mikrokapsulasi 4% berbeda nyata (P<0,05) terhadap kelompok lainnya. Rata–rata konsumsi pakan standar, kontrol positif, raw, M2% dan M4%
masing-masing 11,79 gram/hari, 11, 53 gram/hari, 12,01 gram/hari dan 11, 30 gram/hari dan M4% dengan rata-rata terkecil yaitu 10.16 gram/hari. Dari data tersebut menunjukkan bahwa konsumsi pakan M4% yang relatif lebih kecil dibandingkan kelompok yang lain, menyebabkan pertumbuhan bobot badan M4% yang lebih kecil pula. Karena dengan konsumsi pakan yang lebih sedikit pada masa pertumbuhan akan mengakibatkan energi yang dibutuhkan tubuh menjadi terbatas untuk berlangsungnya proses metabolisme tubuh. Maka hal ini akan mengganggu fase pertumbuhan dari tikus tersebut.
Gambar 7. Konsumsi pakan dari masa adaptasi hingga masa perlakuan Pada M2% terjadi hal yang berbeda, konsumsi pakan mengalami penurunan akan tetapi pertumbuhan mengalami peningkatan. Hal ini menunjukkan adanya efisiensi konsumsi pakan. Hal yang sama telah dilakukan peneliti Itali (Buhatel et al 1983) memberikan sejumlah kecil propolis dalam pakan babi, dan ternyata pertumbuhan berat badannya lebih cepat serta kebutuhan pakannya lebih sedikit (29% lebih rendah). Di Italia (Fearnley 2005) pemberian propolis sebanyak 30 ppm dalam ransum dapat meningkatkan produksi telur 6,07%, berat telur 1,27%, penggunaan pakan lebih efisien 5,46, dan pertambahan berat badan ayam betina muda 6,40%.
Penelitian serupa di Jepang melaporkan bahwa propolis dapat merangsang respon imun pada tikus (Dantas et all 2006). Peneliti dari Jepang menemukan bahwa ekstrak propolis dapat menyebabkan aktivasi makrofag yang berhubungan dengan fungsi kekebalan tubuh pada manusia (Moriyasu et all 1994). Pada dunia peternakan propolis telah banyak digunakan baik untuk pengobatan maupun untuk memperbaiki keseimbangan mikroflora dalam tubuh hewan ternak. Beberapa peneliti dari Moscow (Mirolyubov dan Barskov 1980, diacu dalam Fearnley 2005) dan Polandia (Meresta dan Meresta 1985, serta Meresta et all 1989, diacu dalam Fearnley 2005) dengan menggunakan propolis untuk penyembuhan mastitis pada sapi. Propolis juga dapat meningkatkan imunitas, aktivasi produksi antibody dan fagositosis sapi ketika ditambahkan bersama tembaga dan kobalt (Dunyavin 1971, diacu dalam Fearnley 2005). Budicza dan Molhar (1987) diacu dalam Fearnley (2005) melaporkan bahwa pemberian ekstrak propolis 20% dengan jumlah 2-5 ml tiap pagi dan siang bersama pemberian susu pada anak sapi dapat mengurangi kejadian diare dan mempercepat pertumbuhan berat badan.
Gambar 8. Konsumsi minum dari masa adaptasi hingga masa perlakuan
Konsumsi air minum tikus selama masa adaptasi hingga perlakuan juga mengalami perubahan. Dari grafik (Gambar 8) menunjukkan bahwa terjadinya
peningkatan dan penurunan, konsumsi minum cenderung mengikuti konsumsi pola makan. Dimana dengan konsumsi pakan yang relatif lebih banyak maka konsumsi minum akan cenderung lebih banyak pula. Hal ini disebabkan karena konsumsi minum tersebut dibutuhkan oleh tubuh utamanya dalam pemecahan molekul-molekul nutrisi dalam pakan yang selanjutnya akan digunakan dalam proses metabolisme tubuh.
Perbandingan Potensi Propolis terhadap Standar Perlakuan
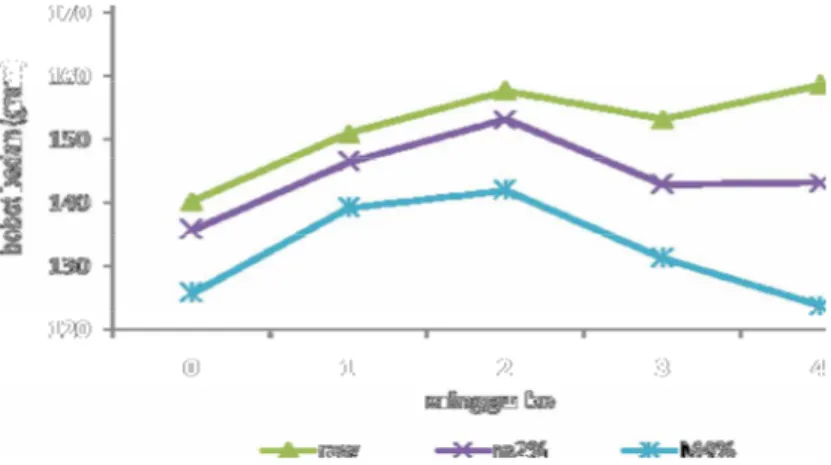
Potensi raw dan M2% terhadap bobot badan berbeda nyata (P<0,05) bila dibandingkan dengan standar dan M4%. Dimana kelompok standar dan M4% memiliki persentase kenaikan bobot badan yang kecil dibanding kelompok perlakuan lain. Hal ini dapat disebabkan karena pengaruh kandungan propolis. Gambar 9 menunjukkan bahwa pertumbuhan bobot badan tikus kelompok raw (15.3%) dan M2% (9.34%) lebih baik jika dibandingkan dengan standar (4,93%) dan M4% (2.12%).
Gambar 9. Potensi sediaan Propolis terhadap standar perlakuan
Perbandingan Potensi Propolis terhadap Ampisilin
Pengaruh raw propolis (15.3%) dan M2% (9.34%) terhadap bobot badan positif (ampisilin, persentase pertumbuhan 26%) tidak berbeda nyata (P<0,05).
Sebaliknya untuk M4% (2.12%) berbeda nyata terhadap raw propolis, M2% maupun ampisilin. Pada Gambar 10 menunjukkan bahwa M2% dan raw propolis memiliki pertumbuhan bobot badan yang stabil dibandingkan dengan M4%. Hal tersebut di atas dapat memberikan gambaran bahwa M2% dan raw propolis memiliki potensi untuk menggantikan antibiotik sebagai salah satu alternatif pemacu pertumbuhan yang bersifat alami.
Propolis sebagai bahan pemacu pertumbuhan merupakan alternatif yang aman apabila dibandingkan dengan penggunaan antibiotik sintetik. Selain itu salah satu peran penting yang dimiliki propolis adalah dapat merangsang imunitas sedangkan pada beberapa obat-obatan medis sintetik justru akan menekan imunitas. Keuntungan lainnya adalah propolis bersifat sebagai antibitotik alami yang dapat menghambat pertumbuhan bakteri patogen tanpa mematikan bakteri yang menguntungkan bagi tubuh. Sebaliknya antibotik sintetik bersifat bakterisidal yang dapat mematikan seluruh bakteri bahkan bakteri non patogen. Disamping itu, antibiotik yang digunakan secara terus menerus akan dapat menyebabkan beberapa bakteri menjadi resisten, karena bakteri dapat secara mudah beradaptasi dengan keadaan tersebut.
Gambar 10. Potensi propolis terhadap Ampisilin sebagai pemacu pertumbuhan
Ampisilin termasuk dalam golongan penisilin yang merupakan antibiotik -laktam. Secara umum, mekanisme antibiotik ampisilin adalah mencegah penggabungan asam N-asetilmurat ke dalam struktur peptidoglikan yang merupakan salah satu bagian penting dalam dinding sel bakteri. Penghambatan ini mengakibatkan lemahnya struktur dinding sel bakteri sehingga tidak dapat menahan kuatnya tekanan dari cairan sitoplasma. Mekanisme yang dimiliki oleh ampisilin ini menyebabkan ampisilin memiliki daya anti bakteri yang besar dan dapat bersifat bakterisidal (Fajarina 2009).
Perbandingan Potensi Mikrokapsul Propolis terhadap Raw Propolis
Pengaruh M2% terhadap bobot badan tidak berbeda nyata apabila dibandingkan dengan kelompok raw propolis. Namun sebaliknya untuk M4% berbeda nyata (P<0,05), dimana M4% memiliki persentase kenaikan bobot badan yang lebih rendah (2.12%) jika dibandingkan dengan M2% (9.34%) dan raw propolis (15.3%).
Gambar 11. Potensi mikrokapsul propolis terhadap Raw propolis
Pada Gambar 11, grafik menunjukkan pola peningkatan bobot badan tikus kelompok M2% menyerupai kelompok raw propolis. Raw propolis memiliki potensi yang sama dengan M2%. Hal ini terlihat pula dari persentasi kenaikan bobot badan tikus. Dimana raw propolis mengalami peningkatan sebesar 15,3% sedangkan pada M2% sebesar 9,34%.
Populasi Bakteri Pada Feses (Escherichia coli)
Hasil uji statistik, menunjukkan adanya beda nyata (P<0,05) jumlah E. coli, pada feses tikus. Beda nyata tersebut antara kontrol positif terhadap perlakuan yang lain. Pada grafik (Gambar 12) menunjukkan bahwa pada minggu pertama setelah pencekokkan, jumlah E. coli khususnya pada kelompok M4% dan kontrol positif relatif jauh lebih tinggi dibandingkan dengan perlakuan kelompok yang lain. Pada minggu kedua kelompok perlakuan M4% mengalami penurunan jumlah E. coli yang sangat tajam mendekati standar, raw propolis dan M2%. Sebaliknya hal ini tidak dialami oleh kelompok kontrol positif. Kelompok kontrol positif mengalami penurunan jumlah E. coli pada minggu kedua, akan tetapi jumlah E. coli masih jauh lebih besar dibandingkan kelompok lain.
Mikroflora dalam usus dapat ditentukan dengan pendekatan terhadap pengujian mikroflora dalam feses. Nakazawa dan Hasono (1992) menyatakan bahwa untuk dapat mengetahui mikroflora normal dalam usus biasanya digunakan feses yang dipupukkan dalam berbagai media digunakan untuk menentukan mikroflora tersebut. E. coli merupakan bakteri golongan oportunistik. Bakteri golongan ini apabila ada dalam saluran pencernaan dalam jumlah yang melebihi batas maksimal akan menyebabkan timbulnya gangguan pada kesehatan saluran pencernaan. Bakteri yang masuk dalam golongan ini adalah E. coli dan Streptococcus (Mitsuoka dalam Pertiwi 2008).
Kondisi yang fluktuatif pada kontrol positif dan mikrokapsul propolis 4% menunjukkan bahwa terjadi ketidakseimbangan mikroflora, khususnya jumlah E. coli setelah pemberian ampisilin dan mikrokapsul propolis (4%) pada minggu pertama dan ada upaya menurunkan jumlahnya mendekati standar pada minggu ketiga. Jumlah E. coli pada minggu pertama pencekokan raw propolis berada dibawah kontrol positif dan M4%, dan mengalami penurunan setelah pencekokan minggu kedua mendekati standar dan M2%. Sementara jumlah E. coli untuk standar dan M2% tidak jauh berbeda. Namun kelompok standar sendiri mengalami sedikit penurunan jumlah E. Coli, sebaliknya mikrokapsul propolis 2% mengalami sedikit peningkatan populasi E. coli saat memasuki minggu kedua pencekokan.
Pada minggu ketiga (Gambar 12) kelompok raw propolis mengalami peningkatan jumlah E. coli, namun jumlah E. coli tersebut tidak lebih tinggi dari minggu pertama. Jumlah E. coli feses kelompok M2% dan standar terlihat lebih stabil dari minggu pertama hingga minggu ketiga. Keadaan tersebut menunjukkan bahwa tikus yang diberi M2% dapat mempertahankan keseimbangan mikroflora dalam saluran pencernaan. Pemberian M2% tidak mengubah keseimbangan mikroflora dalam saluran pencernaan tikus dengan cara mengendalikan populasi E. coli dalam taraf yang tidak membahayakan bagi kesehatan saluran pencernaan. Dengan tujuan bahwa apabila keseimbangan mikroflora dalam usus baik maka fungsi saluran pencernaan yang optimum akan tercapai, sebaliknya jika keseimbangan mikroflora dalam saluran pencernaan terganggu maka fungsi saluran pencernaan pun akan terganggu (Bourlioux et al. 2003).
Tikus pada awal penelitian ini merupakan tikus lepas sapih yang sebelumnya hanya mengkonsumsi air susu dari induknya. Pemberian pakan yang terdiri atas komponen yang beragam akan berpengaruh pada kondisi mikroflora saluran pencernaan tikus tersebut. Perkembangan suatu makhluk hidup akan menyebabkan terjadinya perubahan pada jumlah populasi mikroflora dalam usus makhluk hidup tersebut (Nakazawa dan Hosono 1992). Makanan dapat memodifikasi ekologi enteromikroba saluran pencernaan, maka dapat diperkirakan jika karnivorisme akan merangsang pertumbuhan mikroflora tertentu (Peterson 1975). Perubahan ini terjadi seiring dengan makin beragamnya asupan makanan yang dikonsumsi oleh makhluk hidup tersebut.
Jumlah E. coli yang terhitung pada feses diperkirakan sangat berkaitan dengan bobot badan. Pada kelompok M4% jumlah E. coli yang fluktuatif diduga mengakibatkan penurunan bobot badan yang signifikan, sementara pada M2% dengan jumlah E. coli stabil memperlihatkan pertumbuhan bobot badan yang lebih baik. Keadaan tersebut menunjukkan bahwa tikus yang diberi M2% dapat mempertahankan keseimbangan mikroflora dalam saluran pencernaan khususnya E. coli
Gambar 12. Jumlah sel Escherichia coli (CFU/gram) pada feses Bakteri pada Usus Besar (Escherichia coli)
Berdasarkan analisis data dan grafik (Gambar 13) diperoleh, jumlah E. coli di usus besar (kolon) tertinggi adalah pada M4% (1,66 x 106), diikuti standar (3,03 x 105), M2% (2,79 x 105), raw propolis (1,76 x 105) dan kontrol positif (1,54 x 105). Dari data tersebut diperkirakan bahwa jumlah E. coli dapat mempengaruhi pertumbuhan bobot badan tikus. Dimana kelompok tikus M4% memiliki pertumbuhan berat badan yang lebih kecil dibanding kelompok lainnya karena memiliki jumlah E. coli di usus yang lebih besar. Sementara pada kelompok standar, raw, kontrol positif dan M2% ditemukan jumlah E. coli yang tidak jauh berbeda
Hewan atau manusia bersifat bebas dari mikroorganisme ketika berada di rahim, namun setelah lahir berbagai tipe bakteri dapat menyerbu tubuh melalui jalur kelahiran. Mikroorganisme tersebut tinggal di saluran pencernaan sampai hewan tersebut mati. Bagian dari saluran pencernaan yang paling banyak dihuni oleh bakteri adalah saluran usus (Nakazawa dan Hosono 1992).
Usus besar merupakan suatu mikroekosistem yang sangat kompleks, yang sarat dengan kolonisasi lebih 400 spesies dari sekurang-kurangnya 50 genera bakteri. Bakteri-bakteri ini dapat bersifat potensial penyebab efek patogenik atau efek promotif bagi kesehatan atau keduanya. Bakteri-bakteri ini berkompetisi dan
berinteraksi dalam proses fermentasi substrat yang sampai ke kolon, dan menghasilkan bahan-bahan toksik atau promotif bagi kesehatan (Lisal 2005).
Usus besar (kolon) mempunyai fungsi biologik yang penting, yaitu untuk absorpsi dan sekresi beberapa elektrolit tertentu dan air, serta pengumpulan dan ekskresi bahanbahan sisa pencernaan. Namun dalam dasawarsa terakhir, perhatian banyak ditujukan pada fungsi-fungsi usus besar (kolon) yang mempengaruhi kesehatan dan nutrisi, utamanya dalam hubungan dengan mikrobiota yang hidup di dalamnya (Gibson et all 1995). Kolon merupakan suatu ekosistem yang sangat sarat dengan kolonisasi mikrobiota (sampai 1012 bakteri/gram isi kolon), sehingga aktivitas terpadu dari mikrobiota yang hidup didalamnya, menjadikan usus besar bagian tubuh dengan aktivitas metabolik paling tinggi. Diperkirakan 95% dari semua sel hidup dalam tubuh manusia adalah bakteri usus besar (Gibson 2000).
E. coli merupakan bakteri patogen alami yang terdapat di dalam saluran pencernaan. Bakteri ini berkembangbiak dalam saluran pencernaan bagian kolon (usus besar). Populasi E. coli dalam saluran pencernaan dapat berubah tergantung pada pola makan, susunan makanan yang dikonsumsi serta stress yang dialami oleh makhluk hidup.
Gambar 13. Jumlah sel Escherichia coli (CFU/gram) pada usus
Hasil analisis data yang diperoleh menunjukkan bahwa M4% memiliki jumlah sel E. Coli yang lebih tinggi dibandingkan M2%. Hal ini menunjukkan
bahwa dengan konsentrasi propolis yang lebih tinggi tidak secara signifikan mengurangi jumlah E. coli yang ada. hal yang serupa telah dilakukan peneliti Indonesia (Sabir 2005) menguji propolis asal Bulukumba terhadap pertumbuhan bakteri S. mutans secara in vitro, dimana diperoleh flavonoid propolis dengan konsentrasi 0,1% lebih menghambat pertumbuhan bakteri S. mutans dibandingkan dengan flavonoid propolis dengan konsentrasi 0,5%.
Mekanisme propolis dalam menghambat pertumbuhan bakteri belum sepenuhnya diketahui, namun demikian (Simuth et al. 1986) dilaporkan adanya beberapa komponen yang terdapat pada propolis yang mampu mengabsorbsi sinar ultraviolet sehingga menghambat kerja enzim polimerase RNA bakteri untuk melekat pada DNA sehingga replikasi DNA bakteri tidak terjadi. Selain itu, komponen tersebut juga menghambat kerja dari enzim endonuklease restriksi sehingga transkripsi tidak terjadi pada RNA dan hal ini mengakibatkan pembelahan sel bakteri tidak terjadi karena terganggunya sintesis protein. Mekanisme lain dikemukakan oleh Takaisi-Kikuni dan Schilcher (1994) yang pada penelitiannya mendapatkan bahwa ekstrak etanol propolis bersifat antibakteri terhadap bakteri Streptococcus agalactiae melalui beberapa mekanisme, yakni dengan mencegah pembelahan sel bakteri dengan cara menghambat replikasi DNA sehingga menyebabkan terbentuknya Streptococcus pseudo-multicellular. Selain itu ekstrak etanol propolis juga menyebabkan terjadinya disorganisasi dari sitoplasma, membran sitoplasmik, serta dinding sel yang kesemuanya mengakibatkan bakteriolisis parsial dan penghambatan sintesis protein, sehingga dikatakan bahwa mekanisme antibakteri propolis terhadap bakteri sangat kompleks dan tidak dapat dianalogikan dengan cara kerja antibiotika klasik.
Keseimbangan mikroflora dalam usus tercapai ketika mikroorganisme non patogen lebih dominan stabil dibandingkan spesies patogen yang potensial. Mekanisme ini melalui regulasi mikroflora usus, menghindari situasi stress imun, dan potensinya sebagai sumber enzim pencernaan (Lestradet 1994). Keseimbangan mikroflora usus ini dapat mengurangi patogen penting dalam makanan manusia (Line et al 1997).
KESIMPULAN DAN SARAN
KesimpulanMikrokapsul propolis yang dihasilkan berwarna putih kecoklatan. Raw propolis dan mikrokapsul propolis 2% memiliki potensi sebagai pemacu pertumbuhan dan sebagai senyawa antibakteri yang dapat menurunkan jumlah bakteri E. coli di usus. Mikrokapsul propolis 2% memiliki jumlah E. coli pada feses yang lebih stabil dibandingkan kelompok perlakuan lain. Jumlah E. coli di usus tikus kelompok raw dan mikrokapsul propolis 2% memiliki jumlah yang relatif kecil.
Saran
Perlu dilakukan adanya uji lanjut terhadap beberapa jenis bakteri patogen lain yang terdapat di usus secara in vivo. Dengan adanya potensi propolis sebagai pemacu pertumbuhan dan antibakteri diharapkan dapat memberi peluang untuk meningkatkan pemanfaatan Trigona spp sebagai salah satu penghasil propolis.
DAFTAR PUSTAKA
Amano K, T Nemoto, TA Heard. 2000. Stingless bees as crop pollinators. Japan. Agric. Res. Q. Japan International Research Center for Agricultural Sciences
Amoros M, Simoes CMO, Girre L, Sauvager F, dan Cormier M. 1994. Comparision of the anti Herpes simplex virus activities of propolis and 3-methyl-butyl-2-enyl caffeate. J Nat Prod 57:644-647.
Andrews JM. 2001. Determination of minimum inhibitory concentrations. Journal of Antimicrobial Chemotherapy 48 Suppl. S1:5–16
Bankova VS, Castro SL dan Marcucci MC. 2000. Propolis: recent advances in chemistry and plant origin. Apidologie 31:3–15.
Bentley R, Meganathan R. 1982. Biosynthesis of Vitamin K (menaquione) in Bacteria. Bacteriological Reviews. 46(3): 241-280.
Bourlioux P, Kolletzko B, Guarner F, Braesco V. 2003. The intestine and its microflora are partners for the protection of the host: report on the Danone symposium “The Inteligent Intestine”, held in Paris, June 14, 2002. Am. J. Clin. Nutr. 78: 675-83.
Buhatel, T., Vesa, S., Dimitrin, A., Moldovan, I. 1983. Contribution to knowledge of the stimulative effect of propolis on piglet and pullets. Agronomic Cluj-Napoca Zootehnie Medicina Veterinara 37, 45–48.
Dantas AP, Oliviery BP, Gomes FHM, dan De Castro SL, 2006. Treatment of
Trypanosoma cruzi-infected mice with propolis promotes changes in the
immune response. Journal of Ethnopharmacology 103: 187-193
Deasy P.B. 1984. Microencapsulation and Related Drug Processes. New York: Marcel Dekker Inc. 1-60, 85, 119, 145, 161, 181
Doyle M E. 2001. Alternatives to Antibiotic Use for Growth Promotion in Animal Husbandary. FRI Briefings. University of Wisconsin-Madison
Evans M C and H C Wegener. 2003. Antimicrobial growth promoters and Salmonella spp, Denmark.
Fajrina HI. 2009. Ketahanan tablet propolis Trigona spp. Sebagai antibakteri terhadap cairan rumen in vitro [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Fatoni A. 2008. Pengaruh propolis Trigona spp. asal Bukit Tinggi terhadap beberapa bakteri usus halus sapi dan penelusuran komponen aktifnya
[tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Fearnley J. 2001. Bee Propolis: Natural Healing from the Hive. Souvenir Press Ltd., London.
Filkova I, Mujumdar AS. 1995. Industrial Spray Dryng Systems. Di dalam: Mujumdar AS, editor. Handbook of Industrial Drying 2nd edition. New York: Marcel Dekker.
Free JB.1982. Bees and Mankind. London: George Allen and Unkwin.
Gibson GR, Roberfroid MB. 1995. Dietary modulation of the human colonic microbiota : introducing the concept of prebiotics.J Nutrition 125 : 1401-12.
Gibson GR. 2000. Probiotics and prebiotics : gut microflora management for improved health. Medical Progress; 27(No. 2) : 34-6
Gojmerac, W. L. 1983. Bees, Beekeping, Honey and Pollination. The Avi Publishing Company, Inc. Wetsport, Connecticut.
Harbone, HB. 1987. Metode Fitokimia I. Ed ke-2, Padmawinata K, Penerjemah; Bandung: ITB. Terjemahan dari Phytochemical Methode.
Hasan, A E Z. 2006. Potensi Propolis Lebah Madu Trigona spp. sebagai Bahan Antibakteri. Seminar Nasional HKI, Bogor.
Holt JG, Krieg NR, Sneath PH, Stanley JT, Williams ST. 1994. Bergey s Manual of Determinative Bacteriology. Ed ke-9. Baltimore: Williams & Wilkins. Jensen, BB. 1988. The impact of feed additives on the microbial ecology of the
gut in young pigs. J Anim and Feed Sci 7 (Suppl 1): 964-970
JETACAR. 1999. Report of the Joint Expert Advisory Committee on Antibiotic Resistance (JETACAR) on the use of antibiotics in food producing animals: antibiotic resistant bacteria in animals and humans http://www.health.gov.au/ pubs/jetacar.pdf [28 Okt 2001].
Kartal M, Yildiz S, Kaya S, Kurucu S, dan Topçu G. 2003. Antimicrobial activity of propolis samples from different regions of Anatolia. J Ethnopharmacol 86:69–73.